Основы молекулярной биологии. Часть 1: Молекулярная биология клетки - А.Н. Огурцов 2011
Молекулярные основы функционирования белков
Молекулярные моторы
Механическое перемещение клеток обеспечивается специализированными ферментами, которые называют молекулярными моторами.
Молекулярные моторы создают либо линейное, либо вращательное движение (таблицы 6 и 7). Эти механохимические ферменты превращают энергию гидролиза АТФ или градиента ионов в механическую силу.
Некоторые "моторные" белки являются компонентами макромолекулярных ассоциатов, таких, как рибосома, другие, которые перемещаются вдоль нитей цитоскелета, - нет. Последние объединяют в группу, включающую миозины, кинезины и динеины - линейные моторные белки, которые перемещают присоединенные к ним "грузы" вдоль микрофиламентов или микротрубочек (рисунок 131).
Таблица 6 - Молекулярные моторы: источник энергии, структура и компоненты
|
Мотор |
Источник энергии |
Структура, компоненты |
|
Линейные (поступательные) моторы |
||
|
ДНК-полимераза |
АТФ |
Олигомерная полимераза в реплисоме |
|
РНК-полимераза |
АТФ |
Олигомерная полимераза в комплексе элонгации транскрипции |
|
Рибосома |
ГТФ |
Фактор элонгации 2 (EF2) связанный с рибосомой |
|
Миозины |
АТФ |
Тяжелая и легкая цепи, головной домен с АТ Фазной активностью и центром связывания с микрофиламентом |
|
Кинезины |
АТФ |
Тяжелая и легкая цепи, головной домен с АТ Фазной активностью и центром связывания с микротрубочкой |
|
Динеины |
АТФ |
Множественные тяжелые и легкие цепи, головной домен с АТФазной активностью и центром связывания с микротрубочкой |
|
Вращающие моторы |
||
|
Бактериальный мотор жгутика |
градиент H+/Na+ |
Статорные и роторные белки, жгутик |
|
АТФ-синтаза F0F1 |
градиент Н+ |
Множественные субъединицы, образующие F0 и F1 частицы |
|
Мотор вирусного капсида |
АТФ |
Коннектор, про-головка, РНК, АТФаза |
В мышцах или в жгутиках эукариот глобулярная головка линейного (поступательного) моторного белка за счет энергии гидролиза АТФ перемещает актиновую нить относительно микротрубочки (рисунок 131(a)).
ДНК и РНК полимеразы также представляют собой линейные (поступательные) моторы, поскольку они перемещаются вдоль ДНК в ходе репликации и транскрипции.
Вращающие моторы создают вращательное движение, обеспечивающее вращение жгутиков, упаковку ДНК в капсид вируса и синтез АТФ.
Таблица 7 - Молекулярные моторы: расположение в клетке и создаваемое движение
|
Мотор |
Расположение в клетке |
Создаваемое движение |
|
Линейные (поступательные) моторы |
||
|
ДНК-полимераза |
Ядро |
Транслокация вдоль ДНК в ходе репликации |
|
РНК-полимераза |
Ядро |
Транслокация вдоль ДНК в ходе транскрипции |
|
Рибосома |
Цитоплазма, эндоплазматический ретикулум |
Транслокация вдоль мРНК в ходе трансляции |
|
Миозины |
Цитоплазма |
Перемещение везикул, сокращение |
|
Кинезины |
Цитоплазма |
Перемещение везикул и хромосом в ходе митоза |
|
Динеины |
Цитоплазма |
Перемещение везикул, биение ресничек и жгутиков эукариот |
|
Вращающие моторы |
||
|
Бактериальный мотор жгутика |
Плазматическая мембрана |
Вращение присоединенного к мотору жгутика |
|
АТФ-синтаза F0F1 |
Внутренняя мембрана митохондрии, мембрана тилакоида, плазматическая мембрана бактерии |
Вращение у-субъединицы, приводящее к синтезу АТФ |
|
Мотор вирусного капсида |
Капсид |
Вращение коннектора, приводящее к упаковке ДНК |
Движущая сила перемещения бактерий создается вращательным движением белкового комплекса, расположенного в бактериальной мембране. Ионы перемещаются в направлении электрохимического градиента сквозь неподвижное кольцо белков, которое называется статор и которое расположено в мембране. Вращающий момент, создаваемый статором, приводит в движение внутреннее кольцо белков и присоединенный к нему жгутик (рисунок 131(6)).
Аналогично устроены митохондриальная, тилакоидная и бактериальная АТФ-синтазы (F0F1-комплекс).
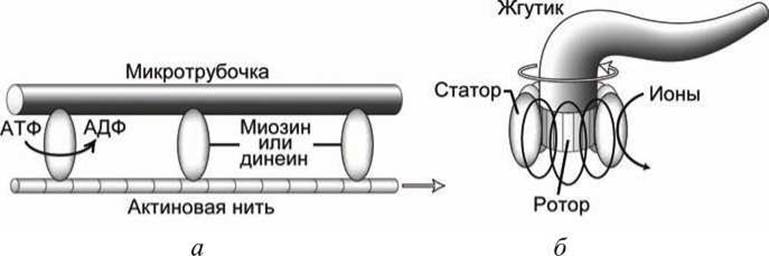
Рисунок 131 - Принцип работы молекулярных моторов: а - линейный мотор; б - вращающий мотор
6.7.1. АТФ-синтаза. АТФ-синтаза является комбинацией двух моторов, называемых F0 и F1, которые используют различные источники энергии для генерации механического вращения (рисунок 132).
Мембранный мотор F0 использует электрохимический градиент, а цитозольный мотор F1 работает за счет энергии гидролиза АТФ.
В АТФ-синтазе эти два мотора объединены так, что один из них выполняет функцию мотора, а другой - генератора.
Вращение мотора F0 вследствие потока протонов через мембрану может быть использовано для синтеза АТФ в субъединице F1. И наоборот, вращение мотора F1 за счет гидролиза АТФ может быть использовано для перекачивания протонов через мембрану, тем самым для создания протонного градиента.
Мотор F0 состоит из цилиндрического ротора и статора, состоящего из 10-14 (в зависимости от вида организма) идентичных субъединиц, зафиксированных в мембране. Мембрана обеспечивает тот барьер, относительно которого и существует градиент протонов
Цилиндрический ротор заканчивается в верхней части эксцентриком, который проходит между каталитическими доменами мотора F1.
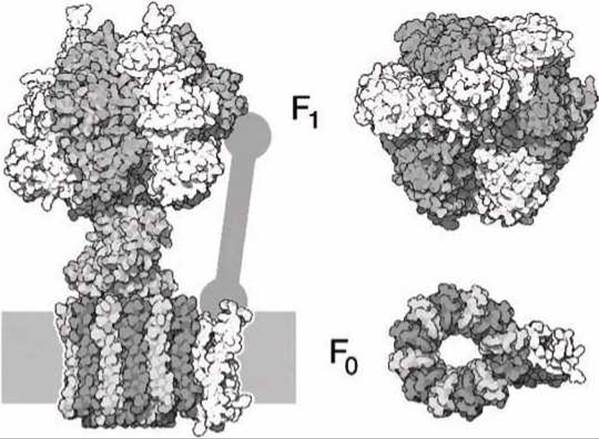
Рисунок 132 - Схема АТФ-синтазы. Справа показан вид сверху каталитической цитозольной части мотора F1 и мембранных доменов мотора F0
При вращении ротора эксцентрик поочередно механически деформирует (стимулирует) каталитические субъединицы АТФ-мотора F1, активизируя их для катализа присоединения фосфатной группы к АДФ.
Подробнее работа АТФ-синтазы будет рассмотрена ниже (см. п.8.4.2).
Все белковые моторы обладают тремя общими свойствами:
1) способность превращать энергию источника - либо АТФ, либо градиента ионов - в поступательное или вращательное движение,
2) способность к связыванию и перемещению вдоль филаментов цитоскелета, цепи нуклеиновой кислоты или белкового ассоциата,
3) согласованное движение в нужном направлении.
6.7.2. Линейные моторы. Моторные белки, которые перемещаются вдоль филаментов цитоскелета, могут транспортировать "грузы", которыми в случае клеток мышц и жгутиков эукариот представляют собой микротрубочки или В-трубочки, соответственно. Эти же белки-моторы могут транспортировать хромосомы и везикулы вдоль филаментов цитоскелета (рисунок 133).
Два наиболее изученных моторных белка, это миозин, который перемещается вдоль актиновых нитей, и кинезин, который перемещается вдоль микротрубочек.
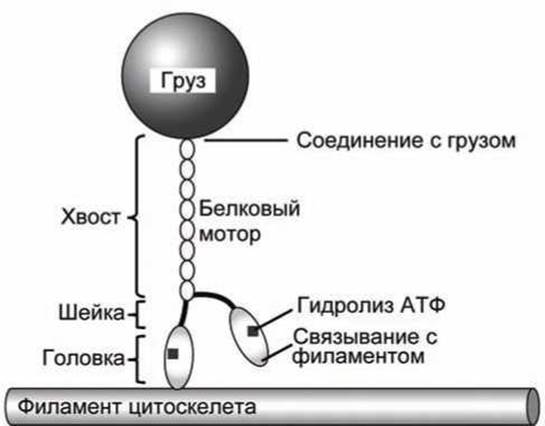
Рисунок 133 - Транспорт груза кинезином
Глобулярные головки миозина и кинезина связываются с филаментами цитоскелета, а фибриллярный "хвост" присоединяется "грузу", в нашем случае - к везикуле. Гидролиз АТФ в глобулярных головках стимулирует "ходьбу" глобулярных головок вдоль филамента, посредством повторяющихся циклов конформационных изменений.
Эти два моторные белка имеют различные принципы реализации механического движения.
Каждая миозиновая молекула осуществляет один "рабочий ход" ("power stoke") за раз - она связывается с актином, тянет его (точнее, дергает), а затем отсоединяется от актина.
Кинезин, напротив, после присоединения к микротрубочке совершает множество "актов" перемещения, и только в конце "работы" кинезин отсоединяется от микротрубочки.
Эти функциональные различия используются для различных биологических операций.
Молекулы миозина входят в состав толстых (массивных) миозиновых филаментов (комплексов), которые и перемещаются вдоль актиновых нитей - каждый миозин совершает свой "рабочий ход" и уходит в сторону, уступая пространство для работы соседних миозинов.
Кинезин работает более автономно. Он используется в качестве "грузовика" для перевозки груза вдоль микротрубочки. Он должен соединиться с трубочкой и двигаться вдоль нее.
Несмотря на эти функциональные различия, миозин и кинезин демонстрируют подобие в молекулярной организации, которая используется для создания "действующей силы".
Все миозины имеют сходную организацию. Рассмотрим структуру миозина II, который обеспечивает мышечное сокращение (рисунок 134).
6.7.3. Миозин. Миозин состоит из одной или двух тяжелых цепей и нескольких легких цепей.
Тяжелые цепи состоят из трех типов доменов: головка, шейка и хвост. Два глобулярных домена головки представляют собой специализированные АТФазы, которые преобразуют гидролиз АТФ в движение. Причем АТФазная активность головок максимальна тогда, когда они связаны с актином.
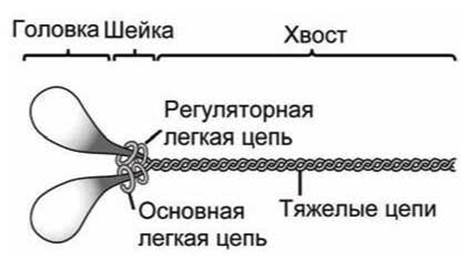
Рисунок 134 - Схема миозина II
Головка заканчивается а-спиральной шейкой, с которой нековалентно связаны легкие цепи (надеты на шейку). Эти легкие цепи предназначены для (1) превращения небольших конформационных изменений в головке в большие пространственные смещения молекулы и для (2) регулирования активности головки. Они придают жесткость шейке и могут выполнять функцию ручки рычага для головки.
Нитеобразные хвостовые домены содержат связывающие центры, которые определяют специфическую активность конкретного миозина.
Моторный глобулярный домен миозина (головка) удлинен, а центр связывания АТФ находится в близи его центра (рисунок 135).
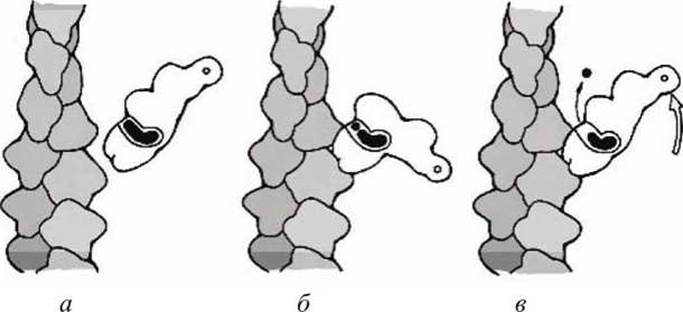
Рисунок 135 - Три стадии рабочего цикла миозина
В релаксированном состоянии миозин изогнут, а конформационный переход, индуцированный связыванием с АТФ, переводит миозин в распрямленное состояние.
Головка миозина состоит из нескольких функциональных частей.
Большой каталитический домен связывается с АТФ и с актином.
Индуцированное связыванием с АТФ изменение конформации каталитического домена стимулирует изменение конвертерного (передающего) домена, которое усиливается доменом-рычагом и совершает смещение конца рычага на 10 нм. В разных формах миозина концы этого рычага присоединены к соответствующим опорам для выполнения специфической работы.
Рабочий цикл миозина содержит три этапа (рисунок 135).
На первом этапе (в исходном состоянии) миозин связан с АТФ и не связан с актином (рисунок 135(a)).
На втором этапе АТФ гидролизуется на АДФ и фосфат, что вызывает такую конформацию актин-связывающего интерфейса, которая позволяет связывание с актином, а миозин принимает изогнутую форму (рисунок 135(6)).
На третьем этапе фосфат диссоциирует, вызывая выпрямление миозина, что и позволяет совершить "рабочий ход" (рисунок 135(b)).
Замена АДФ на АТФ приводит к диссоциации миозина от актиновой нити и переводит миозин в исходное состояние
6.7.4. Кинезин. Кинезин использует принципиально другой подход для движения (рисунок 136). В кинезине реализуется необычное чередование переходов порядок-беспорядок (или упорядочение-разупорядочение) в коротком участке белковой цепи, который называется шейка (или шейка-линкер, neck linker), связывающий глобулярный моторный домен с фибриллярным хвостом.
Вследствие гидролиза АТФ шейка изменяет конформацию из неупорядоченного состояния в упорядоченную форму, совершая при этом "рабочий ход".
Моторный домен кинезина имеет особый паз-желоб, в который входит (укладывается) и из которого выходит шейка-линкер, в зависимости от химической "команды", временно обратимо связываясь с моторным доменом.
"Рабочий ход" совершается тогда, когда шейка упорядочивается и укладывается в паз, объединяясь с моторным доменом. Весь тот "груз", который присоединен к шейке-линкеру, за один "рабочий ход" перемещается на 8 нм.
Рабочий цикл кинезина начинается с исходного состояния, в котором одна (обозначена белым цветом) субъединица пуста, а с другой (серой) связана АДФ (рисунок 136, вверху).
АТФ связывается с пустой субъединицей, что вызывает конформационный переход в "белой" субъединице, шейка упорядочивается, "укладывается" в желоб и прочно связывается с глобулярной головкой. При этом белая субъединица отрывает "серую" субъединицу от микротрубочки, перемещает её "вперед по ходу движения" (средняя часть рисунка 136), где "серая" субъединица снова связывается с микротрубочкой. В результате связывания "серой" субъединицы с микротрубочкой АДФ диссоциирует.
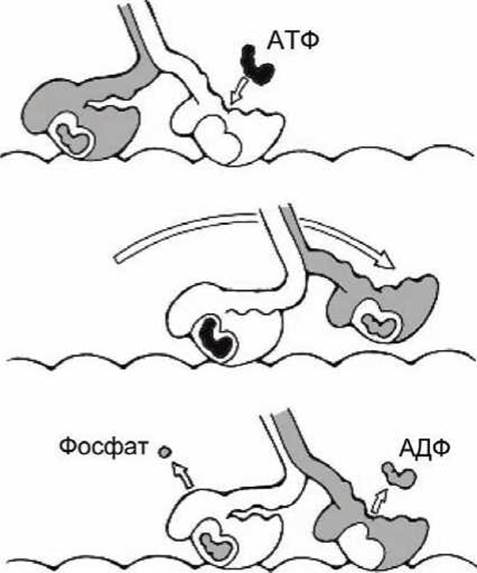
Рисунок 136 - Этапы рабочего цикла кинезина
Диссоциация АДФ от "серой" субъединицы и высвобождение фосфата из "белой" субъединицы приводят к обратному переходу шейки "белой" субъединицы из упорядоченной в разупорядоченную форму и отсоединению её от желоба глобулярной головки, что возвращает всю систему в исходное состояние.
Последовательные циклы-шаги позволяют кинезину двигаться вдоль микротрубочки
И миозин, и кинезин реагируют на наличие третьей фосфатной группы в молекуле АТФ и используют гидролиз АТФ для генерации силового импульса в результате конформационного перехода.
6.7.5. Саркомеры. Хвостовые домены сотен молекул миозина, сплетаясь вместе, образуют толстые миозиновые филаменты. Сократительные элементы (саркомеры) мышечных волокон позвоночных состоят из чередующихся толстых миозиновых филаментов и тонких актиновых нитей (рисунок 137). Актиновые нити крепятся к Z-дискам. Саркомером называется продольная единица, ограниченная двумя Z-дисками.
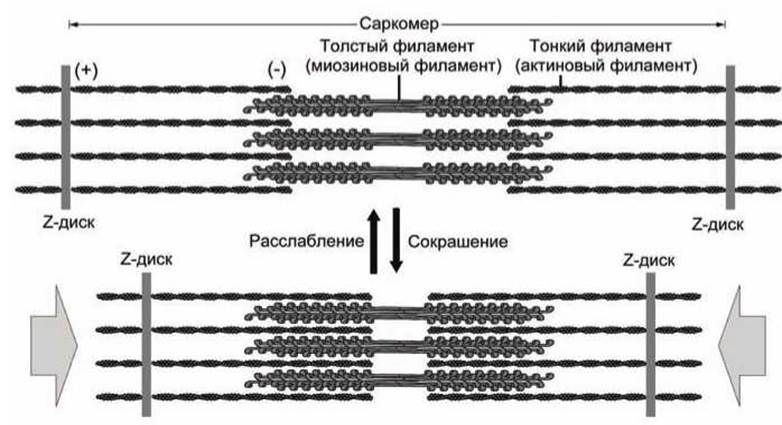
Рисунок 137 - Мышечное сокращение
Сокращение мышечных волокон обусловлено продольным скольжением толстых миозиновых и тонких актиновых филаментов друг относительно друга. Согласованные конформационные изменения сотен головок "протягивают" миозиновые и актиновые филаменты друг относительно друга. Миозиновые головки шаг за шагом "идут" вдоль актиновых волокон.
Как показано на рисунке 135, миозин претерпевает серию конформаций в ходе каждого шага. За цикл миозин должен поочередно принять как минимум три конформационных состояния: (1) АТФ состояние, не связанное с актином, (2) АДФ-Р состояние, связанное с актином, (3) состояние после завершения "протягивания" актиновой нити.