Основы молекулярной биологии. Часть 2: Молекулярные генетические механизмы - А.Н. Огурцов 2011
Скрининг библиотек ДНК
Скрининг по активности белка
Метод гибридизации ДНК позволяет идентифицировать многие гены и их продукты. Однако если при этом искомый ген кодирует фермент, не синтезируемый клеткой-хозяином, то для обнаружения клонов, содержащих данный ген, можно использовать метод идентификации на чашках Петри. Так были идентифицированы гены а-амилазы, эндоглюканазы и ß-галактозидазы различных организмов. Для этого клоны Е. coli, составляющие геномную библиотеку данных организмов, высевали на чашках с питательной средой, содержащей специфический субстрат. После окрашивания селективным красителем клетки, способные утилизировать этот субстрат, приобретали характерную окраску.
Если искомый ген кодирует продукт, без которого мутантная клетка-хозяин не может расти на минимальной среде, то библиотеку можно создать методом трансформации мутантных клеток. Клетки, выросшие в отсутствие необходимого субстрата на минимальной среде, обязательно содержат функциональный искомый ген, попавший в клетку в составе плазмидного вектора. В разных вариантах этот подход использовали для выделения многих важных генов, в частности генов, ответственных за синтез антибиотиков и образование азотфиксирующих клубеньков на корнях некоторых растений
В ряде случаев скрининг ДНК-библиотеки может быть проведен по способности экспрессировать функциональный белок, который восполняет утраченную в результате рецессивной мутации функцию. Скрининг подобного рода позволяет эффективно идентифицировать клонированный ген, который соответствует рецессивной мутации, обнаруженной в экспериментальном организме. Такой метод называется методом функционально й комплементации.
Для иллюстрации этого метода рассмотрим, как гены дрожжей, клонированные в особых плазмидах Е. coli, могут быть введены в мутантные клетки дрожжей для того, чтобы идентифицировать исходный ген, который стал дефектным в мутантном штамме. Другими словами, специфические гены из библиотеки кДНК могут быть выделены по их способности дополнять соответствующие мутантные гены в клетках дрожжей (компенсировать утраченную функцию).
Следует отметить, что библиотеки, создаваемые для скрининга фрагментов ДНК дрожжей обычно конструируются из геномных ДНК, а не как кДНК-библиотеки. Поскольку гены дрожжей Saccharomyces сеrеvisiae не содержат множество интронов, то они достаточно компактны и собственно фрагмент генома, содержащий нужный ген, может быть вставлен в плазмидный вектор.
Для создания плазмидной геномной библиотеки, скрининг которой будет осуществляться методом функциональной комплементации в клетках дрожжей, плазмидный вектор должен быть способен к репликации и в клетках Е. coli, и в клетках дрожжей.
Вектор такого типа, способный реплицироваться в клетках двух различных типов, называют шаттлом (shuttle vector) (рисунок 95).
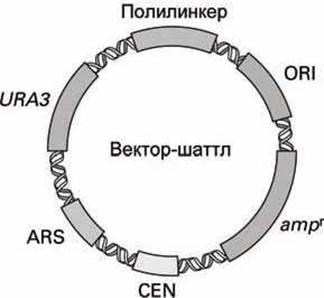
Рисунок 95 - Схема вектора-шаттла
Структура типичного шаттл-вектора дрожжей показана на рисунке 95. А на рисунке 96 представлена схема создания ДНК-библиотеки дрожжей с помощью этого вектора.
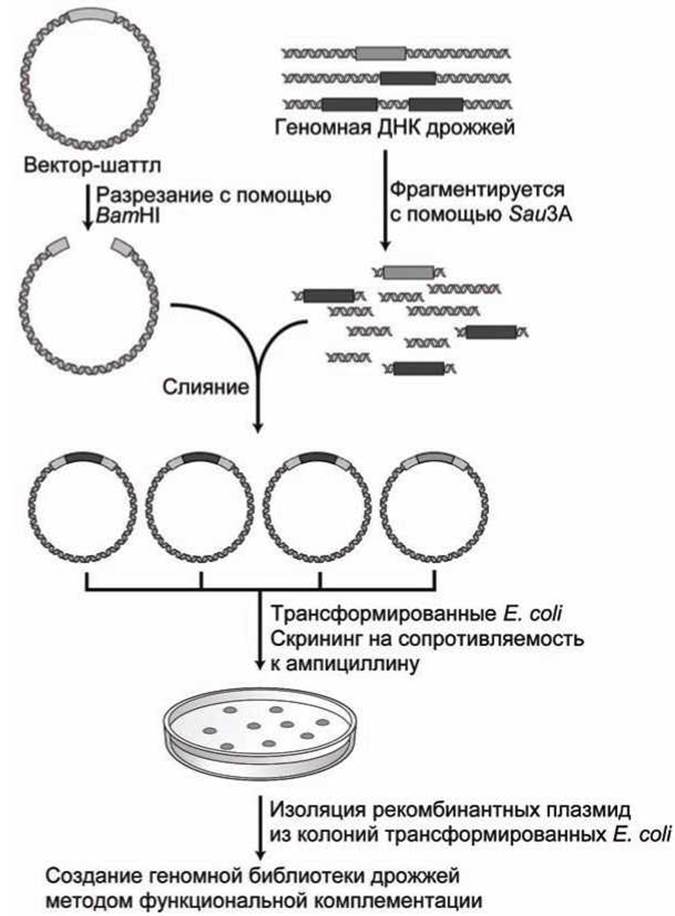
Рисунок 96 - Создание ДНК библиотеки дрожжей с помощью шаттл-вектора
Вектор-шаттл имеет ориджин (ARS) (autonomously replicating sequence) обеспечивающий репликацию ДНК в дрожжах и центромер (CEN) для сегрегации плазмид в ходе деления дрожжевых клеток, а также маркер селекции - ген URA3, кодирующий синтез урацила в клетках дрожжей, который позволяет дрожжевым urа3--мутантам расти в среде с нехваткой урацила. Кроме того, вектор содержит участки для репликации и селекции в Е. coli (ORI и атрг) и полилинкер, обеспечивающий внедрение фрагментов ДНК дрожжей в вектор.
Для того чтобы повысить вероятность того, что все участки генома дрожжей будут успешно клонированы и, следовательно, представлены в плазмидной библиотеке, геномная ДНК обычно фрагментируется не полностью, с тем, чтобы рестрикционные фрагменты длиной около 10 kb имели перекрывающиеся участки.
На рисунке 96 показано, как эти фрагменты, встраивают в шаттл-вектор, в котором полилинкер, разрезанный рестрикционным ферментом ВаmHI, имеет такие же липкие концы, как и у фрагментов ДНК, полученных при неполном фрагментировании с использованием рестрикционного фермента Sau ЗА.
Каждый клон, полученный в результате трансформации клетки Е. coli, и выращенный после отбора на резистивность к ампициллину, содержит единственный тип фрагмента ДНК.
Поскольку 10-kb рестрикционный фрагменты дрожжей случайным образом вставлены в шаттл-векторы, то необходимо иметь как минимум сто тысяч (105) колоний Е. coli, каждая из которых содержит один рекомбинантный шаттл-вектор, для того, чтобы быть уверенным, что каждый участок ДНК-генома дрожжей присутствует в библиотеке хотя бы один раз.
Схема скрининга такой библиотеки для идентификации исходного гена, соответствующего одной из температурно-чувствительных cdc-мутаций представлена на рисунке 97.
Исходный штамм представляет собой двойной мутант, которому для роста необходим урацил (из-за ura3-мутации) и который температурно-чувствителен (из-за cdc-мутации).
Рекомбинантные плазмиды, взятые из геномной библиотеки дрожжей, смешиваются с клетками дрожжей в условиях, которые обеспечивают трансформацию клеток чужими ДНК.
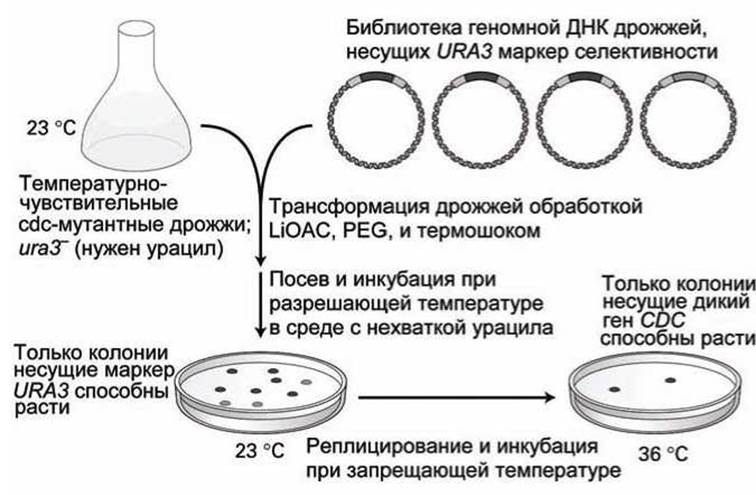
Рисунок 97 - Скрининг методом функциональной комплементарности геномной библиотеки дрожжей. LiOAC - ацетат лития; PEG - полиэтилен гликоль
Поскольку трансформированные клетки теперь содержат принесенные плазмидами копии исходных (немутантных) генов URA3, то эти трансформированные клетки могут быть отселектированы по их способности к росту в среде, в которой отсутствует урацил.
Обычно для полного охвата всего генома дрожжей достаточно около 20 чашек Петри, каждая из которых содержит около 500 трансформированных колоний дрожжей.
С этой коллекцией трансформантов затем можно работать при температуре 23°С - разрешающей температуре для роста сdс-мутантов. Только трансформированные клетки смогут расти в среде без урацила.
После этого реплики со всего набора чашек Петри нагреваются до 36°С - запрещающей температуры для сdс-мутантов. При этой температуре смогут расти только те клоны, в которых присутствуют плазмиды библиотеки, которые содержат исходные (немутировавшие) копии cdc-гена.
После того, как выделены температурно-устойчивые колонии дрожжей, плазмидные ДНК могут быть выделены из клеток и проанализированы методами субклонирования и ДНК-секвенирования.
ВЫВОДЫ
Конкретный клонированный фрагмент ДНК в библиотеке может быть детектирован посредством гибридизации с радиоактивно меченным олигонуклеотидом, чья последовательность комплементарна части фрагмента ДНК.
Шаттл-векторы, которые способны реплицироваться и в дрожжах и в Е. coli, могут быть использованы для создания геномной библиотеки дрожжей. Специфические гены могут быть выделены по их способности дополнять соответствующие мутантные гены в клетках дрожжей.
Вопросы для самоконтроля
1. Какие два способа обнаружения (скрининга) библиотек ДНК используют для обнаружения определённого гена?
2. Какое явление называется гибридизацией ДНК?
3. Как проводят скрининг библиотек ДНК методом мембранной гибридизации?
4. Какие ДНК называют олигонуклеотидными ДНК-зондами?
5. Что такое ауторадиография?
6. Что такое шаттл-вектор? Перечислите основные компоненты вектора-шаттла.
7. В чем заключается метод функциональной комплементации?