Общая микробиология - Шлегель Г. 1987
Рост микроорганизмов
Физиология роста
Под ростом понимают необратимое увеличение количества живого вещества, обычно связанное с увеличением и делением клеток. У многоклеточных организмов увеличиваются размеры тела, у одноклеточных растет число клеток. Однако и у одноклеточных следует отличать увеличение числа клеток от увеличения клеточной массы (табл. 6.4).
При определении числа или массы бактерий пользуются обычно гомогенной суспензией клеток в какой-либо жидкой среде и определяют концентрацию бактерий (число клеток на 1 мл) или плотность бактерий (в мг/мл). На основе данных об увеличении этих показателей в растущей бактериальной культуре можно вычислить константу скорости деления клеток (ее выражают числом удвоений концентрации бактерий за 1 ч) и обратную ей величину - время генерации (интервал времени, за который число клеток удваивается).
Таблица 6.4. Разграничение понятий «число бактерий» и «бактериальная масса»
|
Число бактерий |
Бактериальная масса |
|
|
На единицу объема |
Концентрация бактерий (число клеток на 1 мл) |
Плотность бактерий (сухая масса на 1 мл) |
|
Число удвоений в единицу времени |
Константа скорости деления, v, ч-1 |
Константа скорости роста μ, ч-1 |
|
Время, в течение которого происходит удвоение |
Время генерации g, ч |
Время удвоения td, ч |
6.5.1 Методы определения числа бактерий и бактериальной массы
Во время роста периодической (статической)1 бактериальной культуры может не быть строгой пропорциональности между увеличением числа клеток и увеличением бактериальной массы. Поэтому показатели эти необходимо различать.
1 Так называют культуры микроорганизмов, выращиваемых в какой-либо среде без ее смены - Прим. ред.
Определение числа бактерий. В популяции бактерий не все клетки жизнеспособны. Живыми считаются те клетки, которые могут образовывать колонии на (или в) агаризованной среде либо суспензию в питательном растворе. Эти жизнеспособные клетки выявляют специальными методами, предназначенными для определения числа живых клеток. В общее же число клеток включают все видимые или иным способом выявленные клетки; сюда, следовательно, входят также мертвые или поврежденные клетки.
Общее число клеток. 1. Самым распространенным методом определения общего числа клеток служит их подсчет под микроскопом в тонком слое с помощью «счетной камеры» (например, по Нейбауэру, Тома или Петрову-Хаузеру). Если толщина слоя 0,02 мм, а сторона квадрата 0,05 мм (объем 5 ∙ 10-8 см3), то для того, чтобы определить число клеток в 1 мл, следует найденное их число умножить на 2∙107. 2. Один из самых старых методов состоит в сравнении с известным числом каких-либо других малых частиц, например эритроцитов (около 5∙106 эритроцитов на 1 мл). 3. Значительно облегчает работу применение электронного счетчика («счетчика Каултера»). Действие его основано на снижении проводимости раствора электролитов при прохождении одной бактерии через узкое отверстие. 4. Если на 1 мл приходится менее 106 клеток, для определения их числа пригоден метод мембранных фильтров. Морскую, прудовую или питьевую воду пропускают через мембранный фильтр, а затем этот фильтр сушат, окрашивают, просветляют и производят подсчет клеток под микроскопом.
Число живых клеток. Обычно подсчитывают число колоний, образуемых жизнеспособными клетками в благоприятных для роста условиях. Если пользуются чашечным методом Коха, то равные доли соответственно разбавленной гомогенной суспензии клеток смешивают с расплавленной агаризованной средой (40-45°С) и выливают на чашки Петри. Можно также размазать суспензию по поверхности агара в чашке Петри с помощью (треугольного) шпателя Дригальского или же осадить клетки после фильтрования на агаризованную срeду или на картонные диски с питательной средой. Во всех случаях после надлежащей инкубации подсчитывают число колоний. Применение чашечного метода Коха, а также различных его модификаций предусматривает подсчет клеток одного вида из гомогенных суспензий; эти методы непригодны для подсчета клеток разных видов из смешанных популяций.
Определение бактериальной массы. Выбор метода для определения бактериальной массы зависит от того, с какой целью это определение производится. Для оценки урожая обычно взвешивают сырые или сухие отцентрифугированные клетки. При определении интенсивности обмена или ферментативной активности исходят из содержания в клетках белка или азота. Часто выбор метода диктуется такими соображениями, как простота или быстрота работы. В повседневной практике предпочтение отдается не прямым, а косвенным методам (после соответствующей калибровки).
Прямые методы. 1. Сырую биомассу определяют после осаждения клеток центрифугированием. После центрифугирования отмытых клеток можно определить сухую массу. Оба метода не свободны от довольно больших систематических ошибок. 2. Гораздо большую точность обеспечивает определение общего азота (метод микро-Кьельдаля и микродиффузионный метод определения аммиака), а также определение общего содержания углерода (по ван Слайку-Фолчу). 3. В повседневной практике часто определяют содержание бактериального белка. Хорошие результаты дают модификации биуретового метода и другие колориметрические методы. Микрометоды основаны на измерении количества характерных компонентов белка: тирозина, триптофана (по Лоури или Фолину).
Косвенные методы. 1. Для определения клеточной массы весьма полезны методы, основанные на измерении мутности клеточных суспензий. На практике обычно определяют оптическую плотность суспензии (измерение экстинкции, турбидиметрия). Для некоторых целей более точные результаты дает определение светорассеяния (нефелометрия). Однако прямая (линейная) зависимость между обоими этими показателями и бактериальной массой наблюдается лишь при очень низких плотностях клеточных суспензий. Поскольку рассеяние света зависит от диаметра, формы и показателя преломления рассеивающих частиц, в том числе клеточных включений, приходится от случая к случаю проверять соотношение между оптическими величинами и более прямыми показателями, такими как сухая биомасса, содержание в ней азота или содержание углерода. 2. Показатели интенсивности метаболизма, непосредственно связанные с ростом (поглощение O2, образование СO2 или кислот), могут служить адекватной мерой бактериальной массы. К такого рода определениям прибегают в тех случаях, когда другие методы оказываются непригодными, например при очень малой плотности клеточных суспензий. Для измерения можно применять титрометрические, манометрические, электрохимические и другие методы.
6.5.2 Экспоненциальный рост и время генерации
Бактерии размножаются чаще всего делением надвое, и поэтому число их растет в геометрической прогрессии: 20 → 21→ 22→ 23 → ... → 2n.
Если на единицу объема растущей периодической культуры приходится N0 клеток, то после n делений число клеток будет NO ∙ 2n. Логарифмируя, получаем IgN = lgN0 + nlg2, откуда число клеточных делений
![]()
Число клеточных делений за 1 ч, или константа скорости деления v, определяется по формуле
![]()
Время, необходимое для одного цикла деления, или время генерации
![]()
Если за 10 ч число клеток в суспензии возрастает с 103 до 109, то для константы скорости деления находим:
![]()
а время генерации равно получасу.
Отложив по оси ординат число клеток в экспоненциально растущей популяции, а по оси абсцисс - время (обе величины в арифметическом масштабе), мы получим экспоненциальную кривую роста (рис. 6.5). Такой способ графического представления для большого числа клеточных делений, однако, непригоден, так как в зависимости от выбранного масштаба он позволяет учесть либо только первые, либо только последние деления. Поэтому предпочитают пользоваться полулогарифмической шкалой (рис. 6.5); в этом случае по оси ординат откладывают логарифм числа клеток. При таком построении графика экспоненциальный рост бактерий описывается прямой. Наклон прямой характеризует скорость деления: она тем больше, чем больше наклон. Поскольку при экспоненциальном росте существует линейная зависимость между временем и логарифмом числа клеток, такой рост называют также логарифмическим.
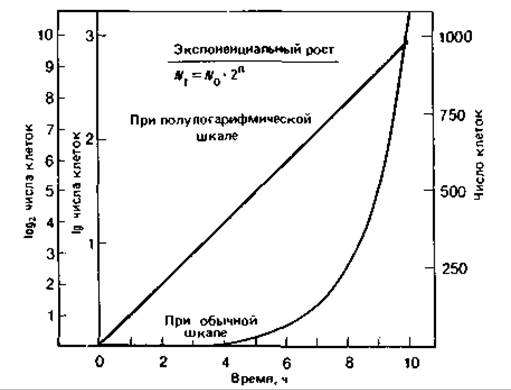
Рис. 6.5. Экспоненциальный рост одноклеточных организмов: зависимость числа клеток от времени.
Если по числу клеток определить указанным выше способом время генерации д, то получим среднее его значение. Следует, однако, учитывать, что в популяции бактерий всегда содержится некоторое число дефектных клеток, не способных к делению; поэтому у активно делящихся клеток время генерации должно быть в действительности несколько меньше. Во многих случаях при изучении кинетики роста отдельные клетки не принимают в расчет и рассматривают растущую популяцию бактерий как автокаталитически размножающуюся систему. При этом в вычислениях исходят из плотности бактериальной суспензии. Скорость изменения плотности такой суспензии в каждый момент времени пропорциональна самой плотности, т. е. изменение следует кинетике реакций первого порядка. В экспоненциальной фазе константа скорости роста определяется как
![]()
Интегрируя, получаем x = x0 ∙ eμt, а для удвоения клеточной массы 2х0 = х0 ∙ еμtd, откуда время удвоения
![]()
При сравнении константы скорости роста (р) с константой скорости деления (v) следует учитывать, что число и масса клеток -понятия не идентичные и что во время роста периодической культуры соотношение между этими двумя показателями изменяется. Если, однако, определение и сравнение сухой массы или числа клеток проводить в условиях, когда рост клеточной массы строго пропорционален увеличению числа клеток («стандартные клетки»), то μ = In 2 ∙ v и td = g.
6.5.3 Рост бактерий в периодической культуре
При внесении бактерий в питательную среду они обычно растут до тех пор, пока содержание какого-нибудь из необходимых им компонентов среды не достигнет минимума, после чего рост прекращается. Если на протяжении этого времени не добавлять питательных веществ и не удалять конечных продуктов обмена, то получим так называемую периодическую культуру (популяцию клеток в ограниченном жизненном пространстве). Рост в такой «закрытой системе» подчиняется закономерностям, действительным не только для одноклеточных, но и для многоклеточных организмов. Периодическая культура ведет себя как многоклеточный организм с генетически ограниченным ростом.
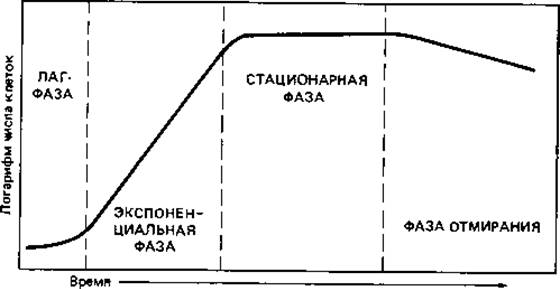
Рис. 6.6. Кривая роста бактериальной культуры.
Кривая, описывающая зависимость логарифма числа живых клеток от времени, называется кривой роста. Типичная кривая роста (рис. 6.6) имеет S-образную форму и позволяет различить несколько фаз роста, сменяющих друг друга в определенной последовательности и в большей или меньшей степени выраженных: начальную (или лаг-) фазу, экспоненциальную (или логарифмическую) фазу, стационарную фазу и фазу отмирания.
Рост микроорганизмов на твердых питательных средах протекает в основном так же, хотя при этом достигаются значительно более высокие плотности клеток.
Начальная фаза. Эта фаза охватывает промежуток времени между инокуляцией и достижением максимальной скорости деления. Продолжительность этой фазы зависит главным образом от предшествовавших условий культивирования и возраста инокулята, а также от того, насколько пригодна для роста данная среда. Если инокулят взят из старой культуры (в стационарной фазе роста), то клеткам приходится сначала адаптироваться к новым условиям путем синтеза РНК, образования рибосом и синтеза ферментов. Если источники энергии и углерода в новой среде отличаются от тех, какие были в предшествующей культуре, то приспособление (адаптация) к новым условиям может быть связано с синтезом новых ферментов, которые ранее не были нужны и поэтому не синтезировались. Образование новых ферментов индуцируется новым субстратом.
Хорошим примером влияния субстрата на синтез ферментов служит так называемая диауксия (рис. 6.7). Это явление двухфазного роста или двойного цикла роста наблюдается на средах, содержащих смесь питательных веществ. Из смеси глюкозы и сорбитола Escherichia coli, например, поглощает в первую очередь глюкозу. Глюкоза индуцирует сначала в клетках синтез ферментов, которые нужны для ее использования, и одновременно подавляет (репрессирует) синтез ферментов, необходимых для использования сорбитола. Эти последние ферменты образуются лишь после того, как вся глюкоза будет израсходована. Такие регуляторные процессы достаточно хорошо объясняют наличие двух начальных фаз.
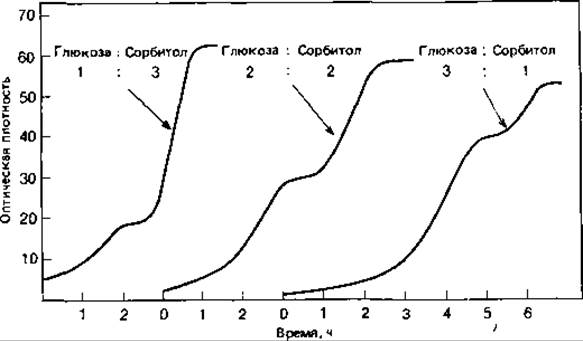
Рис. 6.7. Двухфазный рост (диауксия) Escherichia coli в питательных средах, содержащих глюкозу и сорбитол в разных соотношениях. (Monod J., Recherches sur la croissance des cultures bacteriennes, Paris: Hermann, 1958.)
Количественное изменение состава бактериальной клетки во время начальной фазы роста сильнее всего затрагивает рибонуклеиновую кислоту: содержание РНК повышается в 8-12 раз. Это указывает на участие РНК и рибосом в синтезе ферментных белков.
Экспоненциальная фаза. Экспоненциальная (логарифмическая) фаза роста характеризуется постоянной максимальной скоростью деления клеток. Эта скорость во время экспоненциальной фазы зависит от вида бактерий, а также от среды. Энтеробактерии делятся через каждые 15-30 мин, Escherichia coli при 37°С - примерно каждые 20 мин. У других бактерий время генерации значительно больше: у многих почвенных видов оно достигает 60-150 мин, а у Nitrosomonas и Nitrobacter - даже 5-10 ч.
Величина клеток и содержание в них белка у многих бактерий тоже остаются в экспоненциальной фазе постоянными. В известном смысле можно сказать, что бактериальная культура в этом случае состоит из «стандартных клеток». Если точно установлено, что число клеток, содержание в них белка и их сухая биомасса увеличиваются с одинаковой скоростью, то за ростом культуры можно следить, пользуясь каким-нибудь одним из этих показателей.
Нередко, однако, и в экспоненциальной фазе роста клетки периодической культуры претерпевают изменения, так как постепенно изменяется среда: уменьшается концентрация субстрата, увеличивается плотность клеточной суспензии и накапливаются продукты обмена. В связи с тем что в экспоненциальной фазе скорость деления клеток относительно постоянна, эта фаза наиболее удобна для определения скорости деления (и скорости роста). Изучая влияние факторов среды (pH, окислительно-восстановительного потенциала, температуры, аэрации и т.д.), а также пригодность различных субстратов, следят за увеличением числа клеток или за мутностью (экстинкцией) клеточной суспензии во время экспоненциального роста.
Стационарная фаза. Стационарная фаза наступает тогда, когда число клеток перестает увеличиваться. Скорость роста зависит от концентрации субстрата - при уменьшении этой концентрации, еще до полного использования субстрата, она начинает снижаться. Поэтому переход от экспоненциальной фазы к стационарной происходит постепенно. Скорость роста может снижаться не только из-за нехватки субстрата, но также из-за большой плотности бактериальной популяции, из-за низкого парциального давления O2 или накопления токсичных продуктов обмена; все эти факторы вызывают переход к стационарной фазе. И в стационарной фазе могут еще происходить такие процессы, как использование запасных веществ, распад части рибосом и синтез ферментов. Наблюдаемая картина зависит от того, какой именно фактор лимитирует рост. Быстро гибнут лишь очень чувствительные клетки; другие еще долго сохраняют жизнеспособность-до тех пор, пока есть возможность получать необходимую для этого энергию в процессе окисления каких-либо запасных веществ или клеточных белков.
Количество биомассы, достигнутое в стационарной фазе, называют выходом или урожаем. Урожай зависит от природы и количества используемых питательных веществ, а также от условий культивирования.
Фаза отмирания. Фаза отмирания и причины гибели бактериальных клеток в нормальных питательных средах изучены недостаточно. Сравнительно легко понять случаи, когда в среде накапливаются кислоты (при росте Escherichia, Lactobacillus). Число живых клеток может снижаться экспоненциально. Иногда клетки лизируются под действием собственных ферментов (автолиз).
6.5.4 Параметры кривой роста
Когда рост периодической культуры прослеживают по увеличению сухой бактериальной массы, интерес представляют в первую очередь три показателя, или параметра, роста: урожай клеток, скорость роста и длительность лаг-фазы (рис. 6.8).
Урожай. Под урожаем понимают разность между максимальной и исходной массой бактерий: X = Хмакс — Х0. Эту величину выражают в граммах сухого вещества. Особенно важное значение имеет отношение урожая клеток к количеству потребленного субстрата (Х/S). Если обе эти величины выражены в весовых единицах, то отношение Х/S называют экономическим коэффициентом и обозначают Y. Если же урожай в граммах отнесен к числу молей потребленного субстрата, то полученную величину называют в этом случае молярным экономическим коэффициентом и обозначают Y. Этот коэффициент позволяет связать урожай с количеством АТР, синтезируемым за счет какого-либо источника энергии (субстрата). Таким образом получают энергетический коэффициент выхода YAТР (в граммах клеточной массы на 1 моль АТР); его можно вычислить, если известны путь катаболизма данного субстрата и выход энергии в результате этого процесса.
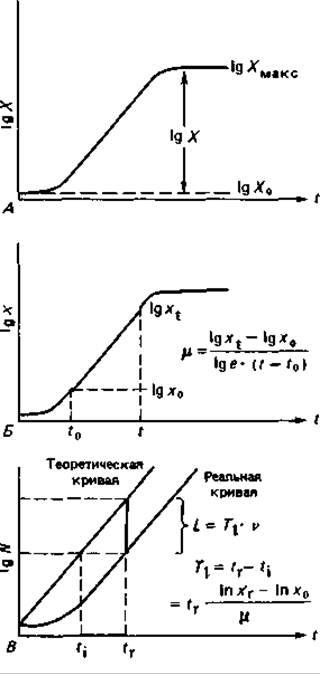
Рис. 6.8. Параметры роста: урожай клеток (А), скорость роста (Б) и длительность лаг-фазы (В).
Для анаэробных культур Escherichia coli и Klebsiella pneumoniae, скорость роста которых лимитировалась количеством добавляемой глюкозы, были найдены величины YAТР соответственно 12,4 и 14 г биомассы на 1 моль эквивалентов АТР. У анаэробных бактерий, получающих энергию в результате брожения, YAТР - в большой степени постоянная величина. Если для какого-то нового штамма бактерий получают существенно больший коэффициент, можно заключить, что имеется «побочный доход», т. е. дополнительный метаболический путь, дающий энергию. Величины YAТР были рассчитаны и определены также для клеток, растущих в аэробных условиях; они зависят от условий роста и от необходимой интенсивности процессов синтеза в клетках, т. е.,
например, от того, служат ли источником азота ионы аммония, нитрата или молекулярный азот.
Скорость экспоненциального роста. Это мера скорости роста клеток в экспоненциальной фазе. Ее вычисляют из начальной и конечной плотности бактерий х0 и xt, в моменты t0 и t по формуле
![]()
где lg е = 0,43429. Время удвоения ![]() Для «стандартных клеток»
Для «стандартных клеток»
p = ln2 ∙ v и td = g (разд. 6.5.2).
Длительность лаг-фазы (Ti). Это параметр, очень важный для суждения о свойствах бактерий или о пригодности среды. Его определяют как промежуток времени между моментом tr, в который культура достигла определенной плотности хr, и моментом ti, в который она могла бы достичь такой же плотности, если бы сразу же после инокуляции начинался экспоненциальный рост (индекс 1 означает лаг-фазу, индекс r - реальный рост, а индекс і - идеальный рост):
![]()
Поскольку параметр Ti пригоден лишь для сравнения двух культур с одинаковыми скоростями экспоненциального роста, рекомендуется измерять длительность лаг-фазы не в абсолютных, а в физиологических единицах (время генерации д). Разность между наблюдаемым ростом и вычисленным идеальным, выраженная числом, кратным времени генерации, равна L = Tiv. Таким образом, величина Lпоказывает, на сколько удвоений (генераций) реальная культура отстает от идеальной, которая с самого начала росла бы экспоненциально. Эту величину обычно используют при сравнении данных, характеризующих влияние различных питательных веществ, ингибиторов роста и условий культивирования.
6.5.5 Рост в непрерывной культуре
В периодической культуре условия все время меняются; плотность популяции бактерий возрастает, а концентрация субстрата уменьшается. Во многих физиологических исследованиях представляется, однако, желательным, чтобы клетки могли долгое время находиться в фазе экспоненциального роста при постоянной концентрации субстрата в неизменных прочих условиях. В какой-то мере приблизиться к такому положению можно, многократно и достаточно часто перенося клетки в новую питательную среду. Той же цели было бы, очевидно, проще достичь, если в сосуд, содержащий популяцию растущих бактерий, непрерывно вводить новый питательный раствор и одновременно удалять из него соответствующее количество бактериальной суспензии. Именно такой метод положен в основу непрерывного культивирования в хемостатах и турбидостатах.
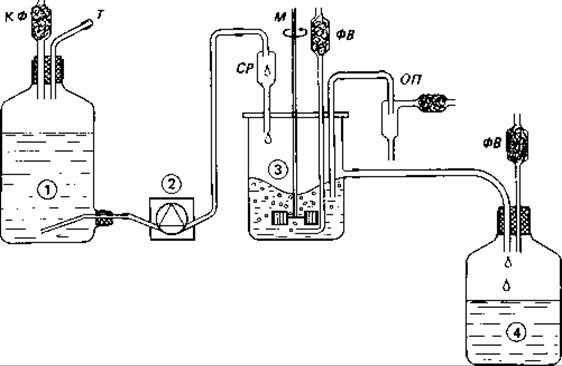
Рис. 6.9. Принцип непрерывной культуры в хемостате. 1 - сосуд с питательной средой, снабженный компенсационным фильтром (КФ) и трубкой для дозаправки (Г); 2 - перистальтический насос; 3 - хемостат с притоком питательной среды (СР), мешалкой (М), фильтром для воздуха (ФВ) и приспособлением для отбора проб (ОД); 4 - приемный сосуд с фильтром для выходящего воздуха (ФВ).
Рост в хемостате. Хемостат (рис. 6.9) состоит из сосуда-культиватора, в который из особого резервуара поступает с постоянной скоростью питательный раствор. Благодаря аэрации и механическому перемешиванию в культиваторе создаются оптимальные условия для снабжения клеток кислородом и для более быстрого и равномерного распределения питательных веществ, поступающих с новыми порциями раствора. По мере поступления в культиватор питательного раствора из него вытекает бактериальная суспензия.
Обозначим объем сосуда через V (литров), а скорость поступления питательного раствора - скорость притока - через f (литров в час); тогда скорость разведения D будет равна f/V Величина D, таким образом, отражает объем жидкости, сменяемый за 1 ч. Если бы при запуске хемостата бактерии, находящиеся в культиваторе (х [г/л]), не росли, то они вымывались бы из сосуда и скорость вымывания была бы равна ![]()
![]() Плотность бактериальной суспензии в сосуде снижалась бы в этом случае экспоненциально:
Плотность бактериальной суспензии в сосуде снижалась бы в этом случае экспоненциально:
![]()
Бактерии в культиваторе тоже растут экспоненциально. Скорость прироста определяется выражением ![]() т. е. экспоненциально увеличивается и плотность бактериальной суспензии:
т. е. экспоненциально увеличивается и плотность бактериальной суспензии:
![]()
Следовательно, скорость изменения плотности суспензии в сосуде dx/dt равна алгебраической сумме величин μх и — Dx:
![]()
Если скорость роста р и скорость разбавления D равны, то потеря в результате вымывания клеток и прирост биомассы уравновешивают друг друга, т. е. изменение равно нулю и плотность бактериальной суспензии x остается постоянной. Культура оказывается при этом в состоянии динамического равновесия. Экспоненциальное размножение клеток компенсируется другим экспоненциальным процессом, ведущим к уменьшению их числа.
Рост культуры в хемостате контролируется концентрацией субстратов. На таком ограничении скорости роста концентрацией одного из необходимых субстратов (донора электронов, источника азота, серы или фосфора) основана стабильность системы. Если вследствие этого ограничения истинная скорость роста μ оказывается меньше μмакс (максимальной скорости, достижимой при насыщении субстратом), то скорость разбавления D можно менять в широких пределах без того, чтобы это привело к снижению плотности суспензии. Однако скорость разбавления не должна превышать μмакс.
Зависимость константы роста μ от концентрации субстрата сs описывается кривой насыщения (рис. 6.10). Вообще говоря, бактерии способны расти с максимальной скоростью уже при очень незначительных концентрациях субстрата (например, 10 мг глюкозы на 1 л). Только при еще меньших количествах субстрата величина р зависит от его концентрации. Ту концентрацию субстрата, при которой скорость ростаμ достигает половины максимального значения (μ = μМакс/2), обозначают КS. Величина КS наряду с величинами Y и μмакс - это один из важнейших параметров, характеризующих рост бактерий в хемостатах.
На рис. 6.11 показано влияние скорости разбавления D на четыре показателя - плотность бактериальной суспензии, концентрацию субстрата, время удвоения и урожай клеток. При изменении скорости разбавления D от нуля почти до точки вымывания Dc плотность бактериальной суспензии меняется незначительно. В этой области бактерии реагируют на повышение D уменьшением времени удвоения. Однако с повышением скорости разбавления (когда увеличивается также скорость притока и уменьшается время удвоения) возрастает урожай клеток. Он достигает максимума при Dm, а при дальнейшем увеличении D резко снижается.
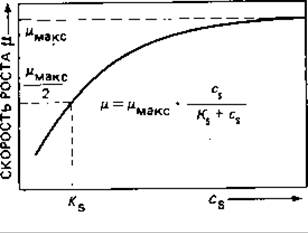
Рис. 6.10. Зависимость скорости роста μ от концентрации субстрата (cs).
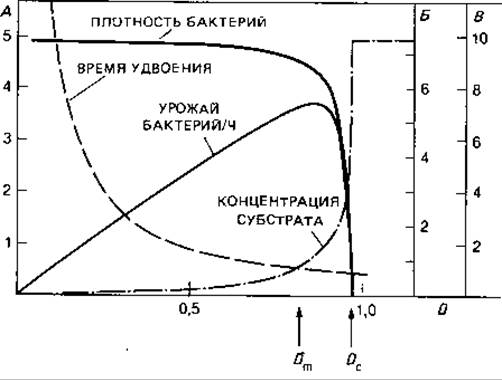
Рис. 6.11. Соотношения между плотностью бактериальной суспензии, концентрацией субстрата, временем удвоения и урожаем бактерий в условиях динамического равновесия при различных скоростях разведения (D) в хемостате. Данные для бактериальной культуры со следующими параметрами: μмaкс = 1,0 ч-1; Y = 0,5; Ks = 0,2 г/л; концентрация субстрата в поступающем питательном растворе Sr = 10 г/л. На оси ординат: А - урожай бактерий, г/(л ∙ ч); Б - время удвоения td, ч; В -концентрация субстрата в культуральном сосуде S, г/л. На оси абсцисс: коэффициент разбавления D, ч-1; Dm- коэффициент разбавления при максимальном урожае бактерий; Dc - точка вымывания. (Herbert et al., J. Gen. Microbiol., 14 [1956] 601.)
Концентрация субстрата в культиваторе, а следовательно, и в вытекающей из него суспензии при низких скоростях разбавления в довольно широкой области близка к нулю. Лишь тогда, когда скорость разбавления приближается к величине, обеспечивающей максимальный рост, заметная часть субстрата начинает вымываться вместе с клетками; в конце концов концентрация субстрата на выходе становится равной его концентрации в поступающем питательном растворе.
Стабильность динамического равновесия культуры в хемостате обусловлена тем, что ее рост лимитирует концентрация какого-то субстрата. Величина μ поддерживается на низком уровне. Хемостат представляет собой саморегулирующуюся систему, простую в работе; если скорость притока достаточно долго остается постоянной, то работа хемостата регулируется автоматически.
Рост в турбидостате. От описанной выше непрерывной культуры в хемостате существенно отличается непрерывная культура в турбидостате. Как указывает само название, работа турбидостата основана на поддержании постоянной плотности бактериальной суспензии, или постоянной мутности. Датчик мутности регулирует через управляющую систему поступление питательного раствора. В сосуде для культивирования все питательные вещества содержатся в избытке, и скорость роста бактерий приближается к максимальной. Работа с турбидостатами технически сложнее, чем с хемостатами.
Принципиальные различия. Между классической периодической культурой и непрерывной культурой в хемостате имеются принципиальные различия, которые в заключение следует еще раз подчеркнуть.
Периодическую культуру можно рассматривать как замкнутую систему (в какой-то мере подобную многоклеточному организму), которая в своем развитии проходит четыре фазы - начальную, экспоненциальную, стационарную и фазу отмирания (юность, расцвет, старение и смерть). Условия существования культуры во всех этих фазах различны. Автоматическое регулирование в периодической культуре вряд ли возможно.
Непрерывная культура представляет собой открытую систему, стремящуюся к установлению динамического равновесия. Фактор времени в ней в известной мере исключается. Для организмов создаются неизменные условия среды. Установка легко поддается автоматическому регулированию.
6.5.6 Синхронизация плеточного деления
Для изучения метаболических процессов на протяжении цикла клеточного деления нужны такие суспензии, в которых клетки делились бы одновременно (синхронно). Чтобы достичь такого совпадения фаз цикла у разных клеток, прибегают к синхронизации культуры. Синхронизировать деление в какой-либо популяции клеток можно с помощью различных искусственных приемов, таких как изменение температуры, воздействие света, ограничение количества питательных веществ или пропускание микроорганизмов через специальный фильтр с целью получить клетки одного размера. Клеточная суспензия, синхронизированная той или иной обработкой, после нескольких одновременных делений постепенно переходит снова к асинхронному делению, так что число клеток увеличивается в дальнейшем уже не ступенчато, а непрерывно.