Клінічна імунологія та алергологія - О.М. Біловол 2011
Структура і принципи функціонування імунної системи. Вікова імунологія
Актуальність теми. У сучасній медицині імунологія зайняла значуще місце як галузь, що розвивається, проте на неї покладають надії лікарі різних спеціальностей. Актуальність теми полягає в тому, що порушення розвитку, диференціювання імунокомпетентних клітин, їх функціонування, синтезу їх продуктів або регуляції цих процесів ведуть до порушень імунологічних функцій. Ці порушення можуть залишатися безсимптомними або виявляються клінічно, і за тяжкістю клінічні прояви коливаються від м’яких до фатальних. Такі порушення можуть стосуватися основних клітин імунної системи: Т- і В-лімфоцитів, фагоцитів, природних кілерів та їх продуктів: білків системи комплементу, імуноглобулінів, цитокінів.
Значна частина порушень пов’язана з уродженими або набутими дефектами продукції імунокомпетентних клітин або їх функцій. Інші випадки імунодефіцитів пов’язані з малігнизацією імунокомпетентних клітин та їх неконтрольованою проліферацією, надмірним накопиченням їх продуктів. Різноманітними можуть бути клінічні прояви порушень регуляції імунологічних функцій: нерегульованої активації системи комплементу, нерегульованої продукції і рецепції цитокінів.
Імунна система складається з таких органів, як кістковий мозок, тимус, селезінка, лімфатичні вузли, скупчення лімфоїдної тканини. Розрізняють первинні - центральні (кістковий мозок і тимус) і вторинні - периферичні (селезінка, лімфатичні вузли, скупчення лімфоїдної тканини) органи імунної системи. Всі вони взаємозв’ язані системою кровообігу, лімфотоку і єдиною системою імунорегуляції.
Загальна мета: Знання основ функціонування природженого та набутого імунітету, центральних і периферичних органів імунної системи, вікових аспектів імунології.
Конкретні цілі: |
Початковий рівень знань-умінь: |
1. Характеристика центральних і периферичних органів імунної системи. 2. Визначення видів імунітету 3. Фактори природженого імунітету. 4. Характеристика антигенів. 5. Етапи специфічного імунітету. 6. Структура і функції імуноглобулінів. 7. Особливості головного комплексу гістосумісності. 8. Вікові особливості функціонування імуно-компетентних клітин. 9. Імунна система новонародженого і дитини в різні вікові періоди. 10. Специфіка проявів імунних порушень у осіб літнього віку. |
1. Особливості функціонування центральних і периферичних органів імунної системи (кістковий мозок, тимус, лімфатичні вузли, селезінка). 2. Фактори уродженого імунітету: клітинні (моноцитарно-макрофагальна система, кілерні та гранулоцитарні клітини), гуморальні (система комплементу, цитокіни та ін.). 3. Популяції (Т- і В-лімфоцити) та субпопуляції (Т-хелпери 1-го і 2-го типу, Т- регуляторні, Т-ЦТЛ) лімфоцитів. 4. Поняття про уроджений та набутий імунітет. 5. Зв’язок між імунною системою та старінням організму. 6. Основні імунологічні зміни, що відбуваються при старінні. |
Тестові завдання для перевірки початкового рівня знань
1. Природний імунітет представлений:
A. Природними бар’єрами.
B. Слизовими оболонками.
C. Фагоцитозом.
D. Запаленням.
2. Антитіла є основним елементом захисту:
A. Проти внутрішньоклітинних антигенів.
B. Проти екстрацелюлярних мікроорганізмів.
C. Відносно пухлинних антигенів.
3. Зменшення якої ланки клітин спостерігається внаслідок старіння організму?
A. Базофілів.
B. В-лімфоцитів.
C. Т-лімфоцитів.
D. Моноцитів.
E. Еозинофілів.
4. Основними клітинами клітинного імунітету є:
A. В-клітини.
B. Макрофаги.
C. Т-клітини.
5. Які клітини не відносяться до антиген-презентуючих клітин?
A. Нейтрофіли.
B. Дендритні клітини.
C. Моноцити.
D. Еозинофіли.
6. Макрофаг виконує всі наступні функції, окрім:
A. Фагоцитує антиген.
B. Синтезує інтерлейкін-2.
C. Експресує молекули 2-го класу головного комплексу гістосумісності.
D. Презентує пептидні фрагменти антигена іншим клітинам імунної системи.
7. Яка відповідь є помилковою? Виділяють наступні субпопуляції лімфоцитів:
A. Т-хелпери.
B. В-клітини.
C. CD-15 Т-ліганд.
D. CD-4 лімфоцити.
8. Які клітини безпосередньо продукують імуноглобуліни класу А?
A. Цитотоксичні лімфоцити.
B. CD-4 лімфоцити.
C. Плазматичні клітини пейєрових бляшок.
D. Макрофаги.
9. До центральних органів імунної системи людини відносяться:
A. Селезінка.
B. Вилочкова залоза.
C. Лімфатичні вузли.
D. Кістковий мозок.
E. Мигдалики.
10. Антиген - це речовина, що має наступні властивості:
A. Чужорідність.
B. Антигенність.
C. Імуногенність.
D. Специфічність.
E. Все з перерахованого.
Вірні відповіді на питання: 1 - АВСD; 2 - В; 3 - C; 4 - С; 5 - D; 6 - В; 7 - С; 8 - С; 9 - В^; 10 - Е.
Джерела учбової інформації
1. Клінічна імунологія та алергологія: Підручник/[Г.М. Дранік, О. С. Прилуцький, Ю. І. Бажора та ін.]; за ред. проф. Г. М. Драніка.- К.: Здоров’я, 2006. - 888 с.
2. Казмірчук В. Є. Клінічна імунологія і алергологія / В.Є. Казмірчук, Л.В. Ковальчук. - Вінниця: Нова книга, 2006, 504 с.
3. Андрєйчин М. А. Клінічна імунологія та алергологія: Підручник / Андрєйчин М. А., Чоп’як В. В., Господарський І. Я. - Тернопіль: Укрмедкнига, 2005. - 372 с.
4. Клиническая иммунология и аллергология: Учебное пособие / под ред. А. В. Караулова.- М.: Медицинское информационное агентство, 2002. - 651 с.
5. Никулин Б. А. Оценка и коррекция иммунного статуса / Никулин Б. А. - М.: ГЭОТАР-Медиа, 2007. - 376 с.
6. Бурместер Г. Р. Наглядная иммунология, пер. с англ. / Бурместер Г. Р. - М.: БИНОМ. Лаборатория знаний, 2007. - 329 с.
7. Анисимов В. Н. Молекулярные и физиологические механизмы старения / Анисимов В.Н. - М.: ГЭОТАР-Медиа, 2003. - 468 с.
Орієнтовна основа дії
Клінічна імунологія - це клінічна і лабораторна дисципліна, яка вивчає обстеження, діагностику і лікування хворих з патологічними процесами, що розвиваються в результаті порушення імунних механізмів, а також тими випадками, коли імунологічні маніпуляції є важливою частиною терапії і (або) профілактики (Комюніке експертів ВООЗ, MCIO, МААСІ, 1993).
Імунітет - це еволюційно обумовлена сукупність реакцій взаємодії між системою імунітету і біологічно активними агентами (антигенами), що спрямовані на збереження фенотипічної постійності внутрішнього середовища (гомеостазу) організму.
СТРУКТУРА І ПРИНЦИПИ ФУНКЦІОНУВАННЯ ІМУННОЇ СИСТЕМИ
Основні функції імунної системи: контроль за антигенним станом внутрішнього середовища організму, захист організму від патогенних мікроорганізмів і протипухлинний нагляд. У виконанні цих функцій беруть участь як механізми неспецифічного захисту, так і специфічна імунна відповідь на конкретні інфекційні або пухлинні антигени. Специфічна імунна відповідь підсилює механізми неспецифічного захисту, робить їх більш цілеспрямованими.
Органи імунної системи
Центральні органи імунної системи - кістковий мозок і тимус - виконують найважливіші функції, забезпечуючи самооновлення імунної системи. У цих органах йдуть процеси проліферації клітин-попередників, їх диференціювання і дозрівання, аж до виходу в циркуляцію і заселення периферичних органів імунної системи зрілими імунокомпетентними клітинами.
Кістковий мозок. Усі клітини крові, у тому числі імунокомпетентні клітини, походять з поліпотентної стовбурової клітини, яка дає початок різним паросткам кровотворення, зокрема мієло-моноцитарному і лімфоцитарному. Напрям диференціювання ранніх попередників залежить від впливу їх мікрооточення, впливу стромальних клітин кісткового мозку.
Дія окремих цитокінів на клітини-попередники в умовах in vitro виявляється стимуляцією зростання окремих колоній, що складаються з лейкоцитів певного типу. Звідси їх назва - колонієстимулюючі чинники GM-CSF, G-CSF, M-CSF. Гранулоцитарно-моноцитарний чинник стимулює проліферацію ранніх загальних клітин-попередників мієло-моноцитопоеза. Гранулоцитарний і моноцитарний чинники стимулюють клітини-попередники кожного з паростків. Ще більш універсальним є так званий мульти-CSF (інтерлейкін-3), який стимулює всі паростки кровотворення. Продуцентами цих ростових чинників та інших цитокінів є стромальні клітини кісткового мозку, макрофаги і активовані лімфоцити. Інтерлейкін-1 й інтерлейкін-6 є синергістами колонієстимулюючих чинників у стимуляції проліферації клітин-попередників або індукують продукцію ростових чинників.
Тимус (вилочкова залоза) є єдиним органом імунної системи, що піддається швидкій віковій інволюції. Протягом перших 50 років життя щорічно втрачається по 3% істинно тимічної тканині, яка поступово заміщається жировою і сполучною тканиною. Відповідно знижується і продукція Т-лімфоцитів. Найвища продукція Т- лімфоцитів зберігається до двох років життя, а потім швидко падає. Проте, слід зазначити, що кількість Т-лімфоцитів у циркуляції зберігається на досягнутому рівні. Річ у тому, що значну частину популяції Т-лімфоцитів складають клітини, які довго живуть і не потребують постійного оновлення. Тому чисельність Т-клітин може підтримуватися в дорослому організмі і за відсутності тимусу. Більш того, зрілі Т-лімфоцити піддаються так званій "клональній експансії", тобто виборчій проліферації у відповідь на зустріч зі своїм антигеном, за рахунок чого їх чисельність зростає. Після створення пулу периферичних Т-лімфоцитів втрата тимусу вже не призводить до катастрофічного зниження імунітету. На користь цього говорять результати імунологічного обстеження дорослих людей, що перенесли тимектомію.
Периферичні органи імунної системи. Периферичні органи імунної системи - лімфатичні вузли, селезінка і лімфоїдна тканина, що асоціюється із слизовими оболонками, - є місцем зустрічі антигенів з імунокомпетентними клітинами, місцем розпізнавання антигена і розвитку специфічної імунної відповіді, місцем взаємодії імунокомпетентних клітин, їх проліферації (клональної експансії), антиген-залежного диференціювання і місцем накопичення продуктів імунної відповіді.
Лімфатичні вузли функціонують як своєрідні фільтри лімфи, затримуючи мікроорганізми та інші частинки, що потрапили в лімфу. Разом з тим, лімфовузли є місцем взаємодії імунокомпетентних клітин у ході специфічної імунної відповіді, місцем синтезу антитіл-імуноглобулінів, місцем, де розігруються події клітинно-опосередкованого імунітету.
Один лімфовузол має масу близько 1 г, містить приблизно 2000 мільйонів лімфоцитів, що відповідає 25% всіх циркулюючих у крові лімфоцитів. Кожну годину з лімфовузла виходить у лімфу кількість лімфоцитів, еквівалентна його потрійній вазі. Велика частина (90%) клітин у цій еферентній лімфі є лімфоцитами, що залишили кров’яне русло на території цього лімфовузла. Мічені лімфоцити, введені в кров, знову опиняються в лімфі вже через декілька годин, досягаючи максимуму через 20 годин. Серед клітин лімфовузла близько 10% складають макрофаги і близько 1% - дендритні клітини.
Тканина лімфовузла складається із зовнішнього кортикального шару, в якому скупчення клітин утворюють фолікули, частково - із зародковими центрами, і внутрішнього мозкового шару з меншим вмістом лімфоцитів у поєднанні з макрофагами, які зосереджені по ходу лімфатичних і судинних синусів. Така структура лімфовузлів дає можливість вільної циркуляції і рециркуляції лімфоцитів між лімфою, кров’ю і тканинами. Певні зони лімфовузла заселяються строго певними клітинами.
Селезінка. У селезінці, як і в лімфовузлах, є Т-залежні і В-залежні зони. Періартеріолярними лімфоїдними скупченнями є Т-залежні зони. Селезінка є місцем розпізнавання антигена, антигензалежної проліферації і диференціювання Т- і В-лімфоцитів, їх активації, а також продукції і секреції специфічних антитіл імуноглобулінів. Основна відмінність селезінки від лімфовузлів полягає в тому, що селезінка є місцем специфічної імунної відповіді на антигени, які циркулюють в крові, а в лімфовузлах відбуваються процеси специфічної імунної відповіді на антигени, що потрапляють у лімфу. Крім того, селезінка, з її багатою мережею макрофагів у червоній пульпі, виконує функції фільтру крові, який видаляє з крові чужорідні частинки і молекули, що потрапляють туди, а також постарілі еритроцити, або еритроцити, навантажені імунними комплексами.
Лімфоїдна тканина, що асоціюється із слизовими оболонками. Скупчення лімфоцитів, макрофагів та інших допоміжних клітин були виявлені у складі багатьох органів і тканин, особливо у складі слизових оболонок. Безпосередньо під мукозним епітелієм у тісному зв’язку з епітеліальними клітинами розташовуються лімфоцити Пейерових бляшок тонкого кишечника, лімфоїдних фолікулів апендиксу, мигдаликів глотки, лімфоїдних фолікулів підслизового шару верхніх дихальних шляхів і бронхів, сечостатевого тракту. Всі ці лімфоїдні скупчення отримали збірну назву - асоційована із слизовими оболонками лімфоїдна тканина (MALT - від mucosal-associated lymphoid tissue).
Імунокомпетентні клітини
Імунокомпетентні клітини знаходяться в стані рециркуляції, тобто постійно відбувається обмін клітинами між кров’ю, лімфою і лімфоїдними органами. Це необхідно для реалізації специфічної імунної відповіді, оскільки імунна система повинна бути готова відповісти на будь-який з безлічі чужорідних антигенів, що потрапляє в будь-яку ділянку тіла. Оскільки кожний окремий антиген розпізнається лише дуже невеликою частиною популяції лімфоцитів, тільки постійна рециркуляція може створити умови для зустрічі кожного антигена з одиничними лімфоцитами, що несуть специфічні для нього антиген-розшукуючі рецептори. В органах імунної системи, де відбувається ця зустріч, стається взаємодія антиген- специфічних лімфоцитів з іншими клітинами, що виконують роль допоміжних, беруть участь у запуску імунної відповіді та в її ефекторній фазі. До допоміжних клітин відносяться дендритні клітини, мононуклеарні фагоцити, гранулоцити та ін.
У процесі диференціювання на мембранах клітин системи імунітету з’являються різні макромолекули - маркери, що відповідають певній стадії розвитку клітинних популяцій. Вони отримали назву CD-антигенів (від англ. clusters of differentiation - кластери диференціювання). З використанням моноклональних антитіл стало можливим провести кількісний аналіз популяцій клітин крові та класифікувати їх відповідно до наявності поверхневих антигенів. Моноклональні антитіла з фактично ідентичною специфічністю до даного мембранного антигену були згруповані і позначені відповідним номером кластера диференціювання (CD). Усі вони виконують функції рецепторів адгезинів, після взаємодії з якими всередину клітини надходить сигнал і відбувається її активація, супресія або навіть апоптоз.
• CD3 - несуть всі зрілі Т-лімфоцити, а незрілі - в цитоплазмі, забезпечує передачу сигналу від Т-клітинного антиген-специфічного рецептора (ТКР) в цитоплазму.
• CD4 - маркер Т-хелперів, трансмембранний глікопротеїн, один з рецепторів вірусу імунодефіциту людини (ВІЛ), є на деяких моноцитах, клітинах глії, бере участь у розпізнаванні антигенів, що асоціюються з молекулами MHC II класу.
• CD8 - маркер Т-супресорів і цитотоксичних лімфоцитів, його мають деякі NK-клітини, залучається до розпізнавання антигенів за участю молекул MHC I класу.
• CD16 - маркер натуральних кілерів (NK-клітин), моноцитів, Fc-рецептор для IgG.
• CD19 - має пре-В-лімфоцити і В-лімфоцити, він є частиною їхнього рецепторного комплексу, залучається до їх активації (сигнал трансдукції, асоційований з CD21).
• CD22 - є на зрілих В-лімфоцитах, молекула адгезії, підсилює анти-lg індуковану активацію В-клітин.
• CD25 - є на активованих Т- і В-лімфоцитах і макрофагах, бере участь в утворенні рецептора інтерлейкіна-2, скидається з активованих лімфоцитів.
У табл. 1 представлені відомі на сьогоднішній день кластери
диференціювання, визначені в клітинах імунної системи за допомогою моноклональних антитіл.
Таблиця 1
Список кластерів диференціювання, визначених у клітинах імунної системи за допомогою моноклональних антитіл
Антиген |
Ліганд |
Клітини, що несуть антиген |
Функції антигена |
Маркери T-лімфоцитів |
|||
CD1 |
- |
T-лімфоцити коркового шару тимуса |
Пов’язаний з бета2-мікроглобуліном, бере участь у представленні антигену незрілим T-лімфоцитам |
CD2 |
LFA-3 |
T- і NK-лімфоцити |
Рецептор до еритроцитів барана, бере участь в активації T-лімфоцитів |
CD3 |
- |
T-лімфоцити |
Пов’язаний з антиген-розпізнаваючим рецептором T-лімфоцитів, бере участь у їх активації |
CD4 |
MHC II класу |
T-лімфоцити, моноцити |
Присутній на T-хелперах, забезпечує їхню взаємодію з макрофагами |
CD5 |
CD72 |
T- і B-лімфоцити |
Присутній на зрілих T-лімфоцитах і незначній частині B-лімфоцитів, з’являється на лейкозних B-лімфоцитах при хронічному лімфолейкозі |
CD7 |
- |
T-лімфоцити |
Присутній на кістковомозкових попередниках T-лімфоцитів і зрілих T-лімфоцитах |
CD8 |
MHC I класу |
T- і NK-лімфоцити |
Присутній на цитотоксичних T-лімфоцитах, забезпечує їх взаємодію з клітинами-мішенями |
CD25 |
Інтерлейкін-2 |
T-, B- і NK-лімфоцити, моноцити |
Альфа-ланцюг рецептора до інтерлейкіну-2 (p55), маркер активованих T- і B-лімфоцитів |
CD28 |
CD80 |
T-лімфоцити |
Бере участь в активації T-лімфоцитів |
CD29 |
Фібро-нектин |
T-лімфоцити |
Забезпечує адгезію до позаклітинного матриксу |
CD38 |
- |
T- і B-лімфоцити |
Присутній на T-лімфоцитах кіркової речовини тимуса, активованих T-лімфоцитах, незрілих B-лімфоцитах і плазматичних клітинах, бере участь у регуляції функцій B-лімфоцитів |
CD43 |
ICAM-1 |
T- і B-лімфоцити, гранулоцити, моноцити |
Бере участь в активації T-лімфоцитів |
CD45 |
- |
Усі лейкоцити |
Бере участь в активації лімфоцитів, внутрішньоклітинна частина рецептора є тирозинкіназою |
CD45RA |
- |
Усі лейкоцити |
Маркер наївних лімфоцитів CD4 |
CD45RO |
- |
T- і B-лімфоцити, гранулоцити, моноцити |
Маркер клітин пам’яті (лімфоцитів CD4) |
CD71 |
Трансферин |
T-лімфоцити, моноцити |
Рецептор трансферіну, маркер активованих T-лімфоцитів |
Маркери B-лімфоцитів |
|||
Поверхневі імуноглобуліни |
Антиген |
B-лімфоцити |
Присутні тільки на зрілих B-лімфоцитах |
CD10 |
- |
B-лімфоцити |
Присутній на незрілих B-лімфоцитах, з’являється на лейкозних клітинах при гострому лімфолейкозі |
CD19 |
- |
B-лімфоцити |
Присутній на пре-Б-лімфоцитах і на всіх зрілих B-лімфоцитах, бере участь в активації B-лімфоцитів |
CD20 |
- |
B-лімфоцити |
Присутній на всіх B-лімфоцитах |
CD21 |
C3d, CD23 |
B-лімфоцити |
Рецептор до комплементу і вірусу Епштейна-Бара |
CD23 |
IgE |
B- і T-лімфоцити, моноцити, еозинофіли |
Низькоаффінний рецептор до Fc-фрагменту IgE |
CD32 |
IgG |
В-лімфоцити, гранулоцити |
Нізькоаффінний рецептор до Fc-фрагменту IgG |
CD40 |
gP39 |
В-лімфоцити |
Стимулює проліферацію В-лімфоцитів, за будовою схожий з CD27 і рецептором чинника некрозу пухлин |
CD72 |
CD5 |
В-лімфоцити |
З’являється на кістковомозкових попередниках В-лімфоцитів, бере участь у їх диференціюванні |
HLA-DR |
Антиген, CD4 |
В- і T-лімфоцити, моноцити |
Антиген MHC II класу, бере участь у представленні антигена T-хелперам і їх активації, маркер активованих T-лімфоцитів |
Маркери моноцитів і макрофагів |
|||
CD11a |
ICAM-1 |
Усі лейкоцити |
Альфа-ланцюг LFA-1, бере участь у міжклітинній адгезії |
CD11b |
C3bi, фібронектин |
Моноцити, гранулоцити, NK-лімфоцити |
Альфа-ланцюг CR3, бере участь у міжклітинній адгезії |
CD11c |
C3bi |
Моноцити, гранулоцити, В- і NK-лімфоцити |
Альфа-ланцюг CR4, бере участь у міжклітинній адгезії |
CD18 |
- |
Усі лейкоцити |
Бета-ланцюг рецепторів CD11a/CD18, CD11b/CD18, CD11c/CD18, бере участь у міжклітинній адгезії |
Маркери NK-лімфоцитів |
|||
CD16 |
Fc-фрагмент IgG |
NK-лімфоцити, моноцити і гранулоцити |
Низькоаффінний рецептор IGG |
CD56 |
- |
NK- і T-лімфоцити |
Присутній на частини T-лімфоцитів, бере участь у міжклітинній адгезії |
CD57 |
- |
NK- і T-лімфоцити |
Присутній на частині лімфоцитів CD8, при деяких вірусних інфекціях збільшується число лімфоцитів, що несуть одночасно CD8 і CD57 |
Прийняті скорочення: (-) - невідомий або відсутній; CR - рецептор до компонентів комплементу; ICAM - молекули міжклітинної адгезії (Inter Cellular Adhesion Molecule); LFA - лімфоцитарний функціональний антиген (Lymphocyte Function-associated Antigen).
Лімфоцити - це єдині клітини організму, здатні специфічно розпізнавати і розрізняти різні антигени і відповідати активацією на контакт з певним антигеном. При вельми схожій морфології малі лімфоцити діляться на дві популяції, що мають різні функції і продукують різні білки.
В-лімфоцити. Одна з популяцій отримала назву В-лімфоцити, від назви органу "бурса Фабріциуса", де було вперше виявлено дозрівання цих клітин у птахів. У людини В-лімфоцити дозрівають у кістковому мозку. В-лімфоцити розпізнають антигени специфічними рецепторами імуноглобулінової природи, які в міру дозрівання експресуються на їх мембранах. Взаємодія антигену з такими рецепторами є сигналом активації В-лімфоцитів та їх антиген-залежного диференціювання в плазматичні клітини, що активно продукують і секретують специфічні для даного антигену антитіла - імуноглобуліни.
Т-лімфоцити отримали свою назву в зв’язку з їх диференціюванням у тимусі. Зрілі Т-лімфоцити (CD2, CD3) на відміну від незрілих (тимоцитів - CD2) здатні відповідати проліферацією на Т-клітинні мітогени. По функціях серед Т-лімфоцитів розрізняють ефекторні (CD8 цитотоксичні лімфоцити - CTL) і регуляторні (CD4+ Т-хелпери-Th) субпопуляції.
Т-хелпери стимулюють проліферацію і диференціювання цитотоксичних лімфоцитів, В-клітин і утворення антитіл. Тобто Т-хелпери мають хелперну функцію (стимулюють В-лімфоцити для продукції імуноглобулінів) і індукторну функцію (стимулюють проліферацію і диференціювання цитотоксичних лімфоцитів, що відповідають на розчинні антигени проліферацією і продукцією лімфокінів).
Т-хелпери 1-го типу (Th1) експресують диференційовочні антигени CD3, CD4, CD45Ra. Це - активатори клітинного імунітету, натуральних кілерів і моноцитів. Продукуючи інтерлейкіни-2, 3, 12, ІФН-у і ФНО-а, вони викликають активацію цитотоксичних Т-лімфоцитів і натуральних кілерів, проліферацію Т- і В-лімфоцитів, продукцію цитокінів і синтез IgM, IgG2. Th1 забезпечують імунітет проти вірусів, внутріклітинних бактерій і онкогенних клітин. Активність Th1 подавляє інтерлейкін-10.
Т-хелпери 2-го типу (Th2) мають диференційовочні антигени CD3, CD4, CD29 і відповідають за кооперацію з В-клітинами. Вони активують гуморальну імунну відповідь і алергічне запалення. Стимулюючи продукцію плазматичними клітинами імуноглобулінів IgG4 і IgA, Th2, забезпечують імунітет проти звичайних (позаклітинних) бактерій і їх токсинів. Активація еозинофілів, тучних клітин і стимуляція синтезу імуноглобуліну Е (IgE) веде до розвитку алергії. Актівність Th2 подавляє ІФН-у.
T-лімфоцити, що несуть на своїй поверхні антигени CD8, мають супресорну (щодо В-лімфоцитів і продукції ними імуноглобулінів) і цитотоксичну активність.
CD8 Т-супресори гальмують розвиток імунної відповіді як на власні, так і на чужі антигени, забезпечуючи імунологічну толерантність.
Цитотоксичні CD8 Т-лімфоцити - це ефектори клітинної імунної відповіді, що забезпечують руйнування чужорідних клітин.
Особливість Т-клітинного рецептора - здатність розпізнавати чужорідний антиген тільки в комплексі з власними клітинними антигенами на поверхні допоміжних антиген-презентуючих клітин (дендритних або макрофагів). На відміну від В-лімфоцитів, здатних розпізнавати антигени в розчині і зв’язувати білкові, полісахаридні і липопротеїдні розчинні антигени, Т-лімфоцити можуть розпізнати тільки короткі пептидні фрагменти білкових антигенів, представлені на мембрані інших клітин у комплексі з власними антигенами головного комплексу гістосумісності. CD4 Т-лімфоцити здатні розпізнавати антигенні пептиди в комплексі з антигенами гістосумісності (mane compartable complex) MHC II класу, а CD8 Т-лімфоцити здатні розпізнавати антигенні пептиди в комплексі з антигенами гістосумісності MHC I класу.
Натуральні кілери (NK-клітини) є субпопуляцією лімфоцитів, що походять з кістковомозкових попередників. Їх морфологічні ознаки - великі розміри і наявність гранул у цитоплазмі - є підставою для їх другої назви - великі гранулярні лімфоцити (ВГЛ). Їх основна функціональна характеристика - здатність вбивати деякі пухлинні клітини.
НК розвиваються незалежно від Т- і В-лімфоцитів і не несуть характерних для Т- і В-лімфоцитів поверхневих маркерів. Їх поверхневий фенотип: ТКР-, CD4, CD8-, Ig-, CD3-, але вони мають деякі загальні з Т-лімфоцитами сигнальні молекули: CD2, окремі компоненти CD3.
Більш специфічними маркерами НК у крові людини є: СD56 і CD 16 (FCYRIII). Поверхневий фенотип НК, як правило, включає наступні маркери: CD2, CD7, CD11, CD16, CD56, CD57.
Мононуклеарні фагоцити. Другу велику популяцію клітин імунної системи складає система мононуклеарних фагоцитів, яка включає кістковомозкові попередники, що походять з єдиної стовбурової клітини, - монобласт і промоноцит, циркулюючий у крові моноцит і зрілі тканинні макрофаги. Мононуклеарні фагоцити забезпечують у значній мірі неспецифічний захист організму за рахунок своєї фагоцитарної функції.
Молекули, що секретуються макрофагами, виконують ефекторні і регуляторні функції. При формуванні специфічної імунної відповіді макрофаги виконують функцію представлення (презентації) антигена.
Для цього захоплений макрофагами антиген піддається переробці у фаголізосомах. Пептидні фрагменти антигена, що утворюються в результаті обмеженого протеолізу, комплексуються з молекулами антигенів головного комплексу гістосумісності класу ІІ і виставляються на мембрані макрофага у формі, доступній для розпізнавання Т-лімфоцитами.
Макрофаги постійно дозрівають з циркулюючих у крові моноцитів, що мають кістковомозкове походження. Покидаючи кров’яне русло, дозріваючі макрофаги мігрують у різні тканини організму. У легенях вони представлені альвеолярними макрофагами. Велика кількість макрофагів знаходиться в сполучній тканині, в лімфовузлах і лімфоїдній тканині, що асоціюється із слизовими оболонками, зокрема із слизовими оболонками повітроносних шляхів. Оновлення тканинних макрофагів відбувається в основному за рахунок рекрутування моноцитів з крові.
Дендритні клітини і клітини Лангерганса мають кістково-мозкове походження. Розрізняють фолікулярні й інтердигітальні дендритні клітини. Перші виявляють у В-зонах лімфатичних вузлів і селезінки, вони мають на своїй поверхні рецептор до Fc-фрагмента імуноглобулінів, але позбавлені антигенів МНС класу II, вони презентують антиген В-лімфоцитам. Інтердигітальні дендритні клітини містяться в Т-клітинних ділянках лімфатичних вузлів і селезінки, мають на своїй поверхні антигени МНС класу II, але не містять рецептори до Fc-фрагмента, беруть участь у презентації антигена для Т-лімфоцитів.
Гранулоцити. В ефекторній фазі специфічної імунної відповіді можуть брати участь й інші лейкоцити крові: гранулоцити або поліморфноядерні лейкоцити. Ці клітини складають першу лінію неспецифічного протимікробного захисту. Вони першими мобілізуються у вогнище запалення або інфекції, і від їх фагоцитарної активності залежить елімінація збудників. Їх мобілізація з кров’яного русла різко підвищується під впливом цитокінів макрофагального походження (інтерлейкін-8) або С5а-фракції активованої системи комплементу. Інші продукти макрофагів активують функції гранулоцитів (туморнекротизуючий фактор).
Молекули, що беруть участь в імунній відповіді і є продуктами імунної відповіді
Система комплементу - це комплекс розчинних білків і білків клітинної поверхні, взаємодія яких опосередкує різні біологічні ефекти: руйнування (лізис) клітин, залучення лейкоцитів в осередок інфекції або запалення (хемотаксис), полегшення фагоцитозу (опсонізація), стимуляція запалення і реакцій гіперчутливості (анафілатоксини). Велика частина компонентів комплементу синтезується гепатоцитами і мононуклеарними фагоцитами. Компоненти комплементу циркулюють у крові в неактивній формі. Існують два взаємопов’язані шляхи активації комплементу: класичний і альтернативний. Каскадну активацію комплементу запускають імунні комплекси (класичний шлях активації) або пряме розщеплювання C3 (альтернативний шлях активації).
Класичний шлях починається зв’язуванням з комплексом антиген-антитіло (IgG або IgM) компоненту С1, який при цьому активується і набуває здатності розщеплювати С4 на С4а і C4b, а C2 на C2a і C2b. При цьому утворюється комплекс C4bC2a, який виконує функції СЗ-конвертази і розщеплює С3 на C3a і C3b. Після цього С3b приєднується до комплексу, який набуває складу: C4bC2aC3b. Цей комплекс функціонує як С5-конвертаза, розщеплюючи С5 на C5a і C5b. Фракція С5Ь може самостійно прикріплятися до клітинної мембрани і створювати ядро для формування мембраноатакуючого (літичного) комплексу. З С5b на мембрані послідовно зв’язуються С6, С7, С8, С9. Компонент С9 за структурою і властивостями нагадує білок - перфорін - цитотоксин природних кілерів і цитотоксичних лімфоцитів.
Альтернативний шлях починається з фракції С3Ь, яка присутня в сироватці в низькій концентрації. Чинник В зв’язується з C3b, утворюючи комплекс C3bB, який служить субстратом для чинника D. Під впливом чинника D чинник В у цьому комплексі розщеплюється на Ba і Bb, причому в складі комплексу залишається Bb. Цей комплекс має протеолітичну дію на С3, який розщеплюється на C3a і C3b. Комплекс C3bBb дуже нестабільний і для збереження активності комплексується ще з білком сироватки крові під назвою пропердин. Цей комплекс ефективно стабілізують полісахариди, гліколіпіди, глікопротеїни поверхні мікроорганізмів. При цьому комплекс зв’язується з мікробною поверхнею і каталізує продукцію великих кількостей C3b. Комплекс, що надалі утворився, набуває властивостей С5-конвертази і запускає формування літичного комплексу.
При активації комплементу утворюються:
1) медіатори запалення;
2) опсоніни, що зв’язуються з клітинами-мішенями і полегшують їх фагоцитоз;
3) мембраноатакуючий комплекс, що руйнує клітини-мішені.
Адгезійні молекули. Рух лейкоцитів у вогнище запалення або інфекції починається з серії адгезійних подій, кожна з яких стосується лейкоцитів певного типу: нейтрофілів, моноцитів або лімфоцитів. Циркулюючі лейкоцити зазвичай вступають лише в швидкоплинні контакти з ендотеліальними клітинами посткапілярних венул: лейкоцити немов "ковзають" по поверхні ендотелію судинної стінки. Ця фаза забезпечується взаємодією спочатку Р-, а потім L- і E-селектинів з вуглеводними компонентами мембран клітин. L-селектин експресований на більшості лейкоцитів. Р-селектин ендотеліальних клітин опосередкує адгезію нейтрофілів і моноцитів до ендотелію. Е-селектин експресується на активованих ендотеліальних клітинах і підтримує адгезію лімфоцитів.
Фаза ковзання відбувається без активації лейкоцитів, проте ковзаючі лейкоцити при контактах з поверхнею ендотелію отримують сигнали активації, що веде до їх іммобілізації. Наступає друга фаза міцної адгезії, опосередкована посиленням здатності лейкоцитарних інтегрінів зв’язуватися з лігандами з суперсімейства імуноглобулінів на ендотеліальних клітинах. Сигналами активації можуть служити цитокіни (хемокіни): макрофагальний запальний протеїн (MIP-ß), макрофагальний хемоаттрактантний протеїн (MCP-1), інтерлейкін 8 (IL-8), міграцію-інгибуючий чинник (MIF), тромбоцитактивуючий чинник (PAF), С5а- фракції комплементу, які здатні зв’язуватися з глюкозамінгліканами поверхні ендотеліальних клітин і діяти на "ковзаючі" лейкоцити.
Цитокіни
Цитокіни є продуктами імунокомпетентних клітин, і в той же час імунокомпетентні клітини служать мішенями дії цитокинів. Основні механізми дії цитокінів можна розділити на: ростові чинники, що контролюють продукцію імунокомпетентних клітин; прозапальні цитокіни, що забезпечують мобілізацію і активацію клітин - учасників запалення; протизапальні цитокіни з альтернативним характером дії, що обмежують розвиток запалення; цитокіни, що регулюють клітинну і гуморальну імунну відповідь; цитокіни, що мають власні ефекторні функції (противірусні, цитотоксичні).
Прозапальні цитокіни
Інтерлейкін 1 (IL-1). Продукується макрофагальними клітинами. Відомий раніше як ендогенний піроген. ІЛ-1 сприяє тому, що Т-лімфоцити-хелпери починають продукувати ІЛ-2. Під назвою інтерлейкін 1 (IL-1) об’єднано два поліпептиди: IL-1a і IL-1ß, що мають широкий спектр прозапальної, метаболічної, фізіологічної, гемопоетичної та імунологічної активності. Як правило, клітини організму не здатні до спонтанного синтезу IL-1, а відповідають його продукцією на інфекцію, дію мікробних токсинів, запальних агентів, інших цитокінів, активованих компонентів комплементу або системи згортання крові.
Інтерлейкін 2 (IL-2) відомий як фактор росту лімфоцитів, тобто білок, що сприяє проліферації лімфоцитів. Продукується Th1.
Інтерлейкін 3 (IL-3) продукується активованими Т-клітинами і має здатність посилювати проліферацію всіх гемопоетичних клітин.
Інтерлейкін 5 (IL-5) - еозинофільний фактор. Сприяє активації еозинофілів і подовжує термін їхньої персистенції у вогнищах еозинофільного запалення.
Інтерлейкін 6 (IL-6) є мультифункціональним цитокіном, який продукують як лімфоїдні, так і нелімфоїдні клітини і який регулює імунну відповідь, гострофазну запальну відповідь і гемопоез. Рецептори для IL-6 виявляються і на лімфоїдних, і на нелімфоїдних клітинах. Однією з основних функцій IL-6 є регуляція процесів дозрівання антитіл-продукуючих клітин з В-лімфоцитів і самої продукції імуноглобулінів. IL-6 бере участь також в активації Т-лімфоцитів.
Інтерлейкін 8 (IL-8) продукують моноцити, макрофаги й інші клітини: нейтрофіли, Т-лімфоцити, природні кілери, ендотеліальні клітини, фібробласти, хондроцити, кератиноцити.
Інтерлейкін 10 (IL-10) - супресорний інтерлейкін, продукується так само, як ІЛ-4 і ГЛ-5, Th2. Є цитокіном, який пригнічує функціонування Th1.
Інтерлейкін 12 (IL-12) продукують моноцити, макрофаги, а також дендритні клітини, нейтрофіли, активовані лімфоцити. Індукторами синтезу цитокіну служать мікробні компоненти і продукти. Останніми роками було показано, що IL-12 є ключовим цитокіном для посилення клітинно-опосередко- ваної імунної відповіді та ініціації ефективного захисту проти вірусів, бактерій, грибків і простіших.
Фактор некрозу пухлини-альфа (TNF-a), він же кахектин - поліпептидний цитокін, що виконує регуляторні та ефекторні функції в імунній відповіді і запаленні. Основні продуценти TNF-a - моноцити і макрофаги, але є інші продуценти: лімфоцити крові, природні кілери, гранулоцити крові, Т-лімфоцитарні клітинні лінії. Головними індукторами синтезу TNF-a вважаються бактерійний ліпополісахарид та інші компоненти мікроорганізмів. Крім того, роль індукторів можуть узяти на себе інші цитокіни: IL1, IL2, інтерферон-a/ß, GM-CSF. Значно менші кількості TNF-a можуть продукувати деякі пухлинні клітки у відповідь на різні стимули.
Інтерферон-гамма (INP-y). Найважливішим прозапальним цитокіном є інтерферон-гамма (INP-y), який продукується активованими Т-лімфоцитами і активованими природними кілерами (NK). Продукція INP-y Т-лімфоцитами запускається при розпізнаванні комплексу антигенного пептиду з власними молекулами гістосумісності (МНС І або ІІ класів) і регулюється іншими цитокінами: типовим стимулятором IL-2 і типовим інгібітором IL-10.
Протизапальні цитокіни
Інтерлейкін 4 (IL-4) продукується Т-хелперами 2-го типу (Th2). Крім того, обмежена здатність до вироблення IL-4 була виявлена у опасистих клітин, базофілів, В-лімфоцитів і стромальних клітин кісткового мозку. Основна функція IL-4 - це контроль проліферації, диференціації та функцій В-лімфоцитів, тобто антитільної відповіді. IL-4 може активувати і Т-лімфоцити, що задіяні у алергічній реакції клітинного типу. IL-4 переключає продукцію IgM на продукцію IgG4 або IgE. Таким чином, підвищене вироблення ІЛ-4 сприяє, в свою чергу, підвищеній продукції IgE.
Інтерлейкін 13 (IL-13). Цей цитокін є продуктом активованих Т-лімфоцитів: як CD4+, так і CD8+. Серед CD4+ Т-лімфоцитів цей цитокін продукують і Th1, і Th2. За біологічною активностю IL-13 має багато загального з IL-4 в тому, що стосується дії на В-лімфоцити і моноцити, макрофаги.
Трансформуючий ростовий чинник-ß (TGF-ß1) - плеотропний і мультифункціональний цитокін, продукується багатьма клітинами, включаючи моноцити, макрофаги, активовані Т- і В-лімфоцити та ендотеліальні клітини.
Імуноглобуліни
Імуноглобуліни (антитіла). Продуктами гуморальної імунної відповіді є специфічні антитіла - імуноглобуліни.
У сироватці здорової людини близько 65% загального білка складає альбумін, а решта білка - імуноглобуліни (Ig). Це великі, складної будови молекули глікопротеїнів, що складаються з важких і легких поліпептидних ланцюгів.
Біологічні властивості імуноглобулінів. Молекула імуноглобуліну (антитіла) виконує два типи функцій: скріплення антигену на основі специфічного розпізнавання епітопа антигена паратопом антитіла і ефекторні функції. Розпізнавання і скріплення антигенних епітопів є функцією варіабельних ділянок імуноглобуліна, а ефекторні функції визначаються константною ділянкою. Скріплення антигена приводить до конформаційних змін в константній ділянці, які відбиваються на ефекторних функціях антитіл: зв’язуванні комплементу, взаємодії з FCR, експресії аллоантигенів та ін.
Фізичні, антигенні і функціональні відмінності між константними ділянками визначають 5 основних класів важких ланцюгів - М, G, А, Е і D і відповідні їм 5 класів імуноглобулінів. У більшості вищих біологічних видів присутні антитіла всіх 5 класів.
IgM. У процесі еволюції антитіла класу IgM з’явилися першими. Вони ж першими синтезуються у відповідь на первинну антигенну стимуляцію, тобто IgM є маркерами первинної імунної відповіді. Оскільки вони мають пентамерну структуру з 10 активними центрами, то вони ефективні в скріпленні і аглютинації мікроорганізмів. Секретуються В-лімфоцитами на 4-5-ту добу після стимуляції антигеном.
IgG - антитіла класу IgG, при імунній відповіді з’являються в сироватці услід за IgM. Мають здатність активно зв’язуватися своєю Fc-ділянкою з Clq і рецепторами фагоцитів. Поступають у позасудинні простори і (через плаценту) до плоду. Більшість біологічних видів мають декілька підкласів IgG. IgG синтезуються зрілими T-лімфоцитами в результаті специфічної адаптивної імунної відповіді, з’являються у крові через 14-16 днів з моменту антигенної стимуляції і досягають максимуму на 21-24-й день.
IgA - основні антитіла, що містяться в секреті, в легенях, кишечнику, сечі. Мають додаткову структуру - секреторний компонент, що оберігає молекулу антитіла від розщеплювання. Основна функція IgA - запобігати проникненню антигенів із зовнішніх поверхонь у тканини.
IgE здатні через Fc-фрагмент зв’язуватися з опасистими клітинами і стимулювати їх дегрануляцію.
IgD діють на поверхні В-клітин, виконуючи регулюючі функції.
Неспецифічний (уроджений імунітет)
При необхідності захистити організм, наприклад, при попаданні в нього інфекційного збудника, в першу чергу вступають чинники уродженого (природного) імунітету.
Уроджений неспецифічний (природний) імунітет - це, перш за все, механічні бар’єри і фізіологічні чинники, які перешкоджають проникненню інфекційних агентів в організм.
Природні бар’єри - чинники природної резистентності організму, перешкоджають проникненню в організм збудників захворювань. До головних природних бар’єрів в організмі людини належать:
1. Шкіра і слизові оболонки (включаючи продуковані ними екзосекрети).
2. Гістогематичні (гемато-енцефалічний, плацентарний) та гістолімфатичні бар’єри, включаючи дренажну функцію лімфатичних вузлів. Стримувальна роль - перешкоджання гематогенному проникненню збудника у тканини у випадках бактеріємії при сепсисі; захист від агресії імунної системи "забар’єрних" органів - головного мозку, щитовидної залози, яєчка, ока, комплексу "плацента-плід".
3. Целюлярний бар’єр, який забезпечується оболонками клітин.
4. Ядерний бар’єр, який захищає генетичну інформацію клітин.
5. Фільтрувальна здатність печінки, селезінки і лімфатичних вузлів.
Хімічні фактори стримування розмноження патогенної флори:
1. Низька рН шлункового соку.
2. Органічні і жирні кислоти, які містяться у секреті потових і сальних залоз, згубно діють на більшість патогенних бактерій і грибків. Секрет залоз ще й протидіє прикріпленню мікроорганізмів до клітин епітелію та зумовлює їх механічне змивання.
3. Деполімерази нуклеїнових кислот (ДНК-ази, РНК-ази), здатні захистити генетичну інформацію шляхом руйнування чужих, у першу чергу вірусних нуклеїнових кислот.
До неспецифічних чинників резистентності можна віднести такі фізіологічні функції, як чхання, блювота, пронос, які також сприяють елімінації патогенних агентів з організму. Сюди ж слід віднести такі фізіологічні чинники, як температура тіла, концентрація кисню, гормональний баланс. Наприклад, збільшення продукції кортикостероїдів пригнічує запальні процеси і знижує резистентність організму до інфекції. Відомо, наприклад, що при автоімунних захворюваннях або кризі відторгнення пересаджених органів під впливом лікування великими дозами кортикостероїдів у пацієнтів розвивається підвищена чутливість до інфекційних агентів.
Наступним компонентом (ланкою) природженого імунітету є клітинний, який включає мононуклеарні фагоцити (моноцити, тканинні макрофаги), гранулоцити - нейтрофіли, еозинофіли, базофіли (периферичної крові і тканинні, або опасисті клітини), а також кілерні клітини - природні (NK-клітини), просто кілерні (K-) і лімфокінактивовані кілерні клітини (ЛАК-клітини).
Моноцити периферичної крові і тканинні макрофаги походять з поліпотентної стовбурової клітини. Потрапивши в кров’яне русло, моноцити протягом 2-3 діб розселяються в тканини, де вони перетворюються на тканинні макрофаги.
Основною функцією тканинних макрофагів і одночасно надзвичайно важливим механізмом уродженого імунітету є фагоцитоз.
Фагоцитоз - процес поглинання чужорідного матеріалу, пошкоджених клітин, їх руйнування і виведення з організму. Найбільш інформативними показниками фагоцитозу в імунограмі є фагоцитарне число (Фч) та відсоток фагоцитозу (Фп).
Процес завершеного фагоцитозу включає декілька етапів: 1) активацію клітини, що фагоцитує; 2) хемотаксис, тобто її просування у напрямку до об’єкту, який викликав її активацію; 3) прикріплення до даного об’єкту (адгезія); 4) власне заковтування цього об’єкту; 5) переварювання, або процесінг, поглиненого об’єкту.
При незавершеному фагоцитозі не відбувається переварювання мікроорганізмів усередині фагоциту. При цьому фагоцитовані мікроорганізми виживають і можуть тривалий час залишатися у вторинних лізосомах.
При завершеному фагоцитозі після достатньо тісного прикріплення (адгезії) клітини, що фагоцитує, до клітини-мішені вона поглинає об’єкт фагоцитозу. При цьому утворюється так звана фагосома, або фагоцитарна вакуоль, яка формується за рахунок мембрани клітини, що фагоцитує, навколо частинки, що поглинається. Така фагосома просувається всередині цитоплазми клітини у напрямку до лізосоми, і мембрани цих двох вакуолей зливаються в одну вакуоль - фаголізосому. Після утворення фаголізосоми починається процес переварювання поглиненого чужорідного матеріалу. Вміст лізосомальних гранул дуже важливий для руйнування поглиненого матеріалу і знищення мікроорганізмів. Лізосомальні гранули бувають двох типів: а) первинні, які містять багато гідролітичних ферментів, мієлопероксидазу, лізоцим і катіонні білки; б) вторинні (специфічні), яких більше, ніж первинних, і які містять лужну фосфатазу, лактоферин і лізоцим.
Вміст первинних і вторинних гранул при руйнуванні клітин-фагоцитів може потрапляти в інтерстиціальний (проміжний) простір. Цей процес називається екзоцитозом, він характеризується пошкодженням тканин і запаленням.
Речовиною, яка підсилює фагоцитоз за рахунок опсонізації, є фібронектин - глікопротеїн, який зв’язується з мікроорганізмами і до якого на поверхні нейтрофілів і макрофагів є рецептор, за рахунок чого відбувається скріплення мікроорганізмів, оброблених фібронектином.
Велике значення в механізмі природного імунітету мають кілерні клітини. До них відносяться натуральні кілерні (NK-клітини), просто кілерні (K-клітини) і лімфокінактивовані кілерні (ЛАК-клітини).
Загальною особливістю NK- і K-клітин є здатність розчиняти клітини-мішені без попередньої сенсибілізації, що відрізняє їх від цитотоксичних Т-лімфоцитів-кілерів. Морфологічно природні килерні клітини великого розміру, з азурофільною зернистістю і низькою щільністю, на підставі чого їх відносять до великих гранулярних лімфоцитів.
NK-клітини. Клітинами-мішенями для NK-клітин є практично всі клітини, що містять ядро, проте найбільшу активність NK-клітини проявляють по відношенню до пухлинних і уражених вірусом клітин. Оскільки для руйнування клітин-мішеней NK-клітинам не потрібна участь антитіл і присутність комплементу, то цей тип цитолізу отримав назву спонтанної клітинно- опосередкованої цитотоксичності.
Роль NK-клітин в організмі полягає в захисті від розвитку пухлин, інфекційних захворювань, що, по суті, є функцією імунного нагляду.
Кілерні К-клітини несуть на своїй поверхні рецептори до Fc-фрагменту IgG і здатні до антитілозалежної клітинно-опосередкованої цитотоксичності. К-клітини беруть участь у розвитку автоімунних захворювань - системного червоного вовчака, гломерулонефриту, хронічного гепатиту. К-клітини хворих на хронічний гепатит мають здатність знищувати ізольовані гепатоцити. Встановлена важлива роль К-клітин при сальмонельозі, дизентерії, онкологічних захворюваннях і в реакції відторгнення трансплантату. Ці дані лягли в основу виділення особливого типу імунологічних реакцій, опосередкованих антитілами і К-клітинами.
Система неспецифічного захисту діє перед першим бар’єром (неспецифічні секреторні імуноглобуліни, лізоцим) та між першим і другим бар’єрами (система комплементу, лізоцим, еозинофільна, К- і NK-цитотоксичність, фагоцитоз).
Регуляція діяльності імунної системи
Основна функція зрілих Т-лімфоцитів - це розпізнавання чужорідних антигенних пептидів у комплексі з власними антигенами тканинної сумісності на поверхні допоміжних (антиген-презентуючих) клітин або поверхні будь-яких клітин-мішеней організму. Для виконання цієї функції Т-лімфоцити повинні бути здатні розпізнавати власні антигени тканинної сумісності, специфічні для кожного індивідуума. Одночасно Т-лімфоцити не повинні розпізнавати автоантигенні пептиди самого організму, пов’язані з власними антигенами тканинної сумісності. Проте в процесі перебудови (реаранжировки) генів дозріваючих тимоцитів деякі з них набувають рецептори Т-клітин (РТК), специфічні саме відносно антигенних пептидів самого організму, тобто автоантигенних пептидів. У зв’язку з цим у тимусі одночасно з процесами проліферації і дозрівання тимоцитів йдуть процеси їх селекції - відбору потрібних Т-лімфоцитів.
Селекція тимоцитів проходить у два етапи. Після того як на індивідуальному тимоциті експресується РТК його унікальної специфічності, клітина вступає в етап позитивної селекції. Для того щоб вижити і вступити в наступні етапи розвитку, тимоцит повинен проявити здатність розпізнавати власні антигени тканинної сумісності, що експресовані на епітеліальних клітинах кори тимусу. Існують сотні різних варіантів антигенів тканинної сумісності, з яких лише мала частина експресована на клітинах даного індивіда. З щонайширшого "репертуару" специфічностей РТК лише небагато які підійдуть для розпізнавання індивідуального набору антигенів тканинної сумісності даного організму. Тимоцити з такими відповідними РТК отримують сигнал подальшого диференціювання. Вони відібрані на етапі позитивної селекції і вступають у наступний етап.
На межі кіркового і мозкового шарів тимуса дозріваючі тимоцити зустрічаються з дендритними клітинами і макрофагами. Функція цих клітин - презентація антигенних пептидів у комплексі з власними антигенами тканинної сумісності для розпізнавання Т-лімфоцитами. У даному випадку ці клітини представляють пептиди самого організму - фрагменти автоантигенів, які можуть заноситися в тимус з током крові. На відміну від зрілого Т-лімфоцита, який при зустрічі з антигенним пептидом, специфічним для його РТК, отримує сигнал активації, незрілі тимоцити в тимусі при розпізнаванні специфічних для їх РТК антигенних пептидів отримують сигнал генетично запрограмованої смерті - апоптозу. Таким чином йде негативна селекція автореактивних Т-лімфоцитів.
У результаті позитивної і негативної селекції з тимуса в кровотік і лімфоїдні органи поступають тільки такі Т-лімфоцити, які несуть РТК, здатні розпізнавати власні молекули тканинної сумісності в комплексі з пептидними фрагментами чужорідних білків і нездатні розпізнавати їх в комплексі з автоантигенними пептидами.
Апоптоз лежить в основі таких важливих процесів, як позитивна і негативна селекція Т- і селекція В-лімфоцитів, загибель лімфоцитів, що індукується глюкокортикоїдами, загибель клітин, що викликана опромінюванням, нагрівом або відсутністю специфічних ростових чинників. Імунодефіцит при ВІЛ-інфекції визначається порушеннями в контролі апоптозу. Цитотоксичні лімфоцити і антитіла до деяких поверхневих антигенів індукують апоптоз у клітинах-мішенях.
Центральним механізмом розвитку імунної відповіді є генетичне обмеження, яке полягає в тому, що для природної взаємодії клітин в імунній відповіді необхідна наявність на їх мембранах антигенів головного комплексу гістосумісності (МНС) даного генотипу ("своїх").
Молекули MHC I класу присутні на всіх клітинах організму, в тому числі на CD8+ T-лімфоцитах - цитотоксичних (перфорин-гранзимових) T-кілерах і Т-супресорах, де вони утворюють комплекс з вірусними антигенами, пухлинними, ендогенними та дефектними власними антигенами, синтезованими своїми ж клітинами. Завдяки їх наявності CD8+ T-лімфоцити здатні відрізняти клітини власного організму від чужорідних, модифікованих вірусною інфекцією, або тих, що піддалися пухлинній трансформації. Синтез цих молекул детермінований генами головного комплексу гістосумісності, локалізованими в 6-й хромосомі клітин організму.
Цитотоксичні T-лімфоцити (CD8+ кілери) знищують клітини, що несуть чужорідні антигени в комплексі з MHC I класу. Зв’язуючись з поверхнею цих клітин, вони виділяють цитотоксини (перфорин і гранзими), які викликають цитоліз даних клітин, при цьому самі Т-кілери залишаються життєздатними.
Т-супресори, навпаки, запобігають імунній відповіді проти нормальних клітин, виділяючи чинники, що пригноблюють функції Т- і В-клітин.
Молекули MHC II класу розташовані на мембранах антиген-презентуючих клітин - дендритних клітинах, активованих макрофагах, В-лімфоцитах і T-хелперах 1-го та 2-го класів, епітелію тимусу. Молекули MHC II класу представляють Т-хелперам екзогенні пептиди-антигени. Цей процес називають "презентацією" (розпізнаванням) антигена. Зазвичай він здійснюється молекулами MHC II класу - HLA-DR-макрофагів, дендритних та інших антиген-презентуючих клітин (АПК). Комплекс MHC II класу - імун-асоційований антиген розпізнають специфічними до нього рецепторами CD4+ T-хелпери і починають імунну відповідь.
Якщо антиген-презентуюча клітина або будь-яка інша клітина, що має антигени MHC, відрізнятиметься за генотипом від рецепторів до MHC, що знаходяться на поверхні цитотоксичних T-лімфоцитів CD8+ кілерів) та T-хелперів CD4+, то імунна відповідь розвиватиметься на антигени MHC I і II класу даної клітини. Цей феномен генетичної рестрикції лежить в основі розпізнавання "свого і чужого", а у результаті запускає елімінацію чужорідного.
Молекули, що несуть характерні для антиген-розпізнаючих клітин (2D8+ цитотоксичних T-лімфоцитів та Т-супресорів, СD4+ Т-хелперів) ознаки клітин "хазяїна", були вперше виявлені в лейкоцитах (фагоцитах) і отримали назву молекули HLA I і II класу (від англ. human leucocyte antigen). У подальшому дані молекули (антигени) були знайдені у всіх клітинах організму і перейменовані в молекули MHC I і II класу.
Молекулами MHC III класу є комплемент.
Нейро-ендокринно-імунна вісь. Зміна активності імунної системи викликає зміни в нейро-ендокринній системі. Наприклад, деякі медіатори, що синтезуються в ній у відповідь на проникнення антигену, впливають на продукування кортикостероїдів. У той же час, характер імунної відповіді безпосередньо залежить від гормонів тимусу, контролюючих "поведінку" Т-лімфоцитів. Опосередкований вплив нейро-ендокринної системи наочно виявляється при так званій холодовій алергії, коли дію на регуляторний центр гіпоталамуса обумовлює зрушення в синтезі гормонів, що і стимулює розвиток алергічної реакції.
Етапи формування імунної відповіді
Імунна відповідь починається з розпізнавання чужорідного антигена, тобто його зв’язування із специфічним рецептором на мембрані зрілого лімфоцита. Такі специфічні рецептори існують на мембранах лімфоцитів до зустрічі з антигеном.
До антигенів слід віднести речовини, що мають дві властивості: 1) імуногенність - здатність індукувати специфічну імунну відповідь внаслідок чого продукуються антитіла або імунні лімфоцити; 2) антигенність - здатність специфічно реагувати з антитілами або клітинами, які продукувалися на введення даного антигену. Імуногенні речовини завжди є антигенами, тоді як антигени не завжди здатні бути імуногенами.
Антигени, що не мають імуногенності, носять назву гаптенів. Гаптен сам по собі не здатний індукувати розвиток імунної відповіді, продукцію імунних лімфоцитів або антитіл, але він здатний з ними реагувати. Крім того, гаптен, що є молекулою з малою молекулярною масою, за рахунок невеликих розмірів не здатний викликати імунну відповідь, проте, при з’єднанні з великою білковою молекулою (яка в даному випадку називається носієм), набуває імуногенних властивостей. Носіями таких молекул можуть бути альбумін, глобуліни або синтетичні пептиди.
Епітоп, або антигенна детермінанта - це місце на антигені або усередині нього, яке специфічно реагує з антитілом. Таким чином, епітоп визначає специфічність молекули та індукує антитільну відповідь. Зазвичай епітопи надзвичайно малі і складають 4-5 амінокислотних або моносахаридних залишків. Антигени мультивалентні, тобто мають, як правило, велику кількість епітопів, до кожного з яких в організмі продукуються свої специфічні антитіла.
Величезну їх різноманітність забезпечує широкий спектр клонів лімфоцитів і можливість розпізнати будь-який чужорідний антиген. Специфічне розпізнавання і скріплення антигена з антиген-розпізнаючим рецептором спричиняє активацію лімфоциту, яка проявляється його посиленою проліферацією (клональною експансією), тобто накопиченням клону антигенспецифічних лімфоцитів, і подальшим диференціюванням лімфоцитів з надбанням ними ефекторних функцій. Результатом ефекторної фази імунної відповіді є елімінація антигена за участю активованих лімфоцитів, їх продуктів, а також інших клітин і механізмів неспецифічного захисту, що залучаються лімфоцитами в специфічну імунну відповідь: клітин, що фагоцитують, NK-клітин, системи комплементу.
Лімфоїдна система здійснює два види специфічної імунної відповіді: гуморальна - синтез антитіл і клітинна - реакції гіперчутливості сповільненого типу, трансплантаційний імунітет і автоімунні реакції, що здійснюються механізмами як гуморального, так і клітинного імунітету. Вважають, що призначення гуморального імунітету - звільняти організм переважно від чужорідних в антигенному відношенні екзогенних речовин, а клітинного - елімінація автоантигенів, якими можуть з’явитися власні клітини, що мутують, і денатуровані.
Для здійснення реакцій гуморального імунітету необхідна кооперація декількох паралельно і послідовно проліферуючих видів лімфоїдних клітин, що диференціюються та розпізнають і реагують на антиген клітин-ефекторів і допоміжних клітин, сприяючих розпізнаванню і обробці антигена, проліферації і диференціюванню клонів - макрофагів, дендритних клітин, клітин-хелперів.
Реалізація імунної відповіді здійснюється в різних морфологічних мікроструктурах лімфоїдних органів, де є умови для певних просторових взаємин тимусзалежних і тимуснезалежних лімфоцитів, для фагоцитозу антигенів, їх концентрації, контакту антигена з клітинними елементами, для розмноження, диференціювання і кооперації клітин, що беруть участь в імунній відповіді. Цими структурними одиницями в лімфовузлах і селезінці є краєві синуси, синуси і тяжі мозкової речовини, паракортикальна зона, лімфоїдні фолікули, зародкові центри, артеріолярні гільзи центральних артерій білої пульпи селезінки, плазмоклітинні острівці. При антигенному стимулі в цих структурах відбуваються характерні морфологічні зміни.
Етапи імунної відповіді:
1. Представлення антигена (антиген-презентація). Якщо антиген корпускулярний (мікроб або інша частинка), то він захоплюється макрофагами і перетравлюється у фагосомі. Невеликі пептиди знову експресуються на мембрані в комплексі з HLA-DR антигеном II класу і представляються Т-хелперам (I сигнал). Одночасно макрофаг активується і виділяє IL-1 та інші цитокіни, що активують Т-хелпери (II сигнал). Макрофаги, що стимулюються бактеріями, виділяють IL-12, що підсилює диференціювання T-хелперів в Th1. Якщо антиген представляють В-лімфоцити, то виникають Th2.
2. Індуктивна фаза. Th1, і/або Th2, отримавши 2 сигнали від макрофагів, виділяють відповідний набір цитокінів, які стимулюють проліферацію Т-лімфоцитів, а також В-лімфоцитів. Причому активуються В-лімфоцити, що мають мономірний IgM як рецептор, який відповідає цьому антигену, тобто наступає селекція і виборча стимуляція В-лімфоцитів.
3. Ефекторна стадія. В-лімфоцити перетворюються на плазматичні клітини, що синтезують антитіла, специфічність яких збільшується у нащадків клітин, що діляться (феномен наростання афінітету B-лімфоцитів). Паралельно виникають антигенспецифічні Т-ефектори, що несуть на своїй поверхні антигенспецифічні Т-клітинні рецептори (ТКР). У результаті під впливом антигенів в організмі утворюються антитіла та імунні Т-клітини (T-кілери).
Одночасно з розвитком імунної відповіді стимулюються механізми і клітини- супресори, що її гальмують. Тому через певний час у нормі імунна реакція затихає. В організмі залишається імунологічна пам’ять: Т- і В-клітини пам’яті.
У разі первинного контакту імунокомпетентних клітин з антигеном розвивається первинна імунна відповідь. У часовому вираженні первинна імунна відповідь має стадійність свого розвитку:
I стадія займає 3-4 доби, антитіла до відповідного антигена в сироватці ще відсутні.
II стадія - через 10-14 діб після контакту з антигеном у сироватці крові з’являються IgM і IgG.
III стадія - рівень антитіл залишається постійним.
IV стадія займає місяці і характеризується поступовим зниженням рівня антитіл.
Вторинна імунна відповідь розвивається при повторному контакті з антигеном, при цьому утворюються імуноглобуліни класу G. Антитіла, головним чином IgG, з’являються швидше і у вищому титрі, ніж при первинній імунній відповіді.
Специфічний імунітет
Набутий специфічний (адаптивний) імунітет реалізується лімфоцитами, і його також можна розділити на два компоненти (ланки): клітинний і гуморальний.
Розрізняють дві основні форми специфічної імунної відповіді: гуморальна та клітинна.
Іуморальна імунна відповідь здійснює продукцію специфічних антитіл у відповідь на дію чужорідного антигену. Основну роль у реалізації гуморальної відповіді грають В-лімфоцити, які під впливом антигенного стимулу диференціюються в антитілопродуценти. Проте В-лімфоцити, як правило, потребують допомоги Т-хелперів і антиген-презентуючих клітин.
При розвитку гуморальної відповіді В-лімфоцит може отримати мікробний пептид різними шляхами:
- отримання розчинного антигену з навколишньої мікросфери. Пептид не вимагає додаткової обробки, оскільки це вже зроблено іншою клітиною. Відбувається селекція антигеном В-лімфоцита (В-лімфоцитів), що має передіснуючі у-глобулінові рецептори на своїй поверхні, найбільш специфічні до даного антигена;
- отримання розчинного антигена за допомогою у-глобулінового рецептору, його подальший процесинг усередині В-лімфоцита і появлення на мембрані В-лімфоцита в комплексі з MHC II класу;
- отримання антигена з поверхні макрофага. Селекція В-лімфоцитів по у-рецепторах. Процесинг антигена у В-лімфоцитах і його представлення Т-лімфоцитам.
MHC II класу макрофага презентує антиген Т-хелперу (CD4). Під впливом IL-4, що продукується нейтрофілами, опасистими клітинами, базофілами, еозинофілами, Т-хелпер трансформується в Т-хелпер 2-го класу, що індукує гуморальний тип імунної відповіді. Найважливішими з інтерлейкінів, що продукуються цими лімфоцитами, є IL-4, 5, 6, 10, що різко стимулюють проліферацію обраних у результаті селекції В-лімфоцитів. Синтезовані трансформованими В-лімфоцитами (плазмоцитами) антитіла специфічні до даного антигена. Гуморальний тип відповіді найбільш важливий відносно позаклітинно розташованих мікробів. Антитіла підсилюють їх поглинання і переварювання фагоцитами.
Особливості специфічного імунітету полягають у тому, що Т- і В- лімфоцити забезпечені спеціальними інструментами - розпізнаючими антиген-рецепторами (MHC I та II класів), за допомогою яких здійснюється процес розпізнавання антигена, диференціювання (відокремлювання) свого (self) від чужого (non-self). Потім, за необхідності, включаються механізми продукції антитіл - імуноглобулінів або Т-лімфоцитів-кілерів, специфічних по відношенню до антигенів, що викликали їх утворення.
Особливою формою специфічної імунної відповіді на контакт імунної системи з чужорідним антигеном є формування імунологічної пам’яті, яка формується у міру стихання імунної реакції. Імунологічна пам’ять полягає в здатності організму відповідати на повторну зустріч з тим же антигеном так званою вторинною імунною відповіддю - швидшою і сильнішою.
Ця форма імунної відповіді пов’язана з накопиченням клону довгоживучих клітин пам’яті, здатних розпізнати антиген і відповісти прискорено і посилено на повторний контакт з ним.
Альтернативною формою специфічної імунної відповіді є формування імунологічної толерантності, тобто відсутність відповіді на власні антигени організму (автоантигени). Така толерантність отримується організмом у період внутрішньоутробного розвитку, коли функціонально незрілі лімфоцити, потенційно здатні розпізнавати власні антигени, в тимусі вступають в контакт з цими антигенами, що приводить до їх загибелі або інактивації (негативна селекція).
Клітинна (клітинно-опосередкована) імунна відповідь здійснюється шляхом накопичення в організмі клону Т-лімфоцитів, що несуть специфічні для даного антигену антиген-розпізнаваючі рецептори і відповідають за клітинні реакції імунного запалення, гіперчутливості сповільненого типу, в яких окрім Т-лімфоцитів беруть участь макрофаги.
Особливості клітинної імунної відповіді полягають у наступному:
- пусковою ланкою у формуванні клітинного типу імунної відповіді є продукція макрофагом, усередині якого йде процесинг антигена, інтерлейкіну IL-12;
- на мембрані зрілих Т-лімфоцитів є антиген-розпізнаючий рецептор з антигенною специфічністю, не залежною від того, зустрічався раніше організм з даним антигеном чи ні;
- зустріч Т-лімфоцита з антигеном включає етап антигензалежного диференціювання Т-лімфоцита (на відміну від антигеннезалежного, який пройшов у тимусі);
- розпізнавання специфічного антигена призводить до активації Т-лімфоцита і подальшої його проліферації, що закінчується появою в організмі великої кількості (клону) Т-лімфоцитів певної специфічності, здатної реалізовувати специфічну імунну відповідь.
Для розпізнавання крупної чужорідної (бактерійні та інші клітки, віруси) або автологічної структури Т-лімфоцитам необхідний проміжний етап, на якому макрофаг або інша антигенпредставляюча клітина спеціальним чином "готує" чужорідний матеріал для розпізнавання. Цей процес підготовки носить назву процесингу (переварювання) і полягає у ферментативному розщеплюванні поглиненого макрофагом чужорідного матеріалу. Окремі блоки, що утворюються в результаті процесингу, або пептиди, є амінокислотні залишки певної довжини - епітопи чужорідного антигена. Ці пептиди і здатні розпізнавати Т-лімфоцити в той момент, коли вони потрапляють на мембрану макрофага у поєднанні з молекулами головного комплексу гістосумісності (MHC) II класу.
Субпопуляція Т-лімфоцитів, що несе на своїй поверхні кластер диференціювання CD8+, відноситься до Т-кілерів / супресорів. Така подвійна назва означає, що ця субпопуляція Т-лімфоцитів може диференціюватися або в Т-кілер (цитотоксичний Т-лімфоцит), або в Т-супресор і виконувати різні функції залежно від потреб організму.
CD8+ Т-кілер - основна ефекторна клітина клітинно-опосередкованого імунітету, яка здійснює лізис мішеней, забезпечує генетичну постійність внутрішнього середовища організму. CD8+ лімфоцити виконують цитотоксичні функції, беруть участь у механізмах відторгнення аллотрансплантатів, реакціях автоімунітету, руйнують вирусінфіковані і пухлинні клітки.
У периферичній крові і у вторинних лімфоїдних органах CD8+ Т-кілер знаходиться в стані спокою, - так звана зріла клітина спокою. Для того щоб відбулося її диференціювання в зрілий Т-кілер, здатний здійснювати кілінговий ефект, необхідно, щоб CD8+ Т-клітина розпізнала чужорідний антиген своїм рецептором MHC I класу і створила клон специфічних Т-кілерів, здатних надати цитотоксичний ефект.
Для розпізнавання чужорідного антигена у CD8+ Т-клітині є Т-клітиний антигенрозпізнаючий рецептор в комплексі з СDЗ-структурою. CD8+T клітина (кілер) розпізнає не весь чужорідний антиген, а його блоки, так звані домінантні пептиди, які знаходяться на поверхні антигенпрезентуючої клітини у поєднанні з молекулами MHC I класу. За допомогою MHC I класу презентуються екзогенні пептиди, утворені з внутріклітинних паразитів, вірусів. CD8+ Т-клітина (кілер) виконує цензорну функцію, що дозволяє імунній системі здійснювати контроль за постійністю внутрішнього середовища організму.
Таким чином, MHC I класу макрофага презентує пептид (антиген) Т-хелперу (CD4). Під впливом IL-12, що продукується цим же макрофагом, Th трансформується в Th1. Після розпізнавання чужорідного пептиду CD8+ Т-клітина (кілер) повинна отримати додатковий сигнал від CD4+ клітини (хелпера), який дозволить їй ділитися, внаслідок чого з однієї клітини утворюється клон (група) клітин, що мають одну специфічність і реалізують клітинну імунну відповідь.
IFN-y є найважливішим з цитокінів, що виділяються з Th1. Він активує контакт Т-кілера CD8 з рецептором MHC I класу макрофага, на якому представлений той же антиген. Th1, що виділяє IL-2, стимулює проліферацію антигенспецифічних Т-цитотоксичних лімфоцитів (Т-кілерів).
Головною функцією Т-кілерів у протиінфекційному захисті є знищення соматичних клітин організму, усередині яких знаходиться збудник, а на поверхні - комплекс MHC I класу - антиген збудника. При прямому контакті з такою клітиною Т-кілер виділяє гранули, що містять білки - перфорин, гранзим. Перфорин вбудовується в мембрану соматичної клітки, утворює в ній канали - "пори" і може діяти як мембраноатакуючий білок. Гранзим (серінові протеінази) індукує один з варіантів апоптозу і загибель соматичної клітини разом з мікробами, що знаходяться в ній.
CD4+ Т-лімфоцити-хелпери можуть розпізнати чужорідний пептид у тому випадку, якщо він знаходиться в поверхні антигенпрезентуючих клітин у поєднанні з MHC II класу. До таких клітин відносяться моноцити-макрофаги, В-лімфоцити і дендритні клітини. Ці клітини мають здатність поглинати чужорідний матеріал, що потрапив в організм, переробляти (процесувати) його за допомогою ферментів, розрізаючи антиген на блоки-пептиди, а потім транспортувати їх з глибини клітини на поверхню у поєднанні з MHC II класу. Після цього CD4+ Т-лімфоцит-хелпер зможе розпізнати чужорідний, як правило, екзогенний, пептид, що спричиняє активацію і проліферацію CD4+ клітин з подальшим їх диференціюванням на Т-хелпери 1-го або 2-го типу, що здійснюють регуляцію імунної відповіді.
Т-хелпери 1-го типу продукують ІНФ-у, IL-2 і TNP-a. Вказані цитокіни активують макрофаги, NK-клітини, дозрівання цитотоксичних Т-кілерів, забезпечуючи переважний розвиток клітинної імунної відповіді, зокрема, при внутрішньоклітинній і вірусній інфекції. Функція T-хелперів l-го типу переважає у хворих з розсіяним склерозом, інсулінзалежним цукровим діабетом, автоімунним тиреоїдитом, при хворобі Крона, гострому відторгненні алотрансплантату, звичному невиношуванні вагітності.
Т-хелпери 2-го типу продукують IL-4, 5, 10 і 13, які відповідають за розвиток гуморальної відповіді, зокрема, за продукцію IgE. Крім того, IL-10 має пригнічуючий ефект по відношенню до T-хелперів 1-го типу. Функція T-хелперів 1-го типу переважає при нормально перебігаючій вагітності, трансплантаційній толерантності, а також при захворюваннях - ідіопатичному легеневому фіброзі, прогресуючому системному склерозі, у ВІЛ-інфікованих хворих з швидким прогресуванням захворювання і при алергічних захворюваннях.
У збереженні і підтримці антигенного гомеостазу організму беруть участь не тільки антигенспецифічні (власне, імунологічні), але і антигеннеспецифічні чинники (неспецифічна реактивність) (табл. 2).
Таблиця 2
Механізми підтримки антигенного гомеостазу
Антигенспецифічні механізми (імунологічні) |
Антигеннеспецифічні механізми (неспецифічна резистентність) |
Гуморальні фактори |
|
Імуноглобуліни (антитіла) Зрілі імунні Т-, В- лімфоцити (з антигенрозпізнаваючим рецептором) |
Компоненти комплементу (лізис і опсонізація антигена) Білки гострої фази - С-реактівний білок, церулоплазмін, гаптоглобулін (опсонізація антигена) Лізоцим (лізис грампозитивних бактерій) Інтерферони (руйнування вірусів) |
Клітинні фактори |
|
Гранулоцити (фагоцитоз) Макрофаги (фагоцитоз і представлення антигена лімфоцитам) NK-клітини (антитіло-, комплемент-залежна клітинно- опосередкована цитотоксичність) Тромбоцити (ферменти) Еритроцити (сорбція і видалення імунних комплексів з крові) Тканинні макрофаги (фагоцитоз) Ендотеліальні клітини (фагоцитоз) Опасисті клітини (анафілаксія) |
|
Реакції імунітету патологічного, "стресового рівня" призводять до розвитку патології:
■ гіперчутливості - підвищеної імунної ("імунітетної") реакції на антигени- алергени; служить причиною двох видів захворювань: алергічних - на екзогенні алергени (алергія); автоалергічних (автоімунних) - на ендогенні, власні біомолекули (автоалергія); при автоалергічних (автоімунних) хворобах "свої" молекули розпізнаються системою імунітету як "чужі" і на них розвиваються реакції;
■ анергії, тобто до відсутності реакції на інфекційні агенти (варіант толерантності); може бути причиною інфекцій, обумовленою недостатністю протиінфекційного імунітету.
Реакції імунітету завжди направлені на підтримку фенотипічного гомеостазу організму і елімінацію чужорідних молекул, але супроводжуються пошкодженням власних тканин організму - запаленням. Проте вони не є єдиним проявом функцій системи імунітету, для якої характерний постійний "фоновий" рівень активності. На фізіологічному рівні система імунітету працює безперервно, формуючи нові клітини, імуноглобуліни і цитокіни; її "фонове" фізіологічне функціонування підтримується стимуляцією постійно персистуючими на шкірі і слизових оболонках мікроорганізмами (вірусами, бактеріями, грибками). Активна взаємодія з ними, постійна їх елімінація, попередження їх генералізації, "нагляд" за ними - запорука здорового організму і показник нормальної елімінуючої функції системи імунітету.
Протиінфекційний набутий - адаптивний імунітет виникає протягом життя в результаті стимуляції клітин системи імунітету антигенами мікроорганізмів або отримання готових імунних чинників. Тому він буває природним і штучним, кожен з яких може бути активним і пасивним.
Природний активний імунітет з’являється в результаті контакту із збудником (після перенесеного захворювання або після прихованого контакту без прояву симптомів хвороби).
Природний пасивний імунітет виникає в результаті передачі від матери до плоду через плаценту (трансплацентарний) або з молоком готових захисних чинників - лімфоцитів, антитіл, цитокінів і т. п.
Штучний активний імунітет індукується після введення в організм вакцин, що містять мікроорганізми або їх субстанції - антигени.
Штучний пасивний імунітет створюється після введення в організм готових антитіл або імунних клітин. Такі антитіла містяться в сироватці крові імунізованих донорів або тварин.
Відмінності набутого імунітету:
- специфічний до певного патогену (бактерії, вірусу);
- специфічність, яка залежить від наявності імунних Т- і В-клітин пам’яті;
- посилюється при повторних контактах з патогеном;
- може супроводжуватися гіперчутливістю (алергією) до патогену;
- виникає після контакту системи імунітету з патогеном, супроводжуючись (чи ні) клінічними симптомами захворювання; може індукуватися відповідними вакцинами.
Таким чином, основними функціями імунної системи є захист організму від патогенних мікробів і протипухлинний нагляд. У виконанні цих функцій беруть участь як механізми неспецифічного захисту, так і специфічна імунна відповідь на конкретні інфекційні або пухлинні антигени. Специфічна імунна відповідь підсилює механізми неспецифічного захисту, робить їх більш цілеспрямованими.
ВІКОВА ІМУНОЛОГІЯ
Імунна система дитини
Особливості імунної системи дітей: 1) незрілість системи фагоцитозу (незавершеність фагоцитозу); 2) незрілість натуральних кілерів; 3) знижений синтез інтерферонів; 4) підвищений синтез лізоциму; 5) висока функціональна активність тимусу.
Імунна система новонародженої дитини характеризується наступними особливостями:
1. Плід синтезує власні антитіла, які, незалежно від природи антигенної стимуляції, є поліреактивними IgM. В-лімфоцити новонародженого з фенотипом CD5+ здатні до синтезу субкласів імуноглобулінів G1, і G3, але не G2 або G4, до яких належать антитіла до капсулярного полісахариду бактерій. Основну кількість IgG дитина отримує від матері трансплацентарно, починаючи з 35-го тижня гестації. При цьому IgG2 погано проникають через плацентарний бар’єр.
2. У В-клітинному репертуарі новонародженої дитини переважають незрілі В-лімфоцити. Для їх фенотипу характерний високий рівень експресії поверхневої молекули slgM і відсутність slgD, у той час як на більшості В-лімфоцитів дорослих переважають slgD і є лише незначна кількість slgM. У новонароджених зв’язок антигену з поверхневим slgM призводить до апоптозу незрілих В-лімфоцитів, оскільки він не пов’язаний з інозитолфосфоліпідним шляхом трансдукції сигналу всередину клітини.
3. В-лімфоцити новонародженого не отримують другого сигналу при кооперації з неонатальними Т-клітинами, оскільки для неонатальних Т-лімфоцитів характерний дуже низький рівень експресії СD40-ліганда (CD40L). Це знижує здатність В-лімфоцитів новонароджених до ізотопічного переключення класів імуноглобулінів, а також пригнічує здатність Т-лімфоцитів до диференціювання до Т-хелперів 1-го типу (Th 1), які мали б посилювати макрофагальні реакції.
4. Відсутність взаємодії CD40 з CD40L може призводити до переважно невідповідного подання антигенів В-клітинами Т-лімфоцитам у зв’язку з порушенням експресії В-7 молекул на антигенпрезентуючих клітинах.
5. Співвідношення між кількістю професійних і непрофесійних клітин, які презентують антиген наївним Т-лімфоцитам, впливає на характер імунної відповіді на антиген: закінчиться вона праймінгом (готовністю Т-лімфоцита до подальшої реалізації імунної відповіді) або толерантністю. У новонароджених переважають непрофесійні антигенпрезентуючі клітини, що призводить до зниження сили імунних реакцій.
6. У периферичній крові новонародженого міститься невелика кількість зрілих В-лімфоцитів, які мають на своїй поверхні достатню кількість slgD. У зв’язку з цим низькі дози антигенів, які вводяться новонародженим, можуть бути достатніми тільки для преміювання зрілих диференційованих В-лімфоцитів і розвитку гуморальної відповіді. Якщо ж доза антигена перевищує певний поріг, то більшість незрілих пре-В-лімфоцитів гинуть шляхом апоптозу, а у зрілих розвивається анергія.
7. Субпопуляція Т-хелперів (CD4+) є гетерогенною. У ній переважають наївні, непремійовані Т-лімфоцити з фенотипом CD45RA+, які функціонують як індуктори супресорних механізмів. Вони продукують головним чином інтерлейкін-2 (80% непремійованих Т-лімфоцитів у новонароджених у порівнянні з 50% у дорослих). При цьому частка непремійованих Т-лімфоцитів вірогідно вища у новонароджених, які перенесли хронічну внутрішньоутробну гіпоксію (збільшується до 90-92%).
Такі особливості імунної системи новонародженого роблять його вразливим щодо зриву захисних реакцій і виникнення інфекційних захворювань.
У подальшому (вже на першому тижні життя) спостерігаються кардинальні зміни в гемограмі, відомі як фізіологічні перехрести в формулі крові (рис. 1). Ці зміни віддзеркалюють процеси імунної перебудови, що відбуваються в організмі новонародженого внаслідок адаптації до зовнішнього середовища.
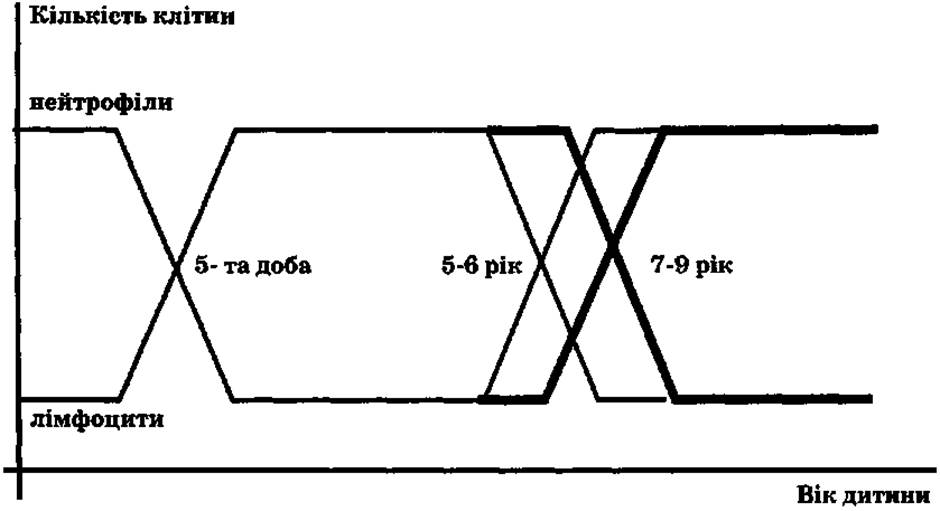
Рис. 1. Фізіологічні перехрести формули крові у дітей (Казмірчук В. Є., Ковальчук Л. В., 2006).
У новонароджених дітей співвідношення між нейтрофілами та лімфоцитами приблизно таке ж, як і у дорослих, або дещо переважає кількість нейтрофілів (як у вагітних). Протягом перших днів позаутробного життя кількість нейтрофілів починає швидко знижуватися, а кількість лімфоцитів - зростати. Приблизно до 4-5-го дня життя процентне співвідношення нейтрофілів та лімфоцитів зрівнюється (в середньому по 45%). Це так званий перший фізіологічний перехрест лейкоцитів. Його фізіологічна роль: підвищення кількості лейкоцитів (у 3-4 рази вище за норму дорослого), в перші дні позаутробного життя забезпечення надійного захисту шкіри і слизових. При цьому відбувається презентація великої кількості різноманітних екзогенних антигенів, що дає потужний імпульс сформованому антенатально лімфоїдному комплексу для різкого підвищення продукції лімфоцитів.
З 10-ти місяців до 2,5 року в дітей відзначається максимальний фізіологічний лімфоцитоз (близько 65%). Протягом цього часу дитина зустрічається зі специфічним антигенним впливом (профілактичні щеплення, дитячі інфекції, віруси, бактерії тощо). Спостерігається кількісне збільшення лімфоїдної тканини (аденоїди, тонзили, лімфатичні вузли). Внаслідок постійного антигенного навантаження імунна система організму поступово набуває компетентності. У більшості дітей вже до кінця 2-го року життя на деякі інфекції розвивається вторинна імунна відповідь.
Приблизно до 4-5-го року життя відзначається повторна рівновага між рівнями лімфоцитів і нейтрофілів. Це так званий другий фізіологічний перехрест у формулі крові. Час настання другого перехресту має індивідуальні коливання (від 4-х до 7-ми років), що залежать від фенотипових особливостей дитини, функціонального стану основних органів та систем, а також умов існування дитини (матеріально-побутова база, індивідуальне та колективне виховання, екологія). Дітей у віці 6-7-ми років з немотивованим лімфоцитозом відносять до категорії "пізно стартуючих", яким притаманне затримане дозрівання імунної системи.
У подальшому відбувається поступова інволюція лімфоїдної тканини з одночасним вдосконаленням її функції. При цьому відсоток лімфоцитів починає знижуватися, а рівень нейтрофілів - зростати, досягаючи норми дорослого.
Критичні періоди імунітету дитини
(Казмірчук В. Є., Ковальчук Л. В., 2006)
І критичний період - період новонародженості. У цей період спостерігається слабка резистентність до умовно-патогенної, гноєтворної, грам- негативної мікрофлори; схильність до генералізації гнійно-запальних процесів, виникнення септичних станів; висока чутливість до вірусних інфекцій. До 0,5% немовлят мають ознаки природженої вірусної інфекції.
Особливість |
Клінічне значення |
Недовершені бар’єри шкіри і слизових |
Потребується добрий догляд |
Найбільш ефективним з факторів природної резистентності є лізоцим |
Один з основних механізмів місцевого захисту |
Незавершеність фагоцитозу |
Інтоксикація організму екзотоксинами - висока захворюваність пневмонією, ускладнений перебіг |
Обмежена активність цитокінів, у т.ч. інтерферонів |
Слабкий противірусний захист, схильність до ранньої генералізації вірусної і бактеріальної інфекцій |
Значно знижений рівень NK-клітин |
Малий противірусний та протипухлинний захист |
В-лімфоцити мають низьку чутливість до інтерлейкінів Т-клітин |
Зниження синтезу специфічних антитіл |
Захищають тільки IgG, які отримані від матері |
Захист від дифтерійного токсину, вірусів поліомієліту, кору, краснухи, мікробних інфекцій |
Низька продукція lgА, lgМ |
Схильність до вірусних і бактеріальних інфекцій |
Відносно високий рівень lgЕ |
Посилення імунного запалення |
II критичний період - 3-6-й місяць життя. У цей період найбільш виражене транзиторне зниження рівня імуноглобулінів у крові. Імунна відповідь має здебільшого первинний характер без збереження імунної пам’яті. Вакцинація не спричиняє формування імунної пам’яті, і тільки ревакцинація формує вторинну імунну відповідь. У віці до 4-5 місяців дебютують Т-клітинні імунодефіцити. У віці близько 6-ти місяців дебютують дефіцити антитілоутворення.
Особливість |
Клінічне значення |
Суттєве зниження IgG (за рахунок катаболізму антитіл, які отримані від матері) |
Зниження пасивного гуморального імунітету |
З 3-місячного віку підвищення синтезу slgА, але зберігається недостатність місцевого імунітету до 4-х років |
Висока чутливість до ГРВІ |
Найбільш низькі рівні всіх класів імуноглобулінів |
Фізіологічна гіпоімуноглобулінемія |
Низька здатність до синтезу інтерферону |
Часті ГРВІ |
На більшість антигенів розвивається первинна імунна відповідь з синтезом lgМ, не зберігаючи імунологічної пам’яті |
Атипово перебігає кір, коклюш, не залишаючи імунітету. Вірус гепатиту В рідко викликає жовтяницю |
ІІІ критичний період - 2-3-й рік життя. Значне розширення контактів дитини обумовлює підвищення частоти інфекційних захворювань, що призводить до декомпенсації незрілих імунних механізмів і маніфестації аномалій імунітету.
Особливість |
Клінічне значення |
Зберігається первинний характер імунної відповіді |
Погано адаптується до дитячого колективу |
Зберігається дефіцит IgG |
Зберігається чутливість до вірусних інфекцій, палочки інфлюенци. Дозріває гуморальний імунітет |
Підвищується чутливість В-лімфоцитів до інтерлейкінів, активується хелперна функція |
Проявляються аномалії імунітету |
Незрілість імунних процесів у слизових |
Діти чутливі до вірусних інфекцій, часті захворювання ЛОР-органів |
IV критичний період - 4-6-й рік життя. Завершується період становлення набутого імунітету. Захворювання верхніх дихальних шляхів набувають хронічного або рецидивного характеру у зв’язку з недостатністю місцевого імунітету.
Особливість |
Клінічне значення |
Здійснюється другий перехрест крові: знижується абсолютна кількість лімфоцитів, підвищується вміст нейтрофілів |
|
Формується вторинна імунна відповідь на більшість антигенів |
Підвищується імунорегуляторний індекс Зменшується абсолютна кількість В-лімфоцитів. lgМ досягає рівня дорослого |
Секреторний lgА значно нижче рівня дорослого |
Зберігається недостатність імунітету слизових |
Підвищення рівня lgЕ |
Підвищена частота проявів імунодефіцитів |
V критичний період - 12-13 років. У цей період розпочинають активно функціонувати статеві залози, у зв’язку з чим відзначаються статеві відмінності в імунному статусі.
Особливість |
Клінічне значення |
Зменшується маса лімфоїдних органів |
|
У хлопчиків стимуляція секреції статевих гормонів (андрогенів), які знижують імунітет |
Підвищується чутливість до мікобактерій туберкульозу. |
У дівчаток невстановлене співвідношення естрогену і прогестерону призводить до зниження супресорної функції Т-ланки |
Тяжче протікають алергічні і автоімунні захворювання |
Імунологічні порушення при старінні
Зміни в роботі імунної системи починаються задовго до будь-яких проявів старіння організму. Нормальна імунна реакція й непорушена генетична регуляція імунореактивності - необхідна умова стійкості до хвороб і старіння.
На вікові ослаблення функцій імунної системи впливають як екзогенні, так і ендогенні фактори: зміна клітинного оточення (порушення нейрогуморальної рівноваги), зміни самих клітин імунної системи. Багатьма дослідниками старість розглядається як Т-імунодефіцит.
При старінні відбувається зменшення кількості Т-лімфоцитів. Однак іноді загальна кількість клітин може й не змінюватися, але збільшується кількість клітин, що мовчать, незатребуваних клітин, що пов’язано зі зниженням активності рецепторного апарата клітини. Старіння характеризується більш вираженим зниженням рівня популяції Т-супресорів (CD8+ клітин) і менш вираженим - Т-хелперів (CD4+ клітин). Виявляються певні особливості усередині популяцій Т-хелперів у літніх людей, зокрема, спостерігається дефіцит Т-клітин пам’яті.
Головна вікова зміна імунної системи - інволюція тимусу, що починається при статевому дозріванні. Вона полягає в прогресивній втраті клітинності (до старості маса тимусу зменшується на 90%) з виснаженням лімфоїдного пула клітин у зонах кори й кістозними змінами епітеліальних клітин. Зі збільшенням віку знижується вихід диференційованих Т-клітин, синтез і секреція поліпептидних гормонів тимусу, таких як тимозин, тимопоетін і тимулін. У всіх випадках зниження ендокринної активності тимусу відіграє патогенну роль у вікових дисфункціях імунної системи.
При старінні відбувається зниження експресії антигенів гістосумісності на Т- лімфоцитах, що обумовлює зниження розпізнавання алоантигенів і подальшої передачі інформації, необхідної для елімінації антигена й антитілопродукції.
Однак вплив інволютивних процесів у тимусі не обмежується тільки Т-клітинною ланкою імунітету, вони захоплюють і В-клітинну ланку - як шляхом взаємодії клітин в імунній відповіді, так і шляхом впливу на формування В-клітин з їхніх попередників у кістковому мозку; в окремих випадках В-клітинний імунодефіцит залежить від внутрішніх дефектів самих В-клітин.
Вікові зміни гуморального імунітету. Старіння асоціюється із присутністю різних антитіл, особливо антитіл проти ядерних антигенів. Є також докази, що старіння діє на швидкість продукції антитіл за допомогою активованих В-клітин.
У процесі старіння слабшає гуморальна імунна відповідь як на автологічні, так і на екзогенні антигени, у чому безпосередньо беруть участь різні класи імуноглобулінів. З віком розвивається дисбаланс імуноглобулінів. Безперечним при старінні є зниження в крові концентрації lgМ, тобто знижена первинна гуморальна відповідь. Вміст IgG і lgА має тенденцію до збільшення. При наявності інфекційного процесу особливо зростає концентрація lgА. Дисбаланс імуноглобулінів вказує на зниження протимікробного захисту, із цим пов’язане підвищення сприйнятливості до інфекцій у людей літнього й старечого віку.
Є відомості про зниження концентрації лізоциму, активності b-лізину й вмісту С3 компонента комплементу в літніх осіб. Зміни в макрофагальній системі при старінні пов’язані зі зниженням міграційної здатності клітин, зі зменшенням числа активних клітин, зі зниженням інтенсивності поглинання й руйнування захопленого матеріалу, тобто зниженням поглинальної здатності й здатності макрофагів до перетравлення.
Для літнього й старечого віку характерне зниження не тільки протимікробного імунітету, але й противірусного й протипухлинного захисту, що безпосередньо пов’язано з реакціями клітинного імунітету, в яких беруть участь природні кілери. При старінні змінюється кількісний вміст клітин-кілерів: він може як збільшуватися, так і знижуватися. Функціональна ж їхня активність після 70 років, як правило, знижується. Лише в довгожителів відзначається знову зростання активності NK-клітин, які беруть на себе реакції клітинного імунітету.
Підсумовуючи все вищесказане, зміни в імунній системі, що супроводжують старіння людини, такі (Бутенко Г.М., 2003):
• Починаючи з періоду статевого дозрівання, відбуваються атрофічні процеси в тимусі, і він поступово заміщається сполучною й жировою тканиною.
• Зменшується продукція гормонів, що сприяють утворенню Т-лімфоцитів; з іншого боку, з’являються речовини, які гальмують проліферацію лімфоцитів.
• Знижується рівень цитокіну ІЛ-7, що стимулює розмноження й диференціацію тимоцитів.
• Порушується контроль за підтримкою антигенної сталості організму.
• Знижується здатність до імунної відповіді на чужорідні агенти.
• Підвищується частота й збільшується виразність автоімунних реакцій, підвищується рівень циркулюючих імунних комплексів.
• Збільшується ймовірність виникнення лімфопроліферативних захворювань - доброякісних (моноклональних гаммапатій) і злоякісних (різних форм лейкозів).
• Зменшується розмаїтість вироблюваних антитіл і Т-клітинних рецепторів, звужується їхній спектр.
• Знижується рівень відповіді і його тривалість.
• Зменшується в крові кількість CD4+ Т-клітин і CD 19+ В-клітин, збільшується число CD8+ Т-клітин при зниженій реакції на мітогени й підвищенні рівня циркулюючих імуноглобулінів.
• Підвищується рівень ІЛ-6, ФНП-а, неоптерина й розчинного ФНП II типу.
• Зменшується співвідношення CD4/CD8 з підвищенням експресії HLA-DR.
• Відзначається підвищена схильність до інфекційних захворювань (інфекцію виявляють у 65% померлих у літньому віці); при цьому відсутня лихоманка.
• Вікові зміни імунітету відіграють роль у патогенезі атеросклеротичного ушкодження судин (імунна система й хронічне запалення ініціюють дисфункцію ендотеліальних клітин, а зміни ліпідного складу судинної стінки є вторинним чинником).
Наприкінці наводимо основні відносні і абсолютні значення лейкоцитів і основних класів імуноглобулінів крові, складових показників імунограми здорової людини у віковому аспекті (табл. 3).
Таблиця 3
Показники імунограми у здорових людей різного віку
Показник |
Середні значення М ± m у людей різного віку |
||
18-25 років |
27-55 років |
60-80 років |
|
Лейкоцити, 109/л |
6,53 ± 0,25 |
5,60 ± 0,21 |
4,90 ± 0,26 |
Лімфоцити% |
30,8 ± 1,07 |
29,4 ± 1,11 |
27,1 ± 1,00 |
Лімфоцити, 109/л |
2,02 ± 0,15 |
1,65 ± 0,11 |
1,33 ± 0,12 |
Нейтрофіли: |
|||
палочкоядерні% |
1,8 ± 0,02 |
1,56 ± 0,015 |
1,6 ± 0,02 |
сегментоядерні,% |
58,2 ± 1,13 |
60,3 ± 1,18 |
62.6 ± 1,15 |
Моноцити,% |
6,5 ± 0,27 |
6,2 ± 0,24 |
5,9 ± 0,25 |
Еозинофіли,% |
2,3 ± 0,03 |
2,2 ± 0,03 |
2,4 ± 0,03 |
Базофіли,% |
0,4 ± 0,003 |
0,4 ± 0,003 |
0,4 ± 0,003 |
Т-лімфоцити: |
|||
(Е-РОЛ),% |
63,7 ± 1,35 |
67,3 ± 1,21 |
71,2 ± 1,30 |
Е-РОЛ, 109/л |
1,28 ± 0,11 |
1,11 ± 0,10 |
0,95 ± 0,10 |
В-лімфоцити: |
|||
(М-РОЛ),% |
9,6 ± 0,78 |
8,2 ± 0,88 |
8,5 ± 0,85 |
М-РОЛ, 109/л |
0,19 ± 0,01 |
0,14 ± 0,01 |
0,11 ± 0,01 |
Нульові клітини% |
26,7 ± 0,90 |
24,5 ± 0,92 |
20,3 ± 0,96 |
Теофілін-резістентні Т-лімфоцити% |
49,8 ± 1,05 |
55,6 ± 1,17 |
54,4 ± 1,29 |
Теофілін чутливі Т-лімфоцити% |
26,4 ± 0,77 |
25,4 ± 0,82 |
25,5 ± 0,96 |
Е-РОК% |
41,7 ± 1,35 |
45,0 ± 1,08 |
47,4 ± 1,06 |
Нейтрофіли фагоцитуючі, % |
1,39 ± 0,10 |
1,86 ± 0,09 |
1,90 ± 0,10 |
lgA, г/л |
1,2 ± 0,10 |
1,00 ± 0,09 |
1,01 ± 0,10 |
lgM, г/л |
11,37 ± 0,39 |
9,85 ± 0,26 |
11,01±0,45 |
lgG, г/л |
6,8 ± 0,12 |
8,1 ± 0,15 |
12,2 ± 0,19 |
ШОЕ, мм/год |
6,53 ± 0,25 |
5,60 ± 0,21 |
4,90 ± 0,26 |
Завдання для заключного контролю знань
11. Антитіла виробляються:
A. Т-хелперами.
B. В -клітинами.
C. Епітеліальними клітинами.
D. Плазматичними клітинами.
E. Клітинами селезінки.
12. Через плаценту IgG проникають?
A. Так.
B. Ні.
13. Які з перерахованих станів відображують процес старіння організму?
A. Підвищення рівня ІЛ-6, ФНП-а, неоптерина й розчинного ФНП II типу.
B. Зменшення співвідношення CD4/CD8 з підвищенням експресії HLA-DR.
C. Зниження рівня цитокіну ІЛ-7, що стимулює розмноження й диференціацію тимоцитів.
D. Зменшення продукції гормонів, що сприяють утворенню Т-лімфоцитів; з іншого боку, з’являються речовини, які гальмують проліферацію лімфоцитів.
E. Все перераховане.
14. Наявність якої кислоти на поверхні шкіри та слизових оболонок обумовлює їх бактеріцидність?
A. Піровінілової.
B. Арахідонової.
C. Молочної.
D. Соляної.
15. Імуноглобулін якого класу переважно утворюється в слизових оболонках?
A. IgD.
B. Секреторний IgA.
C. IgG.
D. IgE.
16. До якого типу резистентності відноситься вроджений імунітет?
A. Неспецифічної резистентності.
B. Специфічної резистентності.
C. Набутої резистентності.
17. Природно набутий пасивний імунітет - це:
A. Імунітет, що розвивається при вакцинації.
B. Імунітет, обумовлений введенням анатоксинів.
C. Імунітет, обумовлений переносом антитіла через плаценту.
18. При фагоцитозі обов'язково мають місце перераховані стадії:
A. Фіксація сторонніх часток.
B. Занурення часток у цитоплазму.
C. Утворення фагосом.
D. Знищення сторонніх часток.
E. Виділення неперетравленних сторонніх часток.
19. Захисна дія інтерферонів:
A. Безпосередньо пов'язана з впливом на трансплантацію РНК вірусів.
B. Обумовлена порушенням процесу проникнення вірусів у клітину організму.
C. Обумовлена утворенням антивірусних білків, які порушують трансплантацію вірусної РНК.
D. Обумовлена зміною адсорбції вірусу на клітинній мембрані.
20. Відзначте класичний активатор системи комплементу:
A. Т-лімфоцити.
B. Антитіла.
C. Комплекс антиген-антитіло.
D. Антигени.
Вірні відповіді на питання: 11 - D; 12 - B; 13 - E; 14 - C; 15 - B; 16 - A; 17 - С; 18 - ABCD; 19 - C; 20 - С.