Введение в молекулярную биологию: От клеток к атомам - Энтони Рис, Майкл Стернберг 2002
Белки
Принципы действия ферментов
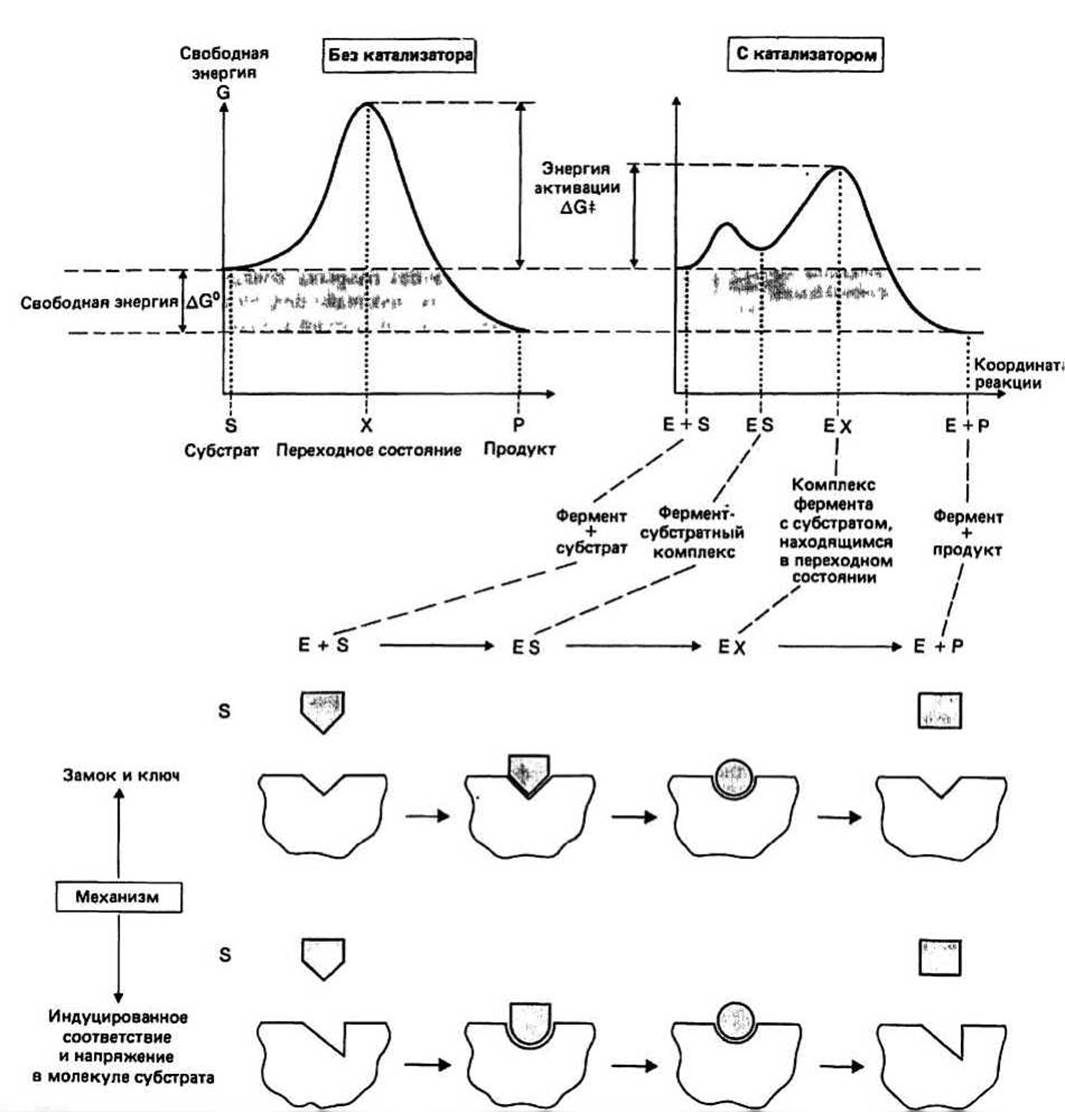
Рис. 12.1.
Фермент — это белок, который увеличивает скорость биохимической реакции (т. е. работает как катализатор). Скорость реакции при этом может возрастать до 1010 раз по сравнению со скоростью той же реакции в отсутствие фермента.
Субстрат - это молекула (обозначаемая S), которая после взаимодействия с ферментом (Е) превращается в продукт (Р).
Активный центр фермента молекулы белка, где может связываться субстрат (или субстраты) с образованием фермент-субстратного (E—S) комплекса. Активный центр почти всегда построен всего лишь из нескольких аминокислотных остатков. Хотя эти остатки пространственно сближены, в линейной белковой молекуле они часто далеко отстоят друг от друга. Как правило, формирование Е—S-комплекса происходит без образования ковалентных связей, а осуществляется за счет более слабых, но и более специфических типов взаимодействий, таких как водородные связи, солевые мостики, гидрофобные силы и плотная упаковка атомов. Однако известны исключения, когда между ферментом и субстратом формируется ковалентная связь, например при образовании промежуточного продукта в ходе функционирования ферментов, принадлежащих семейству сериновых протеиназ.
Под специфичностью фермента понимают его способность отличать свой истинный субстрат от других родственных молекул. Такая избирательность обусловлена высокой специфичностью фермент - субстратных взаимодействий. Ранняя модель это взаимодействия, называемая моделью «замка и ключа», была дополнена идеей «индуцированного соответствия» (см. ниже). Специфичность узнавания у разных ферментов значительно варьирует — некоторые ферменты могут катализировать реакцию с участием только одного субстрата, тогда как другие — с несколькими химически родственными веществами. Например, формамидаза гидролизует только формамид, тогда как амидаза гидролизует любой алифатический амид.
Аналогичный «замок-ключ» для объяснения специфичности ферментов была предложена в 90-х годах XIX в. Фишером: к ферменту (замку) подходит лишь свой субстрат (ключ).
Гипотеза «индуцированного соответствия» для объяснения специфичности ферментов была высказана Кошландом в 1959 г. Согласно этой ныне общепринятой гипотезе, связывание ферментов правильного субстрата индуцирует в белке небольшие конформационные изменения. В результате этих изменений каталитические группы фермента ориентируются таким образом, что становится возможным превращение субстрата в продукт. Дальнейшее развитие модели индуцированного соответствия связано с учетом того, что конформация субстрата при связывании с ферментом также может слегка изменяться. В этом случае говорят о напряжении в молекуле субстрата. Гипотеза о существовании конформационных изменений в ферменте и субстрате при их связывании друг с другом объяснила тот факт, что молекулы, очень похожие по форме на истинный субстрат, могут связываться с ферментом, но не превращаются в продукт, т. е. действуют как ингибиторы. Таким образом, правильный субстрат — это больше, чем просто «ключ» к соответствующему «замку».
Положение равновесия реакции не зависит от присутствия или отсутствия фермента в реакционной смеси. Рассмотрим изменение свободной энергии для обратимой реакции S↔Р (соответствующий график приведен на предыдущей странице). Свободная энергия реакции ∆С0 равна разности свободных энергий S и Р и определяет положение равновесия реакции. В присутствии любого катализатора, в том числе и фермента, свободная энергия исходных реагентов (S) и продуктов реакции (Р) не изменяется и, следовательно, не изменяется ∆С0.
Переходное состояние, или активированный комплекс (обозначается X), - это высокоэнергетическая промежуточная структура, которая образуется во время реакции. Разность свободных энергий исходных реагентов (т. е. субстратов) и переходного состояния называется свободной энергией активации и обозначается ∆С‡ Скорость реакции зависит от величины ∆С‡: чем она меньше, тем больше скорость реакции, и наоборот.
Фермент увеличивает скорость реакции следующими способами.
1. Понижая свободную энергию переходного состояния путем стабилизации активированного комплекса.
2. Увеличивая энергию субстрата, когда тот связывается с ферментом при образовании фермент-субстрат ного (Е—S) комплекса. В итоге уменьшается разность свободных энергий Е—S-комплекса и переходного состояния.
3. Поддерживая микроокружение активного центра в состоянии, отличном от такового в водной среде. Час то у боковых цепей аминокислотных остатков, находящихся в области активного центра, способность приобретать электрический заряд изменяется по срав нению с тем случаем, когда эти цепи целиком погружены в водную среду. В результате боковые цепи могут обладать «повышенной реактивностью».
4. Располагая реагирующие атомы в правильной ориентации и на необходимом расстоянии друг от друга, так чтобы обеспечить оптимальное протекание реакции. Столкновения атомов в отсутствие фермента очень редко приводят к химической реакции, поскольку в этом случае очень редко атомы оказываются в правильной ориентации.
Ингибиторами называются молекулы, которые, связываясь с ферментом, блокируют какую-то стадию ферментативной реакции. Ингибиторы бывают обратимыми и необратимыми. Обратимое ингибирование подразделяется на конкурентное, неконкурентное и бесконкурентное.
Конкурентный ингибитор — это молекула, настолько похожая по своей структуре на молекулу субстрата, что фермент не может различить их. В результате связывания конкурентного ингибитора с активным центром фермента падает концентрация Е—S-комплексов и, следовательно, уменьшается скорость реакции. Ингибитор обычно в продукт не превращается.
Неконкурентный ингибитор - это молекула, связывающаяся не с активным центром, а с каким-то другим участком фермента. Поскольку связывание с неконкурентным ингибитором не мешает ферменту образовывать Е—S-комплекс, этот ингибитор не понижает концентрацию таких комплексов, а влияет на эффективность превращения S в Р.
Бесконкурентный ингибитор— это молекула, которая связывается только с фермент-субстратным комплексом и не может связаться со свободным ферментом. В односубстратных ферментных системах этот тип ингибирования встречается довольно редко. Необратимый ингибитор непрерывно модифицирует молекулы фермента, в результате чего они частично или полностью теряют свою активность.