Введение в молекулярную биологию: От клеток к атомам - Энтони Рис, Майкл Стернберг 2002
Клетки и молекулы за работой
Антитела и их функции
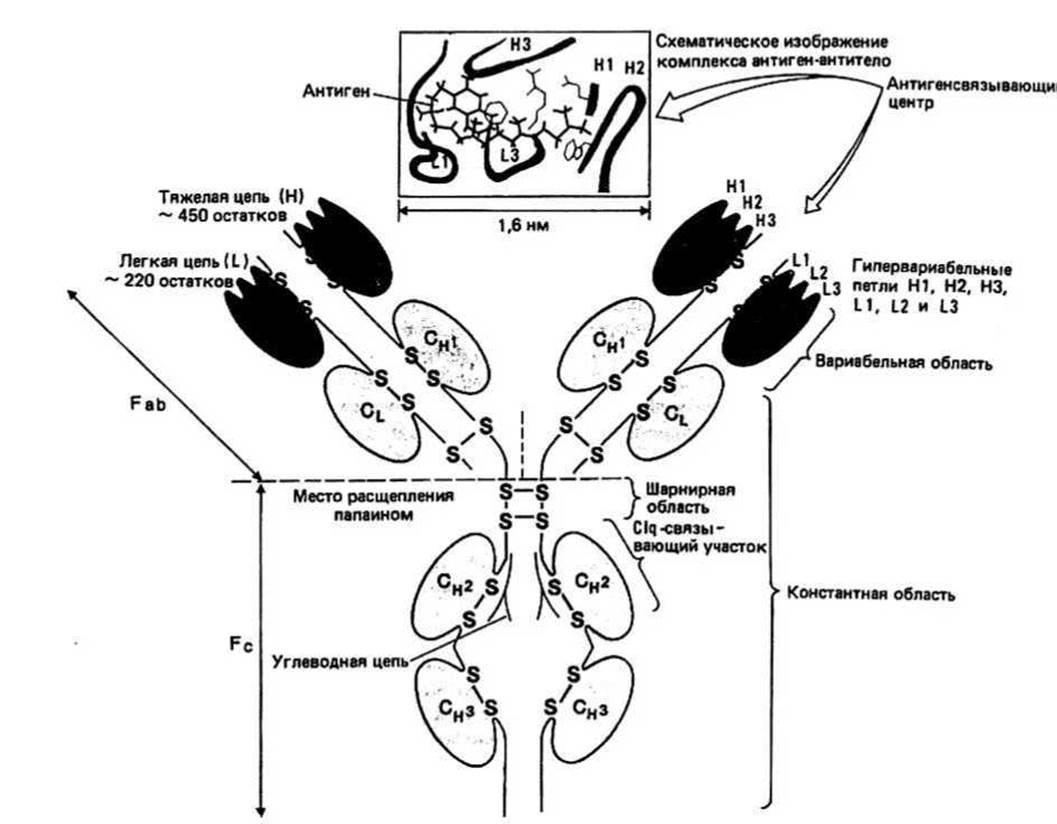
Рис. 40.1. Молекула иммуноглобулина G.
Иммунитетом называется способность организма распознавать и разрушать попавшие в него чужеродные элементы, например микроорганизмы или вирусы. Иммунная система наиболее сложно организована у млекопитающих — проникновение чужеродных веществ служит у них сигналом для запуска ряда процессов, протекающих на клеточном и молекулярном уровнях и называемых в целом иммунным ответом.
Иммуноглобулины, или антитела — это молекулы, циркулирующие в организме и отвечающие за распознавание чужеродных, или «не своих», элементов. За этим узнаванием следует серия реакций, составляющих гуморальный, или опосредованный антителами, ответ.
Антигены — это чужеродные молекулы, с которыми могут связываться антитела. Образование комплекса антиген—антитело, как правило, сопровождается запуском особого процесса, приводящего в конечном итоге к значительному увеличению концентрации соответствующих антител. Антитело специфически связывается с определенным участком антигена. Этот участок носит название эпитоп. Один антиген может содержать множество эпитопов. Обычно антигены представляют собой либо отдельные макромолекулы, такие, как белки, нуклеиновые кислоты, липиды или углеводы, либо комбинации макромолекул, примером которых служат наружные поверхности вирусов и бактерий.
Иммуноглобулин G(lgG), называемый также у-глобулином, — самый распространенный иммуноглобулин. Его мол. масса равна 150 000. Молекула IgG состоит из четырех полипептидных цепей — двух идентичных тяжелых (heavy, H) и двух идентичных легких (light, L). Н-цепь (мол. масса 50 000) содержит около 450 аминокислотных остатков, а L-цепь (мол. масса 25 000) — 220. Четыре цепи ковалентно связаны между собой дисульфидными мостиками (рис. 40.1).
Вариабельные и константные области Н- и L - цепей. Сравнение первичных структур нескольких IgG, принадлежащих одному виду, показывает, что последовательности N-концевых половин L-цепей сильно различаются. Поэтому принято говорить, что первые (т. е. N-концевые) 110 аминокислотных остатков образуют вариабельную (variable), или V-область. С-концевые половины часто имеют одинаковые последовательности. Эти 110 остатков у С-конца составляют константную (constant), или С-область. Последовательности С-области L-цепей можно разбить на два класса. В соответствии с этим L-цепи подразделяются на два типа - каппа (к) и лямбда (к). В каждой из Н-цепей вариабельная область длиной около 110 аминокислотных остатков также находится в N-концевой части, а остальные 340 аминокислот образуют константную область.
Гипервариабельные участки V-областей L- и Н-цепей. Сравнение аминокислотных последовательностей различных V-областей L-цепей показало, что в пределах V-области имеются участки, отличающиеся чрезвычайно высокой степенью вариабельности и называемые поэтому гипервариабельными. L-цепь содержит три таких пространственно отделенных друг от друга участка (L1, L2 и L3 на рис. 40.1) — каждый из них состоит приблизительно из 6 остатков. Аналогично в V- области Н-цепи также обнаруживаются 3 гипервариабельных участка (H1, H2 и НЗ). Гипервариабельные участки L- и Н-цепей составляют антигенсвязывающий центр, т. е. ту часть молекулы Ig, которая узнает антиген. Благодаря высокой степени вариабельности гипервариабельных участков может существовать огромное число различных антигенсвязывающих центров.
Домен иммуноглобулина представляет собой структурную единицу, состоящую примерно из ПО остатков. L-цепь построена из двух доменов, соответствующих вариабельной (V) и константной (С) областям. Эти домены обозначаются VL и CL. В Н-цепи можно выделить четыре домена: вариабельный (VH и 3 домена, образующих константную область (СН1, СН2 и СН3). Аминокислотные последовательности доменов обладают определенным сходством друг с другом. В частности, в каждом домене полипептидная цепь образует петлю (во всех доменах эти петли имеют примерно одинаковую длину), замкнутую внутрицепочечной дисульфидной связью.
Fab- и Fc-фрагменты получаются из интактной молекулы IgG путем ограниченного протеолиза полипептидной цепи с помощью папаина. Каждый фрагмент имеет мол. массу около 50 000. Два из образующихся фрагментов обладают антигенсвязывающими свойствами и называются поэтому Fab (fragment antigen binding). Третий фрагмент легко кристаллизуется и обозначается Fc (fragment crystallised). Fab состоит из одной L-цепи (домены VL и CL) и первой половины одной Н-цепи (VH и СН1), a Fc — из вторых половин двух Н-цепей, т. е. из двух СН2 и двух СН3 доменов.
Пространственная структура lgG была определена методом рентгеноструктурного анализа. Молекула IgG имеет Y-образную форму — каждая ветвь Y соответствует Fab-области, а основание Y — Fc-области. Третичные структуры всех доменов обладают большим сходством. Каждый домен длиной 110 остатков представляет собой плотно упакованную глобулу, состоящую из пары расположенных один над другим р- складчатых листов (см. рис. 10.1). Отдельные домены находятся в тесном контакте. Так, 4 домена Fab-области попарно взаимодействуют друг с другом — VH с VL, a CH1 с CL. В Fc-области С3-домены расположены один напротив другого, а между ОД-доменами локализованы две разветвленные углеводные цепи. Части полипептидной цепи, соединяющие между собой любые два домена, обычно менее плотно упакованы, чем сами домены. Область между Fab и Fc называется шарнирной, поскольку присущая ей определенная гибкость позволяет Fab-областям перемещаться относительно Fc.
Антигенсвязывающие центры находятся в верхних точках обеих ветвей Y-образной молекулы. В каждом вариабельном домене гипервариабельные участки пространственно сближены. Наличие тесного контакта между VH- и VL-доменами в свою очередь приводит к тому, что все гипервариабельные участки оказываются расположенными рядом, формируя таким образом антигенсвязывающий центр. Было показано, что связывание антигена с молекулой IgG может осуществляться за счет водородных связей, солевых мостиков, вандерваальсовых и гидрофобных взаимодействий. На рис. 40.1 схематически изображена локализация витамина К, в комплексе антиген (витамин К,) — антитело (IgG).
Fc - область играет очень важную роль в запуске тех процессов иммунного ответа, которые в конечном итоге приводят к разрушению чужеродных элементов. Один из этих процессов состоит в последовательной активации компонентов так называемой системы комплемента. Первый этап заключается в связывании молекулы Clq с Сн2-доменом IgG. Clq связывается только с IgG, образовавшим комплекс с антигеном.
Clq является составной частью первого компонента (С1) системы комплемента и по форме напоминает букет тюльпанов. В молекуле насчитывается 18 полипептидных цепей. Каждый «тюльпан» состоит из 3 цепей. Головка тюльпана представляет собой глобулу, а вытянутый стебель, по-видимому, имеет структуру тройной коллагеновой спирали (гл. 11). Во всяком случае, последовательность каждой цепи в стебле построена из повторяющихся триплетов —Gly—X—Y—. Для активации следующих компонентов системы комплемента несколько молекул IgG должны присоединиться к антигену и таким образом сблизиться друг с другом настолько, чтобы стало возможным связывание этих IgG с головками одной и той же молекулы Clq (рис. 40.2).
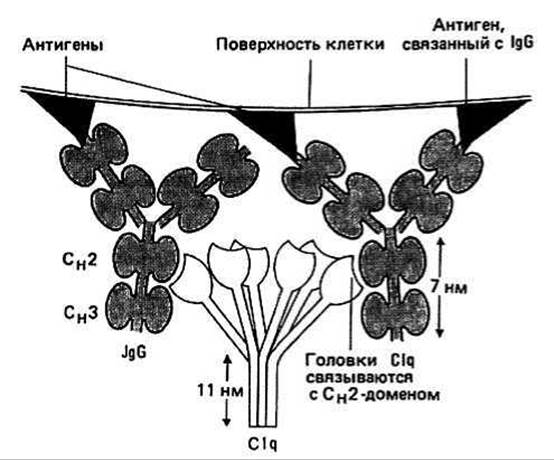
Рис. 40.2.
Разнообразие антител В течение жизни организм продуцирует огромное количество различных антител (>108) против всевозможных антигенов. Такая способность организма объясняется в настоящее время соматической перегруппировкой генов. Это означает, что при рождении в организме существует ограниченное число генов иммуноглобулинов (значительно меньше 108), а необходимое их разнообразие достигается благодаря перегруппировке этих генов.
Расшифровка нуклеотидных последовательностей генов - иммуноглобулинов позволила понять механизм соматической перегруппировки. Каждый V- и С-домен кодируется отдельными генами. Кроме того, ген вариабельной области разделен на различные участки. V-область легкой цепи содержит два таких участка, обозначаемых К и У (от англ. joining— соединение). Расчет числа возможных VL-областей основан на тех известных в настоящее время фактах, что существует 100 различных V-участков и 5 различных J-участков, а
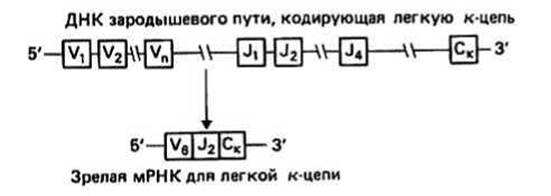
Рис. 40.3.
V/J-сплайсинг может осуществляться 10 способами. Следовательно, возможно образование 100 - 5 - 10 = 5 - 103 VL-областей. V-область тяжелой цепи содержит три участка, обозначаемых V, J и D (от англ. diversity — разнообразие). Существует приблизительно 100 V-участков, 5 J-участков и 50 D-участков, а каждое из V/J- и J/D-coединений может осуществляться 10 способами. Таким образом, возможно образование 100 ∙ 5 ∙ 50 ∙ 10 ∙ 10 = 2,5 ∙ 106 Vн-областей. Вместе с 5 ∙ 103 VL-областей общее число возможных VH—VL-пap, а следовательно и различных антигенсвязывающих центров, составляет 5 - 103 - 2,5 - 106 = 1010.
Классы иммуноглобинов. Все известные иммуноглобулины подразделяются на 5 классов — IgG, IgA, IgM, IgD и IgE — в зависимости от характера аминокислотной последовательности константной области тяжелой цепи. Различают соответственно 5 классов этих последовательностей — у, a, jj., 5 и 8. У иммуноглобулинов разных классов варьирует также число пар Н- и L-цепей и в некоторых случаях длина Н-цепи (IgM и IgG имеют дополнительный домен СН4, расположенный за Сн3-доменом).
|
Класс |
Цепи |
Мол. масса |
|
IgG |
y2κ2 или y2λ2 |
150 000 |
|
IgA |
(a2κ2)1-3 или (а2λ2)1-3 |
160 000, 320 000 или 480 000 |
|
IgM |
(μ2κ2), или (μ2λ2)5 |
900 000 |
|
IgD |
δ2κ2 или δ2λ2 |
185 000 |
|
IgE |
ε2κ2 или ε2κ2 |
200 000 |