Введение в молекулярную биологию: От клеток к атомам - Энтони Рис, Майкл Стернберг 2002
Клетки и молекулы за работой
Как работают антибиотики
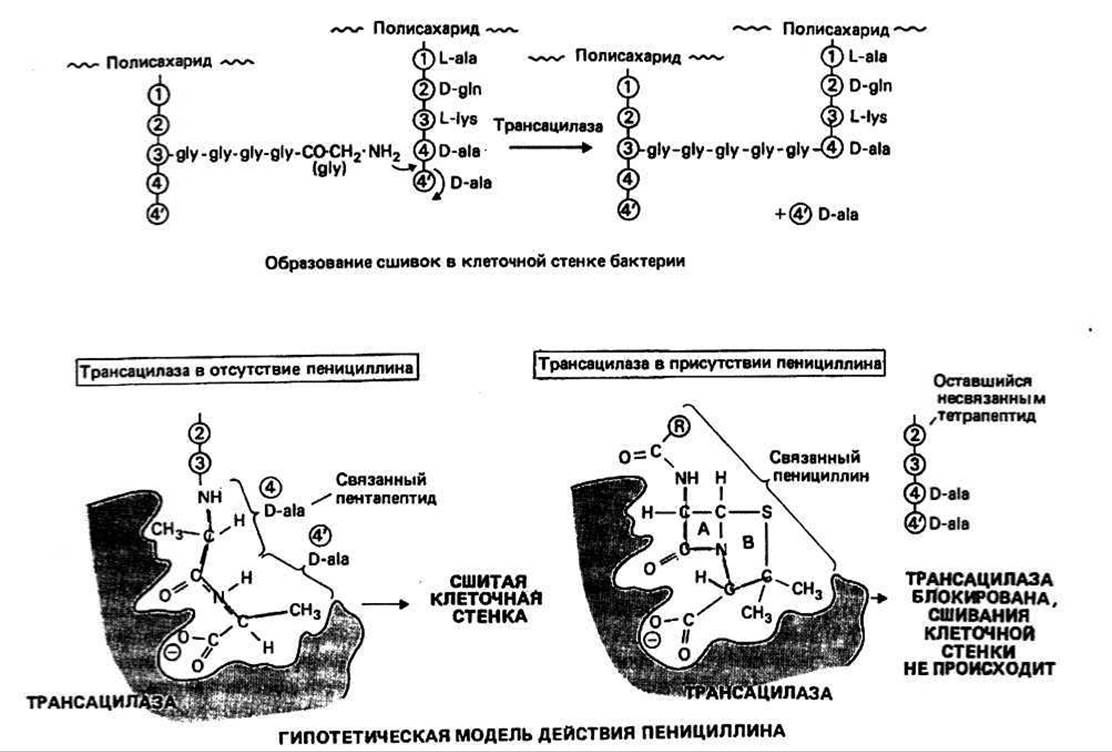
Рис. 42.1.
Антибиотики — химические вещества, продуцируемые в основном микроорганизмами и обладающие прямым и избирательным ингибирующим действием на живые клетки. Исследования Пауля Эрлиха в конце XIX в. привели к открытию химических красителей и других соединений, способных избирательно воздействовать на трипаносомы, спирохеты и прочих паразитов. Работа Эрлиха была встречена его современниками скептически, однако после открытия пенициллина Флемингом в 1928 г. и сульфамидных препаратов Домагком в 1935 г. интерес к антибиотикам возобновился, и в скором времени было найдено множество новых веществ, относимых к антибиотикам. Под термином «антибиотики» подразумевают обычно вещества с антибактериальным действием, хотя многие противовирусные и противоопухолевые препараты также являются антибиотиками. Антибиотики можно не очень строго разделить на два класса в зависимости от того, подавляют ли они рост бактериальных или эукариотических клеток. Антибактериальные антибиотики нарушают один из метаболических процессов, что приводит либо к подавлению роста клеток (бактериостатическое действие), либо к их гибели (бактерицидное действие). В табл. 42.1 приведены примеры некоторых широко известных антибиотиков; все эти антибиотики продуцируются грибами и актиномицетами. Как видно из таблицы, с помощью антибиотиков могут быть блокированы самые разные функции бактериальной клетки.
Таблица 42.1
|
Название |
На что действует |
Характер действия |
|
Пениииллины |
Синтез клеточной стенки |
Бактерицидное |
|
Цефалоспорины |
Тоже |
|
|
Стрептомицин |
Рибосомы (синтез белка) |
|
|
Хлорамфеникол (левомицетин) |
То же |
Бактериостатическое |
|
Тетрациклин |
» |
|
|
Новобиоцин |
ДНК-гираза (репликация) |
» |
|
Рифамицин |
ДНК (транскрипция) |
» |
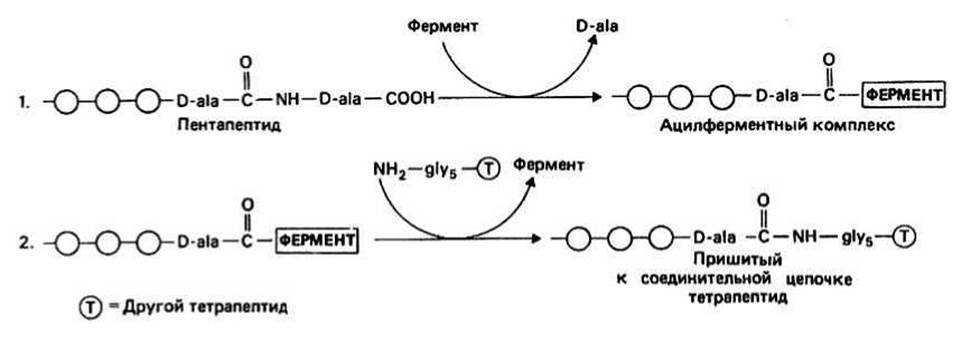
Рис. 42.2.
Выбор конкретных антибиотиков для клинического применения зависит от чувствительности к ним тех или иных бактерий и от вызываемых ими побочных эффектов. Те антибиотики, которые действуют только на функции бактерий, очевидно, более пригодны для клинических целей, чем те, которые атакуют и про-, и эукариотические клетки. Так, широкое использование пенициллина для лечения бактериальных инфекций обусловлено тем, что его действие направлено на клеточную стенку именно прокариот. Вместо пенициллина часто используется тетрациклин, который блокирует метаболический процесс, казалось бы, общий для клеток всех типов, а именно синтез белка, однако в действительности этот антибиотик высокоспецифичен именно в отношении прокариотических рибосом (гл. 24). Сейчас мы рассмотрим механизм действия пенициллина, а действие некоторых противоопухолевых препаратов будет описано в следующей главе.
ПЕНИЦИЛЛИН - природное соединение, продуцируемое плесневым грибом Penicillium notation. Молекула пенициллина содержит два конденсированных кольца: тиазолидиновое и р-лактамное. Группа R может быть разной. По сути дела, пенициллин представляет собой состоящий из L-цистеина и D-валина (гл. 6) циклический дипептид, к которому присоединена ацильная группа (RCO—). Связь СО—N в лактамном кольце напряжена (из-за его четырехчленности) и потому легко гидролизуется. Нестабильность этой связи являлась одной из причин, по которым Флемингу не удалось наладить клиническое применение пенициллина, хотя антибиотик был эффективен в опытах на культурах бактерий. Наиболее удовлетворительным из первоначально полученных пенициллинов оказался бензилпенициллин (пенициллин G), в котором R — бензильная группа. Первые указания на возможный механизм действия пенициллина появились в 1957 г., когда Ледерберг обнаружил, что чувствительные к этому антибиотику бактерии могут расти в его присутствии в том случае, если находятся в форме протопластов, т. е. лишены клеточной стенки. Позднее, в 1965 г., Парк и Стромингер показали, что пенициллин мешает образованию сшивок на заключительном этапе синтеза клеточной стенки у бактерий. На этом этапе происходит образование пептидной связи между аминогруппой пептидного мостика и вторым от конца тетрапептида (см. рис. 42.1 и 42.2) D-ala (реакция транспептидации).
Транспептидация катализируется ферментом гликопептид-транспептидазой (трансацилазой). На первой стадии образования сшивки этот фермент должен связать два D-аланиновых остатка, расположенных на конце пентапептида (см. рис. 42.2; гипотетическая модель фермент-субстратного комплекса показана на рис. 42.1). Затем, удаляя концевой D-ala, фермент образует со вторым от конца D-ala ацил-интермедиат, и наконец аминогруппа соединительной цепочки атакует ацил-фермент, в результате чего образуется сшивка и высвобождается фермент. Пенициллин ингибирует эту реакцию потому, что он сходен с D-аланил-О-аланиновой группой и может занять предназначенное ей место в активном центре фермента (см. рис. 42.1). Однако дело, по-видимому, не ограничивается только связыванием пенициллина с ферментом: последний, вероятно, атакует р-лактамное кольцо, что приводит к образованию уже неспособного деацилироваться ацил-фермента (рис. 42.3), и в результате ингибирование фермента оказывается необратимым. Резистентность к пенициллину некоторых видов бактерий, например многих стафилококков, обусловлена присутствием в них фермента р-лактамазы (пенициллиназы). Этот фермент, имеющий мол. массу около 30 000, инактивирует пенициллин, расщепляя р-лактамное кольцо.
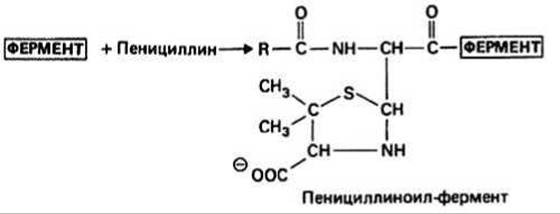
Рис. 42.3.