Биологические мембраны - А. Н. Огурцов 2012
Структура и функции биомембран
Межмолекулярные взаимодействия в биомембранах
Липидно-протеиновые кластеры в мембранах
Недавние исследования опровергли представление о том, что липидный монослой представляет собой смесь липидов, случайным образом распределённых в пределах монослоя. Сначала обнаружили, что после экстракции плазматических мембран детергентами в остатке присутствует повышенное количество холестерола и сфингомиелина. Поскольку эти два типа липидов образуют более упорядоченные и вязкие бислои, то было высказано предположение о том, что они образуют микродомены, которые назвали "липидными плотами" ("lipid rafts") или "островками", окружёнными менее вязкими участками фосфолипидов, которые в первую очередь экстрагировались детергентами.
Эксперименты подтвердили это предположение. Например, с помощью флуоресцентной микроскопии была обнаружена агрегация липидов и белков в такие "острова" в мембранах.
На рисунке 33 показана схема эксперимента, в котором добавление флуоресцентно-меченых молекул токсина холеры (серые ромбы "1") и антител (Y-образные молекулы "2") позволило, используя флуоресцентный микроскоп, подтвердить, что гликосфинголипиды GM1 и липид-заякоренные мембранные белки PLAP - плацентарная щелочная фосфатаза (placental alkaline phosphatase) - объединяются в липиднобелковые "островки" в мембране.
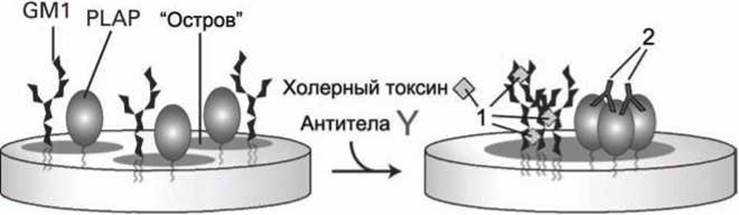
Рисунок 33 - Слияние мембранных островков в результате действия молекул холерного токсина (1) и антител к белкам PLAP (2)
Холерный токсин образует множественные кросс-линки с близкорасположенными молекулами GM1, а молекулы антител, специфических к PLAP, также способны присоединяться к двум расположенным рядом белкам, поэтому, после действия токсинов и антител образовывались бляшки ("патчи", patches) из гликолипидов и из белков PLAP.
Молекулы холерного токсина были помечены флуоресцентными маркерами зелёного цвета, а молекулы антител — красного цвета. Если бы GM1 и PLAP не были бы встроены в общие "островки", то "патчи", образовавшиеся в результате применения холерных токсинов и антител, были бы видны в микроскоп как, соответственно, зелёные или красные светящиеся пятнышки. Но в эксперименте были зарегистрированы преимущественно жёлтые пятна (жёлтый цвет образуется при смешивании красного и зеленого цветов). Следовательно, изначально GM1 и PLAP входили в состав липидно-белковых кластеров-островков и применение токсина и антител привело к объединению таких островков.
Иная картина наблюдалась для мембран, содержащих вместо белка PLAP трансмембранные белки рецепторов трансферрина TfR (transferrin receptor) (рисунок 34).
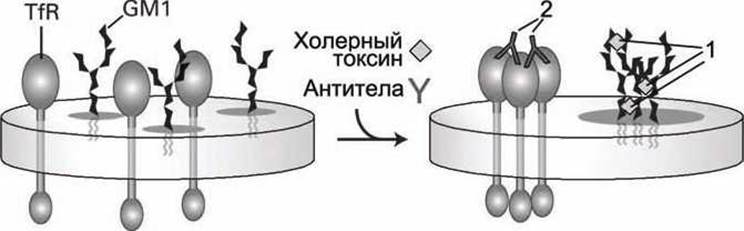
Рисунок 34 - Агрегация гликосфинголипидов GM1 и трансферриновых рецепторов TfR в результате действия молекул холерного токсина (1) и антител к белкам PLAP (2), соответственно
Обработка такой мембраны теми же флуоресцентно мечеными молекулами холерного токсина (зеленые) и антителами к TfR (красные) привело к образованию преимущественно зеленых и красных пятен в поле зрения флуоресцентного микроскопа. Следовательно, в этом случае молекулы гликосфинголипидов GM1 под действием молекул холерного токсина образовывали свои (зеленые) бляшки, а белки TfR под действием антител - свои (красные) бляшки, что доказывало отсутствие белков TfR в липидно-протеиновых кластерах.
Липидно-протеиновые островки бывают различных размеров, но обычно они имеют диаметр ~50 нм. Они могут быть разрушены применением метил-β-циклодекстрина, который удаляет из мембраны холестерол, или использованием антибиотиков, таких как филипин (filipine), который связывает холестерол. Это свидетельствует о важности холестерола в агрегации липидов и белков в острова-кластеры.
Помимо холестерола и сфинголипидов в состав островков входят многие клеточные мембранные белки -рецепторы, так же как и множество сигнальных белков, которые присоединяются к рецепторам и активируются ими. Эти липидно-протеиновые комплексы могут формироваться только в двумерной среде гидрофобного бислоя, и предполагается, что они способствуют детектированию внешних химических сигналов и активации соответствующих внутриклеточных откликов на эти сигналы.
В структурной стабилизации липидных островков важное место занимают так называемые липид-белковые и белок-белковые взаимодействия. Эти термины используют для обозначения широкого круга разнообразных, отличающихся по механизмам явлений, которые приводят к неравномерному распределению молекулярных компонентов в мембранах - микрогетерогенности мембран.