Биологические мембраны - А. Н. Огурцов 2012
Электрогенез биомембран
Потенциал действия
Фиксация мембранного потенциала
Фиксацией мембранного потенциала (voltage clamp) называется методика, при которой не клетка, а экспериментатор устанавливает значение мембранного потенциала. Поддержание постоянного напряжения φM при исследовании токов через возбуждённую мембрану позволяло:
1) избавиться от емкостных токов ![]()
2) исключить изменение ионных проводимостей gNa+ и gK+ при изменении φМ и изучить их изменение в различные фазы развития возбуждения: gi = f(t).
Постоянная разность потенциалов между внутренней и наружной поверхностями мембраны поддерживается при помощи специальной электронной схемы (рисунок 117), ключевым элементом которой является операционный усилитель.
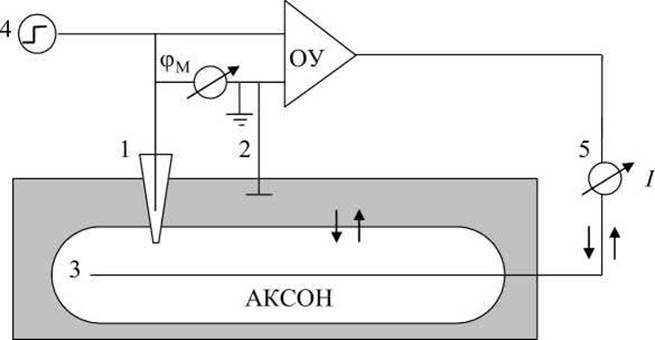
Рисунок 117 - Схема исследования токов через мембрану с фиксацией мембранного потенциала (voltage clamp): 1 - микроэлектрод; 2 - электрод сравнения; 3 - серебряный проводник; 4 - генератор постоянного напряжения; 5 - амперметр
Операционный усилитель (ОУ) представляет собой усилитель постоянного тока, охваченный глубокой отрицательной обратной связью по напряжению. На входы в операционный усилитель подаётся мембранный потенциал φM = φвн - φнар, то есть разность потенциалов микроэлектрода, помещённого внутрь аксона кальмара (1), и электрода сравнения (2).
На выходе операционного усилителя создаётся напряжение, компенсирующее изменение трансмембранного потенциала. Это напряжение подаётся на серебряный проводник (3), расположенный вдоль аксона, чтобы по всему волокну была одна и та же мембранная разность потенциалов. Электронная схема удерживает на выходе (внутри аксона) тот же потенциал, что и на входе операционного усилителя, таким образом удерживается постоянный мембранный потенциал: φM = const.
При помощи генератора постоянного напряжения (4) можно "ступенькой" изменить входное напряжение на операционном усилителе, например, поднять его выше порогового. Электронная схема будет удерживать это заданное напряжение во время опыта. Амперметр (5) измеряет протекающий при этом через мембрану ток (между электродом сравнения (2) и выходящим электродом операционного усилителя (3)). В опытах с фиксацией напряжения можно исследовать изменение мембранного тока во времени при развитии возбуждения, задавая разные постоянные значения мембранного потенциала φM.
Принято считать ток, направленный из клетки наружу в окружающий раствор положительным, а из окружающего раствора внутрь клетки - отрицательным.
В экспериментах было обнаружено, что, если поднять мембранный потенциал φM выше порогового, то сначала течет ток внутрь клетки (фаза 1), а затем из клетки наружу (фаза 2) (рисунок 118).
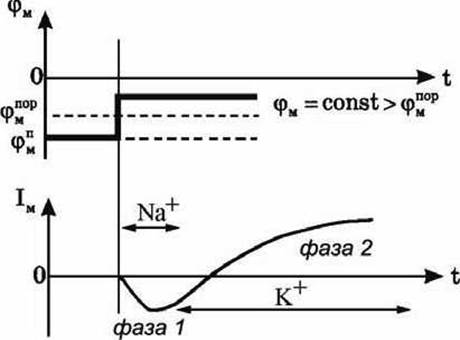
Рисунок 118 - Результаты исследований мембранного тока методом фиксации напряжения
В экспериментах, проведенных Ходжкиным, Хаксли, Бейкером, Шоу, было доказано, что фаза 1 мембранного тока связана с потоком ионов натрия из окружающей среды (где концентрация натрия больше) в клетку (где она меньше), а фаза 2 объясняется вытеканием ионов калия из клетки наружу.
В своих опытах Ходжкин и Хаксли изменяли ионный состав окружающего раствора. Было обнаружено, что, если снаружи убирали натрий, то пропадала первая фаза мембранного тока (ток внутрь клетки). Следовательно, первая фаза развития потенциала действия связана с увеличением проницаемости мембраны для ионов натрия. Поток положительных частиц в клетку и приводит к деполяризации мембраны - внутренняя её поверхность заряжается положительно по отношению к наружной.
Во второй фазе резко увеличивается проницаемость мембраны для калия, и из клетки наружу выходят положительно заряженные ионы калия, в то время как натриевый ток уменьшается.
Ионный механизм развития потенциала действия был окончательно доказан в эксперименте Ходжкина, Бейкера и Шоу, в котором аксоплазму препарированного аксона заменили на наружный раствор, а ионный состав наружного раствора сделали таким же, как у нормальной аксоплазмы.
При такой замене ионных составов разность потенциалов на мембране изменила знак. Теперь в покое внутренняя поверхность мембраны была заряжена положительно по отношению к наружной. А потенциал действия оказался отрицательным.
Ходжкин и Хаксли предположили, что селективное (избирательное) изменение ионной проницаемости возбуждённой мембраны: сначала для Na+, а потом для К+ - объясняется тем, что в мембране имеются специальные ионные каналы (предположительно, это поры, образованные белковыми молекулами).
Они предположили также, что существуют отдельно натриевые и калиевые каналы, которые открываются и закрываются во время прохождения через данный участок мембраны нервного импульса.
В первой фазе - открываются натриевые каналы, во второй фазе - калиевые. А закрываются, соответственно, сначала натриевые каналы, а затем калиевые. Открывание и закрывание ионных каналов вызывается изменением мембранного потенциала.
Одним из доказательств наличия в мембране ионных каналов было обнаружение веществ-ингибиторов, блокирующих ионные потоки через мембрану.
Так, содержащийся в рыбе фугу тетродотоксин блокирует поступление внутрь клетки натрия и, таким образом, нарушает передачу нервного импульса, что может привести к летальному исходу. Доказано, что тетродотоксин не влияет на проницаемость клетки для калия, значит, ионы натрия и калия на самом деле проходят через разные каналы. Из-за своего специфического строения молекулы тетродотоксина закупоривают только натриевые каналы.
Подсчитав число застрявших в мембране молекул тетродотоксина, удалось определить количество натриевых каналов. В разных нервных волокнах позвоночных оно было разным - от 3 до 75 каналов на один квадратный микрометр площади мембраны (для сравнения, количество молекул фосфолипидов порядка 2∙106 мкм-2).
Был обнаружен и специфический ингибитор калиевых каналов - тетраэтиламмоний. Если обработать мембрану тетродотоксином, блокирующим натриевые каналы, в опытах с фиксацией мембранного потенциала пропадает первая фаза (рисунок 118), а тетраэтиламмоний, прекращающий перенос через мембрану калия, вызывает исчезновение второй фазы.
Экспериментально ионный ток удаётся разделить на отдельные компоненты путем замены Na+ в среде на непроникающие катионы холина. В этом случае кинетическая кривая включает только К+-компонент.
На рисунке 119 показаны наблюдаемые кривые I(t). Если аксон погружен в морскую воду, полный ток I = INa + IК изображается кривой 1. При замене Na+ холином наблюдается чистый калиевый ток — кривая 2. Разность этих двух кривых - кривая 3 - даёт натриевый ток INa.
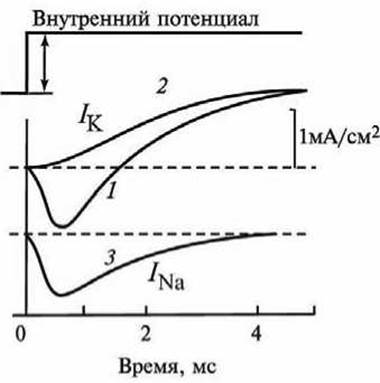
Рисунок 119 - Мембранный ток и его компоненты
При быстром смещении потенциала внутри волокна на +56 мВ ("короткое замыкание" мембраны) натриевая проводимость gNa сначала быстро растет от нуля до 25∙10° Ом-1∙см-2, а затем убывает (рисунок 120).
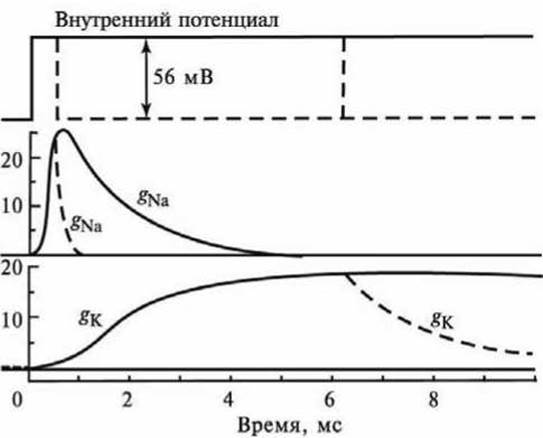
Рисунок 120 - Изменение натриевой и калиевой проводимости при деполяризации мембраны на 56 мВ: сплошными линиями показана проводимость при длительной деполяризации, штриховыми - при реполяризации мембраны через 0,6 и 6,3 мс
Калиевая проводимость медленно возрастает и через 5 мс достигает постоянного уровня. При реполяризации мембраны натриевая проводимость убывает значительно быстрее, чем калиевая.
Таким образом, было установлено, что формирование потенциала действия вызывается ионными потоками через мембрану: сначала ионов натрия внутрь клетки, а затем — ионов калия из клетки в наружный раствор, что связано с изменением проводимости мембраны для ионов калия и натрия.