Биологические мембраны - А. Н. Огурцов 2012
Электрогенез биомембран
Неравновесная термодинамика биомембран
Сродство химической реакции
Перейдем теперь от рассмотрения закрытых систем, к открытым системам, в которых происходят постоянные притоки и оттоки вещества. В этом случае изменение термодинамического потенциала в зависимости от состава системы происходит не только за счёт протекания химических реакций, но и за счёт притока вещества из внешней среды - существуют потоки вещества через границу системы. Роль химического потенциала как "источника" сил, формирующих эти потоки вещества можно проиллюстрировать следующим примером. Если в ведро с водой капнуть каплю синих чернил, то они будут постепенно диффундировать из области высокой концентрации до тех пор, пока концентрация чернил не выровняется по всему объёму ведра, вода при этом приобретет равномерную бледно-голубую окраску. Значение химического потенциала в концентрированном растворе выше, чем в разбавленном, и разность химических потенциалов играет ту же роль в установлении потоков вещества, что и температурный градиент при теплопереносе.
В ходе химической реакции синхронно расходуются молекулы исходных веществ и образуются молекулы продуктов реакции. Например, в реакции синтеза аммиака
N2 + 3Н2 = 2NH3
при образовании двух молей аммиака расходуется один моль азота и три моля водорода. Поэтому сохраняется постоянной величина, называемая степенью полноты реакции
![]()
где dni - изменение количества і -го компонента системы в ходе реакции; vi - соответствующий стехиометрический коэффициент с учётом правила знаков (в данном примере vN2 = -1, vH2 = -3, vNH3 = +2).
Изменение энергии Гиббса в этой реакции
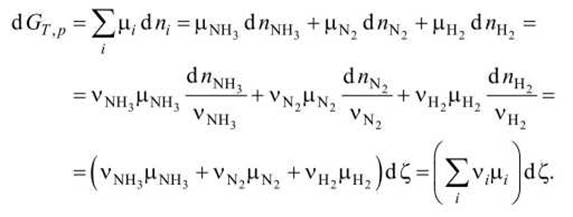
Сродством химической реакции называется сумма
![]()
![]()
При термодинамическом равновесии dG = 0, а, следовательно, A = 0. Для рассматриваемой нами реакции N2+ 3Н2 = 2NH, условие
![]()
или, иначе,
![]()
является условием равновесия химической реакции.
Перед достижением равновесия dG < 0, следовательно,
![]()
Изменение во времени энергии Гиббса
![]()
где
![]()
- скорость химической реакции.
Условие ![]() может быть только в случае, когда А и v имеют один и тот же знак.
может быть только в случае, когда А и v имеют один и тот же знак.
В рассматриваемом примере перед достижением равновесия молекулы аммиака образуются, поэтому скорость реакции положительна, следовательно, сродство А для синтеза аммиака тоже величина положительная
![]()
Реакция самопроизвольно идёт слева направо до тех пор, пока сродство положительно. Если, например, в равновесную смесь добавить некоторое количество аммиака (сохраняя
неизменным реакционный объём), то сродство для синтеза аммиака становится величиной отрицательной, но в то же самое время сродство для образования водорода и азота из распавшихся молекул аммиака будет величиной положительной, и реакция будет протекать в обратном направлении.
В состоянии равновесия
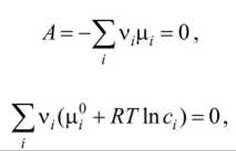
или
![]()
Правая часть равенства представляет собой стандартное сродство химической реакции при данной температуре - стандартное изменение энергии Гиббса химической реакции
![]()
С другой стороны
![]()
откуда следует
![]()
Для рассматриваемой реакции
![]()
откуда следует
![]()
Для произвольной реакции
![]()
можно записать
![]()
Таким образом, зная стехиометрическое уравнение реакции, с помощью табличных значений химического сродства можно рассчитать константу равновесия и предсказать возможность протекания реакции.
Если в открытой системе проходят необратимые процессы, тогда изменение энтропии можно представить как
![]()
где de S - изменение энтропии за счёт обмена с внешней средой; di S - производство (прирост) энтропии в самой системе вследствие необратимых процессов таких, как теплопроводность, диффузия, химические реакции. Так как вследствие химической реакции, изменение массы і -го компонента при химическом преобразовании имеет вид dmi = viMidζ, то
![]()
где vi - стехиометрический коэффициент; ni - число молей вещества; Mi - молярная масса; ζ - степень полноты реакции.
Энтропия является полным дифференциалом, и изменение энтропии S(n1,n2,...ni) запишется как
![]()
Поскольку
![]()
следовательно,
![]()
или
![]()
Общее изменение энтропии в открытой системе с учётом обмена энергией с внешней средой имеет вид
![]()