МІКРОБІОЛОГІЯ - М.Г. Сергійчук - 2008
Розділ 5. МЕТАБОЛІЗМ МІКРООРГАНІЗМІВ
КАТАБОЛІЗМ АЕРОБНИХ ХЕМООРГАНОТРОФНИХ МІКРООРГАНІЗМІВ
Катаболізм хемоорганотрофів складається з реакцій підготовчого (периферійного) та основного метаболізму. При підготовчому метаболізмі відбувається підготовка субстрату до включення в основні катаболічні шляхи: розщеплення великих полімерних молекул на дрібніші фрагменти та мономери (наприклад, гідроліз крохмалю, пектину, целюлози, орто- та мета-розщеплення ароматичних сполук тощо). Ці реакції не постачають клітині енергію, а, навпаки, є енерговитратними. Чим складніша будова субстрату, чим більше реакцій необхідно для його розщеплення, тим більше енергії мікроорганізм витрачає на синтез необхідних ферментів. Енергію і відновлені еквіваленти мікроорганізм отримує лише в реакціях основного метаболізм.у. Розглянемо реакції основного метаболізму хемоорганотрофних бактерій на прикладі катаболічного перетворення гексоз (рис. 5.3).
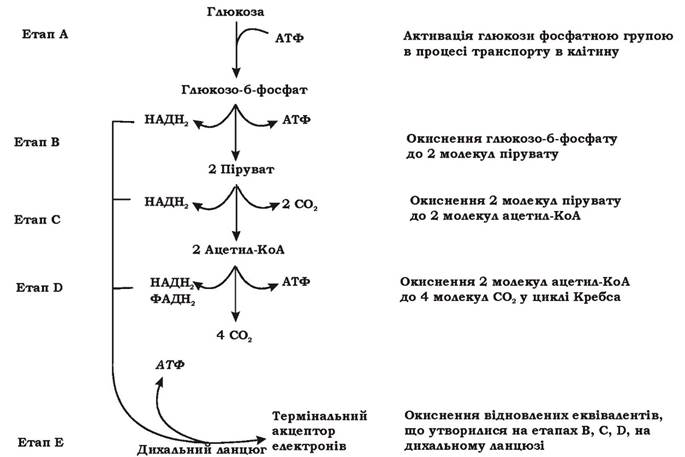
Рис. 5.3. Етапи катаболічного перетворення гексоз у мікробній клітині
Цей процес можна розділити на п'ять етапів (А-Е):
Етап А: активація молекули глюкози фосфатною групою. Цей етап пов'язаний із витратою енергії. У факультативних та облігатно анаеробних бактерій фосфорилювання глюкози відбувається при 'її транспорті у клітину за механізмом перенесення груп за допомогою фосфоенолпіруват:глюкоза-фосфотрансферазної системи.
Етап В Розщеплення глюкозо-6-фосфату до пірувату в мікроорганізмів може відбуватися трьома способами:
- гліколітичним шляхом;
- шляхом Ентнера - Дудорова;
- пентозофосфатним шляхом.
Гліколітичний шлях (рис. 5.4) є найбільш поширеним серед мікроорганізмів. За дев'ять реакцій глюкоза перетворюється у два пірувати.
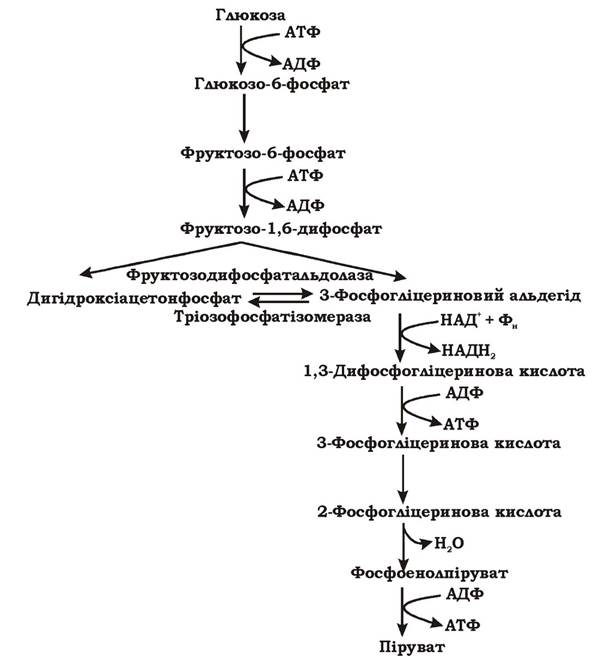
Рис. 5.4 Гліколітичний шлях перетворення гексоз (синоніми: шлях Ембдена - Мейєргофа - Парнаса, гексозодифосфатний шлях)
Гліколітичний шлях можна умовно розділити на три етапи. На першому етапі відбувається "активація" цукру шляхом його фосфорилювання. Спочатку глюкоза фосфорилюється до глюкозо-6-фосфату за рахунок витрати АТФ. В аеробних мікроорганізмів це відбувається безпосередньо у клітині при гліколізі. В анаеробів фосфорилювання глюкози здійснюється у процесі її транспорту у клітину за механізмом перенесення груп. Наступне фосфорилювання субстрату призводить до утворення фруктозо-1,6-дифосфату і також супроводжується використанням АТФ.
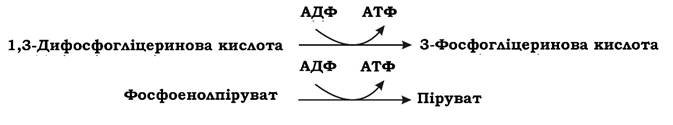
Таким чином, перший етап гліколізу є енерговитратним. На другому етапі відбувається розщеплення гексози на дві тріози. Фруктозо-1,6-дифосфат за допомогою фруктозодифосфатальдолази розщеплюється на дві фосфорильовані тріози: дигідроксіацетонфосфат та 3-фосфогліцериновий альдегід. Ці дві сполуки можуть взаємно перетворюватися за допомогою ферменту тріозофосфатізомерази. При достатній кількості неорганічних фосфатів у поживному середовищі подальше перетворення субстрату мікроорганізми здійснюють гліколітичним шляхом через 3-фосфогліцериновий альдегід, а при недостатній - за допомогою метилглюксалевого шунта через дигідроксіацетонфосфат. На третьому етапі гліколізу відбувається фосфорилювання двох молекул 3-фосфогліцеринового альдегіду неорганічним фосфором (без витрат АТФ) та їх окиснення до 1,3-дифосфогліцеринової кислоти і далі до пірувату з утворенням 4 АТФ та 2 НАДН2. Важливими метаболітами є фосфоенолпіруват (ФЕП), 3-фосфогліцеринова кислота (ФГК) та піруват. Таким чином, під час гліколізу з однієї молекули глюкози утворюється 4 АТФ та 2 НАДН2. Оскільки 2 АТФ витратилося на першому етапі, загальний енергетичний вихід становить 2 АТФ та 2 НАДН2 на одну молекулу глюкози.
АТФ утворюється в результаті фосфорилювання АДФ у двох реакціях субстратного фосфорилювання:
Метилгліоксалевий шунт. При обмеженій кількості неорганічних фосфатів у поживному середовищі фермент гліцеральдегід-3-фосфат-дегідрогеназа є недостатньо активним, тому фосфорилювання 3-фосфогліцеринового альдегіду не відбувається. Процес перетворення субстрату здійснюється обхідним шляхом через дигідроксіацетонфосфат і проміжний метаболіт метилгліоксаль. Цей обхідний метаболічний шлях називається метилгліоксалевим шунтом (рис. 5.5). Він енергетично менш вигідний, ніж гліколіз, але дозволяє клітині виживати при лімітованому джерелі фосфору в середовищі.
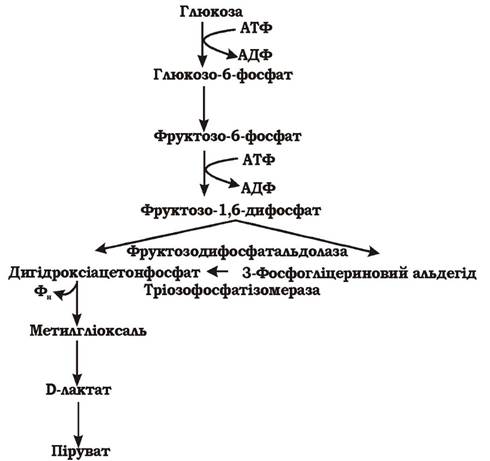
Рис. 5.5. Метилгліоксалевий шунт розщеплення гексоз
Шлях Ентнера - Дудорова (рис. 5.6) має обмежена кількість мікроорганізмів, головним чином представники роду Pseudomonas та деякі анаероби, наприклад Zymomonas mobilis.
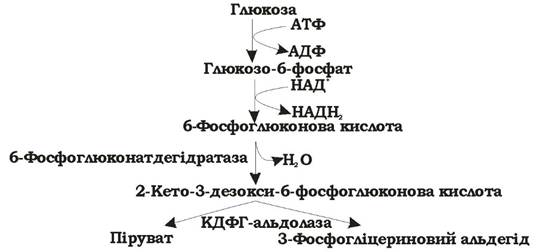
Рис. 5.6. Шлях Ентнера - Дудорова розщеплення гексоз (синоніми: 2-кето-3-дезокси-6-фосфоглюконатний шлях)
Поява цього шляху пов'язана з великою потребою прокаріотів у піру- ваті, адже тут піруват утворюється з глюкози лише за чотири реакції. У результаті витрачається 1 АТФ і утворюється 1 НАДН2. Основний ключовий метаболіт цього шляху - 2-кето-3-дезокси-6-фосфоглюконова кислота (КДФГ), а специфічні ферменти - 6-фосфоглюконат-дегідратаза та КДФГ-альдолаза. Шлях Ентнера - Дудорова має декілька точок перетину з пентозофосфатним та гліколітичним шляхами, тому в разі необхідності може на них переключатися.
У результаті розщеплення глюкози пентозофосфатним шляхом (рис. 5.7) витрачається 1 АТФ, відновлюються 2 НАДФН2, відщеплюється 1СО2 і синтезуються сполуки з різною довжиною вуглецевого скелету: С3,С4,С5,С7, необхідні для подальшого біосинтезу. На рівні спільних метаболітів (3-фосфогліцеринового альдегіду) пентозофосфа- тний шлях може переключатися на гліколіз. Таке комбінування двох шляхів дає можливість клітині не лише отримати метаболіти для анаболізму та відновлені еквіваленти, а й АТФ. Пентозофосфатний шлях може функціонувати як цикл за рахунок конденсації двох молекул 3-фосфогліцеринового альдегіду або за рахунок ізомеризації фруктозо-6-фосфату. У такому випадку після п'яти обертів циклу молекула глюкози повністю окиснюється до 6СО2.
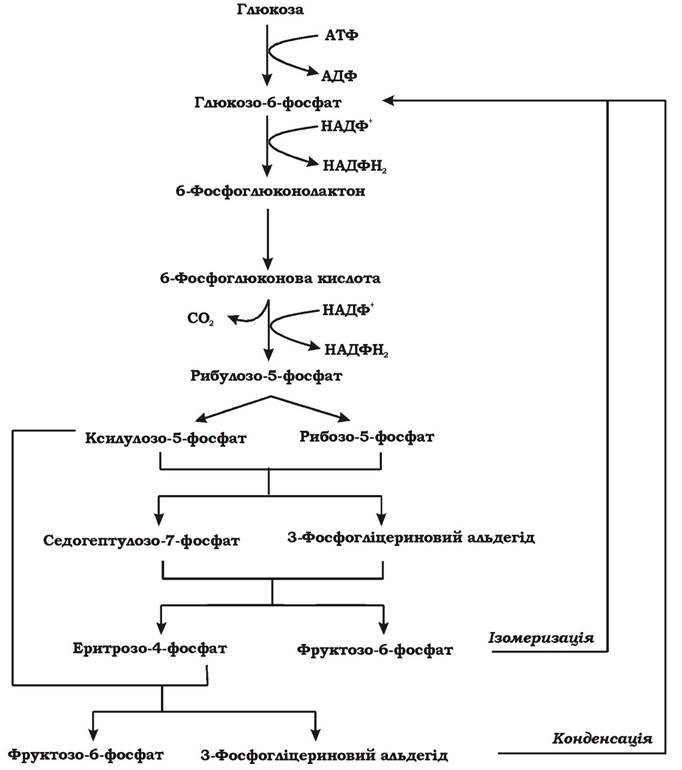
Рис. 5.7. Пентозофосфатний шлях розщеплення гексоз (синоніми: окисний пентозофосфатний шлях, гексомонофосфатний шлях, фосфоглюконатний шлях, шлях Варбурга - Діккенса - Хорекера)
Етап С: Окиснення пірувату до ацетил-КоА. Мікроорганізми цей етап можуть здійснювати чотирма способами (табл. 5.3).
Таблиця 5.3. Шляхи окиснення пірувату мікроорганізмами
Мікроорганізми |
Реакція |
Ферменти |
Облігатні аероби |
Піруват + КоА + НАД+ → ацетил-КоА + НАДН2 + СО2 |
Піруват- дегідрогеназа |
Облігатні анаероби: Clostridium |
Піруват + КоА + 2 Фд+ → ацетил-КоА + 2 ФдН2 + СО2 |
Фередоксин- оксидоредуктаза |
Факультативні анаероби, що утворюють форміат: Enterobacteriaceae; фототрофи |
Піруват + КоА → ацетил-КоА + форміат |
Форміатліаза |
Дріжджі |
Піруват оцтовий альдегід + СО2 |
Піруват- декарбоксилаза |
Етап D: Окиснення ацетильної групи ацетил-КоА до СО2 у циклі Кребса (рис. 5.8).
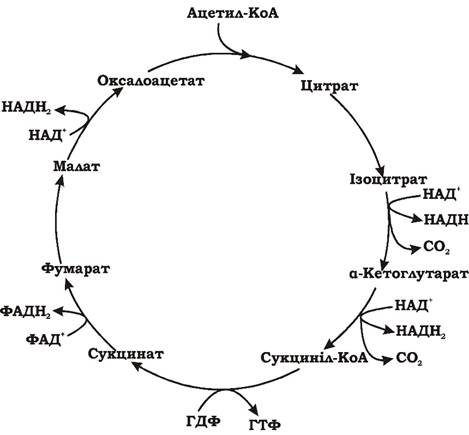
Рис. 5.8. Окиснення ацетил-КоА у циклі Кребса (синоніми: цикл трикарбонових кислот (ЦТК), цикл цитринової кислоти)
Молекула оцтової кислоти при своїх малих розмірах і порівняно простій будові є досить стійкою до хімічного окиснення. Живі клітини у процесі еволюції пристосувалися використовувати складний обхідний шлях окиснення ацетил-КоА. Спочатку ацетил-КоА, об'єднавшись із ок- салоацетатом (щавлево-оцтова кислота, ЩОК), утворює цитринову кислоту. Далі відбувається дегідрування і декарбоксилювання цитрату, що значно легше, ніж пряме окиснення ацетату. Таким чином, основна мета циклу Кребса - окиснення ацетату (ацетил-КоА) до 2СО2. Паралельно з цим процесом у циклі Кребса з 1 ацетил-КоА утворюється 1 ГТФ, 3 НАДН2, і ФАДН2. Цей цикл також має велике значення для анаболізму, оскільки ряд його метаболітів (α-кетоглутарова та щавлево-оцтова кислоти) використовуються клітиною для біосинтезу амінокислот. ГТФ у циклі Кребса утворюється в такій реакції:
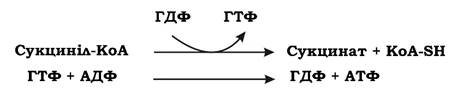
ГТФ може передавати свою кінцеву фосфатну групу на АДФ з утворенням АТФ. Отже ця реакція належить до субстратного фосфорилювання.
Етап Е Окиснення відновлених коферментів, що утворилися на етапах В, С і D на дихальному ланцюзі.
Дихальний ланцюг - це сукупність великої кількості переносників і ферментів, які фізично зв'язані з матрексом мембран і занурені в їхній ліпідний шар. В еукаріотів дихальний ланцюг в основному локалізований на внутрішній мембрані мітохондрій, а у прокаріотів - на цитоплазматичній мембрані та її утвореннях (мезосомах), направлених усередину клітини.
Переносники в дихальному ланцюзі мають такі властивості.
- розміщені в міру зростання їхнього окисно-відновного потенціалу від -320 мВ (ОВП системи НАДН2/НАД+) до +810 мВ (ОВП системи 1/2 О2/Н2О);
- здатні до зворотного окиснення та відновлення;
- забезпечують плавне перенесення електрона від відновленого еквівалента (НАДН2, ФАДН2) до термінального акцептора (за аеробних умов до О2);
- розміщені в мембрані в безпосередній близькості один до одного, тому електрон передається від одного переносника до іншого без затримки;
- переносники в мембрані утворюють петлі, в яких переносники електронів повернені до зовнішнього боку мембрани, а переносники атомів водню - до внутрішнього.
За хімічною природою переносники поділяються на:
- флавопротеїни;
- залізосірчані білки;
- хінони;
- цитохроми.
Флавопротеїни - це низькопотенційні переносники атомів водню, побудовані на основі вітаміну рибофлавіну. флавінмононуклеотид (ФМН) і флавінаденіндинуклеотид (ФАД). ФМН є простетичною групою ферменту НАДН2-дегідрогенази (Е-ФМН). Функція Е-ФМН полягає в окисненні НАДН2, приєднанні до себе атомів водню і подальшій передачі їх по дихальному ланцюгу. ФАД є простетичною групою ферменту сукцинат-дегідрогенази (Е-ФАД). Функція Е-ФАД полягає в окисненні сукцинату (у циклі Кребса), приєднанні до себе атомів водню і подальшій передачі їх по дихальному ланцюгу (рис. 5.9).
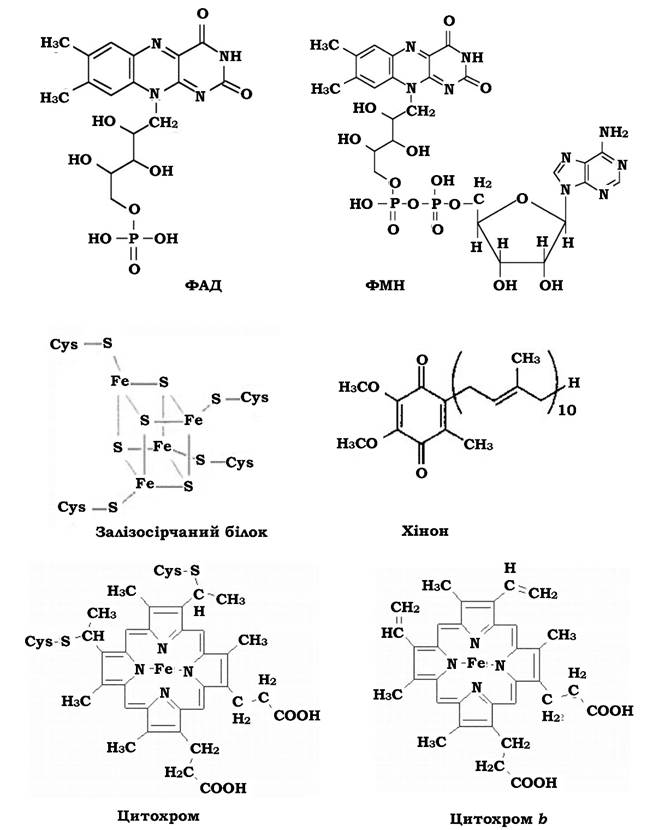
Рис. 5.9. Будова деяких переносників дихального ланцюга
Залізосірчані білки (залізосіркопротеїди) - це ферменти, що містять 18 атомів заліза в негемовій формі. Атоми заліза, у свою чергу, зв'язані з атомами кислотолабільної сульфідної сірки. Атоми сірки на периферії молекули належать до чотирьох залишків цистеїну поліпептидного ланцюга ферменту. Кожна Fe-S-група називається центром або кластером. Найбільш поширені у природі залізосірчані білки чотирьох типів: рубре- доксин (містить 1 Fe-S кластер), 2 Fe-S-, 4 Fe-S- та 8 Fe-S-фередоксини. Залізосірчані білки переносять електрони (рис. 5.9).
Хінони на відміну від інших переносників не "зафіксовані" в мембрані, а "розчинені" в їхніх ліпідах. Існує кулька типів хінонів: убіхінон (позначається Q або СоQ, зустрічається у грампозитивних бактерій), менахінон (у E.coli), нафтохінон (у деяких грамнегативних бактерій). Хінони відновлюються атомами водню. Відновлена форма убінінону називається убіхінолом (QH2). Хінони відновлюються атомами водню. Електрони вони приймають від залізосірчаних білків, а протони - з цитоплазми. Якщо водень надходить з Е-ФАД, то хінон приймає його у вигляді атома.
Цитохроми - це гемопротеїди (рис. 5.9), які містять простетичну групу, що є похідною гема (циклічного тетрапіролу з атомом Fe). Окисна форма заліза цитохромів (Fe-III) відновлюються електронами до закисної форми (Fe-II), тобто цитохроми переносять електрони. Їх ОВП залежить від будови і властивостей білкової частини молекули і коливається від -290 до +290 мВ. Цитохроми позначаються літерами латинського алфавіту (a, b, c, d, o, сco), часом із зазначенням довжини хвилі α-смуги, наприклад, b557. У бактерій, що дихають анаеробно, наприклад у Shewanella frigidimanna, містяться мультигемові цитохроми (тетра-, дека-гемові). Цитохроми можуть утворювати комплекси, наприклад цитохромоксидаза aa3.
На рис. 5.10 наведено схематичну будову мітохондріального дихального ланцюга. Чергування переносників атомів водню і електронів призводить до транслокації протонів через мембрану. В еукаріотів протони виділяються з внутрішньомітохондріального простору назовні мітохондрій, а у прокаріотів - з цитоплазми в периплазматичний простір.
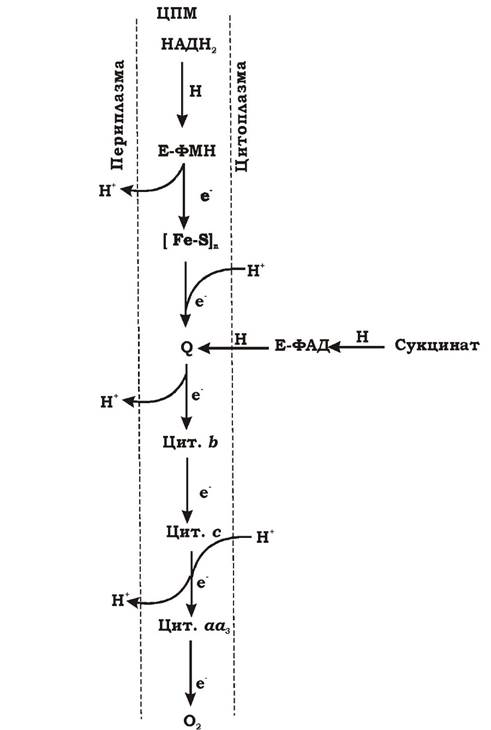
Рис. 5.10. Схематична будова мітохондріального дихального ланцюга (вказані можливі пункти виносу протонів назовні - пункти фосфорилювання): Е-ФМН, Е-ФАД - флавопротеїни: Е-ФМН — НАДН2-дегідрогеназа; Е-ФАД - сукцинат-дегідрогеназа; [Fe-S]n - залізосірчані білки; Q - хінон; b, c, aа3- цитохроми; Н - атом водню; Н+ - протон; е- - електрон
У процесі функціонування електрон-переносних ланцюгів на мембранах виникає градієнт електрохімічного потенціалу іонів водню (ΔμН+), який є рушійною силою процесу фосфорилювання АДФ. ΔμН+ складається з електричного (різниця електричних потенціалів Δφ) і осмотичного (концентраційного - ΔрН) компонентів:
![]()
де Δφ - мембранний потенціал; R - універсальна газова стала; T - абсолютна температура; F - число Фарадея.
Одиниця вимірювання ΔμН+- Дж/моль. Для переведення цієї одиниці у вольти значення ΔμН+ необхідно поділити на число Фарадея. Одержана частка називається протонрушійною силою і позначається символом р:
![]()
Згідно із хеміосматичною гіпотезою Мітчела, протони повертаються назад через мембрану лише в місцях локалізації АТФ-синтетази (АТФази). У результаті цього відбувається реакція фосфорилювання АДФ до АТФ:
![]()
На дихальному ланцюзі АТФ утворюється під час окисного фосфорилювання. Оскільки утворення градієнта протонів за рахунок проходження електрона по дихальному ланцюгу призводить до утворення АТФ, місця виносу протонів називаються пунктами фосфорилювання. У мітохондріальному дихальному ланцюзі їх три:
- між Е-ФМН та залізосірчаними білками;
- між хіноном та цитохромами;
- на цитохромі аа3.
На кожні два електрони, що переносяться з НАДН2 на кисень, можуть фосфорилюватися три молекули АТФ, а з ФАДН2 - 2 АТФ.
Теоретичний вихід АТФ при хемоорганотрофному аеробному метаболізмі за оптимальних умов складає 38 молекул АТФ (688 ккал) на одну молекулу глюкози (рис. 5.11).
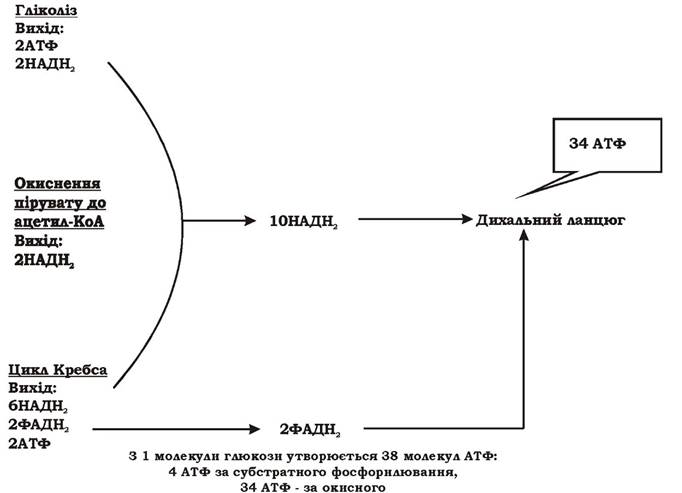
Рис. 5.11. Теоретичний вихід АТФ при хемоорганотрофному аеробному метаболізмі
Це найбільш енергетично вигідний тип метаболізму в мікроорганізмів. В аеробних хемоорганотрофів присутнє і субстратне і окисне фосфорилювання, причому завдяки переносу електронів по дихальному ланцюгу на кисень організм отримує у вісім з половиною разів більше енергії, ніж при прямому розщепленні субстрату. Однак потрібно враховувати, що за реальних умов частина відновлених еквівалентів використовується на біосинтез і не досягає дихального ланцюга, частина протонів використовується для активного транспорту та обертання джгутиків і не надходить на АТФ-синтетазу. Тому такий підрахунок виходу АТФ має лише теоретичне значення.
Дихальні ланцюги прокаріотів, на відміну від еукаріотів, надзвичайно різноманітні. Склад переносників та кількість пунктів фосфорилювання, а отже і вихід АТФ, залежить від багатьох чинників: ОВП донора та акцептора електронів, типу метаболізму мікроорганізмів, умов довкілля.
Неповне окиснення органічних сполук. Зазвичай аеробні хемоорганогетеротрофні мікроорганізми прості органічні субстрати частково окиснюють до СО2 та Н2О, а частково використовують для біосинтезу. Проте за деяких умов у середовищі можуть накопичуються органічні кислоти (оцтова, піровиноградна, глюконова, цитринова тощо) та деякі спирти (ацетоїн, бутандіол). Це явище часом називають "аеробним бродінням», однак його механізм і причини принципово відрізняються від класичного анаеробного бродіння. Неповне окиснення має практичне значення і використовується в біотехнологіях для отримання цінних речовин.
Неповне окиснення органічних речовин може відбувається з таких причин:
1. У зв'язку з особливостями метаболізму бактерій (наприклад, Acetobacter, Gluconobacter);
2. За аномальних фізіологічних умов (наприклад, виділення грибами органічних кислот через брак у середовищі макро- та мікроелементів і бацилами - через надлишок вуглеводів).
Типовими бактеріями, що здійснюють неповне окиснення завдяки особливостям метаболізму, є оцтовокислі бактерії - група грамнегативних хемоорганогетеротрофних аеробів. До них належать близькос- поріднені роди Acetobacter та Gluconobacter, які внаслідок надлишку спирту або цукру окиснюють їх з утворенням органічних кислот.
Бактерії роду Gluconobacter окиснюють молекулу етанолу до ацетату та 2 НАДН2. Відновлені еквіваленти скеровуються на дихальний ланцюг для окисного фосфорилювання, а ацетат накопичується в середовищі. Це відбувається тому, що окиснення ацетил-КоА у циклі Кребса в них неможливе через відсутність ряду ферментів, а саме: α- кетоглутаратдегідрогенази, ізоцитратліази та малатсинтетази.
Бактерії роду Acetobacter мають повний цикл Кребса. Однак спочатку вони окиснюють весь етанол до ацетату, який накопичується в середовищі. Лише після повного використання етанолу бактерії починають окиснювати ацетат.
У лабораторних та промислових умовах гриби родів Rhizopus, Mucor, Circinella, Aspergillus можуть виділяти в середовище молочну, глюконову, щавлеву, цитринову, ітаконову, фумарову, яблучну, бурштинову, мурашину кислоти при нестачі заліза, мангану, міді, магнію, калію чи кальцію. Це відбувається за рахунок порушення регуляції метаболізму мікроорганізмів.
Більшість представників Bacillus при рості на високих концентраціях вуглеводів накопичують у середовищі ацетат, піруват, ацетоїн та бутандіол, які потім використовуються клітинами на стадії спороутворення.
Особливості катаболізму метилотрофів. Метилотрофні бактерії (метилотрофи) - облігатно аеробні прокаріоти, які утилізують од- новуглецеві сполуки, більш відновлені, ніж форміат, як єдине джерело вуглецю та енергії. Особливістю метаболізму цих бактерій є те, що весь потік вуглецю в них проходить через такий токсичний проміжний продукт, як формальдегід.
Субстратом для метилотрофів є ряд різноманітних речовин, що містять один атом вуглецю або більше, але не мають С-С-зв'язків. Такі сполуки зазвичай називаються одновуглецевими або С1-сполуками:
- метан (СН4);
- метанол (СН3ОН);
- форміат (СНООН);
- формальдегід (НСОН);
- формамід (HCONH2);
- метильовані аміни (метиламін, диметиламін, триметиламін),
- метильовані сірковмісні сполуки.
Названі вище речовини є органічними, тому метилотрофні бактерії за типом метаболізму слід відносити до хемоорганогетеротрофів. У той же час використання метилотрофами С1-сполук в енергетичному та конструктивному метаболізмі призвело до формування в них специфічних шляхів асиміляції та дисиміляції цих сполук, відмінних від типових для хемоорганогетеротрофних мікроорганізмів.
Метанотрофні бактерії (метанотрофи) - це підгрупа метилотрофів. Вони унікальні за своєю здатністю утилізувати метан як єдине джерело вуглецю та енергії. Визначальною особливістю метанотрофів є наявність ферменту метанмонооксигенази, який каталізує реакцію окиснення метану до метанолу. Метан - найстабільніша сполука вуглецю в анаеробному середовищі. Він виділяється в довкілля з анаеробних екологічних ніш і аеробно окиснюється метанотрофами.
Окиснення метану відбувається в кілька етапів (рис. 5.12).
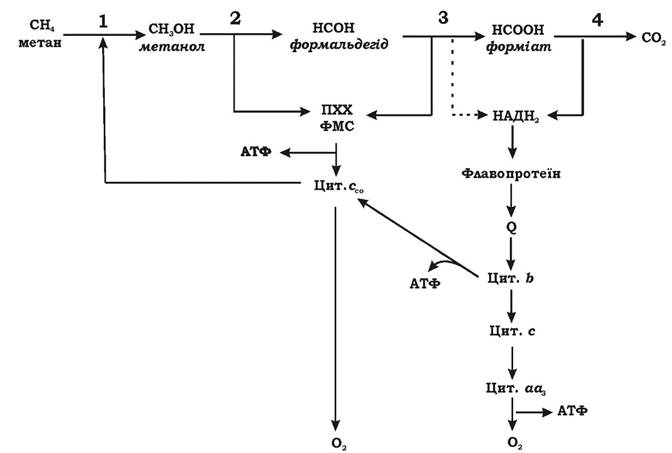
Рис. 5.12. Можлива схема енергетичного обміну в Methylosinus trichosporium: ПХХ - піролохінолінхінон; ФМС - феназинметасульфат
Етап 1. Метан окиснюється до метанолу. Реакція відбувається у присутності молекулярного кисню і каталізується ферментом метан- монооксигеназою (ММО). Цей фермент за допомогою двох відновлених еквівалентів розщеплює зв'язок О-О у молекулі кисню. Один атом кисню при цьому відновлюється до води, а другий включається в метан з утворенням метанолу (СН3ОН):
![]()
де О2 - молекулярний кисень, а Н2А - відновник. З наведеної реакції стає зрозумілою облігатна залежність окиснення метану від молекулярного кисню.
У метанотрофів існує дві форми ММО: нерозчинна, зв'язана з частками мембран, (p-ММО) і розчинна (s-ММО). Донором електронів для першої можливо є відновлений цитохром с або НАДН2, що утворився в результаті зворотного електронного транспорту, для другої - тільки НАД(Ф)Н2, або сполуки, що окиснюються при його утворенні. Етап окиснення метану до метанолу не пов'язаний з отриманням клітиною енергії.
Етап 2. Метанол окиснюється до формальдегіду. Метанол, який утворився з метану на першому етапі чи надійшов з довкілля в результаті розщеплення пектину чи лігніну, окиснюється до формальдегіду за допомогою метанолдегідрогенази (МДГ): периплазматичної (у грамнегативних метилотрофів) чи зв'язаної з НАД (у грампозитивних метилотрофів). МДГ належить до особливого класу ферментів - хінопротеїдів. Простетичною групою МДГ є піролохінолінхінон (ПХХ), який також називають метоксантином. Перехід ПХХ з окисненої форми до відновленої (ПХХН4) пов'язаний з перенесенням чотирьох електронів. Цей процес відбувається у дві стадії (рис. 5.13) і має місце як на етапі окиснення метанолу (етап 2), так і на етапі окиснення формальдегіду (етап 3).
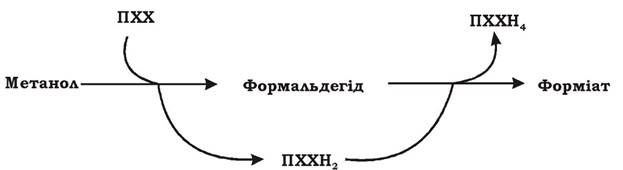
Рис. 5.13. Двостадійне відновлення піролохінолінхінону (ПХХ)
1. ПХХ приєднує два електрони і перетворюється в ПХХН2. При цьому метанол окиснюється до формальдегіду (етап 2).
2. ПХХН2 приєднує ще два електрони і перетворюється в ПХХН4. При цьому формальдегід окиснюється до форміату (етап 3).
МДГ проявляє свою активність у присутності такого переносника електронів, як феназинметасульфат (ФМС). Електрони, що відірвалися від метанолу та формальдегіду при їх окисненні, за допомогою ПХХ через ФМС передаються на цитохром ссо.
Етап 3. Формальдегід окиснюється до форміату. Цей етап може відбуватися трьома способами:
1. За рахунок другої стадії відновлення ПХХ метанолдегідрогенази (МДГ) (етап 2).
2. За рахунок НАД+-залежної формальдегіддегідрогенази. Оскільки ОВП реакції окиснення формальдегіду до форміату становить -440 мВ, то немає термодинамічної заборони для перенесення електронів від формальдегіду до НАД+, тобто на цьому етапі можливе функціонування переносника піридиндинуклеотиду.
3. Можливе окиснення формальдегіду за циклічним механізмом без використання ферментів дегідрогеназ.
Етап 4. Форміат окиснюється до діоксиду вуглецю. Це відбувається за рахунок НАД+-залежної форміатдегідрогенази. Ця реакція дуже важлива для метилотрофів, оскільки вона є основним джерелом відновлення НАД+.
Електронотранспортна система метилотрофів за своїм складом та локалізацією дуже схожа на дихальний ланцюг більшості аеробних еубактерій. В окисному кометаболізмі С1-сполук беруть участь флавопротеїни, хінони, цитохроми типів b, c, ссоa, o. Основна частина електронів подається з переносників на цитохрос с. АТФ утворюється в результаті окисного фосфорилювання.
Джерелом вуглецю в метилотрофів є формальдегід. Він асимілюється двома анаболічними циклічними шляхами:
1. Рибулозомонофосфатний шлях (шлях RuMP) характерний для родів Methylococcus, Methylomicrobium, Methylobacter, Methylomonas.
2. Сериновий шлях характерний для родів Methylocystis, Methylosinus.