МІКРОБІОЛОГІЯ - М.Г. Сергійчук - 2008
Розділ 5. МЕТАБОЛІЗМ МІКРООРГАНІЗМІВ
ОТРИМАННЯ ЕНЕРГІЇ ТА ВІДНОВЛЕННЯ ЕКВІВАЛЕНТІВ ФОТОТРОФНИМИ МІКРООРГАНІЗМАМИ
Для фотосинтезу найбільше значення має видимий спектр сонячного світла, а саме діапазон хвиль від 400 до 700 нм. Ультрафіолетові промені несуть у собі занадто багато енергії, тому вони руйнують органічні молекули (на цьому ґрунтується використання УФ-опромінення для дезинфекції), а інфрачервоні - мають недостатньо енергії для генерації хімічних реакцій і практично одразу ж перетворюються на тепло.
За механізмом фотосинтез поділяють на два типи:
1. Аноксигенний фотосинтез не супроводжується виділенням молекулярного кисню. Цей більш давній процес характерний для анаеробних прокаріотів: пурпурних бактерій, зелених бактерій, геліобактерій та аеробних аноксигенних фотосинтетиків. Особливим типом фотосинтезу, пов'язаним з каротиноїдами, характеризуються представники археїв - галобактерії.
2. Оксигенний фотосинтез, при якому молекулярний кисень виділяється в атмосферу, характерний для двох груп прокаріотичних організмів - ціанобактерій та прохлорофітів, а також для всіх еукаріотів - водоростей та вищих рослин.
Здатність організмів існувати за рахунок енергії світла пов'язана з наявністю в них специфічних фоторецепторних молекул - пігментів. Усі фотосинтезуючі пігменти належать до сполук двох хімічних класів:
- пігменти, в основі яких лежить тетрапірольна структура (хлорофіли, бактеріохлорофіли та фікобіліпротеїни) (рис. 5.20, а);
- пігменти, основу яких складають довгі поліізопреноїдні ланцюги (каротиноїди) (рис. 5.20, б).
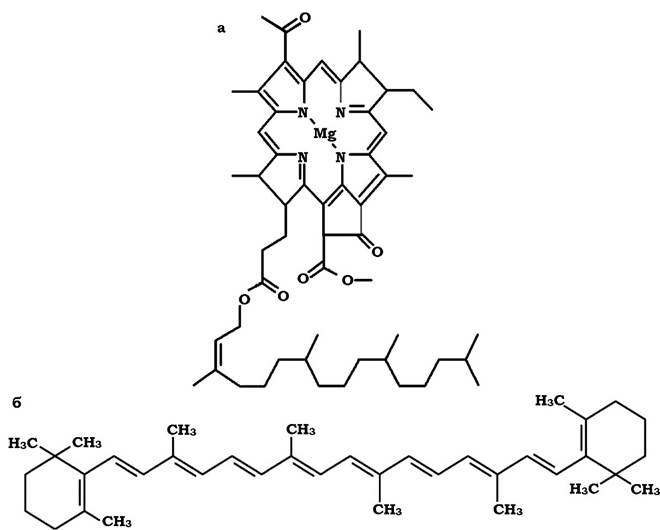
Рис. 5.20. Хімічна будова пігментів фотосинтезуючих мікроорганізмів:
а - бактеріохлорофіл; б - бета-каротин
Хлорофіли (Хл) - це магній-порфіринові пігменти. Вони складаються з чотирьох, з'єднаних між собою, пірольних кілець. Утворюють закриту циліндричну структуру. Містять метал (магній), що з'єднується з атомами азоту пірольних кілець за допомогою ковалентних та координаційних зв'язків. Ці пігменти характерні для організмів, у яких відбувається оксигенний фотосинтез. Хлорофіли прокаріотів, які здійснюють аноксигенний фотосинтез, називаються бактеріохлорофілами (Бхл). Ідентифіковано шість типів бактеріохлорофілів (a, b, c, d, e, g) та два типи хлорофілів (a та b). Хлорофіли та бактеріохлорофіли забезпечують поглинання світла в діапазоні 650-1035 нм.
Фікобіліпротеїни - червоні і сині пігменти, що складаються з білкової субодиниці та простетичної групи - фікобілінів. Фікобіліни мають чотири пірольні кільця, але на відміну від хлорофілів утворюють незамкнену структуру і не містять металу. Їх називають тетрапіролами з відкритими ланцюгами. Фікобіліпротеїни поглинають фотони в діапазоні 480-650 нм і виконують функцію світлозбиральних молекул. Для ціанобактерій характерна наявність таких фікобіліпротеїнів, як фікоеритрин, фікоціанін та алофікоціанін.
Каротиноїди - це велика група хімічних сполук, що є продуктом конденсації, як правило, восьми залишків ізопрену. За своєю будовою вони бувають аліфатичними (не містять циклічних груп) та циклічними. Якщо молекула містить ароматичне кільце на одному кінці ланцюга, то каротиноїд називається моноциклічним, якщо на двох - біциклічним. Каротиноїди, до складу яких входить кисень, належать до ксантофілів. Каротиноїди забезпечують поглинання світла в діапазоні 400-550 нм та запобігають шкідливим для клітини реакціям фотоокиснення.
За своїми функціями клітинні пігменти поділяються на основні і допоміжні. Основними пігментами є та частина бактеріохлорофілів (та хлорофілів), які входять до складу фотохімічного реакційного центру і здійснюють фотохімічну реакцію. Цю функцію виконує частина Хл а та Бхл a, b, g. Це незначна частина від загальної кількості пігментів у клітині: в аноксигенних фотосинтетиків основним є 1/25-1/50 частина бактеріохлорофілу, а в ціанобактерій - 1/30-1/100 частини хлорофілу. У галобактерій основними пігментами, що здійснюють фотохімічну реакцію, є каротиноїди. Допоміжні пігменти у клітинах фотосинтезуючих мікроорганізмів виконують такі функції:
- поглинають кванти світла і передають їх у фотореакційний центр: виконують функцію антен;
- беруть участь у фототаксисі;
- захищають клітини від фотоокиснення.
Допоміжними пігментами є значна частина Хл а, Бхл a, b, g, а також інші хлорофіли (бактеріохлорофіли), каротиноїди (крім галобактерій) та фікобіліпротеїни (у ціанобактерій).
Прокаріоти, на відміну від еукаріотів, не мають спеціальних органел для фотосинтезу (хлоропластів). У пурпурних бактерій фотосинтетичний апарат локалізований у ЦПМ та внутрішньоцитоплазматичних мембранах, у зелених бактерій - у ЦПМ та особливих структурах - хлоросомах, у ціанобактерій - у ЦПМ та фікобілісом.ах, подібних за будовою до хлоросом.
Фотосинтетичний апарат мікроорганізмів складається з трьох основних компонентів:
1. Світлозбиральних антен, що поглинають енергію світла і передають її до фотохімічних реакційних центрів. Їх ще називають фоторецепторними, світлозбиральними або антенними молекулами.
2. Фотохімічних реакційних центрів (РЦ), де відбувається трансформація електромагнітної форми енергії в хімічну.
3. Фотосинтетичних електронотранспортних систем, що забезпечують перенесення електронів, пов'язане із синтезом АТФ.
Світлозбиральні антени виконують функцію поглинання фотонів і перетворення їхньої енергії в енергію синглетно збудженого стану Бхл. У пурпурних бактерій існує два типи світлозбиральних комплексів (світлозбиральних антен):
- внутрішній (коровий) світлозбиральний комплекс, який завжди тісно пов'язаний з реакційним центром і кільцем його оточує;
- периферичний світлозбиральний комплекс, який міститься поза внутрішнім світлозбиральним комплексом і оточує його. Таких комплексів може бути один або декілька. Кількість білків у ньому збільшується при зменшенні інтенсивності освітлення.
Світлозбиральні антени мають вигляд олігомерних пігмент-білкових структур, які локалізуються у внутрішньоцитоплазматичних мембранах. Молекули каротиноїдів та Бхл нековалентно зв'язані з інтегральними мембранними білками таким чином, що тетрапірольні кільця перебувають у строго фіксованому положенні відносно один одного і площини мембрани. Пігменти, що входять до складу антени, поглинають світлову енергію і переходять у збуджений синглетний стан. Енергія цього стану передається на інші молекули пігментів і досягає реакційного центру. Частина енергії губиться у вигляді тепла чи флюоресценції. У зелених бактерій світлозбиральні антени містяться у хлоросомах (рис. 5.21) - багатих на ліпіди везикулах видовженої форми, локалізованих у цитоплазмі і зв'язаних з ЦПМ через базальну пластинку кристалічної структури. Внутрішня частина хлоросоми заповнена пучками паличкоподібних структур, що містять агрегати Бхл c, d або e. Молекули Бхл не зв'язані з білками. До складу хлоросом входять також ліпіди та каротиноїди. У базальній пластинці локалізований Бхл а, який здійснює перенесення енергії збудженого стану від хлоросом на реакційний центр.
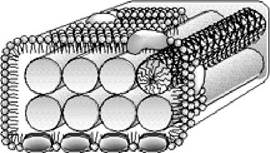
Рис. 5.21. Схематичне зображення будови хлоросоми зелених бактерій
Фотохімічні реакційні центри (РЦ). У фототрофних організмів виявлено два типи реакційних центрів: РЦ І та РЦ ІІ:
1. РЦ І присутній у зелених сіркових бактерій (наприклад, Chlorobium limicola, Prosthecochlorum aestuarii), геліобактерій (наприклад, Heliobacterium chlorum, Heliobacillus mobilis), ціанобактерій, водоростей та вищих рослин.
2. РЦ ІІ присутній у сіркових та несіркових пурпурних бактерій, зелених несіркових бактерій, ціанобактерій та фототрофних еукаріотів.
Реакційний центр І. Первинним донором електронів служить спеціальна пара молекул Бхл (у зелених бактерій це димер Бхл а, у геліобактерійдимер Бхл g). ОВП цих донорів дорівнює +240 мВ. Первинний донор переходить у збуджений стан, отримуючи енергію від збудженого Бхл світлозбиральних антен. Електрон від сильно відновленого первинного донора подається на первинний акцептор, яким є мономерний Бхл (ізомер Хл а), а потім на хінон А, залізосірчаний білок [4Fe-4S] та на хінон В.
Реакційний центр ІІ (хіноновий тип). Первинним донором електронів служить спеціальна пара молекул Бхл а або Бхл b, яка переходить у збуджений стан, отримуючи енергію від збудженого Бхл світлозбиральних антен. Електрон від сильно відновленого первинного донора подається на первинний акцептор, яким є допоміжний Бхл а, а потім на бактеріофеофітин (Бфф) і далі - на хінон А та хінон В.
Таким чином, у реакційних центрах відбувається трансформація світлової енергії в енергію розподілу зарядів (мембранний потенціал - Δφ і різницю окисно-відновних потенціалів на мембрані - ΔΕh). Розподіл зарядів відбувається між первинним донором електронів (димером Хл чи Бхл), локалізованим на зовнішній стороні ЦПМ, та вторинним акцептором електронів (хінонами у випадку РЦ ІІ чи залізосірчаними білками у випадку РЦ І).
Фотосинтетичні електронотранспортні системи здійснюють подальше перенесення електрона, що відщепився від первинного донора, через систему переносників. Такий транспорт забезпечує створення електрохімічного протонного потенціалу ΔμΗ+. Електрон- транспортна система містить комплекс цитохромів bC1 та цитохром c2. Комплекс цитохромів bC1 функціонує як протонна помпа, створюючи ΔμΗ+. Відновлений цитохром С2 переносить електрони на первинний донор електронів РЦ.
Механізм аноксигенного фотосинтезу. Світлозбиральні антени, до складу яких входять Бхл та каротиноїди, поглинають енергію світла в діапазоні 400-1100 нм і передають її на фотохімічний реакційний центр (першого чи другого типу - РЦ І чи РЦ ІІ).
У темряві молекула бактеріохлорофілу у РЦ перебуває у стабільному незбудженому стані, а її електрони - на основному енергетичному рівні. ОВП реакційного центру складає приблизно +500 мВ. Коли квант світла через світлозбиральні антени потрапляє на молекулу бактеріохлорофілу РЦ, його електрон поглинає порцію енергії кванта і переходить на більш багатий енергетичний рівень, а молекула бактеріохлорофілу - у збуджений стан. При цьому ОВП збудженого реакційного центру зменшується приблизно до -700 мВ. Тобто при поглинанні кванта світла реакційним центром його ОВП зменшується майже на 1200 мВ, а молекула бактеріохлорофілу стає активним відновником. Вона є первинним донором електронів. У збудженому стані молекула бактеріохлорофілу РЦ перебуває дуже короткий час (10-9-10-13 с).
Відірвавшись від збудженого первинного донора, електрон переноситься на первинний акцептор, потім на вторинний акцептор та рухається далі по фотосинтетичній електронотранспортній системі до термінального акцептора.
Рух електрона може здійснюватися у двох напрямках:
1. Назад до молекули бактеріохлорофілу, від якої він відірвався (рис. 5.22, 1) Таке переміщення електрона називається циклічним транспортом. У результаті циклічного перенесення електрона відбувається транслокація протонів через ЦПМ і утворення градієнта протонів, який є джерелом синтезу АТФ. Такий механізм утворення АТФ називають фотофосфорилюванням.
2. Електрон не повертається до бактеріохлорофілу, а переноситься на НАД+ чи окиснений фередоксин (Фд+), які потім використовуються як відновлені еквіваленти в реакціях анаболізму (рис. 5.22, 2). Таким чином, електрон, що покинув молекулу бактеріохлорофілу, виводиться із "системи". Виникає незамкнений потік електронів, що називається нециклічним транспортом.
У фотосинтезуючих бактерій можлива наявність або лише циклічного транспорту (пурпурні та зелені нитчасті бактерії), або одночасне функціонування обох типів перенесення електронів. Незалежно від напрямку руху електрона, що відірвався від бактеріохлорофілу, клітина відчуває недостачу електронів. Адже при циклічному транспорті не вистачає електронів для утворення відновлених еквівалентів, а при нециклічному - для заповнення електронної "вакансії" бактеріохлорофілу. Тому фототрофні організми потребують додаткових джерел електронів - екзогенних донорів. Екзогенними донорами електронів можуть бути органічні сполуки (у фотоорганотрофів) або неорганічні (у фотолітотрофів). Неорганічними екзогенними донорами електронів є відновлені сполуки сірки (H2S, SO32-, тіосульфат, тетратіонат, тіогліколят), а також молекулярний водень.
Електрони, що вивільнюються при окисненні екзогенних донорів, використовуються клітиною для:
а) заповнення електронної "вакансії" бактеріохлорофілу;
б) відновлення НАД+.
ОВП всіх можливих екзогенних донорів достатньо низьке для того, щоб передати електрон на окиснений бактеріохлорофіл без витрат енергії. Це здійснюється за рахунок перенесення електрона по електронотранспортній системі за електрохімічним градієнтом (від переносників з нижчими значеннями ОВП до вищих) (рис. 5.22, 3). У випадку транспортування електрона від екзогенного донора на НАД+, процес може відбуватися двома способами:
1. Якщо донором електронів є молекулярний водень, ОВП якого -420 мВ, відновлення НАД+ відбувається без витрат енергії (рис. 5.22, 4).
2. Якщо донорами електронів є відновлені сполуки сірки або сукцинат, ОВП яких значно вищий, ніж ОВП НАД+/НАДН2, електрони переносяться по електронотранспортній системі за механізмом зворотного транспорту проти електрохімічного градієнта із витратою енергії (рис. 5.22, 5).
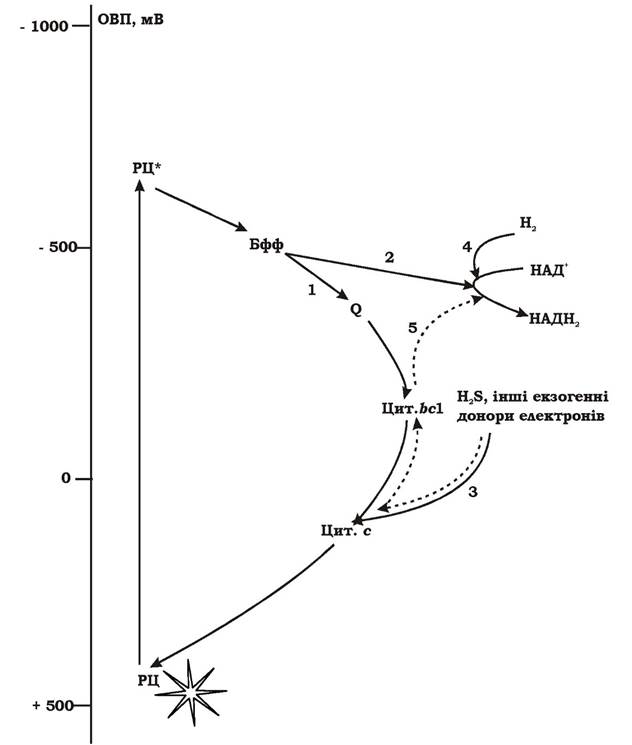
Рис. 5.22. Загальна схема перенесення електронів при аноксигенному фотосинтезі:
РЦ - реакційний центр; РЦ* - реакційний центр із збудженим бактеріохлорофілом; Бфф - бактеріофеофітин; Q - убіхінон; bС1, c - цитохроми; 1-5 - шляхи перенесення електронів від бактеріохлорофілу та екзогенних донорів
Пурпурні бактерії - це різноманітна за морфологією група грамнегативних прокаріотів, яка налічує понад 50 видів, мешкає у прісних водоймах та морських осадах і здатна здійснювати аноксигенний фотосинтез. Пурпурні бактерії містять бактеріохлорофіли а або b та понад 50 різних каротиноїдів (наприклад, спірілоксантин, родопін, родопінал, сфероїден). Ті бактерії, що мають бактеріохлорофіл а, поглинають сонячне світло з довжиною хвилі до 950 нм. У видів з бактеріохлорофілом b максимум поглинання в червоній частині спектру зсунутий у довгохвильову область більш ніж на 100 нм і припадає на 1020-1030 нм. Завдяки каротиноїдам пурпурні бактерії використовують і короткі хвилі 400-550 нм. Поєднання бактеріохлорофілу b та каротиноїдів дозволяє їхнім клітинам рости в дуже широкому діапазоні світлових хвиль і відповідно - у багатьох екологічних нішах, недоступних для інших фотосинтетиків. Саме кількість і склад каротиноїдів визначають колір пурпурних бактерій, який може бути рожевим, червоним, помаранчевим, пурпурним, коричневим, жовто- зеленим. Синтез пігментів залежить від віку культури, складу поживного середовища, інтенсивності освітлення, наявності кисню. Найкраще пігменти синтезуються при помірному освітленні за анаеробних умов. За цих же умов найкраще йде і фотосинтез.
У пурпурних бактерій фотосинтетичний апарат локалізований у ЦПМ та внутрішньоцитоплазматичних мембранах.
Екзогенними донорами електронів у них можуть бути як органічні (сукцинат, фруктоза), так і неорганічні сполуки (сульфід та інші відновлені сполуки сірки, молекулярний водень, відновлене залізо). Окиснення відновлених сполук сірки відбувається через проміжний продукт - елементарну сірку: H2S → S0^ SO42-. Залежно від локалізації елементарної сірки, пурпурні бактерії поділяють на сіркові та несіркові (рис. 5.23). Сіркові пурпурні бактерії толерантні до високої концентрації сульфіду, а несіркові - чутливі.
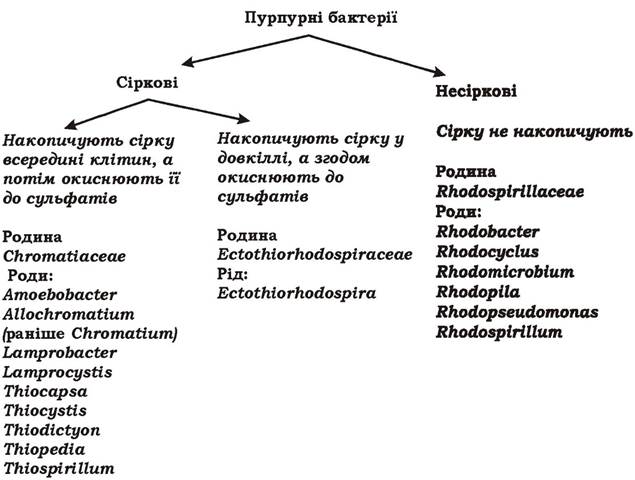
Рис. 5.23. Систематика пурпурних бактерій
За типом метаболізму пурпурні бактерії є найбільш екзотичною групою прокаріотів. Вони можуть рости фотолітоавтотрофно, фотоорганогетеротрофно, хемолітоавтотрофно та хемоорганогетеротрофно. У деяких випадках окремі види можуть здійснювати всі чотири типи метаболізму. У табл. 5.6 наведено можливі типи метаболізму несіркової пурпурної бактерії Rhodospirillum rubrum за анаеробних умов.
Таблиця 5.6. Умови, за яких може рости Rhodospirillum rubrum
Тип метаболізму |
Джерело енергії |
Джерело електронів |
Джерело вуглецю |
Фотолітоавтотрофний |
Світло |
H2S |
СО2, СО |
Фотоорганогетеротрофний |
Світло |
Сукцинат |
Сукцинат |
Хемоорганогетеротрофний |
Хімічні зв'язки |
Фруктоза |
Фруктоза |
Для пурпурних сіркових бактерій основний спосіб існування - фотолітоавтотрофія. Усі представники цієї групи можуть рости при освітленні в анаеробних умовах на середовищі з СО2 - як єдиному джерелі вуглецю, використовуючи як екзогенний донор електронів відновлені сполуки сірки чи молекулярний водень. Органічні речовини можуть слугувати для них лише як додаткові джерела вуглецю чи фактори росту, зрідка - як донори електронів. Усі види можуть фотометаболізувати ацетат і піруват, і лише деякі здатні існувати повністю фотоорганогетеротрофно. Раніше вважалося, що пурпурні сіркові бактерії дуже чутливі до кисню, але наразі вже відомо, що деякі види є аеротолерантними і навіть здатними рости хемолітотрофно при низькій концентрації кисню, використовуючи його як термінальний акцептор електронів. Для деяких видів Ectothiorhodospira та Thiocapsaдоведений аеробний хемоорганогетеротрофний ріст. Деякі пурпурні сіркові бактерії виявляють здатність рости в темряві за анаеробних умов, зброджуючи деякі цукри чи органічні кислоти.
Пурпурні несіркові бактерії мають схильність до фотоорганогетеротрофного способу життя, як джерела електронів і вуглецю вони використовують жирні кислоти, спирти, цукри, амінокислоти. Багато видів можуть рости і фотолітоавтотрофно. Джерелом електронів для них є молекулярний водень, а часом і відновлені сполуки сірки. Деякі представники цієї групи ростуть у темряві за мікроаерофільних або аеробних умов, отримуючи енергію при аеробному диханні. У них активно функціонують цикл Кребса, гліколіз та інші шляхи хемоорганотрофного метаболізму. Серед представників Rhodobacter виявлено здатність рости в анаеробних умовах при окисненні органічних сполук шляхом нітратного дихання чи бродіння. Таким чином, у пурпурних несіркових бактерій існують різноманітні способи отримання енергії - фотосинтез, аеробне та анаеробне дихання, бродіння.
Коли пурпурні несіркові бактерії ростуть аеробно в темряві, їхні мембрани є типовими для грамнегативних організмів. Клітини безбарвні або жовтуваті і містять дуже мало фотосинтезуючих пігментів. Анаеробні умови та освітлення призводять до радикальних змін у структурі їхніх клітин і мембран: починається інвагінація та утворення внутрішньоцитоплазматичних мембран, у яких розміщується фотосинтетичний апарат.
Зелені бактерії - це невелика група бактерій, що здійснюють ано- ксигенний фотосинтез. Їхній фотосинтетичний апарат розміщений у ЦПМ та особливих структурах - хлоросомах. Ці мікроорганізми поділяють на дві підгрупи: зелені сіркові бактерії та зелені несіркові (нитчасті) бактерії (рис. 5.24, табл. 5.7).
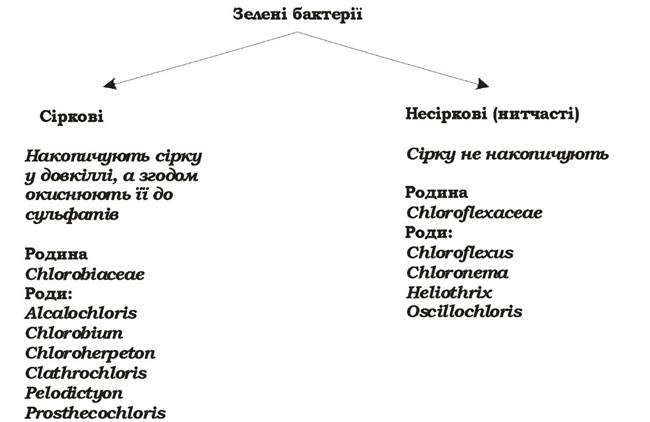
Рис. 5.24. Систематика зелених бактерій
Зелені сіркові бактерії - грамнегативні одноклітинні нерухомі форми, облігатні анаероби і облігатні фотолітотрофи. Як джерело вуглецю вони використовують СО2. Деякі органічні сполуки (обмежена кількість цукрів, органічних кислот, амінокислот) зелені сіркові бактерії можуть асимілювати як додаткові джерела вуглецю, але ніколи як основне джерело вуглецю чи екзогенні донори електронів. Екзогенними донорами електронів для них є H2S, S0, Nа2S2О3, H2. Під час окиснення сульфіду, яке відбувається в периплазмі, на першому етапі утворюється елементарна сірка, яка накопичується завжди поза клітиною. Після вилучення H2S із середовища, S0 поглинається клітинами й окиснюється до сульфату в периплазматичному просторі. Тобто зелені сіркові бактерії ростуть фотолітоавтотрофно. Вони містять бактеріохлорофіли c, d, e та незначну кількість бактеріохлорофілу а.
Таблиця 5.7. Основні морфологічні та фізіолого-біохімічні відмінності між зеленими сірковими та несірковими (нитчастими) бактеріями
Ознака |
Зелені бактерії |
|
Сіркові |
Несіркові (нитчасті) |
|
Організація |
одноклітинна |
багатоклітинна |
Рухливість |
нерухливі (виняток Chloroherpeton) |
рухливі (ковзання) |
Запасні речовини |
глікогеноподібний полісахарид |
полі- β - оксимасляна кислота |
Відношення до температури |
мезофіли |
мезофіли та термофіли |
Донори електронів при фотосинтезі |
Н2S, S0, Na2S2O3, H2 |
органічні сполуки, H2S, H2 |
Джерела вуглецю |
СО2, органічні сполуки як додаткові джерела |
органічні сполуки, СО2 |
Відношення до кисню |
облігатні анаероби |
факультативні анаероби |
Зелені сіркові бактерії існують у вузьких екологічних нішах: освітлених анаеробних водних шарах озер чи прибережних осадах.
Зелені несіркові (нитчасті) бактерії складаються з багатьох паличкоподібних клітин, часто оточених слизовою піхвою. Клітинна стінка в них грамнегативна, але не ригідна, а гнучка, завдяки чому вони мають ковзний рух. Серед них є мезофіли та термофіли. Зелені несіркові бактерії - факультативні анаероби та фототрофи, надають перевагу органічним екзогенним донорам електронів. Так, Chloroflexus auranticus на світлі росте в аеробних та анаеробних умовах у присутності цукрів, спиртів, органічних кислот та амінокислот. Деякі штами цього виду здатні до анаеробного фотолітоавтотрофного росту, використовуючи як донори електронів Н2 чи H2S. Окиснення H2S призводить до утворення молекулярної сірки і відкладанню її в середовищі у вигляді аморфної маси, яка потім у дуже незначних кількостях окиснюється до сульфату. Можливий також хемоорганогетеротрофний ріст за аеробних, а для деяких штамів і за анаеробних умов. Зелені несіркові бактерії містять бактеріохлорофіли с чи d, а їхні антенні молекули локалізовані у хлоросомах.
Геліобактерії - облігатно анаеробні фотобактерії, що здійснюють аноксигенний фотосинтез і містять єдиний бактеріохлорофіл д, який відсутній у інших фотосинтетиків. Наразі описано чотири роди геліобактерій: Heliobacterium (H. chlorum, H. gestii, H. sulfidophilum, H. undosum, H. modesticaldum), Heliobacillus (H. mobilis), Heliophilum (H. fasciatum) та Heliorestis (H. daurensis, H. baculata). Бактеріохлорофіл g за своєю будовою нагадує і Хл а вищих рослин, і Бхл пурпурних та зелених бактерій. Максимум поглинання Бхл g становить 788 нм (біля інфрачервоної області). У клітинах геліобактерій виявлено також незначну кількість особливих С30-каротиноїдів (інші фотосинтетики містять С40-похідні). Іншою відмінністю геліобактерій від прокаріотичних фотосинтетиків є відсутність фотосинтетичних внутрішньоцитоплазматичних мембран (як у пурпурних) та хлоросом (як у зелених бактерій). Їхні пігменти локалізовані лише в ЦПМ. Первинним донором електронів у геліобактерій є Бхл g, а первинним акцептором - особлива форма хлорофілу (не бактеріохлорофілу) а, яка називається гідроксихлорофілом а. Це вказує на філогенетичний зв'язок між геліобактеріями та оксигенними фотосинтетиками. Геліобактерії ростуть лише за анаеробних умов, але мають як фото-, так і хемотрофний метаболізм. Фотоге- теротрофний ріст відбувається на світлі у присутності деяких органічних джерел вуглецю: пірувату, лактату, ацетату, бутирату з СО2, етанолу з СО2. У жодного виду геліобактерій не виявлено фотоавтотрофного метаболізму, оскільки в них відсутні відомі шляхи фіксації СО2. Хемо-
гетеротрофний метаболізм геліобактерії здійснюють лише за рахунок збродження пірувату. Інші органічні речовини їхній хемогетеротрофний ріст не підтримують. Дихання в геліобактерій відсутнє. Виявлено види, здатні до азотофіксації. Геліобактерії живуть у звичайних і затоплених ґрунтах, їх виділяють з мікробних матів гарячих джерел і содових озер, але ніколи - з води та донних осадів. Термофільним є вид Heliobacterium modesticaldum, а алкаліфільними (ростуть при рН 9,0) Heliorestis daurensis та Heliorestis baculata.
Аеробні аноксигенні фотосинтетики були виділені з аеробних морських пісків та ціанобактеріальних матів. Серед них зустрічаються мезофільні, термофільні, галотолерантні та алкаліфільні види. Наразі аеробні аноксигенні бактерії віднесено до восьми родів. Два з них - Erythrobacter та Roseobacter - були виділені з моря, а шість - Erythromicrobium, Roseococcus, Porphyrobacter, Acidiphilium, Erythromonas та Sandaracinobacter - з прісних екологічних ніш. За морфологією вони досить різноманітні: Erythrobacter та Sandaracinobacter - типові тонкі палички, що можуть утворювати ланцюжки; рід Roseococcus - коки; Porphyrobacter та Erythromonas - кокоподібні палички.
Більшість видів аеробних аноксигенних фототрофів рухливі, мають 1-3 джгутики. Новий штам (JF-1), виділений з глибоководної гідротермальної морської води, має плеоморфну клітину. Залежно від віку і складу середовища клітини можуть бути коками, мати вигляд бобів або утворювати нитки з кількох клітин.
Пігменти аеробних аноксигенних фототрофів складаються з великої кількості (близько 20) незвичайних каротиноїдів та бактеріохлорофілу. Каротиноїди визначають червоно-рожево-помаранчеве забарвлення клітин і мають піки поглинання в діапазоні 420-550 нм. У більшості видів переважають біциклічні каротиноїди - зеаксантин та β-каротин. Ці бактерії містять всього один тип бактеріохлорофілу - Бхл а, причому в 10-20 разів менше, ніж анаеробні фототрофи. Максимум поглинання Бхл а в комплексі з білками лежить у діапазоні 800-870 нм. Співвідношення кількості каротиноїдів та Бхл а у клітині становить від 1 : 8 до 1 : 10 відповідно.
У клітинах аеробних аноксигенних фототрофів пігменти локалізуються в основному в ЦПМ. Внутрішньоцитоплазматичні мембрани починають утворюватися лише за умов зменшення парціального тиску кисню та освітлення в довкіллі. Функцію світлозбиральних антен виконують каротиноїди та Бхл а, а до складу фотореакційного центру входить Бхл а і тетрагемові цитохроми с з низько- та високопотенційними гемами. Електронотранспортна система містить різноманітні убіхінони (Q8, Q9, Q10) та менахінони (МК8 чи МК9), але в меншій кількості, ніж у пурпурних бактерій. Присутні також різноманітні цитохроми типу с, b, а. Фотофосфорилювання аеробні аноксигенні фотосинтетики можуть здійснювати лише у присутності молекулярного кисню.
Ці бактерії мають лабільний гетеротрофний метаболізм і здатні до окиснення ряду органічних субстратів: цукрів, жирних кислот, амінокислот. У них виявлено активні ферменти шляху Ентнера - Дудорова, циклу Кребса та гліоксилатного циклу. Кілька видів мають ферменти циклу Кальвіна і можуть рости автотрофно. Наявність світла стимулює асиміляцію СО2. Ці бактерії акумулюють у клітинах запасні речовини у вигляді глікогену та поліфосфатів.
Фотосинтетична активність аеробних фототрофних бактерій не є їх основним джерелом енергії, але в той же час вона робить певний внесок у створення електрохімічного потенціалу на ЦПМ.
Особливий механізм аноксигенного фотосинтезу галобактерій.
Галофіли - це мікроорганізми, які живуть у гіперсолоному довкіллі. Легкі галофіли витримують концентрацію NaCl до 5 %, помірні - до 20 %, а екстремальні - до 30 %. Високий осмотичний тиск у солоному середовищі спричинює видалення з клітини води та денатурації білків. Тому до галофілів належать організми, які здатні урівноважувати осмотичний тиск довкілля та мають механізми захисту від денатуруючої дії солей. Адаптація мікроорганізмів до високої концентрації солей (осморегуляція) може здійснюватися двома способами:
1. Осморегуляція за рахунок сумісних осморегуляторних органічних речовин Осмотична рівновага у клітині підтримується завдяки накопиченню в цитоплазмі дрібних, добре розчинних у воді молекул гліцерину, арабітолу, цукрів та їхніх похідних, амінокислот та їхніх похідних, бетаїну, ектоїну тощо. Накопичення може здійснюватися як шляхом біосинтезу, так і за рахунок поглинання цих сполук із середовища. Концентрація сумісних осморегуляторних органічних речовин у клітині залежить від концентрації солей у довкіллі. Структура й активність ферментів мікроорганізмів, що мають такий тип осморегуляції, не залежать від концентрації цих сполук у цитоплазмі. Осморегуляція за рахунок сумісних осморегуляторних органічних речовин притаманна більшості галофільних та галотолерантних організмів.
2. Осморегуляція за рахунок створення у клітині високої концентрації солей забезпечується тим, що клітина активно виводить назовні NaCl і накопичує всередині KCl. Концентрація KCl всередині клітини підтримується на рівні концентрації NaCl у довкіллі (приблизно 4М), тобто галотолерантність забезпечується утворенням градієнта концентрації Na+ та K+. При такому типі адаптації ферменти і структурні компоненти клітини пристосовані до високої концентрації солі (білки містять багато кислих амінокислот; конформація і активність ферментів підтримується високою концентрацією солей). Такий тип осморегуляції притаманний лише анаеробним галофільним бродильникам порядку Haloanaerobiales та аеробним екстремально галофільним археям порядку Halobactenales.
Аеробні екстремально галофільні археї (порядок Halobactenales) отримують додаткову енергію за рахунок нетипових фотохімічних реакцій. Ці бактерії мають аеробний хемоорганотрофний метаболізм. Вони окиснюють глюкозу шляхом Ентнера - Дудорова, а протонрушійну силу створюють в основному під час дихання. Однак у зв'язку з тим, що підтримання осматичного балансу у клітині потребує великих витрат енергії, а розчинність кисню в солоній воді дуже мала, у галобактерій існує додатковий механізм отримання АТФ за рахунок світла.
Поверхня галобактерій складається з червоних та пурпурних мембран. Червоні мембрани містять велику кількість каротиноїдів, які виконують фоторепаративну функцію (руйнують тимінові димери, що утворюються під впливом ультрафіолету). У червоних мембранах локалізований типовий дихальний ланцюг з трьома пунктами фосфорилювання, де і відбувається дихання.
Пурпурні мембрани займають приблизно 50 % поверхні галобактерій. Вони містять до 75 % родопсинів і беруть участь у фотосинтезі. В археїв відомо чотири типи родопсинів: два з них - бактеріородопсин і галородопсин - беруть участь у функціонуванні іонних насосів, а інші два виконують роль фоторецепторів при фототаксисі.
Бактеріородопсин складається з білка бактеріоопсину та хроматофору ретиналю, що ковалентно з'єднується з цим білком. Ретиналь, у свою чергу, є похідною β-каротину (каротиноїду) й утворюється при його окисному розщепленні у присутності молекулярного кисню. Саме ретиналь надає мембрані характерного пурпурного кольору. Світло адсорбується пурпурними мембранами. Під дією світла ретиналь віддає протон (переходить у депротонізовану форму) і знебарвлюється. Протон виходить у довкілля, створюючи градієнт електрохімічного потенціалу іонів водню (ΔμH+), який є рушійною силою процесу синтезу АТФ. Депротонізований ретиналь бактеріородопсину відновлюється за рахунок протона, що надходить з цитоплазми. Таким чином, ретиналь діє як протонний насос і викачує протони назовні клітини.
Галородопсин - це також білок, що містить ретиналь. Вважається, що ця сполука більше поширена серед галобактерій, ніж бактеріородопсин. Під дією світла галородопсин заносить у клітину іони хлору (Cl-). Оскільки іони хлору мають негативний заряд, перенесення хлориду всередину клітини за енергією є еквівалентом до винесення
протонів назовні. Таким способом галобактерії генерують градієнт іонів хлору, який також є джерелом енергії.
На відміну від класичного фотосинтезу, де АТФ утворюється за рахунок циклічного перенесення електрона хлорофілу, у галобактерій трансмембранний потенціал створюється за допомогою каротиноїдів.
На рис. 5.25 наведено можливі шляхи транспорту іонів у аеробних галофільних археїв. Як видно з рисунку, градієнт протонів у галобактерій створюється трьома способами: за рахунок аеробного дихання на червоних мембранах (рис. 5.25, 1); за допомогою світла через бактеріо- родопсин на пурпурних мембранах (рис. 5.25, 2); у випадку недостатньої кількості протонів у периплазмі за рахунок гідролізу АТФ, що утворилося в реакціях субстратного фосфорилювання, на АТФазі (рис. 5.25, 3). Градієнт електрохімічного потенціалу іонів водню (ΔμH+), що утворився наведеними вище способами, використовується галоба- ктеріями для синтезу АТФ на АТФазі (рис. 5.25, 3) та для винесення катіонів Na+ з клітини, що необхідно для осморегуляції (рис. 5.25, 4). Висока концентрація K+ у клітині забезпечується за рахунок уніпорту (рис. 5.25, 6). Cl- надходить у клітину двома способами: за рахунок симпорту з Na+ (рис. 5.25, 7) та за рахунок фотохімічних процесів на галородопсині (рис. 5.25, 8).
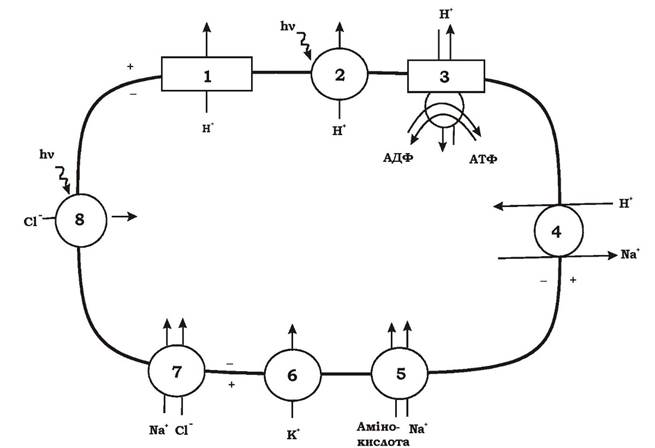
Рис. 5.25. Транспорт іонів в аеробних галофільних археїв:
1 - винесення протонів у процесі дихання; 2 - винесення протонів за допомогою світла через бактеріородопсин; 3 - утворення АТФ за рахунок градієнта протонів на АТФ-синтетазі; 4 - електрогенний натрій/протоновий антипорт; 5 - транспорт амінокислот за рахунок градієнта натрію; 6 - калієвий уніпорт, що викликається мембранним потенціалом; 7 - світлонезалежна система транспорту хлориду, можливо, пов'язана із внесенням у клітину натрію; 8 - внесення іонів хлору за допомогою світла через галородопсин
Механізм оксигенного фотосинтезу. Оскільки джерела відновлених сполук сірки і молекулярного водню у природі досить обмежені, важливим еволюційним кроком стало використання організмами води як нового екзогенного донора електронів. Однак ОВП системи Н2О/Н2 дорівнює +810 мВ, тому електронна "вакансія" в молекулі бактеріофілу реакційного центру, що виникає при нециклічному транспорті електронів, не може бути заповнена безпосередньо електроном молекули води. Щоб це стало можливим, необхідно, по-перше, "відірвати" їх від термодинамічно стійкої молекули Н2О і, по-друге, "підняти" їх на більш високий енергетичний рівень, що дало б змогу включитися в описану вище фотосистему. Цю проблему було вирішено шляхом утворення додаткової пігментної системи - фотосистеми ІІ. Вона пов'язана з появою нових пігментів: хлорофілів a, b та фікобіліпротеїнів. Виявлено, що хлорофіл a реакційного центру фотосистеми ІІ у фотоокисненому стані має значення ОВП на рівні + 1000 - +1300 мВ, тобто достатньо позитивне для відновлення за участю електронів з молекулами води. Механізм реакцій, пов'язаних з перенесенням електронів від молекул води на пігмент Пб80, невідомий. Показано, що цей процес ступінчастий, необхідним компонентом системи є манган. Таким чином, фотосистема ІІ була добудована до фотосистеми І з метою використання води як екзогенного донора електронів. Побічним продуктом цього процесу є молекулярний кисень (рис. 5.26).
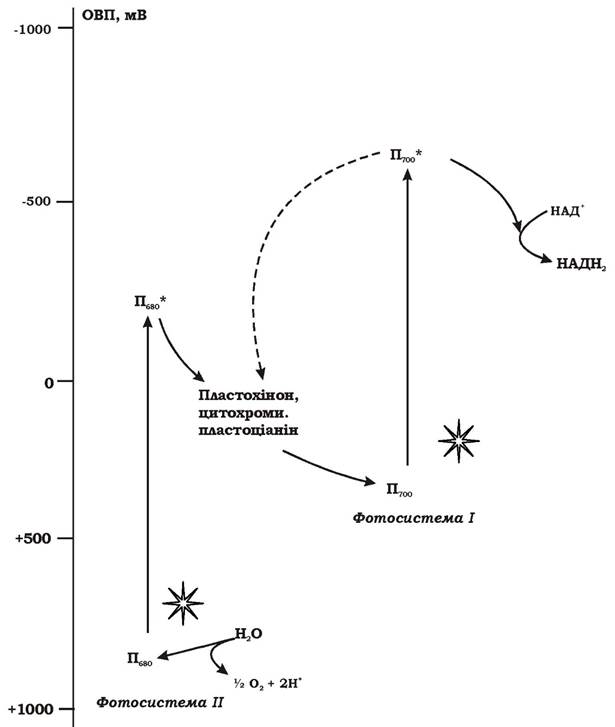
Рис. 5.26. Загальна схема перенесення електронів при оксигенному фотосинтезі
Загальна схема фотосинтезу ціанобактерій - це певна серія реакцій, яка містить дві послідовні фотореакції. Світло поглинається фоторецепторами фотосистеми ІІ (фікобіліпротеїнами, хлорофілом а, каротиноїдами) і передається на хлорофіл реакційного центру. Електрон відривається від хлорофілу і передається на пластохінон, а окиснена молекула пігменту відновлюється за рахунок електронів води. Електрон від акцептора фотосистеми ІІ проходить через ланцюг переносників до реакційного центру фотосистеми І і надходить до фотоокисненої форми хлорофілу а - пігменту П700 (ОВП = +500 мВ), заповнюючи електронну "вакансію". Перенесення електронів від пластохінону фотосистеми ІІ до реакційного центру фотосистеми І відбувається в кілька етапів за електрохімічним градієнтом. Електронний транспорт на цій ділянці на певних етапах супроводжується перенесенням протонів упоперек мембрани і відповідно синтезом АТФ. Поглинання ще одного кванта світла молекулою хлорофілу (П700) реакційного центру фотосистеми І призводить до відривання від неї електрона, який подається на молекулу Fe-S-білка, а потім, через ланцюг переносників - на НАДФ+.
Ціанобактерії (синьозелені водорості) - це велика група прокаріотів, що здійснює оксигенний фотосинтез та має різноманітні фізіологічні можливості. Усі вони мають дві фотосистеми, використовують воду як екзогенний донор електронів і виділяють молекулярний кисень. Містять хлорофіл а, фікобіліпротеїни, каротиноїди. У той же час у ціанобактерій виявлено здатність і до аноксигенного фотосинтезу, пов'язану з відключенням фотосистеми ІІ при збереженні активності фотосистеми І. За цих умов екзогенними донорами електронів є відновлені сполуки сірки, молекулярний водень та ряд органічних сполук (цукри, кислоти). Здатність ціанобактерій переключатися з одного типу фотосинтезу на інший свідчить про гнучкість їхнього світлового метаболізму. Хоча більшість ціанобактерій є облігатними фототрофами, у темряві в них виявлено активний ендогенний метаболізм, ендогенним субстратом якого служить глікоген, що накопичився на світлі. Глікоген катаболізується пентозофосфатним шляхом або гліколізом і забезпечує повне окиснення молекули глюкози. При цьому водень з НАДН2 подається на дихальний ланцюг, термінальним акцептором якого є молекулярний кисень. Відомо також, що ціанобактерії за анаеробних умов здатні до сіркового дихання. Цикл Кребса в цих бактерій "незамкнений" і виконує лише біосинтетичну функцію. Вони асимілюють СО2за циклом Кальвіна, а органічні сполуки (ацетат, піру- ват) використовують в основному лише як додаткові джерела вуглецю. Деякі види здатні до хемогетеротрофного росту, але лише на обмеженому наборі субстратів (кілька цукрів). Більш як у 250 штамів ціанобактерій виявлено здатність фіксувати молекулярний азот.
Прохлорофіти - це прокаріоти, що здатні до оксигенного фотосинтезу. На відміну від ціанобактерій вони не містять фікобіліпротеїнів. Фотосинтетичні пігменти представлені хлорофілами а і b, каротиноїдами. Основна маса останніх складена β-каротином та ксантофілом, близьким до зеаксантину. У незначних кількостях зустрічаються інші каротиноїди: ехіненон, β-криптоксантин, ізокриптоксантин тощо. Усі ці каротиноїди містяться і в ціанобактеріях. Вуглекислий газ прохлорофіти фіксують за циклом Кальвіна. Їхніми представниками є Prochloron didenmi (екзосимбіонт асцидій), Prochlorothrix hollandia (вільноживучий).