МІКРОБІОЛОГІЯ - М.Г. Сергійчук - 2008
Розділ 6. ОСОБЛИВОСТІ ФІЗІОЛОГІЇ АНАЕРОБНИХ МІКРООРГАНІЗМІВ
Анаеробне дихання
Анаеробне дихання - це процес окиснення органічних і неорганічних субстратів, при якому термінальними акцепторами електронів є:
- неорганічні речовини - окиснені аніони (SO42-, SO32-, NO3-, NO2-); катіони металів в окисненому стані (Fe3+, Mn4+), СО2; кисневмісні аніони металів (селенати, арсенати); радіонукліди (U+6, Tc+7); сполуки в окисненому стані СO2, S0);
- ряд органічних сполук - сірковмісні (диметилсульфоксид), органічні оксиди азоту (триметиламіноксид), галогеновані органічні сполуки (3-хлорбензойна кислота, тетрахлоретан), фумарат.
Залежно від природи термінального акцептора електронів анаеробне дихання буває нітратним, сульфатним, сірковим, залізним, фумаратним, вуглецевим тощо.
Розрізняють два типи анаеробного дихання:
- за участю акцепторів, що мають позитивний (високий) окисно- відновний потенціал (нітрат, нітрит, Fe3+, фумарат, диметилсульфоксид, оксиди азоту). Таке дихання характерне для факультатив - них анаеробів, воно конкурує з аеробним і пригнічується молекулярним киснем;
- за участю акцепторів, що мають негативний (низький) окисно- відновний потенціал (сірка, сульфат, карбонат). Таке дихання виявлено лише в облігатних анаеробів.
Найважливіші акцептори електронів та їхні стандартні окисно- відновні потенціали (Ео') за рН 7,0 наведено в табл. 6.1.
Таблиця 6.1. Стандартні окисно-відновні потенціали можливих акцепторів електронів при диханні
Окисно-відновна пара |
Ео', В |
НСО3-/НСО2- |
-0,41 |
Н+/Н2 |
-0,42 |
НСО3-/ацетат |
-0,35 |
НСО3-/СН4 |
-0,33 |
S0/HS- |
-0,27 |
HSO3-/HS- |
-0,12 |
SeO42-/SeO32- |
+0,02 |
Фумарат / сукцинат |
+0,03 |
Триметиламіноксид/триметиламін |
+0,13 |
Диметилсульфоксид / диметилсульфід |
+0,16 |
NO2-/NH4+ |
+0,34 |
NO 2-/ NO |
+0,35 |
NO3-/NO2- |
+0,43 |
Fe3+/Fe2+ |
+0,77 |
O2/H2O |
+0,82 |
Значення ОВП термінального акцептора електронів визначає місце виходу електрона з дихального ланцюга, а отже, кількість АТФ, що утворюється в результаті окисного фосфорилювання. Чим вище значення ОВП акцептора, тим більше енергії отримує мікроорганізм внаслідок дихання. У природних умовах, де зазвичай присутні одночасно кілька можливих акцепторів електронів, факультативні анаероби спочатку використовують найвигідніші з них - з найвищими значеннями ОВП, облігатні анаероби - лише низькопотенційні. Послідовність використання різних акцепторів електронів у кожного мікроорганізму детермінована генетично і контролюється складними регуляторними механізмами.
Нітратне дихання - це процес використання факультативно анаеробними мікроорганізмами нітрату (NO3-) як термінального акцептора електронів при анаеробному диханні. Оскільки нітрат у результаті відновлюється, нітратне дихання називають дисиміляційною нітратредукцією, а мікроорганізми, що здійснюють цей процес, - нітратредукторами, або нітратовідновлювальними.
Субстратами або донорами електронів при нітратному диханні є різноманітні органічні речовини (глюкоза, етанол, сукцинат, бензоат) і деякі неорганічні (молекулярний водень, відновлені сполуки сірки), тобто нітратредуктори можуть бути хемоорганотрофами (Pseudomonas aeruginosa), хемолітотрофами (Hydrogenomonas agilis, Thiobacillus deni- tnficans) та міксотрофами (Micrococcus denitnficans). Механізм окиснен- ня органічних субстратів при цьому, як правило, не відрізняється від тих, що мають місце за аеробних умов, тому частину АТФ нітратредуктори отримують у результаті субстратного фосфорилювання.
Відновлення нітратного азоту супроводжується зміною ступеня його окиснення та утворенням ряду проміжних продуктів, наведених у табл. 6.2.
Таблиця 6.2. Ступені окиснення ключових сполук азоту
Сполука |
Ступінь окиснення |
Амоній (NH4+) |
-3 |
Аміак (NH3) - газ |
-3 |
Молекулярний азот (N2) - газ |
0 |
Закис азоту, геміоксид азоту (N2O) - газ |
+ 1 (середній) |
Оксид азоту (NO) - газ |
+2 |
Нітрит (NО2-) |
+3 |
Нітрат (NО3-) |
+5 |
Під час нітратного дихання бактерії відновлюють нітрат двома шляхами (рис. 6.20):
1. Через нітрит до газоподібних продуктів NO, N2O, N2. Оскільки середовище при цьому позбавляється азоту, процес називають денітрифікацією. Денітрифікація -поширене явище, характерне для представників понад 40 видів бактерій: Pseudomonas (P aeruginosa., P fluorescens, P stutzen), Thauera, Alcaligenes, Paracoccus, Hyphomicrobium, Thiobacillus (T. denitdficans), Bacillus та багатьох інших.
2. Через нітрит до амонію. Цей процес отримав назву дисиміляційної (дихальної) амоніфікації. Він характерний для деяких бацил, ентеробактерій і стрептококів. На відміну від асиміляційної амоніфікації - енерговитратного відновлення нітрату до амонію з метою включення останнього у біосинтез (див. розд. 5), дисиміляційна амоніфікація відбувається з утворенням АТФ внаслідок окисного фосфорилювання. У деяких мікроорганізмів процес дисиміляційної амоніфікації може за-
тримуватися на стадії утворення нітриту до повного вичерпання запасу нітрату. Нітрит накопичується в середовищі або з часом відновлюється далі до амонію. Це характерно для Escherichia coli.
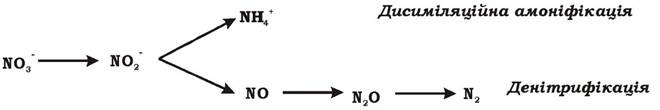
Рис. 6.20. Два шляхи відновлення нітрату бактеріями при нітратному диханні
Ферменти, що каталізують обидва шляхи відновлення нітрату, утворюються лише за анаеробних умов. Молекулярний кисень сильно інгібує активність ферментів, що беруть участь у дисиміляційній нітратредукції.
Окисне фосфорилювання при нітратному диханні має кілька складових:
1. Відновлення нітрату до нітриту (цей етап спільний для асиміляційної амоніфікації і денітрифікації).
2. Відновлення нітриту до амонію (асиміляційна амоніфікація).
3. Відновлення нітриту до газоподібних продуктів (денітрифікація).
Відновлення нітрату до нітриту здійснюється за рівнянням
NO3- + 2e- + 2H+ → NO2- + H2O
Нітрат відновлюється до нітриту на дихальному ланцюзі за рахунок НАДН2, що утворився при окисненні глюкози у гліколізі. Відновлення нітрату каталізується ферментом дисиміляційною нітратредуктазою. У бактерій існує два типи дисиміляційних нітратредуктаз: NAR та NAP. NAR з'єднана з цитоплазматичною мембраною з боку цитоплазми і функціонує за наявності в середовищі достатньої кількості нітрату. NAR - це ферментний комплекс (часом позначається як (NarGHI), що складається з трьох субодиниць: NarI, NarH, NarG (рис. 6.21).
Фермент NarI - це мультигемовий цитохром b, який містить два геми. Він приймає електрони з хінону (убіхінону чи менахінону) і переносить їх далі на мембранний білок NarH. Протони при цьому виходять у пери- плазму, що призводить до утворення трансмембранного електрохімічного протонного потенціалу. Білок NarH містить чотири Fe-S-кластери. Його функція - перенесення електронів з NarI на NarG. Білок NarG складається з Fe-S кластера і молібденовмісного кофактора - молібдоптерингуаніндинуклеотиду (МГД). Власне на МГД і відбувається відновлення нітрату до нітриту таким чином: рис. 6.22):
- оксогрупа окисненого Мо(VІ) при відновленні кофактора до Мо(ІV) втрачає воду;
- нітрат приєднується до відновленого кофактора, приймає від нього електрони і відновлюється до нітриту;
- Мо(ІV) при цьому окиснюється до Мо(VІ).
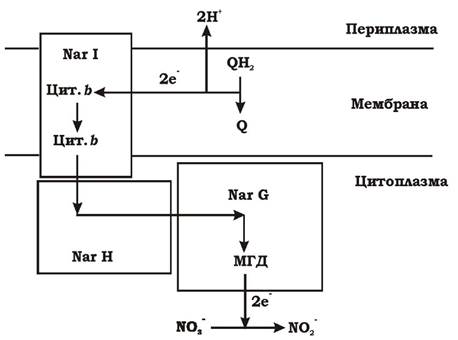
Рис. 6.21. Структура і функції нітратредуктази:
Q - убіхінон; NarI, NarH, NarG - субодиниці нітратредуктази; Цит. b - цитохром b, МГД - молібдоптерингуаніндинуклеотид
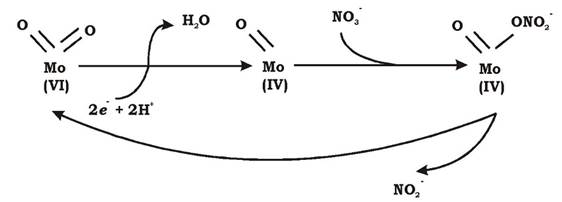
Рис. 6.22. Механізм дії МГД-кофактора NarG нітратредуктази
Нітрат відновлюється до нітриту в цитоплазмі, тому у клітині існують спеціальні механізми транспорту нітрату всередину і швидкого винесення токсичного нітриту за межі клітини.
Інший тип дисиміляційної нітратредуктази NAP функціонує у клітині при недостатній кількості нітрату в середовищі. Вона локалізована в периплазмі і складається з двох субодиниць.
Відновлення нітриту до амонію у процесі дисиміляційної амоніфікації здійснюється за рівнянням
NO2- + 3 НАД(Ф)Н + 5H+ → NH4++ 3 НАД(Ф)+ + 2H2O у три етапи. На кожному етапі на акцептор переноситься два електрони, а проміжні продукти залишаються зв'язаними з ферментами:
1. HNO2 спочатку відновлюється до HNO (N+3 → N+1).
2. HNO відновлюється до NH2OH (N+1 → N-1).
3. NH2OH відновлюється до NH4+ (N-1→ N-3).
Каталізатором цього процесу є комплекс локалізованих у периплазмі або зв'язаних з мембраною ферментів, що називаються дисиміляційними нітритредуктазами (їх є кілька типів). Цей складний фермент може приймати електрони з НАДН2-дегідрогенази та з відновленого хінону. Відновлення нітриту пов'язане з генерацію протонрушійної сили (Δρ), однак механізм дії протонного насосу не вивчений. Незважаючи на те, що при відновленні нітриту до амонію виникає градієнт протонів, АТФ практично не синтезується. Річ у тому, що нітрит - токсична для клітини сполука. Відразу ж після відновлення нітрату нітрит виноситься з цитоплазми в периплазму за допомогою протонового антипорту. Тому градієнт протонів, що утворюється при відновленні нітриту, використовується клітиною не на синтез АТФ, а на видалення нітриту. Відновлення нітриту до амонію відбувається в периплазмі. Синтез дисиміляційних нітритредуктаз пригнічується киснем.
Відновлення нітриту при денітрифікації проходить через ряд газоподібних проміжних продуктів згідно з рівняннями:
NO2- + e- + 2H+→ NO + H2O (фермент: NO-утворювальна нітритредуктаза)
2NO + 2e- + 2H+ → N2O + H2O (фермент: NO-редуктаза)
N2O + 2e- + 2H+ → N2 + H2O (фермент: N2O-редуктаза)
Деякі денітрифікатори відновлюють нітрит повністю до N2, інші не використовують нітрит, а відновлюють до молекулярного азоту NO чи N2O, деякі види можуть відновлювати нітрит до NO і N2O до N2, але не відновлюють NO до N2O.
Відновлення нітриту до NO каталізується периплазматичною NO- утворювальною нітритредуктазою. Існує дві форми цього ферменту, які одночасно не зустрічаються в одних і тих же клітинах:
- 75 % денітрифікаторів містять тетрагемовий цитохром cd1;
- 25 % бактерій містять нітритредуктазу, до складу якої входить мідь.
Обидва ці ферменти отримують електрони з хінонів, при цьому відбувається транслокація протонів з цитоплазми.
NO відновлюється до N2O за допомогою NO-редуктази, яка називається NOR. Це комплекс цитохромів bc, який утворюється лише за анаеробних умов і розміщений на периплазматичному боці цитоплазматичної мембрани. На цьому етапі денітрифікації протони не виносяться з клітини, а виникає N-N-зв'язок.
Відновлення N2O до N2 включає утворення потрійного зв'язку N=N. Це енергетично вигідний процес, який призводить до виносу протонів. Усі типи ферменту N2O-редуктази локалізовані в цитоплазматичній мембрані і містять мідь, а деякі також і унікальний Cu/S центр.
Таким чином, загальна схема метаболізму факультативно анаеробних бактерій, що здійснюють денітрифікацію, має такий вигляд (рис. 6.23).
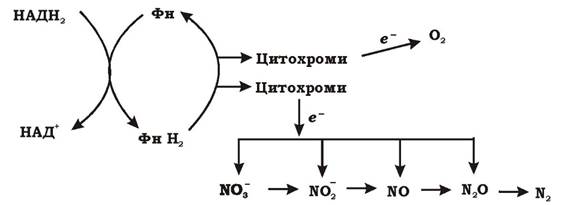
Рис. 6.23. Потік електронів при аеробному диханні та денітрифікації (Фн - флавопротеїн)
Анаеробне окиснення амонію (Anoxic (anaerobic) Ammonium Oxidation ANAMMOX) - це процес мікробного перетворення амонію й нітриту на молекулярний азот за анаеробних умов (описаний у 1992 р.).
Бактерії, що здійснюють анаеробне окиснення амонію, були віднесені до порядку Planctomycetales, їх ідентифікують як нову розгалужену групу планктоміцетів, до якої належать три роди: Brocadia, Kuenenia та Scalindua. Відомі такі види анамокс-бактерій: Brocadia anammoxidans, Kuenenia stuttgartiensis, Scalindua wagneri, S.sorokinii, S. brodae. Перші два роди були виявлені у стічних водах, а Scalindua - у багатьох морських екосистемах.
Анамокс - це цікава група бактерій з багатьма дуже рідкісними властивостями. В їхній клітинній стінці відсутній пептидоглікан, вони розмножуються брунькуванням і мають цитоплазму, розділену на сегменти мембранними перегородками. Ці сегменти виконують різні клітинні функції. Схоже, що ці найдавніші мікроорганізми знаходять
ся при корені еволюційного дерева. Інші види планктоміцетів - аеробні хемоорганогетеротрофи і дуже відрізняються від анамокс- бактерій, які є анаеробними хемолітоавтотрофами.
Метаболізм анамокс-бактерій ґрунтується на отриманні енергії за рахунок анаеробного окиснення амонію та відновлення нітриту як акцептора електронів через такі проміжні продукти як гідразин (N2H4) та гідроксиламін (NH2OH). СО2 слугує для цих бактерій основним джерелом вуглецю.
Загальне рівняння процесу: NH4+ + NO2- → N2 + 2H2O
Схему анаеробного окиснення амонію наведено на рис. 6.24.
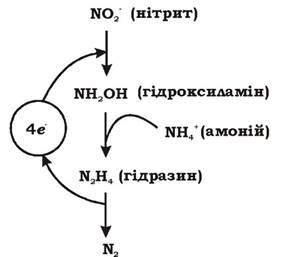
Рис. 6.24. Схема анаеробного окиснення амонію
Одним із ключових ферментів анаеробного окиснення амонію є гідроксиламіноксидоредуктаза. Важливість цього ферменту підтверджується тим, що його вміст становить 10 % від усіх білків клітини. Він каталізує окиснення і гідразину, і гідроксиламіну. Гідроксиламін-оксидоредуктаза міститься виключно в органелоподібній зв'язаній з мембраною структурі, яка розміщена в цитоплазмі. Ця органела називається анамоксосомою і займає понад 30 % об'єму клітини (рис. 6.25).
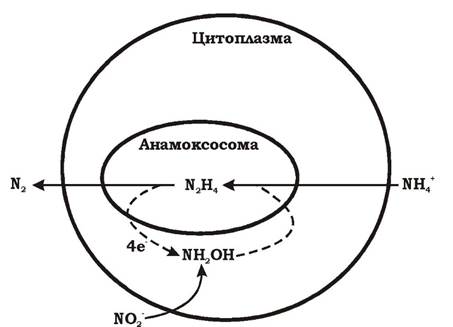
Рис. 6.25. Схематична будова клітини анамокс-бактерії
Анамоксосоми - це центри анаеробного окиснення амонію. Вони оточені надзвичайно щільною подвійною мембраною, яка містить унікальні ладеральні ліпіди: зчеплені 4-членні аліфатичні циклобутанові кільця, щільно упаковані разом. Механізм синтезу цих ліпідних залишків невідомий. Класичні мікробні мембранні ліпіди містять 3-, 5-, 6-, навіть 7-членні аліфатичні кільця, але про 4-членні аліфатичні циклобутанові кільця досі ще не було відомо. Їх вперше виявили в анамокс-бактерій. З погляду еволюції цікаво зазначити, що нині відома лише невелика кількість бактерій (термофілів і сульфатредукторів) які мають фрагменти таких ліпідів. Вони можуть служити маркерами при виявленні анамокс-бактерій у довкіллі.
Мембрани з латеральними ліпідами мало проникні для хімічних сполук і здатні утримувати градієнт їхньої концентрації протягом тривалого часу. Якби гідразин встигав виходити з анамоксосоми протягом тривалого анамокс-процесу, клітини б зазнавали великих енергетичних втрат. Мембрани анамоксосом також захищають інші частини клітини від токсичних інтермедіатів - гідроксиламіну та гідразину.
Анамокс відбувається при температурі від 6 до 43 0С, рН 6,7-8,3. Для інтенсивного анамокс-процесу необхідно, щоб нітрит утворювався з амонію аеробно нітрифікаторами першої фази. Тому найкраще функціонує кокультура з аеробних та анаеробних окисників амонію при концентрації кисню близько 0,5 %.
Виявлено, що анаеробне окиснення амонію постачає до 70 % молекулярного азоту у світовому океані.
Сульфатне дихання (дисиміляційна сульфатредукція) - це процес використання облігатними анаеробними бактеріями сульфату (SO42-) як термінального акцептора електронів при анаеробному диханні.
Здатність до сульфатредукції виявлено в мікроорганізмів чотирьох неспоріднених груп:
1. Найбільша з них належить до γ-підгрупи класу протеобактерій і обіймає роди Desulfovibrio, Desulfobulbus, Desulfomicrobium, Desulfobacter, Desulfobacterium, Desulfosarcina, Desulfococcus, Desulfonema та ін.
2. Грампозитивні бактерії роду Desulfotomaculum.
3. Грамнегативні бактерії роду Thermodesulfobacterium.
4. Археї роду Archaeglobus.
Сульфатредуктори можуть (сульфатвідновлювальні, сульфатредукуючі бактерії) мати хемоорганогетеротрофний і хемолітоавтотрофний типи метаболізму. Донорами електронів для них є молекулярний водень, форміат, ацетат, лактат, фумарат, сукцинат, пропіонат, жирні кислоти (С4-С20), метанол, етанол, пропанол. Деякі сульфатредуктори також можуть рости на аланіні, глутаматі, холіні, гліцерині, фруктозі, нікотиновій кислоті, індолі, вуглеводнях (переважно С16, але не на СН4), крохмалі, пептидах, бензоаті, фенілацетаті та фенолі.
Автотрофну асиміляцію вуглекислого газу сульфатредуктори здійснюють відновлювальним шляхом ацетил-КоА (див. рис. 5.32).
За вуглецевим обміном сульфатредуктори поділяються на дві групи (табл. 6.3):
1. Ті, що не здатні окиснювати ацетил-КоА (вони окиснюють органічні сполуки лише до ацетату і не використовують ацетат як джерело електронів та вуглецю - "неповні окисники»).
2. Ті, що окиснюють ацетил-КоА, а отже, розкладають органічні сполуки повністю до СО2 (такі бактерії здатні рости на ацетаті).
Таблиця 6.3. Розподіл сульфатредукторів за вуглецевим метаболізмом
Сульфатредуктори, що окиснюють органічні сполуки лише до ацетату |
Сульфатредуктори, що окиснюють органічні сполуки до СО2 |
Desulfovibrio |
Desulfobacter |
Desulfomicrobium |
Desulfobacterium |
Desulfomonile |
Desulfococcus |
Desulfobotulus |
Desulfonema |
Desulfomonas |
Desulfurella |
Desulfotomaculum (деякі) |
Desulfosarcina |
Desulfobulbus |
Desulfuromonas |
Thermodesulfobacterium |
Desulfoarculus |
Archaeglobus |
Desulfotomaculum (деякі) |
Сульфатредуктори, здатні до повного окиснення субстратів, а також до росту на ацетаті, розщеплюють ацетил-КоА двома способами:
- окисним шляхом ацетил-КоА (рис. 6.26);
- за модифікованим циклом Кребса (рис. 6.27).
Модифікований цикл Кребса (рис. 6.27, б), який використовують
сульфатредуктори для розщеплення ацетату, відрізняється від класичного наявністю ферменту сукциніл-КоА:ацетил-КоА-трансферази, за допомогою якого ацетат активуються без участі АТФ:
Сукциніл-КоА- + Ацетат- → Сукцинат2- + Ацетил-КоА
Види Desulfobacter містять також додатковий фермент АТФ- залежну цитратліазу. У реакції, що каталізується нею, ацетил-КоА через ацетилфосфат перетворюється в цитрат. При цьому синтезується одна молекула АТФ:
Ацетил-КоА + ЩОК2- + АДФ + НРО42- → Цитрат3- + КоASH + АТФ
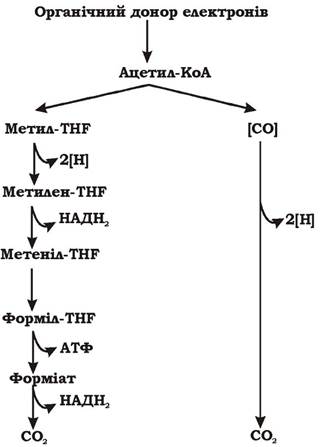
Рис. 6.26. Окисний шлях ацетил-КоА (окиснений шлях Люнгдаля - Вуда):
THF - тетрагідрофолієва кислота
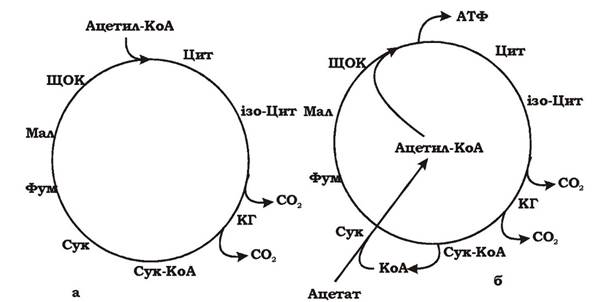
Рис. 6.27. Утилізація ацетату сульфатредукторами за допомогою модифікованого циклу Кребса:
а - звичайний цикл Кребса; б - модифікований цикл Кребса; ЩОК - щавлево-оцтова кислота; Цит - цитрат; ізо-Цит - ізо-цитрат; КГ - α-кетоглутарова кислота; Сук - сукцинат; Фум - фумарат; Мал - малат
Акцепторами електронів при сульфатному диханні є сульфат (SO42-), а також окиснені сполуки сірки - тіосульфат (S2O32-), тетратіонат (S4O62-), сульфіт (SO32-). Деякі види сульфатредукторів, наприклад Desulfovibrio gigas, Desulfovibrio multispirans, Desulfuromicrobium baculatum, можуть відновлювати і молекулярну сірку (S0), Кінцевим продуктом відновлення цих сполук є сульфід (S2-), який виділяється з клітини в довкілля.
У табл. 6.4 наведено деякі проміжні продукти сульфатредукції та ступені їх окиснення.
Таблиця 6.4. Ступені окиснення ключових сполук сірки
Сполука |
Ступінь окиснення |
Органічні сполуки сірки |
-2 |
Сульфід (H2S) |
-2 |
Елементарна сірка S0 |
0 |
Тіосульфат (S2O32-) |
+2 (середній для S) |
Тетратіонат (S4O62-) |
+2 (середній для S) |
Діоксид сірки (SO2) |
+4 |
Сульфіт (SO32-) |
+4 |
Триоксид сірки (SO3) |
+6 |
Сульфат (SO42-) |
+6 |
Залежно від рН середовища сульфід може мати такі форми:
- при низьких значеннях рН - HS - газ сірководень має низьку розчинність у воді і тому леткий;
- приа нейтральних значеннях рН - НS-;
- за високих значень рН - S2-.
Дві останні сполуки добре розчинні у воді. При контакті з важкими металами вони утворюють нерозчинні солі темного забарвлення, наприклад FeS, PbS, CuS.
Усі етапи відновлення сульфату відбуваються в цитоплазмі. Іони SO42- надходять у клітину за рахунок симпорту з Н+ або Na+. На транспортування 1 моля сульфату витрачається приблизно Уз моля АТФ, однак ця кількість залежить від концентрації акцептора в довкіллі.
Дисиміляційне відновлення сульфату до сульфіду у клітині можна описати рівняннями:
1. АТФ + SO42- → AФС + ФФн (АТФ-сульфурилаза)
2. АФС + 2е- → АМФ + SO3- (АФС-редуктаза)
3. HSO3- + 7Н+ + 6е- → H2S + 3H2O (сульфітредуктази)
На першому етапі відбувається ендергонічна реакція. Оскільки ОВП реакції SO42-/HSO3- занадто низький (Eo'= -516 мВ), сульфат спочатку активується за допомогою АТФ з утворенням аденозинфосфо- сульфату (АФС) (рис. 5.17), ОВП якого значно вищий (E0'= -60 мВ). Реакцію каталізує фермент АТФ-сульфурилаза.
На другому етапі АФС перетворюється в гідросульфіт та АМФ за допомогою ферменту АФС-редуктази. Два необхідні для цього електрони надходять з ФАДН2.
На третьому етапі проходять реакції відновлення сульфіту (гідросульфіту) до сульфіду. Вони потребують шість електронів і каталізуються ферментами сульфітредуктазами. У сульфатредукторів виявлено чотири типи сульфітредуктаз: десульфовіридини, десульфорубідин, десульфофусцидин та фермент Р-582, подібний до цитохрому р. Існує дві моделі цього процесу:
- безпосереднє шестиелектронне відновлення сульфіту без проміжних продуктів;
- тритіонатний шлях (рис. 6.28) відновлення сульфіту з утворенням таких проміжних продуктів, як тритіонат (S3O62-) та тіосульфат (S2O32-). Тритіонатний шлях описується трьома реакціями:
1. 3HSO3- + 2е- + 3Н+ → -O3S-S-SO3- + 3Н2О
2. -O3S-S-SO3- + 2е- + Н+ → -S-SO3-+ HSO3-
3. -S-SO3- + 2е- + 3Н+ → HSO3- + H2S
Баланс: HSO3- + 6е- + 7Н+→ H2S + 3Н2О
Спочатку в реакції беруть участь три гідросульфіт-іони, які після приєднання двох електронів перетворюються у тритіонат. Останній відновлюється до тіосульфату і, нарешті, - до сульфіду. На другому і третьому етапах відбувається регенерація сульфітних груп.
Неорганічний пірофосфат (ФФн), що вивільнюється під час утворення АФС, може розщеплюватися в сульфатредукторів двома способами:
1. Desulfovibrio гідролізує його за допомогою неорганічної пірофосфатази без акумулювання енергії: ФФн + Н2О → 2Фн
2. Desulfotomaculum неорганічний пірофосфат розщеплює через ацетилфосфат з утворенням АТФ. Каталізує цю реакцію фермент ацетат-пірофосфат-кіназа:
Ацетат + ФФн → Ацетилфосфат + Фн
Ацетил фосфат + АДФ → Ацетат + АТФ
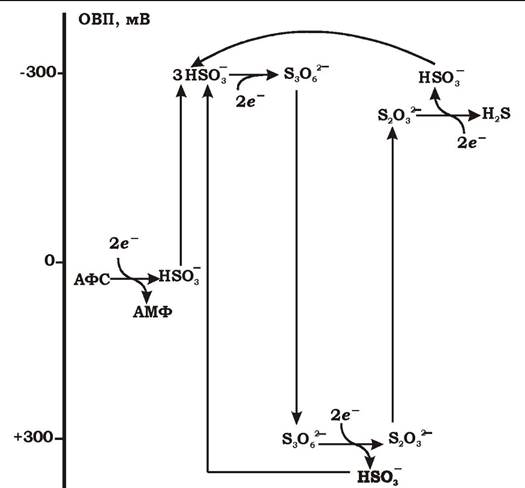
Рис. 6.28. Тритіонатний шлях відновлення аденозинфосфосульфату та сульфіту сульфатредукторами: АФС — аденозинфосфосульфат
Дисмутація (диспропорціонування) сірковмісних сполук сульфатредукуючими бактеріями. Деякі сульфатредуктори мають унікальний енергетичний метаболізм, який називається диспропорціонуванням або дисмутацією сульфіту та тіосульфату. Цей процес можна розглядати як неорганічне бродіння. Термін "диспропорціонування" означає розщеплення сполуки на два компоненти, один з яких є більш окисненим, а другий - більш відновленим, ніж вихідна сполука. Розглянемо цей процес на прикладі диспропорціонування тіосульфату Desulfovibrio sulfodismutans. Тіосульфат (S2O32-) містить два атоми сірки, сумарний ступінь окиснення яких становить +2. Один атом сірки бактерія використовує як донор електронів, інший - як акцептор:
S2+ - 4e- → SO42- (реакція окиснення сірки тіосульфату до сульфату) S2+ + 4e- → S2- (реакція відновлення сірки тіосульфату до сульфіду)
Сумарне рівняння:
S2O32- + Н2О → SO42- + H2S; ΔG0'= - 27,6 кДж/моль.
Сульфатредуктори можуть диспропорціонувати і сульфіт:
4S032-+ Н2О → 3SO42-+ H2S; ΔG0' = - 241,3 кДж/моль.
Оскільки донором електронів є неорганічна сполука, то цей процес можна розглядати як тип літотрофії. За таких умов мікроорганізми можуть рости при незначній кількості органічних сполук у середовищі або навіть автотрофно, використовуючи лише енергію реакції диспропорціонування.
Процеси утворення АТФ сульфатредукторами наразі повністю не вивчені. Відомо, що вони здійснюють субстратне та окисне фосфорилювання.
Дихальний ланцюг сульфатредукторів має ряд особливостей. Для нього характерна наявність різноманітних низько- і високопотенцій- них переносників, таких як фередоксини (E0'= -130...-440 мВ), флаводоксини (E0'= -140.-440 мВ), рубредоксини (E0'= +5.-5 мВ, рубреритрини (E0'= +225 мВ), менахінони. Сульфатредукторам притаманні унікальні цитохроми типу с3, що мають найнижчий ОВП серед усіх відомих цитохромів (E0'= -260 мВ). Ці цитохроми локалізовані в периплазмі і мають мультигемову будову. Відомі три-, тетра- та октагемові цитохроми типу с3. Бактерії, що окиснюють жирні кислоти, містять цитохроми типу b, яких також існує кілька видів. На відміну від бактерій, які дихають киснем і мають одну термінальну оксидазу, зв'язану з цитоплазматичною мембраною, у сульфатредукторів є багато розчинних термінальних оксидаз: АФС-редуктаза, сульфітредуктаза, тритіонатредуктаза, тіосульфатредуктаза. Крім того, в утворенні градієнта протонів сульфатредукторами беруть участь ферменти гідрогенази, локалізовані в периплазмі. У сульфатредукторів зустрічаються три типи гідрогеназ: [Fe]-, [NiFe]- та [NiFeSe]-гідрогеназа.
Механізм окисного фосфорилювання в сульфатредукторів демонструє рис. 6.29.
Незалежно від природи донора електронів (органічні речовини чи Н2) водень дифундує через ЦПМ у периплазму, де окиснюється комплексом ферменту гідрогенази та цитохрому с3: 4Н2 → 8Н+ + 8е. Назад у клітину повертаються вісім електронів, які відновлюють активований сульфат у вигляді АФС до сульфіду. Вісім протонів 8Н+ залишаються в периплазмі і створюють градієнт концентрації протонів між внутрішнім і зовнішнім середовищем клітини. АТФ синтезується на АТФ-синтетазі згідно з хемі- осматичною гіпотезою Мітчела. Механізм утворення градієнта протонів, зумовлений простим розділенням зарядів атомів водню за допомогою гідрогенази і поверненням електронів у цитоплазму, називають векторним транспортом електронів.
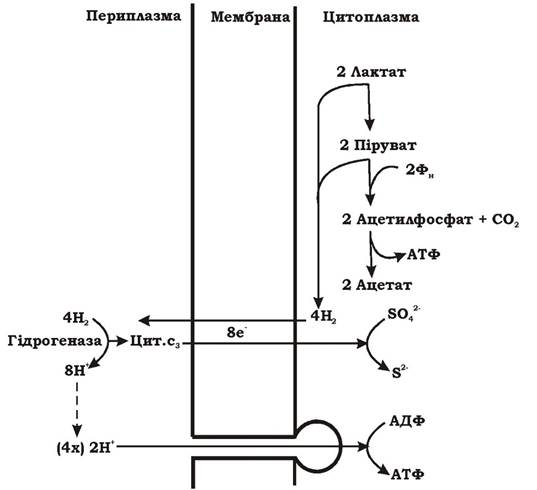
Рис. 6.29. Імовірний механізм окисного фосфорилювання сульфатредукторів
Сіркове дихання - це процес використання бактеріями елементарної сірки (S0) як термінального акцептора електронів при анаеробному диханні. Його здатні здійснювати такі облігатно анаеробні еубактерії, як Desulfuromonas acetoxidans, Desulfurella acetivorans, Wolinella succinogenes, Desulfovibrio gigas, Desulfomicrobium sp. Дихати сіркою за відсутності кисню можуть дві аеробні бактерії - Pseudomonas mendonica та Alteromonas putrefaciens. Сіркове дихання спостерігається і в деяких термофільних анаеробних археїв: Acidianus infernos, Desulfolobus ambiva- lens, Pyrobaculum islandicum, Pyrodictium occultum, Thermoproteus neutrophilus. Серед сіркоредукторів є хемооргано- та хемолітотрофи.
Відновлення елементарної сірки деякими бактеріями може відбуватися не тільки в результаті анаеробного дихання, а й як побічний процес при бродінні, однак у цьому випадку окисне фосфорилювання відсутнє (АТФ не утворюється), а сірка є лише додатковим акцептором електронів, "місцем скидання зайвого водню». Так, термофільні еубактеріїї Thermosipho africanus та Thermotoga sp. відновлюють сірку до сірководню паралельно із зародженням цукрів та інших органічних субстратів.
Залізне та манганове дихання. Відновлення заліза (ІІІ) до заліза (ІІ) в результаті мікробного дихання - дуже давній процес. Існує думка, що він мав місце в гіпергарячому довкіллі Землі ще понад 3,5 млрд років тому. Тоді в Землі було багато Fe3+, яке утворилося з Fe2+ в результаті фотохімічних реакцій у давніх морях та гіпертермальних джерелах.
Окисно-відновний потенціал пари Fe3+/Fe2+ дуже високий (+770 мВ) і наближається до ОПВ кисню (+810 мВ), тому використання Fe3+ мікроорганізмами як акцептора електронів - надзвичайно енергетично вигідне. Залізне дихання притаманне двом групам мікроорганізмів: гіпертермофільним археям і мезофільним еубактеріям.
Розрізняють кілька типів дисиміляційного відновлення заліза та мангану:
1. При збродженні органічних речовин (цукрів, амінокислот) культурами Escherichia coli, Bacillus polymyxa, Clostridium pasteurianum, Lactobacillus lactis, Vibrio spp., окрім традиційних продуктів бродіння, можливе незначне відновлення Fe(III) та Mn(IV). На відновлення металів за цих умов витрачається лише 0,03-5% відновлених еквівалентів. Тобто дисиміляційне відновлення металів у цьому разі є лише незначним додатковим катаболічним процесом для мікроорганізмів і слугує в основному для видалення надлишку відновників, що утворюються під час бродіння.
2. Відновлення Fe(III) та Mn(IV) може здійснюватися бактеріями Thiobacillus thiooxidans, Thiobacillus ferrooxidans та Sulfolobus acidocaldarius у процесі окиснення елементарної сірки як донора електронів:
S0+ 6Fe(III) + 4H2O → HSO4- + 6Fe(II) + 7H+
Однак енергії при цьому виділяється недостатньо для підтримання життєдіяльності бактерій.
3. Відновлення Fe(III) та Mn(IV) може здійснюватися в результаті хемолітотрофного окиснення молекулярного водню. Pseudomonas sp. та Shewanella putrefaciens окиснюють водень, використовуючи Fe(III) як єдиний акцептор електронів. Shewanella putrefaciens може рости і за рахунок манганового дихання:
H2+ 2Fe(III) → 2H++ 2Fe(II)
H2+ Mn(IV) → 2H+ + Mn(II)
4. Використовувати залізне та манганове дихання як єдиний спосіб отримання енергії під час росту на органічних кислотах (ацетаті, лактаті, піруваті, форміаті) може Shewanella putrefaciens та ряд неіден- тифікованих бактерій згідно з рівняннями:
Форміат- + 2Fe(III) + Н2О → НСО3- + 2Fe(II) + 2H+
Лактат- + 4Fe(III) + 2Н2О → Ацетат- + НСО3- + 4Fe(II) + 5H+
Піруват- + 2Fe(III) + 2Н2О → Ацетат- + НСО3- + 2Fe(II) + 3H+
Форміат- + Mn(IV) + Н2О → НСО3- + Mn(II) + 2H+
Лактат- + 2Mn(IV) + 2Н2О → Ацетат- + НСО3- + 2Mn(II) + 5H+
Піруват- + Mn(IV) + 2Н2О → Ацетат- + НСО3- + Mn(II) + 3H+
5. У мікробних угрупованнях основне дисиміляційне відновлення заліза (ІІІ) здійснюють бактерії родини Geobactenaceae (Geobacter chapelleii, G. hydrogenophilus, G. metalliraducens, G. sufUreducens, Geobacter spp, Geothrix fermentans, Geovibrio fernreducens).
Основна проблема використання Fe(III) для дихання полягає в нерозчинності його сполук при рН ~7, а отже, неможливості його надходження всередину клітини. Цю проблему грамнегативні бактерії, наприклад Shewanella, вирішують так (рис. 6.30). Їхні клітини містять велику кількість тетра- та декагемових цитохромів типу с, які утворюють мультигемовий "провідник" між внутрішньою і зовнішньою мембранами. По цьому "провіднику" електрони від реакцій вуглецевого метаболізму, що відбуваються в цитоплазмі, передаються через дві мембрани та периплазму назовні клітини, де, власне, і відбувається відновлення нерозчинних сполук заліза (ІІІ). У Shewanella frigidimadna відомі такі мультигемові цитохроми, як:
- CymA - тетрагемовий, зв'язаний з мембранною хінолдегідрогеназою;
- Рсс35 - периплазматичний декагемовий;
- Ifc3 - залізоіндукований флавоцитохром сз;
- OmcA - позамембранний декагемовий ліпопротеїн.
Гени, що відповідають за синтез цих цитохромів, містяться в геномі в багатьох копіях, що дає змогу клітині за потреби синтезувати їх у великій кількості. Виявлено, що при культивуванні Shewanella frigidi- marina в анаеробних умовах із залізом (ІІІ) кількість цитохромів в її клітинах різко зростає.
Мультигемова залізо(ІІІ)-редуктазна система є неспецифічною. Вона може відновлювати також і інші позаклітинні сполуки, такі як Mn(IV) та нерозчинні форми сірки.
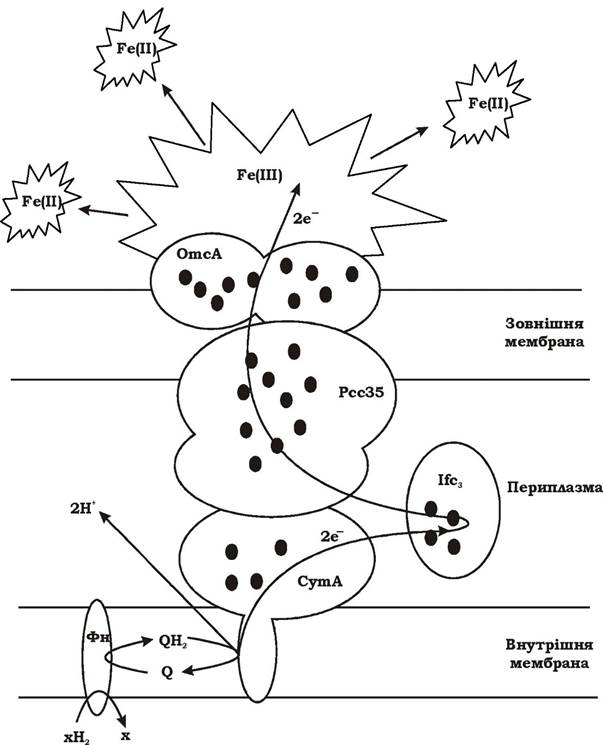
Рис. 6.30. Гіпотетична схема включення у процес залізного дихання Shewanella frigidimarina внутрішньої і зовнішньої мембран, периплазми та мультигемових цитохромів: CymA - тетрагемовий цитохром, зв'язаний з мембранною хінолдегідрогеназою; Pcc35 - периплазматичний декагемовий цитохром; Ifc3 - залізо індукований флавоцитохром с3; OmcA - позамембранний декагемовий ліпопротеїн; Фн — флавопротеїн
Фумаратне дихання - це анаеробний процес, під час якого акцептором електронів слугує органічна сполука - фумарова кислота. Відновлюючись, фумарат перетворюється в сукцинат. ОВП пари фумарат/сукцинат досить високий і становить +30 мВ. Донорами електронів при фумаратному диханні є мурашина кислота, молекулярний водень, сульфід, а також НАДН2, що утворюється внаслідок катаболізму органічних сполук. Фумаратне дихання характерне для багатьох факультативно анаеробних бактерій: E. coli, Proteus rettgeri, Salmonella, Klebsiella. Його можуть здійснювати і облігатні анаероби: Clostridium formoaceticum, Desulfovibriogigas, PYopionibacterium, Vibrio succinogenes, Bacteroides fragilis, Wolinella succinogenes.
Фумарат може відновлюватися внаслідок окиснення НАДН2. Перенесення електронів від НАДН2 до фумарату відбувається через ряд переносників дихального ланцюга, специфічними серед яких є:
- менахінон (скорочена назва метилнафтохінона);
- цитохроми типа b;
- фумаратредуктаза.
Менахінон - ліпофільна речовина, з ОВП ~ -74 мВ, що дає їй змогу переносити електрони на фумарат. Оскільки ОВП убіхінону становить +133 мВ, цей хіхон участі у фумаратному диханні не бере.
У бактерій, що дихають фумаратом, як правило містяться кілька типів цитохромів b з різними значеннями ОВП: -200 мВ і -20 мВ.
Фумаратредуктаза - це залізосірчаний флавопротеїн із простетичною групою ФАД, приєднаною ковалентно. Цей фермент тісно зв'язаний з мембраною і складається з двох субодиниць. Фумаратредуктаза синтезується у клітині лише за певних умов, оскільки цей фермент індуктивний.
Загальну схему фумаратного дихання наведено на рис. 6.31.
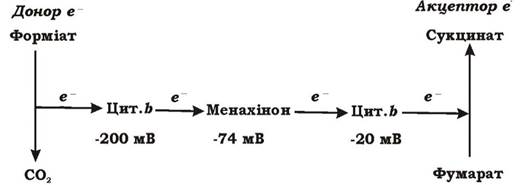
Рис. 6.31. Загальна схема фумаратного дихання
Вуглецеве дихання притаманне гомоацетогенним бактеріям. Го- моацетогени - це облігатно анаеробні бактерії, які використовують СО2 як термінальний акцептор електронів і утворюють єдиний кінцевий продукт - ацетат.
Таксономічно гомоацетогенні бактерії є найнеодноріднішою групою серед облігатних анаеробів. До них належать грампозитивні і грамнегативні бактерії, спорові і неспорові, палички і коки, рухливі і нерухливі, психро-, мезо та термофіли, хемоорганогетеро- та хемолі- тоавтотрофи. Гомоацетогенами є: Eubacterium limosum, Acetobacterium carbinolicum, A. malicum, A. woodii, Clostridium thermoaceticum, C. pfenningii, C. thermoautotrophicum, C. formiaceticum, Butyribacterium methylotrophicum, Syntrophococcus sucromutans, Peptostreptococcus productus, Acetitomaculum ruminis, Sporomusa termitida, S. malonica, S. acidovorans.
Залежно від умов середовища гомоацетогени можуть здійснювати два типи метаболізму: хемолітоавтотрофний і хемолітогетеротрофний.
Хемолітоавтотрофний метаболізм гомоацетогени демонструють при рості на суміші двох газів - молекулярного водню та діоксиду вуглецю. Якщо Н2 вони використовують як джерело електронів, то СО2 - як термінальний акцептор електронів і джерело вуглецю. Вуглекислий газ включається в метаболізм гомоацетогенів відновлювальним шляхом ацетил-КоА. Ми вже зустрічалися з цим шляхом у сульфатвіднов- лювальних бактерій. Там він слугував для:
- асиміляції СО2 при автотрофному рості (відновлювальний шлях ацетил-КоА, рис. 5.32).
- розщеплення ацетату (окисний шлях ацетил-КоА, рис. 6.26).
У гомоацетогенів шлях ацетил-КоА слугує для:
1. Асиміляції СО2 при автотрофному рості (рис. 5.32).
2. Генерації енергії при перенесенні електронів на термінальний акцептор СО2 при вуглецевому диханні, тобто для окисного фосфорилю- вання. Це відбувається в результаті відновлення N5, N10-метилен-ТНР до №-метил-ТНР під дією ферменту метилен-ТНР-редукгази. Вихід енергії цієї реакції достатній для перенесення одного або двох моновалентних катіонів через мембрану. Виявлено, що даний процес супроводжується транспортом через мембрану іонів Na+. Потім Na+ повертаються у клітину, а Н+виноситься назовні через Na+/H+ антипорт. Наявність такого антипорту було показано у Clostridium thermoaceticum. Так утворюється градієнт протонів, який призводить до синтезу АТФ на АТФ-синтетазі. Це єдина реакція відновлювального шляху ацетил-КоА, яка пов'язана з окисним фосфорилюванням (рис. 6.32).
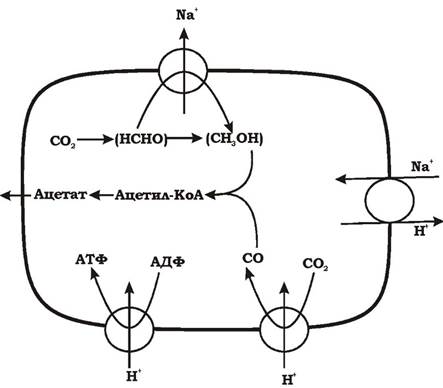
Рис. 6.32. Утворення градієнта протонів у гомоацетогенів при вуглецевому диханні
Гомоацетогени також здатні синтезувати АТФ відновлювальним шляхом ацетил-КоА при перетворенні ацетил-КоА в ацетат через ацетилфосфат. Ці реакції каталізуються ферментами фосфотрансацетилазою та ацетаткіназою і є приладом субстратного фосфорилювання.
Отже, у гомоацетогенів шлях ацетил-Коа є мультифункціональним - він використовується одночасно і в енергетичному метаболізмі, і в біосинтезі.
Гомоацетогенні бактерії можуть рости і на різноманітних органічних субстратах, тобто здійснювати хемоорганогетеротрофний метаболізм. Більшість з цих субстратів в анаеробних умовах є малопридатними джерелами енергії (табл. 6.5).
Таблиця 6.5. Субстрати, на яких ростуть гомоацетогени
Субстрат |
Мікроорганізми |
Н2+СО2 |
Більшість гомоацетогенів |
СО |
Peptostreptococcus productus, Butyribacterium me- thylotrophicum, Eubacterium limosum, Clostridium thermoaceticum, Clostridium thermoautotrophicum, Sporomusa termitida, Acetobacterium woodii, Aceti- tomaculum ruminis |
Метанол |
Eubacterium limosum, Butyribacterium methylotro- phicum, Clostridium formiaceticum, Acetobacterium carbinolicum, Sporomusa spp. |
Субстрат |
Мікроорганізми |
Аліфатичні спирти |
Acetobacterium carbinolicum, Sporomusa spp. |
2,3-бутандіол |
Acetobacterium carbinolicum, Sporomusa spp. |
Етиленгліколь |
Acetobacterium carbinolicum |
Бетаїн |
Eubacterium limosum, Sporomusa spp. |
Гексаметилентетрамін |
Acetobacterium spp. |
Малонат |
Sporomusa malonica |
2-метоксиетанол |
Acetobacterium malicum |
Фенілметилові ефіри |
Acetobacterium woodii, Clostridium thermoaceticum, Sporomusa termitida, Clostridium pfennigii, Syntro- phococcus sucromutans, Acetobacterium carbinolicum, Eubacterium limosum, Clostridium thermo- autotrophicum |
Манделат |
Acetobacterium spp. |
Спочатку глюкоза гліколітичним шляхом перетворюється на дві молекули пірувату. При цьому відновлюється 2 НАД+ (2 НАДН2 є еквівалентом 4Н):
Глюкоза → 2 Піруват + 2 НАДН2
Потім дві молекули пірувату окиснюються до двох молекул ацетату:
2 Піруват → 2 Ацетат + 2СО2 + 4Н
Хемоорганогетеротрофний метаболізм гомоацетогенних бактерій розглянемо на прикладі утилізації глюкози (рис. 6.33).
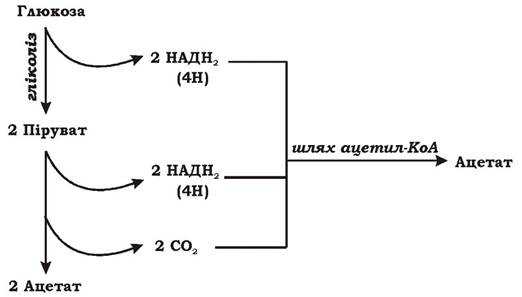
Рис. 6.33. Хемоорганогетеротрофний метаболізм гомоацетогенних бактерій
Третю молекулу ацетату гомоацетогени утворюють відновленням 2СО2, що виділився в попередній реакції, шляхом ацетил-КоА. Для відновлення СО2 використовується водень, що також походить з глюкози. Сумарне рівняння окиснення глюкози гомоацетогенами:
Глюкоза → 3 Ацетат
Енергетика утворення ацетату гомоацетогенами. Більшість гомоацетогенів можуть рости на суміші газів СО2 і Н2, використовуючи водень як єдине джерело електронів. Це означає, що відновлення СО2 до ацетату має супроводжуватися синтезом АТФ. 1 моль АТФ утворюється шляхом ацетил-КоА при перетворенні ацетилфосфату в ацетат. У той же час активування форміату з утворенням форміл-тетрагідрофоляту стехіометрично використовує 1 АТФ. Тому та частина шляху ацетил-КоА, яка приводить до синтезу клітинного вуглецю, не є джерелом утворення АТФ на рівні субстратного фосфорилювання. Накопиченню АТФ при відновленні СО2 до ацетату додатково заважає споживання енергії при утворенні СО з СО2. Для Acetobacterium woodii було показано, що відновлення СО2 до СО пов'язане з використанням градієнта протонів. За звичайних умов вихід вільної енергії для реакції відновлення СО2 до СО становить +20 кДж/моль. Розрахунки показують, що для забезпечення цієї реакції енергією через мембрану назад у клітину має повернутися принаймні один протон. Тобто відновлення 1СО2 до 1СО буде "коштувати" клітині 1/3 молекули АТФ. Таке явище також описано і для метаногенів у випадку використання ними шляху ацетил-КоА для асиміляції СО2. Це одна з небагатьох реакцій у катаболізмі бактерій, яка пов'язана зі зворотним перенесенням електронів.
Оскільки утворення СО та активація форміату - ендергонічні процеси, у клітині має бути одна чи більше екзергонічних реакцій. Єдиною доволі екзергонічною реакцією є відновлення метилен-THF до метил-THF (див. вище). Виявлено, що клітинна суспензія Acetobacterium woodii при культивуванні на СО2+Н2 створювала градієнт концентрації іонів натрію. Було показано, що в метаногенних бактерій процес відновлення метилен- тетрагідрометаноптеріну до метилових похідних при утворенні метану з СО2 супроводжувався транспортом натрію через мембрану. За аналогією з метаногенами було зроблено висновок, що при відновленні метилен-THF до метил-THF також повинна мати місце транслокація іонів натрію за межі клітини. Так може утворюватися електрохімічний натрієвий градієнт. Яким чином цей натрієвий градієнт переходить у АТФ, досі не з'ясовано. Найімовірніше, що він за рахунок антипорту натрій/ протони (Na+/H+) переходить у градієнт протонів. Наявність такого антипорту показано у Clostridium thermoaceticum. Градієнт протонів, створений Na+/H+ антипортом, може генерувати синтез АТФ через АТФазу.
Завдяки широкому спектру придатних для споживання субстратів гомоацетогени живуть практично в усіх безкисневих прісних (деякі - у морських) екологічних нішах: осадах прісних водоймищ, стічних водах, кишечнику жуйних тварин, термітів і гризунів, фекаліях тварин і людей, ціанобактеріальних матах. Для гомоацетогенів дуже важливою є умова, щоб у довкіллі було достатньо молекулярного водню, за який вони конкурують з метаногенами й отримують перевагу у психрофільних умовах при температурі нижче 20 0С. В еконішах, де є достатньо органічних речовин (фекалії), гомоацетогени надають перевагу енергетично вигіднішим субстратам, ніж молекулярний водень.