МІКРОБІОЛОГІЯ - М.Г. Сергійчук - 2008
Розділ 2. МОРФОЛОГІЯ І БУДОВА БАКТЕРІАЛЬНОЇ КЛІТИНИ
УЛЬТРАСТРУКТУРА ПРОКАРІОТИЧНОЇ КЛІТИНИ
Незважаючи на зовнішній простий вигляд, бактеріальна клітина є складним живим об'єктом (рис. 2.17), будова якого за багатьма ознаками нагадує будову клітин рослинного чи тваринного походження.
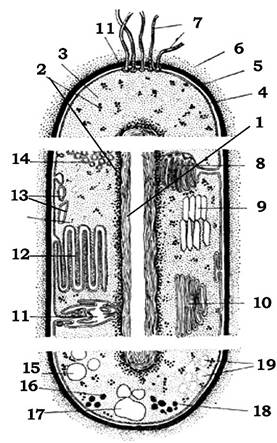
Рис. 2.17. Схематичне комбіноване зображення прокаріотичної клітини
1 - нуклеоїд; 2 - рибосоми; 3 - цитоплазма; 4 - цитоплазматична мембрана; 5 - клітинна стінка; 6 - капсула; 7 - джгутики;
8 - мезосоми; 9 - аеросоми (газові вакуолі); 10 - ламелярні структури; 11 - трубчасті тилакоїди; 12 - пластинчасті тилакоїди;
13 - хлоросоми; 14 - хроматофори; 15 - включення сірки; 16 - карбоксисоми; 17 - гранули полі -β-оксимасляної кислоти;
18 - гранули поліфосфату; 19 - полісахаридні гранули
Бактеріальна клітина оточена щільною оболонкою - клітинною стінкою. У багатьох бактерій ззовні від клітинної стінки розташовані капсула або слизові шари, пілі (ворсинки) та джгутики. Усередину від клітинної стінки розташована цитоплазматична мембрана (обов'язкова структура клітин усіх бактерій), яка оточує цитоплазму. У цитоплазмі міститься бактеріальне ядро, рибосоми, запасні речовини та інші бактеріальні структури. Структури, розташовані ззовні від цитоплазматичної мембрани, називають поверхневими.
Клітинна стінка належить до обов'язкових структур бактеріальної клітини. Винятком є мікоплазми та L-форми бактерій, які позбавлені цієї структури.
Клітинна стінка - структура ригідна, але в той же час до певної мірі й еластична. Вона визначає форму бактеріальної клітини. Це легко демонструється експериментально: якщо порушити цілісність клітинної стінки, утворюються сферопласти або протопласти, які змінюються морфологічно.
Клітинна стінка захищає внутрішній вміст клітини від механічних і осмотичних впливів зовнішнього середовища, відіграє важливу роль у регуляції росту, поділу клітини. Хімічний склад і будова клітинної стінки різних еубактерій відрізняються між собою, що зумовлює здатність клітини по-різному забарвлюватися за Грамом (табл. 2.2).
Таблиця 2.2. Хімічний склад клітинних стінок грампозитивних і грамнегативних прокаріотів
Компоненти клітинної стінки |
Грампозитивні прокаріоти |
Грамнегативні прокаріоти |
|
внутрішній шар |
зовнішній шар |
||
Пептидоглікан |
+ |
+ |
- |
Тейхоєві кислоти |
+ |
- |
- |
Полісахариди |
+ |
- |
+ |
Білки |
± |
- |
+ |
Ліпіди |
± |
- |
+ |
Ліпополісахариди |
- |
- |
+ |
Ліпопротеїди |
- |
± |
± |
Важливим структурним компонентом клітинної стінки як грампозитивних, так і грамнегативних бактерій є біополімер мукопептид (пептидоглікан, глюкозамінопептид, глікопептид або муреїн; лат. murus - стінка) (рис. 2.18). Саме цей біополімер і визначає ригідність бактеріальної клітинної стінки. Його вміст у клітинних стінках грампозитивних прокаріотів досягає 50-90 % за масою. У більшості видів грамнегативних бактерій вміст пептидоглікану коливається від 1 до 10 %. У клітинних стінках ціанобактерій, які мають грамнегативний тип організації клітинної стінки, визначається 22-52 % муреїну.
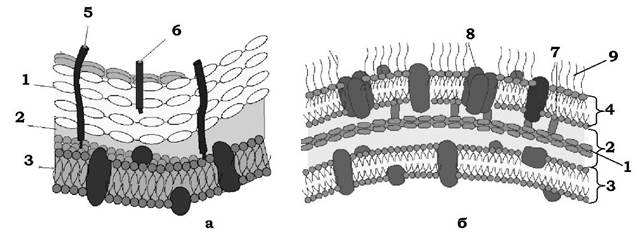
Рис. 2.18. Модель організації клітинної стінки грамнегативних (а) і грампозитивних (б) бактерій:
1 - пептидоглікан; 2 - периплазматичний простір; 3 - цитоплазматична мембрана; 4 - зовнішня мембрана; 5 - ліпотейхоєва кислота; 6 - тейхоєва кислота; 7 - ліпопротеіни; 8 - білки порини; 9 - ліпополісахариди
За допомогою електронної мікроскопії було показано, що клітинна стінка грампозитивних прокаріотів має вигляд гомогенного електронно-щільного шару, представленого пептидогліканом із вбудованими в нього тейхоєвими кислотами, полісахаридами та ін. Товщина цього шару коливається в різних видів бактерій від 20 до 50 нм.
Клітинна стінка грацилікутних бактерій являє собою багатошарову (гетерогенну) структуру, яка містить:
- внутрішній електронно-щільний шар завтовшки 2-3 нм, представлений пептидогліканом;
- ззовні до нього примикає шар завтовшки 8-10 нм, який складається з двох електронно-щільних смужок, розділених електронно- прозорим проміжком. Таку трикомпонентну структуру клітинної стінки грамнегативних бактерій, яка нагадує елементарну мембрану, називають зовнішньою мембраною, а простір між ЦПМ і зовнішньою мембраною - периплазматичним.
Таким чином, клітинні стінки грампозитивних і грамнегативних прокаріотів суттєво відрізняються між собою за ультраструктурою та хімічним складом.
Спосіб диференціації бактеріальних клітин, запропонований у 1884 р. датським ученим Х. Грамом (1853-1938), увійшов у мікробіологічну практику як метод Грама. Суть його полягає в тому, що в певних видів бактерій деякі компоненти клітинної стінки при взаємодії з генціановим (або кристалічним) фіолетовим у присутності йоду утворюють стійкий комплекс, який не вимивається спиртом або ацетоном. Такі бактерії називаються грампозитивними (або фірмакутними). Бактерії, які не забарвлюються за методом Грама, називають грамнегативними (або грацилікутними). Забарвлювання за Грамом є одним із важливих методів диференціації бактерій. Теоретично всі бактерії можна поділити на дві групи: грампозитивні та грамнегативні. Реально мають місце випадки, коли один і той же мікроорганізм характеризується як грамваріабельний, тобто залежно від віку культури забарвлюється за Грамом як позитивно, так і негативно.
Отже, клітинні стінки грампозитивних і грамнегативних бактерій відрізняються між собою за ультраструктурою та хімічним складом, але обов'язковим і одним з основних їх компонентів є пептидоглікан. Цей біополімер не виявляється у клітинах інших організмів, тобто він є унікальною структурою прокаріотів.
Молекула пептидоглікану має скелет, який утворюється залишками N-ацетилглюкозаміну (N-Ac.Gl.) і N-ацетилмурамової кислоти (N-Ac.M.).
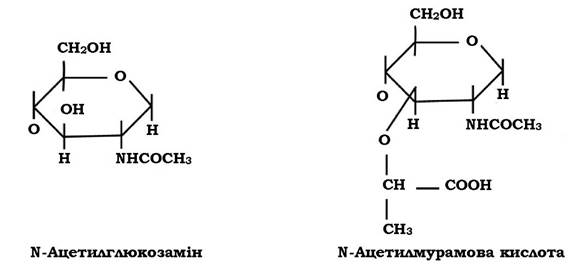
N-Ac.Gl. - це похідне глюкози, в якій гідроксильна група при другому атомі вуглецю заміщена аміногрупою, до якої приєднується ацетильний залишок.
Молекула N-Ac.M. - це ефір N-Ac.Gl. і молочної кислоти. Ця сполука притаманна лише клітинам прокаріотів, тобто є унікальною.
Обидві молекули з'єднуються між собою β-1,4-глюкозидними зв'язками, утворюючи лінійну структуру - глікан (рис. 2.19).
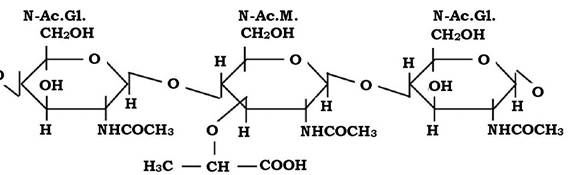
Рис. 2.19. Структура молекули глікану
Елементи, що утворюють глікан, подібні до таких дисахаридів, як целобіоза чи хітин. Але на відміну від целобіози й хітину до структури глікану входять карбоксильні групи, які і визначають його кислотні властивості
До карбоксильної групи молочної кислоти в молекулі N-Ас.М. приєднується пептид. У багатьох випадках - це тетрапептид. Пептидний залишок містить L- i D-форми амінокислот (неприродна конфігурація, оскільки біологічну активність проявляють лише L-форми), які чергуються між собою.
До складу тетрапептиду часто входить також незвична амінокислота - мезо-диамінопімелінова (DAP), яка може бути в мезо- або L-формі. Ця амінокислота виявляється тільки у прокаріотів і лише в структурі їхньої клітинної стінки.
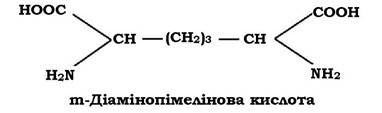
До карбоксильної групи N-Ас.М. у молекулі глікану приєднується аміногрупа амінокислоти, яка стоїть у першому положенні пептиду (рис. 2.20). Найчастіше такою амінокислотою є L-аланін, інколи L- форма серину або гліцину.
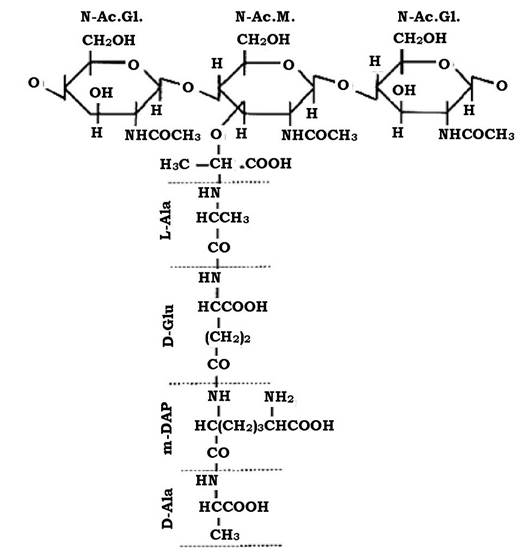
Рис. 2.20. Структура молекули муреїну
У другому положенні - D-глутамінова кислота. Вона з'єднується в подальшому з диамінокислотою, яка займає третє положення в пептидному залишку пептидоглікану. Диамінокислотою (третє положення) найчастіше служить m-диамінопімелінова кислота (m-DAP). Інколи в третьому положенні може перебувати: LL-DAP, D-лізин, L- або D- орнітин, m-2,6-диаміно-3-гідрокси-β-пімелінова, 2,4-диаміномасляна кислота або гомосерин.
Четвертою амінокислотою в багатьох випадках пептидогліканів виявляється D-аланін.
Пептидний залишок пептидоглікану не обов'язково має чотири амінокислотних залишки. Інколи пептид може мати два термінальних D-Ala, в інших випадках - лише три амінокислотних залишки.
D-глутамінова кислота має дві карбоксильні групи. Одна з них залишається вільною або служить місцем з'єднання з амінокислотним залишком другого пептиду, тобто є місцем зшивання двох пептидів.
Вивчення пептидогліканів різних бактерій показало, що всі вони організовані однотипно і мають глікановий ланцюг, пептидні ланцюги і перехреснозв'язуючі містки, які з'єднують пептидні залишки.
Усе це створює сітчасту структуру цього біополімеру, схему просторової організації якого наведено на рис. 2.21.
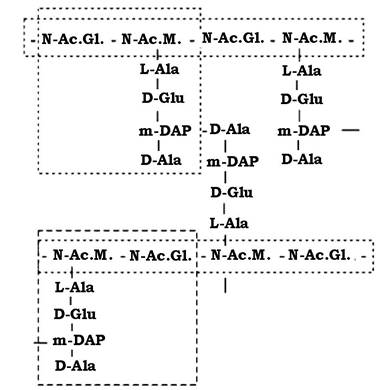
Рис. 2.21. Просторова організація молекули пептидоглікану
Під час вивчення ферментних гідролізатів пептидогліканів було виділено декілька мінорних компонентів:
- похідне мурамової кислоти, в якій гідроксил у С6 заміщений О- ацетильною або фосфатною групою. Остання зв'язує пептидоглікани з іншими полімерами клітинної стінки, наприклад із тейхоєвими кислотами;
- у деяких залишках мурамової кислоти замість залишку N-Ac.Gl. визначається N-ацетилманозамін;
- інколи виявляється мурамова кислота з вільною, тобто неацильованою, аміногрупою;
- визначається невелика кількість мурамової кислоти, яка замість N-ацетильних має N-гліколільні групи.
Товщина одного шару пептидоглікану коливається в межах 1,52,0 нм, тобто можна вважати, що пептидоглікан грамнегативних бактерій є одно- або двошаровим, а в грампозитивних - має 20-40 шарів, що визначається товщиною клітинної стінки.
Основними функціями пептидоглікану вважають:
- виявляє ригідність (цупкість, механічну міцність), отже визначає форму бактеріальної клітини;
- протидіє тургорному тиску вмісту клітини, тобто запобігає осмотичному лізису;
- значною мірою зумовлює антигенну специфічність бактеріальної клітини;
- деякі елементи клітинної стінки виявляють неспецифічний ад'ювантний ефект. Ад’юванти - це речовини, що посилюють імунну відповідь на введення антигену. У випадку пептидоглікану це, як правило, трипептиди (L-Ala - D-Glu - m-DAP), з'єднані з N-AcM;
- наявність вільних карбоксильних (СОО-) або аміногруп (NH+) визначає поверхневий заряд клітини.
Таким чином, пептидоглікан є одним із важливих компонентів клітинної стінки бактерій, але його структура як біополімеру може варіювати.
Оскільки пептидоглікан деяких бактерій має антигенні властивості, можливість інгібування його синтезу має велике значення для медицини. Муреїновий шар грампозитивних і грамнегативних бактерій можна зруйнувати літичними ферментами або інгібувати його синтез антибіотиками пеніцилінового ряду: бензилпеніциліном, 2-оксибензилпеніциліном, n-гептилпеніциліном, n-амілпеніциліном та ін. Ефект інгібування синтезу речовини клітинної стінки виявляють також бацитрацин, ванкоміцин, ристоміцин, циклосерин.
Ферменти, які руйнують структуру пептидоглікану, вперше були описані О. Флемінгом у 1922 р., вони відомі як лізоцими.
Лізоцим (ацетилмурамідаза) - бактерицидний фермент, який виявляється в сльозовій рідині, носовому слизу, яєчному білку, молоці. Цей фермент виділений також із клітин деяких бактерій (наприклад, E. coli, деяких представників роду Streptomyces) і бактеріофагів. Він розриває в молекулі муреїну глюкозидні зв'язки між першим атомом вуглецю N-Ас.М. і четвертим - у молекулі N-Ac.Gl. Унаслідок такої дії по- лісахаридні ланцюги розриваються до дисахаридних фрагментів.
Місце розриву молекули пептидоглікану залежить від ферменту, який використовується з цією метою (рис. 2.22):
- ендо-N-ацетилглюкозаміл-N-ацетилмурамідаза (глюкозидаза) - розриває зв'язки після N-ацетилглюкозаміну;
- ендо-N-ацетилмураміл-Nацетилглюкозиламідаза (глюкозидаза) - діє на зв'язки після N-ацетилмурамової кислоти;
- N-ацетилмураміл-N-аланінамідаза - відщеплює тетрапептид від молекули глікану.
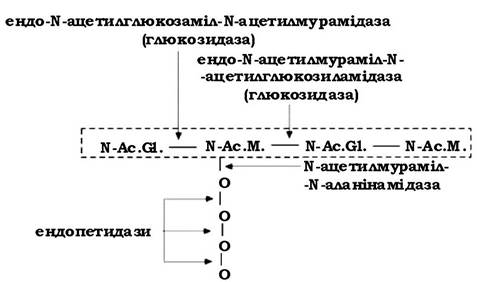
Рис. 2.22. Схема дії літичних ферментів на молекулу пептидоглікану
Порушити цілісність структури пептидоглікану можна також дією ендопептидаз - ферментів, які розривають зв'язки в молекулі тетрапептиду або між двома пептидами. Унаслідок такої дії утворюються сферопласти - структури, частково позбавлені клітинної стінки, або протопласти - структури, повністю позбавлені клітинної стінки.
Експериментально функцію пептидоглікану вперше продемонстрував С. Вейбел у 1953 р. З цією метою він помістив клітини B. megaterium в ізотонічний розчин сахарози, а потім додав лізоцим. Паличкоподібні клітини перетворилися у клітини сферичної форми - протопласти, які зберігали дихальну активність, синтезували білок і нуклеїнові кислоти.
Через те, що протопласти не мають клітинної стінки, вони набувають найрізноманітнішої форми: видовженої, роздутої, грушоподібної, спіральної тощо.
Таким чином, було доведено, що лізис клітинної стінки не призводить до порушення метаболічних функцій: протопласти дихають подібно до інтактних клітин, а якщо до цього мала місце ініціація процесу спороутворення, то вона завершується утворенням спори.
У гіпотонічних розчинах протопласти руйнуються. Через те що в протопластів відсутня клітинна стінка, вони стають більш чутливими до дії хімічних речовин і тому є зручною моделлю для проведення фізіологічних досліджень.
Вважається, що гіпертонічні розчини є стабілізуючим фактором для клітин, які позбавлені клітинної стінки, внаслідок чого вони набувають сферичної форми. Крім того, встановлено, що певну роль в отриманні сферопластів відіграє також речовина, з якої було одержано гіпертонічний розчин. При утворенні сферопластів з E. coli гіпертонічний розчин, одержаний із сахарози, добре зберігає протопласти, тоді як у гіпертонічному розчині із целобіози вони руйнуються.
Якщо протопласти відмити від лізоциму і помістити в оптимальне середовище, вони збільшуються в розмірах і виявляють обмежену здатність до розмноження. Але вони не відновлюють здатності до синтезу речовини клітинної стінки. Регенерація клітинної стінки відбувається лише в деяких спеціальних умовах, тоді клітина набуває своєї вихідної форми. У гіпертонічних або в ізотонічних розчинах протопласти більш- менш стабільні, у гіпотонічних - відбувається осмотичний лізис.
Гідроліз муреїну грамнегативних бактерій під дією літичних ферментів не призводить до видалення зовнішньої мембрани. При цьому утворюються чутливі до зміни осмотичного тиску структури, які називаються сферопластами. Сферопласти, як і протопласти, більші за клітини, з яких вони утворюються, в 3-10 разів. Але на відміну від протопластів, вони містять залишки мурамової та диамінової кислот і легше ревертують у вихідні форми.
L-форми - це бактерії, які позбавлені клітинної стінки, але здатні до розвитку. Уперше L-форми спостерігали вчені Лістерівського інституту (Великобританія) у 1935 р., звідки і походить їхня назва. Було помічено, що культура Streptobacillus moniliformis може утворювати атипові форми колоній, в яких виявляються анормальні клітини. Якщо такі клітини помістити в середовище, яке містить сироватку крові, то вони можуть розмножуватися невизначено довго. Початково вважали, що це контамінанти або симбіонти (чи паразити) Streptobacillus moniliformis, але згодом було доведено можливість деяких із цих клітин переходити (ревертувати) у вихідну (паличкоподібну) форму.
На агаризованих середовищах L-форми утворюють колонії, які вростають у поживне середовище і нагадують форму яєчні. Ріст таких колоній досить повільний. У колоніях визначаються структури, що відрізняються і морфологічно, і за розмірами: елементарні тіла розміром 0,2-1,0 мкм, які проявляють мінімальну здатність до розмноження; тіла кулястої або неправильної форми розміром від 1,0 до 5,0 мкм; структури ниткоподібної форми різних розмірів; великі тіла (5,0-10,0 мкм); безструктурні маси.
У грампозитивних бактерій пептидоглікан є багатошаровою структурою. При цьому муреїновий матрикс ковалентно зв'язаний з іншими макромолекулами, до яких належать і тейхоєві кислоти (грец. teixos - стінка).
Тейхоєві кислоти були відкриті Беділі в 1958 р. у клітинних стінках Bacillus subtilis, Staphylococcus aureus i Lactobacillus arabinosus. Згодом було доведено, що тейхоєві кислоти визначаються у клітинних стінках більшості грампозитивних бактерій. В еубактерій їх вміст може досягати 50 %, а в актиноміцетів - 20-30 %.
Основою молекули тейхоєвої кислоти є полімерний ланцюг, в якому чергуються з'єднані ефірними зв'язками залишки рибітфосфату (або гліцеринфосфату). Одна молекула тейхоєвої кислоти може містити від 7 до 15, а інколи - до 50 спиртових залишків.
Деякі гідроксильні групи спиртів заміщені залишками D-Ala, глюкози, N-Ac.Gl. або N-Ac.галактозаміну (R).
Залежно від характеру багатоатомного спирту (рибіту чи гліцерину) тейхоєві кислоти поділяють на дві групи - рибіттейхоєві й гліцеротейхоєві кислоти (рис. 2.23), причому клітинна стінка може містити обидві групи.
Вільні гідроксили фосфорної кислоти надають тейхоєвій кислоті полі- аніонних властивостей. У гліцеротейхоєвій кислоті фосфатні залишки розташовані близько один до одного, що дозволяє їм захоплювати двовалентні катіони. Фосфатні групи рибіттейхоєвих кислот розміщені на більшій відстані одна від одної, ніж у випадку гліцеротейхоєвих кислот, тому вони мають меншу спорідненість до двовалентних катіонів. Вільні аміногрупи аланіну надають тейхоєвим кислотам амфотерних властивостей і можуть нейтралізувати їхній внутрішній заряд.
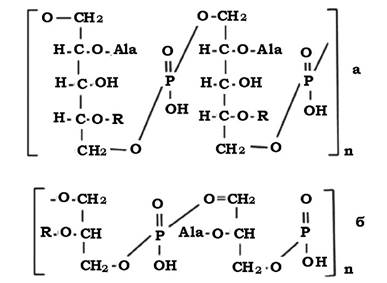
Рис. 2.23. Схема будови рибіттейхоєвої (а) і гліцеротейхоєвої (б) кислот
Клітинна стінка бактерій може містити як гліцеротейхоєві, так і рибіттейхоєві кислоти. Усі мембранні тейхоєві кислоти є гліцерофосфатними.
Вважається, що тейхоєві кислоти - головні антигени бактеріальної клітини. Їх антигенність посилюється при частковому гідролізі муреїну.
Гліцеротейхоєві кислоти мембрани бактеріальної клітини ковалентно зв'язані з гліколіпідом. Такі комплекси називаються ліпотейхоєвими кислотами.
Тейхоєві кислоти клітинної стінки можуть виконувати різні функції. Вони є додатковими елементами просторової організації структури клітинної стінки; тейхоєві і ліпотейхоєві кислоти виявляють антигенні властивості і визначають певною мірою антигенну специфічність клітинної поверхні; вуглеводневі компоненти тейхоєвих кислот входять до складу рецепторів для бактеріофагів; будучи поліаніонами, тейхоєві кислоти визначають поверхневий заряд клітини і впливають на катіонний обмін клітини; у деяких бактерій тейхоєві кислоти беруть участь у регуляції активності автолітичних ферментів - гідролаз, здатних лізувати власний пептидоглікан. Часто тейхоєві кислоти зв'язують власні літичні ферменти. При порушенні таких зв'язків клітина може лізуватися.
Таким чином, крім пептидоглікану, до складу клітинних стінок грампозитивних бактерій входять тейхоєві кислоти, які служать додатковими елементами її просторової організації і виконують ряд інших важливих функцій.
Специфічним компонентом клітинних стінок грамнегативних бактерій є ліпополісахарид (ЛПС). Він локалізований у зовнішній пелюстці зовнішньої мембрани і складається з трьох компонентів (ліпіду А, ядра, О-специфічного ланцюга), які проявляють різноманітні біологічні властивості.
Основні функції ЛПС такі:
- стабілізація зовнішньої мембрани - конструктивна роль;
- запобігання проникненню всередину клітини детергентів, антибіотиків та інших токсичних для клітини речовин - бар'єрна функція;
- акцепторна функція (ЛПС є акцептором для бактерицинів та фагів);
- визначає серологічну специфічність мікробної клітини - О-антиген;
- проявляє токсичні властивості - ендотоксин.
Біохімічний склад ЛПС суттєво відрізняється в різних видів бактерій, але його структура подібна для всіх грамнегативних прокаріотів.
Ліпід А має гідрофільну і гідрофобну частини. Гідрофільна частина представлена дисахаридом, побудованим із залишків Д-глюкозаміну, з'єднаних β-1,6-зв'язком (Salmonella, Pseudomonas, Serratia та ін.) або β-1,4-зв'язком (Shigella, Escherichia та ін.). Дисахаридна ланка, у свою чергу, зв'язана із залишками жирних кислот, які утворюють гідрофобну частину молекули ліпіду А. Жирні кислоти з'єднані між собою складноетерними зв'язками і представлені в основному оксикислотами (оксикапроновою, оксимиристиновою, лауриновою та ін.). ЛПС, які мають незвичну (іншу) будову ліпіду А, не є токсичними.
Ядро (коровий олігосахарид) - олігомер, який включає від 3 до 11 моносахаридних залишків. Його умовно поділяють на дві структурні ділянки: внутрішній кор, або КДО-гептозна ділянка (2-кето-3-дезоксиоктулонова кислота), яка безпосередньо зв'язана з ліпідом А; зовнішній кор, або гексозна ділянка, зв'язана з О-ланцюгом.
О-специфічний полісахаридний ланцюг - полімер, побудований з олігосахаридних ланок, що повторюються. Ці ланки включають моносахаридні залишки, які відрізняються складом і структурою в різних видів і навіть штамів мікроорганізмів. Характер будови О-ланцюга зумовлює серотип даного штаму.
Залежно від повноцінності будови ЛПС розрізняють кілька її фенотипів:
- S-фенотип (від smooth - гладенький) - бактерії, які синтезують повну (повноцінну) структуру ЛПС. На агаризованому середовищі бактерії цього типу утворюють колонії з рівною блискучою поверхнею;
- R-фенотип (rough - нерівний). Ядро ЛПС повноцінне або частково неповноцінне і повністю відсутній О-специфічний ланцюг. Бактерії з таким фенотипом ЛПС утворюють шорсткі, зморшкуваті колонії. Патогенні бактерії при формуванні R-фенотипу знижують свою токсичність;
- RS-фенотип. О-ланцюг представлений однією ланкою, що повторюється.
За хімічним складом клітинні оболонки архебактерій відрізняються від клітинних стінок грампозитивних та грамнегативних еубактерій, але їм також властива диференціація при забарвлюванні за Грамом. Відмінність у структурі клітинної стінки еубактерій і архебактерій полягає насамперед у відсутності у складі клітинних оболонок архебактерій істинного пептидоглікану. Лише у клітинних стінках окремих архебактерій (наприклад, у представників роду Methanobactenum) визначається речовина, подібна до муреїну, яку називають псевдомуреїном (рис. 2.24).
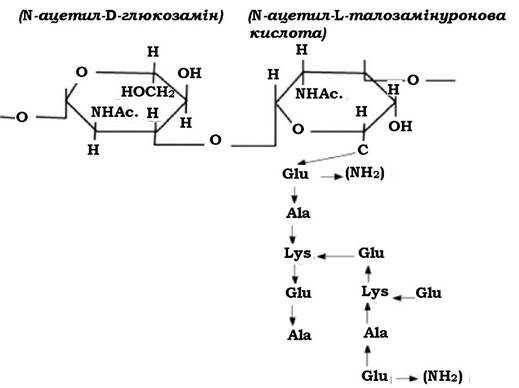
Рис. 2.24. Схема будови молекули псевдомуреїну
Молекула псевдомуреїну має скелет, утворений N-Ac.-D-Gl. і N-Ac.-L- талозамінуроновою кислотою, з'єднаних між собою β-Ι,β-зв'язками. Така структура нагадує глікан. До N-Ac.-L-талозамінуронової кислоти приєднується пептид (пента- або тетрапептид). Пептидні фрагменти включають лише L-форми амінокислот: глутамінову, аланін, лізин та ін.
Мурамова кислота у структурі псевдомуреїну не виявляється. Відсутні також D-форми амінокислот. Електронною мікроскопією показано, що клітинна стінка таких бактерій має вигляд однорідного шару завтовшки 15-40 нм (як і в грампозитивних еубактерій). Описані також випадки (наприклад, деякі метаногенні бактерії), коли товщина клітинної стінки досягає 500 нм. Архебактерії, які у складі клітинної стінки містять псевдомуреїн, при диференціації за Грамом забарвлюються як грампозитивні.
У складі клітинних стінок інших архебактерій (наприклад, екстремальні галофіли) муреїн не визначається. Частіше клітинна стінка складається з гетерополісахариду (у представників Halococcus) або глікопротеїну (Halobacterium). Гетерополісахаридну природу мають і клітинні стінки Methanosarcina barken. У такому випадку речовина клітинної стінки містить цукри, аміноцукри й уронові кислоти. Клітинна стінка деяких галобактерій і метанобактерій утворена білком. Інколи білки мають зв’язок з аміноцукрами. Незвичну будову має клітина Methanospmllum hungatii (рис. 2.25). Вона одягнута білковим циліндричним чохлом, який вкриває всю спіральну багатоклітинну нитку. Між окремими клітинами є проміжки (спейсери), де може відбуватися розрив нитки, тобто її дроблення, розпад. Археї, які не містять псевдомуреїну, забарвлюються як грамнегативні.
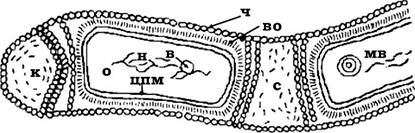
Рис. 2.25. Будова архебактерії Methanospirillum hungatii
ч - білковий чохол; во - внутрішня оболонка; к - кінцевий спейсер; с - міжклітинний спейсер; н - нуклеоїд; в - включення; мв - мембранне включення; цпм - цитоплазматична мембрана
Отже, клітинні стінки різних груп бактерій відрізняються між собою як за хімічним складом, так і за структурною організацією. До їх складу входять речовини, які належать до різних класів хімічних сполук, що забезпечує поліфункціональність клітинної стінки.
Клітини багатьох бактерій здатні синтезувати органічні речовини, які відкладаються із зовнішнього боку клітинної стінки у вигляді слизу або капсул (рис. 2.26).
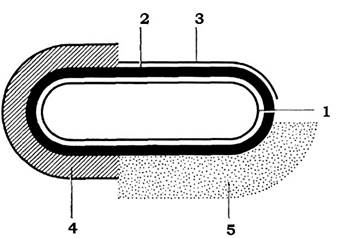
Рис. 2.26. Схематичне зображення розташування поверхневих шарів клітини мікроорганізмів:
1 - цитоплазматична мембрана; 2 - клітинна стінка; 3 - мікрокапсула; 4 - капсула; 5 - слизовий шар
Інколи клітина має і капсулу, і аморфний слиз однакового хімічного складу. Наприклад, клітини Leuconostoc mesenteroides мають капсулу
декстранової природи і слиз такого самого складу, який розчиняється в середовищі.
Капсулою називають шар, який служить зовнішнім покривом клітини і зберігає зв'язок із клітинною стінкою. Залежно від її товщини і консистенції розрізняють: макрокапсули, мікрокапсули, слизові шари і розчинний слиз.
Макрокапсули - це структури, які добре видно у світловому мікроскопі після обробки препарату китайською тушшю або нігрозином. При такій обробці капсули виглядають світлими структурами на темному фоні (рис. 2.27). Тонші капсули визначаються при обробці гомологічними сироватками. Картина, яка виникає при цьому, нагадує набухання.
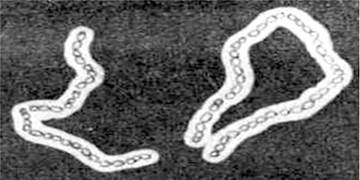
Рис. 2.27. Капсули Bacillus megaterium
Вода становить 95-98 % речовини капсули, а на інші компоненти припадає 2-5 %. Хімічний склад сухої речовини досить різноманітний, але всі речовини сухого залишку гідрофільні, з негативним зарядом і мають високу молекулярну масу (~1 000 000).
Найпоширенішими є капсули полісахаридної природи (Streptococcus, Aerobacter, деякі представники роду Bacillus).
Наприклад, капсульний полісахарид B. polymyxa має у своїй структурі залишки манози, глюкози, галактози та глюкуронової кислоти в рівних співвідношеннях - 1 : 1 : 1 : 1. Речовина капсули може бути представлена як гомо-, так і гетерополісахаридами. Полісахарид S. pneumoniae складається із залишків глюкози і глюкуронової кислоти, які чергуються. Інші полісахаридні капсули містять галактозу, рамнозу, 2-кето-3-дезоксигалактонат, манозу та інші цукри.
У багатьох бацил (B. anthracis, B. subtilis та ін.) капсула складається з поліпептидів, які побудовані залишками D- і L-глутамінової кислот. У деяких представників роду Bacillus речовина капсули утворена лише полі-D-глутаміном. Речовина капсули B. megaterium має більш складну структуру - до її складу входять поліпептидний і полісахаридний компоненти.
Полісахаридна оболонка представників роду Aerobacter чи Klebsiella за своїми розмірами також належить до макрокапсул. Вона містить складний гетерополісахарид, який складається з олігосахаридних одиниць, що повторюються. Олігосахарид Aerobacter aerogenes має такий склад:

У деяких мікроорганізмів, зокрема Mycobacterium tuberculosis, речовина капсули складається з гетерополісахаридів, ліпідів та інших високомолекулярних сполук. Такий склад капсули сприяє виживанню клітин цих бактерій у несприятливих умовах довкілля.
При світлопольних методах дослідження капсула має вигляд гомогенної структури. На електронних мікрофотографіях виявляються фібрили, розташовані перпендикулярно або паралельно клітинній стінці. Інколи такі фібрили утворюють сітчасту структуру.
На щільних поживних середовищах капсульовані клітини утворюють блискучі колонії S-типу. При мутаціях капсульні форми перетворюються в безкапсульні, а колонії набувають R-типу.
Синтез речовини капсули в різних груп мікроорганізмів досить різноманітний. У більшості випадків капсульні полісахариди синтезуються із сахаронуклеотидних попередників. Глікозильні залишки при цьому послідовно переносяться на ланцюги полісахариду за участю ліпідного переносника цитоплазматичної мембрани. Вважається, що цукри, які утворюють речовину капсули, синтезуються самою клітиною, а склад середовища мало впливає на їхній біосинтез.
Якщо речовиною капсули є декстран (поліглюкоза) або леван (поліфруктоза), то її синтез йде за рахунок екзогенного субстрату - дисахариду сахарози (α-глюкозил-β-фруктоза).
У процесі біосинтезу левану має місце послідовне приєднання фруктозильних одиниць до акцепторної молекули сахарози:
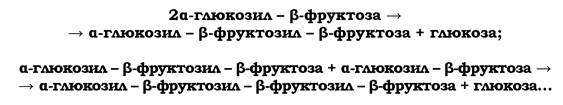
Синтез леванів каталізується позаклітинною левансахаразою. Левановий тип капсул характерний для багатьох мікроорганізмів (Bacillus subtilis, B. cereus, Streptococcus salivarius, S. mutans, Azotobacter chroococcum та ін.).
При синтезі декстрану має місце послідовне приєднання глюкозильних одиниць до залишку молекули сахарози.
Таким чином, декстран - гетерополісахарид, який складається із залишків α-D-глюкози, з'єднаних у положенні 1,6, тобто декстран - це α-1,6-глюкан, паралельні ланцюги якого утворюють сітку.
Було помічено, що багато мікроорганізмів особливо інтенсивно утворюють слиз на середовищах, які містять сахарозу. Одним із таких мікроорганізмів є Leuconostoc mesenteroides - представник гетероферментативних молочнокислих бактерій. За короткий проміжок часу цей мікроорганізм трансформує розчин цукру в декстрановий гель, через що на цукрових підприємствах він отримав назву "бактерія жаб'ячої ікри».
Мікрокапсули інколи розглядають як частину клітинної стінки. Вони мають товщину менш як 0,2 мкм. Найкраще мікрокапсули вивчені в представників родини Enterobactenaceae; вони мають гетерополісахаридну природу.
Струшуванням або гомогенізацією бактеріальних суспензій капсули можна відділити від поверхні мікробної клітини або можна отримати безкапсульні мутанти. Ці процедури не приводять до загибелі клітини, тобто капсула не є життєво важливою структурою. Виходячи з цього, можна було б думати, що капсула - інертна структура клітини, але це не так. Капсула виконує ряд важливих функцій:
- захищає (екранує) клітину від дії токсичних речовин;
- оскільки речовина капсули має негативний заряд, на поверхні клітини концентруються катіони, створюється катіонний пул, який може використовуватися для потреб клітини;
- будучи речовиною сильно гідрофільною, сприяє поглинанню води клітиною, що важливо в умовах дефіциту вологи;
- покращує адгезивні властивості клітини;
- речовина капсули виявляє антигенну специфічність, що використовується для серотипування багатьох груп бактерій (К-антиген);
- у деяких бактерій речовина капсули служить для імунологічної мімікрії - утворення мікроорганізмом антигену, близького до антигенів макроорганізму - організму хазяїна. У таких випадках імунна система макроорганізму не спроможна виробляти антитіла до цього мікроорганізму, бо вона їх не розпізнає. Наприклад, речовина капсули Yersinia pestis має антиген, який є спорідненим з анти-
геном еритроцитів О-групи крові, і в таких випадках людина стає беззахисною при інфікуванні.
Зв'язок капсули з клітинною стінкою може бути різним. Деякі бактерії синтезують слизові речовини, які легко відділяються від клітин, особливо при культивуванні в рідкому поживному середовищі. В інших випадках зв'язок між капсулою і клітинною стінкою настільки стійкий, що її інколи розглядають як частину клітинної стінки. Наявність капсули залежить від штаму мікроорганізму й умов його культивування.
Речовина, яка оточує клітину, може мати аморфний, безструктурний вигляд і легко відділятися від поверхні клітини. У такому випадку говорять про слизові шари.
Інколи слиз зв'язує окремі клітини, утворюючи специфічні угруповання. Так, Acetobacter xylinum виділяє целюлозу, яка зв'язує окремі клітини в щільну плівку. В Sarcina ventriculi клітини з'єднуються за допомогою целюлози в "агрегати" правильної форми. Целюлоза служить у цих випадках зв'язуючою речовиною. За своєю структурою й функцією вона відрізняється від речовини капсули. Втрата здатності до утворення целюлози в мутантів не порушує росту мікроорганізмів, але характер угруповань, які утворюють клітини, змінюється.
Чохли, на відміну від капсул, мають, як правило, тонку структуру. Часто в них визначається декілька шарів з різною будовою. Інколи чохол може оточувати декілька клітин. Це особливо характерно для нитчастих бактерій, зокрема Sphaerotilus natans - бактерії, яка окиснює залізо. У воді цей мікроорганізм формує нитки, що утворюють згустки, які можуть забивати труби, відстійники, ями для стоків тощо. Така нитка має декілька клітин, вкритих загальним чохлом. У випадку Sphaerotillus natans ця структура містить (у %): вуглеводи (36); гексозаміни (~11); білки (~27); ліпіди (~5); сполуки фосфору (~0,5). Чохли S. natans часто інкрустовані окислами заліза.
На поверхні деяких бактерій визначаються також шипи. Шипи - це структури циліндричної форми білкової природи, які закріплюються на поверхні зовнішньої мембрани. Довжина шипів коливається в межах 1-3 мкм, а товщина становить ~65 нм.
Білок шипів - спінін (лат. spina - шип) має молекулярну масу 19 000.
Шипи виявляються на поверхні клітин деяких псевдомонадоподібних планктонних морських бактерій. Їх легко можна обірвати (порушити) дією механічних факторів, органічних розчинників. На поверхні однієї клітини визначається до 10 шипів. Клітини, які мають шипи, як правило, нерухомі. Вони мають більшу щільність і легше осідають. Функції шипів вивчаються.
У деяких бактерій відбувається направлене виділення слизу, внаслідок чого утворюються стеблинки (рис. 2.28), які можуть забезпечувати бактеріям можливість обмеженого переміщення (наприклад, Nevskia, Gallionella).
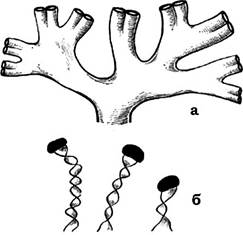
Рис. 2.28. Бактерії зі слизовими стеблинками:
а - Nevskia; б - Gallionella
Між цими надоболонковими структурами у прокаріотів установлено багато перехідних форм, через що інколи не можна чітко відмежувати капсулу від слизових виділень клітини чи капсулу від чохла.
Пілі (фімбрії) - це прямі циліндричні білкові структури, які виступають над поверхнею клітини і закріплені у клітинній стінці (рис. 2.29). Трубочка пілі проходить крізь шар муреїну і зовнішню мембрану клітини на її зовнішній бік.
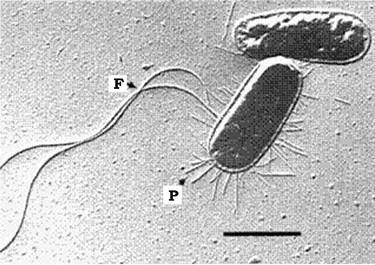
Рис. 2.29. Клітини E. coli:
F - джгутики; Р - пілі
Нитка пілі являє собою білок пілін з молекулярною масою 14 500-26 200. Білкові мономери зібрані в спіральні ланцюги навколо порожнинної серцевини.
Розрізняють пілі загального типу і статеві (F-пілі).
Найбільш детально пілі вивчені у клітин E. coli. У цих бактерій наявні як пілі загального типу, так і статеві.
Пілі загального типу поділяються на дві групи. Пілі типу 1 досить міцно зв'язані з клітиною. Вони стійкі до дії хімічних реагентів. Їх можна зруйнувати кип'ятінням у розчинах з низькими значеннями pH, що супроводжується денатурацією білка. Білок пілей цього типу має молекулярну масу 17 000. На поверхні бактеріальної клітини може визначатися від 50 до 400 пілей типу 1. Довжина пілі досягає 1,5 мкм, зовнішній діаметр становить ~7 нм, а діаметр внутрішнього отвору - 2,0-2,5 нм.
Пілі типу 1 розташовуються перитрихально і виконують певні функції, а саме:
- викликають аглютинацію еритроцитів, що зумовлюється здатністю пілей приклеюватися до них;
- визначають здатність клітини до адгезії;
- надають клітині гідрофобності, внаслідок чого при рості в рідкому поживному середовищі такі бактерії утворюють поверхневу плівку;
- знижують електрофоретичну рухомість клітин.
Пілі типу 2 антигенно і структурно нагадують пілі типу 1, але вони не сприяють утворенню плівки при рості таких бактерій у рідкому поживному середовищі і не викликають аглютинації еритроцитів. Можливо, що вони являють собою мутантну форму пілей типу 1.
В ентеропатогенних штамів E. coli пілі є одним із факторів патогенності - вони забезпечують здатність клітин прикріплюватися до епітелію кишок. Це веде до колонізації епітелію бактеріями, внаслідок чого посилюється вплив бактеріального ентеротоксину на клітини епітелію кишок, порушується водний обмін тканин. При цьому бактерії інтенсивно розмножуються в тонких кишках, а потім у великих кількостях виносяться з фекаліями в довкілля.
Статеві пілі - це білкові циліндри, розташовані перпендикулярно до поверхні клітини. Молекулярна маса білка, який виявляється в пі- лях цього типу, - 11 800. Товщина нитки статевої пілі коливається в межах 8,5-9,5 нм, а довжина досягає 1,1 мкм. При струшуванні бактеріальної суспензії вони легко руйнуються.
Статеві пілі утворюються на клітинах донорських штамів, характерною особливістю яких є наявність особливого генетичного детермінанта - статевого фактора або фактора трансмісивності. Останній може бути автономним репліконом (F-фактор), входити до складу автономного реплікона або інтегруватися з бактеріальною хромосомою.
Синтез F-піліну відбувається на рибосомах, зв'язаних з ЦПМ. У цитоплазмі він не виявляється. Пул піліну накопичується в ЦПМ. Кожна молекула має сигнальний пептид, який відщеплюється в процесі транспорту піліну через ЦПМ. Утворенню статевих пілей перешкоджає наявність у середовищі ціаніду, азиду натрію, динітрофенолу. F-пілін - це гідрофобна структура, яка легко дисоціює в розчинах додецилсульфату натрію і руйнується органічними розчинами. Клітини, що мають F-пілі, малорухливі і мають тенденцію до автоаглютинації, наприклад при зниженні pH середовища.
F-фактор має гени, які відповідають за процес кон'югації, а також гени, що детермінують F-пілі. Синтез F-пілей контролюється комплексом генів (~13). При депресії F-фактора утворюється 1-2 статеві пілі. В анаеробних умовах або на середовищі оптимального складу утворюється 4-5 пілей цього типу.
F-пілі мають канал (отвір), через який у процесі кон'югації передається генетичний матеріал з однієї клітини в іншу. При цьому вільний
кінець F-пілі приєднується до реципієнтної клітини в місці розташування рецептора. Рецептором служить білок зовнішньої мембрани реципієнтної клітини. На початку контакт не дуже стійкий, і його можна порушити гідродинамічними впливами. З часом (через кілька хвилин) контакт стає стабільним, і між двома клітинами формується цитоплазматичний місток.
Статеві пілі найкраще утворюються клітинами, які перебувають у фазі активного росту. Клітини, що перебувають у стаціонарній фазі розвитку, пілей, як правило, не утворюють і є поганими донорами генетичного матеріалу.
Крім E.coli, F-пілі утворюються також іншими представниками родини Enterobacteriaceae: Vibrio, Pasteurella, Aeromonas, Pseudomonas.
У деяких бактерій утворюються пілі, які здатні скорочуватися, наприклад, у Pseudomonas aeruginosa, Acinetobacter calcoaceticus, Streptococcus sanguis, окремих представників роду Moraxella та Pasteurella. Клітини, які мають такий тип пілей, здатні до смикального руху, що призводить урешті-решт до переміщення окремих клітин (а інколи й цілих колоній) по щільному субстрату.
Таким чином, до поверхневих структур бактеріальної клітини відносять клітинну стінку, капсулу, чохли, стеблинки, простеки, пілі, шипи та джгутики.
Цитоплазма - це вміст клітини, оточений цитоплазматичною мембраною (ЦПМ). Вона є середовищем, яке зв'язує всі внутрішньоклітинні структури в єдину систему. Внутрішню порожнину клітини заповнює цитозоль - напіврідка колоїдна маса, що складається на 7085 % з води, РНК, білків (включаючи ферменти), продуктів і субстратів метаболічних процесів. У цитоплазмі містяться структури клітини (рибосоми, нуклеоїд та ін.), цитоплазматичні мембранні утвори (газові вакуолі, мезосоми, хроматофори, тилакоїди), включення, оточені білковою мембраною (хлоросоми, фікобілісоми, аеросоми, мегнетосоми, карбоксисоми), а також структури, позбавлені мембрани, які розглядаються як запасні речовини.
Цитоплазматична мембрана є обов'язковим і життєво важливим структурним елементом кожної клітини. Порушення цілісності ЦПМ супроводжується втратою клітиною життєздатності. ЦПМ виконує ряд важливих функцій:
- служить вибірковим бар'єром між внутрішнім вмістом клітини і зовнішнім середовищем;
- ЦПМ клітин багатьох груп прокаріотів відіграє значну роль в енергетичному обміні клітини, чого не спостерігається у клітин еукарі- отів. Наприклад, в аеробних бактерій дихальна система перенесення електронів "вмонтована" в ЦПМ (в еукаріотів ця система локалізована в мітохондріях). При цьому бактерії з інтенсивним типом дихальної системи мають досить складну структуру ЦПМ - утворюються численні інвагінації, які проникають у цитоплазму;
- вважається, що на внутрішній поверхні ЦПМ є спеціальні ділянки, до яких прикріплюється ДНК. Це підтверджується і тим, що ріст мембрани (її подовження) супроводжується поділом геномів;
- ЦПМ виявляє певну пружність, але в той же час здатна і розтягуватися. Наприклад, якщо клітини Acholeplasma laidlawii помістити в гіпотонічний розчин NaCl, то їхня поверхня збільшиться приблизно на 50 % без порушення цілісності мембрани.
На частку ЦПМ припадає 8-15 % сухої маси клітини. На електронних мікрофотографіях ультратонких зрізів ЦПМ має тришарову структуру (рис. 2.30): два електронно-щільних шари, які обмежують електронно-прозорий проміжок. При цьому осмофільні електронно-щільні шари мають товщину 2-3 нм кожен, а електронно-прозорий проміжок між ними - 4-5 нм.
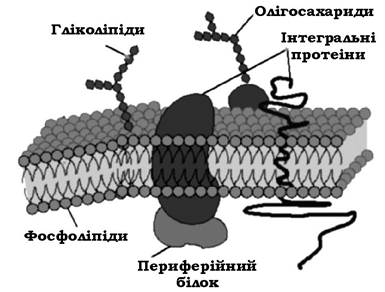
Рис. 2.30. "Рідинно-мозаїчна" модель мембрани
За хімічним складом ЦПМ є білково-ліпідним комплексом, який містить 50-75 % білків, 15-45 % ліпідів та невелику кількість вуглеводів. У ліпідах мембран багатьох прокаріотів виявлено ряд специфічних жирних кислот, яких немає в мембранах еукаріотичних клітин.
Найдетальніше вивченим компонентом мембран мікроорганізмів є ліпіди. Ліпіди мембрани складаються з фосфо- і нейтральних ліпідів. Фосфоліпіди є основними ліпідами ЦПМ бактеріальної клітини. Вони становлять 70-90 % сухої маси ЦПМ.
Скелет молекули мембранних Р-ліпідів утворюється фосфатидною кислотою (ФК), до складу якої входять гліцерин і залишки жирних кислот (R) (рис. 2.31). До ФК приєднуються залишки спиртів, амінокислот та інших сполук (Х).
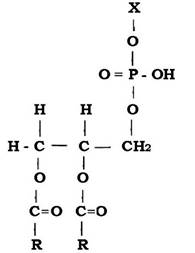
Рис. 2.31. Структура молекули фосфатидної кислоти
Найпоширенішими серед мембранних Р- ліпідів є: фосфатидилетаноламін (ФЕ): ФK-СН2-СН2NH2; фосфатидилгліцерин (ФГ): ФK-СН2-СНОН-СН2ОН та дифосфатидилгліцерин (кардіоліпін - КЛ): ФK-СН2-СНОН-СН2-ФK.
Склад Р-ліпідів може значно змінюватися, але функції мембрани, як правило, не порушуються. Але якщо вміст фосфатидилетаноламіну зменшується більше як на 50 %, ріст клітини припиняється. Такий ефект не спостерігається навіть за повної відсутності кардіоліпіну.
Близько 50 % поверхні мембрани зайнято білками. Деякі з них мають слабкий зв'язок з ЦПМ і при зміні іонної сили розчину можуть вивільнятися. Ці білки називають периферійними. Частина білків має досить стійкий зв'язок з ліпідами ЦПМ, утворюючи білково-ліпідні комплекси, які становлять ~10 % маси мембрани. Такі білки називають інтегральними.
Білковий склад ЦПМ досить різноманітний. Так, у мембрані E. coli визначається близько 120 різних білків. Серед них особливе місце займають транспортні білки, до яких належать пермеази, і білки, які забезпечують активний транспорт речовин, а також біосинтетичні ферменти, які здійснюють кінцеві етапи синтезу мембранних ліпідів і макромолекул клітинної стінки (муреїну, тейхоєвих кислот, ліпополісахаридів).
У мембрані прокаріотів містяться компоненти апарату регенерації АТР, а в пурпурових бактерій (Rhodospirillum) у ЦПМ локалізований і фотосинтетичний апарат клітини.
Більшість мембран мікроорганізмів містять 2-5 % вуглеводів. У деяких випадках вони можуть бути залишковим матеріалом клітинної стінки, що прилип до мембрани. Є дані, що в мембранах грампозитивних бактерій містяться гліколіпіди. Так, мембрани Micrococcus lysodeikticus містять манозилдигліцерид, а в Streptococcus faecalis виявляються моноглюкозилдигліцерид і галактозилглюкозилдигліцерид.
Площа ЦПМ може змінюватися за рахунок інвагінацій. Останні утворюються в центрі клітинного поділу. Вважається, що такі інвагінаційні структури беруть участь у побудові поперечної перетинки у клітині під час її поділу.
Інвагінаційні утворення необхідні також для розміщення центрів дихальної і фотосинтетичної активності. Це підтверджується, зокрема, тим, що такі інвагінації визначаються в мембранах бактерій з високою дихальною активністю (Azotobacter, нітрифікуючі бактерії).
Таким чином, ЦПМ прокаріотичної клітини в цілому подібна до мембрани еукаріотичної, але в бактерій вона багатша на білки.
Раніше було описано відмінності між прокаріотичними й еукаріотичними клітинами щодо їхніх мембранних систем. Відсутність у прокаріотів типових органел, тобто структур, повністю відмежованих від цитоплазми елементарними мембранами, - принципова особливість їхньої клітинної організації.
Серед внутрішньоцитоплазматичних мембран розрізняють декілька видів (табл. 2.3). Розвинена система внутрішньоцитоплазматичних мембран характерна для більшості фотосинтезуючих прокаріотів. Оскільки доведено, що в цих мембранах локалізований фотосинтетичний апарат клітини, вони отримали загальну назву фотосинтетичних мембран. Усі фотосинтетичні мембрани, як і всі внутрішньоклітинні, - похідні цитоплазматичної мембрани, що утворилися внаслідок її розростання і глибинної інвагінації в цитоплазму. У деяких бактерій, наприклад пурпурових, фотосинтетичні мембрани зберігають тісний зв'язок з ЦПМ і легко виявляються при електронно-мікроскопічному дослідженні ультратонких зрізів клітини. У ціанобактерій такий зв'язок менш виражений.
Таблиця 2.3. Мембрани прокаріотів
Прокаріоти |
Фізіологічні групи |
Мембрани |
||||
зовнішня клітинна мембрана |
ЦПМ |
внутрішньо-цитоплазматичні |
||||
фотосинтетичні |
мезосомальні |
інші |
||||
Грампозитивні |
Хемотрофи |
- |
+ |
- |
± |
- |
Грамнегативні |
Фототрофи |
+ |
+ |
± |
±* |
- |
Хемотрофи |
+ |
+ |
- |
± |
+** |
|
* не виявляється в зелених бактерій і ціанобактерій Gloeobacter violaceus;
** сильно розвинені в нітрифікуючих, азотофіксувальних, метанокиснювальних бактерій.
Внутрішньоцитоплазматичні мембрани фотосинтезуючих бактерій можуть мати вигляд трубочок, пухирців (везикул, хроматофорів) або сплющених замкнутих дисків (тилакоїдів), утворених двома тісно зближеними мембранними пластинами (ламелами). Система фотосинтетичних мембран дуже пластична. Її морфологія і ступінь розвитку у клітині визначаються багатьма факторами зовнішнього середовища (інтенсивність світла, концентрація кисню, наявність поживних речовин) та віковими характеристиками культури. Проте в групі зелених бактерій та ціанобактерій Gloeobacter violaceus внутрішньоклітинні фотосинтетичні мембрани не виявляються. Основні компоненти їхнього фотосинтетичного апарату локалізовані в ЦПМ, і лише світлозбиральні пігменти (хлоросоми в зелених бактерій і фікобілісоми у ціанобактерій) містяться в особливих структурах, які прилягають до ЦПМ і не мають елементарної мембрани.
У прокаріотичних організмів описані локальні інвагінації ЦПМ - мезосоми, які добре розвинені і складно організовані в грампозитивних бактерій. У грамнегативних прокаріотів ці структури виявляються рідше і вони простіше організовані.
Мезосоми - це відносно прості, а інколи й досить складні інвагінації ЦПМ. Вони відрізняються розмірами, формою і локалізацією у клітині. Виділяють три основних типи мезосом: ламелярні (пластинчасті), везикулярні (мають форму пухирців) і тубулярні (трубчасті) (рис. 2.32).
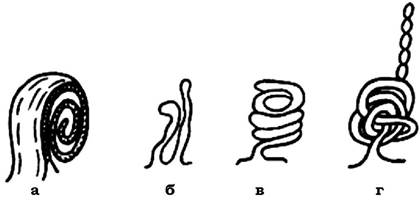
Рис. 2.32. Типи будови істинних мезосом:
а - ламелярний; б, в, г - трубчастий
Часто можна спостерігати мезосоми змішаного типу, вони можуть складатися з ламел, трубочок і пухирців. За розташуванням у клітині розрізняють: мезосоми, які утворюються в зоні клітинного поділу і формування поперечної перетинки (септи); мезосоми, до яких прикріплений нуклеоїд; мезосоми, які сформовані внаслідок інвагінації периферійних ділянок ЦПМ.
Термін "нуклеїдосоми" належить до мезосомальноподібних утворень, зв'язаних з хромосомою. Зв'язок ДНК зі специфічною ділянкою мембрани необхідний для функціонування геному, проте, як і істинні мезосоми, нуклеїдосоми виявляються не в усіх бактерій і не завжди, тобто їх наявність у клітині не обов'язкова.
Існують різні погляди щодо ролі мезосом у прокаріотичній клітині.
Деякі автори вважають, що вони не є обов'язковими структурами прокаріотів, а служать лише для підсилення певних функцій клітини, збільшуючи загальну "робочу" поверхню мембрани. Є також дані, що з мезосомами пов'язане підсилення енергетичного метаболізму клітин. Вважається, що ці структури відіграють певну роль у реплікації хромосоми та її розходженні між дочірніми клітинами. Установлено, що мезосоми деяких грампозитивих бактерій беруть участь у секреторних процесах. Висловлюється також думка, що мезосоми не беруть активної участі в процесах клітинного метаболізму, а виконують структурну функцію, забезпечуючи компартменталізацію прокаріотичної клітини, тобто просторове розмежування внутрішньоклітинного вмісту на порівняно відокремлені ділянки, що створює більш сприятливі умови для перебігу певних ланок ферментативних реакцій.
Таким чином, одночасне існування різних гіпотез щодо ролі мезосом у прокаріотичній клітині свідчить про те, що їхні функції продовжують залишатися не з'ясованими.
Добре розвинена система внутрішньоцитоплазматичних мембран, яка морфологічно відрізняється від мезосомальних, описана в представників трьох груп грамнегативних хемотрофних бактерій (азотофіксувальних, нітрифікуючих, метанокиснювальних), для яких установлена висока активність дихання, а також здатність метаболізувати розчинні в рідкому середовищі газоподібні сполуки.
Хроматофори. Для деяких груп мікроорганізмів характерна наявність мембранних систем, які є похідними ЦПМ і просторово зв'язані з нею, хоча такий зв'язок не завжди виявляється.
На внутрішньоклітинних мембранних системах, які визначаються як хроматофори, локалізовані процеси фотосинтезу в пурпурових бактерій. У Rhodospirillum, Thiocystis, Chromatium і багатьох інших пурпурових бактерій мембранні структури хроматофора мають вигляд трубочок і пухирців діаметром 20-100 нм. Трубочки та пухирці утворюють у клітині складну мембранну сітку і в численних ділянках зберігають зв'язок з ЦПМ. На репліках із сколів таких мембран на внутрішній поверхні виявляються частинки діаметром 7 і 10 нм.
У деяких пурпурових бактерій, зокрема Thiocapsa pfennigii, хроматофор утворений системою трубочок, розташованих паралельними або розгалуженими рядами. Хроматофори Rhodopseudomonas gelatinosa і R. tenue являють собою подвоєні мембранні пластинки, які є виростами ЦПМ. Такі подвоєні мембрани називають тилакоїдами. У клітинах деяких пурпурових бактерій тилакоїди зібрані в стоси. Стоси дископодібних тилакоїдів виявляються у клітинах деяких видів Rhodopseudomonas і Ectothiorhodospira. Пурпурові бактерії, які брунькуються (наприклад, Rhodomicrobium, Rhodopseudomonas viridis), мають хроматофори у вигляді пластинок, розташованих паралельно клітинній стінці. Такий хроматофор складається інколи з декількох тилакоїдів, на полюсі клітини він має отвір, через який у бруньки може переходити ДНК після поділу нуклеоїду. Під час брунькування тилакоїди залишаються в материнській клітині, а в бруньках вони утворюються заново.
На відміну від хлоропластів рослин, хроматофори бактерій можуть зникати й утворюватися заново. Це явище спостерігається в бактерій, здатних до гетеротрофного розвитку в темряві. При цьому хроматофори в темряві зникають і знову з'являються при вирощуванні бактерій на світлі.
Розвиток системи внутрішньоклітинних мембран властивий метано-киснювальним бактеріям. У них виявляється два типи таких мембран. Мембрани типу I складаються із стосів щільно упакованих везикулярних дисків, розташованих по всій цитоплазмі. Такий тип структур виявлено в Methylomonas, Methylobacter, Methylococcus. Ці структури утворюються за рахунок інвагінації ЦПМ на одному з полюсів, хоча точка контакту внутрішньоклітинних структур і цитоплазматичної мембрани може бути дещо зміщена від полюса клітини. Мембрани типу II характерні для Methylosinus, Methylocystis, Methylobacterium - це спарені мембранні шари, розташовані по периферії цитоплазми.
Функціональна роль внутрішньоклітинних мембранних систем метилотрофів до кінця не вивчена, але існує думка, що завдяки їхній наявності збільшується локальна концентрація субстратів (метану й кисню) метанмонооксигенази, відбувається просторове зближення всіх компонентів, які беруть участь в окисненні метану.
Бактеріальні рибосоми служать місцем синтезу білка. Це округлі рибонуклепротеїнові частинки розміром 16-18 нм, розташовані в цитоплазмі. У рибосомах міститься 80-85 % усієї бактеріальної РНК.
Рибосома складається з двох субчастинок: у бактерій - це субчастинки 30S та 50S, які утворюють рибосому 70S типу, тобто таку, яка при ультрацентрифугуванні осідає зі швидкістю близько 70 одиниць Сведберга (S), їх називають 70S-рибосомами. Бактеріальна клітина має приблизно від 5 000 до 90 000 рибосом, що визначається інтенсивністю синтезу білка. Еукаріоти мають рибосоми 80S типу.
30S субчастинка має одну молекулу 16S РНК і в більшості випадків - по одній молекулі білка 21 виду. Білкові молекули позначаються S1-S21 відповідно до їх положення в поліакріламідному гелі при хроматографії. 50S-субодиниця складається з двох молекул РНК (23S і 5S) і по одній копії білків 34 видів - L1-L34. Більшість рибосомальних білків містяться в одній копії і виконують структурну функцію.
Будова рибосоми еубактерій, архебактерій та еукаріотів у загальних рисах подібна (рис. 2.33). Разом з тим існують і деякі відмінності: рибосоми архебактерій і еукаріотів мають дзьобик (носик), відсутній в еубактеріальних рибосом; рибосома еукаріотів відрізняється від бактеріальної наявністю лопатей.
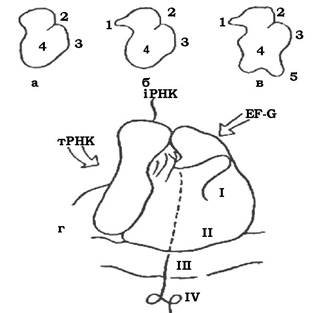
Рис. 2.33. Будова рибосоми:
а-в - малі субчастинки еубактерій (а), архебактерій (б), цитоплазматичної рибосоми еукаріотів (в); г - еубактеріальна рибосома, зв'язана з ЦПМ; I - транслююча область; II - область виходу білка; III - ЦПМ бактерії; IV - молекула білка, що синтезується; EF-G - фактор елонгації; 1 - дзьобик (носик); 2 - головка; 3 - платформа; 4 - тіло; 5 — лопаті
Таким чином, бактеріальна клітина містить у цитоплазмі всі необхідні структури, які забезпечують її життєдіяльність.
Запасні речовини перебувають в осмотично інертній формі, але якщо умови змінюються і стають сприятливими для росту, то вони включаються в метаболічні процеси (табл. 2.4). За консистенцією ці речовини можна поділити на рідкі (наприклад, полі-β-гідроксимасляна кислота - ПОМК), напіврідкі (сірка) та тверді (глікоген).
Для мікроорганізмів, як і для організмів тварин, вуглеводи не є основним будівельним матеріалом. Це характерно лише для рослин, які є джерелом вуглеводів для всіх інших живих істот.
Мікроорганізмам властиве накопичення деяких вуглеводів як запасних поживних речовин. До таких речовин належать глікоген, який називають тваринним крохмалем, оскільки він утворюється в організмі людини і тварин і використовується як запасний енергетичний матеріал.
Запасні полісахариди бактерій (глікоген) - це глюкани, які на відміну від полісахаридів клітинної стінки утворюються з α-D-глюкози. Скелет молекули має глюкозидні зв'язки α(1-4)-типу та зв'язки в точках галуження α-(1-6)-типу. Галуження відходять у середньому через кожних 12 залишків глюкози в основному ланцюзі.
Запасна речовина |
Структурна характеристика |
Хімічний склад |
Функції |
Поширення |
Гранули глікогену (α-гранули) |
Сферичної форми, діаметр 20-100 нм |
Високомолекулярні полімери глюкози |
Джерело вуглецю й енергії |
Значно поширений тип запасних речовин |
Гранули полі-β- оксимасляної кислоти |
Діаметр 100-1000 нм; оточені одношаровою білковою мембраною 2-3 нм завтовшки |
98 % полімеру полі-β- оксимасляної кислоти; 2 % білка |
Джерело вуглецю й енергії |
Значно поширені лише в прокаріотів |
Ціанофіцинові гранули |
Розмір і форма різні; можуть досягати в діаметрі 500 нм |
Поліпептид, який містить аргінін і аспарагінову кислоту (1 : 1); М.м. - 25-100 х 103D |
Джерело азоту |
Виявляються в багатьох видів ціанобактерій |
Гранули поліфосфату |
Діаметр близько 500 нм, залежить від об'єкта й умов вирощування |
Лінійні полімери ортофосфату |
Джерело фосфору |
Поширений тип запасних гранул |
Гранули сірки |
Діаметр 100-800 нм; оточені одношаровою білковою мембраною завтовшки 2-3 нм |
Включення рідкої сірки |
Донор електронів або джерело енергії |
Пурпурові сіркобактерії, безбарвні бактерії, які окиснюють H2S |
Вуглеводневі гранули |
Діаметр 200-300 нм; оточені білковою оболонкою 2-4 нм завтовшки |
Вуглеводні такого ж типу, що і в середовищі |
Джерело вуглецю й енергії |
Представники родів Arthrobacter, Acinetobacter, Mycobacterium, Nocardia та інші прокаріоти, які використовують вуглеводні |
При реакції з розчином Люголя полісахариди утворюють червоно-фіолетове (або коричневе) забарвлення. Молекулярна маса глікогену може досягати 1 000 000. Глікоген, або тваринний крохмаль, має риси подібності з амілопектином, але його ланцюги мають більше галуження. Він виявляється у клітинах дріжджів і деяких бацил (B. polymyxa), багатьох представників родини Enterobacteriaceae (Escherichia, Salmonella), у Sarcina, Arthrobacter.
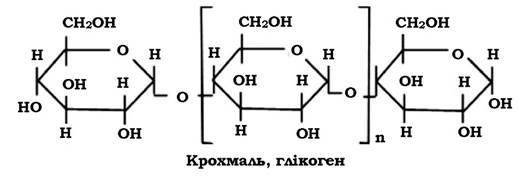
Під час мікроскопії глікоген має вигляд округлих електронно- щільних гранул діаметром до 200 нм. Гранули можна розчинити шляхом обробки гарячим KOH.
Завдяки α-глюкозидним зв'язкам поліглюкозні ланцюги не витягнуті в довжину, а закручені гвинтоподібно.
Накопичення полісахаридних гранул стимулюється дефіцитом азоту при надлишку джерела вуглецю й енергії в середовищі. При культивуванні бактерій в оптимальних умовах глікоген накопичується під час переходу культури у фазу стаціонарного розвитку.
У клітинах деяких бактерій вміст полісахаридів може досягати 25 % їхньої маси.
Жироподібні речовини. Гранули крапель жиру дуже часто зустрічаються у клітинах мікроорганізмів у формі полі-β-оксимасляної кислоти (ПОМК) - поліефіру β-оксимасляної кислоти, в якій окремі мономери з'єднані складним ефірним зв'язком за рахунок карбоксильної та гідроксильної груп сусідніх молекул β-оксимасляної кислоти.
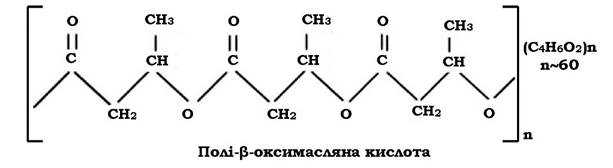
ПОМК як запасна речовина виявляється у клітинах Azotobacter, Rhizobium, Bacillus, фототрофних бактерій і практично відсутня в об лігатних анаеробних хемотрофів. У деяких бактерій, які окиснюють вуглеводні, полі-β-оксимасляна кислота становить до 70 % сухої речовини клітин. Накопичення ліпідів у клітині відбувається в умовах, коли середовище багате на джерело вуглецю і бідне на азот.
ПОМК у клітинах має вигляд округлих, інколи видовжених гранул розміром 200-800 нм. У клітинах їхній вміст може досягати 80 % від сухої маси. Для їх виявлення використовують ліпофільні барвники - судан 3 (гранули забарвлюються в червоний колір), судан чорний (гранули ПОМК мають чорний колір). Такі суданофільні гранули розчиняються у хлороформі, спиртах, піримідині, диоксані, толуолі, 1М NaOH, камфорі і практично нерозчинні у воді, ефірі, метиловому й етиловому спиртах, ацетоні.
Гранули ПОМК оточені білковою мембраною, товщина якої коливається від 2,2 до 8,0 нм. З мембраною зв'язані ферменти синтезу і розпаду цієї запасної речовини.
У клітинах деяких бактерій, наприклад B. cereus, представників роду Azotobacter, посилення синтезу ПОМК спостерігається при внесенні в середовище глюкози, а у Micrococcushalodenitnficans - у присутності гліцерину, пірувату або ацетату.
Важливим фактором, який стимулює синтез ПОМК, є лімітування екзогенного джерела азоту.
Якщо клітини, які містять гранули ПОМК, помістити в середовище без джерела вуглецю й енергії, то вони починають енергійно використовувати ПОМК.
Еукаріотичні організми не мають ферментів синтезу чи розпаду ПОМК, тому бактерії, які накопичують у своїх клітинах цю речовину, небажано використовувати для виробництва харчових чи кормових добавок.
У клітинах мікобактерій, нокардій і актиноміцетів у вакуолях можуть накопичуватися інші жироподібні речовини, здатні навіть виділятися в середовище. Так, у клітинах мікобактерій до 40 % сухої маси становлять воски (складні ефіри вищих жирних кислот і спиртів).
Поліфосфати. Багато бактерій і зелені водорості виявляють здатність запасати фосфорну кислоту у вигляді гранул поліфосфату. Уперше їх було виявлено у клітинах Spirillumvolutans, тому вони називаються волютиновими гранулами. Іншу свою назву - метахроматичні гранули - вони отримали через те, що поліфосфати викликають у деяких барвників (метиленовий синій, толуїдиновий синій) характерні зміни кольору - метахромазію. Виявлення волютину краще проводити при низьких значеннях pH, оскільки вони зберігають забарвлення в кислому середовищі, що є основним показником належності включень до волютинових. В основі метахроматичного забарвлення лежить взаємодія полікатіонів, якими є основні барвники, з поліаніона- ми, тобто з поліфосфатами, що викликає поглинання барвниками
хвиль більшої довжини. Суть цієї реакції полягає в полімеризації барвника на макромолекулах поліаніону.
Зерна поліфосфатів розчиняються в гарячій воді і слабких лугах. Вони нерозчинні в спиртах, ефірі та хлороформі.
У значних кількостях волютин накопичується у клітинах деяких корінеформних бактерій. У клітинах Corynebacterium diphtheriae ці включення називають тільцями або зернами Бабеша - Ернста (на честь учених, які вперше звернули на них увагу).
Волютин утворює гранули діаметром до 1 мкм, які складаються переважно з поліфосфатів, але в препаратах гранул виявляється також РНК, ДНК, білок.
Вважається, що волютинові гранули виконують функцію депо фосфатів, за рахунок яких клітина може ділитися при дефіциті фосфору в середовищі. У деяких випадках відмічається залежність накопичення і розкладу волютину від стадій клітинного циклу бактеріальної популяції. Так, під час вивчення синхронних культур Corynebacterium diphtheriae було встановлено, що волютин накопичується у клітинах перед їх поділом і витрачається в процесі останнього. Особливо енергійно волютин синтезується при перенесенні бактерій із середовища, лімітованого за фосфором, у середовище, багате на фосфати. Поліфосфати використовуються клітинами як джерело фосфору. Питання, чи можуть вони служити джерелом енергії у прокаріотів, залишається дискусійним.
Специфічною запасною речовиною ціанобактерій є ціанофіцинові гранули. Хімічний аналіз показав, що вони складаються з поліпептиду, який містить аргінін і аспарагінову кислоту в еквімолярних кількостях. Скелет молекули побудований із залишків аспарагінової кислоти, з'єднаних пептидними зв'язками, а до її β-карбоксильної групи приєднані залишки аргініну. Для початку синтезу ціанофіцину необхідні молекули АТФ, іони K+і Mg2+. Поява ціанофіцинових гранул при культивуванні ціанобактерій у середовищі з азотом та їх зникнення при його виснаженні свідчить про те, що вони служать резервом азоту, який мобілізується в разі його дефіциту в середовищі.
Бактерії, метаболізм яких пов'язаний із сполуками сірки, здатні відкладати у своїх клітинах молекули сірки. Сірка накопичується, коли в середовищі є сірководень, і окиснюється до сульфату, якщо весь сірководень вичерпується. Для аеробних тіонових бактерій, які окиснюють H2S, сірка служить джерелом енергії, а для анаеробних фотосинтетичних - донором електронів.
Газові вакуолі - це структури, які оточені мембраною й утворені скупченням газових пухирців (везикул). Вони виявляються тільки в прокаріотичних клітинах. Газовий пухирець має форму циліндра завдовжки 200-1000 нм і діаметр близько 75 нм. Білкова оболонка, яка оточує вакуоль, має товщину до 2 нм, вона побудована з білкових субодиниць із молекулярною масою 14 000. Гідрофобні амінокислоти оболонки повернуті всередину вакуолі, а гідрофільні - на зовнішній бік. Така упаковка амінокислот оболонки перешкоджає проникненню води всередину газової вакуолі. Склад повітря, яке визначається у вакуолях, відповідає його складу в навколишньому середовищі.
При мікроскопії у світлому полі газові вакуолі мають вигляд оптично-порожнього простору, який сильно заломлює світло. При електронній мікроскопії вони мають вигляд порожнистих циліндрів з конічними кінцями, розташованими паралельними рядами.
Утворення газових вакуолей (аеросом) характерне для багатьох водних бактерій, особливо фототрофних, але ряд безбарвних бактерій (Pelonema, Peloploca), галобактерії (Halobacterium halobium) і деякі представники роду Clostridium також містять газові вакуолі. Вони надають клітині здатності змінювати свою середню щільність і залишатися в завислому стані, через що деякі бактерії можуть у стратифікованих озерах утримуватися в шарі води з оптимальними умовами для їх розвитку. Аноксигенні фототрофні бактерії, зокрема пурпурові (Lamprocystis, Amoebobacter, Thiodictyon) і зелені (Pelodictyon), ростуть у водоймах в анаеробній зоні (в гіполімніоні). Вважається, що плавучість цих організмів є достатньою для того, щоб вони могли перебувати в суспендованому стані в холодному (більш важкому) шарі води гіполімніону, але не забезпечує підйомної сили, яка дозволяла б їм триматися в теплому (більш легкому) шарі води. Оксигенні ціанобактерії (Oscillatoria agardhii, Aphanizomenon flosaquae, Microcystis aeruginosa) розташовуються в більш теплих шарах води. Існує думка, що плавучість цих бактерій регулюється за допомогою фотосинтезу, тургору клітин, а також зміни кількості і розміру газових пухирців.
Параспоральні тіла. У клітинах Bacillus thuringiensis і родинних видів (B. laterosporus, B. medusa) виявляються особливі кристалоподібні включення - параспоральні тільця. При світлопольній мікроскопії з використанням анілінового чорного вони мають вигляд чорних кристалів, локалізованих біля незафарбованих спор (рис. 2.34). За хімічною природою - це білок, дуже токсичний для кровосисних комарів. Такі бактерії знайшли своє практичне застосування як засіб біологічної боротьби не тільки з кровосисними комарами, а й з багатьма ко- махами-шкідниками сільськогосподарських культур.
Рис. 2.34. Параспоральні тіла у Bacillus thuringiensis
Магнетосоми виявляються у клітинах бактерій, здатних до магнетотаксису, тобто здатних рухатися вздовж силових ліній магнітного поля. Вони являють собою оточені мембраною частинки Fe3O4. Так, у клітинах Aquaspirillum magnetotacticum магнетосоми мають форму куба зі сторонами 40-50 нм і розташовані в ряд уздовж клітини. Форма, кількість і характер розташування цих структур у різних груп мікроорганізмів різні.
Локомоторні органи бактерій. Рухомість бактеріальної клітини може забезпечуватися різними способами. Найхарактернішими є плаваючий і ковзний типи руху.
Локомоторним органом бактерій з плаваючим типом руху є джгутик. Джгутикові форми зустрічаються серед усіх відомих груп бактерій. Це свідчить про те, що джгутики є дуже давніми утвореннями бактеріальної клітини.
Розрізняють кілька типів розташування джгутиків на поверхні мікробної клітини (рис. 2.35):
- монотрихальний тип джгутикування, при якому один джгутик розташований на одному з полюсів клітини (Vibrio comma, Pseudomonas aeruginosa, Neurospora europea, Thiobacillus ferrooxidans) або один джгутик локалізований субтермінально (Rhzobium lupini);
- на одному з полюсів клітини може бути пучок джгутиків - лофотрихи. Такий тип джгутикування характерний для Pseudomonas fluorescens, P. putida, Chromatium okenii та представників роду Sphaerotillus (субполярне розташування пучка джгутиків);
- в амфітрихів пучки джгутиків виявляються на обох полюсах мікробної клітини (біполярні політрихи) - Spirillum;
- джгутики можуть локалізуватися по всій поверхні клітини - перитрихальний тип джгутикування. Він властивий, наприклад, представникам родів Proteus, Escherichia, Salmonella.
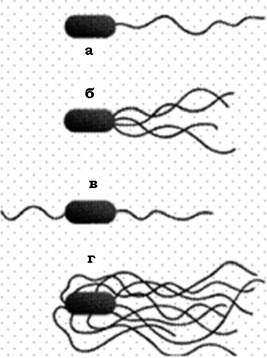
Рис. 2.35. Основні типи розташування джгутиків у бактерій:
а - монотрихи; б - лофотрихи; в - амфітрихи; г - перетрихи
Кількість джгутиків та характер їх розташування може бути однією з диференційних ознак. Однак слід пам'ятати, що ця ознака визначається умовами культивування, а також те, що в процесі виготовлення препаратів джгутики можуть обламуватися. Для виявлення джгутиків бактерій використовують спеціальні методи, зокрема метод фазового контрасту або темного поля (Bdellovibrio, Chromatium okenii, Pseudomonas, Spirillum). Хороші результати дає електронна мікроскопія. При мікроскопії у світлому полі застосовують спеціальні методи забарвлювання, які передбачають потовщення нитки джгутикового апарату.
У прокаріотів розрізняють два типи джгутиків: прості і складні. Товщина простого джгутика коливається в межах 12-18 нм, довжина - 315 мкм. Складні джгутики покриті додатковим чохлом білкової природи. Білок чохла з молекулярною масою 55 000 відрізняється як від білків оболонки клітини, так і від білків самого джгутика. Товщина складного джгутика становить ~18 нм. Цей тип джгутиків зустрічається в деяких представників роду Pseudomona.s (P. rhodos), Rhzobium (R. lupini).
Швидкість обертання джгутика відносно велика. Джгутики спірил, наприклад, обертаються зі швидкістю 40-60 об./с (~3 000 об./хв).
Швидкість руху клітини за допомогою джгутика в різних груп мікроорганізмів різна і не залежить від кількості джгутиків. Так, клітини B. megaterium, які мають перитрихальний тип джгутикування, рухаються зі швидкістю ~27 мкм/с, а Vibrio comma (монотрихи) - ~200 мкм/с. Швидкість руху клітини за допомогою джгутиків становить від 300 до 3 000 довжин тіла за хвилину (900-9 000 мкм/хв) при довжині тіла клітини ~3 мкм. Якщо уявити, що людина зростом 1,5 м рухалася б із такою швидкістю, то вона становила б 27-270 км/год.
Апарат джгутика складається з нитки, гачка і базальної структури (рис. 2.36).
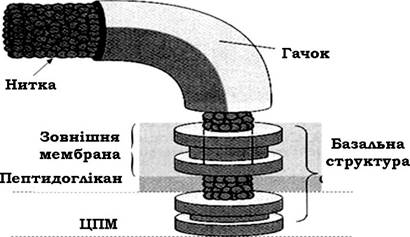
Рис. 2.36. Схема будови джгутикового апарату грамнегативних бактерій
За хімічною природою нитка джгутика - це білок флагелін з молекулярною масою 25 000-60 000. Білкові субодиниці (мономери) джгутика зібрані у спіральні ланцюги, закручені навколо порожнинної серцевини. Особливістю будови білка флагеліну джгутика є відсутність у його складі гістидину, проліну, тирозину, триптофану, цистеїну.
Білок джгутика виявляє антигенну специфічність. Його називають Н-антигеном, який широко використовується при ідентифікації бактерій.
Білок гачка дещо відрізняється від білка нитки джгутика як за молекулярною масою, так і за антигенною специфічністю. Він стійкіший до низьких значень pH, нагрівання, дії сечовини.
Базальна структура джгутика складається з центрального стрижня (палички-осі), вмонтованого в систему кілець. У грамнегативних бактерій ця структура має дві пари кілець: внутрішню (M i S) та зовнішню (P i L); у грампозитивних - лише одну пару кілець (M i S).
Внутрішня пара кілець локалізована на рівні ЦПМ. При цьому М-кільце ніби занурене в цитоплазматичну мембрану. Кільце S локалізоване дещо вище, воно майже прилягає до внутрішньої поверхні пептидоглікану. L-кільце розташоване на рівні шару ЛПС зовнішньої мембрани клітинної стінки грамнегативних бактерій, а Р - на рівні муреїнового шару.
Довжина базальної структури коливається в межах 25-30 нм і визначається товщиною клітинної стінки. Зв'язок кілець з паличкою - віссю відносно слабкий, про що свідчать електронні мікрофотографії, на яких деякі кільця відсутні.
Головна функція базальної структури полягає у фіксації (закріпленні) джгутика. А оскільки ця структура складна, кожен її елемент має своє призначення. Виходячи з того, що кільця L і P виявляються лише в структурі джгутика грамнегативних бактерій, можна вважати, що вони служать для додаткової фіксації джгутика і що для функціонування джгутикового апарату достатньо лише внутрішньої пари, тобто кілець S i M.
Найбільш детально рух джгутиків вивчений у бактерій з лофо- і амфітрихальним типом джгутикування. У більшості лофотрихів джгутики (подібно до корабельного гвинта) проштовхують клітину через середовище.
У бактерій з перитрихальним джгутикуванням окремі латерально розташовані джгутики функціонують, як вважається, ніби один джгутик, тобто як одне ціле (рис. 2.37). Вони щільно прилягають до клітини, виходячи на задньому кінці за її межі, і, обертаючись, проштовхують клітину через середовище. Перитрихи плавають гірше, ніж моно- чи лофотрихи, часто перекидаються, але деякі з них добре пересуваються по вологій поверхні щільного середовища, тобто інколи вони краще повзають, ніж плавають.

Рис. 2.37. Рух бактерії з перетрихальним типом джгутикування
Джгутики можуть спонтанно або у відповідь на зовнішній стимул змінювати напрямок обертання. У деяких бактерій, які мають полярний джгутик, це супроводжується тим, що клітина рухається в протилежному напрямку. Так, у випадку Chromatium okenii у відповідь на спалах світла обертання джгутиків змінюються - пучок джгутиків перетворюється на пристосування, що тягне клітину. У Thiospinllum jenense - гігантської фототрофної спірили - полярний пучок джгутиків під час зворотного руху б'ється вже попереду клітини. Простір биття джгутиків охоплює при цьому клітину з боків, він ніби вивернутий навиворіт (подібно до вивернутої вітром парасольки). У спірил з амфітрихальним джгути- куванням у такому положенні перебуває, залежно від обставин, то один, то інший пучок полярно локалізованих джгутиків.
Джгутик має спіралеподібну упаковку, закручену, як правило, проти годинникової стрілки. Сам джгутик теж обертається проти годинникової стрілки (якщо дивитися на клітину, яка пливе, ззаду), що супроводжується обертанням клітини, але в протилежному напрямку
руху. Напрямок обертання джгутика може змінюватися. Так, якщо лівозакручена спіраль починає обертатися за годинниковою стрілкою, клітина зупиняється або перекидається. При зміні напрямку обертання джгутика в E.coli змінюється його конфігурація і напрямок ходу спіралі. Нитка джгутика трансформується у правоспіральну структуру, крок спіралі зменшується й утворюються "кучеряві" джгутики. Такі джгутики не здатні утворювати косу, через що клітини перекидаються або тремтять, не здійснюючи поступального руху.
Деякі бактерії (представники роду Bdellovibrio) мають незвично товстий, полярно локалізований джгутик (~50 мкм), який дозволяє цій бактерії рухатися значно швидше, ніж це можуть робити інші бактерії. Зустрівши бактерію-хазяїна, паразит прикріплюється до її поверхні кінцем, протилежним тому, від якого відходить джгутик. Інколи бделовібріон обертається навколо своєї поздовжньої осі. Згодом клітина-жертва заокруглюється і стає схожою на сферопласт. Після проникнення у клітину-жертву бделовібріон швидко збільшується в об'ємі й розмножується. Дочірні клітини BdellovibHo залишаються у сферопласті до того часу, поки його вміст не буде повністю перетравлений. Після руйнування клітинної стінки (лізису) ураженої бактерії бделовібріони виходять із клітини й інфікують нові (рис. 2.38). Бделовібріони лізують переважно грам- негативні бактерії, насамперед псевдомонади та ентеробактерії.
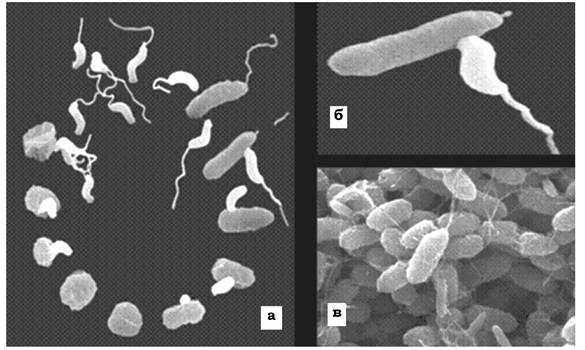
Рис. 2.38. Bdellovibrio bacteriovorus - бактерія, яка паразитує на інших бактеріях:
а - життєвий цикл B. bacteriovorus; б, в - проникнення клітини B. bacteriovorus у клітину
Механізм роботи джгутикового апарату довгий час був загадкою. Згодом з'ясувалося, що джгутиковий "мотор" локалізований у внутрішній парі кілець базальної структури, які обертаються (крутяться) і передають свій рух нитці.
Гіпотетичну схему роботи джгутикового апарату запропонували О. Глаголєв і В. Скулачов у 1978 р. Одна із серії аміногруп відкривається у верхній протонопровідний шлях (канал) (рис. 2.39). Аніонна група (СОО-) локалізована на цитоплазматичній мембрані поблизу нижнього протоновивідного шляху. У процесі протонування NH2 - група набуває позитивного заряду (-NH3+), що супроводжується притягуванням аніонної та катіонної груп, а це змушує М-кільце рухатися - має місце поворот кільця, що супроводжується переміщенням наступної аміногрупи до верхнього протонопровідного шляху. Викид катіонів Н+ проходить через нижній протоновивідний канал у цитоплазму.
Теоретично було підраховано, що на один поворот такого мотора витрачається 103 протонів Н+.
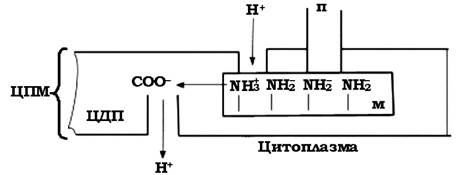
Рис. 2.39. Модель роботи протонного мотора базальної структури джгутикового апарату бактерій: п - палочка-вісь; м - М-кільце
Унікальну будову органів руху мають спірохети (рис. 2.40). Клітина спірохет має протоплазматичний циліндр, обмежений цитоплазматичною мембраною, і зовнішній чохол, утворений шаром муреїну і зовнішньою мембраною. Тобто оболонка спірохет має таку ж будову, як і оболонки інших грамнегативних бактерій.
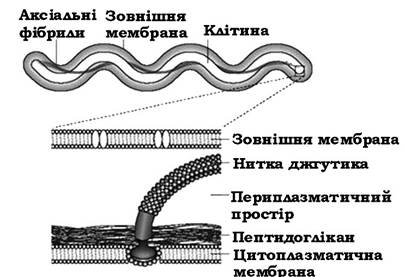
Рис. 2.40. Схема будови клітини спірохет
У просторі між шаром пептидоглікану і зовнішньою мембраною чохла містяться аксіальні фібрили (осьові нитки). Кількість фібрил залежно від виду може коливатися від 2 до 100. Пучок таких нитчастих структур обвиває протоплазматичний циліндр. Таким чином, орган руху спірохет міститься в закритому клітинними структурами просторі, тобто він є внутрішньоклітинною структурою.
Аксіальна фібрила дещо менша (коротша) від тіла клітини. Вона займає приблизно 2/3 її довжини. Один кінець фіксується на полюсі протоплазматичного циліндра, а другий - залишається вільним. Вільні кінці протилежних фібрил перекриваються.
З'єднання аксіальної фібрили із протоплазматичним циліндром відбувається за участю гачка і базальної структури. Остання являє собою паличку-вісь, на якій визначається 1-2 кільця.
Спірохети можуть здійснювати різні типи руху: тіло клітини може вигинатись, утворюючи вторинну хвилю (спіраль); обертатися на одному місці або здійснювати поступальний рух.
У лептоспір можливі два типи руху клітин. У першому випадку передбачається, що зовнішній чохол і протоплазматичний циліндр фіксовані один відносно одного. У такому разі обертання ниток супроводжується коливанням кінців клітини. Зовнішній чохол і протоплазматичний циліндр вигинаються, але не обертаються.
Другий тип руху пов'язаний з обертанням і вигинанням протоплазматичного циліндра і зовнішнього чохла, яке спричинене обертанням осьових ниток. Клітини лептоспір (Leptospira interrogans), здійснюючи поступальний рух, можуть ніби штопор вгвинчуватися у в'язке середовище.
Будь-який рух має свій біологічний сенс. Рухомі бактерії рухаються під впливом певних зовнішніх сил або стимулів. Такий рух називають таксисом (грец. taxis - розташування). Можна сказати, що таксис - це рух, зорієнтований відносно напрямку стимулу, тобто це направлений рух.
Залежно від зовнішніх факторів, під дією яких здійснюється рух, розрізняють хемотаксис, фототаксис, аеротаксис, магнетотаксис, вискозитаксис.
Хемотаксис - єдиний приклад поведінкових реакцій, для яких порівняно добре досліджена не тільки феноменологія явища, але й молекулярні процеси, які забезпечують його реалізацію. У суспензії джгутикових бактерій клітини перебувають у стані безперервного, але хаотичного руху. При створенні в популяції бактерій градієнта концентрації деяких хімічних речовин клітини мігрують і накопичуються в тій його частині, де концентрація даної речовини є для них оптимальною. Деякі речовини (переважно поживні субстрати) діють як атрактанти: клітини накопичуються в зоні найвищої концентрації цієї речовини. Інші речовини, більшість з яких є токсичними, діють як репеленти, тобто клітини уникають зон з високою концентрацією їх і збираються в тій частині градієнта, де вона найнижча. До хемотаксису можна віднести також аеротаксис, зумовлений впливом кисню, та осмотаксис, спричинений дією солей.
Зміни концентрації ефекторів можуть директуватися за допомогою декількох механізмів. Установлено, що в ЦПМ E. coli i S. typhimurium локалізовано понад 20 хеморецепторів, кожен з яких зв'язує специфічний набір молекул-ефекторів та/або периплазматичних білків, які є первинними акцепторами цих ефекторів.
Здатність до таксису дає клітині певні переваги, насамперед дозволяє їй активно вести пошук середовища, оптимального для існування. Як було встановлено у випадку E.coli, такий пошук має логічне завершення: із досягненням джерела глюкозного градієнта синтез флагеліну пригнічується за типом катаболічної репресії. Крім пошуку таких універсальних субстратів, як глюкоза й амінокислоти, таксис допомагає бактеріям потрапляти в їхні специфічні екологічні ніші.
Термотаксис - це рух бактерій в осередки з підвищеною температурою. Він був описаний ще в 1920 р. Однак кількісне дослідження цього явища здійснили зовсім недавно. Автори використали такий простий підхід: у скляній трубці із суспензією E. coli створюється лінійний градієнт температури. Уже через 1 год клітини збираються вузькою смужкою в ділянці, де визначається температура 340С (оптимальна для росту цих бактерій). Різке зниження температури на предметному склі від 34 до 200С викликало перехід клітин у стан дрижання з наступною їх адаптацією. При підвищенні температури до оптимального значення швидкість руху клітин у середовищі збільшувалась.
Аеротаксис - рух бактерій, пов'язаний з різницею вмісту кисню. Це явище легко спостерігати в препаратах "роздавлена крапля", де градієнт кисню встановлюється за рахунок його дифузії, направленої від країв покривного скельця до центра препарату. У рухомих бактерій можна визначити тип метаболізму (аеробний чи анаеробний) за їхнім аеротаксичним рухом і скупченням клітин на певних відстанях від краю покривного скельця або біля пухирців повітря.
Фототаксис - рух бактерій у напрямку до світла або від нього. Рухомі фототрофні бактерії, наприклад пурпурові, можуть реагувати на градієнти інтенсивності світла - явище, відоме як фототаксис. Таку поведінку легко продемонструвати, проектуючи вузький промінь яскравого світла на недостатньо освітлену в інших ділянках суспензію рухомих фототрофних бактерій. Протягом 10-30 хв значна кількість популяції збирається в найкраще освітленій частині, що діє як "світлова пастка". Плаваюча клітина потрапляє в світлову пляму внаслідок випадкового руху. Але потрапивши туди, клітина не здатна її покинути. Як тільки клітина потрапляє в темну зону, напрямок руху джгутиків миттєво змінюється на протилежний, і клітина повертається в освітлене місце. Зміна роботи джгутикового апарату відбувається так швидко, що ця реакція отримала назву "реакція переляку" (фототаксис). Для того щоб викликати таку відповідь, достатньо навіть невеликої різниці в освітленні двох ділянок. Клітини бактерій роду Chromatium накопичуються в якомусь одному місці, якщо його освітлення лише на 0,7 % вище, ніж в навколишніх ділянках.
Якщо вологий препарат рухомих пурпурових бактерій освітлювати не білим світлом, а спектрально розкладеним, то і при фокусуванні променів на препараті клітини швидко збираються в місцях, які відповідають основним максимумам поглинання пігментних систем цих бактерій. Точне кількісне визначення відносної ефективності хвиль різної довжини, які викликають фототаксис, показало, що спектр його дії в пурпурових бактерій точно відповідає спектру дії фотосинтезу.
Магнетотаксис - здатність бактерій рухатися по силових лініях магнітного поля. З поверхневих шарів мулу було виділено бактерії, здатні орієнтуватися в магнітному полі і переміщуватися в напрямку його ліній. Вони містять багато заліза (0,4 % від сухої маси) у формі феромагнітного оксиду заліза (магнетиту) в кількості 10-20 мікрокристалів розміром 40-90 нм, які містяться в гранулах (магнітосомах), розташованих біля місць прикріплення джгутиків. Бактерії, виділені в північній частині земної кулі, "шукають" південь; тут лінії магнітного поля проходять під кутом 700 до горизонту вниз, у глиб водойми. Магнітотаксична поведінка спрямовує бактерії в глиб мулу, де мало або зовсім немає кисню. Оскільки магнітотаксичні бактерії - анаероби або мікроаерофіли, їхня реакція на магнітне поле доцільна з позиції екології. Такі клітини, завезені в південну півкулю, найчастіше гинуть. Виживають лише деякі "помилково" поляризовані клітини, які зможуть потім розмножуватися. Полярність, імовірно, генетично не зафіксована.
Віскозитаксис - рух бактерій у напрямку збільшення або зменшення густини розчину. Зокрема для спірохет, які пересуваються по поверхні слизових оболонок, ця особливість має пристосувальне значення. Механізм цього процесу не з'ясований.
Морфологічна диференціація у прокаріотів. За Ф. Жакобом і Ж. Моно, "одну клітину можна вважати диференційованою порівняно з іншою, якщо при однакових геномах набір білків, які синтезуються цими клітинами, різний".
Характерною особливістю деяких прокаріотів є здатність утворювати структури, які суттєво відрізняються від вихідних форм, а також від подібних структур інших біологічних об'єктів; мікроорганізмам властива морфологічна диференціація, яка супроводжується суттєвими біохімічними та фізіологічними змінами. В основі морфологічної диференціації лежать певні біохімічні процеси, що контролюються генетичним апаратом клітини. До морфологічно диференційованих структур прокаріотів відносять екзоспори, ендоспори, цисти, гетероцисти, акінети (табл. 2.5).
Ендоспора - це стадія спокою бактеріальної клітини (рис. 2.41), яка сприяє виживанню (збереженню) бактерій у несприятливих умовах середовища, тобто ендоспора не служить для розмноження.
Рис. 2.41. Ендоспора прокаріотичної клітини
Таблиця 2.5. Морфологічно диференційовані структури прокаріотів
Спеціалізовані клітини |
Основні роди і групи бактерії, які їх утворюють |
Ендоспори |
Amphibacillus, Bacillus, Clostridium, Desulfotomaculum, Oscillospira, Sporohalobacter, Sporolactobacillus, Sporosarcina, Syntrophospora, Sulfobacillus |
Екзоспори |
Актиноміцети, Rhodomicrobium |
Цисти |
Міксобактерії, ковзні бактерії, Azotobacter, Bdellovibrio |
Гетероцисти, акінети |
Ціанобактерії |
Бактероїди |
Бульбочкові бактерії |
Утворення ендоспор характерне виключно для прокаріотів. Бактеріальні ендоспори - це особливий тип форм спокою клітин бактерій, які формуються ендогенно, тобто всередині цитоплазми "материнської" клітини (спорангія). Ендоспорам властивий особливий фізичний стан протопласта.
Вважається, що утворення ендоспори є однією з фаз розвитку мікробної популяції. Але ця стадія не є обов'язковою для життєвого циклу спороутворювальних бактерій. За сприятливих умов живлення клітини можуть необмежений час розмножуватися, не переходячи в стадію спокою.
Процес спороутворення можна також інгібувати, наприклад, внесенням у середовище глюкози або частими пересівами культури. Роль інгібуючого фактора залежить від часу його внесення. Так, якщо до суспензії вегетативних клітин B. mycoides протягом перших 5 год після внесення їх у воду додати глюкозу, то утворення спор репресується. Глюкоза, внесена пізніше як через 6 год, уже не діє - інгібування спороутворення не відбувається. У той же час індукція (дерепресія) спороутворення зберігається в період між 10 і 13-ю годинами після внесення бацил у воду - приблизно 90 % клітин утворюють спори. Таким чином, процес споруляції певною мірою регулюється факторами середовища.
Процес споруляції можна індукувати. До факторів, що індукують утворення ендоспор, відносять: нестачу поживних речовин, надлишок продуктів метаболізму, наявність у середовищі іонів Mn2+, Ca2+, зміну температури вирощування, рівня pH, концентрації О2 та ін.
Отже, спороутворення відбувається в тих випадках, коли загальні умови існування допускають його. Якщо помістити вегетативні клітини на певній стадії розвитку в дистильовану воду, то можна спостерігати так звану ендотрофну споруляцію, тобто утворення спор за
рахунок запасних речовин клітини. У таких випадках утворення спор дійсно викликається дефіцитом екзогенного субстрату.
Тривалість процесу споруляції в різних представників ендоспороутворювальних бактерій різна. В аеробних мезофільних бацил, зокрема, спороутворення займає близько 8 год.
Здатність клітин до утворення спори визначається комплексом генів, який називають спорулоном, хоч він і не є цілісно оформленою структурою. Проте встановлено наявність кількох груп - оперонів, локалізованих у різних ділянках хромосоми. Було показано, що B. subtilis має 42 спорових оперони, кожен з яких містить ~3 гени. У цілому B. subtilis має 150-200 генів, що контролюють процес споруляції. Події, які відбуваються на кожній стадії споруляції, можуть залежати від активності генів з різних оперонів.
Найкраще процес спороутворення досліджено в представників родів Bacillus i Clostridium, хоча інформація, отримана протягом останніх років, свідчить про принципову однотипність цього процесу в усіх видів ендоспороутворювальних бактерій.
Спороутворення проходить у декілька фаз (етапів). Зміна кожної стадії визначається активацією відповідних генів. При цьому один із продуктів гена, що "функціонує", індукує активність наступного гена.
Для початку спороутворення необхідне завершення реплікації бактеріальної хромосоми. Сигнал до спороутворення має надійти ще в період реплікації. Якщо реплікація хромосоми завершується в багатому на поживні речовини середовищі, тоді такий сигнал не надходить, а популяція продовжує вегетативний поділ. У процесі утворення спори хромосома не реплікується, і в спору переходить одна або декілька цілком реплікованих раніше хромосом.
Клітина, що готується до споруляції, має не менше двох нуклеоїдів, які утворюють тяж, що проходить майже по всій довжині клітини, включаючи в себе всю ДНК (рис. 2.42).
Рис. 2.42. Схематичне зображення формування ендоспори спороутворювальними бактеріями:
а - вегетативна клітина; б - інвагінація ЦПМ; в - утворення спорової перетинки (септи); г - формування подвійної мембранної системи проспори; д - сформована проспора; е - формування кортексу; є - формування покривів спори; ж - лізис материнської клітини; з - вільна зріла спора; и - проростання спори; 1 - нуклеоїд; 2 - цитоплазма; 3 - ЦПМ; 4 - клітинна стінка; 5 - спорова перетинка; 6 - зовнішня мембрана спори; 7 - внутрішня мембрана спори; 8 - кортекс; 9 - покриви спори
У деяких видів роду Clostridium він утворюється лише частиною наявної у клітині ДНК і локалізується на одному з полюсів клітини, займаючи незначну частину її довжини. У подальшому від осьового тяжа відшнуровується ділянка, яка відповідає хромосомі. Вона переміщується до одного з полюсів клітини.
Далі ЦПМ починає інвагінуватися, утворюються дві різного розміру структури, розділені мембраною. На цьому етапі процес споруляції є ще оборотним. Якщо бактеріальні клітини перенести у сприятливі для розвитку умови, то процес їхнього поділу завершиться утворенням двох вегетативних клітин різної довжини. Виявлено, що цей процес контролюється генами восьми оперонів, локалізованих у різних ділянках хромосоми.
На перших етапах споруляції використовуються запасні речовини і частина білків материнської клітини. У більшості видів роду Bacillus відбувається синтез специфічних протеаз, яким приписують різні функції, у тому числі участь у кругообігу білка, модифікації ДНК-залежних РНК-полімераз і білків-попередників покривів спори.
У подальшому ЦПМ більшої частини клітини починає оточувати меншу структуру, у результаті утворюється структура, обмежена двома ЦПМ, - проспора. Дві мембрани, які оточують проспору, розташовані одна щодо одної ніби в дзеркальному відображенні - зовнішній, раніше звернений до середовища шар внутрішньої мембрани, повернений на зовнішній бік, а в зовнішньої мембрани - всередину. На наступному етапі проспора відділяється від ЦПМ материнської клітини і ніби вільно "плаває" в ній. На цьому етапі процес споруляції стає необоротним, змінюються властивості мембрани, особливо її транспортні функції. Процес стає необоротним не лише для проспори, а і для материнської клітини, яка вже не може повернутися до вегетативного росту. Якщо така система потрапляє в несприятливі умови, вона або завершує утворення спори, або гине.
У проспорі посилюється поглинання іонів Са2+, розпочинається синтез деяких амінокислот та дипіколінової кислоти (піридин-2,6-дикарбонова кислота). Вегетативні клітини не здатні до синтезу останньої.
Проспора, що утворилася, переміщується до центра клітини або залишається біля одного з її полюсів, що визначається видовою належністю об'єкта, тобто типом розташування спори.
Між двома ЦПМ у більшості представників роду Bacillus утворюється ще одна оболонка - кортекс. Процес йде у дві стадії. Спочатку синтезується примордіальний (зачатковий) шар, який у процесі проростання спори дає оболонку проростка. Над примордіальним шаром синтезується модифікований шар муреїну, який і утворює кортекс. Синтез речовини кортексу триває до дозрівання спори. Цей біополі- мер є більш кислим, ніж його аналог у клітинній стінці. Пояснюється це тим, що багато залишків мурамової кислоти не містять пептидів, а отже - мають більше вільних карбоксильних груп.
У B. cereus одночасно із синтезом кортексу формується екзоспоріум. На початку він синтезується на одному з полюсів проспори, а потім обростає її повністю. У більшості видів роду Clostridium початок закладки покривів передує формуванню кортексу.
На зрізах спори кортекс має вигляд масивного електронно- прозорого шару. У спори, яка перебуває в стані спокою, він має гомогенну структуру, а в спор, які проростають, - фібрилярну.
Екзоспоріум нагадує мішок, у якому міститься спора. У різних видів будова екзоспоріума різна. Найбільш детально він вивчений у B. cereus. До складу екзоспоріума входять білки, ліпіди та вуглеводи. Вважається, що він захищає спору від дії зовнішніх факторів.
Екзоспоріум C. botulinum має 15 паралельних шарів, загальна товщина яких понад 100 нм. У C. pasteurianum це тоненька структура, яка на одному з полюсів має велику пору. У деяких випадках зовнішній екзоспоріум покритий придатками або виростами різної форми.
Наприкінці формування екзоспоріума молода спора ще осмотично нестабільна й нежиттєздатна, але в неї вже змінюються деякі фізичні властивості, зокрема посилюється заломлення світла, що свідчить про синтез білкових сполук, оскільки у присутності інгібіторів синтезу білка світлозаломлення не підвищується.
У подальшому триває формування оболонки спори. Із зовнішнього боку зовнішньої мембрани формується оболонка спори. Сама зовнішня мембрана на зрізах майже не визначається. У спорі продовжує накопичуватися дипіколінат кальцію, підвищується її стійкість до органічних розчинників, наприклад хлороформу. Спора набуває осмотичної стабільності, але ще не терморезистентна.
Розвиток спори визначається активністю двох геномів: власного і материнського. Материнська частина клітини - спорангій - до останнього моменту зберігає свою активність. При цьому геном материнської клітини визначає синтез дипіколінової кислоти, білків, покривів спори (матеріалу), екзоспоріума та виростів спори, власний - відповідає за зневоднення та формування комплексу дипіколінату кальцію.
Цитоплазма спори оточена ЦПМ, яка переходить у примордіальний шар, а потім у кортекс. Речовина останнього становить 20-60 % об'єму спори, але не перевищує 15 % її маси.
У процесі дозрівання спора зневоднюється. Вміст води у зрілій спорі знижується до 10-15 %, що супроводжується інактивацією ферментів, а отже, гальмуванням метаболічних процесів. Спора набуває терморезистентності.
Структура зрілої спори в різних ендоспороутворювальних бактерій майже однакова. У цитоплазмі міститься ядерний матеріал. Вміст білків і нуклеїнових кислот спори досягає 50-60 % сухої маси. Значну частину спори складає дипіколінова кислота. У зрілої спори вона представлена дипіколінатом кальцію, вміст якого може становити до 10-15 % за сухою масою.
Кортекс обмежений зовнішньою мембраною спори, яка межує із зовнішньою оболонкою. Речовина останньої забезпечує стійкість спори до дії лізоциму.
Спороутворення супроводжується активним синтезом білків, які на відміну від білків вегетативної клітини багаті на цистеїн та гідрофобні амінокислоти, з чим теж пов'язують стійкість спори до дії несприятливих факторів середовища.
Оболонки спори забезпечують її стійкість до дії ферментів, проникності для органічних розчинників, поверхнево-активних речовин, антибіотиків, барвників тощо. Після того як спора сформувалась, відбувається лізис клітинної стінки і спора звільняється.
Схему будови зрілої спори наведено на рис. 2.43.
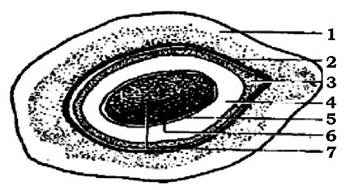
Рис. 2.43. Схема будови зрілої спори:
1 - екзоспоріум; 2, 3 - відповідно зовнішня і внутрішня оболонки спори; 4 - кортекс; 5 - клітинна стінка зародка; 6 - ЦПМ; 7 - цитоплазма з ядерною речовиною
Спори мають специфічні властивості: по-перше, вони метаболічно неактивні; по-друге, вони стійкі до дії високих температур, хімічних речовин та опромінення.
Природа (механізм) терморезистентності спори повністю не з'ясована. На думку Г. Шлегеля, це явище можна пояснити низьким вмістом води. Існує також думка, що терморезистентність приблизно пропорційна вмісту дипіколінової кислоти. Стійкість спор до дії хімічних речовин забезпечується також непроникністю зовнішніх покривів. Крім того, білки покривів спори захищають її від дії літичних ферментів.
Спори різних бактерій відрізняються за формою, розмірами і локалізацією в материнській клітині (рис. 2.43). Так, у багатьох бактерій спора розташована в центрі клітини, а її діаметр не перевищує поперечника клітини - центральний (бацилярний) тип локалізації (B. subtilis, B. anthracis, B. megateHum). Спори багатьох бактерій мають овальну форму, але їхній діаметр більший від поперечника клітини - клостридіальний тип локалізації. Клітина набуває при цьому вигляду веретена (С. pasteunanum). Спора може локалізуватися на одному з полюсів мікробної клітини, роздуваючи її спорангій. Сама клітина набуває форми барабанної палички - плектридіальний тип розташування спори (С. tetani). Спора займає центральну частину спорангія, але один його бік при цьому деформується - латеральне положення (B. laterosporus).
Особливістю спороутворення в анаеробних бактерій є утворення на спорах особливих виростів різноманітної структури (рис. 2.44). Ця ознака специфічна, спадково закріплена і досить стійка. Навіть у дефектних спор, які втратили здатність утворювати оболонку, вирости зберігаються і не змінюють своєї структури.

Рис. 2.44. Типи розташування спор у клітині:
а - центральний (бацилярний); б - субтермінальний (бацилярний); в, д - плектридіальний; г - клостридіальний
Вирости можуть мати форму тонких ниток або джгутиків, трубочок різної товщини, які розташовуються на всій поверхні спори, або зібраних у пучок йоржикоподібних паличок, довгих широких стрічок, шипів, утворів, які нагадують роги оленя.
Формування виростів розпочинається на ранніх стадіях споруляції - перед закладкою кортексу, потім вони ростуть, подовжуються, цитоплазма материнської клітини навколо виростів лізується. На зрілих спорах, які вийшли із спорангія, вирости розпускаються.
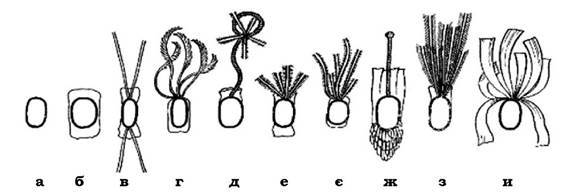
Рис. 2.45. Будова поверхневих структур спор деяких анаеробних бактерій:
а - спора без виростів і екзоспоріума; б - спора без виростів, але має екзоспоріум; в-и - спори з виростами різних типів і екзоспоріумом
Речовина виростів складається переважно з білків, а також незначної кількості полісахаридів і ліпідів.
Функції виростів вивчаються. Деякі вчені вважають, що вирости на спорах - специфічно чутливі (хемосенсорні) органели, які подають "сигнал" на проростання спори у сприятливих для неї умовах. З погляду інших, вирости виконують важливу функцію у процесі дозрівання спор, беруть участь у формуванні спорових покривів і кортексу. Існує також думка, що вирости на спорах - наслідок певних порушень обміну речовин.
Процес проростання спори можна поділити на три етапи: ініціація, активація й виростання.
Ендоспора навіть у сприятливих умовах може не проростати. Цей процес необхідно ініціювати. Активація означає готовність спори до проростання, при цьому зберігається її стійкість до температури, світлозаломлення та інші характеристики. Одним з ініціюючих факторів є термообробка. Виявлено, що процес активації йде тим швидше, чим вища температура. Так, при температурі 65 0С активація триває 45 хв, а при зниженні до 34 0С - близько 48 год.
Активація є процесом необоротним, вона триває декілька хвилин і проходить у певній послідовності: спочатку знижується терморезистентність і відбувається вихід у середовище дипіколінату кальцію, після чого спора набуває здатності забарвлюватися; далі спора втрачає діамінопімелінову кислоту і глюкозамін, а потім знижується світлорозсіювання.
Процес ініціації залежить від температури, вологості середовища, pH та інших факторів.
До початку проростання спора інтенсивно поглинає воду і набрякає. Протягом перших хвилин проростання вона втрачає майже 25 % своїх білків, тобто тих, що синтезувалися в процесі споруляції. Гідроліз білків здійснюється за рахунок специфічної протеази самої спори, яка діє лише на ці білки.
У ході проростання спори її оболонки лізуються або розриваються, а проросток виходить з оболонок.
Виростання - це процес активного росту, у ході якого активно синтезуються РНК і білки, а через 1-2 год розпочинається реплікація ДНК.
Спори актиноміцетів формуються переважно на повітряному міцелії (спороносцях), а в окремих випадках - на субстратному. Розташування спороносних гілок у деяких актиноміцетів - ознака досить закономірна й постійна. За формою найчастіше зустрічаються спіральні (з множинними завитками, примітивні спіралі, розтягнуті або у вигляді клубочків) спороносці. За характером розташування на спороносних гілках їх поділяють на мутовчастий, супротивний та послідовний типи.
Утворення спор актиноміцетами може відбуватися різними способами. До найбільш поширених та вивчених належить утворення спор шляхом фрагментації або сегментації спороносних гілок.
Фрагментаційний процес характеризується тим, що навколо ядерних елементів, рівномірно розподілених по гіфі, концентрується цитоплазма, яка покривається власною оболонкою і перетворюється у зрілу спору. Оболонка спороносних ниток деякий час зберігається, але з часом розпадається, а спори висипаються і за відповідних умов знову проростають, утворюючи гіфи нових колоній актиноміцетів.
При сегментаційному утворенні спор спостерігається простий поділ спороносних гілок. По всій довжині гілки утворюються поперечні перетинки, і спороносець ділиться на ряд рівномірних клітин-спор. Перед сегментацією у спороносній гілці відбувається поділ ядерної речовини: утворюється стільки зерен хроматину, скільки буде спор. Навколо хроматинових зерен також концентрується цитоплазма клітини. Коли спора дозріває, спороносець розпадається на окремі спори.
У деяких родів актиноміцетів (Actinoplanes, Ampullariella, Streptosporangium та ін.) утворюються спорангії-мішки, в яких містяться спори (рис. 2.46).
Окремі актиноміцети утворюють незвичні структури. Так, представники родів Dermatophilus, Frankia, Geodermatophilus утворюють велику кількість спор у результаті поділу гіф у кількох площинах, а не перпендикулярно осі. Такі структури називають багатогніздовими спорангіями.
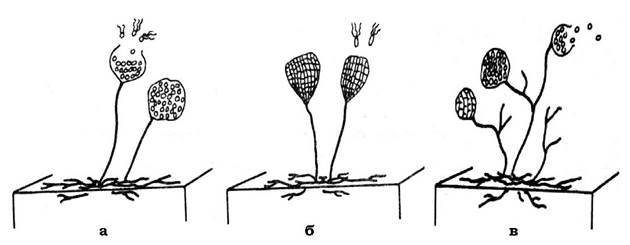
Рис. 2.46. Спорангії Actinoplanes (а), Ampullariella (б) і Streptosporangium (в) зі спорами
Деяким актиноміцетам властиве утворення склероцій - кулястих структур, які містять не спори, а клітини, заповнені ліпідами. Склероцій проростає як єдине ціле, утворюючи одну ростову трубку.
У представників родів Actinobifida, Microbispora, Micromonospora, Micropolyspora спорангіїв немає. Поодинокі спори, їх пари або ланцюжки (до 20 спор) як форма розмноження та спокою містяться безпосередньо на гіфах міцелію або на дуже коротких спороносних гіфах (спорофорах).
Спори актиноміцетів відрізняються між собою за формою. Вони бувають кулясті, циліндричні, паличкоподібні, грушоподібні. Поверхня спор різних видів актиноміцетів теж може бути різною. На поверхні виявляються структури шипоподібної, горбкуватої, волосоподібної форми, в окремих випадках поверхня оболонки гладенька. Ця ознака використовується для визначення належності актиноміцетів до тієї чи іншої групи.
Спори актиноміцетів більш стійкі до дії несприятливих умов довкілля, ніж вегетативні клітини. Так, культури актиноміцетів, висушені до повітряно-сухого стану, можуть зберігати життєздатність протягом кількох років. Спори стійкі також до різних механічних впливів: при розтиранні культур у суміші з частинками піску спори не втрачають своєї життєздатності, тимчасом як відповідні їм за розмірами фрагменти вегетативного міцелію гинуть.
Проростання спор актиноміцетів однотипне. На свіжому поживному середовищі вони спочатку дещо набухають, потім на їхній поверхні з'являються горбочки - бруньки, які, подовжуючись, проростають у довгі нитки. Нитки галузяться, формується міцелій - колонії актиноміцетів.
Цисти як форми спокою виявляються в різних груп бактерій: азотобактера, спірохет, міксобактерій, рикетсій. У більшості міксобактерій утворення цист (міксоспор) - це одна зі стадій життєвого циклу. Після завершення стадії активного розмноження клітини міксобактерій групуються й утворюють так звані плодові тіла, що являють собою масу слизу, в який занурені клітини. Усередині плодових тіл клітини переходять у стан спокою (рис. 2.47).
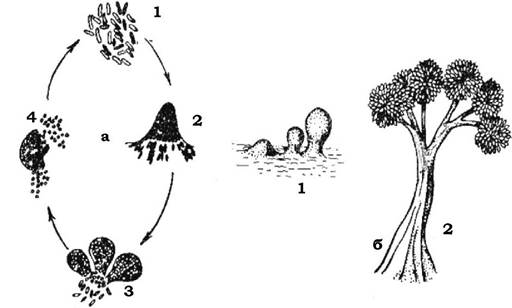
Рис. 2.47. Морфологічне диференціювання у міксобактерій:
а - схема циклу розвитку Myxococcus: 1 - вегетативні клітини, які активно розмножуються; 2 - скупчення клітин-попередників плодових тіл; 3 - плодове тіло; 4 - міксоспори; б - плодові тіла: 1 - Myxococcus; 2 — Chondromyces
Утворення міксоспор супроводжується синтезом специфічного білка. ДНК не синтезується, а переходить з вегетативної клітини. Міксоспора може мати три-чотири копії хромосоми. Цисти міксоспор більш стійкі до нагрівання, висушування, дії фізичних факторів, ніж вегетативні клітини, тобто ця структура певною мірою може розглядатися як форма спокою.
У деяких видів бактерій цисти морфологічно не відрізняються від вегетативних клітин, але в більшості випадків їх утворення супроводжується помітними морфологічними й структурними змінами: потовщується стінка вегетативної клітини, внаслідок чого утворюються оптично щільні структури, які сильно заломлюють світло (рис. 2.48).
У представників роду Azotobacter утворення цист супроводжується зміною морфології клітини, втратою джгутиків, накопиченням у цитоплазмі гранул ПОМК, синтезом додаткових покривів: зовнішніх (екзини) і внутрішніх (інтини). Ці оболонки (покриви) відрізняються між собою як структурно, так і за хімічним складом.
Рис. 2.48. Схематичне зображення будови форм спокою прокаріотів:
а - міксоспори міксобактерій; б - цисти азотобактера; в - акінети ціанобактерій; г - ендоспори: 1 - нуклеоїд; 2 - цитоплазма; 3 - цитоплазматична мембрана; 4 - клітинна стінка; 5 - капсула; 6 - гранули запасних речовин; 7 - внутрішні покриви (інтина); 8 - зовнішні покриви (екзина); 9 - тилакоїди; 10 - чохол; 11, 12 - відповідно внутрішня і зовнішня мембрана спори; 13 - кортекс; 14 - покриви спори, які складаються з декількох шарів; 15 — екзоспоріум
Форми спокою деяких ціанобактерій називають акінетами. Вони більші за вегетативні клітини, мають подовжену або сферичну форму, товсту оболонку. Утворюються акінети в період затримки росту культури. Клітина при цьому збільшується в розмірах, у цитоплазмі накопичуються гранули запасних речовин (глікоген, поліфосфати, ціанофіцинові гранули), а також утворюються карбоксисоми. Одночасно потовщується пептидоглікановий шар, ущільнюється слизовий чохол. У цілому оболонки акінети містять більше ліпідів і полісахаридів, а цитоплазма - менше води, ніж вегетативна клітина. У процесі формування акінет збільшується вміст ДНК, кількість рибосом, зменшується кількість хлорофілу і фікобілінових пігментів.
Сформовані форми спокою протягом різного часу можуть зберігати свою життєздатність (табл. 2.6) і проростають у відповідних умовах з утворенням активних (щодо метаболізму) клітин.
Таблиця 2.6. Стійкість форм спокою прокаріотів до екстремальних умов
Тип форм спокою |
Пошкоджуючий фактор |
|
Висока температура |
Висушування |
|
Ендоспори деяких бактерій |
Загибель 90 % після витримування при t 100 0С протягом 11 хв |
Життєздатність зберігається протягом майже 1 000 років |
Ендоспори актиноміцетів |
Загибель 99 % після витримування при t 75 0С протягом 70 хв |
Життєздатність зберігається протягом 14 років |
Міксоспори міксобактерій |
Загибель 90 % після витримування при t 50 0С протягом 20 хв |
Загибель 50 % після зберігання протягом 6 років |
Цисти азотобактера |
Загибель 100 % після витримування при t 60 0С протягом 15 хв |
100%-ва життєздатність при зберіганні протягом 12 років |
Акінети ціанобактерій |
Загибель 95 % після витримування при t 40 0С протягом 10 хв |
95%-ва життєздатність після зберігання протягом 15 міс. при t 4 0С |