МІКРОБІОЛОГІЯ - М.Г. Сергійчук - 2008
Розділ 11. АНТИБІОТИКИ. ПРОБІОТИКИ
Антибіотики та їх класифікація
Історія створення антибіотиків бере початок з доісторичних часів. Індіанці майя використовували зелену цвіль, що виросла на зернах кукурудзи, для загоювання ран. Ліками з кори хінного дерева (Cinchona officinalis) вони лікували малярію (рис. 11.1).

Рис. 11.1. Cinchona officinalis
Саме цей досвід не загубився і був використаний європейцями для створення цинхони - першого системного лікувального засобу західної медицини. Проте проблема складних, невиліковних на той час, інфекційних хвороб (венеричні захворювання, лихоманки та ін.) стимулювала пошук нових ефективних засобів.
Успіхи в галузі хімічного синтезу дозволили не тільки одержати синтетичні аналоги природних ліків, зокрема хініну - найбільшого за вмістом алкалоїду цинхони, але сприяли пошуку нових синтетичних лікувальних препаратів. Так, у 1912 р. німецький хімік П. Ерліх (18541915) запропонував сальварсан (амінофеніларсенова кислота) - перший препарат специфічної дії проти трипаносом та збудника сифілісу. Другим сучасним синтетичним хіміопрепаратом у 1935 р. став пронтозил, що містив амід сульфанілової кислоти. Впровадив його як засіб проти грампозитивних коків при різних інфекціях німецький бактеріолог Г. Домагк (1895-1964), за що отримав Нобелівську премію в 1939 р. (рис. 11.2).
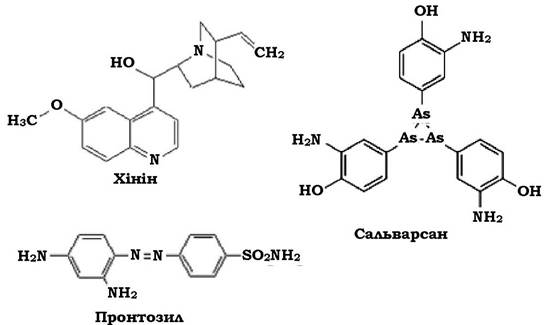
Рис. 11.2. Хімічна структура перших природних і синтетичних хіміопрепаратів
П. Ерліх заклав основи хіміотерапії, зокрема, створив концепцію вибіркової дії препаратів, сприяв розвитку вчення про антиметаболіти - структурні аналоги природних метаболітів клітин. На цих наукових засадах були створені кілька поколінь сучасних синтетичних хіміотерапевтичних препаратів: сульфаніламідів, нітрофуранів, імідазолів, фторхінолонів.
Інше базове вчення про антагонізм створило можливості для розвитку другого напряму в хіміотерапії - одержання і застосування біо- синтетичних антимікробних речовин. Спроби застосування цвілевих грибів відомі ще з часів середньовіччя. Так, британські хроніки описують успішний досвід лікування ран "мохом з черепів». На сході філософ та лікар Абу-Алі-Ібн-Сіна рекомендував використовувати цвіль при гнійних ураженнях.
Проте першою науковою працею про практичне застосування антагоністичних відносин цвілевих грибів та збудників інфекцій стала праця російських лікарів В. Манасєїна (1841-1901) та А. Полотєбнова (1838-1908), написана в 1871 р. На жаль, вона була маловідомою, тому вивчення мікробного антагонізму стимулювали дослідження Л. Пастера, М. Гамалєї, І. Мечникова.
Наукове обґрунтування антагонізму цвілевого гриба роду Penicillium проти стафілококу дав англійський мікробіолог О. Флемінг у 1928 р., вказавши на можливість одержання антибактеріальної речовини, яку продукує гриб. Дослідження грибів роду Penicillium, розпочаті Е. Чейном (1906-1979) і Х. Флорі (1898-1968), дозволили не тільки виділити цю речовину, але й створити на її основі перший антибіотик - пеніцилін (1940). За це відкриття Флемінг, Чейн та Флорі одержали Нобелівську премію в 1945 р.
Після цього відкриття стали відомі факти про встановлену в кінці 1930-х років американським мікробіологом З. Ваксманом (18881973), російським мікробіологом М. Красильниковим (1896-1973) та іншими дослідниками антибактеріальну активність бактерій роду Streptomyces. Завдяки цим результатам у 1943 р. З. Ваксман запропонував другий сучасний антибіотик - стрептоміцин, за що в 1952 р. отримав Нобелівську премію (рис. 11.3).

Рис. 11.4. Лауреати Нобілевської премії за винайдення антибіотиків З. Ваксман та О. Флемінг
Наступні роки названо ерою антибіотиків, адже вони характеризувалися масштабним пошуком та одержанням антибіотиків із грибів, бактерій та інших організмів.
Термін "антибіотики", що в 1942 р. запропонував З. Ваксман, означав "хімічні речовини, утворені мікроорганізмами, які здатні пригнічувати ріст і навіть руйнувати бактерії та інші мікроорганізми".
У результаті розширення та поглиблення уявлень про антибіотики змінилося і трактування цього поняття.
Антибіотики - це хіміотерапевтичні речовини, які одержані з різних організмів у процесі їх життєдіяльності і відрізняються від звичайних метаболітів специфічністю та високою активністю, а також синтетичні аналоги цих речовин, що здатні вибірково пригнічувати ріст збудників захворювань - вірусів, бактерій, грибів, водоростей, простіших, гельмінтів - та (або) затримувати розвиток злоякісних пухлин.
Підходи до класифікації антибіотиків визначаються фаховими інтересами. Академічними є класифікації за хімічною будовою та за механізмом дії (рис. 11.4, 11.5). Класифікація за спектром дії, як і класифікація антибіотиків за біологічним походженням має практичне спрямування в медичній та науковій галузях.
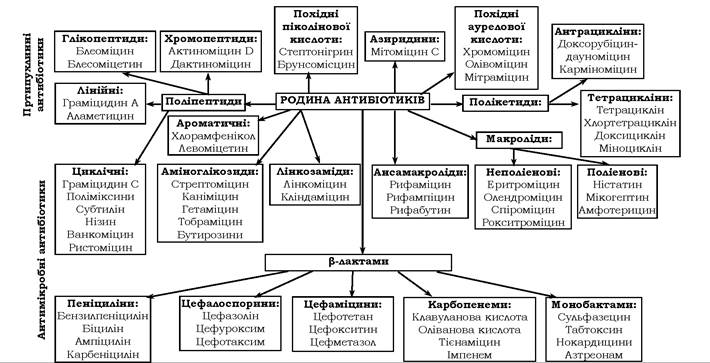
Рис. 11.4. Класифікація антибіотиків за хімічною будовою
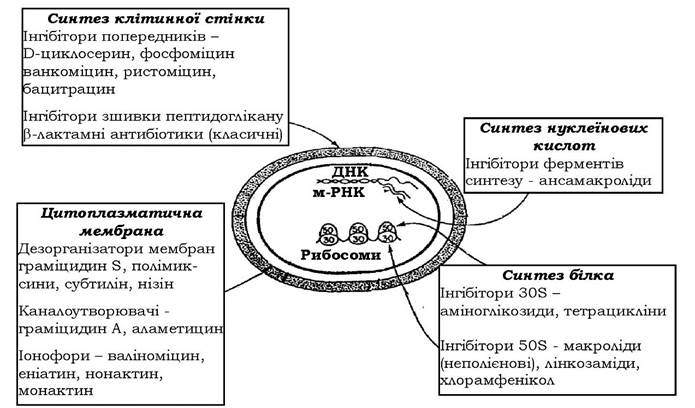
Рис. 11.5. Мішені дії антибактеріальних антибіотиків
Перший антибіотик пеніцилін було одержано зі штаму Penicillium chrysogenum (рис. 11.6). Цей антибіотик започаткував родину класичних β-лактамних антибіотиків.
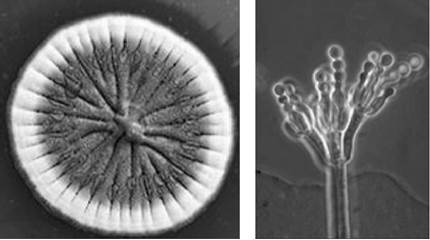
Рис. 11.6. Колонія та конідієносець гриба Penicillium chrysogenum
Природні пеніциліни - це суміш 4-5 близьких за структурою та властивостями сполук, основою яких є ядро молекули пеніцилінів - 6-амінопеніциланова кислота (6-АПК).
6-амінопеніциланова кислота (6-АПК) - це β-лактам-тіазолідінова ге- теробіциклічна система, структура якої встановлена 1959 р. (рис. 11.7).
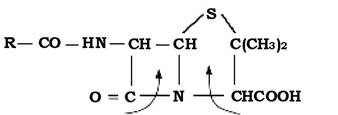
Рис. 11.7. Структура ядра молекули пеніцилінів
Синтез β-лактамних антибіотиків, зокрема пеніцилінів, відбувається в реакціях амінокислотного обміну як вторинних метаболітів. Аміноадипінова кислота та цистеїн утворюють дипептид, що за участю валіну перетворюється у трипептид з подальшим конденсуванням у циклічну структуру ізопеніциліну N (L-ААК-б-АПК). Різноманіття природних пеніцилінів забезпечується наступною реакцією ацилювання,
яку каталізує пеніциліна- цилаза, за участю попередників певного виду пеніциліну - фенілоцтової кислоти, феноксиоцтової кислоти, фенілетиламіну тощо. Ці попередники зумовлюють особливості структур бічного радикалу.
Технологія одержання пеніцилінів стала базовою для багатьох інших антибіотиків. Спочатку до 1946 р. здійснювали поверхневе культивування продуцентів на рідких середовищах, що мало перевагу максимального кисневого забезпечення, але унеможливлювало відведення надлишку тепла та продуктів обміну, було трудомісткім, з високими витратами та собівартістю - одну дозу антибіотика отримували з 10-20 літрів культуральної рідини. Глибинне культивування подолало вади поверхневого, стимулювало розвиток засобів аерації і в сучасних умовах переважає як спосіб культивування.
Вилучають антибіотик з культуральної рідини продуцента методами осадження й одержують високоочищені препаративні форми у вигляді солей. Рівень активності препаратів виражають в одиницях активності або у вагових категоріях.
Природні пеніциліни є вузькоспектровими антибіотиками, активними проти грампозитивних коків, переважно стафілококів. Деякі пеніциліни (біциліни) активні проти гонококів та трепонем (табл. 11.1).
Таблиця 11.1. Класичні β-лактамні антибіотики
Група |
Антибіотики |
Мікроорганізми-продуценти або інше джерело одержання |
Спектр дії |
|
Пеніциліни |
Природні |
Бензилпеніцилін (Пен G) солі - калієва, новокаїнова та дибензил-етиленди- амінова(біцилін)оксибензилпеніцилін (Пен X), феноксиметилпеніцилін (Пен V) |
Penicillium brevicompactum, P. nigricans, P. corilophillum, P. turbatum, Aspergillus flavus, A. nidulans, Acremonium sp. |
Staphylococcus, Streptococcus Neisseria, Treponema (біциліни) |
Напів-синтетичні |
Ампіцилін, карбеніцилін, метицилін, оксацилін, клоксацилін, диклоксацилін, амоксицилін, азлоцилін, мезлоцилін, піперацилін |
6-АПК - біосинтетична основа пеніцилінових антибіотиків |
Staphylococcus, Streptococcus, E. coli, Klebsiella, Salmonella, Shigella |
|
Цефалоспорини |
1-е покоління |
Цефалотин, цефазолін, цефалоридин, цефпірин, цефалексин, цефадроксил та інші |
Acremoniumstrictum - продуцент 7-АЦК - біосинтетичної основи цефалоспори нових антибіотиків |
Staphylococcus, Streptococcus, Neisseria, деякі Shigella, Proteus, Salmonella, Escherichia |
2-е покоління |
Цефуроксим, цефаклор, цефамандол, цефоніцид, цефметазол, цефотіам та інші |
Staphylococcus, Streptococcus, Neisseria, E. coli, Klebsiella, Proteus, деякі Pseudomonas |
||
3-є покоління |
Цефотаксим, цефтриаксон, цефтазидим, цефоперазон, цефодизим, цефетамет, цефменоксим та інші |
Менш активні проти Staphylococcus, Streptococcus. Більш активні проти Enterobacteriaceae, Neisseria, Haemophilus, Moraxella, Pseudomonas, Acinetobacter, стійких до β-лактамаз |
||
4-е поко-ління |
Цефепим, цефпиром, цефклидин, цефозопран, цефхином та інші |
Більш активні проти Staphylococcus, Streptococcus, Neisseria, Enterobacteriaceae, Haemophilus, Moraxella, Pseudomonas, Acinetobacter, Bacteroides, Fusobacterium, Clostridium, стійких до β-лактамаз |
||
5-е покоління |
Цефтобіпрол |
|||
Цефаміцини |
Цефотетан, цефокситин, цефметазол |
Streptomycesclavuligerus, S. lactamdurans, S. lipmanii |
Аналогічний до спектрів дії 3 і 4-го покоління цефалоспоринів |
|
У перші роки розвитку антибіотикотерапії нагальною потребою було одержання широкоспектрових антибіотиків, тобто таких, що діють як на грампозитивні, так і грамнегативні бактерії. Це сприяло створенню напівсинтетичних похідних із біосинтетичною антибіотичною основою, яку хімічно модифікували.
Першим напівсинтетичним пеніциліном був ампіцилін. Він, як і інші напівсинтетичні пеніциліни, має широкий спектр дії, є кислотостійким, зокрема в шлунковому середовищі, на відміну від більшості природних пеніцилінів, які застосовують в ін'єкціях (табл. 11.1).
Загалом створено понад 50 тис. напівсинтетичних пеніцилінів, з яких лише 35-40 застосовується у клінічній практиці. Найбільшою вадою як природних, так і напівсинтетичних пеніцилінів є висока алергенність.
Стратегія створення напівсинтетичних препаратів стала провідною для іншої групи класичних β-лактамних антибіотиків - цефалоспоринів. Продуцент біосинтетичної основи цефалоспорину мікроскопічний гриб Cephalosporiun acremonium (синоним Acremonium strictum) вперше було виділено в 1946 р. З огляду на дуже низьку антимікробну активність природної сполуки почали розробку напівсинтетичних препаратів.
Схема біосинтезу природних цефалоспоринів подібна до такої для пеніцилінів.
Подібність хімічної будови цефалоспоринів полягає в наявності β-лактамного кільця. Ядром молекули цефалоспоринів є 7-аміноцефалоспоранова кислота (7-АЦК) - β-лактам-тіазинова гетеробіциклічна система (рис. 11.8).
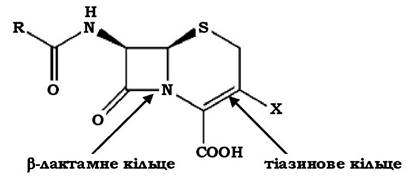
Рис. 11.8. Структура ядра молекули цефалоспоринів
Молекула біосинтетичної основи цефалоспоринів має більші можливості для модифікації, тому створено близько 60 тис. напівсинтетичних похідних, з яких понад 100 застосовується у клініці.
У сучасних умовах половина антибіотиків, що випускаються у світі, є цефалоспоринами, тому β-лактами займають серед усіх антибіотиків перше місце.
Установлено також можливість одержання цефалоспоринів не з грибів, а з бактерій роду Streptomyces, що дозволило створювати аналогічні цефалоспоринам препарати - цефаміцини.
Цефалоспорини та цефаміцини - це класичні β-лактами, широкоспектрові, високоактивні антибіотики кількох поколінь, з низьким рівнем токсичності та алергенності, прості в застосуванні (табл. 11.1).
Механізм дії класичних β-лактамних антибіотиків (пеніцилінів, цефалоспоринів, цефаміцинів) пов'язаний із синтезом пептидоглікану. На останніх етапах синтезу пептидоглікану транспептидази каталізують утворення зшивок у незавершеному полімері. Саме ферменти з транспептидазною активністю і є мішенями для пеніциліну, тому їх називають ПЗБ (пеніцилін-зв'язуючі білки, РВР (penicillin binding protein). Приєднуючись до активного центру ферменту, вони забезпечують утворення неактивного пеніцилоїл-ферменту, порушуючи завершення синтезу клітинної стінки. Клітинна стінка з незавершеним пептидогліканом є дефектною і не може виконувати своїх функцій,
водночас активізуються автолітичні ферменти клітини, що призводить до загибелі клітини.
β-лактами - не єдині антибіотики, які здатні порушувати синтез пептидоглікану. Перші етапи його синтезу інгібують D-циклосерин, фосфоміцин як структурні аналоги амінокислот. Синтезовані попередники пептидоглікану безпосередньо або через носій можуть бути заблоковані пептидними антибіотиками: ванкоміцином, ристоміцином або бацитрацином відповідно.
β-лактамні антибіотики, як й інші інгібітори синтезу клітинної стінки прокаріотів, ефективно впливають на клітини грампозитивних бактерій, у яких пептидоглікан не захищений зовнішньою мембраною. Вплив на грамнегативні бактерії залежить від структури молекули напівсинтетичних β-лактамів та рівня щільності зовнішньої мембрани.
Зниження ефективності застосування як природних, так і напівсинтетичних β-лактамних антибіотиків пов'язане насамперед з дією β-лакта- маз (пеніциліназ та цефалоспориназ). Це - захисні ферменти мікроорганізмів, здатних руйнувати β-лактамне кільце у структурі антибіотика.
Значним здобутком у створенні сучасних антибіотиків стали кар- бапенеми і монобактами. Це - некласичні β-лактамні антибіотики (табл. 11.2).
Таблиця 11.2. Некласичні β-лактамні антибіотики
Група |
Антибіотики |
Мікроорганізми-продуценти або шлях одержання |
|
Карбапенеми |
Природні |
Клавуланова кислота, оліванова кислота, тієнаміцин |
Streptomyces clavuligerus, S. olivaceus, S. cattleya |
Напівсинтетичні |
Іміпенем |
Формімідоілтієнаміцин |
|
Синтетичні |
Сульбактам-натрій |
Натрієва сіль сульфонпеніцилату |
|
Монобактами |
Природні |
Табтоксин, сульфазецин, нокардицин |
Pseudomonas tabaci, P. acidophila, Nocardia, Gluconobacter, Chromobacterium, Agrobacterium |
Синтетичні |
Азтреонам |
Аміно-тіазоліл-метил-оксо-сульфо-метилпро- панова кислота |
|
Карбаненеми мають структуру бігетероциклів за участю β-лактамного кільця. Монобактами мають моноциклічну будову ядра молекули - β-лактамне кільце.
Некласичність карбапенемів і монобактамів, як β-лактамів, пов'язана не тільки з особливостями структури, але й біологічної дії. Основним механізмом їх дії вважають інгібування β-лактамаз, тому вони зазвичай входять до складу потенційованих форм β-лактамних антибіотиків. Відомий аугментин є комплексом амоксициліну та клавуланової кислоти, уназин - комплекс ампіциліну та сульбактаму натрію.
Другим після пеніциліну відомим антибіотиком став стрептоміцин, який також започаткував нову родину антибіотиків - аміноглікозиди. Стрептоміцин, одержаний у 1943 р. зі Streptomyces griseus, - перший високо ефективний біосинтетичний протитуберкульозний засіб.
З відкриттям аміноглікозидних антибіотиків стрептоміцети стали провідними продуцентами різних антибіотиків (рис. 11.9).
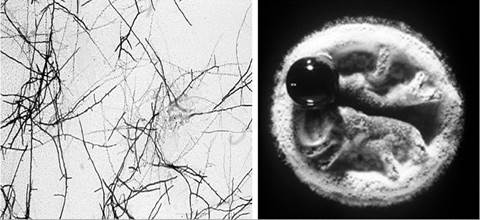
Рис. 11.9. Розгалужені клітини та колонія бактерій роду Streptomyces
Сучасна родина аміноглікозидів налічує понад 100 природних сполук, що синтезуються актиноміцетами та бактеріями роду Bacillus, а також напівсинтетичних похідних.
Молекула аміноглікозиду - це основа з шестичленного карбоциклічного аміноспирту (аміноінозиту), з'єднаного глікозидним зв'язком з одним або кількома звичайними або специфічними аміноцукрами (рис. 11.10).
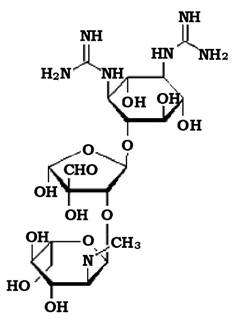
Рис. 11.10. Структура молекули стрептоміцину
Аналіз шляхів біосинтезу аміноглікозидних антибіотиків довів, що вони пов'язані з вуглеводним обміном клітин продуцентів. Основними методами обробки культуральної рідини з метою одержання препаратів аміноглікозидних антибіотиків є методи іонообмінної сорбції.
Аміноглікозиди - антибіотики, які утворені різними бактеріями, мають широкий спектр дії, з особливостями впливу на окремі групи мікроорганізмів (табл. 11.3).
Механізм дії аміноглікозидів полягає в утворенні аномального ініціаторного комплексу шляхом зв'язування з 30S-субчасткою рибосоми, що блокує початок трансляції. Можливе також інгібування аміноглікозидами термінації трансляції.
Аміноглікозидні антибіотики широко застосовуються, але тільки в ін'єкціях через низьку всмоктуваність мають високий рівень токсичності та швидкості формування резистентності до них, тому займають лише четверте місце серед інших антибіотиків.
Друге місце за обсягами застосування посідають макролідні неполієнові антибіотики.
Перший макролідний неполієновий антибіотик - еритроміцин було виділено в 1952 р. з культуральної рідини Streptomyces erythreus (синоним Saccharopolyspora erytraea). Незабаром було одержано олеандоміцин та інші природні неполієнові макроліди.
Таблиця 11.3. Особливості аміноглікозидних антибіотиків
Покоління антибіотиків |
Антибіотики |
Мікроорганізми-продуценти |
Спектр дії |
1-е |
Стрептоміцин Неоміцин Мономіцин Канаміцин |
Streptomyces griseus Streptomyces fradiae Streptomyces monomycini Streptomyces kanamyceticus |
Mycobacterium tuberculosis, бактерії родів: Staphylococcus, Klebsiella, Shigella, Proteus, Salmonella, Escherichia, Yersinia, Brucella, Frencisella |
2-е |
Гентаміцин Сизоміцин Тобраміцин Бутирозини |
Micromonospora purpurea Micromonospora injoensis Streptomyces tenebrarius Bacillus drculans |
Pseudomona.s a.eruginosa, а також грампозитивні та грамнегативні бактерії, стійкі до аміноглікозидів 1-го покоління та інших антибіотиків |
3-є |
Амікацин Нетилміцин |
Напівсинтетичне похідне канаміцину Напівсинтетичне похідне сизоміцину |
Грампозитивні та грамнегативні бактерії, стійкі до аміноглікози- дів 2-го покоління та інших антибіотиків |
Особливістю структури стала наявність 14- або 16-членного лак- тонного кільця із залишками цукрів (рис. 11.11).
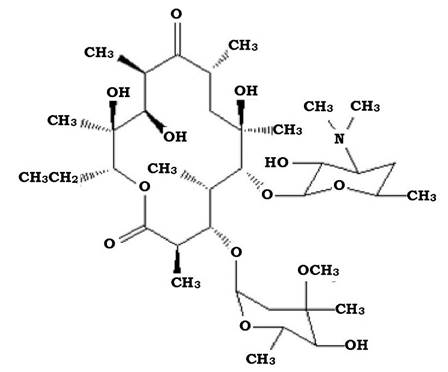
Рис. 11.11. Структура молекули еритроміцину
Синтез сполук лактонної структури відбувається в реакціях жир- нокислотнго обміну, за участю пропіонілу-КоА та малонілу-КоА з наступною конденсацією полікетокислот.
Отримують не тільки природні антибіотики, а й біосинтетичні основи численних напівсинтетичних похідних макролідів, що відрізняються як структурою, так і особливостями спектру дії (табл. 11.4).
Механізм дії неполієнових макролідів пов'язаний із синтезом білка і полягає у блокуванні 23S-РНК у межах пептидилтрансферазної ділянки БОБ-субчастки рибосоми, що пригнічує транслокацію пептиду з аміноацильного центру в пептидильний центр рибосоми.
Макролідні неполієнові антибіотики характеризуються низькою токсичністю, високою біодоступністю та активністю проти антибіотикорезистентних бактерій. Найбільш перспективними макролідами вважають азаліди, започатковані азитроміцином - високоактивним, пролонгованим антибіотиком.
Серед інгібіторів синтезу білка відомі лінкозаміди (піранозиди). Ці антибіотики вивчаються з 1962 р., коли було встановлено продукцію лінкоміцину штамом Streptomyceslincolniensis.
Будова молекули цих антибіотиків характеризується наявністю піролідінового кільця, що має глікозидний зв'язок із цукром (рис. 11.12).
Таблиця 11.4. Природні, синтетичні та напівсинтетичні макролідні антибіотики
Антибіотики |
Мікроорганізми-продуценти |
Спектр дії |
|
14-членне лактонне кільце |
Еритроміцин Олеандоміцин |
Saccharopolyspora erytraea Streptomyces antibioticus |
Бактерії родів Staphylococcus, Streptococcus, Neisseria, Legionella, Moraxella, Campylobacter |
Рокситроміцин Кларитроміцин Флуритроміцин |
Напівсинтетичні антибіотики |
Бактерії родів Staphylococcus, Streptococcus, Neisseria, Legionella, Moraxella, Campylobacter, Haemophilus, Mycoplasma, Chlamydia. Бактерії, стійкі до дії інших антибіотиків |
|
15-членне |
Азитроміцин - родина азалідів |
Синтетичний або напівсинтетичний антибіотик - похідне еритроміцину |
Бактерії родів Staphylococcus, Streptococcus, Neisseria, Legionella, Haemophilus, Mycoplasma, Chlamydia. Бактерії, стійкі до дії інших антибіотиків |
16-членне лактонне кільце |
Джозаміцин Мідекаміцин Спіраміцин Тилозин |
Streptomyces narbonensis Streptomyces mycarofaciens Streptomyces ambofaciens Streptomyces fradiae |
Бактерії родів Staphylococcus, Streptococcus, Neisseria, Legionella, Moraxella, Campylobacter, Haemophilus, Mycoplasma, Chlamydia |
Рокітаміцин Міокаміцин |
Напівсинтетичні антибіотики |
Грампозитивні та грамнегативні бета-лактамазоутворювальні бактерії |
Окрім природного антибіотика лінкоміцину, використовують його хлордезоксипохідне - кліндаміцин, який у 2-10 разів активніший за лінкоміцин, особливо проти пептококів та пептострептококів. Лінко- заміди виявляють активність проти більшості грампозитивних коків (стафілококів, пневмококів та інших стрептококів), за винятком ентерококів, неспороутворювальних анаеробних бактерій (бактероїдів, еубактерій, фузобактерій та ін.). Ці антибіотики не активні проти бактерій роду Haemophilus, Neisseria, Clostridium.
Механізм дії лінкозамідів пов'язаний із блокуванням утворення бактеріальних полісом, що порушує процес трансляції. Широке застосування лінкозамідів обмежується потенційним дисбактеріозом з причини елімінації анаеробної флори.
Поширеними в лікувальній практиці є тетрациклінові антибіотики. За частотою застосування вони конкурують з макролідними антибіотиками.
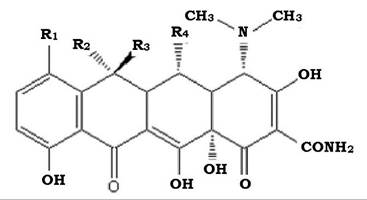
Рис. 11.12. Структура молекули лінкоміцину
Перший тетрациклін було одержано в 1948 р. з культуральної рідини Streptomyces aureofaciens. Цей антибіотик являв собою хлортетрациклін і був названий ауреоміцином. У сучасних умовах відомо понад 30 біосинтетичних тетрациклінів.
Молекула тетрациклінів складається з одного ароматичного і трьох гідроароматичних кілець (рис. 11.13).
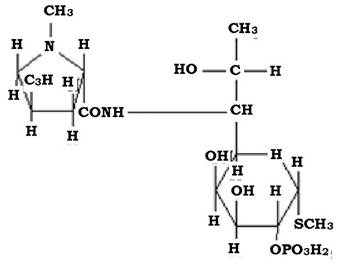
Рис. 11.13. Структура молекули тетрациклінів
Біосинтез тетрациклінів відбувається за схемою утворення полікетидів за участю малонілу-СоА та малонамоїлу-СоА з подальшим декарбоксилюванням, метилюванням та циклізацією.
На відміну від інших антибіотиків пошук напівсинтетичних тетрациклінів виявився менш плідним. Проте одержані похідні вже набули широкого застосування (табл. 11.5).
Таблиця 11.5. Природні та напівсинтетичні тетрацикліни
Антибіотики |
Мікроорганізми- продуценти |
Спектр дії |
Хлортетрациклін Тетрациклін Окситетрациклін |
Streptomyces aureofaciens Streptomyces viridifaciens або з Streptomyces aureofaciens в дехлорованому середовищі |
Staphylococcus, Streptococcus, Neisseria, Haemophilus, Salmonella, Escherichia, Vibrio, Brucella, Leptospira, Mycoplasma, Rickettsia, Borrelia, Chlamidia; |
Бромтетрациклін |
Streptomyces rimosus |
|
Деметилхлортетрациклін Деметилтетрациклін |
Streptomyces aureofaciens в середовищі з бромом Streptomycesaureofaciens з порушенням перенесення метильних груп |
Protozoa: Hexamita, Trichomonas |
Метациклін Міноциклін Доксициклін |
Напівсинтетичні похідні тетрацикліну Напівсинтетичне похідне оксітетрацикліну |
Подібний до спектра дії біосинтетичних тетрациклінів |
Механізм дії тетрациклінових антибіотиків полягає у пригніченні функції як ЗОS-субчасток, так і 40S-субчасток рибосом шляхом інгібування зв'язування аміноацил-тРНК з ділянкою аміноацильного центру рибосоми.
Тетрацикліни є бактеріостатичними антибіотиками широкого спектру дії. Висока токсичність, розвиток резистентності мікроорганізмів до цих препаратів, створення ефективних та безпечних антибіотиків інших груп звужує показання для призначення тетрациклінів. Напівсинтетичні антибіотики цієї родини мають покращені фармакокинетичні властивості та активність проти бактерій, стійких до дії природних тетрациклінових антибіотиків.
Серед антибіотиків-інгібіторів синтезу білка значний досвід застосування мають також ароматичні антибіотики, представниками яких є хлорамфенікол та левоміцетин.
Хлорамфенікол, виділений з культуральної рідини актиноміцета Srteptomyces Venezuela, дослідженого ще в 1947 р., став першим високоефективним засобом проти рикетсій. За будовою хлорамфенікол є нітрофеніл-дихлор-ацетиламіно-пропандіолом (рис. 11.14).
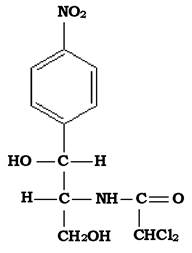
Рис. 11.14. Структура молекули хлорамфеніколу
Біосинтез цього антибіотика пов'язаний з біосинтезом ароматичних амінокислот.
Після встановлення структури з 1950 р. було налагоджено випуск синтетичного аналога хлорамфеніколу - левоміцетину. Левоміцетин є D-трео-формою в рацемічному препараті синтоміцин. Шляхом хімічної модифікації було одержано похідне хлорамфеніколу - тіамфенікол (тіоциметин).
Через відносну простоту будови ароматичні антибіотики одержують у промислових масштабах повним хімічним синтезом.
Хлорамфенікол (левоміцетин) має широкий спектр активності. Бактерицидно він діє на бактерії роду Haemophilus, Neisseria, Streptococcus, бактеріостатично - на бактерії роду Shigella, Proteus, Salmonella, Escherichia, Mycoplasma, Rickettsia, Chlamidia, Bacteroides, Fusobacterium, Clostridium.
Серед ускладнень під час застосування ароматичних антибіотиків головним є пригнічення кровотворення, однак використання тіамфеніколу дозволяє уникнути анемічних станів. Формування резистентності мікроорганізмів до цих антибіотиків є ще однією проблемою їх застосування.
Механізм дії цих антибіотиків полягає в інгібуванні 508-субчасткн рибосоми шляхом блокування ділянки, що каталізує подовження пептидного ланцюга під час синтезу білка.
Представники споріднених родин антибіотиків можуть також впливати на різні організми. Зокрема, макролідні неполієнові антибіотики відомі як інгібітори білкового синтезу бактерій, у той час як по- лієнові макроліди є інгібіторами функцій мембран грибів.
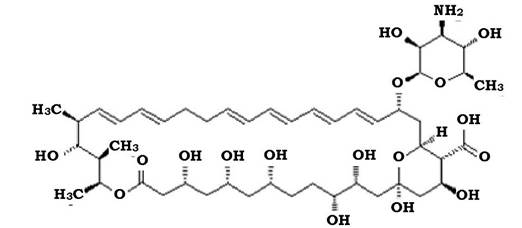
Полієни у структурі лактонного кільця мають від трьох до восьми подвійних зв'язків. За кількістю цих зв'язків розрізняють триєни, пентаєни, гексаєни, гептаєни. У будові молекули розрізняють гідрофільну, що несе гідроксильні групи, та гідрофобну частину (рис. 11.15).
Рис. 11.15. Структура молекули ністатину
Продуценти полієнових антибіотиків відомі з 1950 р., коли з культуральної рідини Streptomyces noursei було виділено ністатин. У 1955 р. було отримано амфотерицин з культуральної рідини
Streptomyces nodosus. Амфотерицин В визнано золотим стандартом спектра та рівня активності антифунгальних засобів.
Найбільш відомими є гексан - ністатин, гептаєни - леворин, амфотерицин, мікогептин (табл. 11.6).
Таблиця 11.6. Поліснові антибіотики
Антибіотики |
Мікроорганізми-продуценти |
Спектр дії |
Ністатин |
Streptomyces noursei |
Гриби роду Candida, Torulopsis, Cryptococcus, Trichosporon, Microsporum, Penicillium, Aspergillus |
Амфотерицин |
Streptomyces nodosus |
|
Леворин |
Streptomyces levoris |
|
Мікогептин |
Streptoverticillium mycoheptinium |
Механізм дії полієнових антибіотиків полягає в утворенні каналів у структурі мембран грибів. Гідрофобні ділянки молекул антибіотиків утворюють комплекси з ергостерином мембрани, у той час як гідрофільні ділянки молекул антибіотиків орієнтовані в отвір каналу. Такі канали порушують функції мембрани грибів, зменшуючи її вибірковість та збільшуючи проникність.
Полієни здатні утворювати комплекси як з ергостерином, так і з холестерином, що є причиною значної побічної дії цих антибіотиків. Побічна дія стримує їх широке застосування в клініці грибкових уражень і сприяє пошуку ефективних і більш безпечних засобів.
Висока токсичність характерна також для інших мембраноактивних антибіотиків - пептидів. З цієї причини їх обмежено застосовують в медицині, проте в наукових дослідженнях ними послуговуються при вивченні транспорту через мембрани.
Створенню каналів у мембранах бактерій може сприяти лінійний пептидний антибіотик граміцидин А, який синтезується бактеріями Bacillus brevis. Депсипептидні антибіотики, які складаються з амінокислот та оксикислот, у неполярних середовищах утворюють структуру замкнутого ланцюга - "іонну пастку», розмір порожнини якої відповідає розміру відповідного іону, що забезпечує селективність дії антибіотика. Ці антибіотики за механізмом дії є іонофорами - транспортувальниками іонів. Зовнішня сфера антибіотика гідрофобна, що дозволяє долати ліпідний шар мембрани. До таких антибіотиків належать валіноміцин, еніатини, нонактин, монактин тощо. Їх продуцентами є бактерії роду Streptomyces та гриби роду Fusarium.
Більшість пептидних антибіотиків мають циклічну будову і є дезорганізаторами мембран (табл. 11.7).
Таблиця 11.7. Циклопептидні антибіотики
Антибіотики |
Мікроорганізми-продуценти |
Спектр дії |
Граміцидин S |
Bacillus brevis |
Бактерії роду Staphylococcus, Streptococcus, Neisseria |
Поліміксин |
Bacillus polymyxa |
Бактерії роду Haemophilus, Salmonella, Escherichia, Vibrio, Klebsiella, Pseudomonas |
Субтилін |
Bacillus subtilis |
Бактерії роду Corynebacterium, Mycobacterium |
Нізин |
Lactococcus lactis |
Бактерії роду Bacillus, Corynebacterium, Mycobacterium, Clostridium |
Механізм дії цих антибіотиків полягає в утворенні комплексів з фосфоліпідами, що змінює катіонну проникність мембрани.
За будовою циклічні пептидні антибіотики розрізняються вмістом амінокислотних залишків та конфігурацією структури. Так, граміцидин S є циклодекапептидом, поліміксини мають лінійно-кільцеву структуру, а субтілін та нізин є пептид-поліциклопептидами.
Спектр дії цих антибіотиків охоплює переважно грампозитивні бактерії, окрім поліміксинів, які впливають на грамнегативні бактерії.
Застосування циклічних пептидних антибіотиків у медицині обмежене їх високою токсичністю, проте вони є препаратами вибору за умов стійкості збудників до інших антибіотиків. Деякі антибіотики, наприклад субтілін та нізин, відомі як консерванти в харчовій промисловості.
Як антибактеріальні засоби застосовуються також циклічний пептид бацитрацин та поліциклоглікопептиди - ванкоміцин і ристоміцин, про які згадувалося при розгляді антибіотиків - інгібіторів синтезу пептидоглікану.
Серед пептидних антибіотиків також є такі, які окрім мікроорганізмів здатні впливати на еукаріотичні клітини, зокрема пухлини. До таких антибіотиків належать хромопептиди (актиноміцини) та глікопептиди (блеоміцини).
Нуклеотропні антибіотики синтезуються різними видами актиноміцетів і представлені різними сполуками (табл. 11.8).
Таблиця 11.8. Нуклеотропні антибіотики
Антибіотики |
Клас сполук |
Мікроорганізми-продуценти |
Актиноміцин D |
Хромопептиди |
Streptomyces antibioticus, Streptomyces parvulius |
Хромоміцин Олівоміцин Мітраміцин |
Похідні аурелової кислоти |
Streptomyces griseus, Streptomyces olivoreticuli, Streptomyces griseoolivaceus |
Адріаміцин Карміноміцин Рубоміцин |
Антрацикліни (антрахінони) |
Streptomyces peusetins, Actinomadura carminata, Streptomyces coeruleorubidus |
Мітоміцин С |
Азиридини (мітозани) |
Streptomyces caespitosus |
Блеоміцин Блеоміцетин |
Глікопептиди |
Streptomyces verticillus, Streptoverticillium griseocarneum |
Стрептонигрин Брунеоміцин |
Похідні піколінової кислоти |
Streptomyces floeculus, Streptomyces albus var. bruneomycini |
За механізмом дії мітозани є "зшивками" ланцюгів ДНК, що порушує їх розходження під час реплікації. Глікопептиди та похідні піколінової кислоти здійснюють розриви ДНК. Антрацикліни, похідні аурелової кислоти, та хромопептиди завдяки хромофору - комплексу 6-членних кілець - здатні до інтеркаляції - вбудовуванню в молекулу ДНК.
Класичним інтеркалятором є актиноміцин D. У молекулі актиноміцину міститься хромофорна феноксазинова група та два пептидних лактони, які складаються з п'яти білкових та небілкових амінокислот (рис. 11.16).
При взаємодії з ДНК хромофорна група актиноміцину локалізується між парами основ, водночас пептидні ділянки молекули антибіотика стабілізують цей комплекс шляхом утворення водневих зв'язків з ланцюгами ДНК. У такий спосіб актиноміцини пригнічують ДНК-залежний синтез нуклеїнових кислот.
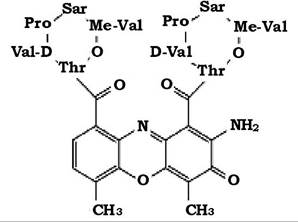
Рис. 11.16. Структура молекули актиноміцину D
Окрім безпосереднього взаємодії з ДНК, пригнічення синтезу може відбуватися шляхом впливу на ферменти, що його забезпечують. Так, антрацикліни та глікопептиди здатні інгібувати топоізомерази пухлинних клітин.
Ансамакролідні антибіотики є інгібіторами ДНК-залежної РНК-полімерази бактерій, що порушує синтез матричної РНК.
Утворення ансамакролідних сполук відоме в рослин, але найбільш ефективне воно в бактерій роду Srteptomyces та Nocardia які продукують антибіотики рифаміцини.
Особливістю будови цих антибіотиків є наявність аліфатичного лак- тамного ланцюга, який зв'язаний з нафталіновим або бензольним кільцем (рис. 11.17).
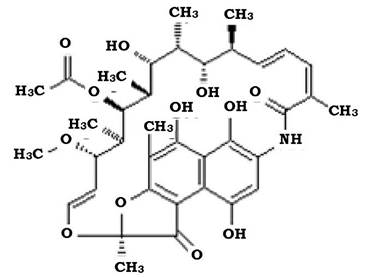
Рис. 11.17. Структура молекули рифаміцину
Синтез рифаміцинів подібний до синтезу макролідних антибіотиків. На основі біосинтетичних рифаміцинів шляхом хімічної модифікації створено напівсинтетичні похідні: анзаміцин, ріфамід, ріфампіцин. Це широкоспектрові антибіотики, що виявляють активність проти бактерій роду Mycobacterium, Staphylococcus, Streptococcus, Neisseria, Haemophilus, Legionella.
Рифампіцин широко застосовується як протитуберкульозний засіб, а також проти збудників, стійких до інших антибіотиків.
Значний перелік антибіотичних речовин різних класів та різного спрямування свідчить про створення потужного арсеналу засобів, спрямованих перш за все на лікування інфекційних хвороб та онкологічних захворювань. Можливості мікроорганізмів як продуцентів антибіотиків дозволили створити біотехнологічну галузь одержання препаратів
для хіміотерапії. Завдяки своїй специфічній вибірковій дії антибіотики стали незамінними інструментами в академічних дослідженнях.
Широке використання антибіотиків протягом десятиліть дозволило не тільки досягти значних успіхів у подоланні інфекцій, але й створило багато проблем. Окрім побічної дії антибіотиків (алергій, дисбактеріозу, нефро-, гепато-, ототоксичності тощо), проблемою їх застосування стало формування резистентності до них клітин мікроорганізмів та макроорганізмів.
Резистентність - це здатність бактерій протистояти дії антибіотиків.
Умовами виникнення резистентних форм є гетерогенність природних популяцій мікроорганізмів та пухлинних клітин, у яких співіснують чутливі і стійкі до антибіотиків клітини, та мутаційно-селекційний процес. Основні механізми формування резистентності поділяють на три рівні.
На рівні захисних ферментів мікроорганізми інактивують молекули антибіотиків ще до досягнення ними мішені. Серед захисних ферментів відомі β-лактамази, хлорамфенікол-гідролази, макролід-естерази, макролід-трансферази, аміноглікозид-трансферази, лінкозамід-трансферази.
На рівні мішені в резистентних до макролідів бактерій змінена конформація пептидилтрансферазного центру завдяки метилюванню в 23 S рРНК одного із залишків аденіну специфічною метилазою.
При формуванні резистентності до β-лактамів у метицилінстійких стафілококів або стрептококів у клітинах синтезується транспептидаза 2а (РВР 2 А), яка здатна заміняти функції усіх інших транспептидаз (пеніцилін-зв'язуючих білків) і при цьому бути нечутливою до антибіотиків.
При ванкоміцинрезистентності ентерококів відбувається зміна в пептидоглікановій мішені - пентапептиду на депсипептид з кінцевим залишком D-лактату замість кінцевого D-аланіну. Це унеможливлює впізнавання мішені антибіотиком.
На рівні транспортних систем резистентність формується завдяки активному викиду антибіотика з клітини. Це явище отримало назву ефлюкс (efflux).
Активний викид антибіотиків з клітин Mycobacterium tuberculosis забезпечує резистентність до них поряд з резистентністю на рівні мішені. Більш ефективним механізмом резистентності є ефлюкс тетрациклінів різними мікроорганізмами.
Резистентність еукаріотичних клітин до хіміопрепаратів корелює з підвищеною експресією глікопротеїну Р та білка MRP, які забезпечують ефлюкс.
Усі механізми резистентності мають генетичні основи. Ферменти, що модифікують мішень антибіотиків, транспортні системи, ферменти -
інактиватори антибіотиків кодуються як хромосомними, так і переважно плазмідними генами. Наприклад, метилаза, яка модифікує мішень макролідів, кодується erm-геном (Erythromycin Ribosome Metylation), ванкоміцинрезистентність - van-геном, макролідглікозил-трансфераза - продукт mgt-гена, макролід-естераза - продукт плазмідного ere-гена.
Плазмідні гени резистентності відомі як R-фактори. Формування резистентності забезпечують і інші мігруючі елементи - транспозони та IS-фрагменти. Усі вони можуть мігрувати між клітинами різних видів та родів грамнегативних бактерій шляхом кон'югації та у грам- позитивних бактерій - шляхом трансдукції, що зумовлює більш повільне перенесення (рис. 11.18).
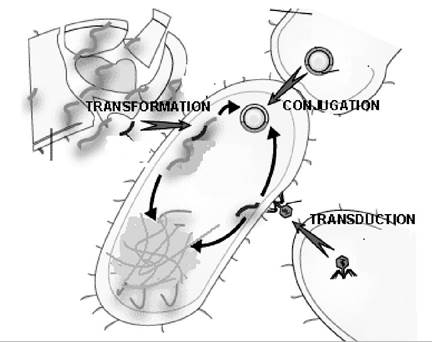
Рис. 11.18. Генетичні шляхи формування резистентності
Мультирезистентність - це одночасна стійкість до кількох антибіотиків, що належать до різних родин. Так, резистентність до макролідів, лінкозамідів, стрептограмінів визначає MLS-тип.
Перехресна резистентність - набуття стійкості до одного антибіотика, що сприяє резистентності до інших антибіотиків цієї родини.
Шляхи уповільнення росту резистентності до антибіотиків такі:
1. Виключення з медичних схем антибіотиків як профілактичних засобів.
2. Виключення з практики багаторазового використання одних і тих самих антибіотиків з поверненням до старих препаратів через 10-15 років.
3. Зміни терапевтичних схем, збільшення лікувальних доз антибіотика безпосередньо у вогнищі запального процесу, скорочення терміну застосування.
4. Створення баз даних і систем контролю поширення резистентних штамів мікроорганізмів.
Практичні заходи з подолання резистентності полягають у створенні потенційованих форм та модифікації антибіотиків, щодо яких є досвід ефективного застосування.
Потенційовані форми β-лактамних антибіотиків, створені шляхом введення до складу препаратів інгібіторів β-лактамаз-карбапенемів та монобактамів, суттєво вплинули на рівень ефективності антибіотикоте- рапії β-лактамами. Створені також інгібітори метилази 23S рРНК, які входять до складу потенційованих форм макролідних антибіотиків.
Завдяки створенню напівсинтетичних похідних, стійких до β-лактамаз, запроваджено нові пеніциліни - ізоксазолілпеніциліни. Дибекацин (бідезоксиканаміцин) - похідне, стійке до аміноглікозидфосфотрансфераз.
Прикладом створення похідних, що впізнають модифіковану мішень, можуть бути гліцилцикліни (напівсинтетичні тетрацикліни).
Інгібування ферментів ефлюксу тетрациклінів здійснюють 13-циклопентил-5-гідрокситетрацикліни.
Пошук та створення нових антибіотиків продовжує залишатися актуальним завданням хіміотерапії. Для його успішного вирішення традиційних схем скринінгу не достатньо. Сучасний напрям пошуку базується на досягненнях геноміки.. Пошукова робота починається не з виявлення антибіотиків як речовин-інгібіторів, а з їх мішеней. Гени та продукти їх експресії, що характерні для бактерій, але відсутні в еукаріотів, є потенційними мішенями майбутніх поколінь антимікробних препаратів.