ФАРМАЦЕВТИЧЕСКАЯ МИКРОБИОЛОГИЯ - В. А. Галынкин - 2015
ЧАСТЬ II. АНТИМИКРОБНЫЕ АГЕНТЫ
ГЛАВА 9. ПРОИЗВОДСТВО ХИМИОТЕРАПЕВТИЧЕСКИХ ПРЕПАРАТОВ
9.1 Общие представления о промышленном производстве лекарственных препаратов
Промышленное производство лекарственных препаратов включает широкое использование машин, аппаратов, поточных механизированных и автоматизированных линий. Оно предусматривает массовый, серийный выпуск препаратов по стандартным прописям, рассчитанным на среднего потребителя.
Укрупненное фармацевтическое производство состоит из комплекса специализированных цехов. Цех — основное производственное подразделение, специализированное для выполнения однородных процессов (дробильный, экстракционный, фасовочный и т. д.) или для выпуска однотипной продукции (таблеточный, ампульный, аэрозольный и др.). Каждый цех имеет несколько участков, где осуществляются однотипные
операции, составляющие технологический процесс. Например, таблеточный цех имеет участки смешивания ингредиентов, гранулирования, сушки гранулята, прессования и др.
Работа промышленных предприятий характеризуется строгой регламентацией и планированием производства. Производственный процесс проводится в определенных стандартных условиях, предусмотренных точными инструкциями, объединенными в одни сводный документ — регламент. Регламент представляет собой совокупность правил, определяющих порядок деятельности фармацевтического предприятия по выпуску готовой продукции. В нем дается характеристика исходных продуктов, полуфабрикатов и готового продукта, указаны последовательность стадий технологического процесса, режим обработки материалов по стадиям, аппаратурная схема, методы анализа, правила по технике безопасности, производственной гигиене и другие условия производства. Регламент является законом производства, отступление от него недопустимо. За соблюдением регламента следит отдел технического контроля.
В фармацевтическом производстве технологические процессы подразделяются на химические, связанные с химическим синтезом лекарственных веществ и физические. К последним относятся механические, связанные с обработкой твердых материалов (измельчение, просеивание, смешивание, дозирование, прессование), гидромеханические (перемешивание жидкостей, эмульгирование, фильтрование), тепловые (испарение, конденсация, плавление), массообменные (растворение, кристаллизация, сушка, экстракция, ректификация). Все эти процессы требуют соответствующего аппаратурного оформления, т. е. выполняются с использованием специальных машин и аппаратов.
Основным исходным материалом для изготовления лекарственных препаратов являются активные фармацевтические субстанции, которые могут быть получены путем химического или биологического синтеза, а также путем переработки лекарственного растительного сырья или тканей и органов животных.
Лекарственные препараты имеют определенную лекарственную форму, т. е. удобное для применения состояние. Существуют твердые (порошки, таблетки, гранулы), жидкие (растворы, суспензии, эмульсии) и мягкие (мази, суппозитории) лекарственные формы. Этапы химического синтеза определенного лекарственного вещества могут включать процессы смешивания ингредиентов реакции, их термической обработки, экстракционного или хроматографического разделения продуктов реакции, упаривания, кристаллизации, сушки и т. п.
Основные этапы микробиологического синтеза антибиотиков, ферментов, органических кислот и т. п. показаны на схеме (рис. 59).
Рис. 59. Этапы получения продуктов микробиологического синтеза.
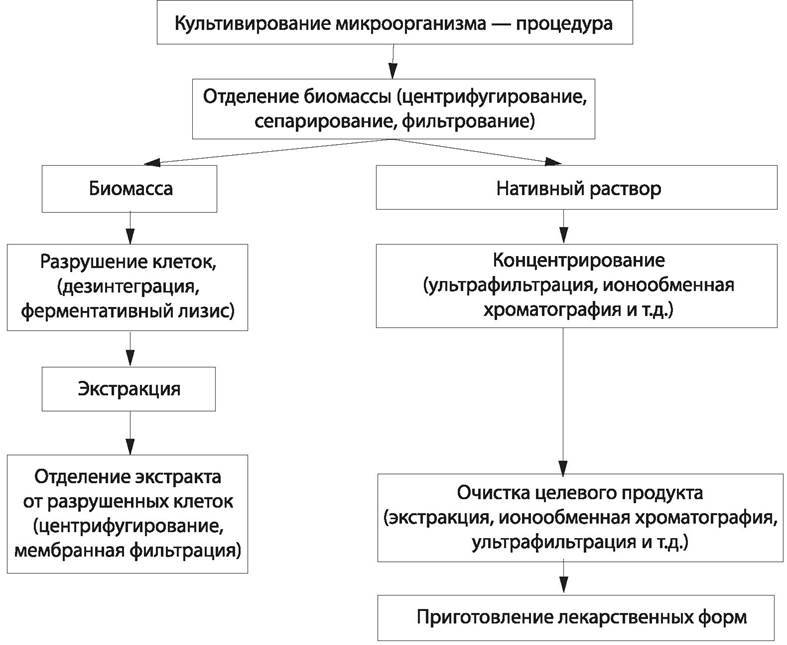
Из лекарственного растительного сырья готовят сборы, порошки, настойки, экстракты, а также получают максимально очищенные экстракционные препараты или препараты индивидуальных веществ.
Из животного сырья получают гормоны, ферменты и препараты неспецифического действия. Они могут представлять собой высушенные, обезжиренные и измельченные ткани или экстракты (максимально очищенные или препараты индивидуальных веществ).
В основу гомеопатической фармации положен принцип потенцирования (динамизации) — особая технология приготовления гомеопатических лекарств. Сущность этого принципа состоит в том, что процесс включает в себя поэтапное снижение концентрации исходного гомеопатического вещества в носителе (растворе или порошке) в 10 или 100 раз на каждом этапе путем интенсивного встряхивания, растирания и перемешивания. В результате получают препараты, в которых содержание исходной субстанции снижено до ничтожных значений.
Для современной фармацевтической промышленности характерно непрерывное совершенствование и комплексное применение новых технологических подходов, основанных на понимании механизма действия и фармакологического эффекта лекарственного вещества и направленных к общей цели — созданию более эффективных и безопасных медицинских препаратов.
Современное фармацевтическое производство требует от персонала понимания смысла и значения каждой ступени технологического процесса и строгого контроля выполнения требований регламента. В связи с этим центральное место в общем направлении развития фармацевтической технологии наряду с химией и биотехнологией принадлежит микробиологии, научный поиск и развитие этих направлений определяют успех развития всей отрасли.
Существенная часть требований к качеству фармацевтической продукции и к условиям производства контролируется микробиологом: стерильность, микробная контаминация сырья и нестерильных лекарственных средств, соблюдение правил производственной гигиены, предусмотренных GМР. Эти требования должны быть хорошо известны всем участникам производственного процесса и неукоснительно соблюдаться с сознанием важности тщательного выполнения каждого из них.
С появлением фармацевтических препаратов, получаемых с использованием методов генетической инженерии, более 80% стерильных лекарственных форм готовят асептично, поскольку эти вещества лабильны и не могут быть простерилизованы в готовом виде. Лекарственные препараты, приготовленные с использованием асептичной технологии, превосходят по своему качеству препараты, производимые ранее.
Техникой работы в асептичных условиях должны владеть не только микробиологи, но и химики, а также весь персонал, от которого зависит выпуск микробиологически безопасной продукции.
9.2 Производство антибиотиков
Получение препаратов антибиотиков - сложный и многоступенчатый процесс. Он слагается из комплекса последовательных исследований, которые можно свести в основном к следующим этапам:
1) изыскание микроорганизмов-антагонистов в природе и выделение их в чистую культуру;
2) изучение спектра действия и определение антибиотической активности выделенных культур антагонистов;
3) подбор условий культивирования продуцентов антибиотиков;
4) первичная идентификация антибиотика на ранних этапах изучения;
5) выделение и химическая очистка активно действующего начала из культуральной жидкости и клеток, а также сравнение полученного антибиотика по биологическим и химическим показателям с уже известными препаратами для выявления новых свойств полученных веществ;
6) изучение механизма действия и испытание токсических и лечебных качеств антибиотиков на животных;
7) разработка технологии получения антибиотика в лаборатории и внедрение ее в промышленное производство;
8) получение из исходных штаммов новых генотипов микроорганизмов, обладающих повышенной активностью, путем мутаций и рекомбинаций методами генетической и клеточной инженерии (рис. 60).
Для получения новых антибиотиков помимо изыскания новых или генетически измененных продуцентов используют следующие методические подходы:
1) получение из исходного антибиотика препарата с новыми свойствами путем химической или биохимической модификации его молекулы;
2) направленный биосинтез путем биохимической модификации структуры, полученной химическим методом;
3) химический синтез с использованием природных структур в качестве шаблонов;
4) мутасинтез. Этот метод включает следующие этапы:
а) получение мутантов — идиотрофов, требующих для образования антибиотика определенный фрагмент его молекулы (предшественник);
б) получение химическими методами аналога этого предшественника (мутасинтона);
в) культивирование идиотрофа на среде, содержащей мутасинтон. При этом идиотроф включает мутасинтон в молекулу продуцируемого им антибиотика. В результате получаются новые (мутасинтетические) структуры.
5) Получение гибридных антибиотиков, т. е. веществ, продуцируемых генетическими гибридами; гибридный антибиотик может содержать структуры двух различных метаболитов. От антибиотиков, получаемых перечисленными выше методами, они отличаются тем, что представляют собой продукт комбинации генов.
Основные этапы получения гибридных антибиотиков:
а) выбор продуцента, образующего известный антибиотик;
б) изыскание нового микроорганизма для гибридизации;
в) исследование биохимических путей синтеза антибиотика, интермедиатов и ферментов;
г) определение генов, контролирующих образование ферментов биосинтеза и его регуляторов;
д) получение рекомбинантной ДНК, содержащей комбинацию генов, благоприятную для процесса биосинтеза;
е) клонирование новой генетической структуры в культуре реципиента;
ж) химическое, микробиологическое и фармакологическое исследование нового антибиотика.
Природные антибиотики получают путем культивирования микроорганизма — продуцента с использованием методов биотехнологии. По объему выпускаемых антибиотиков антибиотическая промышленность является самым крупным биотехнологическим производством.
Цель любой биотехнологии — на базе понимания физиологических и генетических свойств продуцента
получить максимальный выход конечного продукта. Необходимые для этого биотехнологические манипуляции реализуются в соответствующей аппаратуре (рис. 60).
Рис. 60. Аппаратно-технологическая схема периодического культивирования микроорганизмов в стерильных условиях: 1 — реактор для приготовления питательной среды; 2 — насос; 3 — нагреватель среды — стерилизационная колонка; 4 — выдерживатель; 5 — охладитель среды; 6 — индивидуальный фильтр воздуха; 7 — посевной ферментатор; 8 — рабочий ферментатор; 9 — мерник. вода; .......пар; воздух
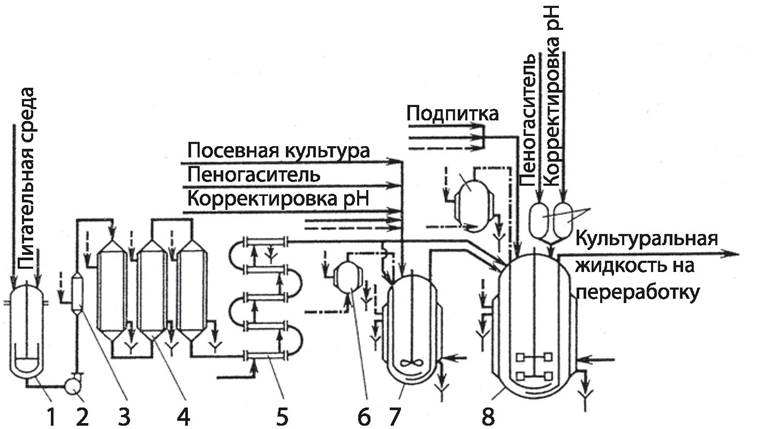
Управление процессами метаболизма продуцента может осуществляться следующими способами:
1) изменением состава питательной среды;
2) изменением условий внешней среды (температура, рН, аэрация);
3) конструкцией биореактора (ферментера);
4) регламентированием введения дополнительного субстрата;
5) фиксацией физиологического состояния культуры применением метода непрерывного культивирования;
6) использованием генетически модифицированных штаммов продуцента.
Реализация этих способов требует специальных инженерно-технологических подходов, обеспечивающих биохимическую регуляцию биосинтеза при сохранении свойств популяции продуцента (отсутствие повреждений клеток, автолиза, инфекции и др.).
Ферментация антибиотиков (рис. 61), как правило, аэробный процесс, требующий подачи воздуха в ферментационную среду и перемешивания.
Рис. 61. Ферментатор. 1 — мешалка одноярусная; 2 — отражательная перегородка; 3 — рубашка; 4 — привод мешалки; 5 — крышка; 6 — труба для подачи воздуха (барботер); 7 — корпус.
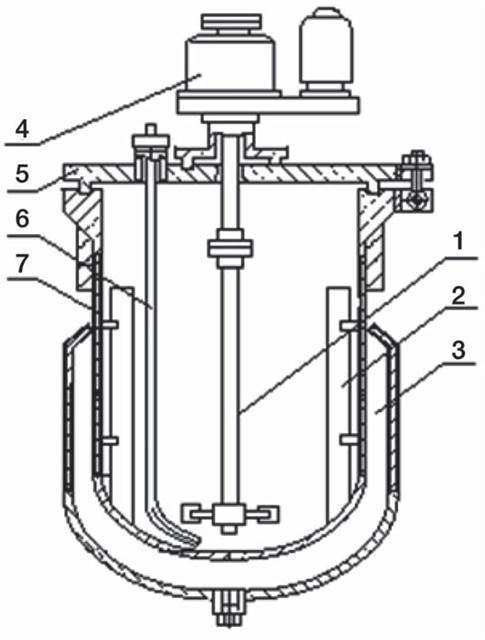
В антибиотической промышленности преимущественно применяют биореакторы объемом от 30 до 200 м3 с механической мешалкой, снабженные системой автоматического контроля и управления процессом ферментации. Температуру ферментации (обычно 24-26°С) обеспечивает система охлаждения. После ферментации биомассу отделяют, антибиотик выделяют из фильтрата (для некоторых антибиотиков — из клеток продуцента) путем экстракции, ионообмена, ультрафильтрации, осаждения и кристаллизации. Процесс подготовки посевного материала, ферментации и многие из дальнейших операций проводят в асептических условиях.
Культура продуцента. Исходный штамм микроорганизма, продуцирующего антибиотик или другие БАВ, выделяют из природных источников (почва, растительные субстраты и др.) специальными методами скрининга; природный (дикий) штамм обладает низкой активностью, поэтому требуется длительная генетико-селекционная работа, обычно с применением мутагенов для повышения его активности. Полученный производственный штамм хранится в состоянии анабиоза (например, при низкой температуре в лиофилизированном состоянии). Такая культура может быть возвращена в активное состояние путем посева на соответствующую питательную среду и использована для приготовления посевного материала.
Приготовление посевного материала. Культуру с поверхности скошенного агара асептично переносят в колбу с посевной средой. При работе с грибами и актиномицетами используют споровый посевной материал (500-5000 спор на 1 л среды). Колбы инкубируют в термостате на качалке. Материал из колб переносят в инокулятор объемом 0,5-1 м3 (0,1% посевного материала от объема среды) и выращивают 1-4 суток. Далее посевной материал асептично переносят в посевной ферментатор объемом 5-20 м3(1012% инокулята от объема питательной среды, время культивирования от 1 суток.). Постоянно отбирают пробы для микробиологического и биохимического анализов. Посевной материал для главной ферментации готовят в количестве 5-10% от объема питательной среды. Ступенчатая подготовка посевного материала позволяет получить его в количестве, необходимом для обеспечения быстрого и продуктивного роста в биореакторе, и поддерживает культуру в фазе логарифмического роста.
Питательная среда конструируется, таким образом, чтобы обеспечить быстрый рост микроорганизма в начальной стадии и максимальный выход продукта в конце ферментации. Среду стерилизуют паром под давлением при 120-140°С непосредственно в ферментаторе или в специальной установке непрерывной стерилизации.
Ферментация. Схема промышленного периодического процесса показана на рис. 61. Ферментер и систему трубопроводов перед заполнением средой моют, проверяют на герметичность и стерилизуют острым паром. Для обеспечения стерильности часто применяют предварительную обработку ферментера химическими дезинфицирующими веществами.
Количество стерильной охлажденной питательной среды в ферментере не должно превышать 70% от его объема. Через линию посевного материала с помощью стерильного воздуха в ферментатор вводят посевной материал. Температура и рН питательной среды до подачи посевного материала должны быть доведены до оптимальных значений для данной культуры.
Ферментацию проводят при аэрации (аэробный процесс) путем подачи стерильного воздуха или без подачи воздуха (анаэробный процесс) и перемешивании, которое способствует растворению кислорода в жидкой среде и полному контакту клеток с питательными веществами. Для предотвращения попадания нестерильного атмосферного воздуха в аппарат давление воздуха над поверхностью жидкости повышают до 20-30 кПа (0,2-0,3 кгс/см3). При необходимости вводят химические пеногасители.
Во время ферментации автоматически регулируются температура и рН среды, по специальной программе вводятся добавочные компоненты питательной среды. Систематически берут контрольные пробы жидкости из ферментатора, в которых определяют необходимые физико-химические показатели, активность и отсутствие посторонних микроорганизмов.
Ферментацию прекращают, когда в среде накапливается максимальное количество полезного продукта. По окончании ферментации культуральную жидкость охлаждают до 10-25°С и перекачивают в резервуары, из которых она подается на дальнейшую обработку.
Способы выделения и очистки антибиотиков индивидуальны и определяются его физико-химическими характеристиками. Например, пенициллин выделяют из культуральной жидкости экстракционным методом (бутилацетатная экстракция), стрептомицин и тетрациклин — методом ионообменной хроматографии.