ФАРМАЦЕВТИЧЕСКАЯ МИКРОБИОЛОГИЯ - В. А. Галынкин - 2015
ЧАСТЬ II. АНТИМИКРОБНЫЕ АГЕНТЫ
ГЛАВА18. МЕХАНИЗМ ДЕЙСТВИЯ ДЕЗИНФЕКТАНТОВ И АНТИСЕПТИКОВ
18.1 Действие антисептиков на микробную клетку
Действие антисептиков на микробную клетку неспецифично, т. е. их мишень может находиться и в клетках млекопитающих. Мишени действия антисептиков разнообразны и присутствуют в клеточной стенке, мембранах и цитоплазме.
В низких концентрациях антисептики вызывают лизис микробных клеток, возможно, воздействуя на ферменты, принимающие участие в синтезе клеточной стенки, таким образом, что они изменяют свои функции, дезинтегрируя ее. Лизис клеточных стенок Е. coli, стафилококков и стрептококков наблюдали в присутствии следующих веществ (указаны концентрации в %): формалин 0,12, фенол 0,32, ртути хлорид 0,0008, натрия гипохлорит 0,005, мертиолат 0,0004. Глутаровый альдегид нарушает структуру клеточной стенки грамположительных бактерий, вызывая необратимое образование в ней перекрестных связей.
Воздействие на цитоплазматическую мембрану сопровождается нарушением мембранного потенциала, ферментов мембраны и ее проницаемости. Нарушение мембранного потенциала приводит к разобщению транспорта электронов и фосфорилирования, препятствует переносу протонов через мембрану, что приводит к прекращению энергетических процессов, направленных к синтезу АТФ. Подобные явления наблюдаются в присутствии таких веществ, как тетрах- лорсалициланилид, трикарбанилид, трихлор- карбанилид, пентахлорфенол и 2-феноксиэтанол.
Ингибирование ферментов, ассоциированных с мембраной, приводит к нарушению многих процессов метаболизма. Гексахлорофен угнетает активность ферментов цепи переноса электронов, подавляя метаболическую активность аэробных бактерий. Хлоргексидин ингибирует мембранную АТФазу, воздействуя таким образом на анаэробные процессы. Антисептики, содержащие ртуть, бронопол и др. ингибируют ферменты, содержащие тиоловые группы (-SH). В присутствии избытка соединений, содержащих тио- группы (цистеин, тиогликолаты), такие антисептики утрачивают активность.
Многие антисептики (ЧАС, фенол, гексилрезорцин и др.) нарушают проницаемость мембраны, что сопровождается утечкой цитоплазматического содержимого. Клетка теряет калий, пурины, пиримидины сахара и другие метаболиты. Если действие антисептика кратковременно, наблюдается лишь бактериостатический эффект.
Цитоплазма представляет собою сложную многокомпонентную систему молекул и субклеточных частиц, каждая из которых может в той или иной степени подвергаться воздействию антисептиков. Высокие концентрации биоцидов, например, хлоргексидина, фенола, солей ртути, вызывают общую коагуляцию цитоплазмы. В присутствии водорода пероксида и п-хлормеркурбензоата происходит диссоциация рибосом на субчастицы. Акридиновые красители способны встраиваться в структуру ДНК, нарушая тем самым ее функции. Многие антисептики взаимодействуют с тиоловыми группами белков, например, галогены могут их окислять. Формальдегид, глутаровый альдегид и серы диоксид реагируют с аминогруппами. Высокореактивные агенты воздействуют на многие клеточные системы. Например, β-пропиолактон алкилирует амино-, имино-, гидроксильные и карбоксильные группы, взаимодействует с тио- и дисульфидными группами, нарушая структуру белков и других макромолекул. Подобной активностью обладает и этилена оксид. Высокой реактогенностью обладают также серы диоксид, сульфиты и бисульфиты.
В таблице 36 приведены данные о клеточных мишенях, подвергающихся воздействию различных антисептиков.
Таблица 36. Действие антисептиков на клеточные мишени
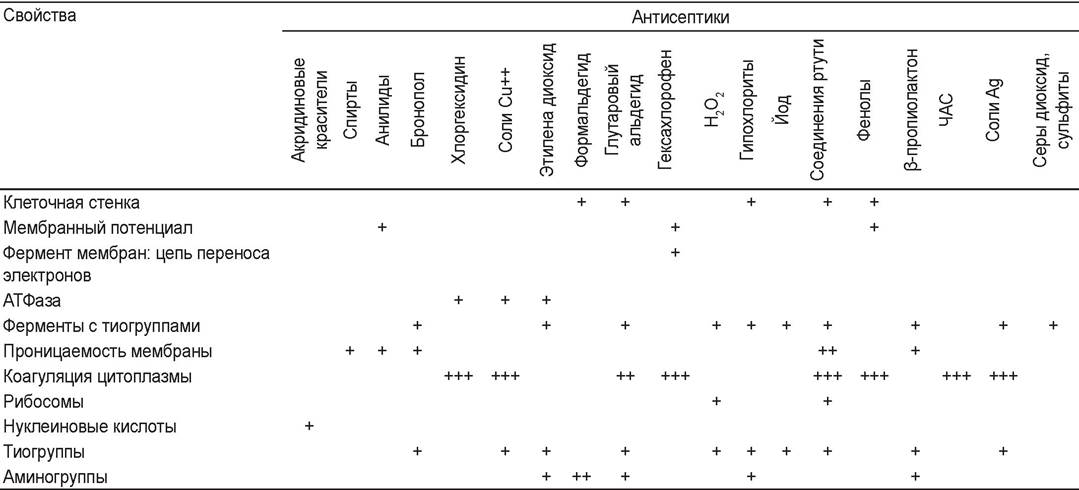
Примечание: + Антисептик действует на низких концентрациях; +++ Антисептик действует в высоких концентрациях
18.2 Резистентность микроорганизмов к антисептикам и дезинфектантам
Микроорганизмы существенно различаются по своей резистентности к действию биоцидов (табл. 37). Как и по отношению к антибиотикам, различают естественную (природную) и приобретенную резистентность к антисептикам и дезинфектантам.
Таблица 37. Чувствительность микроорганизмов к хлоргексидину
Микроорганизмы Грамотрицательные |
Минимальная подавляющая концентрация, мкг/мл |
Pseudomonas aeruginosa |
100-500 |
P. cepacia |
5-100 |
Proteus mirabilis |
25-100 |
Serratia marcescens |
3-50 |
Salmonella typhimurium |
14 |
Klebsiella aerogenes |
1-12 |
Escherichia coli |
1-5 |
Грамположительные |
|
Staphylococcus aureus |
1-2 |
Streptococcus faecalis |
1-3 |
Bacillus subtilis |
1-3 |
Streptococcus mutans |
0,1 |
Mycobacterium tuberculosis |
0,7-6 |
Грибы |
|
Candida albicans |
7-15 |
Trichophyton mentagrophytes |
3 |
Penicillium notaatum |
200 |
Естественная резистентность связана с природными особенностями строения микробной клетки и ее метаболизма: наличием защитных покровов, образованием биопленок, способностью к ферментативной деградации или активному выбросу ксенобиотиков из клетки. Микробной деградации подвергаются все виды ПАВ и другие дезинфектанты в концентрации ниже действующей, а иногда и в рабочей концентрации, например, бензалкониум хлорид, как и другие ПАВ, Р. aeruginosa использует в качестве источника углерода. Этот микроорганизм наиболее часто обнаруживается в растворах дезинфектантов наряду с представителями других родов (табл. 38).
Таблица 38. Микроорганизмы, наиболее часто обнаруживаемые в дезинфектантах
Биоцид |
Роды загрязняющих микроорганизмов |
Хлоргексидин |
Pseudomonas, Serratia, Enterobacter, Klebsiella, Escherichia, Chromobacter, Candida, Aspergillus |
Фенол и его препараты |
Pseudomonas |
Хлорамин |
Bacillus, Pseudomonas, Staphylococcus, Enterobacteriaceae |
Водорода пероксид |
Staphylococcus, Escherichia, Klebsiella |
Формальдегид |
Pseudomonas |
18.3 Проницаемость клеточных оболочек и резистентность
Проницаемость клеточной стенки грамотрицательных бактерий во многом определяется наличием внешней мембраны, защищающей клетку от проникновения химических веществ. Однако ПАВ, особенно ЧАС, разрушают липополисахаридный слой внешней мембраны и проникают внутрь клетки. Под электронным микроскопом видно, как на поверхности клеток, обработанных ЧАС, появляются вздутия, которые увеличиваются в размере и отделяются от клетки в виде пузырьков, состоящих из липополисахаридов, белков и фосфолипидов. Частичная компенсация повреждения внешней мембраны возможна за счет фосфолипидов, которые образуют бислой. Но если повреждение слишком велико, клетка утрачивает внешний барьер проницаемости, биоцид проникает внутрь, вызывая необратимые изменения структур и метаболитов.
Изменения в структуре внешней мембраны могут влиять на ее проницаемость и устойчивость клетки к биоцидам. Примером может служить Pseudomonas aeruginosa, которая по своей устойчивости превосходит другие грамотрицательные бактерии. Возможной причиной этого может быть повышенное содержание фосфатных групп в липиде А, характерное для этого микроорганизма.
Важной особенностью грамотрицательных бактерий, определяющей их устойчивость к биоцидам, является способность к адгезии на поверхностях с образованием биопленок, представляющих организованное сообщество клеток, объединенных массой экзополисахарида (гликокаликс). Верхние слои гликокаликса защищают внутреннюю часть от проникновения биоцида. Клетки, обитающие внутри биопленки, ограничены в доступе питательных веществ и растут медленно. Эти факторы способствуют повышению их резистентности к неблагоприятным условиям среды.
Грамположительные бактерии, как правило, более чувствительны к биоцидам, хотя и в этой группе появляются резистентные штаммы. Например, устойчивость Staphylococcusaureus к фенолам и ЧАС зависит от присутствия на поверхности клеток липидов, которые защищают микроорганизм от проникновения биоцидов.
Споры выдерживают концентрации биоцидов, в несколько тысяч раз превышающие концентрации эффективные в отношении вегетативных клеток. Соединения ртути, ЧАС, хлоргексидин, фенолы и спирты практически не обладают спороцидной активностью, хотя могут задерживать прорастание спор. Этилена оксид, β-пропиолактон, формальдегид, глутаровый альдегид, водорода пероксид и галогены убивают споры, однако их действие достаточно медленное, процесс стерилизации должен продолжаться от 30 мин до нескольких часов. Резистентность спор обеспечивает их уникальная клеточная оболочка, которая препятствует проникновению биоцидов внутрь клетки и, возможно, нейтрализует действие некоторых из них. Споры разных микроорганизмов различаются по своей чувствительности к стерилизующим агентам. Помимо генотипической вариабельности существует и фенотипическая зависимость резистентности спор от условий выращивания микроорганизма.
Микобактерии высокорезистентны к действию дезинфектантов (наиболее эффективны фенолы); при возможности для их уничтожения следует применять тепловую обработку. Защитными свойствами обладает клеточная стенка микобактерий, содержащая большое количество воскоподобных липидов, образующих гидрофобные слои. Существенную роль в составе липидов играют миколовые кислоты. Клеточная стенка обеспечивает кислотоустойчивость этих микроорганизмов, которая служит основой их дифференциального окрашивания путем обработки карболовым фуксином при нагревании. При комнатной температуре процесс требует 18-часовой экспозиции. Окрашенные клетки устойчивы к обесцвечиванию спиртом и разбавленными кислотами, с чем и связано происхождение термина «кислотоустойчивость».
Приобретенная резистентность появляется в результате изменений в генетическом аппарате бактерий, в результате отбора устойчивых мутантов в среде, содержащей биоциды. Большое значение в распространении генов резистентности имеет их горизонтальный транспорт между различными видами и родами бактерий с помощью трансмиссивных плазмид и конъюгативных транспозонов. Плазмиды могут определять множественную резистентность к биоцидам. У Staphylococcus aureus, Escherichia coli и Pseudomonas aeruginosa описаны плазмиды, обеспечивающие устойчивость к соединениям ртути. Плазмиды узкого спектра контролируют образование редуктазы, переводящей Hg++в металлическую ртуть. Плазмиды широкого спектра помимо редуктазы кодируют одну или несколько гидролаз, которые освобождают Hg++из ртутьорганических соединений, разрывая связь ртуть — углерод. Образующаяся металлическая ртуть испаряется из среды. Существование таких процессов трансформации ртутьорганических соединений делает проблематичным их использование в качестве консервантов в фармацевтике.
Широкий круг хозяев у генов резистентности способствует их сохранению в природе, причем такие гены могут стабильно существовать даже в отсутствие селективного давления, т. е. в среде, не содержащей биоцидов. Селективные условия создаются в растворах дезинфектантов с концентрацией, ниже рекомендуемой, и при нарушении сроков их хранения. Например, в растворах хлорсодержащих веществ часто обнаруживается снижение содержания активного хлора.
Помимо концентрации биоцида для развития резистентности популяции имеет значение состав среды (наличие защитных агентов, факторов роста), фаза развития и скорость размножения клеток. Например, Pseudomonas aeruginosa, выращенная на среде с недостаточным количеством магния, высокоустойчива к бензалкониума хлориду, тогда как выращенная на среде с недостатком углерода — высокочувствительна. Большое значение имеет температура и время культивирования. Медленнорастущие клетки менее чувствительны к биоцидам, чем быстрорастущие. Поэтому необходимо строго соблюдать стандартные условия испытания активности антимикробных агентов.
Возможность быстрого развития резистентности в популяции следует учитывать на практике при применении биоцидов для дезинфекции. При продолжительном использовании какого-либо антимикробного агента микробиота, обитающая в данном объекте (госпиталь, аптека, цех, лаборатория, находящиеся там предметы, стены и пол помещений и т. д.), может приобрести высокую устойчивость к этому препарату. Для эффективного проведения всех мероприятий, обеспечивающих асептичные условия работы, осуществляют ротацию биоцидов, т. е. используют несколько химических веществ, применяя их в определенном порядке.