Молекулярная биология. Практическое руководство - Великов В.А. 2013
Приложение
Приложение 1. Характеристика плазмид и бактериофагов, приведенных в руководстве
|
Наименование |
Маркер |
Размер |
Число копий на клетку E.coli |
Характеристика |
|
pBR322 |
Apr Tcr |
4,4 kb |
≈ 20 |
Рекомбинантная плазмида. Один из первых векторов молекулярного клонирования |
|
pBluescript II |
Apr |
2,96 kb |
до 300 |
Вектор для клонирования и секвенирования. Фагмида. Имеет ori фага M13 и ген lacZ |
|
M13 |
6,4 kb |
≈ 100 |
Нитевидный фаг дикого типа с одноцепочечной ДНК. Умеренный. Заражает только F+ клетки E.coli |
|
|
M13 K07 |
Kmr |
6,5 kb |
≈ 100 |
Рекомбинантный фаг-помощник. Имеет ген канамицин-устойчивости. Дефектен по упаковке в вирионы |
|
M13 mp18 |
- |
7,25 kb |
≈ 100 |
Фаговый вектор для клонирования и секвенирования. Имеет MCS. |
|
λ (Lambda) |
48,5 kb |
≈ 100 |
Лизирующий фаг с двухцепочечной ДНК, упакованной в белковый капсид икосаэдрической формы. Дикий тип. Способен переходить в лизогенное состояние |
|
|
pSUP106 |
Cmr Tcr |
9,6 kb |
до 40 |
Вектор широкого круга хозяев. Плазмида. Поддерживается в клетках многих грам-отрицательных бактерий |
|
pSUP106::sacB |
Cmr Kmr |
14,4 kb |
до 40 |
Содержит встроенную по BamH1- сайту 3,8 kb кассету (конструкт) с геном левансахаразы sacB из бактерии Bacillus subtilis |
|
pHEN1 |
Apr |
4,5 kb |
≈ 100 |
Вектор для фагового дисплея антител. Фагмида. Способен упаковываться в вирионы в присутствии в клетках фага-помощника M13 K07 |
|
pHEN1:: scFv |
Apr |
5,4 kb |
≈ 100 |
Содержит клонированный ген scFv, кодирующий синтез одноцепочечных рекомбинантных миниантител определенной специфичности |
|
pET30 |
Kmr |
5,4 kb |
≈ 100 |
Плазмида-вектор для экспрессии белков. Имеет промотор РНК- полимеразы фага Т7 |
Примечание. Apr - устойчивость к ампициллину, Kmr - устойчивость к канамицину, Cmr - устойчивость к хлорамфениколу, Tcr - устойчивость к тетрациклину
Приложение 2. Характеристика штаммов бактерий, приведенных в руководстве
|
Штамм |
Генотип |
Характеристика |
|
Escherichia coli XL1-Blue |
recA1 endA1 gyrA96 thi-1 hsdR17 hsdR17 supE44 relA1 lac [F' proAB lacEZ∆M 15 Tn10(TetR)] |
Широко используемый штамм-хозяин для различных векторов |
|
E.coli TG1 |
supE thi-1 A(lac-roAB) ∆(mcrB-hsdSM)5(rK- mK-) [F' traD36 proAB lacIqZA M15] |
Штамм-хозяин для нитевидных фагов, удобен для нарабоки фаговых (и фагмидных) частиц |
|
E.coli JS5 |
ara D139 A(ara leu) 7967 ∆ (lac) x74 galU galK hsdR12 (rk- mk-) mcrA mcr BC rpsL (StrR) thi rec A1 [F::Tn10 (TetR)proAB lac Iq LacZ ∆М15] |
Штамм-хозяин для нитевидных фагов и фагмид, удобен для наработки «растворимых» одноцепочечных рекомбинантных миниантител scFv |
|
E.coli BL21(DE3) |
F- dcm ompT hsdS(rB- mB-) gal λ(DE3) |
Штамм-хозяин для экспрессии рекомбинантных белков с помощью T7 РНК-полимеразы (на векторе необходим Т7 промотор) |
|
E.coli BL21(DE3) |
F- ompThsdS(rB- mB-) |
Содержит плазмиду pLysS с |
|
pLysS |
gal dcm λ(DE3) [pLysS CmR] |
геном синтеза ингибитора T7 РНК-полимеразы, обеспечивающим отсутствие «фоновой» экспрессии, если нет индукции |
|
Erwinia carotovora B15 |
Штамм дикого типа, прототроф, почвенный изолят |
Фитопатогенный микроорганизм (мягкая гниль картофеля) |
|
Azospirillum brasilense Sp245 |
Штамм дикого типа, прототроф, почвенный изолят |
Модельный штамм для изучения ассоциативной азотфиксации |
|
Agrobacterium tumefaciens C58 |
Штамм дикого типа, прототроф, почвенный изолят |
Модельный штамм для изучения механизмов трансгеноза растений |
Приложение 3. Сайты узнавания некоторых рестриктаз
|
Фермент |
Сайт узнавания и точка разрезания (указана стрелкой) |
Количество сайтов в ДНК |
||
|
pBR322 |
M13 mp18 |
Lambda |
||
|
BamHI |
G↓GATCC |
1 |
1 |
5 |
|
BgIII |
A↓GATCT |
- |
1 |
6 |
|
SauIIIA |
↓GATC |
22 |
7 |
16 |
|
EcoRI |
G↓AATTC |
1 |
1 |
5 |
|
EcoRII |
↓CC(A/T)GG |
6 |
7 |
71 |
|
EcoRV |
GAT↓ATC |
1 |
- |
21 |
|
HindIII |
A↓AGCTT |
1 |
1 |
7 |
|
KpnI |
G↓GTACC |
- |
1 |
2 |
|
NotI |
GC↓GGCCGC |
- |
- |
- |
|
PstI |
CTGCA↓G |
1 |
1 |
28 |
|
SmaI |
CCC↓GGG |
- |
1 |
3 |
|
XhoI |
C↓TCGAG |
- |
- |
1 |
Приложение 4. Рестрикционная карта плазмиды pBR322
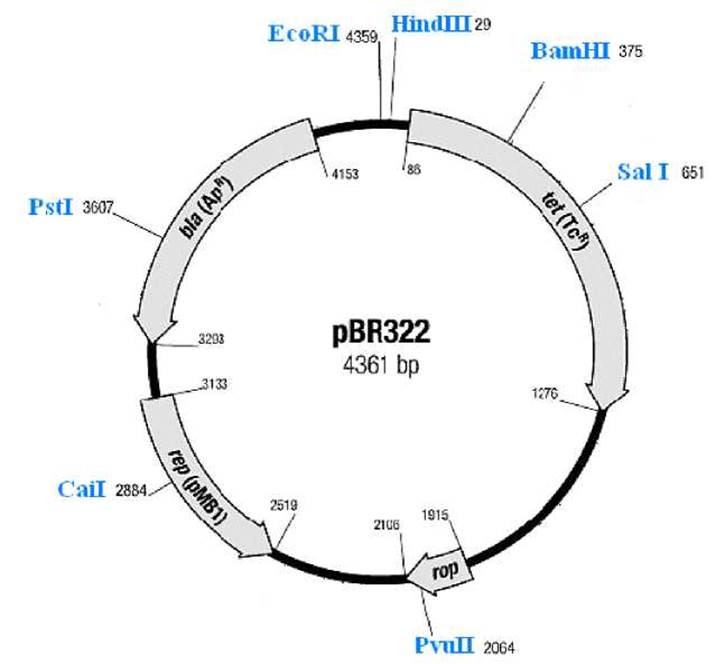
Обозначения:
|
rep (pMB1) |
- ori репликации плазмиды pMB1 (ориджин, точка начала репликации, репликон), |
|
bla (Apr) |
- ген устойчивости (резистентности) к ампициллину (ß-лактамаза), |
|
tet (Tcr) |
- ген устойчивости к тетрациклину, |
|
rop |
- область контроля копийности. |
Цифры возле обозначения сайтов узнавания рестриктаз соответствуют номеру первого нуклеотида в сайте. Отсчёт ведётся от первого нуклеотида Т в сайте узнавания рестриктазы EcoRI. Показаны только уникальные сайты, причём для небольшого числа из множества рестриктаз, способных гидролизовать ДНК плазмиды pBR322 (≈ 50).
Ген устойчивости к ампициллину (полусинтетический антибиотик из группы пенициллинов, лактамное кольцо которого способна разрушать ß-лактамаза) инактивируется при клонировании ДНК по сайту рестриктазы Pstl. Ген устойчивости к антибиотику тетрациклину, кодирующий защитный белок - по сайту рестриктазы BamHI. Инсерционная инактивация этих генов при вставке «чужеродной ДНК» позволяет выявлять рекомбинантные плазмиды, поскольку у трансформированной такой плазмидой клетки исчезает устойчивость к тому или другому антибиотику, в то время как ко второму антибиотику сохраняется.
Приложение 5. Рестрикционная карта фагмиды pBluescript® II (Stratagene)
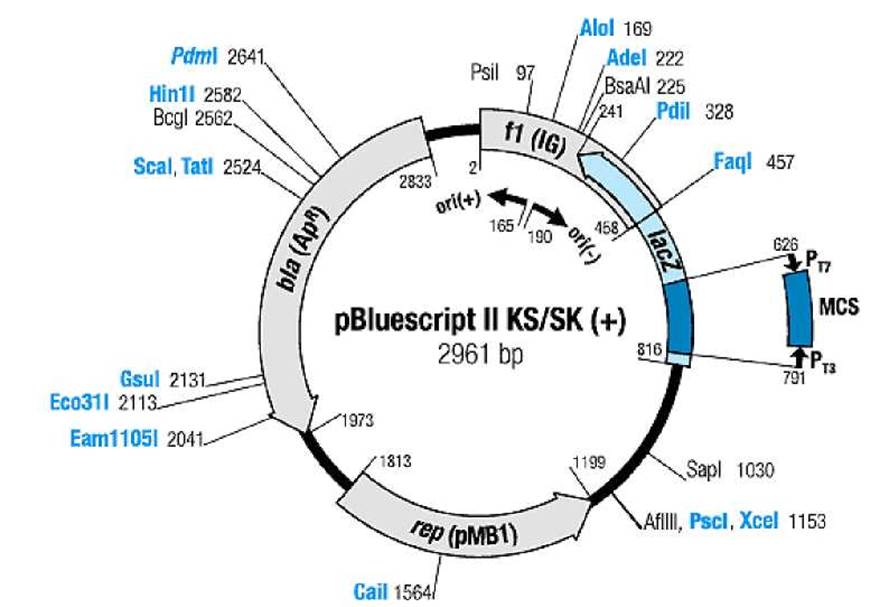
Обозначения:
|
rep (pMB1) |
-ori репликации плазмиды pMB1 (репликон ColEl-типа), |
|
bla (Ap) |
- ген устойчивости к ампициллину (ß-лактамаза), |
|
f1 (IG) |
- ori репликации фага М13, |
|
LacZ |
- ген ß-галактозидазы, N-концевая часть, |
|
PT3 |
- промотор фага Т3, |
|
PT7 |
- промотор фага Т7, |
|
MCS |
- полилинкер, мультиклональный сайт (Multiple Cloning Site). |
Порядок расположения сайтов рестрикции в полилинкере MCS, начиная от промотора Рт7 (ориентация полилинкера): pBluescript II SK(+)
KpnI, XhoI, SalI, HindIII, EcoRI, PstI, SmaI, BamHI, XbaI, NotI, SacI; pBluescript II KS(+)
SacI, NotI, XbaI, BamHI, SmaI, PstI, EcoRI, HindIII, SaII, XhoI, KpnI.
Универсальные праймеры для секвенирования:
M13/pUC sequencing primer (- 20)
5’-GTAAAACGACGGCCAGT-3’ (перед промотором PT7);
M13/pUC reverse sequencing primer (- 26)
5’-CAGGAAACAGCTATGAC-3’ (перед промотором PT3).
Примечание. Как +-цепь, так, в принципе, и - -цепь ДНК фагмиды pBluescript® II может быть «упакована» в белковый капсид с получением вириона (фаговой частицы) после инфицирования клетки E.coli с этой фагмидой особым фагом-помощником. Одноцепочечная ДНК из вирионов удобна для секвенирования. Можно также секвенировать двухцепочечную ДНК фагмиды со вставкой «чужеродной ДНК» (или трансгена) по обеим цепям, для точности. При этом используют по отдельности тот или другой универсальный праймер.
Приложение 6. Схема устройства и использования лактозного оперона E.coli
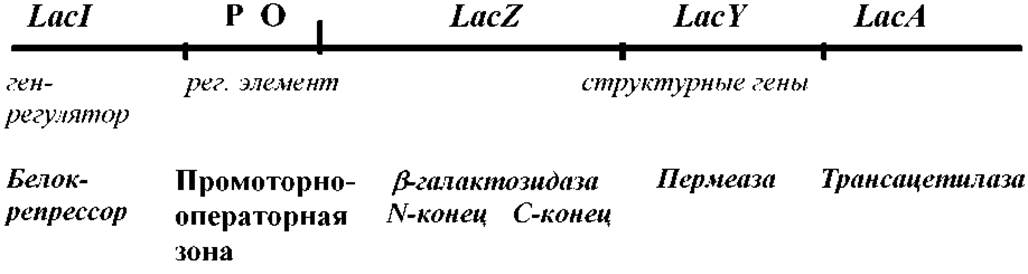
Индукция гена ß-галактозидазы. Фермент ß-галактозидаза расщепляет дисахарид лактозу на галактозу и глюкозу. Индуктор лактозного оперона - лактоза. Она связывается с репрессором и способствует его диссоциации с промоторно-операторной зоны, обеспечивая прохождение транскрипции. Негидролизуемый аналог лактозы ИПТГ - изопропил-Р-О-тиогалактозид - также может выступать индуктором.
Сине-белая селекция при клонировании, ß-галактозидаза способна расщеплять субстрат X-gal (5-бром-4-хлор-3-индолил-β-0-галактозид) на галактозу и индольное соединение голубой окраски. Колонии бактерий на питательном агаре с X-gal и ИПТГ (по 40 мкг/мл) имеют голубую окраску. При клонировании под промотор гена lacZ происходит инактивация гена, что приводит к появлению обычных («белых») колоний. При трансформации E.coli продуктами лигазной реакции получение клеткой плазмиды со вставкой «чужеродной ДНК» приведёт к появлению обычной, а не голубой колонии.
Явление а - комплементации. Синтез активного фермента в бактериальных клетках будет происходить, если его N-концевая часть кодируется плазмидой (например pBluescriptl II или др.), а С-концевая часть - встроенным в хромосому E.coli F-фактором. В этом случае штамм-хозяин должен иметь мутацию lacIq LacZ ∆M15 (конститутивный синтез репрессора Iq и N-концевая делеция гена ß-галактозидазы). Это позволяет располагать на векторе не весь ген lacZ, а только его часть.
Приложение 7. Некоторые соотношения между количеством, размером и оптической плотностью для нуклеиновых кислот
|
1 ОЕ260 |
ДНК двухцепоч. |
50 мкг |
|
1 ОЕ260 |
ДНК одноцепоч. |
37 мкг |
|
1 ОЕ260 |
РНК одноцепоч. |
40 мкг |
|
1 мкг |
ДНК двухцепоч. |
3,08 мкМ фосфата |
|
1 мкг |
ДНК двухцепоч. (размером 1 kb) |
3,08 нМ 5'-концов |
|
1 мкг |
ДНК двухцепоч. (размером 1 kb) |
9,3x10і1 молекул |
|
1 пМ |
ДНК плазмиды pBR322 |
2,83 мкг |
|
1 пМ |
ДНК двухцепоч. (размером 1 kb) |
650 нг |
|
1 kb |
ДНК двухцепоч. |
650 kDa |
|
1 kb |
ДНК одноцепоч. |
330 kDa |
|
1 kb |
РНК одноцепоч. |
340 kDa |
Приложение 8. Стандартные обозначения полиморфных позиций нуклеотидов
|
Символ |
Полиморфная позиция |
Пояснение |
|
R |
A или G |
puRine |
|
Y |
C или T |
pYrimidine |
|
M |
A или C |
aMino |
|
K |
G или T |
Keto |
|
S |
C или G |
сильное /Strong/ взаимодействие - три |
|
W |
A или T |
слабое /Weak/ взаимодействие - две |
|
H |
(A, C, T) но не G |
H следует за G в алфавите |
|
B |
(C, G, T) но не A |
B следует за A в алфавите |
|
V |
(A, C, G) но не T(U) |
V следует за T(U) в алфавите |
|
D |
(A, G, T) но не C |
D следует за C в алфавите |
|
N |
(A, G, C, T) |
любое основание / Nucleotide |
Приложение 9. Однобуквенные обозначения аминокислот
|
Аланин |
A |
Лейцин |
L |
|
Аргинин |
R |
Лизин |
K |
|
Аспарагин |
D |
Метионин |
M |
|
Аспарагиновая кислота |
N |
Пролин |
P |
|
Валин |
V |
Серин |
S |
|
Глутамин |
Q |
Треонин |
T |
|
Глутаминовая кислота |
E |
Триптофан |
W |
|
Глицин |
G |
Тирозин |
Y |
|
Гистидин |
H |
Фенилаланин |
F |
|
Изолейцин |
I |
Цистеин |
C |
Приложение 10. Генетический код
|
Первое основание кодона |
Второе основание кодона |
Третье основание кодона |
|||
|
U |
C |
A |
G |
||
|
F (Phe) |
S (Ser) |
Y (Tyr) |
C (Cys) |
U |
|
|
U |
F (Phe) |
S (Ser) |
Y (Tyr) |
C (Cys) |
C |
|
L (Leu) |
S (Ser) |
STOP |
STOP |
A |
|
|
L (Leu) |
S (Ser) |
STOP |
W (Trp) |
G |
|
|
L (Leu) |
P (Pro) |
H (His) |
R (Arg) |
U |
|
|
C |
L (Leu) |
P (Pro) |
H (His) |
R (Arg) |
C |
|
L (Leu) |
P (Pro) |
Q (Gln) |
R (Arg) |
A |
|
|
L (Leu) |
P (Pro) |
Q (Gln) |
R (Arg) |
G |
|
|
I (Ile) |
T (Thr) |
N (Asn) |
S (Ser) |
U |
|
|
A |
I (Ile) |
T (Thr) |
N (Asn) |
S (Ser) |
C |
|
I (Ile) |
T (Thr) |
K (Lys) |
R (Arg) |
A |
|
|
M (Met) |
T (Thr) |
K (Lys) |
R ( Arg) |
G |
|
|
V (Val) |
A (Ala) |
D (Asp) |
G (Gly) |
U |
|
|
G |
V (Val) |
A (Ala) |
D (Asp) |
G (Gly) |
C |
|
V (Val) |
A (Ala) |
E (Glu) |
G (Gly) |
A |
|
|
V ( Val) |
A (Ala) |
E (Glu) |
G (Gly) |
G |
|
Приложение 11. Электрофореграмма продуктов ПЦР-амплификации гена НАДН-дегидрогеназы гадюки Никольского и гена 12S рибосомной гРНК
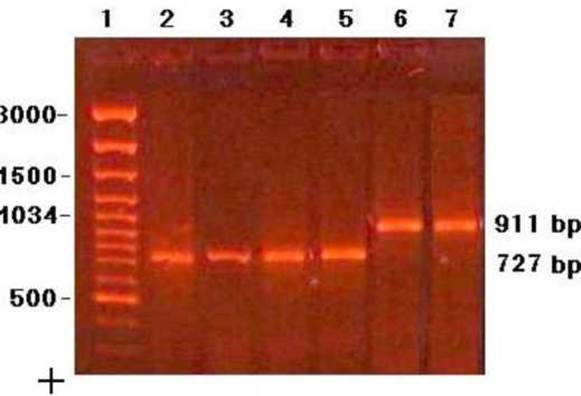
Обозначения дорожек:
1. - маркер молекулярного веса 100bp DNA Ladder Plus (Fermentas). Размеры фрагментов ДНК, начиная сверху: 3000, 2000, 1500, 1200, 1034, 900, 800, 700, 600, 500 п.н.;
2-5. - ПЦР-продукт гена 12S рРНК размером 727 п.н.;.
6-7. - ПЦР-продукт гена НАДН-дегидрогеназы размером 911 п.н.
Приложение 12. Движение различных форм плазмидной ДНК при гель-электрофорезе
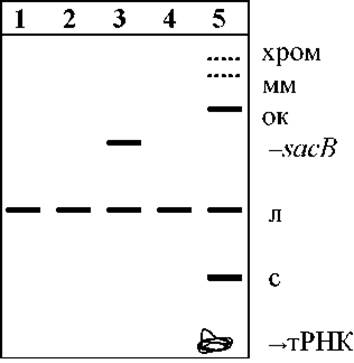
Обозначения дорожек:
1. - плазмидная ДНК pBluescript II, рестрицированная ферментом Eco31I;
2. - рестрицированная BamHI;
3. - с кассетой nptI-sacB-sacR, рестрицированная BamHI;
4. - рестрицированная PstI;
5. - нативный препарат плазмидной ДНК pBluescript II.
Формы плазмиды:
л - линейная (с разрывом в обеих цепях ДНК); с - суперспиральная кольцевая; ок - открытая кольцевая (с разрывом в одной цепи ДНК); мм - димерная и мультимерные; хром - остатки хромосомной ДНК; sacB - кассета nptI-sacB-sacR.
Приложение 13. Электрофореграмма продуктов рестрикции ДНК фага лямбда и геномной ДНК E.coli
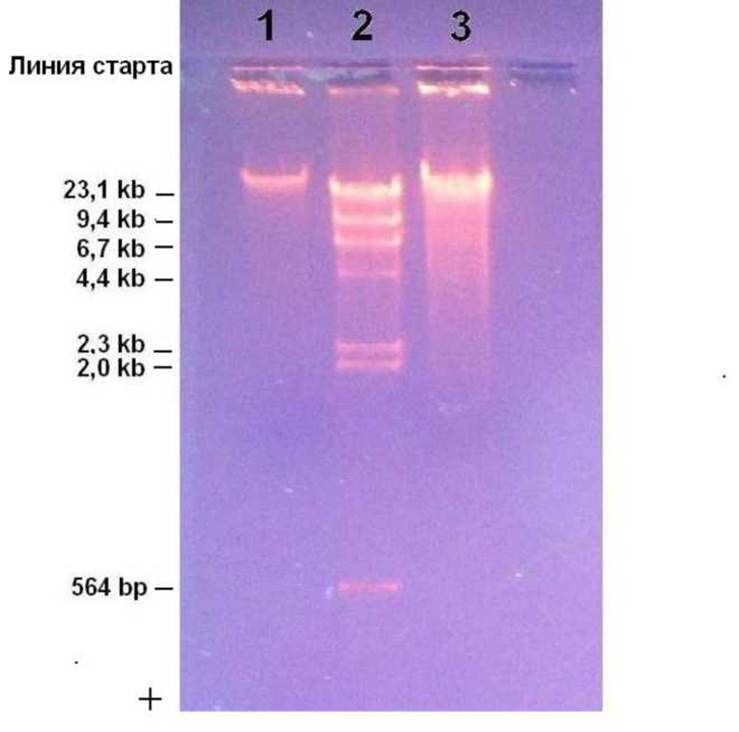
Обозначения дорожек:
1. - нативная ДНК фага X размером 48502 п.н.;
2. - ДНК фага X, гидролизованная рестриктазой Hindill;
3. - тотальная ДНК E.coli, гидролизованная рестриктазой Hindill (неполный гидролиз)
Примечание. При гель-электрофорезе сравнивают электрофоретическую подвижность фрагментов ДНК или нативных молекул ДНК, находящихся в одной конформации: линейную форму сравнивают с линейной, суперспиральную - с суперспиральной, одноцепочечную - с одноцепочечной и т.д. Здесь нативная ДНК фага лямбда тоже линейная, хотя его репликативная форма в клетках E.coli замкнута в кольцо благодаря cos-сайтам.
Наиболее крупные фрагменты ДНК размером 23,1kb и 48,5kb эффективно не разделяются, поскольку использован 1,5% агарозный гель (см. тему 3). Низкомолекулярные фрагменты окрашиваются слабее, так как связывают меньше бромистого этидия EtBr, уходящего из ДНК при форезе к катоду. Здесь фрагмент размером 564 н.п. дорисован, поскольку был малозаметен, хотя молярные концентрации всех рестрикционных фрагментов одинаковы. При повышении общей концентрации ДНК верхние фрагменты постепенно сольются в одно яркое пятно.
Приложение 14. Схема клонирования ДНК
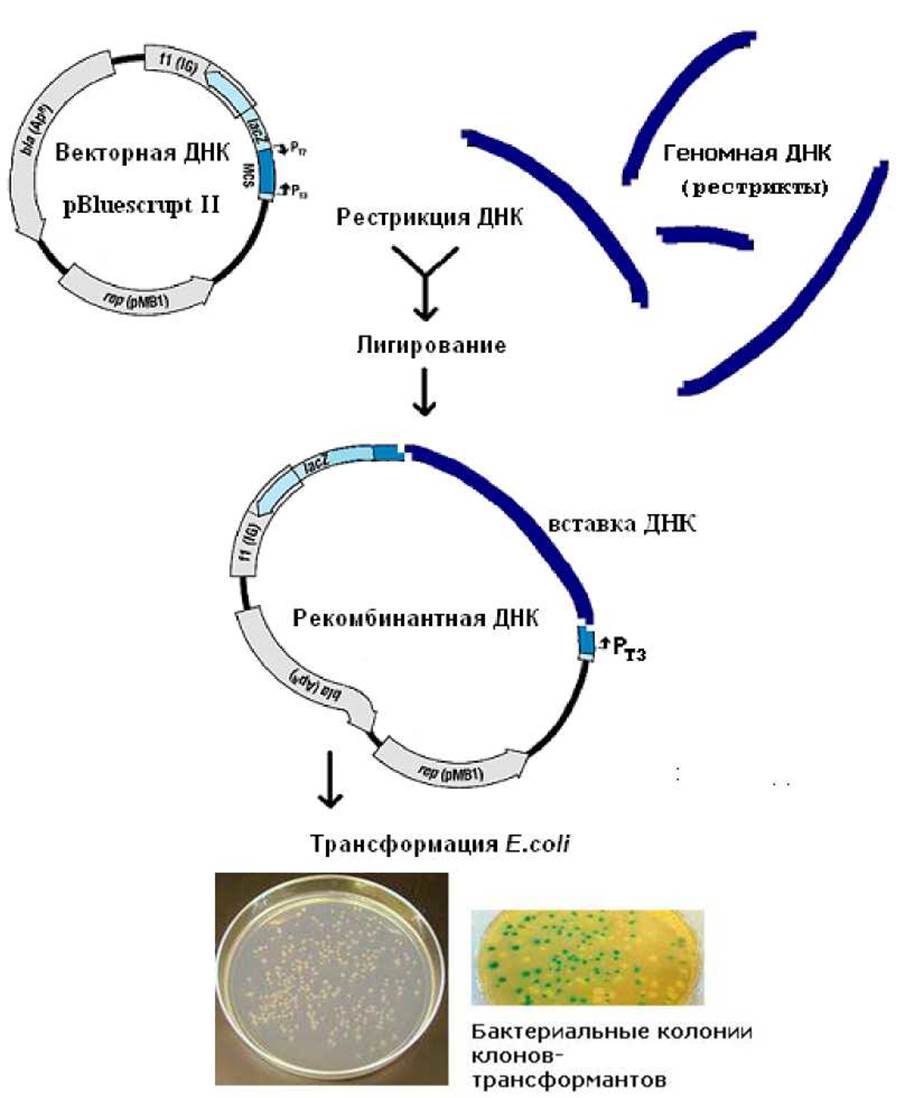
Примечание. В приведённой схеме кроме скрининга плазмид по размеру возможна «сине-белая селекция» рекомбинантной ДНК. При клонировании под промотор фага ТЗ (Ртз) нарушается целостность гена LacZ и фермент ß-галактозидаза в клетках не синтезируется. После высева клеток бактериальной культуры, трансформированной продуктами лигазной реакции на питательный агар с ампициллином, хромогенным субстратом X-gal и индуктором ИПТГ вырастают бактериальные колонии двух типов. Колонии с голубой окраской будут содержать «пустой» вектор, а обычные «белые» колонии - рекомбинантную ДНК. В каждой колонии ~ 104-105 клеток.
Гибридные молекулы ДНК называют рекомбинантными молекулами, потому что объединение клонируемой и векторной ДНК является не чем иным, как рекомбинацией in vitro.
Приложение 15. Общая схема ПЦР
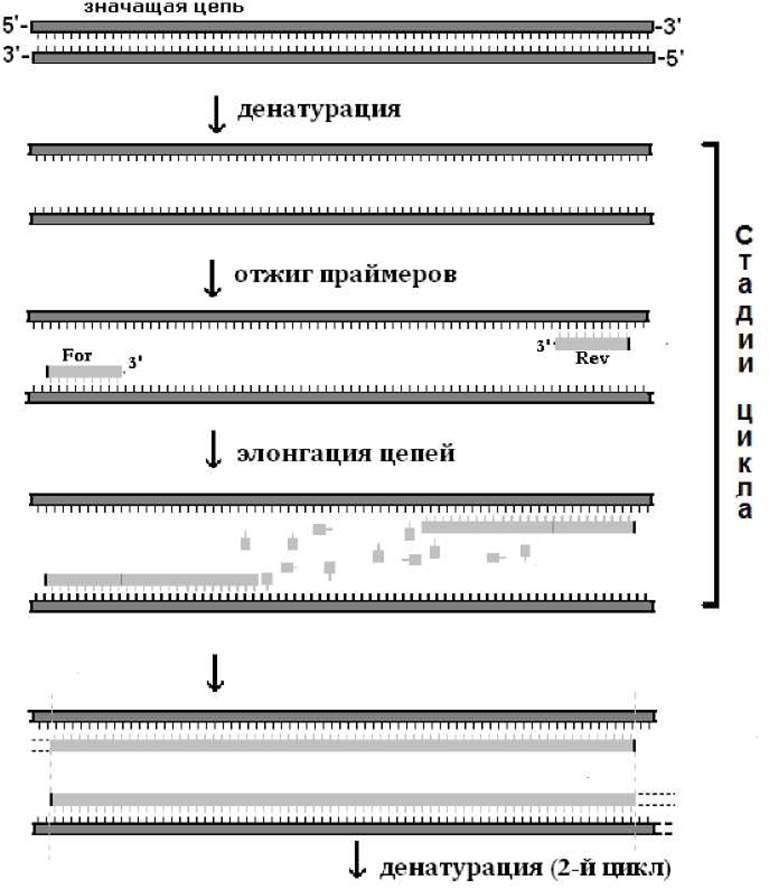
Примечание. Приведён только первый цикл ПЦР. Первая одноцепочечная молекула ДНК строго определённого размера, от 5’-концевого нуклеотида одного праймера до нуклеотида, комплементарного 5’-концевому нуклеотиду другого праймера, появляется только после второго цикла. Первая двухцепочечная молекула ДНК такого размера - после третьего цикла. Затем ПЦР-продукт, или ампликон, с определённым числом пар нуклеотидов начинает накапливаться в последующих циклах. Ампликон имеет фиксированный размер, поскольку матрица теперь ограничена, её дальнейшее сканирование ДНК-полимеразой невозможно и матричный синтез биополимера обрывается.
В результате этой ферментативной реакции из единичных молекул ДНК-мишени синтезируется de novo в микрограммовых количествах и в миллионах копий определённая ДНК, или амплификат. Другими словами, происходит селективная амплификация ДНК in vitro (англ. amplify - увеличивать, расширять). In vivo миллион копий ДНК получается за миллион митозов.
Теоретический предел обнаружения ДНК с помощью метода ПЦР (одна молекула) и практический минимум фактически совпадают, либо находятся близко один от другого. Для сравнения: иммуноферментный анализ на присутствие патогенного микроба требует биоматериала, по меньшей мере, из сотни клеток.
Приложение 16. Сравнение аминокислотных последовательностей НАДН-дегидрогеназы гадюки Никольского и гадюки обыкновенной

Примечание. Приведены результаты попарного выравнивания (alignment) аминокислотных последовательностей НАДН-дегидрогеназы двух видов гадюк. Верхняя строка Vipera nikolskii, нижняя строка Vipera berus. Программа FASTA3x.
Выявляется 6 различий среди 256 сравниваемых аминокислотных остатков (76% от полной аминокислотной последовательности белка). Так, в позиции № 62/85 у гадюки Никольского стоит серин (S), в то время как у обыкновенной гадюки - аспарагин (N, различие Ser:Asn). Другие различия — Ala:Thr (поз. 120), Ser:Asn (поз. 123), Tyr:Thr (поз. 179), Ile:Leu (поз. 196), Ile:Thr (поз. 222).
Результаты сравнения опровергают мнение некоторых учёных о том, что гадюка Никольского является всего лишь чёрной формой гадюки обыкновенной. Это утверждение вступает в противоречие с данными молекулярного анализа важнейших биополимеров клетки: накопившиеся различия в митохондриальном белке у этих гадюк - результат их обособленной эволюции.
Приложение 17. Некоторые соотношения между размером, количеством, оптической плотностью и молярной концентрацией для белков
Конверсия: масса/моли
|
Молекулярный вес белка Mw (kDa) |
1 мкг данного белка - |
1 нМ данного белка - |
|
10 |
100 пМ, 6 х10 13 молекул |
10 мкг |
|
50 |
20 пМ, 1,2х10 13 молекул |
50 мкг |
|
100 |
10 пМ, 6 х10 12 молекул |
100 мкг |
|
150 |
6,7 пМ, 4 х10 12 молекул |
150 мкг |
Конверсия: ДНК/белок
|
Размер ДНК |
Молекулярный вес белка Mw (kDa) |
Количество аминокислотных остатков |
|
270 bp |
10 kDa |
90 |
|
0,9 kb |
33,3 kDa |
300 |
|
1 kb |
37 kDa |
333 |
|
1,35 kb |
50 kDa |
450 |
А280 некоторых белков с концентрацией 1 мг/мл
|
Белок |
Концентрация |
A280 |
|
IgG |
1 мг/мл |
1,35 |
|
IgM |
1 мг/мл |
1,20 |
|
IgA |
1 мг/мл |
1,30 |
|
Белок А |
1 мг/мл |
0,17 |
|
Авидин |
1 мг/мл |
1,50 |
|
Стрептавидин |
1 мг/мл |
3,40 |
|
БСА |
1 мг/мл |
0,70 |