МИКРОБИОЛОГИЯ БИОЛОГИЯ ПРОКАРИОТОВ ТОМ II - А. В. ПИНЕВИЧ - 2007
ГЛАВА 11. ХЕМОТРОФИЯ
Если без предубеждения смотреть на малое распространение химических познаний между классом образованным, на слабые по сей части успехи нашего юношества, жаждущего приобретать познания, то сие должно отнести исключительно к совершенному недостатку в способах изучения сей науки.
Г. Гесс. Основания чистой химии (Санкт-Петербург, 1831)
В большинстве случаев при хемотрофии ассимилируется энергия, освобождающаяся в ходе окислительно-восстановительных превращений органических или неорганических субстратов. Исключением служат «не-редокс» механизмы, когда Рmf или Smf создаются в результате реакций декарбоксилирования (см. разделы 10.4.9 и 10.4.10).
Поскольку при хемотрофии электроны переносятся от терминального донора к терминальному акцептору, метаболический потенциал хемотрофа, выбор им той или иной ниши для обитания и его конкурентоспособность в конечном счете зависят от термодинамических и физико-химических характеристик этой окислительно-восстановительной пары.
11.1. Терминальные доноры электронов
Терминальный донор электронов (неорганический или органический, в своем первоначальном виде или после подготовительных превращений) служит субстратом для специфических дегидрогеназ.
Хемолитотрофия. Напомним, что использование неорганических веществ в качестве источника энергии называется хемолитотрофией. Она представляет собой продуктивный процесс, в глобальном масштабе эквивалентный фототрофии. Эти ассимиляционные механизмы связывают энергетику абиотических систем с биоэнергетикой — подобно тому, как углеродная автотрофия и диазотрофия служат мостом между неорганической и органической материей.
Хемолитотрофия и фототрофия создают фундамент пищевой пирамиды, и поток свободной энергии, которую используют живые системы (индивидуальная клетка, локальная микробиота и глобальный экоценоз), зарождается в популяциях хемолитотрофов и фототрофов.
При хемолитотрофии используется узкий, но гетерогенный круг субстратов, которые обычно не требуют предварительных превращений.
Хемоорганотрофия. Если источником энергии служит органическое вещество, то такой вариант хемотрофии называется хемоорганотрофией. В глобальном масштабе хемоорганотрофия представляет собой консументный процесс, при котором используются и неогенные, и ископаемые продукты фототрофной или хемолито- трофной ассимиляции неорганического углерода.
Важнейшим источником энергии при бактериальной, археотной и эукариотной хемоорганотрофии являются полисахариды — прежде всего, целлюлоза и крахмал. Хемоорганотрофные бактерии и археи предварительно расщепляют их на фрагменты с помощью внеклеточных полигликозидгидролазных комплексов. Напомним, что для гидролиза целлюлозы у бактерий имеется специальный экзоплазматический компартмент — целлюлосома (см. I том учебника).
Образовавшиеся моносахариды и олигосахариды доставляются в цитоплазматический компартмент АВС-транспортерами, Рmf-зависимыми пермеазами или фосфотрансферазной системой. Олигосахариды гидролизуются до гексоз (галактозы, глюкозы, маннозы, фруктозы и др.) или пентоз (арабинозы, ксилозы, рибозы и др.). Эти моносахариды окисляются через генеральные катаболические пути, которые будут рассмотрены в последующих разделах.
Сахара и спирты также могут частично окисляться в периплазматическом ком- партменте или в цитоплазме. Для этого используются мембранные или растворимые дегидрогеназы, которые непосредственно взаимодействуют с дыхательной цепью. Указанное свойство ярко выражено у бактерий рода Gluconobacter, которые окисляют глицерин, глюкозу, маннит, сорбит, фруктозу, этанол и т. д. до соответствующих кислот, альдегидов и кетонов.
11.2. Терминальные акцепторы электронов
Эффективность хемотрофии во многом зависит от того, каким образом решается проблема терминального акцептора электронов.
Терминальные акцепторы бывают органические и неорганические.
Органические акцепторы могут иметь как экзогенное, так и эндогенное происхождение. Неорганические акцепторы, за исключением протонов, всегда заимствуются из внешней среды.
Экзогенный акцептор. При дыхании ключевая роль принадлежит терминальной редуктазе. От этого фермента зависит «пропускная способность» электрон- транспортной цепи. В конкретных метаболических условиях может использоваться та или иная конститутивная редуктаза или тот или иной представитель из набора адаптивно синтезируемых редуктаз.
Брожение обычно происходит без участия экзогенного акцептора электронов. Однако при некоторых «необычных» брожениях (см. раздел 11.3.4.7) необходимы экзогенные акцепторы, и за них члены микробиоты жестко конкурируют друг с другом.
Эндогенный акцептор. Чаще всего роль эндогенного акцептора выполняет один из продуктов катаболизма экзогенного органического субстрата. Примерами служат классические брожения (см. раздел 11.3), а также дыхание «гетеротрофных», т. е. использующих ацетат метаногенов (см. раздел 11.4.5.5).
Довольно противоречивая ситуация складывается у «автотрофных», т. е. использующих Н2/СО2 метаногенов (см. раздел 11.4.5.5) и автотрофных, т. е. использующих Н2/СО2ацетогенов (см. раздел 11.4.5.6). С одной стороны, они обладают замечательной способностью самостоятельно синтезировать терминальные акцепторы электронов для дыхательной цепи. По этой причине они не сталкиваются с необходимостью конкурировать за экзогенные акцепторы с другими членами микробиоты. С другой стороны, самостоятельно синтезировать эндогенные акцепторы невыгодно, поскольку на это расходуется часть экзогенного энергоносителя (водорода или монооксида углерода).
Кроме того, при использовании эндогенного акцептора электронов во внешнюю среду выделяются конечные продукты — метан и «автотрофный» ацетат. В обоих случаях это расточительный процесс, связанный с потерей неизрасходованной свободной энергии.
11.2.1. Молекулярный кислород и его альтернатива
Из всех терминальных акцепторов электронов молекулярный кислород наиболее «выгоден» в термодинамическом отношении, поскольку аэробная дыхательная цепь ассимилирует максимум свободной энергии окисляемых субстратов. Неудивительно, что в аэробных условиях органические субстраты окисляются преимущественно до СО2 и Н2О.
Альтернативные акцепторы электронов по объему своих природных ресурсов уступают молекулярному кислороду, и поэтому эффективность хемотрофии в микроаэробной или анаэробной среде в значительной степени определяется способностью найти эту альтернативу.
При дефиците кислорода или в анаэробных условиях автономию приобретают бактерии, «сбрасывающие» электроны на интермедиаты брожения. В аналогичном положении находятся прокариоты, которые сами синтезируют акцептор электронов для дыхательной цепи (например, метаногенные археи, у которых эту роль выполняет эндогенный гетеродисульфид).
Однако большинство прокариотов с дыхательным типом метаболизма зависит от присутствия во внешней среде неорганического акцептора электронов.
Значительно реже при дыхании используются экзогенные органические акцепторы (например, фумарат).
11.2.2. Анаэробное деструктивное сообщество
Этот тип микробиоты характерен для богатых органическим веществом ниш, в которых запас кислорода уже израсходован. Подобные условия складываются в затапливаемых почвах, в стратифицированных водоемах ниже зоны хемоклина, в континентальных подземных гидросистемах, а также в морских и пресноводных илистых отложениях. Жизнедеятельность этих экосистем обеспечивается, в первую очередь, поступлением в них извне мортмассы (органического вещества отмерших организмов, преимущественно растений или животных).
Нисходящая ветвь анаэробной пищевой цепи — это сложный многоэтапный процесс, в котором участвуют несколько специализированных групп прокариотов (рис. 85).
Рис. 85. Схема анаэробного деструктивного сообщества.
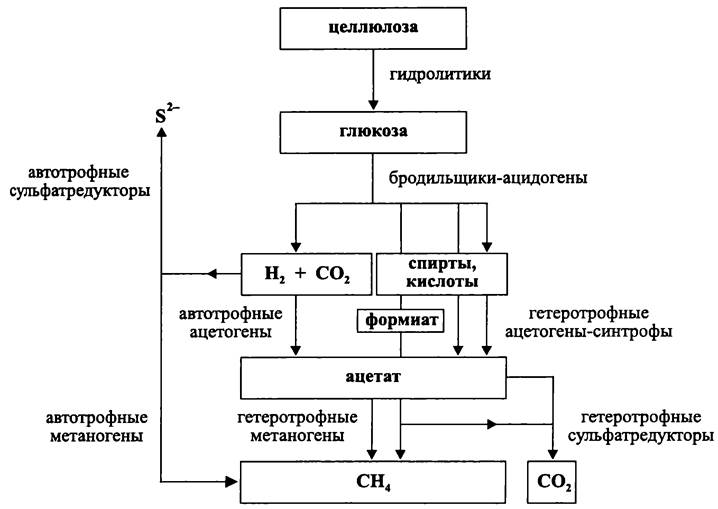
Первичные анаэробы. За первый этап диссимиляции органических субстратов отвечают первичные анаэробы — гидролитики и диссипотрофы
Гидролитики, например, бактерии рода Clostridium, концентрируются вокруг скоплений биополимеров или образуют биопленки на поверхности твердых субстратов. Они кооперативно секретируют комплекс экзоферментов, гидролизующих полигликозиды и полипептиды на олигомеры и мономеры. Полученные низкомолекулярные водорастворимые продукты утилизируются в первую очередь самими гидролитиками.
Диссипотрофы (англ. dissipated — рассредоточенный), например, бактерии рода Syntrophomonas, не секретируют гидролитические ферменты в сколь-нибудь значительном количестве. Они менее кооперированы друг с другом, чем гидролитики, и используют накопленные последними продукты распада биополимеров.
Гидролитики и диссипотрофы связаны между собой сетью трофических взаимодействий. Гидролитики поставляют диссипотрофам питательные субстраты. В свою очередь, диссипотрофы не только снабжают гидролитиков факторами роста, но и снижают до подпорогового уровня концентрацию продуктов гидролитического расщепления биополимеров, что устраняет эффект ретроингибирования гидролаз.
Первичные анаэробы обладают метаболизмом бродильного типа. Как правило, они не зависят от внешних акцепторов электронов.
Основными продуктами ферментации мономеров, в первую очередь простых сахаров, являются летучие карбоновые кислоты (ацетат, бутират, лактат, пропионат, сукцинат, формиат и др.), низкомолекулярные спирты и кетоны (бутанол, метанол, пропанол, этанол, диацетил и др.), а также Н2 и СО2. Первичных анаэробов также называют «ацидогенными» бактериями из-за их способности накапливать кислоты (рис. 85).
В результате экскреции первичными анаэробами конечных продуктов их жизнедеятельности во внешней среде образуется пул субстратов. Последние окисляются вторичными анаэробами, которые отвечают за конечный этап диссимиляции органики.
Вторичные анаэробы. Эти прокариоты обладают метаболизмом дыхательного типа, и их классифицируют в соответствии с тем, какой донор электронов они предпочитают.
Магистральным трофическим маршрутом в анаэробном деструктивном сообществе является «ацетатный» путь (рис. 85), поскольку ацетат, наряду с водородом и формиатом, относится к числу важнейших продуктов ферментации.
Ацетатный путь выбирают гетеротрофные (использующие ацетат) метаногенные археи и гетеротрофные сульфатредуцирующие бактерии. При помощи СО-дегидрогеназы, они расщепляют ацетат на карбонильную и метильную группы (см. раздел 11.4.5.5). Затем метаногены дыхательным путем диспропорционируют эти субстраты в СО2 и СН4, а гетеротрофные сульфатредукторы — полностью окисляют их до СO2.
Второй по значению трофический маршрут в анаэробном деструктивном сообществе — «водородный», поскольку при ферментации постоянно образуется водород.
Водородный путь выбирают «автотрофные», т. е. использующие Н2/СО2 метаногенные археи и автотрофные сульфатредукторы (рис. 85).
Ацетатный и водородный пути не обособлены друг от друга, что связано с жизнедеятельностью автотрофных (использующих Н2/СО2) ацетогенных бактерий, которые передают восстановительные эквиваленты с водородного пути на ацетатный путь согласно уравнению реакции:
2СO2 + 4Н2 —> СН3СООН + 2Н2O.
Кроме участников ацетатного и водородного путей, к вторичным анаэробам относятся еще две группы микроорганизмов.
Во-первых, это бактерии, полностью окисляющие жирные кислоты посредством нитратного или сульфатного дыхания.
Во-вторых, это гетеротрофные ацетогенные бактерии, окисляющие жирные кислоты до ацетата и молекулярного водорода (рис. 85). Последний вариант метаболизма реализуется в синтрофной ассоциации с гидрогенотрофами — сульфатредуцирующими и нитратредуцирующими бактериями, автотрофными метаногенными археями и автотрофными ацетогенными бактериями.
В результате автотрофного биосинтеза метана и ацетата продукты ацидогенеза вступают в реакции, которые протекают на восходящей ветви цикла углерода.
Пространственно-временная структура анаэробного деструктивного сообщества. Хотя в каждой природной экосистеме обычно присутствуют сразу несколько акцепторов электронов, их восстановление обособлено в пространстве и во времени.
Пространственная структура анаэробного деструктивного сообщества изучена на примере морских и пресноводных донных отложений.
В самых верхних слоях осадков — в условиях остаточного аэробиоза — органика окисляется с использованием молекулярного кислорода в качестве терминального акцептора электронов. В нижних слоях, где запас кислорода практически уже исчерпан, происходит диссимиляционное восстановление нитрата. Еще глубже восстанавливается Мn4+, а затем Fе3+. Наконец, в глубинных слоях донных отложений протекают диссимиляционное восстановление сульфата и метаногенез.
Причина пространственного обособления этих процессов становится понятной, если учесть, что с глубиной уменьшается концентрация молекулярного кислорода (соответственно, снижается окислительно-восстановительный потенциал) и увеличивается концентрация органических доноров электронов.
Временная структура анаэробного деструктивного сообщества, т. е. очередность использования перечисленных терминальных акцепторов электронов определяется сродством к ним редуктазных систем.
Высоким сродством к акцептору обладает нитратредуктаза, и поэтому в верхних горизонтах донных отложений активно идет восстановление нитрата, а все остальные дыхательные процессы подавлены. Диссимиляционное восстановление сульфата и метаногенез не могут происходить одновременно с восстановлением Мn4+ и Fе3+, поскольку редуктазы, участвующие в этих двух процессах, обладают меньшим сродством к акцепторам электронов, чем метал редуктазы.
Как уже указывалось, первичные анаэробы обладают метаболизмом бродильного типа. В свою очередь, вторичные анаэробы имеют дыхательный тип метаболизма, основанный на использовании в качестве источника энергии органических или неорганических субстратов.
Брожение и дыхание — это два важнейших метаболических процесса, в основе которых лежит хемотрофный способ ассимиляции энергии.
Остановимся на них подробно.
11.3. Брожение
Фотосинтез и брожение — это два фундаментальных физиологических процесса, которые стали предметом экспериментальных исследований в первой половине XIX в. Характерными признаками брожения являются турбулентность из-за выделения газообразных продуктов (чем и объясняется метафорическое название этого феномена; лат. fermentum — закваска, в переносном смысле — душевное волнение), а также накопление ценных органических соединений.
Со спиртовым брожением человек столкнулся задолго до возникновения земледелия и скотоводства, еще в эпоху первобытного собирательства. На протяжении 6 тыс. лет этот процесс использовался при приготовлении пива, а в течение последних 3 тыс. лет — в хлебопечении и виноделии. Развитие скотоводства подарило человечеству продукты молочнокислого брожения. С начала XX в. производство этанола, бутанола, ацетона, молочной кислоты и ацетальдегида, при котором используются разные типы брожения, стало краеугольным камнем промышленной биотехнологии.
В историческом очерке (см. I том учебника) мы уже отмечали, что причинную связь спиртового брожения с жизнедеятельностью дрожжей-сахаромицетов установили в конце 1830-х годов французский физик Шарль Каньяр де Латур (C.Cagniard de Latour), немецкий зоолог Теодор Шванн и немецкий ботаник Фридрих Кютцинг (F. Kützing). В отличие от них сторонники химической теории брожения Юстус фон Либих (J. von Liebig), Фридрих Велер (F. Wöhler) и Йенс Берцелиус (J. J. Berzelius) считали, что брожение связано с постмортальным разложением белка. К сожалению, эти выдающиеся химики подвергли выводы де Латура, Шванна и Кютцинга агрессивной антинаучной критике, что на полстолетия затормозило изучение биологического смысла брожения.
В середине 1850-х годов Луи Пастер (L. Pasteur) описал молочнокислых бактерий-возбудителей брожения, при котором накапливается лактат. Следом за этим он открыл процесс маслянокислого брожения, которое вызывают облигатно анаэробные бактерии рода Clostridium.
Данное Пастером определение брожения как жизни без воздуха (фр. «lа fermentation est la vie sans air») имело огромное концептуальное значение, поскольку ранее такая возможность исключалась в принципе. Кроме того, он впервые указал на то, что разные формы брожения вызываются специфическими микроорганизмами. Однако, будучи виталистом, он считал, что брожение связано с сохранением «жизненной силы» и прекращается после смерти возбудителя.
В 1897 г. немецкий ботаник Эдуард Бухнер (Е. Buchner, Нобелевская премия по химии, 1907 г.) обнаружил, что спиртовое брожение происходит в бесклеточном препарате дрожжей. Стало ясно, что метаболические процессы можно изучать химическими методами, и это привело к рождению новой науки — биохимии.
11.3.1. Брожение с позиций биоэнергетики; различие между брожением и дыханием
Хотя логическая нить к роли компартментализации в биоэнергетике протягивается еще от опытов Бухнера, даже в наше время сущность брожения часто пытаются объяснить с позиций конструктивного метаболизма.
Например, в классическом учебнике по общей микробиологии Ганса Шлегеля (Н. Schlegel) брожение рассматривается как «... метаболический процесс, при котором регенерируется АТФ, а продукты расщепления органического субстрата могут служить одновременно и донорами, и акцепторами водорода» (перевод 1985 г. на русский язык с 6-го немецкого издания, стр. 263).
Процитированное определение, к сожалению, не раскрывает механизм ассимиляции энергии при брожении. Кроме того, сюда не укладываются следующие важные моменты.
Во-первых, АТФ может образовываться не только при брожении, но и за счет дыхания, а также в результате фототрофии.
Во-вторых, расщепление органического субстрата может дать один и тот же продукт и при брожении, и при дыхании. Примером служат бактерии рода Acetobacter, превращающие этанол в ацетат. Такой процесс иногда называют «уксуснокислым брожением». Однако в действительности это типичное дыхание, поскольку электроны, полученные при окислении этанола, затем передаются аэробной дыхательной цепи.
Втретьих, органическое вещество может быть акцептором электронов не только при брожении, но и при дыхании — например фумаратном.
Вчетвертых, при брожении могут использоваться не только органические, но и неорганические акцепторы электронов — например катионы окисного железа.
Брожение с позиций биоэнергетики. Суть брожения вытекает из основ биоэнергетики. При этом метаболическом процессе энергия ассимилируется с помощью цитозольных биотрансформаторов.
Брожение — это такой тип хемоорганотрофии, когда энергия ассимилируется путем фосфорилирования АДФ на уровне субстрата при окислении последнего цитозольными дегидрогеназами, причем электроны передаются эндогенному или экзогенному (не)органическому акцептору, который превращается в специфический побочный продукт.
При брожении энергия первично ассимилируется в форме фосфагена, например, фосфоэнолпирувата или 1,3-бисфосфоглицерата. После этого происходит фосфорилирование АДФ на уровне субстрата.
Энергия, запасенная при брожении в форме АТФ, обеспечивает разнообразные эндергонические процессы с помощью реакций, которые катализируются АТФазами и АТФ-киназами.
Прокариотные ферментаторы имеют, наряду с растворимыми АТФазами, мембраносвязанные АТФазы/АТФ-синтазы. Благодаря этим ферментам энергия гидролиза терминальной фосфоэфирной связи АТФ преобразуется в Рmf. В свою очередь, Рmf используется в тех эндергонических процессах, которые протекают без участия АТФ. В качестве примеров можно привести некоторые типы активного транспорта, а также движение с помощью вращающихся жгутиков.
В самом общем виде энергетическую стратегию брожения можно изобразить следующим образом:
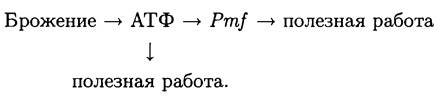
Таким образом, при брожении «цитозольная» биоэнергетика первична, а «мембранная» — вторична.
Сравнение брожения с дыханием. Зачастую утверждают, что главное отличие дыхания от брожения связано с поглощением кислорода. Это справедливо лишь для растений и большинства животных, поскольку некоторые ядерные организмы и очень многие прокариоты используют при дыхании не кислород, а другой окислитель, например, нитрат или сульфат. Другое утверждение, что при брожении используется только органический акцептор электронов, также несостоятельно. Это могут быть, в частности, катионы Fе3+ (см. раздел 11.3.4.6).
В действительности коренное различие между брожением и дыханием заключается не в типе акцептора электронов, а в способе ассимиляции энергии.
Как мы уже выяснили, при брожении энергия первично ассимилируется в форме АТФ. В отличие от этого при дыхании энергия первично ассимилируется в форме Рmf. Затем она используется вторичными транспортерами и двигательными системами, а также преобразуется в химический потенциал АТФ с помощью мембраносвязанной АТФазы/АТФ-синтазы. Энергия, которая освобождается при разрыве терминальной фосфоэфирной связи АТФ растворимыми или мембраносвязанными АТФазами и АТФ-киназами, в свою очередь, расходуется для полезной работы.
Поэтому в самом общем виде энергетическую стратегию дыхания можно изобразить следующим образом:
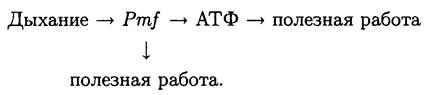
Таким образом, концептуальное различие между брожением и дыханием заключается в том, что в этих процессах используются разные биоэнергетические стратегии.
11.3.2. Механизмы образования пирувата при катаболизме углеводов
Возбудителями брожения могут быть представители всех трех глобальных доменов.
В основе реакций, на которых основано большинство типов брожения, лежит катаболизм углеводов. Ключевым продуктом этих биохимических превращений, обеспечивающих клетку свободной энергией в форме АТФ, служит пировиноградная кислота (пируват).
Наиболее распространенным механизмом образования пирувата является гек- созобисфосфатный путь (англ, hexose bisphosphate pathway, НВР).
11.3.2.1. Гексозобисфосфатный путь Эмбдена-Мейергофа-Парнаса
Этот путь по старой традиции называют гликолизом (греч. glykos — сладкий и lysis — уничтожение; распад глюкозы).
Гликолиз был первым полностью расшифрованным метаболическим путем. Главная заслуга в этом принадлежала когорте выдающихся биохимиков, куда входили немцы Карл Ломан (K.Lomann), Карл Нойберг (С. Neuberg), Густав Эмбден (G.Embden), Отто Мейергоф (О. F. Meyerhof, Нобелевская премия по физиологии и медицине, 1922 г.), Ганс Эйлер (Н. von Euler- Chelpin, Нобелевская премия по физиологии и медицине, 1929 г.) и Отто Варбург (О. Н. Warburg, Нобелевская премия по физиологии и медицине, 1931 г.); англичанин Артур Харден (А. Harden, Нобелевская премия по химии, 1929 г.); австро-венгры Якуб Парнас (J. К. Parnas) и супруги Кори (С. R. Cori, G.T.Cori, Нобелевская премия по физиологии и медицине, 1947 г.).
В память исследователей, которые внесли наибольший вклад в реконструкцию гексозобисфосфатного пути, его называют путем Эмбдена-Мейергофа (англ. ЕМ) или Эмбдена-Мейергофа- Парнаса (англ. ЕМР).
Первоначально гликолиз изучали, используя в качестве объектов ферментирующие дрожжи (Saccharomyces cerevisiae) и анаэробные мышечные препараты позвоночных. Позднее выяснилось, что гликолиз и его модификации встречаются у представителей всех трех доменов.
Обобщенная схема гликолиза приведена на рис. 86.
Рис. 86. Гексозобисфосфатный путь Эмбдена-Мейергофа-Парнаса (гликолиз).
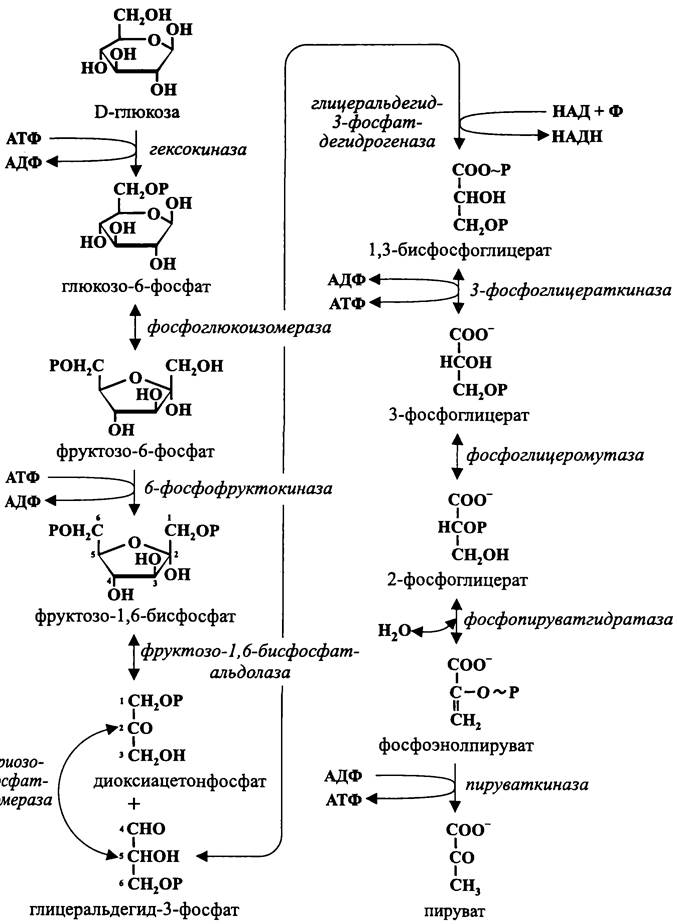
Левая ветвь этого пути (пять ферментативных реакций) несет конструктивный смысл и заключается в подготовке донора электронов — глицеральдегид-3-фосфата. С этой целью гексоза симметрично активируется с помощью гексокиназы и 6- фосфофруктокиназы двумя молекулами АТФ (понесенный расход в дальнейшем компенсируется за счет экзергонических реакций на правой ветви), а затем с помощью альдолазы расщепляется на два С3-фрагмента. Один — это глицеральдегид-3-
фосфат. Другой — это диоксиацетон-3-фосфат, и он превращается в глицеральдегид- 3-фосфат с помощью триозофосфатизомеразы.
Из-за того, что при гликолизе шестиуглеродный субстрат расщепляется надвое, этот путь еще называют «дихотомическим» (от греч. dichotoma — разрезать на две части).
Правая ветвь гликолитического пути (пять ферментативных реакций) имеет биоэнергетический смысл, поскольку в ней синтезируются два фосфагена.
Один фосфаген (1,3-бисфосфоглицерат) образуется при окислении глицеральдегид-3-фосфата — путем включения неорганического фосфата (Ф) в состав триозы. Другой фосфаген (фосфоэнолпируват) образуется при отщеплении молекулы воды от 2-фосфоглицерата.
Путем переноса фосфорильной группы от этих фосфагенов происходит фосфорилирование на уровне субстрата двух молекул АДФ.
Кофактором дегидрогеназы, катализирующей ключевую реакцию гликолиза — превращение глицеральдегид-3-фосфата в 1,3-бисфосфоглицерат — служит никотинамид-адениндинуклеотид (НАД; см. рис. 103), который был впервые выделен Эйлером и Варбургом. Его восстановленная форма может использоваться:
— для образования специфических конечных продуктов (в случае энергетического метаболизма бродильного типа);
— для создания Рmf (в случае энергетического метаболизма дыхательного типа);
— для биосинтетических реакций (в случае конструктивного метаболизма, например, диазотрофии).
Особо обратим внимание на то, что в правую ветвь гликолитического пути входят две молекулы глицеральдегид-3-фосфата. Первая молекула этой триозы (атомы углерода №4, 5 и 6) является прямым продуктом дихотомического расщепления гексозы. Вторая молекула этой триозы (атомы углерода №1, 2 и 3) образуется путем изомеризации другой триозы — диоксиацетонфосфата.
Таким образом, на правой ветви гликолитического пути синтезируются четыре молекулы АТФ. Поскольку две из них затрачиваются на левой ветви, конечный итог ассимиляции энергии при гликолизе составляет две молекулы АТФ на молекулу окисленной гексозы.
Суммарное уравнение гексозобисфосфатного пути записывается следующим образом:
глюкоза + 2АДФ + 2Ф + 2НАД —> 2 х пируват + 2АТФ + 2НАДН + 2Н+.
На основе вышеизложенного мы можем дать следующее определение гексозобисфосфатного пути.
Гексозобисфосфатпный путь (гликолиз) — это катаболическое превращение глюкозы в две молекулы пирувата, которое сопровождается восстановлением двух молекул НАД и фосфорилированием на уровне субстрата четырех молекул АДФ, причем две молекулы АТФ расходуются в подготовительных киназных реакциях.
Как мы уже отмечали, гликолитический путь служит основой большинства брожений. Однако он может выполнять и альтернативную роль, подготавливая для дыхательной цепи субстрат — НАДН. Последний образуется как в самом гликолизе, так и при дальнейшем окислении пирувата.
Необходимо особо подчеркнуть, что конкретные реакции гликолиза и весь гексозобисфосфатный путь обратимы (рис. 86). Это, в частности, позволяет при отсутствии готовой глюкозы осуществить глюконеогенез, т. е. синтезировать глюкозу из
триоз, после чего включать ее в состав структурных полимеров (пептидогликана, липополисахарида), поверхностных слоев (чехла, капсулы), а также откладывать ее в составе запасного полигликозида.
Регуляция гексозобисфосфатного пути. Классический гексозобисфосфатный путь регулируется на уровне транскрипции (путем изменения паттерна и скорости экспрессии генов, кодирующих гликолитические ферменты), а также на посттрансляционном уровне (путем аллостерической модификации уже синтезированных гликолитических ферментов).
Особо важен контроль двух однонаправленных реакций гликолиза. Одна из них катализируется фосфофруктокиназой и связана с превращением фруктозо-6-фосфата во фруктозо-1,6-бисфосфат; противоположную реакцию катализирует фруктозо-1,6-бисфосфат-фосфатаза. Другая реакция катализируется пируваткиназой и связана с превращением фосфоэнолпирувата в пируват (рис. 86).
При выращивании Е. coli на богатой сахарами среде регулятор транскрипции FYuR, или активатор катаболитной репрессии (англ. catabolite repressor activator, Сrа) реагирует на высокую концентрацию фруктозо-1,6-бисфосфата и усиливает транскрипцию гена фосфофруктокиназы pfkA, а также гена пируваткиназы pykF.
При наличии сахаров возрастает и активность фосфофруктокиназы, поскольку повышается концентрация ее субстрата (фруктозо-6-фосфата), а также концентрация ее аллостерического регулятора (фруктозо-1,6-бисфосфата).
В то же время фосфофруктокиназа аллостерически ингибируется АТФ, тогда как АДФ или АМФ действуют на нее как положительные эффекторы. Этим отчасти объясняется так называемый «эффект Пастера», или физиологический антагонизм между дыханием и брожением.
При усиленной аэрации брожение вытесняется дыханием («прямой эффект Пастера»). После перехода к аэробиозу синтезируется больше АТФ, в результате чего аллостерически ингибируется активность фосфофруктокиназы, уменьшается содержание фруктозо-1,6-бисфосфата и, соответственно, уменьшается потребление глюкозы, т. е. подавляется брожение. Это свойственно всем факультативным бродильщикам —от прокариотов до мышц позвоночных.
В свою очередь, при «обратном эффекте Пастера» на фоне дефицита кислорода падает скорость мембранного фосфорилирования и снижается энергетический заряд, т. е. уменьшается отношение АТФ к сумме всех трех аденилатов (см. раздел 10.2). В результате этого активируется фосфофруктокиназа и больше глюкозы окисляется по гликолитическому пути, т. е. брожение стимулируется. Кроме того, брожение усиливается из-за ослабления конкуренции за АДФ и Ф между фосфорилированием на уровне субстрата и мембранным фосфорилированием.
11.3.2.2. Гексозомонофосфатный путь Энтнера — Дудорова
Этот путь, известный также как «2-кето-3-дезокси-6-фосфоглюконатный путь» (англ. 2-keto-3-deoxy-6-phosphogluconate pathway, KDP), был открыт у Pseudomonas saccharophila в 1952 г. Энтнером (N. Entner) и Дудоровым (М. Doudoroff). В настоящее время установлено, что он распространен очень широко и встречается у представителей всех трех глобальных доменов.
KDP-путь особо характерен для представителей филы ВХII Proteobacteria (84 вида 37 родов, в частности Zymomonas mobilis). Реже им обладают представители фил ВХIII Firmicutes(восемь видов трех родов, в частности Streptococcus faecalis), BXIV Actinobacteria (пять видов трех родов, в частности Arthrobacter simplex), BXVII Spirochaetes (Treponemasaccharophilum) и BXX Bacteroidetes (три вида трех родов, например Spirosoma linguale).
В домене Archaea KDP-путь обнаружен у представителей фил AI Crenarchaeota (четыре вида трех родов, например Sulfolobus solfataricus) и АII Euryarchaeota (пять видов пяти родов, например Thermoplasma acidophilum).
Наконец, в домене Еисагуа KDP-путь выявлен у Aspergillus niger, Entamoeba histolytica и Pénicillium notatum.
Продуктом пути Энтнера-Дудорова, как и при гликолизе, является пируват (рис. 87).
Рис. 87. Гексозомонофосфатный путь Энтнера-Дудорова.
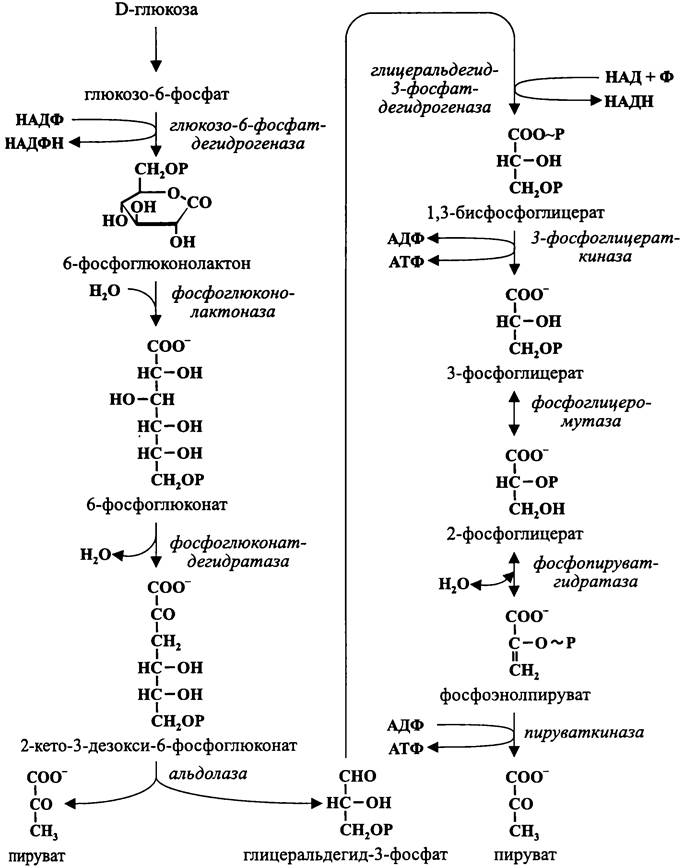
Точно так же, как при гликолизе, левая ветвь пути Энтнера-Дудорова (пять ферментативных реакций) имеет конструктивный смысл и заключается в подготовке донора электронов — глицеральдегид-3-фосфата.
Однако из-за отсутствия 6-фосфофруктокиназы симметричная активация гексозы оказывается невозможной. Вместо этого гексоза асимметрично активируется одной молекулой АТФ (понесенный расход компенсируется за счет экзергонических реакций на правой ветви), в результате чего образуется глюкозо-6-фосфат. НАДФ- зависимая дегидрогеназа окисляет его в 6-фосфоглюконолактон, а из последнего под действием фосфоглюконолактоназы образуется 6-фосфоглюконат.
С помощью фосфоглюконат-дегидратазы б-фосфоглюконат превращается в 2- кето-3-дезокси-6-фосфоглюконат, ключевой метаболит цикла Энтнера-Дудорова. Этот фермент имеет гомодимерную структуру (63 кДа; ген edD), а в качестве простетической группы используется [FеnSn]-кластер.
Далее под действием специфической альдолазы 2-кето-3-дезокси-6-фосфоглюконат расщепляется на две триозы — глицеральдегид-3-фосфат и первую молекулу пирувата (вторая молекула пирувата образуется на правой ветви). Этот фермент представляет собой тример (23 кДа; ген edA) и не содержит простетических групп.
Легко заметить, что правая ветвь пути Энтнера-Дудорова полностью совпадает с гликолитической, т. е. он представляет собой не что иное, как вариант гликолиза.
Однако, в отличие от «классического» гликолиза, в правую ветвь пути Энтнера- Дудорова вступают не две, а только одна молекула глицеральдегид-3-фосфата (атомы углерода №4, 5 и 6), что обеспечивает фосфорилирование на уровне субстрата только двух молекул АДФ. Поскольку одна из них затрачивается на левой ветви, конечный итог ассимиляции энергии на пути Энтнера-Дудорова минимален — одна молекула АТФ на молекулу окисленной гексозы:
глюкоза + АДФ + Ф + НАДФ + НАД —> 2 х пируват + АТФ + НАДФН + НАДН + 2Н+.
Тем не менее, благодаря этому пути многие бактерии, растущие на богатых сахарами средах, получили возможность быстро накапливать пируват (примерами служат ассоциированные с растениями представители рода Pseudomonas).
У аэробов путь Энтнера-Дудорова обычно сопровождается окислительным декарбоксилированием пирувата (см. раздел 11.3.3), и образующийся ацетил-СоА поступает в цикл Кребса, снабжающий дыхательную цепь донорами электронов — восстановленными пиридиновыми (НАДН и НАДФН) и флавиновым (ФАДН2) нуклеотидами.
Единственным примером, когда путь Энтнера-Дудорова функционирует у анаэробов, является Zymomonas mobilis. В данном случае после декарбоксилирования пирувата (см. раздел 11.3.3) ацетальдегид используется в качестве ловушки для электронов и с помощью алкогольдегидрогеназы превращается в этанол.
Z. mobilis встречается преимущественно в тропическом поясе в ассоциации с растениями, сок которых содержит много глюкозы, сахарозы и фруктозы. Созданию элективных условий для роста этой бактерии способствуют бактерии рода Gluconobacter, которые окисляют этот узкий набор сахаров до глюконата. Хотя Z. mobilis дает минимальный для прокариотного организма урожай биомассы в расчете на моль окисленного субстрата, эта бактерия активно импортирует сахара, и содержание ферментов KDP-пути у нее достигает 50% растворимого белка.
11.3.2.3. Гексозомонофосфатный путь Варбурга-Диккенса-Хореккера
Второе название этого пути — «окислительный пентозофосфатный путь» (англ. oxidative pentose phosphate pathway, OPP). Он был назван в честь Отто Варбурга, который внес первоначальный вклад в его изучение в 1930-е годы, и английских биохимиков Диккенса (F. Dickens) и Хореккера (G. Horecker), которые реконструировали его в конце 1950-х годов.
Наконец, этот путь называют «апотомическим» (от греч. apotome —отрезать). В отличие от «дихотомического» гликолиза, где шестиуглеродный субстрат расщепляется пополам, здесь он подвергается декарбоксилированию.
ОРР-путь используют гетероферментативные молочнокислые бактерии, принадлежащие к филе ВХIII Firmicutes.
Подобно гликолизу и пути Энтнера-Дудорова, левая ветвь пути Варбурга- Диккенса-Хореккера (семь ферментативных реакций) имеет конструктивный смысл и заключается в подготовке донора электронов — глицеральдегид-3-фосфата. В результате его окисления образуется пируват. Однако в данном случае наряду с пируватом образуется ацетилфосфат (рис. 88). Как и пируват, ацетилфосфат может иметь разную «судьбу», что является основой для разных типов брожения.
Так же, как в пути Энтнера-Дудорова, глюкоза сначала превращается в 6-фос- фоглюконат. Затем, в отличие от пути Энтнера-Дудорова, 6-фосфоглюконат не дегидрируется в 2-кето-З-дезокси-6-фосфоглюконат, а окисляется в З-кето-6-фосфо- глюконат.
Рис. 88. Гексозомонофосфатный путь Варбурга-Диккенса-Хореккера.
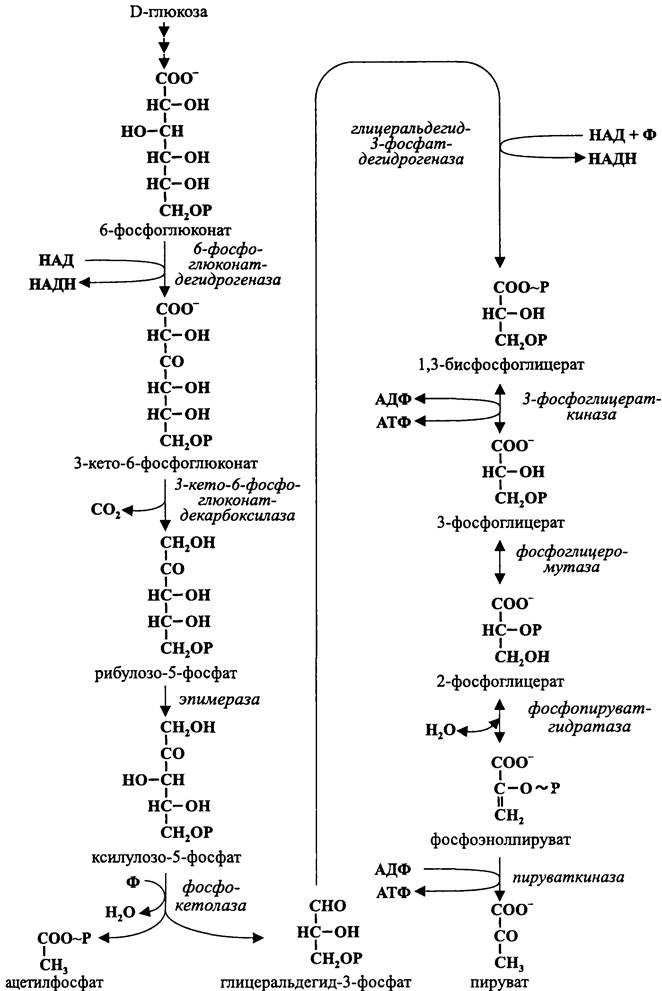
После этого 3-кето-6-фосфоглюконат декарбоксилируется с образованием рибулозо-5-фосфата, который эпимеризуется в ксилулозо-5-фосфат.
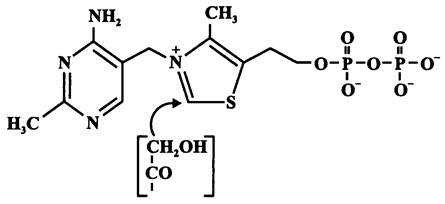
Наконец, с помощью фосфокетолазы ксилулозо-5-фосфат расщепляется на гли- церальдегид-3-фосфат и ацетилфосфат (СН3—СОО~Р). Кофактором в данной реакции служит тиаминпирофосфат, или витамин B1 (рис. 89). Он связывает «кетольную» группу (СН2ОН-СО-) ксилулозо-5-фосфата, которая после отщепления молекулы воды и присоединения неорганического фосфата превращается в ацетилфосфат.
Рис. 89. Тиаминпирофосфат (витамин В1). Стрелкой указано место присоединения кетольной группы.
Правая ветвь пути Варбурга-Диккенса-Хореккера полностью совпадает с гликолитической. Поэтому, как и путь Энтнера-Дудорова, этот путь представляет собой не что иное, как вариант гликолиза.
Однако, в отличие от «классического» гликолиза и аналогично пути Энтнера- Дудорова, в правую ветвь пути Варбурга-Диккенса-Хореккера вступают не две, а только одна молекула глицеральдегид-3-фосфата (атомы углерода №4, 5 и 6). Этим обеспечивается фосфорилирование на уровне субстрата только двух молекул АДФ. Поскольку одна из них затрачивается на левой ветви, конечный итог ассимиляции энергии на пути Варбурга-Диккенса-Хореккера минимален — одна молекула АТФ на молекулу окисленной гексозы:
глюкоза + АДФ + 2Ф + 2НАД + НАДФ —> пируват + ацетилфосфат + АТФ + 2НАДН + НАДФН + Н2О + 2Н+.
Еще раз напомним, что левая ветвь пути Варбурга-Диккенса-Хореккера до стадии расщепления ксилулозо-5-фосфата входит составной частью в окислительный пентозофосфатный цикл (см. раздел 11.4.2.2), снабжающий дыхательную цепь донорами электронов — восстановленными пиридиновыми нуклеотидами.
Кроме того, с помощью пути Варбурга-Диккенса-Хореккера бактерии могут катаболизировать не только гексозы, но и пентозы.
У бактерий, обладающих метаболизмом бродильного типа, гексозомонофос- фатный путь Варбурга-Диккенса-Хореккера может использоваться наряду с гексозобисфосфатным путем. Примером служат факультативные «гетероферментативные» молочнокислые бактерии, в частности Lactobacillus plantarum.
У бактерий с дыхательным типом метаболизма гексозомонофосфатный путь Варбурга-Диккенса-Хореккера может использоваться наряду с гексозомонофосфатным путем Энтнера-Дудорова. В качестве примера можно назвать фитопатогена Xanthomonas campestris.
11.3.2.4. Гексозомонофосфатный путь де Фриза — Стаутамера
Этот путь расшифровали во второй половине 1960-х гг. голландский микробиолог де Фриз (W. De Vries) и английский микробиолог Стаутамер (A. Stouthamer). Он известен также под названием «бифидо-шунт» (англ. bifido shunt). Его используют «гетероферментативные» молочнокислые бактерии рода Bifidobacterium, принадлежащие к филе BXIV Actinobacteria.
Подобно гликолизу, а также путям Энтнера-Дудорова и Варбурга-Диккенса- Хореккера, левая ветвь бифидо-шунта (семь ферментативных реакций) имеет конструктивный смысл и заключается в подготовке донора электронов — глицеральдегид-3-фосфата. В результате окисления глицеральдегид-3-фосфата образуется пируват.
Как и в случае пути Варбурга-Диккенса-Хореккера, вторым продуктом бифидо- шунта является ацетилфосфат. Однако механизм его синтеза имеет существенные особенности (рис. 90).
Рис. 90. Гексозомонофосфатный путь де Фриза-Стаутамера (бифидо-шунт).
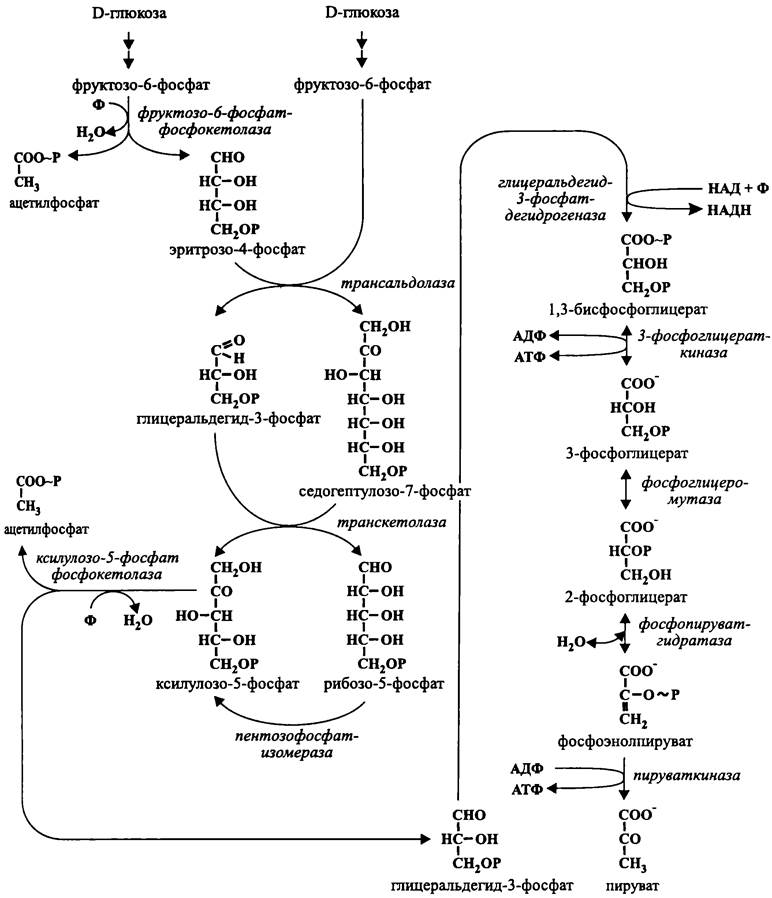
Глюкоза так же, как при гликолизе, превращается во фруктозо-6-фосфат. Затем с помощью фосфокетолазы фруктозо-6-фосфат расщепляется на ацетилфосфат и эритрозо-4-фосфат. Эта реакция аналогична фосфокетолазному расщеплению ксилулозо-5-фосфата в пути Варбурга-Диккенса-Хореккера, и кофактором здесь также служит тиаминпирофосфат.
Затем осуществляется серия из четырех реакций, в которых участвуют эритрозо- 4-фосфат и вторая молекула фруктозо-6-фосфата. Сначала с помощью трансальдолазы от альдозы (эритрозо-4-фосфата) на кетозу (фруктозо-6-фосфат) переносится формильная, или «альдольная» группа (СНО-); в результате образуются гли- церальдегид-3-фосфат и седогептулозо-7-фосфат. Затем с помощью транскетолазы от кетозы (седогептулозо-7-фосфата) на альдозу (глицеральдегид-3-фосфат) переносится «кетольная» группа (СН2ОН-СО-); в результате образуются ксилулозо-5-фосфат и рибозо-5-фосфат. После этого пентозофосфат-изомераза превращает рибозо-5-фосфат в ксилулозо-5-фосфат. Наконец, ксилулозо-5-фосфат-фосфокетолаза расщепляет ксилулозо-5-фосфат на ацетилфосфат и глицеральдегид-3-фосфат.
Таким образом, в правую ветвь пути де Фриза-Стаутамера входят две молекулы глицеральдегид-3-фосфата (атомы углерода № 4, 5 и 6), что обеспечивает фосфорилирование на уровне субстрата четырех молекул АДФ. Две из них затрачиваются на левой ветви для асимметричного фосфорилирования двух молекул глюкозы, и поэтому итог ассимиляции энергии для данного пути минимален — одна молекула АТФ на молекулу окисленной гексозы:
2 х глюкоза + 2АДФ + 5Ф + 2НАД —> 2 х пируват + 3 х ацетилфосфат + 2АТФ + 2НАДН + 3Н2О + 2Н+.
Однако не следует забывать, что в левой ветви пути де Фриза-Стаутамера образуются три молекулы ацетилфосфата. С помощью ацетаткиназы они превращаются в ацетат, в результате чего регенерируется дополнительное количество АТФ:
СН3-СОО~Р + АДФ —> СН3-СОО- + АТФ.
Наконец, благодаря мощным фосфокетолазам, а также наличию трансальдолазной и транскетолазной активности, бифидобактерии могут катаболизировать не только гексозы, но и пентозы.
11.3.2.5. Образование пирувата у архей
Из-за позднего «пришествия» архей в биологию особенности их углеводного метаболизма оставались неизвестными до начала 1990-х годов.
Основные объекты при изучении механизмов образования пирувата у архей — это гипертермофилы, имеющие оптимум роста >80°С. Большинство из них растет хемогетеротрофно на средах, содержащих полипептиды. Однако встречаются и сахаролитические формы с метаболизмом дыхательного типа, которые используют в качестве терминального акцептора электронов кислород (например, Sulfolobus), серу (например, Thermoproteus) или сульфат (например, Archaeoglobus).
В настоящее время способность к катаболизму углеводов выявлена у восьми видов из филы AI Crenarchaeota (рода Desulfurococcus, Pyrodictium, Sulfolobus и Thermoproteus) и y двадцати видов из филы АII Euryarchaeota (рода Archaeoglobus, Haloarcula, Halobacterium, Halococcus, Haloferax, Pyrococcus, Thermococcus и Thermoplasma).
Выяснено, что архей могут образовывать пируват по модифицированному гек- созобисфосфатному пути или по модифицированному гексозомонофосфатному пути
Энтнера-Дудорова. Интересно, что некоторые ферменты этих путей не гомологичны бактериальным.
У архей гексозомонофосфатный путь Варбурга-Диккенса-Хореккера не найден и, скорее всего, он у них вообще отсутствует (в частности, не выявлены гены-ортологи глюкозо-6-фосфат-дегидрогеназы и 6-фосфоглюконат-дегидрогеназы). Гексозомонофосфатный путь де Фриза-Стаутамера у архей также не обнаружен.
Особенности гексозобисфосфатного пути у архей. Они проявляются на стадии подготовки глицеральдегид-3-фосфата (рис. 91, А). Прежде всего, наряду с АТФ-зависимой «бактериальной» гексокиназой может использоваться гетерологичная АДФ-зависимая глюкокиназа. Фосфоглюкоизомераза, превращающая глюкозоб-фосфат во фруктозо-6-фосфат, также не родственна бактериальной. Наконец, донорами фосфорила для 6-фосфофруктокиназы может быть не только АТФ, но и АДФ, а также пирофосфат ФФ.
Важнейшей особенностью гексозобисфосфатного пути у архей является способ, которым глицеральдегид-3-фосфат может быть превращен в 3-фосфоглицерат. Наряду с обычным механизмом, когда на уровне субстрата фосфорилируются две молекулы АДФ, имеется уникальный одноэтапный механизм — без образования 1,3- бисфосфоглицерата. Катализатором этой реакции является «необратимая» НАДФ- зависимая или ферредоксинзависимая глицеральдегид-3-фосфат-оксидоредуктаза. В качестве простетических групп она использует [Fe4S4]-кластер и вольфрам, лигандированный молекулами птерина (продукта конденсации двух шестичленных азотсодержащих гетероциклов). При использовании этого механизма выход АТФ равен нулю, поскольку две молекулы АТФ, образующиеся в результате пируваткиназной реакции, компенсируют затрату двух молекул АТФ при симметричной активации гексозы:
глюкоза + 4ФДоХ —> 2 х пируват + 4Фдred + 4Н+.
В том случае, когда донором одного из фосфорилов служит пирофосфат ФФ, конечный итог ассимиляции энергии составляет одну молекулу АТФ на молекулу окисленной глюкозы.
Особенности гексозомонофосфатного пути Энтнера-Дудорова у архей. Они проявляются на этапе образования 2-кето-3-дезокси-6-фосфоглюконата (рис. 91, Б). Активация гексозы осуществляется не в начале пути, а только на стадии 2-кето-З-дезоксиглюконата. Вначале НАДФ-зависимая глюкозодегидрогеназа окисляет нефосфорилированную глюкозу в глюконат, а затем глюконатдегидратаза превращает его в 2-кето-З-дезоксиглюконат. В итоге энергетический выход такого «поздно фосфорилирующего» пути Энтнера-Дудорова составляет одну молекулу АТФ:
глюкоза + НАДФ + НАД + АДФ + Ф —> 2 х пируват + НАДФН + НАДН + АТФ + 2Н+.
Рис. 91. Гексозобисфосфатный (А) и гексозомонофосфатный (Б) путь у архей. 1 — глюкокиназа; 2 — 6-фосфофруктокиназа; 3 — глицеральдегид-3-фосфат-оксидоре- дуктаза; 4 — глюкозодегидрогеназа; 5 — 2-кето-З-дезоксиглюконат-киназа; 6 — 2-кето-З- дезоксиглюконат-альдолаза; 7 — глицеральдегид-дегидрогеназа; 8 — глицераткиназа.
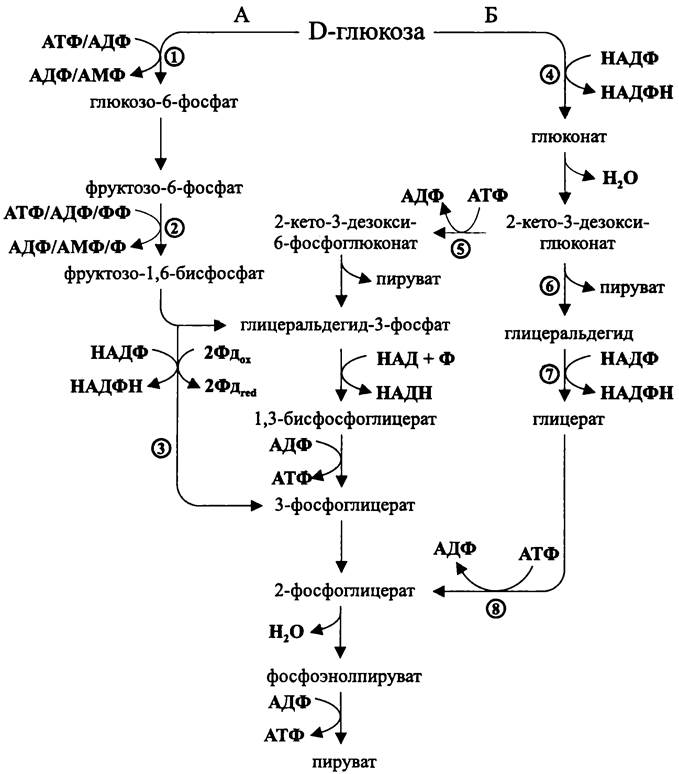
Существует также «нефосфорилирующий» путь Энтнера-Дудорова, когда 2-кето-3-дезокси-глюконат расщепляется уникальной альдолазой на молекулу пирувата и молекулу глицеральдегида. Затем уникальная НАДФ-зависимая дегидрогеназа превращает его в глицерат. И, наконец, уникальная киназа превращает глицерат в 2-фосфоглицерат, который поступает в магистральный гликолитический путь. При использовании такого механизма выход АТФ равен нулю, поскольку одна молекула
АТФ, образующаяся в результате пируваткиназной реакции, компенсирует затрату одной молекулы АТФ при активации глицерата:
глюкоза + 2НАДФ —>2 х пируват + 2НАДФН + 2Н+.
Таким образом, кроме образования пирувата итогом катаболизма гексоз является синтез восстановителя (НАДН, НАДФН или Фдred). Низкий или нулевой выигрыш АТФ в данном случае не создает энергетической проблемы, поскольку археи получают энергию главным образом в результате дыхания.
11.3.3. Судьба пирувата — основа разнообразия типов брожения
При брожении кофакторами дегидрогеназ служат пиридиннуклеотиды — НАД и НАДФ. Для того, чтобы снова вступить в реакцию, они должны передать электроны растворимому конечному акцептору.
В качестве него обычно используются продукты окислительно-восстановительных реакций самого брожения. В результате образуются специфические соединения, которые выделяются во внешнюю среду, что дает название разным типам брожения (спиртовое, молочнокислое, ацетонобутиловое и т. д.).
В основе разнообразия типов брожения лежит судьба пирувата. Этот генеральный метаболит одновременно является одним из важнейших промежуточных продуктов брожения.
Существуют четыре пути гетеротрофного, т. е. не связанного с карбоксилированием превращения пирувата (рис. 92).
Окислительное декарбоксилирование пирувата (рис. 92, А). Оно приводит к образованию ацетил-Со А.
Рис. 92. Пути гетеротрофного превращения пирувата. 1 — пируват: ферредоксин-оксидоредуктаза; 2 — пируватдегидрогеназа; 3 — пируват- декарбоксилаза; 4 — лактатдегидрогеназа; 5 — пируват: формиат-лиаза (тиолаза).
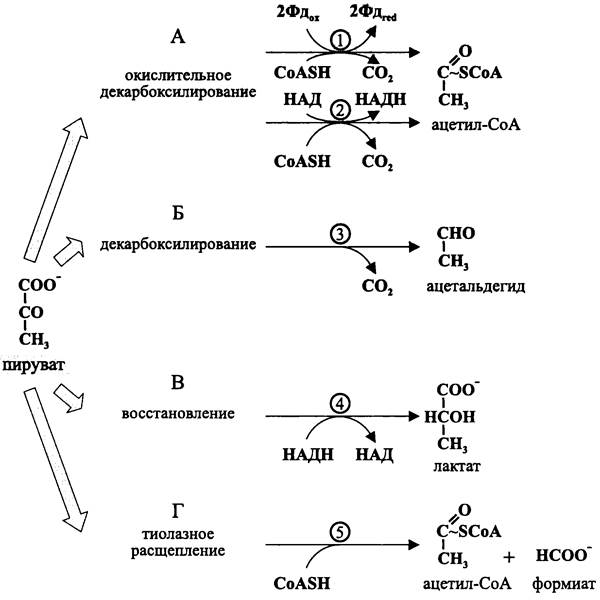
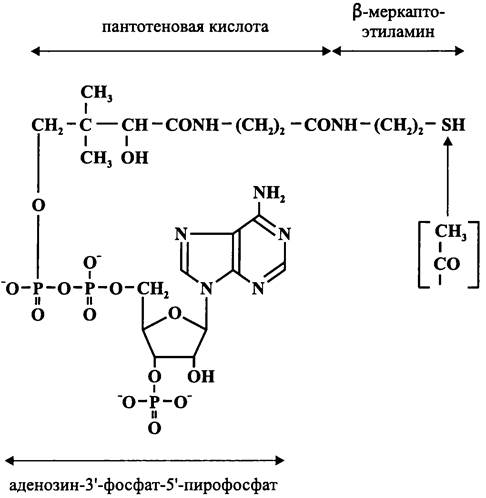
Коэнзим А (рис. 93) является производным пантотеновой кислоты. Он участвует в реакциях S-ацилирования, прежде всего в реакции S-ацетилирования. Его открыл Фриц Липманн в 1947 г. Ацетильная форма коэнзима А (ацетил-СоА) является активированной формой ацетата, что позволяет ему участвовать в разнообразных энергетических и конструктивных процессах.
Фермеитаторы-бродильщики окислительно декарбоксилируют пируват с помощью ферредоксинзависимой пируват: ферредоксин-оксидоредуктазы:
СН3-СО-СОО- + СоАSН + 2Фдох —> СН3-СО~SСоА + СO2+ 2Фдred.
После этого ацетил-СоА может использоваться для образования ряда конечных продуктов — например, масляной кислоты при маслянокислом брожении или ацетона и бутанола при ацетонобутиловом брожении.
Рис. 93. Коэнзим А. Стрелкой указано место присоединения ацетильной группы.
Ферредоксин с помощью ферредоксин: НАД-оксидоредуктазы восстанавливает НАД:
2Фдred + НАД —> 2Фдоx + НАДН.
В свою очередь, НАДН передает электроны соответствующим предшественникам этих конечных продуктов (см. ниже), которые служат ловушками для электронов.
Альтернативной ловушкой для электронов могут быть протоны:
ФДгеd + 2Н+ —> ФДох + Н2,
где Фдrеd и ФДох — соответственно восстановленный и окисленный ферредоксин. Катализатором здесь является гидрогеназа. Благодаря образованию водорода регулируется баланс эндогенных окислительно-восстановительных реакций, а заодно редокс-состояние окружающей среды.
Ацетил-СоА в данном случае превращается в ацетилфосфат с помощью фосфо- трансацетилазы:
СНз-СО~SСоА + Ф —> СН3-СОО~Р + СоАSН.
Суммарная реакция окислительного декарбоксилирования пирувата с участием ферредоксинзависимой оксидоредуктазы и фосфотрансацетилазы называется «фосфорокластическим» распадом (греч. сдфышы — разламывание):
СНз-СО-СОО- + Фдох + Ф —> СН3-СОО~Р + СO2 + Фдгеd.
Дальнейшее превращение ацетилфосфата заключается в том, что он служит донором фосфорильной группы в реакции фосфорилирования АДФ, которая катализируется ацетаткиназой:
СН3-СОО~Р + АДФ —> СНз-СОО- + АТФ.
Такой метаболический путь называется «уксуснокислым брожением». Он встречается у некоторых прокариотов, а также у паразитических протистов.
Забегая вперед, отметим, что у прокариотов с дыхательным типом метаболизма пируват окислительно декарбоксилируется в ацетил-СоА при помощи НАД-зависимой пируватдегидрогеназы:
СНз-СО-СОО- + СоАSН + НАД —> СН3-СО~SСоА + СO2 + НАДН.
После этого ацетил-СоА конденсируется с оксалоацетатом с образованием цитрата. Затем из цитрата в системе взаимно сбалансированных реакций образуются интермедиаты цикла Кребса, в частности изоцитрат, α-кетоглутарат, малат и сукцинат (см. рис. 101). При их окислении восстанавливаются пиридиновые и флавиновые нуклеотиды (НАД и ФАД), которые передают электроны дыхательной цепи.
Декарбоксилирование пирувата (рис. 92, Б). Оно приводит к образованию ацетальдегида. Катализатором этой реакции служит пируватдекарбоксилаза.
При спиртовом брожении ловушкой для электронов является ацетальдегид, который восстанавливается в этанол НАДН-зависимой алкогольдегидрогеназой:
CH3 - CO - COO- —> СН3 - СНО + СO2,
СН3 - СНО + 2Н+/2е- —> СН3 - СН2ОН.
Восстановление пирувата (рис. 92, В). Оно приводит к образованию лактата. При молочнокислом брожении пируват, который восстанавливается НАДН- зависимой лактатдегидрогеназой, непосредственно служит ловушкой для электронов:
СНз-СО-СОО- + 2Н+/2е- —> СН3-СНОН-СОО-.
Тиолазное расщепление пирувата (рис. 92, Г). Оно осуществляется с помощью пируват: формиат-лиазы (тиолазы) и приводит к образованию ацетил-СоА и формиата:
СНз-СО-СОО- + CoASH —> CH3-CO~SCoA + НСОO-.
Это характерно для муравьинокислого брожения, которое еще называют «брожением смешанного типа».
11.3.4. Типы брожения
Рассмотрим теперь основные типы брожения в том же порядке, в каком мы перечисляли основные пути превращения пирувата.
11.3.4.1. Маслянокислое и ацетонобутиловое брожение
Правильные названия брожений этого типа — «маслянокислотное» и «ацетон-бутанольное». Однако, чтобы не нарушать традиции, здесь и в дальнейшем мы будем использовать привычные термины («молочнокислое», «муравьинокислое», «уксуснокислое»).
Возбудители маслянокислого и ацетонобутилового брожения принадлежат к роду Clostridium (фила ВХIII Firmicutes). Это облигатные анаэробы с метаболизмом исключительно бродильного типа. Они не содержат цитохромов и других гемопротеинов, в частности каталазы, хотя различаются по своей толерантности к кислороду. В число сбраживаемых ими субстратов входят углеводы, спирты, аминокислоты, пурины, стероиды и ряд других соединений.
«Сахаролитические» клостридии (например, С. pasteurianum) добывают сбраживаемые субстраты, гидролизуя на мономеры полигликозиды (крахмал, пектины и целлюлозу). «Протеолитические» клостридии (например, С. histolyticum) используют для этой цели белки и полипептиды. Некоторые клостридии могут быть одновременно сахаролитическими и протеолитическими. Для обозначения клостридиев, сбраживающих азотистые основания, используется неверный термин «пуринолитические».
Клостридии встречаются почти повсеместно — в почве, илах, на разлагающихся растительных и животных продуктах, в пищеварительном тракте позвоночных и насекомых, а также в ранах и глубоко инфицированных мягких тканях человека и животных.
Маслянокислое и ацетонобутиловое брожения основаны на катаболизме сахаров по гексозобисфосфатному пути. В данном случае пируват подвергается окислительному ферредоксинзависимому декарбоксилированию с образованием ацетил-СоА.
Восстановительные эквиваленты передаются от ферредоксина на НАД при помощи растворимой ферредоксин: НАД-оксидоредуктазы. В свою очередь, НАДН отдает электроны интермедиатам брожения, к которым относятся сам ацетил-СоА, а также ацетальдегид, ацетон, бутиральдегид, бутирил-СоА и кротонил-СоА. Конечными продуктами брожения в разных комбинациях и разных количественных соотношениях становятся диоксид углерода и водород, а также ацетат, ацетон, бутанол, бутират, изопропанол и этанол (рис. 94).
Рис. 94. Маслянокислое и ацетонобутиловое брожение. 1 — пируватдегидрогеназа; 2 — ферредоксин: НАД-оксидоредуктаза; 3 — тиолаза; 4 — 2-окси- бутирил-СоА-дегидрогеназа; 5 — кротоназа; 6 — бутирил-СоА-дегидрогеназа; 7 — бутиральдегид- дегидрогеназа; 8 — бутанолдегидрогеназа; 9 — СоА-трансфераза; 10 — ацетальдегид-дегидрогеназа; 11 — алкогольдегидрогеназа; 12 — фосфотрансацетилаза; 13 — ацетаткиназа; 14 — СоА-трансфераза; 15 — ацетоацетат-декарбоксилаза; 16 — изопропанолдегидрогеназа.
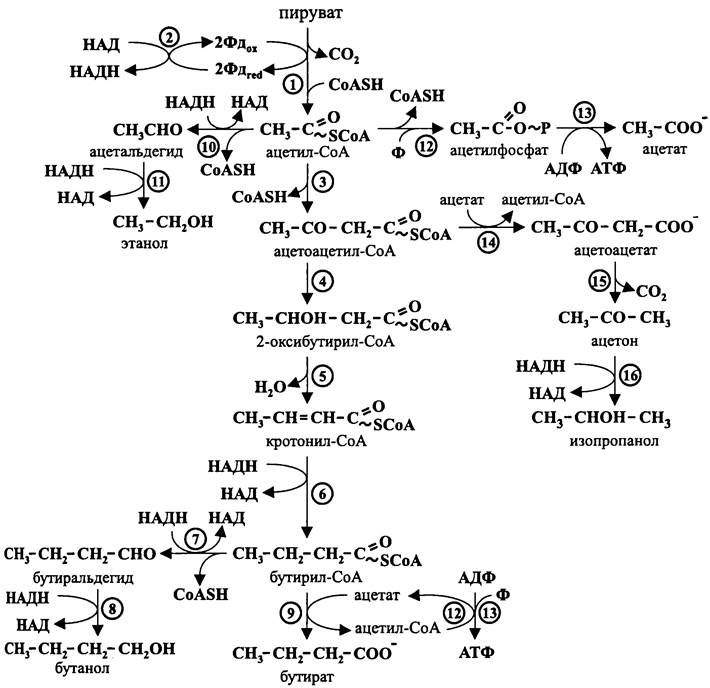
При избыточном накоплении восстановительных эквивалентов клетка освобождается от них наипростейшим способом — ловушкой для электронов становятся протоны, которые восстанавливаются до молекулярного водорода с помощью ЕFе-гидрогеназы (см. раздел 11.4.4.4).
Маслянокислое брожение, типичным возбудителем которого является С. butyricum, протекает следующим образом.
Вначале из двух молекул ацетил-СоА с помощью тиолазы образуется активированный четырехуглеродный скелет — ацетоацетил-СоА. Его дальнейшие превращения сводятся к реакциям дегидратации, восстановления, декарбоксилирования и дезактивации (путем передачи остатка СоА другому носителю). В результате этих реакций образуются альдегиды, кетоны и органические кислоты. Некоторые из них служат ловушками для электронов, другие являются конечными продуктами брожения.
Следом за тиолазой в пути, приводящем к образованию бутирата, участвует 2-оксибутирил-СоА-дегидрогеназа, которая превращает ацетоацетил-СоА в 2-окси- бутирил-СоА. Затем под действием кротоназы из 2-оксибутирил-СоА образуется кротонил-СоА. С помощью бутирил-СоА-дегидрогеназы он восстанавливается в бутирил-СоА. Наконец, после переноса остатка Со А на ацетат с помощью СоА-трансферазы образуется конечный продукт маслянокислого брожения — бутират. Полученный в этой реакции ацетил-СоА при помощи фосфотрансацетилазы и ацетатки- назы превращается в молекулу ацетата. В результате фосфорилирования на уровне субстрата синтезируется молекула АТФ. Ацетат приобретает остаток СоА от бутирил-СоА, и цикл снова повторяется.
Четыре «лишних» электрона удаляются путем образования двух молекул водорода (в гексозобисфосфатном пути восстанавливаются две молекулы НАДН; при окислении двух молекул пирувата восстанавливаются четыре молекулы ферредоксина; две молекулы НАДН затрачиваются на восстановление кротонил-СоА; остается 2 x 2 + 1 x 4 — 2 x 2 = 4). В конечном счете, маслянокислое брожение протекает в соответствии с уравнением:
глюкоза —> СН3-СН2-СН2-СОО- + 2СO2 + 2Н2.
Энергетический выход маслянокислого сбраживания глюкозы составляет три молекулы АТФ (две на стадии гликолиза и одна на стадии регенерации ацетата).
В отличие от маслянокислого брожения, ацетонобутиловое брожение связано с образованием целой серии конечных продуктов. В случае С. acetobutylicum (еще одно неправильное название, следовало бы: С. acetonobutylicum) это ацетат, ацетон, бутанол, бутират, изопропанол и этанол.
Биосинтез указанных продуктов различается по динамике. Вначале образуются кислоты (ацетат и бутират), а затем более восстановленные нейтральные соединения (ацетон, бутанол, изопропанол и этанол). Такая двухфазность накопления продуктов брожения носит адаптивный характер.
Синтез бутирата из части пула ацетил-СоА происходит так же, как при маслянокислом брожении, и сопровождается фосфорилированием АДФ. Проблема ловушки для электронов решается путем восстановления кротонил-СоА в бутирил- СоА, а также благодаря выделению молекулярного водорода. Кроме того, восстановительные эквиваленты используются на анаболической ветви конструктивного метаболизма. Другая часть пула ацетил-СоА превращается в ацетат в ходе фосфотрансацетилазной и ацетаткиназной реакций, что позволяет ассимилировать дополнительную энергию (рис. 94).
Негативным последствием этой фазы является увеличение общей кислотности среды, что крайне неблагоприятно для развития клостридиев.
Поэтому при затухании роста, когда потребность в АТФ и восстановителе сокращается, ацетонобутиловые клостридии начинают «исправлять положение». Теперь они накапливают нейтральные продукты, синтез которых не связан с фосфорилированием АДФ. В качестве дополнительной ловушки для электронов используются протоны, что вызывает благоприятное для бактерий защелачивание окружающей среды.
Для синтеза этанола используется ацетальдегид, полученный в результате восстановления ацетил-СоА с помощью ацетальдегид-дегидрогеназы. Бутанол образу-
ется аналогичным образом — из бутиральдегида, полученного в результате восстановления бутирил-СоА.
Ацетон является продуктом декарбоксилирования ацетоацетата, образованного из ацетоацетил-Со А после переноса остатка СоА на ацетат. В свою очередь, продуктом восстановления ацетона является изопропанол (рис. 94).
Естественно, что двухфазность ацетонобутилового брожения связана с адаптивным синтезом соответствующих ферментов.
Из-за сложной динамики ацетонобутилового брожения нет смысла изображать его общим уравнением, а также точно указывать его энергетический выход.
Природное значение маслянокислых и ацетонобутиловых клостридиев определяется тем, что они играют роль первичных анаэробов-гидролитиков в анаэробном деструктивном сообществе (см. раздел 11.2.2). Некоторые из них, например, С. pasteurianum, являются свободноживущими диазотрофами.
Общеизвестно биологическое значение токсигенных клостридиев, в частности С. botulinum (агент пищевого ботулизма), С. perfringens (возбудитель газовой гангрены) и С. tetani(возбудитель столбняка).
Практическое значение маслянокислых и ацетонобутиловых клостридиев относительно невелико. В настоящее время АВЕ-ферментация (от англ. acetone-butanol- ethanol) с использованием мелассы или крахмалсодержащего растительного сырья значительно уступает по рентабельности химическому синтезу из нефтепродуктов. Однако в исторической ретроспективе это был первый «настоящий» биотехнологический процесс, основанный на применении специально отселектированного штамма С. butylicum, который выращивался в аксеничных условиях на оптимизированной питательной среде. В широких масштабах АВЕ-ферментацию впервые осуществил в 1915-1919 гг. в Канаде и США Хаим Вайцманн (С. Weizmann), что позволило странам антигерманской коалиции преодолеть дефицит сырья для производства бездымного пороха и авиационного лака.
11.3.4.2. Уксуснокислое брожение
Правильное название такого брожения — «уксуснокислотное», или «ацетатное». Говоря о нем, мы должны сделать очень важное смысловое и терминологическое уточнение.
Образование ацетата в качестве конечного продукта хемотрофии возможно четырьмя различными способами:
— из глюкозы при уксуснокислом брожении;
— из глюкозы при уксуснокислом брожении в сочетании с синтезом из 2СO2/8Н+/8е-;
— из 2CÖ2/8H+/8е- при N-метилен-тетрагидрофолатном дыхании (см. раздел 11.4.5.6);
— из этанола при дыхании в результате неполного окисления этого субстрата с помощью алкогольдегидрогеназы и ацетальдегид-дегидрогеназы.
Первый способ связан с ассимиляцией энергии в результате фосфорилирования АДФ на уровне субстрата, а ацетат является главным конечным продуктом.
Второй способ, или «гомоацетатное брожение» и третий способ, или «автотрофный синтез ацетата» частично или полностью связаны с уникальным тетрагидро- фолатным дыханием, которое мы подробно рассмотрим в разделе 11.4.5.5.
Четвертый способ является частным случаем аэробного дыхания, с помощью которого представители р. Gluconobacter ассимилируют энергию в форме Pmf.
В данном случае мы рассмотрим только уксуснокислое брожение, которое протекает в соответствии с общим уравнением реакции:
глюкоза —> 2СН3СООН + 2СО2 + 4H2.
Энергетический выигрыш относительно высок и составляет четыре молекулы АТФ на молекулу катаболизируемой глюкозы.
Однако данный вариант брожения приводит к образованию большого количества молекулярного водорода, и в случае повышения его парциального давления создаются термодинамические условия, неблагоприятные для протекания окислительных реакций. Возникает альтернатива — снизить энергетический выигрыш брожения путем дополнительного образования лактата, формиата и этанола или каким- то образом нейтрализовать ингибирующее действие молекулярного водорода.
В данном случае бактерии следуют по второму пути и используют широко распространенный механизм «межвидового переноса водорода», который они реализуют в синтрофной ассоциации с другими бактериями или археями. Такой симбиоз существует в пищеварительном тракте травоядных животных и древесноядных насекомых.
Типичный пример связан с целлюлолитической бактерией Ruminococcus albus (фила ВХIII Firmicutes), которая является одним из важнейших обитателей рубца жвачных животных. В результате катаболизма глюкозы образуется пируват, который затем подвергается фосфорокластическому расщеплению с выделением молекулярного водорода (рис. 95).
Рис. 95. Уксуснокислое брожение. 1 — ферредоксин: НАД-оксидоредуктаза; 2 — гидрогеназа; 3 — пируват: ферредоксин- оксидоредуктаза; 4 — фосфотрансацетилаза; 5 — ацетаткиназа; 6 — гидрогеназа; 7 — фумаратредуктаза.
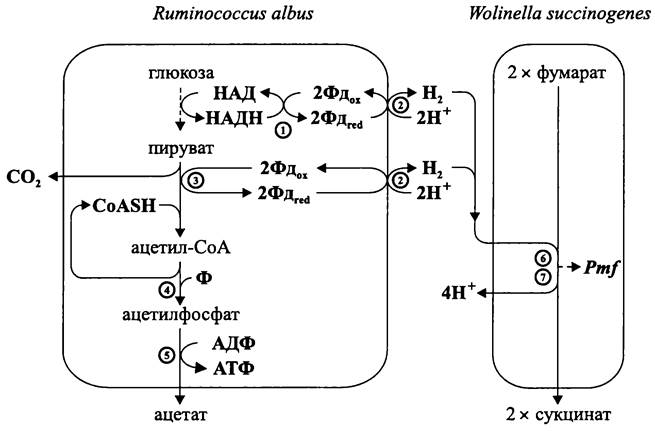
Водород незамедлительно потребляется симбиотическими партнерами R. albus. В качестве них обычно выступают метаногенные археи Methanobrevibacter ruminantium и М. smithii(фила АII Euryarchaeota) или бактерия Wolinella succinogenes (класс «Epsilonproteobacteria»). В последнем случае водород используется в качестве донора электронов при фумаратном дыхании (см. раздел 11.4.5.3).
Уксуснокислое брожение является важным звеном анаэробной ветви глобального круговорота углерода. В составе внутридоменных или междоменных симбиотических ассоциаций оно шунтирует нисходящую или восходящую ветви этого цикла.
11.3.4.3. Спиртовое брожение
Правильное название такого брожения — «эганольное». При нем происходит неокислительное декарбоксилирование пирувата с образованием ацетальдегида. Последний служит ловушкой для электронов и восстанавливается НАДН-зависимой алкогольдегидрогеназой в этанол (рис. 96, А). Общее уравнение спиртового брожения:
глюкоза —> 2СНз-СН2ОН + 2СО2.
Энергетический выигрыш от спиртового сбраживания одной молекулы глюкозы составляет две молекулы АТФ.
Способность к спиртовому брожению относительно редко встречается у бактерий и вообще не обнаружена у архей. Основными примерами этанольных бактерий являются:
— мезофилы (20-40°С), осуществляющие «классический» гликолиз (Erwinia amylovorans, Sarcina ventriculi);
— термофилы (40-65°С), осуществляющие «классический» гликолиз (С. thermocellum, С. thermosaccharolyticum)',
— экстремальные термофилы (> 65°С), осуществляющие «классический» гликолиз (С. thermohydrosulfuricum, Thermoanaerobacter ethanolicus, Thermoanaerobium brockii);
— представители рода Zymomonas, которые катаболизируют моносахариды (глюкозу, фруктозу) и дисахариды (лактозу, сахарозу) по пути Энтнера-Дудорова.
Хотя спиртовое брожение является базой для получения традиционных пищевых продуктов (в частности, хлеба и спиртных напитков), этанол в основном используется как химическое сырье и топливо для двигателей внутреннего сгорания. Ежегодное производство технического этанола только в европейских странах составляет более 1,5 • 106 т, две трети которых синтезируют дрожжи.
Промышленным конкурентом этанола является ацетальдегид, который необходим при производстве пластмасс, искусственного каучука и фотоматериалов. Чтобы получить его, предварительно синтезированый этанол приходится окислять «обратно». В последнее время разработан прямой способ производства ацетальдегида с помощью штаммов Е. mobilis, обладающих пониженной алкогольдегидрогеназной активностью (в данном случае регенерация НАД осуществляется с помощью НАДН- оксидазы).
С использованием Е. mobilis производятся традиционные спиртные напитки — агавовое вино ацтеков (пульке) и продукт его перегонки (текила).
11.3.4.4. Глицериновое брожение
Правильное название этого брожения — «глицерольное».
В годы первой мировой войны Карл Нойберг, Эльза Рейнфурт, Вильгельм Коннштайн и Карл Людеке обнаружили, что при добавлении к бродящему суслу бисульфита натрия дрожжи вместо этанола накапливают глицерол.
Механизм этого процесса заключается в том, что ацетальдегид, который образуется в результате декарбоксилирования пирувата, реагирует с безвредным для дрожжей бисульфитом с образованием 2-гидроксиэтил-сульфоната натрия:
СНз-СНО + NаНSО3 —> СН3-СНOН-SO3Nа.
В отсутствии ацетальдегида роль ловушки для электронов начинает выполнять диоксиацетонфосфат, восстанавливающийся в 3-фосфоглицерол. Последний дефосфорилируется с образованием глицерола (рис. 96, Б).
Рис. 96. Спиртовое (А) и глицериновое (Б) брожение.
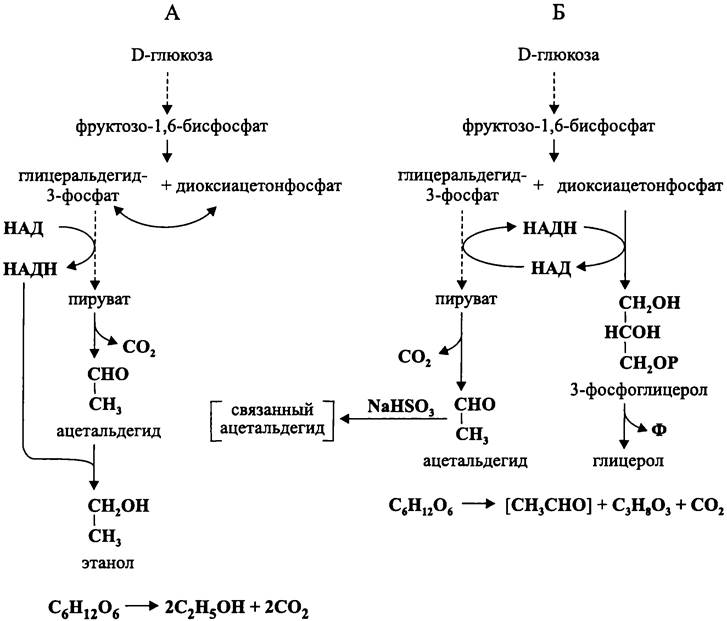
Общее уравнение глицеринового брожения, получившего название «вторая форма брожения по Нойбергу» («первая форма» — это обычное спиртовое брожение) выглядит следующим образом:
глюкоза —> СН2ОН-СНОН-СН2ОН + [СН3-СНО] + СO2, где [СН3—СНО] — связанный ацетальдегид.
Так как при глицериновом брожении окисляется только одна молекула триозы, его энергетический выход равен нулю, т. е. оно не приносит энергетического выигрыша.
Фабричный метод, основанный на второй форме брожения по Нойбергу, позволил, начиная с 1915 г., ежемесячно производить для изготовления взрывчатки до 103 т глицерола. Поскольку традиционные источники глицерола — мыловарение и гидролиз жиров и масел — полностью не обеспечивали потребности германской военной промышленности, экономически обоснованной альтернативой оказался биотехнологический процесс, разработанный на основе результатов фундаментальных исследований.
11.3.4.5. Молочнокислое брожение
Термин, который традиционно используется для обозначения данного типа брожения, неудачен. Вместо него следовало бы говорить «молочнокислотное», или «лактатное».
При молочнокислом брожении ловушкой для электронов служит пируват, образующийся при катаболизме глюкозы. В результате восстановления пирувата с помощью НАДН-зависимой лактатдегидрогеназы образуется лактат, и отсюда происходит название данного типа брожения.
Однако при молочнокислом брожении углеводы могут катаболизироваться разными способами, что сказывается на энергетическом выходе брожения, а также на качественном и количественном составе конечных продуктов.
В связи с этим традиционно различают «гомоферментативное молочнокислое брожение» и «гетероферментативное молочнокислое брожение». Оба термина неудачны как тавтологические («ферментативное» означает не фермент, а ферментацию, т. е. брожение). Вместо этого следовало бы говорить «гомолактатное» и «ге- теролактатное».
При гомоферментативном молочнокислом брожении глюкоза катаболизируется по гексозобисфосфатному пути (см. рис. 86), после чего пируват восстанавливается в лактат с выходом не менее 90%, что близко теоретическому:
глюкоза —> 2СН3-СНОН-СОО-.
Облигатные гомоферментативные молочнокислые бактерии (Lactobacillus acidophilus, L. delbrueckii, L. salivarius, Sporolactobacillus inulinus, Streptococcus lactis и др.) обладают полным набором ферментов гексозобисфосфатного пути и не способны катаболизировать сахара иными способами.
У факультативных гетероферментативных молочнокислых бактерий (L. casei, L. plantarum, L. sake, Leuconostoc mesenteroides и др.) адаптивно не синтезируются, а у облигатных гетероферментативных молочнокислых бактерий (Lactobacillus brevis, L. fermentum, L. kefir и др.) отсутствуют два ключевых фермента гексозобисфосфатного пути — фруктозо-1,6-бисфосфат-альдолаза и триозофосфатизомераза.
В качестве альтернативы эти бактерии используют гексозомонофосфатный путь Варбурга-Диккенса-Хореккера (см. рис. 88).
Пиру ват, как и у гомоферментативных молочнокислых бактерий, восстанавливается до лактата:
СН3-СО-СОО- + 2Н+/2е- —> СН3-СНОН-СОO-.
Ацетилфосфат (другой продукт пути Варбурга-Диккенса-Хореккера) может подвергаться двум вариантам превращений.
В первом варианте с помощью ацетаткиназы он превращается в ацетат:
СН3-СОО~Р + АДФ —> СН3-СОО- + АТФ.
Во втором варианте ацетилфосфат при помощи фосфотрансацетилазы предварительно превращается в ацетил-СоА. Затем ацетил-СоА под действием ацетил-СоА- синтазы восстанавливается в ацетальдегид. И, наконец, из ацетальдегида с помощью алкогольдегидрогеназы образуется этанол:
СН3-СОО~Р + CoASH —> СН3—CO~SCoA + Ф,
СН3—CO~SCoA + 2Н+/2е- —> СН3-СНО + CoASH,
СН3-СНО + 2Н+/2е- —> СН3-СН2ОН.
Первый вариант преимущественно использует L. brevis, а второй — Leuconostoc mesenteroides.
Общее уравнение гетероферментативного молочнокислого брожения можно представить в следующем виде:
глюкоза —> СН3-СНОН-СОО- + СН3-СОО-(или СН3-СН2ОН) + СO2.
Какой из указанных вариантов преобладает, зависит от активности энергетического метаболизма. Если клетке нужно больше энергии в форме АТФ, преимущественно используется первый вариант, и весь ацетилфосфат переводится в ацетат. В этом случае ловушкой для «лишних» электронов становятся не ацетил-СоА и ацетальдегид, а глюкоза, которая из пятиатомного альдегидоспирта превращается в шестиатомный спирт — маннитол.
Большинство молочнокислых бактерий принадлежит к филе ВХIII Firmicutes. Они обладают метаболизмом облигатно бродильного типа, что связано с отсутствием у них дыхательной цепи. Хотя молочнокислые бактерии не синтезируют порфиноиды и лишены каталазы, они являются аэротолерантными анаэробами и даже нуждаются в небольшом количестве кислорода, который используется ими в биосинтетических оксигеназных реакциях.
Молочнокислые бактерии характеризуются очень сложными пищевыми потребностями (им нужны готовые аминокислоты, азотистые основания, витамины) и в природной среде ассоциированы с высшими растениями. Благодаря способности гидролизовать лактозу с помощьюβ-галактозидазы они вторично колонизируют кишечник млекопитающих.
Обладая повышенной устойчивостью к бактерицидному лактату, молочнокислые бактерии создают себе элективные условия на содержащих сахара растительных и животных субстратах. На этом основаны традиционные и современные методы производства квашеных молочных, растительных и мясных продуктов (йогурт, силос, салями и многое другое).
Микробиологическое производство молочной кислоты, используемой в различных отраслях легкой, пищевой и фармацевтической промышленности, конкурирует с ее химическим синтезом из лактонитрила, который образуется путем реакции ацетальдегида с синильной кислотой.
Особое положение среди гетероферментативных молочнокислых бактерий занимают представители рода Bifidobacterium, относящиеся к филе BXIV Actinobacteria.
Бифидобактерии не имеют ключевого фермента гексозобисфосфатного пути — фруктозо-1,6-бисфосфат-альдолазы. У них также отсутствует ключевой фермент гексозомонофосфатного пути Варбурга-Диккенса-Хореккера — глюкозо-6-фосфат- дегидрогеназа. В качестве альтернативы этим путям они используют бифидо-шунт (см. рис. 90).
Пиру ват, как в случае гомоферментативных молочнокислых бактерий, восстанавливается до лактата:
СН3-СО-СОО- + 2Н+/2е- —> СН3-СНОН-СОО-.
Ацетилфосфат (второй продукт бифидо-шунта) с помощью ацетаткиназы превращается в ацетат:
СН3-СОО~Р + АДФ —> СН3-СОO- + АТФ.
Таким образом, общее уравнение молочнокислого брожения у бифидобактерий приобретает вид:
2 х глюкоза —> 2 СН3-СНОН-СОО- + 3СН3-СОO-.
Бифидобактерии имеют характерную форму бумеранга и очень чувствительны к кислороду. Типичной средой их обитания является кишечник грудных детей, вскармливаемых материнским молоком (в коровьем молоке отсутствует N-ацетил- глюкозамин, который для этих бактерий служит незаменимым фактором роста). Помимо того их можно выделить из пищеварительного тракта взрослых млекопитающих и пчел, а также из сточных вод, богатых органикой. Для человека они вместе с другими молочнокислыми бактериями являются «пробиотиками», т. е. микроорганизмами, которые при добавлении в пищу поддерживают гомеостаз кишечной микробиоты и благотворно влияют на иммунный статус. В настоящее время они широко используются в заквасках для производства молочнокислых продуктов.
11.3.4.6. Муравьинокислое брожение
Правильное название этого брожения — «муравьинокислотное», или «формиатное». Происхождение этих терминов объясняется тем, что в качестве одного из конечных продуктов брожения образуется формиат. Поскольку синтез формиата сопровождается накоплением других кислот (ацетата, лактата и сукцината), такое брожение также называют брожением «смешанного типа».
Возбудителями муравьинокислого брожения являются Enterobacter, Erwinia, Escherichia, Klebsiella, Proteus, Salmonella, Serratia, Shigella, Yersinia и другие представители бактерий кишечной группы, или сем. Enterobacteriaceae (фила ВХII Ргоteobacteria).
Для энтеробактерий характерен адаптационно гибкий метаболизм, сочетающий в себе ассимиляцию энергии с помощью цитозольных и мембранных биотрансформаторов.
В первом случае — при брожении — гексозы катаболизируются по фруктозобис- фосфатному пути, гексозомонофосфатному пути Энтнера-Дудорова или гексозомо- нофосфатному пути Варбурга-Диккенса-Хореккера. Дальнейшая судьба пирувата, приводящая к образованию конечных продуктов брожения, сложна и неоднозначна (см. ниже).
Во втором случае — при дыхании — пируват и его непосредственный предшественник фосфоэнолпируват полностью окисляются через цикл Кребса. При этом образуются восстановленные формы пиридиновых (НАД(Ф)Н) и флавинового (ФАДН2) нуклеотидов, которые служат донорами электронов для дыхательной цепи.
При муравьинокислом брожении пируват подвергается тиолатному расщеплению с помощью пируват: формиат-лиазы с образованием формиата и ацетил-СоА (см. рис. 92). Ацетил-СоА превращается в ацетат в результате фосфотрансацетилазной и ацетаткиназной реакций, что позволяет ассимилировать энергию путем фосфорилирования АДФ на уровне субстрата. Ловушкой для электронов служит пируват, который восстанавливается в лактат.
В данном случае конечными продуктами муравьинокислого брожения оказываются формиат и ацетат, и его общее уравнение принимает вид:
глюкоза —> НСОО- + СН3-СОO- + СН3-СНОН-СОO-.
Энергетический выигрыш от формиатного сбраживания одной молекулы глюкозы составляет три молекулы АТФ (две на стадии гликолиза и одна на стадии образования ацетата).
По аналогии с ацетонобутиловыми клостридиями, энтеробактерии переходят от образования кислот к биосинтезу нейтральных продуктов. Однако при этом они образуют не ацетоацетил-Со А из двух молекул ацетил-СоА, а ацетолактат из двух молекул пирувата (рис. 97). Ацетолактат при помощи ацетолактат-декарбоксилазы превращается в ацетил-метил-карбинол, или ацетоин. После этого ацетоин может восстановиться в 2,3-бутандиол или окислиться в диацетил. Еще одним нейтральным продуктом муравьинокислого брожения становится этанол, который, как и при ацетонобутиловом брожении, образуется из ацетил-СоА с помощью ацетальдегид-дегидрогеназы и алкогольдегидрогеназы. Что касается «лишнего» формиата, то он превращается в диоксид углерода и молекулярный водород в результате формиат: Н2-лиазной реакции, в которой совместно участвуют формиатдегидрогеназа и гидрогеназа.
Рис. 97. Муравьинокислое брожение (брожение смешанного типа). 1 — пируваткиназа; 2 — фосфоэнолпируват-карбоксилаза; 3 — фумаратредуктаза; 4 — пируватформиат-лиаза; 5 — лактатдегидрогеназа; 6 — ацетальдегид-дегидрогеназа; 7 — алкогольдегидрогеназа; 8 — формиатдегидрогеназа; 9 — гидрогеназа; 10 — формиат: нитрат-оксидоредуктаза; 11 — фосфотрансацетилаза; 12 — ацетаткиназа; 13 — ацетолактат-синтаза; 14 — ацетолактат-декарбоксилаза; 15 — 2,3-бутандиол-дегидрогеназа; 16 — диацетил редуктаза.
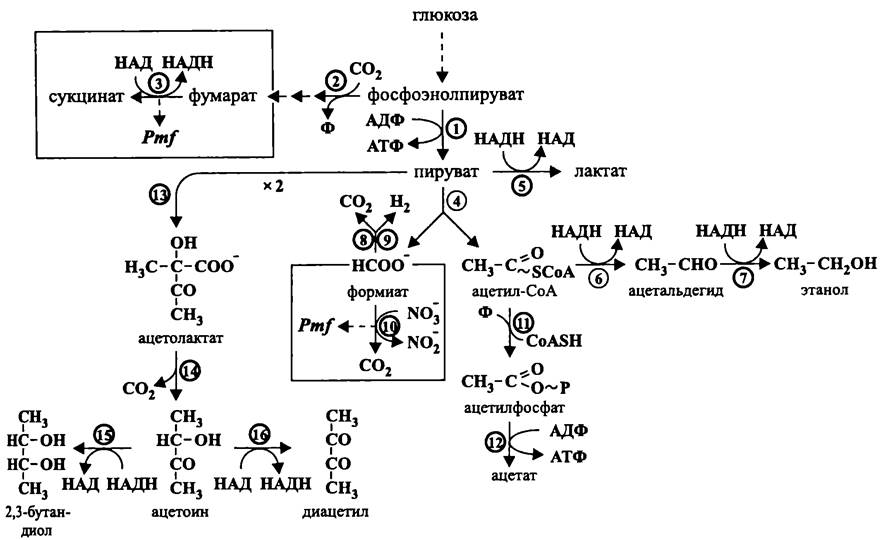
Изложенный сценарий целиком реализуется не у всех энтеробактерий. В частности, Е. coli не может синтезировать ацетоин. Следует подчеркнуть, что таксономическая дифференциация энтеробактерий во многом основана на образовании в результате брожения кислот, газов, ацетоина и т. д.
Еще раз отметим, что интермедиаты конструктивных реакций муравьинокислого брожения могут использоваться в альтернативном сценарии хемотрофии — при дыхании, когда энергия ассимилируется в форме Pmf (см. раздел 11.4).
Рассматриваемый пример особо интересен тем, что в отсутствии кислорода энтеробактерии (в частности, Е. coli) в состоянии обеспечивать себя как донором, так и акцептором электронов для анаэробной дыхательной цепи.
В первом случае речь идет о нитратном дыхании, когда терминальным акцептором электронов является анион нитрата. Донором электронов служит формиат, который окисляется с помощью формиат: нитрат-оксидоредуктазы, или формиатзависимой нитратредуктазы (см. разделы 11.4.4.2 и 11.4.6.2). Помимо восстановления нитрата, с окислением формиата может быть связано восстановление нитрита.
Во втором случае речь идет о фумаратном дыхании, когда акцептором электронов служит фумарат, а донором электронов — НАДН. Это один из примеров очень оригинальной биоэнергетической стратегии, когда прокариоты сами синтезируют для дыхания акцептор электронов. Энтеробактерии за несколько этапов синтезируют фумарат из фосфоэнолпирувата (см. раздел 11.4.5.3).
Энтеробактерии широко распространены в природе. Они живут в почве (например, Enterobacter aerogenes) или на растительной мортмассе (например, Serratia marcescens), могут быть компонентами нормальной микробиоты кишечника человека (например, E. coli), а также фитопатогенами (например, Erwinia carotovora) и зоопатогенами (например, Klebsiellapneumoniae, Salmonella typhi и Shigella dysenteriae).
11.3.4.7. «Необычные» типы брожения
Под таким общим названием объединяются несколько разных типов брожения. Их отличие от уже рассмотренных заключается в том, что используется либо «не гликолитический» способ образования пирувата, либо «не гликолитическая» ловушка для электронов.
Сбраживание цитрата. Этот тип брожения осуществляют энтеробактерии Klebsiella pneumoniae и Salmonella typhimurium при анаэробном росте на цитрате.
С помощью цитратлиазы цитрат расщепляется на ацетат и оксалоацетат (см. рис. 81). Затем оксалоацетат декарбоксилируется с образованием пирувата, который под воздействием пируват: формиатлиазы распадается на формиат и ацетил-СоА. Из последнего через стадию ацетилфосфата образуется ацетат, что сопровождается фосфорилированием АДФ на уровне субстрата.
Энергетический выход ацетатного сбраживания цитрата невелик и составляет одну молекулу АТФ на молекулу окисленного цитрата. Однако на стадии декарбоксилирования оксалоацетата энергия дополнительно запасается в форме Smf при помощи мембраносвязанной биотинзависимой оксалоацетат-декарбоксилазы (см. раздел 10.4.10).
Маслянокислое сбраживание глутамата. Выше мы уже говорили о том, что в качестве сбраживаемых субстратов клостридии могут использовать не только сахара, но и другие органические соединения. Прежде всего к ним относятся аминокислоты, которые «пептолитические» клостридии в изобилии образуют на субстратах, содержащих белки и полипептиды (мортмасса, раневые зоны, глубоко инфицированные мягкие ткани и т. д.). Поскольку субстратом для брожения служат не сахара, а аминокислоты, способ образования пирувата не имеет ничего общего с гликолизом.
В качестве примера рассмотрим уникальное маслянокислое брожение у С. tetanomorphum, основанное на катаболизме глутамата (рис. 98).
Сперва в результате внутримолекулярной перегруппировки, катализатором которой служит витамин В12-зависимая (см. рис. 80) глутаматмутаза, глутамат превращается в 2-метиласпартат. Затем под действием 2-метилфумаразы 2-метиласпартат дезаминируется в 2-метилфумарат. На следующем этапе с помощью 2-метилфума- рат-гидратазы из 2-метилфумарата образуется 2-метилмалат.
В результате реакции, катализируемой 2-метилмалат-лиазой, 2-метилмалат расщепляется на два фрагмента — ацетат и пируват. Последний с помощью ферредок- синзависимой пируватдегидрогеназы окислительно декарбоксилируется в ацетил- СоА.
Из ацетил-СоА при помощи тривиальных реакций маслянокислого брожения в пять этапов образуется бутират.
Напомним, что для образования бутирата (через стадию ацетоацетил-СоА) требуются две молекулы ацетил-СоА, которые (через стадию пирувата) образуются в результате расщепления двух молекул 2-метилмалата (рис. 98).
Рис. 98. Маслянокислое сбраживание глутамата. 1 — глутаматмутаза; 2 — 2-метилфумараза; 3 — 2-метилфумарат-гидратаза; 4 — 2-метилмалат-лиаза; 5 — пируватдегидрогеназа; 6 — СоА-трансфераза.
Другой фрагмент 2-метилмалата — две молекулы ацетата — используются по разному назначению. Одна молекула ацетата становится конечным продуктом брожения. Другая с помощью СоА-трансферазы получает СоА-группу от бутирил-СоА и превращается в ацетил-СоА. Наконец, с помощью фосфотрансацетилазы и ацетат- киназы ацетил-СоА превращается во вторую молекулу ацетата. При этом в результате фосфорилирования на уровне субстрата синтезируется молекула АТФ.
Общее уравнение маслянокислого брожения, основанного на реакциях превращения глутамата, можно записать следующим образом:
2 х глутамат + 2Н2О —> бутират + 2 х ацетат + 2СО2 + 2NH3.
Энергетический выигрыш в этой реакции очень низкий и составляет всего лишь одну молекулу АТФ на две молекулы катаболизированной аминокислоты.
Реакция Стикленда. Это совершенно особый путь сбраживания аминокислот, отличающийся от сбраживания глутамата. Он требует совместного участия двух разных аминокислот, которые данной бактерией в энергетических целях раздельно не используются.
Смысл этого пути, открытого в 1934 г. английским биохимиком Стиклендом и названного его именем, состоит в том, что одна аминокислота одновременно выполняет роль источника энергии и донора электронов, а другая аминокислота — только роль ловушки для электронов.
Аминокислотами-донорами электронов, в частности, могут быть аланин, валин, лейцин или метионин, а аминокислотами-акцепторами электронов аргинин, глицин, пролин или триптофан.
Характерным примером реакции Стикленда служит сопряженное окисление- восстановление аланина и глицина пептолитическим клостридием С. sticklandii (рис. 99).
Вначале аланин окислительно дезаминируется НАДН-зависимой аланиндегидрогеназой. Затем полученный пируват подвергается окислительному декарбоксилированию с помощью пируват: ферредоксин-оксидоредуктазы, в результате чего образуется ацетил-СоА. После этого под действием фосфотрансацетилазы ацетил-СоА превращается в ацетилфосфат. Последний с помощью ацетаткиназы передает свою фосфорильную группу на АДФ, и в результате фосфорилирования на уровне субстрата образуется молекула АТФ.
Рис. 99. Реакция Стикленда. 1 — аланиндегидрогеназа; 2 — пируват: ферредоксин-оксидоредуктаза; 3 — фосфотрансацетилаза; 4 — ацетаткиназа; 5 — глициндезаминаза.
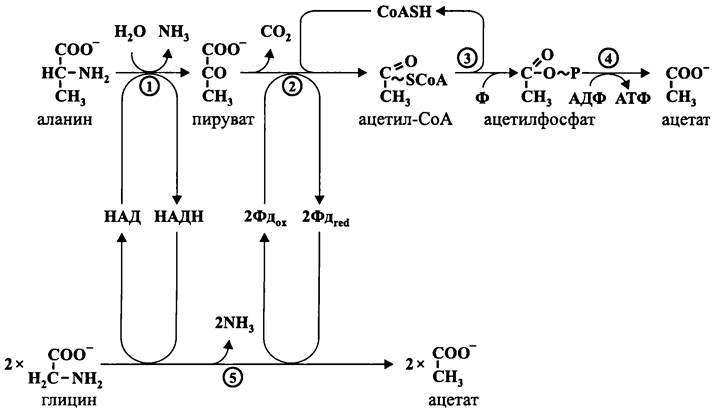
Две молекулы глицина, используемые в качестве акцептора электронов, подвергаются восстановительному дезаминированию. Катализатором этой нетривиальной реакции служит «обратимая» глициндезаминаза, которая превращает глицин в ацетат, используя в качестве кофакторов НАДН и Фдred. Общее уравнение ацетатного брожения, основанного на реакции Стикленда между аланином и глицином, можно записать в следующем виде:
аланин + 2 х глицин + Н2О —> 3 х ацетат + СО2 + 3NH3.
Хотя энергетический выигрыш в обоих рассмотренных случаях очень низкий (одна молекула АТФ соответственно на две и три молекулы катаболизированной аминокислоты), клостридии, обладающие высокой протеолитической активностью, извлекают достаточно энергии для того, чтобы активно расти на белковых субстратах.
Люцифераза в качестве ловушки для электронов. Примером необычного решения проблемы ловушки для электронов являются светящиеся бактерии, которые в основном принадлежат к морским родам Photobacterium и Vibrio, а также к сухопутному роду Xenorhabdus (класс «Gammaproteobacteria»). Они автономно живут в морской воде, развиваются как сапрофиты на трупах животных и могут быть паразитами членистоногих. Свечение бактерий в симбиозе с рыбами и головоногими моллюсками играет в поведении их хозяев роль привлекающего или отпугивающего сигнала.
Светящиеся бактерии осуществляют брожение смешанного типа, и в этом отношении проявляют сходство с энтеробактериями.
Биолюминесценция у разных живых организмов — от насекомых до бактерий — обеспечивается люциферазами. Это группа гетерологичных монооксигеназ, т. е. ферментов, которые катализируют включение атома кислорода в состав окисляемого субстрата (см. раздел 11.4.4.2).
Для бактериальной люциферазы субстратами служат относительно простые соединения, тесно связанные с первичным метаболизмом, что отличает их от люци- феринов, которые используются в других системах биолюминесценции.
Реакция, катализируемая бактериальной люциферазой, выглядит следующим образом:
ФМНН2 + R-СНО + O2 —> ФМН + R-СОО- + Н2O + hv (490 нм),
где ФМНН2 — восстановленный флавинмононуклеотид (см. рис. 104), а R-СНО — алифатический альдегид тетрадеканаль (число атомов углерода равно четырнадцати).
Бинарный комплекс ФМНН2 с кислородом взаимодействует с тетрадеканалем, в результате чего образуется относительно стабильный тройственный комплекс. При его распаде флавин испускает зеленый квант люминесценции, один из двух атомов кислорода восстанавливается до Н2O за счет ФМНН2, а другой атом кислорода связывается с тетрадеканалем с образованием жирной кислоты (рис. 100). В некоторых случаях свободная энергия передается особым антенным белкам, которые излучают более длинноволновый (желтый) свет.
Рис. 100. Брожение смешанного типа, сопряженное с биолюминесценцией. 1 — флавинредуктаза; 2 — альдегид-дегидрогеназа; 3 — люцифераза; R — радикал H(СН2)13-
Восстановленная форма ФМН регенерируется с помощью флавинредуктазы, а тетрадеканаль — альдегид-дегидрогеназы. В обоих случаях источником электронов служит НАДН.
Контроль бактериальной люминесценции связан с оценкой бактериями плотности собственной популяции, по аналогии с контролем биосинтеза ферментов вторичного метаболизма. Стимуляция люминесценции определяется «чувством кворума» (англ. quorum sensing), при котором клетки образуют и выделяют низкомолекулярный автоиндуктор, или феромон. После достижения пороговой концентрации он запускает регуляторный каскад, завершающийся ответной реакцией — индукцией оперона lux.
В состав оперона lux входят структурные гены lихА и lихВ, которые кодируют αβ-субъединицы люциферазы (40 и 30 кДа). Продукты структурных генов luxCDE отвечают за биосинтез алифатического альдегида — тетрадеканаля. Регуляторные гены luxG-R обеспечивают адаптивную экспрессию люциферазной системы.
Хотя механизм бактериальной биолюминесценции в целом уже выяснен, ее приспособительное значение остается загадочным.
Одно из объяснений сводится к тому, что бактерии используют люциферазу в качестве ловушки для электронов.
Действительно, светящиеся бактерии катаболизируют глюкозу по гексозобис- фосфатному пути, конечным продуктом которого является пируват. В свободном состоянии они решают проблему ловушки для электронов с помощью реакций муравьинокислого брожения, образуя из пирувата ацетат, ацетоин, лактат, сукцинат, формиат и этанол. В симбиотическом состоянии пируват в основном экскретируется, и поэтому он или его производные уже не могут быть ловушками для электронов. Поскольку при утилизации пирувата хозяйские митохондрии поддерживают парциальное давление кислорода на очень низком уровне, другой возможный способ регенерации НАД — при помощи НАДН-оксидазы — также бесполезен. В этой ситуации эффективной ловушкой для электронов становится люциферазная система. ФМНН2 и алифатический альдегид окисляются в монооксигеназной реакции, после чего НАДН с помощью флавинредуктазы и альдегид-дегидрогеназы восстанавливает соответственно ФМН и жирную кислоту (рис. 100).
Однако такое объяснение не универсально. В частности, оно не раскрывает роль биолюминесценции для светящихся бактерий, которые не сбраживают сахара, а растут за счет нитратного или нитритного дыхания (например, Shewanella woodyi).
Использование неорганических ловушек для электронов. Расссматривая глицериновое брожение (см. раздел 11.3.4.4), мы убедились в том, что эндогенный органический акцептор электронов можно заменить искусственным неорганическим (в данном случае бисульфитом натрия), хотя в энергетическом отношении этот процесс не имеет утилитарного значения.
Существуют и природные неорганические акцепторы. Они используются при брожении, обеспечивающем реальный энергетический выигрыш. Самыми простыми из них являются протоны, которые с помощью гидрогеназы восстанавливаются до водорода. Этот пример мы уже рассматривали в связи с реакцией фосфорокластического расщепления пирувата (см. раздел 11.3.3).
Другими примерами природных неорганических акцепторов при брожении являются катионы железа и марганца:
2Fe3+ + 2е- —> 2Fe2+, Мn4+ + 2е- —> Мn2+.
Первыми бактериями, для которых продемонстрирована данная способность, были С. pasteurianum, Е. coli и Lactobacillus lactis. Это микроаэробы или факультативные и облигатные анаэробы, сбраживающие углеводы или аминокислоты.
В качестве нетипичного примера можно назвать гомоацетатное сбраживание запасных углеводов нитчатой цианобактерией Microcoleus sp. Часть промежуточного
продукта этой ферментации — формиата — окисляется с помощью катионов записного железа:
НСОO- + 2Fе3+ —> СO2 + 2Fе2+ + Н+.
В качестве ловушки электронов могут использоваться и неорганические анионы, в частности нитрит:
NO2 + 6Н+/6е- + 2Н+ —> NH+ + 2Н2O.
При бродильной аммонификации нитрита у Е. coli окисление глюкозы, лактата или жирных кислот сопровождается фосфорилированием АДФ на уровне субстрата. Редокс-баланс обеспечивается посредством сброса электронов на нитрит, для чего используется растворимая НАДН-зависимая нитритредуктаза (англ, nitrite reductase, Nir).
Наконец, некоторые представители экстремально термофильных архей (например, Pyrococcus furiosus) при сбраживании углеводов используют в качестве ловушки для электронов элементную серу, что осуществляется при помощи растворимой НАД(Ф)Н-зависимой сульфиддегидрогеназы.
На этом месте мы оставляем тему, посвященную механизмам брожения и его распространению в мире прокариотов, и переходим к другому способу хемотрофной ассимиляции энергии — дыханию.
11.4. Дыхание
В отличие от брожения, основанного на цитозольной биоэнергетике, при дыхании используются механизмы мембранной биоэнергетики (см. раздел 10.4.6).
Дыхание — это такой тип хемотрофии, когда энергия ассимилируется в форме Pmf и/или Smf при переносе электронов по электрон-транспортной цепи от субстрата, частично или полностью окисляемого с помощью растворимых или мембраносвязанных дегидрогеназ, на экзогенный или эндогенный акцептор.
Энергия, первично ассимилированная при дыхании, используется для поддержания эндергонических процессов — в частности, мембранного фосфорилирования, которое осуществляется с помощью мембраносвязанной АТФазы/АТФ-синтазы.
11.4.1. Общие положения
При дыхательной органотрофии окисляется органический, а при дыхательной литотрофии — неорганический субстрат. Способностью к дыхательной органотрофии обладают археи, бактерии и произошедшие от бактерий митохондрии. Дыхательная литотрофия встречается только у бактерий и архей.
Отдельные звенья дыхательной цепи служат «сайтами сопряжения», т. е. они непосредственно создают Pmf или Smf. Природа и число этих сайтов могут различаться. Центральную роль в транслокации протонов дыхательной цепью играют цитохром b/с(f)-комплекс или его функциональные аналоги.
Дыхание может быть энергетически сопряженным или разобщенным. При энергетически сопряженном дыхании создается Pmf или Smf и их величина достаточна для того, чтобы поддерживать эндергонические процессы. В конечном счете, это зависит от величины редокс-потенциала пары: терминальный донор/терминальный акцептор. При энергетически разобщенном (холостом) дыхании трансмембранный электрохимический потенциал по той или иной причине не создается или он недостаточен для того, чтобы поддерживать эндергонические процессы. В этом случае свободная энергия окислительно-восстановительной реакции преобразуется в тепло.
Дыхательные цепи у прокариотов исключительно разнообразны. По меткому высказыванию американского бактериолога Кеннета Нильсона, бактерии «могут окислять через свою дыхательную цепь все, что угодно, при помощи всего, чего угодно». Мы не знаем, справедливо ли это в отношении архей, однако у них также выявлены мультивариантные дыхательные цепи.
В любой дыхательной цепи существует донорный («низкопотенциальный») участок и акцепторный («высокопотенциальный») участок. В качестве доноров электронов могут использоваться органические или неорганические вещества. Акцепторы электронов также могут быть органическими или неорганическими.
11.4.2. Органический донор электронов
Катаболизм органических субстратов имеет целью получение энергии, строительного материала и восстановителя. Он происходит при помощи окислительновосстановительных ферментов (дегидрогеназ и оксигеназ), а также благодаря гидролазам, декарбоксилазам, тиолазам и другим ферментам, которые разрушают углеродный скелет органических молекул.
Одним из наиболее распространенных промежуточных продуктов катаболизма органики является ацетат. Основными источниками его получения служат:
— «кетогенные» аминокислоты (например, лейцин);
— жирные кислоты (в результате β-окисления);
— моносахара (в результате гликолиза и других путей образования пирувата).
В химическом отношении ацетат относится к очень устойчивым и инертным соединениям. Для того, чтобы полностью окислить его до СО2, что дает возможность получить максимум свободной энергии, необходима ферментативная активация. Через «богатую энергией» тиоэфирную связь он присоединяется к коэнзиму А с образованием ацетил-СоА (см. раздел 11.3.3).
Известны два принципиально разных способа окисления ацетил-СоА — нециклический и циклический.
Нециклический способ окисления ацетил-СоА. Этот способ встречается довольно редко. К нему прибегают «ацетокластические» метаногенные археи, а также ацетотрофные сульфатредуцирующие бактерии, в частности представители рода Desulfotomaculum.
При нециклическом окислении СН3—СО~SСоА расщепляется на метильную СН3— и карбонильную [СО] группы. Реакцию катализирует СО-дегидрогеназа. Одним из кофакторов этого фермента служит кобальтсодержащий порфиноид, или корриноид (см. рис. 80).
Образовавшиеся метильная и карбонильная группы порознь окисляются до СО2 (первая — с помощью все той же СО-дегидрогеназы, вторая — в линейном пути, причем кофакторами-переносчиками одноуглеродной группировки у метаногенов служат тетрагидрометаноптерин и метанофуран, а у сульфатредукторов тетрагидрофолат (см. разделы 11.4.5.5, 13.3.1 и 13.3.2):
СНз-СО~SСоА —> [СО] + СНз-Х,
СН3-Х + 2Н2O —> СООН-Х + 4Н+/4е- —> СO2 + 2Н+/2е-,
где X — переносчик одноуглеродной группировки.
Фактически данный процесс представляет собой непрямое окислительное декарбоксилирование ацетата.
Циклический способ окисления ацетил-СоА. В отличие от нециклического, циклический способ распространен исключительно широко, хотя и не универсально.
Его суть заключается в том, что углеродный скелет ацетата «наращивается» путем присоединения к нему С4-дикарбоновой кислоты (оксалоацетата), и образуется С6-трикарбоновая кислота (цитрат). В результате серии реакций дегидратации, дегидрирования и декарбоксилирования из цитрата вновь образуется оксалоацетат, т. е. процесс носит циклический характер.
Как и в предыдущем способе, итогом становится непрямое окислительное декарбоксилирование ацетата, хотя природа молекулярных превращений совершенно разная. При нециклическом способе окисляются связанные с коферментами одноуглеродные группировки, а при циклическом способе окисляются и декарбокислируются свободные дикарбоновые или трикарбоновые кислоты (цитрат, изоцитрат, α-кетоглутарат, сукцинат и малат).
В соответствии с общим характером процесса, приводящего к полному окислению активированного ацетата, циклический способ неточно назван «циклом трикарбоновых кислот» (англ. tricarboxylic acid cycle, ТСА), а по имени исследователя, который впервые дал его общую схему — циклом Кребса.
11.4.2.1. Окислительный цикл трикарбоновых кислот, или цикл Кребса
Цикл Кребса (Н. Krebs, Нобелевская премия по физиологии и медицине, 1953 г.) представляет собой взаимно сбалансированную систему ферментативных реакций, которые протекают в цитоплазме прокариотной клетки или митохондриальном матриксе (за исключением сукцинатдегидрогеназной реакции, которая катализируется мембраносвязанным ферментом).
В ходе цикла Кребса ацетильный остаток полностью окисляется до СO2. Полученные электроны при посредстве пиридинового и флавинового кофакторов (НАД и ФАД) передаются дыхательной цепи. Наряду с этим происходит фосфорилирование ГДФ на уровне субстрата с последующей регенерацией АТФ при помощи нуклеозидцифосфаткиназы: АДФ + ГТФ —>АТФ + ГДФ.
Таким образом, цикл Кребса является весьма совершенной метаболической «топкой», которая снабжает клетку энергией сразу в двух формах — в форме Pmf и в форме фосфагена (АТФ).
Наряду с высокоэффективной энергетической функцией цикл Кребса выполняет очень важную конструктивную роль. Восстановленные формы пиридиннуклеотида (НАДН) и флавиннуклеотида (ФАДН2) используются при разнообразных биосинтезах, а интермедиаты цикла (органические кислоты) служат предшественниками аминокислот, жирных кислот, моносахаров, полиизопреноидов и тетрапирролов.
Цикл Кребса был реконструирован и подробно изучен в 1930-1960-х годах, вначале на мышечных препаратах животных, а затем на дрожжевых клетках (в ос-
новном, Saccharomyces cerevisiae). Позднее существование этого цикла было доказано у растений и многих бактерий, а также у экстремально галофильных архей, в частности Halobacterium salinarium (фила All Euryarchaeota), и у экстремально термоацидофильных архей, в частности Sulfolobus acidocaldarius (фила AI Crenar- chaeota).
Гипотетическую схему окисления углеводов с использованием, в качестве интермедиатов, дикарбоновых органических кислот (сукцината, фумарата, малата и оксалоацетата) предложил в 1920 г. шведский биохимик Торстен Тунберг (Т. L. Thunberg). Следом за ним в 1935 г. венгерский биохимик Альберт фон Сент-Дьердьи (А. Szent-Györgyi, Нобелевская премия по физиологии и медицине, 1937 г.) указал на ключевую роль фумаровой кислоты в мышечном дыхании животных. Спустя еще два года немецкие биохимики Карл Мартиус (С. Martius) и Франц Кноп (F. Knoop) предположили, что окисление ацетата происходит путем его ферментативной конденсации с оксалоацетатом, и образующийся цитрат при помощи аконитазы превращается в изоцитрат, а затем окислительно декарбоксилируется в α-кетоглутарат, который, в свою очередь, окислительно декарбоксилируется в сукцинат. Одновременно с ними в 1937 г. немецкий биохимик Ганс Кребс и английский биохимик Уильям Джонсон (W. А. Johnson) установили, что цитрат оказывает стимулирующее воздействие на мышечное дыхание и что продуктами окисления цитрата являются α- кетоглутарат и сукцинат. Они предположили, что цитрат образуется путем слияния ацетата с ок- салоацетатом, а затем по цепочке реакций (α-кетоглутарат —> сукцинат —> фумарат —> малат) из него получается оксалоацетат. На основе этого они постулировали схему циклического окисления ацетата, позднее названную «циклом Кребса».
Решающую роль сыграло использование радиоизотопа 14С, благодаря которому в 1950 г. немецкий биохимик Феодор Линен (F. Lynen, Нобелевская премия по физиологии и медицине, 1964 г.) доказал, что ацетат окисляется через цикл Кребса.
Идею о необходимости активации ацетата высказал тоже Линен, хотя заслуга открытия в 1945 г. активирующего коэнзима (СоА) принадлежит Фрицу Липманну. Наконец, в 1952 г. испанский биохимик Северо Очоа (S. Ochoa, Нобелевская премия по физиологии и медицине, 1959 г.) установил, что при взаимодействии СоА с пируватом образуется ацетил-СоА, который реагирует с оксалоаце- татом с образованием цитрата и свободного СоА.
В 1949 г. американские биохимики Юджин Кеннеди (Е. Р. Kennedy) и Альберт Ленинджер (A. Lehninger) выяснили, что цикл Кребса компартментализован внутри митохондрии.
Реакции цикла Кребса. Ключевой реакцией цикла Кребса является образование цитрата из ацетил-СоА и оксалоацетата с помощью цитратсинтазы. При этом гидролизуется «богатая энергией» тиоэфирная связь и освобождается CoASH (рис. 101). Затем с помощью аконитазы цитрат изомеризуется в изоцитрат; интермедиатом в этой реакции является трикарбоновая кислота cis-аконитат.
На следующем этапе изоцитрат окислительно декарбоксилируется в α-кетоглутарат с помощью НАД-зависимой изоцитратдегидрогеназы. Интермедиатом в этой реакции является неустойчивая трикарбоновая кислота оксалосукцинат, которая существует в ферментносвязанной форме.
Затем α-кетоглутарат окислительно декарбоксилируется в сукцинил-СоА при помощи ферментного комплекса α-кетоглутаратдегидрогеназы. Эта реакция также является ключевой. Ее кофакторами служат:
— НАД:
— коэнзим А;
— переносчик ацильной группы липоевая (ε, ɳ-димеркаптооктоновая) кислота;
— переносчик кетольной группы тиаминпирофосфат (рис. 89);
— катионы Mg2+.
Сукцинил-СоА превращается в сукцинат под действием сукцинил-СоА-синтетазы. При этом регенерируется CoASH и (через стадию образования сукцинилфосфата; см. раздел 10.3) фосфорилируется ГДФ.
Далее из сукцината образуется фумарат с помощью мембраносвязанной ФАД- зависимой сукцинатдегидрогеназы. Полученные электроны прямо передаются убихинонному пулу.
На завершающем этапе стереоспецифичная фумаратгидратаза (фумараза) превращает фумарат в L-малат, а затем НАД-зависимая малатдегидрогеназа окисляет малат в оксалоацетат, и цикл замыкается (рис. 101).
Рис. 101. Окислительный цикл трикарбоновых кислот (цикл Кребса). Пунктиром изображен глиоксилатный шунт. 1 — цитратсинтаза; 2 — аконитаза; 3 — изоцитратде- гидрогеназа; 4 — α-кетоглутаратдегидрогеназа; 5 — сукцинил-СоА-синтетаза; 6 — сукцинатдегидрогеназа; 7 — фумараза; 8 — малатдегидрогеназа; 9 — изоцитратлиаза; 10 — малатсинтаза; 11 — фосфоэнолпируват- карбоксилаза; 12 — пируваткарбоксикиназа; 13 — цитратлиаза.
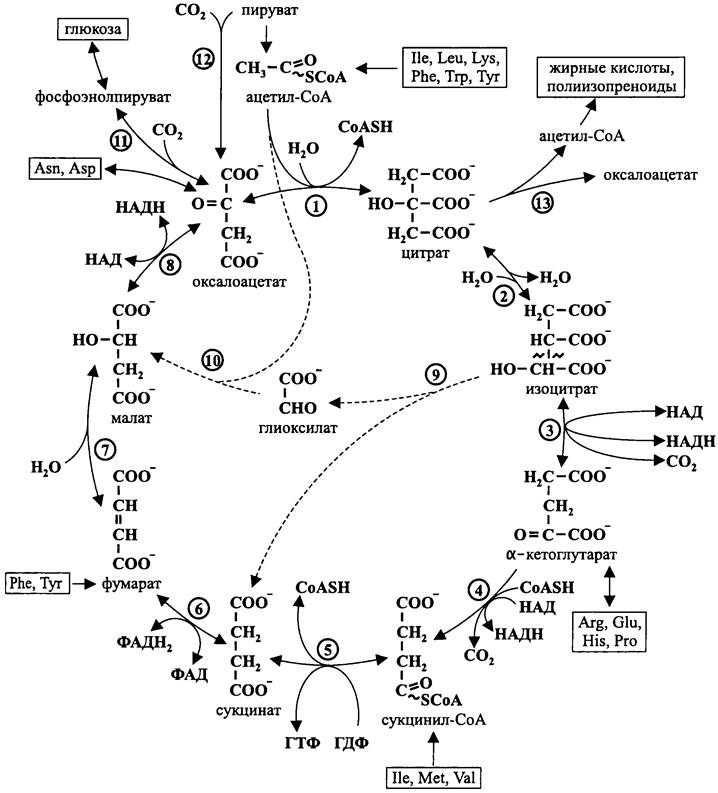
Следует отметить, что все реакции цикла Кребса, кроме а-кетоглутаратдегидрогеназной, обратимы.
Таким образом, суммарное уравнение цикла Кребса имеет вид:
ацетил-СоА + Н2О + 3НАД + ФАД + 5Н+ + ГДФ + Ф —> 2СO2 + CoASH + 3НАДН + ФАДН2 + ГТФ.
При условии, что свободная энергия Pmf полностью конвертируется в свободную энергию АТФ, максимальный энергетический выигрыш при окислении одной молекулы ацетата через цикл Кребса составит 12 молекул АТФ (3 x 3 за счет окисления дыхательной цепью трех молекул НАДН, 2 за счет окисления дыхательной цепью одной молекулы ФАДН2 и 1 за счет образования одной молекулы ГТФ).
Биосинтетическая функция цикла Кребса. Таким образом, окисление активированного ацетата до СO2 в цикле Кребса является самым эффективным путем энергетического метаболизма у гетеротрофных прокариотов. Оно позволяет окислять углеводы, жирные кислоты и аминокислоты путем вступления продуктов их катаболизма в цикл через ацетатную «горловину» или на стадии интермедиатов.
В свою очередь, цикл Кребса может быть источником субстратов для магистральных биосинтетических путей.
Биосинтетические реакции, потребляющие интермедиаты цикла Кребса, называются катаплеротпическими (англ. catapleurotic; от англ. catabolism и греч. plevra — боковая сторона; реакции, примыкающие к катаболическому процессу). Примерами катаплеротических реакций служит глюконеогенез, или биосинтез глюкозы, а также биосинтез жирных кислот (рис. 101).
Как уже указывалось, почти все реакции цикла Кребса обратимы, и некоторые его интермедиаты посредством восстановительного аминирования превращаются в аминокислоты (оксалоацетат в аспартат, α-кетоглутарат в глутамат).
Помимо биосинтеза белков и полипептидов, цикл Кребса может снабжать строительным материалом и другие ключевые биосинтезы (рис. 101):
— в результате расщепления цитрата с помощью цитратлиазы образуется ацетил- СоА, который используется для биосинтеза жирных кислот и полиизопреноидов (см. разделы 15.1.1 и 15.2);
— при декарбоксилировании оксалоацетата образуется фосфоэнолпируват, используемый при глюконеогенезе;
— из α-кетоглутарата образуется глутамат, используемый при биосинтезе тетра- пирролов (см. раздел 15.3).
Отток интермедиатов цикла Кребса на строительные нужды должен быть восполнен, в противном случае его действие приостановится.
Биосинтетические реакции, компенсирующие отток интермедиатов цикла Кребса, называются анаплеротическими (англ. anapleurotic; от англ. anabolism и греч. plevra — боковая сторона; примыкающие анаболические реакции). К анаплеротиче- ским реакциям в первую очередь принадлежит биосинтез оксалоацетата из пирувата с помощью пируваткарбоксикиназы и биосинтез оксалоацетата из фосфоэнолпирувата с помощью фосфоэнолпируват-карбоксилазы:
пируват + СO2 + АТФ —> оксалоацетат + АДФ + Ф, фосфоэнолпируват + СO2 + Н2O —> оксалоацетат + Ф.
Другими примерами анаплеротических реакций является вхождение в цикл аминокислот — аспартата и аспарагина (на уровне оксалоацетата); тирозина и фенилаланина (на уровне фумарата); аргинина, гистидина, глутамата и пролина (на уровне α-кетоглутарата).
По-видимому, в ходе эволюции метаболических путей цикл Кребса сформировался из отдельных реакций биосинтеза «не-незаменимых» аминокислот. Это означает, что энергетическая функция цикла Кребса вторична по отношению к его биосинтетической функции.
Интересно, что в ряде случаев у бактерий (примером служат все цианобактерии, а также уксуснокислые бактерии р. Gluconobacter) цикл Кребса не замкнут по причине изначального отсутствия или вторичной потери одного из двух ключевых ферментов, а именно α-кетоглутаратдегидрогеназы. В результате этого незамкнутые ветви цикла выполняют только конструктивную нагрузку.
Глиоксилатный шунт (цикл Корнберга). Цикл Кребса служит функциональным продолжением гликолиза и других путей образования пиру вата из гексоз. В качестве катаболического пути он эффективно действует при росте на углеводах, особенно в аэробных условиях.
При росте бактерий на ацетате, длинноцепочечных жирных кислотах и углеводородах у некоторых бактерий начинает функционировать вариант цикла Кребса — глиоксилатный шунт, или цикл Корнберга. Здесь также из ацетил- СоА и оксалоацетата образуется цитрат. Затем цитрат изомеризуется в изоцитрат; интермедиатом в этой реакции также является cis-аконитат.
Дальнейшая судьба изоцитрата иная, чем в цикле Кребса — он не окислительно декарбоксилируется в α-кетоглутарат, а расщепляется под действием изоцитратлиазы на глиоксилат (С2) и сукцинат (С4).
Затем при помощи малатсинтазы из глиоксилата и второй молекулы ацетил- СоА образуется малат. Он обычным путем превращается в оксалоацетат, и цикл замыкается (рис. 101).
За один оборот глиоксилатного шунта в результате ассимиляции двух молекул ацетата образуется сукцинат, который используется для биосинтеза оксалоацетата. Следовательно, глиоксилатный шунт выполняет анаплеротические функции. Наряду с этим он служит источником энергии (за один оборот регенерируется молекула НАДН).
Таким образом, основной функцией глиоксилатного шунта является быстрая утилизация субстратов (прежде всего липидов, жирных кислот и углеводородов), при катаболизме которых образуется ацетил-СоА. Кроме того, происходит накопление оксалоацетата, используемого для биосинтеза аминокислот. Наконец, глиоксилатный шунт поставляет материал для биосинтеза глюкозы. Это достигается путем превращения малата в пируват с помощью «декарбоксилирующей» малатдегидрогеназы, а оксалоацетата — в фосфоэнолпируват с помощью фосфоэнолпируват- карбоксилазы (см. выше).
Кроме бактерий, глиоксилатным шунтом обладают некоторые грибы и растения, накапливающие запасные липиды; у животных он не обнаружен.
В отличие от цикла Кребса, глиоксилатный шунт локализован не в митохондриях, а в специализированных органеллах — глиоксисомах. Образующийся сукцинат выходит в цитоплазму, превращается в оксалоацетат и используется при глюконеогенезе.
Регуляция ферментов глиоксилатного шунта. В отличие от конститутивных ферментов цикла Кребса, ферменты вспомогательного глиоксилатного шунта
индуцибельны. Они не синтезируются при росте на глюкозе, а образуются при попадании в среду, где единственным источником углерода служит ацетат (или соединение, в результате катаболизма которого образуется ацетат).
Если питательная среда содержит глюкозу и ацетат, то наблюдается явление диауксии —вначале утилизируется глюкоза, а после нее ацетат. Биосинтез изоцитратлиазы и малатсинтазы, ключевых ферментов глиоксилатного шунта, подавлен в результате так называемой катаболитной репрессии (см. III том учебника). Гены, ответственные за их биосинтез, активируются только после полного использования глюкозы.
11.4.2.2. Окислительный пентозофосфатный цикл, или цикл Варбурга —Диккенса — Хореккера
Наряду с гликолизом, существует второй важнейший способ катаболизма глюкозы— окислительный пентозофосфатный цикл (англ. oxydative pentose phosphate cycle, ОРС). Он был назван в честь Варбурга, который внес первоначальный вклад в его изучение в 1930-е годы, а также Диккенса и Хореккера, которые реконструировали его в конце 1950-х годов.
Другое название этого цикла — «гексозомонофосфатный цикл», поскольку в нем участвуют монофосфаты С3 — С7 сахаров, прежде всего гексоз.
Наконец, существует еще одно название этого цикла — «гексозомонофосфатный шунт», из которого следует, что он функционально заменяет цикл Кребса.
Окислительный пентозофосфатный цикл осуществляется при помощи цитозольных ферментов. Он широко распространен у эукариотов, в частности высших животных и растений. Среди прокариотов им обладают аэробно дышащие бактерии с полноценным (например, энтеробактерии из филы ВХII Proteobacteria) или незамкнутым (например, представители филы ВХ Cyanobacteria) циклом Кребса. Функционирование окислительного пентозофосфатного цикла у архей не показано.
Окислительный пентозофосфатный цикл (ОРС) не следует смешивать с окислительным пентозофосфатным путем (ОРР), который мы уже рассмотрели в разделе
11.3.2.3. Хотя в окислительном пентозофосфатном пути и в окислительном пентозофосфатном цикле принимают участие несколько общих реакций (см. ниже), на этом их сходство заканчивается. Линейный путь приводит к образованию побочного продукта — пирувата, а в полностью сбалансированном цикле гексоза окисляется до СО2, и восстановительные эквиваленты передаются на НАДФ.
Реакции окислительного пентозофосфатного цикла. Цикл Варбурга- Диккенса-Хореккера можно условно подразделить на две ветви — окислительную и неокислительную.
На окислительной ветви в цикл поступает молекула глюкозы, которая с помощью гексокиназы превращается в глюкозо-6-фосфат. Еще пять молекул глюкозо-6- фосфата имеют «эндогенное» происхождение и регенерируются на неокислительной ветви (рис. 102).
Все шесть молекул глюкозо-6-фосфата окисляются при помощи НАДФ-зависимой (см. рис. 103) глюкозо-6-фосфат-дегидрогеназы. При этом образуется 6-фосфо- глюконолактон — неустойчивое соединение, которое спонтанно или под воздействием фосфоглюконолактоназы гидролизуется в 6-фосфоглюконат. Нетрудно заметить, что такие же реакции происходят на пути Энтнера-Дудорова (см. раздел 11.3.2.2).
Следующая реакция окислительной ветви уникальна для данного цикла. Она катализируется НАДФН-зависимой «декарбоксилирующей» фосфоглюконат-дегидрогеназой и приводит к образованию кетопентозы — рибулозо-5-фосфата.
При переходе к неокислительной ветви 6 молекул рибулозо-5-фосфата превращаются в альдокетозу — ксилулозо-5-фосфат (с помощью фосфопентоэпимеразы) или в альдопентозу — рибозо-5-фосфат (с помощью фосфопентоизомеразы). Все три типа субстратов находятся между собой в динамическом равновесии:
ксилулозо-5-фосфат <-> рибулозо-5-фосфат <-> рибозо-5-фосфат.
На неокислительной ветви они рекомбинируют таким образом, что происходит регенерация пяти молекул глюкозо-6-фосфата (6С5 = 5С6).
В полностью сбалансированном цикле из шести молекул рибулозо-5-фосфата образуются четыре молекулы ксилулозо-5-фосфата и две молекулы рибозо-5-фосфата (рис. 102).
Две из четырех молекул ксилулозо-5-фосфата взаимодействуют с двумя молекулами рибозо-5-фосфата. Реакцию катализирует транскетолаза, переносящая гликольальдегидную группу -НСОН-СНО от рибозо-5-фосфата на ксилулозо-5-фоcфат. Полученные продукты, две молекулы альдотриозы (глицеральдегид-3-фосфата) и две молекулы кетогептозы (седогептулозо-7-фосфата), превращаются в две молекулы альдотетрозы (эритрозо-4-фосфата) и две молекулы кетогексозы (фруктозо-6-фосфата). Данную реакцию катализирует трансальдолаза, переносящая ди- оксиацетоновую группу -СНОН-СО-СН2ОН от седогептулозо-7-фосфата на глице- ральдегид-3-фосфат.
Две молекулы фруктозо-6-фосфата направляются в начало цикла (рис. 102), а две молекулы эритрозо-4-фосфата взаимодействуют с двумя оставшимися молекулами ксилулозо-5-фосфата с образованием двух молекул фруктозо-6-фосфата и двух молекул глицеральдегид-3-фосфата. Эту реакцию катализирует транскетолаза, переносящая кетоальдегидную группу -СО-СНО от ксилулозо-5-фосфатана эритрозо- 4-фосфат. Таким образом, еще две молекулы фруктозо-6-фосфата направляются в начало цикла (рис. 102).
Рис. 102. Окислительный пентозофосфатный цикл (цикл Варбурга-Диккенса- Хореккера). 1 — гексокиназа; 2 — глюкозо-6-фосфат-дегидрогеназа; 3 — фосфоглкжонолактоназа; 4 — фосфоглюконат-дегидрогеназа; 5 — фосфопентоэпимераза; 6 — фосфопентоизомераза; 7 — транскетолаза; 8 — трансальдолаза; 9 — триозофосфатизомераза; 10 — альдолаза; 11 — фосфатаза; 12 — гексозофосфатизомераза.
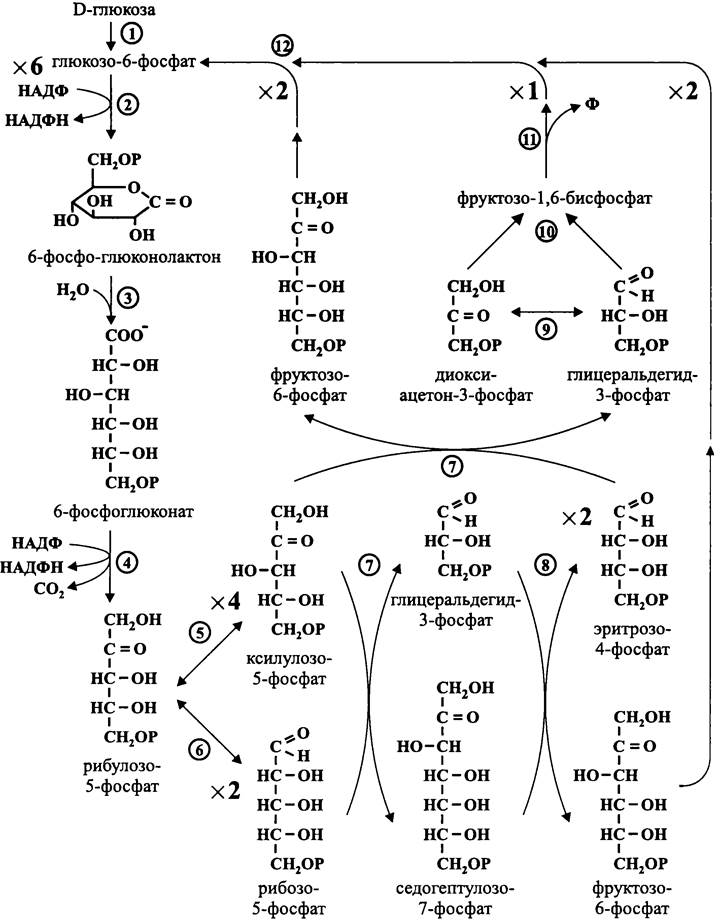
Под воздействием триозофосфатизомеразы молекула глицеральдегид-3-фосфата превращается в молекулу диоксиацетон-3-фосфата, после чего при помощи альдолазы и фосфатазы образуется пятая молекула фруктозо-6-фосфата.
Все пять молекул фруктозо-6-фосфата, полученные на неокислительной ветви, с помощью гексозофосфатизомеразы превращаются в пять молекул глюкозо-6-фосфата и вместе с «экзогенной» молекулой глюкозо-6-фосфата замыкают цикл.
Таким образом, суммарное уравнение цикла Варбурга-Диккенса-Хореккера имеет вид:
6 х глюкозо-6-фосфат + 12НАДФ + 7Н2О —> 5 х глюкозо-6-фосфат + 6СО2 + 12НАДФН + Ф.
Функции окислительного пентозофосфатного цикла. У бактерий цикл Варбурга-Диккенса-Хореккера является эффективным способом получения энергии при катаболизме таких широко распространенных углеродсодержащих субстратов, как глюкоза и глюконат. Подобно циклу Кребса, он снабжает дыхательную цепь восстановительными эквивалентами (в данном случае НАДФН, а не НАДН), что позволяет ассимилировать энергию в форме Рmf. Однако, в отличие от цикла
Кребса, в нем не происходит фосфорилирование нуклеозидцифосфатов. Напротив, для активации глюкозы затрачивается АТФ.
Потенциальная энергетическая эффективность окислительного пентозофосфатного цикла очень высока — при расчете, что окисление одной молекулы НАДФ дает три молекулы АТФ, она составляет 36 (3 х 12) молекул АТФ на молекулу нефосфорилированной глюкозы.
Окислительный пентозофосфатный цикл является связующим звеном при метаболизме гексоз и пентоз, поскольку глицеральдегид-3-фосфат и фруктозо-6-фосфат, образующиеся на неокислительной ветви, могут использоваться в гликолитическом пути Эмбдена-Мейергофа-Парнаса. Благодаря транскетолазе и трансальдолазе бактерии получают возможность катаболизировать пентозы — арабинозу, ксилозу и рибозу.
Многие восстановительные процессы специфически зависят от НАДФН, и окислительный пентозофосфатный цикл является наиболее эффективным способом его регенерации у гетеротрофов (12 молекул на одну молекулу полностью окисленной глюкозы).
Наконец, что особенно важно, окислительный пентозофосфатный цикл служит источником субстратов для тех биосинтезов, в которых участвуют тетрозы, пентозы и гептозы:
— эритрозо-4-фосфат является предшественником шикимовой кислоты, на основе которой синтезируются ароматические аминокислоты (тирозин и фенилаланин), а также предшественником гетероциклических витаминов, в частности пиридоксина (витамина В6);
— рибулозо-5-фосфат является предшественником гистидина и триптофана, а также нуклеотидов и витаминов, в частности рибофлавина (витамина В2); после превращения в арабинозо-5-фосфат он используется для синтеза кетодезоксиоктулозоновой кислоты (КДО), входящей в костяк эндотоксина, или липополисахарида грамотрицательных бактерий;
— седогептулозо-7-фосфат используется для образования гептозы, входящей в состав кор-олигосахарида грамотрицательных бактерий (см. I том учебника).
По-видимому, изначально цикл Варбурга-Диккенса-Хореккера был предназначен для получения пентоз, необходимых для биосинтеза нуклеиновых кислот. На этом основании его следует рассматривать как более архаичную метаболическую систему — по сравнению с гликолизом и его вариантами, которые в основном используются для получения энергии.
Регуляция ферментов цикла Варбурга-Диккенса-Хореккера. В 1980 — 1995 гг. были картированы, клонированы и секвенированы гены, кодирующие ферменты окислительного пентозофосфатного пути у Е. coli. Выяснилось, что кроме фосфопентоэпимеразы и транскетолазы все они организованы в моноцистронный оперон.
За исключением фосфопентоизомеразы все ферменты окислительного пентозофосфатного пути синтезируются конститутивно. Помимо конститутивной фосфопентоизомеразы (RpiA) Е. coli экспрессирует индуцибельную фосфопентоизомеразу (RpiB). Последняя появляется только при росте на рибозе или соединениях, при катаболизме которых образуется рибоза, в частности на аденозине или уридине. Механизм контроля точно неизвестен, хотя предполагается, что его осуществляет негативный регулятор RpiR.
Завершая этот раздел, еще раз напомним, что в циклах Кребса и Варбурга- Диккенса-Хореккера регенерируются восстановленные формы кофакторов дегидрогеназ — ФАДН2, НАДН и НАДФН. Они служат посредниками между органическим донором электронов и дыхательной цепью.
11.4.3. Посредники между органическим донором электронов и дыхательной цепью
При дыхательной органотрофии энергия с помощью электрон-транспортной цепи ассимилируется в форме Рmf.
Посредниками между органическим донором электронов и дыхательной цепью (точнее сказать — посредниками между органическим донором электронов и убихинонным пулом, который взаимодействует с цитохром bс1(b6f)-комплексом) служат коферменты дегидрогеназ.
К их числу относятся пиридиновые нуклеотиды НАД(Ф) и флавиновый нуклеотид ФАД.
НАД(Ф). В начале 1930-х годов Отто Варбург впервые выделил и получил в кристаллическом виде важнейшие ферменты метаболизма глюкозы. К концу 1930-х годов он установил, что некоторые из них используют в качестве коферментов пиридиновые нуклеотиды — НАД, или никотинамид-адениндинуклеотид и НАДФ, или никотинамид-адениндинуклеотид-фосфат (рис. 103).
Рис. 103. НАД(Ф). Двойной стрелкой указано место обратимого восстановления/протонирования.
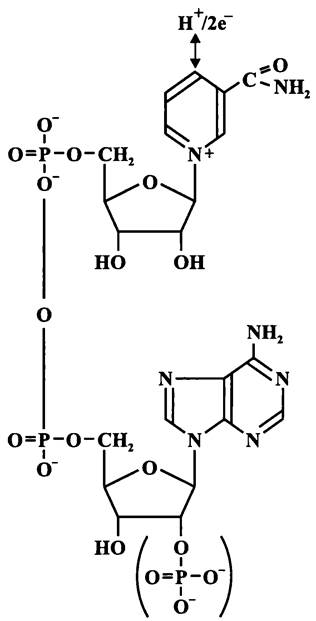
Позже выяснилось, что НАД выполняет роль кофермента для самых разнообразных цитозольных дегидрогеназ и передает электроны, полученные от окисленного органического субстрата, НАДН-дегидрогеназе, а она — дыхательной цепи.
Что касается НАДФН, то этот кофермент либо неспецифически окисляется НАДН-дегидрогеназой, либо предварительно восстанавливает НАД в трансгидро- геназной реакции: НАДФН + НАД —> НАДФ + НАДН.
ФАД. Флавинадениндинуклеотид (рис. 104) открыл и идентифицировал в качестве кофермента в середине 1930-х годов Отто Варбург. Он служит простетической группой для специфической мембраносвязанной дегидрогеназы — сукцинатдегидро- геназы (см. ниже), которая катализирует реакцию: сукцинат + ФАД <-> фумарат + ФАДН2.
НАДН -дегидрогеназа. Ферменты, относящиеся к группе НАДН-дегидрогеназ (НАДН: хинон-оксидоредуктаз), функционируют в донорном, или низкопотенциальном участке дыхательной цепи.
В зависимости от наличия или отсутствия сайта сопряжения НАДН-дегидрогеназы подразделяются на две группы. Те из них, которые имеют сайт сопряжения (т. е. создают трансмембранный электрохимический потенциал), обозначаются как НАДН-дегидрогеназы-1, а те, которые не имеют сайта сопряжения — как НАДН- дегидрогеназы-2.
НАДН-дегидрогеназа-1 встречается у бактерий, архей и митохондрий. Она представляет собой мультиполипептидный комплекс. Наиболее сложно устроена митохондриальная НАДН-дегидрогеназа-1, или «комплекс I». Это один из самых больших мембранных комплексов (45 гетерологичных субъединиц общей молекулярной массой около 103 кДа); из всех компонентов дыхательной цепи только она еще не подвергалась рентгеноструктурному анализу. Ее простетическими группами являются нековалентно связанный ФМН и до девяти [FеnSn]-кластеров, которые ковалентно взаимодействуют с остатками Суs отдельных субъединиц. Митохондриальная НАДН-дегидрогеназа создает Рmf, но не Smf.
Бактериальные НАДН-дегидрогеназы-1, в разной степени охарактеризованные у Е. coli, Klebsiella pneumoniae, Paracoccus denitrificans, Rhodobacter capsulatus и Thermus thermophilus,состоят «только» из 14 субъединиц суммарной молекулярной массой 500 кДа. Анализ бактериальной НАДН-дегидрогеназы-1 не менее проблематичен, чем для митохондрий. Это связано с нестабильностью данного фермента in vitro, а также со сложностью получения мутантов, поскольку все его структурные гены кодируются и регулируются одним опероном. Бактериальная НАДН-дегидрогеназа-1 может создавать и Pmf, и Smf.
НАДН-дегидрогеназа-2 состоит только из одного полипептида. Она не содержит [FenSn]-кластеров и нечувствительна к антагонистам хинонов капсаицину, пиерицидину и ротенону, которые ингибируют НАДН-дегидрогеназу-1.
Рис. 104. ФАД (ФМН), присоединенный ковалентной связью к апопротеину. Пунктирной рамкой выделен обратимо восстанавливающийся участок в сопряженной изоаллоксазиновой трициклической системе.
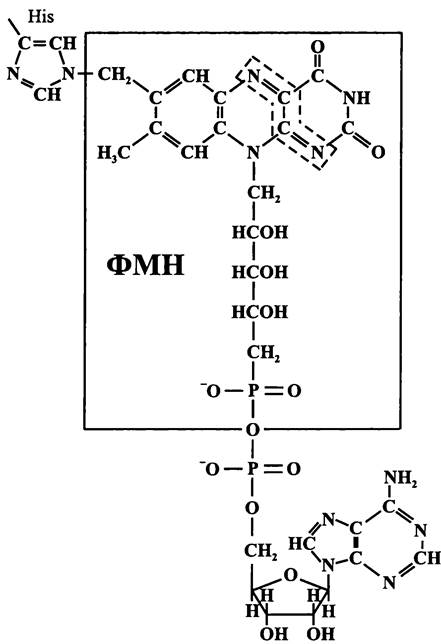
Данные про НАДН-дегидрогеназу архей фрагментарны и получены лишь для Halobacterium salinarium и Sulfolobus acidocald. arius. Неизвестно, способны ли эти археотные ферменты окислять субстрат сопряженно с образованием трансмембранного электрохимического потенциала. В секвенированных геномах термоацидофильных и метаногенных архей выявлены нуклеотидные последовательности, сходные со структурными генами НАДН-дегидрогеназы-1. Однако они могут оказаться псевдогенами, т. е. неэкспрессируемыми участками ДНК, которые гомологичны полноценным бактериальным или митохондриальным генам.
НАДН-дегидрогеназа-1 состоит из двух доменов — мембранного и цитоплазматического. Ее форма варьирует у разных объектов и может быть L-, О- или U- образной. В функциональном отношении фермент подразделяется на три модуля — НАДН-дегидрогеназный, гидрогеназный и транспортный.
Дегидрогеназный модуль у бактерий представлен субъединицей NuoF (51 кДа) с двумя простетическими группами — ФМН и [Fе4S4]-кластером, который обозначается как N3(рис. 105). Флавиновая группа имеет редокс-потенциал -336 мВ и служит входными воротами для электронов, поступающих от НАДН. Кроме того, двухэлектронный донор (НАДН) при посредничестве ФМН приобретает способность взаимодействовать с одноэлектронным переносчиком ([Fe4S4]-кластером).
Рис. 105. НАДН-дегидрогеназа. NuoB, NuoC, NuoD, NuoE, NuoF, NuoG и NuoI — периферические субъединицы; ND1, ND2, ND4 и ND5 — интегральные субъединицы; N1a, N1b, N2, N3, N4, N5, N6a и N6b — железо-серные кластеры; Q — хинон.
Гидрогеназный модуль называется так поскольку две его субъединицы, восстанавливающие убихинон, гомологичны двум субъединицам NiFe-гидрогеназы (см. раздел 11.4.4.4).
В зависимости от источника фермента гидрогеназный модуль содержит разное количество бинуклеарных [Fe4S4]-кластеров и тетрануклеарных [Fe4S4]-кластеров, которые обозначаются как N1a, N1b, N1c, N2, N4, N6a и N6b. Субъединица NuoE (24 кДа) связывает бинуклеарный [Fe2S2]-кластер N1a, который имеет редокс-потенциал -370 мВ и используется в качестве вторичного акцептора электронов, поступающих от кластера N3. Субъединица NuoG (75 кДа) содержит бинуклеарный [Fе2S2]-кластер N1b и тетрануклеарные [Fe4S4]-кластеры N4 и N5, редокс-потенциал которых составляет—250 мВ, из-за чего их называют «изопотенциальными». В некоторых случаях в полипептидной цепи субъединицы NuoE присутствует дополнительный остаток Cys, который присоединяет четвертый кластер —N1с, скорее всего, бинуклеарного [Fe2S2]-типа. Субъединица NuoI (25 кДа) содержит два тетрануклеарных [Fe4S4]-кластера — N6a и N6b, которые аналогичны [Fe4S4]/[Fe4S4]- кластерам 8Fe-ферредоксинов (см. раздел 10.4.1). Электроны от кластера NuoE передаются по цепочке NuoG —> NuoI —> NuoB (рис. 105).
Каталитический центр гидрогеназного модуля находится на стыке субъединиц NuoB (30 кДа) и NuoD (49 кДа). Субъединица NuoB гомологична малой субъединице NiFe-гидрогеназы. Она связывает [Fe4S4]-кластер N2, редокс-потенциал которого составляет -150 мВ, и непосредственно восстанавливает убихинон. Субъединица NuoD гомологична большой субъединице NiFe-гидрогеназы. Она не содержит простетических групп и только образует «карман» для убихинона.
Восстановленный убихинон поступает в липидный матрикс мембраны, а затем окисляется цитохром bc1-комплексом.
Транспортный модуль, состоящий из гетерологичных гидрофобных субъединиц ND1, ND2, ND4 и ND5, по-видимому, играет ключевую роль в создании трансмембранного электрохимического потенциала. Механизм, с помощью которого одновременно с восстановлением убихинона через мембрану переносятся протоны или катионы Na+, еще не выяснен. Скорее всего, при восстановлении убихинона кластером N2в гидрогеназном модуле возникают конформационные изменения. Они передаются гидрофобным субъединицам, которые произошли от Nа+/Н+-антипортеров и выступают в качестве протонных помп.
Сукцинатдегидрогеназа. Этот мембраносвязанный фермент (англ. succinate dehydrogenase, Sdh) имеется у всех аэробных организмов.
Sdh («комплекс II» митохондрий) — это единственный мембраносвязанный фермент цикла Кребса. Его активный центр находится на цитоплазматической стороне СМ. Эндогенный сукцинат окисляется в фумарат (стандартный редокс-потенциал пары +113 мВ).
Sdh состоит из растворимой «каталитической» субъединицы SdhA (70 кДа) с простетической группой ФАД (рис. 104), амфипатической «коннекторной» субъединицы SdhB (27 кДа) с простетической группой [Fе2S2] и интегральной «якорной» субъединицы SdhC (15 кДа) с простетической группой [FenSn]. В некоторых случаях имеется дополнительная «якорная» субъединица SdhD (13 кДа). От сукцината электроны передаются по цепочке субъединиц SdhA —> SdhB —> SdhC и затем поступают в убихинонный пул.
Сукцинатдегидрогеназа, наряду с мембраносвязанной фумаратредуктазой (англ. fumarate reductase, Frd; см. раздел 11.4.5.1), имеющейся у факультативных и облигатных анаэробов, принадлежит к суперсемейству флавиновых железопротеинов. Если бактерия, например, Е. coli, образует оба фермента, то сукцинатдегидрогеназа репрессируется в анаэробных, а фумаратредуктаза — в аэробных условиях. Кроме этого, Sdh репрессируется при аэробном росте на глюкозе.
Sdh и Frd катализируют одну и ту же реакцию: сукцинат ⇄ фумарат + 2е- /2Н+, однако в первом случае равновесие смещено в сторону окисления сукцината, а во втором — в сторону восстановления фумарата.
Каталитические субъединицы «аэробной» Sdh и «анаэробной» Frd Е. coli взаимно гомологичны, что указывает на их общее происхождение, хотя они не проявляют иммунологического родства друг с другом. Они различаются по сродству к сукцинату и фумарату, катализируют реакцию преимущественно в одном из двух противоположных направлений и специфически регулируются на генном уровне.
Не исключено, что функциональная гетерогенность этих ферментов связана с особенностями лигандирования [FenSn]-кластеров коннекторными субъединицами SdhB и FrdB. В частности, бинуклеарный [Fe2S2]-кластер субъединицы SdhB лигандируется только тремя остатками Cys, а четвертым лигандом служит остаток Asp-62. Разнонаправленность действия сукцинатдегидрогеназы и фумаратредуктазы также связана с гетерологичной структурой якорных субъединиц SdhCD и FrdCD.
На этом мы оставляем тему, посвященную органическим донорам электронов для дыхательной цепи, и переходим к неорганическим донорам.
11.4.4. Неорганический донор электронов
При дыхательной литотрофии, или хемолитотрофии энергоносителями служат разнообразные неорганические субстраты, в том числе и углеродсодержащие (использование метильной группы и формальдегида метилотрофными бактериями является одним из типов хемолитотрофии).
Хемолитотрофия нередко сопровождается углеродной автотрофией. В этом случае в конструктивных целях ассимилируются неорганические субстраты — СО2, НСО3-, НСОО-, СО, НСНО, а также «неорганическая» метальная группа соединений типа СН3—X—К, (где X — атом азота, кислорода или серы).
Из истории открытия хемолитотрофии и хемосинтеза. Нитрификация, или накопление селитры в богатой азотом разлагающейся органике (навозе, птичьем помете, компостных кучах и т. д.) известна с незапамятных времен. Этот спонтанный процесс использовался в технике и сельском хозяйстве задолго до того, как стал понятен его биологический смысл и был изучен его молекулярный механизм.
В 1877 г. Шлезинг (Т. Schloesing) и Мюнц (A. Muntz) установили, что нитрификацию вызывают живые микроорганизмы. Для этого было достаточно проинкубировать опытный и контрольный (простерилизованный) образец сточной воды или почвы, а затем сравнить количество образовавшейся селитры. В начале 1880-х годов Уорингтон (R. Warrington) установил, что нитрификация происходит в два этапа — сначала аммиак, образующийся при аммонификации, окисляется до нитрита, а затем нитрит окисляется до нитрата. Однако физиологический смысл этого процесса оставался загадкой.
В 1886-1888 гг. С. Н. Виноградский провел тщательное микроскопическое наблюдение за бесцветной серной бактерией Beggiatoa alba и хламйдобактерией Leptothrix ochraceae в препаратах типа «висячей капли» и сопоставил их развитие с динамикой потребления сероводорода и закисного железа. В результате он пришел к революционному выводу, что окисление этих субстратов является физиологическим эквивалентом дыхания с использованием органических веществ. По предложению Вильгельма Пфеффера такие биологические реакции были названы аноргоксидацией (греч. ат — не, organikos — органический, oxis — кислый; окисление неорганических веществ с целью получения энергии). Значение открытия Виноградского было огромным, поскольку единственным абиогенным источником энергии для живых организмов до этого считали видимый свет.
Последовательно применяя придуманный им метод элективных сред, Виноградский выделил в 1890 г. хемолитоавтотрофных бактерий Nitrosomonas и Nitrobacter, для которых источником энергии служит соответственно аммиак и нитрит, а строительным материалом — диоксид углерода. По аналогии с фотосинтезом, Пфеффер назвал такой тип питания хемосинтезом (греч. chemeja —химия, synthesis — соединение; образование органических веществ из неорганических за счет использования энергии окисления неорганических веществ).
В настоящее время хемосинтезу можно дать следующее определение.
Хемосинтез — это сочетание хемолитотрофии (ассимиляции энергии, освобождающейся при ферментативном окислении неорганического субстрата) с углеродной автотрофией (ассимиляцией неорганических соединений углерода).
Из истории изучения хемолитотрофии у бактерий. Работы С. Н. Виноградского с бесцветными серными бактериями, железобактериями и нитрифицирующими бактериями положили начало изучению биоразнообразия хемолитотрофов и хемосинтетиков.
В начале 1890-х годов В.Т. Шевяков описал одноклеточную серную бактерию Achromatium охaliferum, относящуюся к числу некультивируемых форм (англ. viable but not culturable, VBNC). В 1907 г. Лаутерборн (R. Lauterborn) выделил другого представителя VBNC — окисляющую сероводород нитчатую бактерию Thioploca. Приоритет открытия серуокисляющих тионовых бактерий из рода Thiobacillus принадлежит Мартинусу Бейеринку (М. Beijerinck), который в 1904 г. сообщил об их получении в чистой культуре.
В 1931 г. Стикленд установил, что анаэробные сульфатредуцирующие бактерии способны к водородной хемолитотрофии. Позднее было показано, что энергию окисления водорода могут ассимилировать и аэробные бактерии из родов Alcaligenes, Bacillus, Mycobacterium и Pseudomonas. В 1976 г. Г. А. Заварзин открыл физиологически близких к аэробным водородным бактериям аэробных карбоксидобактерий, которые используют монооксид углерода в качестве источника энергии и конструктивного субстрата. Анаэробных карбоксидобактерий описал Зейкус (J. G. Zeikus) в 1983 г.
В середине 1980-х годов Вуд (Н. G. Wood) раскрыл механизм, с помощью которого водородокисляющая бактерия Clostridium thermoaceticum автотрофно синтезирует ацетат. В настоящее время этот метаболический путь называют «путем Вуда».
Метилотрофных бактерий, использующих метан, метанол или другие одноуглеродные соединения в качестве источника энергии и конструктивного субстрата, обнаружил Зенген (N. L. Sôngen) в 1906 г. Однако до 1970-х годов отсутствовали сведения о распространении этих бактерий в природе и их роли в цикле углерода; были также неизвестны их физиологические свойства и биоразнообразие.
Во второй половине 1970-х годов, в первую очередь благодаря исследованиям Квайла (J. R. Quayle), были реконструированы два пути автотротрофной ассимиляции формальдегида метилотрофами — рибулозомонофосфатный путь, или «путь Квайла», и сериновый путь.
До недавнего времени микробное окисление метана рассматривали как облигатно аэробный процесс. Однако в 2002 г. Михаэлис (W. Michaelis) установил, что микробные маты на дне Черного моря, образованные археями и сульфатредуцирующими бактериями, окисляют метан в анаэробных условиях.
Во второй половине 1990-х годов стали поступать сообщения о двух ранее неизвестных типах бактериальной хемолитотрофии. Ван де Грааф (A. A. van de Graaf) обнаружил процесс анаэробного окисления аммиака нитритом, теоретическую возможность которого предсказал в 1977 г. австрийский биохимик Энгельберт Брода (Е. Broda). Одновременно с этим Видцель (F. Widdel) открыл процесс анаэробного окисления закисного железа нитратом.
Из истории изучения хемолитотрофии у архей. В 1776 г. итальянский физик Алессандро Вольта (A. Volta) описал природное явление, связанное с образованием «взрывчатого воздуха» в болотах и речных илах. На рубеже XIX-XX вв. Зенген, В. Л. Омелянский и Хоппе-Зейлер (F. Hoppe-Seyler) установили, что этот процесс связан с жизнедеятельностью микроорганизмов.
До середины XX в. метаногенов относили к разным группам гетеротрофных бактерий и интерпретировали метаногенез как облигатно анаэробное «метановое брожение». В частности, В. Л. Омелянский в 1902 г. предположил, что в качестве исходного субстрата используется целлюлоза. Однако в 1967 г. было доказано, что выделенная им культура («Methanobacillus omelianskii») представляет собой симбиотическую ассоциацию бактерии, окисляющей этанол до ацетата и водорода, и метаногенного археота, который восстанавливает углекислоту водородом. Такое взаимодействие, или «межвидовой перенос водорода», широко распространено у анаэробов; оно устраняет торможение катаболического процесса конечным продуктом и служит одним из краеугольных камней микробной экологии (см. раздел 11.3.4.2).
В 1936 г. Баркер (Н. А. Вагкег) выяснил, что метаногенные прокариоты восстанавливают диоксид углерода до метана, используя в качестве донора электронов молекулярный водород или монооксид углерода. В 1940 г. он доказал это путем радиоуглеродного анализа с применением короткоживущего изотопа 11С. В 1948 г. Басвелл (А. М. Buswell) и Солло (F.W. Sollo) установили, что предшественником метана помимо углекислоты может быть метанол или метильная группа ацетата. В 1956 г. Баркер пришел к выводу, что общим таксономическим признаком этих микроорганизмов служит уникальная способность к образованию метана, и на этом основании отнес их к «бактериальному» семейству Methanobacteriaceae.
Работа с облигатно анаэробными метаногенами связана с техническими сложностями, и только в 1947 г. Схнеллен (С. G.T. P. Schnellen) сумел выделить чистые культуры Methanobacterium formicicum и Methanosarcina barkeri. По методике, которую в 1976 г. разработали Белч (W. Е. Balch) и Вулф (R. S. Wolfe), метаногенов выращивают на газовой смеси из углекислоты и водорода (1:4) под давлением 0,2 мПа.
Метаногенные археи подразделяются на две подгруппы — «автотрофные», или «гидрогенотрофные» (восстанавливающие СО2 за счет окисления молекулярного водорода либо формиата) и «гетеротрофные», или ацетокластические (расщепляющие ацетат). Помимо ацетата субстратами гетеротрофного метаногенеза могут быть метанол, метилированные амины или метионин (см. раздел 11.4.5.5).
Используя сравнительно узкий круг субстратов, метаногены занимают разнообразные экологические ниши: осадки, илы, пресноводные и солоноватые водоемы, гидротермальные источники и геотермальные поля. Кроме того, они могут вступать в эктосимбиоз с животными (в пищеварительном тракте широкого круга объектов — от насекомых до млекопитающих) и растениями (в стволах некоторых видов сем. Salicaceae), а также в эндосимбиоз с анаэробными протистами.
Смит (Р. Н. Smith) и Хангейт (R. Е. Hungate) выделили в 1958 г. из рубца жвачных первого экто- симбиотического метаногена — Methanobacterium ruminantium. В начале 1980-х годов ван Бругген (J. J. A. van Brüggen) обнаружил, что Methanobacterium formicicum является факультативным цитоплазматическим эндоцитобионтом некоторых амеб и ресничных инфузорий.
Большинство метаногенных архей — это мезофилы, однако среди них встречаются термофильные и даже гипертермофильные формы. В 1981 г. Штеттер (К. Stetter) выделил из почвы сольфатар на побережье Исландии термофила Methanothermus, максимальная температура роста которого составляет 97°С. Первого морского гипертермофильного метаногена Methanococcus ther- molithotrophicus, имеющего оптимум роста 85°С, обнаружил Хубер (Н. Huber) в подводных гидротермах у побережья Италии в 1982 г.
Фундаментальный путь метаногенеза был расшифрован главным образом в результате пионерских исследований Ральфа Вулфа. В 1960-х годах были идентифицированы уникальные кофакторы этого процесса: меркаптоэтансульфонат (СоМ), деазафлавин (F420), тетрагидрометаноптерин (F342), кобальт-тетрапиррол (F430), метанофуран и меркаптогептаноил-треонинфосфат (СоВ). В настоящее время охарактеризованы все ферменты, участвующие в автотрофном биосинтезе метана из СО2 и Н2. Пять из них получены в виде кристаллических препаратов; определена их третичная структура и выяснен механизм катализа (см. раздел 11.4.5.5).
Помимо хемолитотрофов-метаногенов существуют хемолитотрофные археи, относящиеся к сборной группе термоацидофилов. После появления в 1977 г. «археотной» концепции Карла Воза (С. R. Woese) они вызывают устойчивый интерес, что приводит к открытию все новых и новых форм. Особенно это касается гипертермофилов, число известных видов которых уже больше сотни (по определению это такие формы, оптимум роста которых составляет 80-100°С; в отличие от умеренных термофилов они не размножаются при температуре ниже 60°С). Местами обитания гипертермофилов служат гидротермы и геотермы, а также антропогенные термогидросистемы.
Браэрли (J. A. Brierley) выделил в 1966 г. из кислого горячего источника в Йеллоустоунском национальном парке (США) первого представителя рода Sulfolobus. Независимо от него Брок (Т. Brock) получил в 1970 г. ряд изолятов этого серуокисляющего термофильного микроорганизма, оптимум роста которого около 87° С. Многочисленных представителей гипертермофильных серазависимых (т. е. окисляющих или восстанавливающих элементную серу) ацидофилов, относящихся к родам Desulfurococcus, Thermococcus, Thermofilum и Thermoproteus, выделил в 1981-1983 гг. Циллиг (W. Zillig) из наземных и подводных термальных источников, грязевых вулканов и почв сольфатар на Азорских о-вах и у побережья Исландии.
11.4.4.1. Основы хемолитотрофии
При дыхательной литотрофии энергия ассимилируется в форме Рmf и/или Smf.
Механизм хемолитотрофии. Биохимическая суть хемолитотрофии та же, что и у хемоорганотрофии — в обоих случаях происходят дегидрогеназные реакции. Однако между этими двумя вариантами хемотрофного метаболизма есть существенные различия.
Во-первых, при хемолитотрофии свободная энергия ассимилируется только в форме трансмембранного электрохимического потенциала, тогда как при хемоорганотрофии она может ассимилироваться и в форме трансмембранного электрохимического потенциала, и в форме фосфагена (см. раздел 10.1).
Во-вторых, неорганические субстраты окисляются только за пределами цитоплазматического компартмента — в соответствии с механизмом экстрацитоплазматического окисления «простых» субстратов (см. раздел 10.4.7), в то время как органические субстраты могут окисляться и в цитоплазме, и в периплазме.
Энергетический смысл хемолитотрофии заключается в том, что окисление терминального донора электронов и восстановление терминального акцептора электронов происходят в разных компартментах — периплазматическом и цитоплазматическом. В результате этих реакций периплазматический компартмент обогащается протонами, а из цитоплазмы они удаляются, и таким путем создается Рmf (см. рис. 78).
Необходимые условия для хемолитотрофии. Таковыми являются:
— энергетическая эффективность экзергонической окислительной реакции (∆G°' должно быть <0, и по абсолютной величине достаточным, чтобы поддерживать сопряженные эндергонические процессы);
— присутствие неорганического субстрата у поверхности СМ или ОМ в концентрации, необходимой для оптимальной активности дегидрогеназы (если субстрат легко подвержен абиотическому окислению, то он должен регенерироваться партнерами хемолитотрофа по экосистеме);
— гидрофильность неорганического субстрата (если он липофилен, то требуется транспортная система или иные механизмы, обеспечивающие его контакт с активным центром дегидрогеназы);
— резистентность хемолитотрофа к токсическому шоку, который может вызвать неорганический субстрат или продукты его окисления.
Для одних неорганических субстратов все перечисленные условия соблюдаются, что приводит к широкому распространению отдельных хемолитотрофных бактерий (например, тионовых) или архей (например, метаногенных). Другие неорганические субстраты по тем или иным причинам малодоступны, что ограничивает распространение соответствующих групп хемолитотрофов. В некоторых случаях рост хемолитотрофов за счет специфической окислительно-восстановительной реакции удается продемонстрировать только в лабораторных условиях.
Поскольку акцептором электронов в хемолитотрофном процессе не обязательно служит кислород, скрининг хемолитотрофов в последнее время все чаще проводят в анаэробных нишах. Необходимой (но не достаточной) предпосылкой искомого процесса служит высокое значение редокс-потенциала предполагаемого акцептора электронов.
Типы хемолитотрофии. В соответствии с преобладающим типом окисляемого неорганического субстрата можно назвать несколько групп хемолитотрофных прокариотов (табл. 12).
Таблица 12. Типы и распространение хемолитотрофии
Донор электронов |
Группа прокариотов |
|
Бактерии |
Археи |
|
Углеродная хемолитотрофия |
||
С1-субстрат: СН4, СН3—Х*-R; НСНО; НСОО-; СО |
Метано- и метил отрофные; формиатокисляющие; карбоксидотрофные |
Метилотрофные метаногены |
Водородная хемолитотрофия |
||
Н2 |
Водородные; ацетогены, карбоксидотрофные |
Водородные; гидрогенотрофные метаногены |
Азотная хемолитотрофия |
||
N1 -субстрат: NН3; NО-2 |
Нитрифицирующие |
-** |
Серная хемолитотрофия |
||
S-субстрат: |
Бесцветные серные; |
Серазависимые; |
S0; S2-, -SО3-(S)n-SО-3; SО2-3; S2О2-3 |
тионовые |
Thermoplasma acidophilum |
Железная хемолитотрофия |
||
Fе2+ |
Железоокисляющие |
Ferroplasma acidiphilum |
Марганцевая хемолитотрофия |
||
Мn2+ |
Марганецокисляющие |
|
Фосфорная хемолитотрофия |
||
Р(III) |
Штамм FiРS-3 (класс «Deltaproteobacteria») |
— |
Мышьяковая хемолитотрофия |
||
Аs(III) |
Штамм МLНЕ-1 (класс « Саmmaproteobacteria») |
— |
Хемолитотрофия с использованием других металлов или металлоидов |
||
Сu+ |
Аcidithiobacillusferrooxidans |
— |
Sb(III) |
Аt. ferrooxidans |
— |
Sn2+ |
Аt. ferrooxidans |
— |
U(IV) |
Аt. ferrooxidans |
— |
* — атом азота, кислорода или серы; ** — данный тип хемолитотрофии не обнаружен.
Классические типы хемолитотрофии — углеродная, водородная, азотная, серная, железная и марганцевая. В настоящее время к ним добавились фосфорная и мышьяковая литотрофия.
Способностью к фосфорной хемолитотрофии обладает штамм FiPS-З, близкий родственник сульфатредукторов Desulfospira joergensenii и Desulfobacula toluolica. Он был выделен из осадков венецианской лагуны и растет литоавтотрофно за счет анаэробного окисления фосфита (фосфор в степени окисления +III) в фосфат (фосфор в степени окисления +V).
Акцептором электронов в данной реакции служит сульфат, который восстанавливается до гидросульфида:
4НРО2-3 + SO2-4 + Н+ —> 4НРO2-4 + HS-,
∆G°' = -91 кДж • моль-1 (для НРО2-3).
Экологическое значение этого процесса невелико. Фосфит, который служит промежуточным продуктом при микробной деградации фосфоорганических соединений в отсутствии кислорода, из-за своей нестабильности не может накапливаться в большом количестве.
К мышьяковой литотрофии способен штамм MLHE-1, который является близким родственником пурпурной бактерии Ectothiorhodospira halochloris. Он был выделен
из придонного водного слоя озера Моно-Лейк (штат Калифорния, США) и растет факультативно хемолитоавтотрофно благодаря превращению арсенита (мышьяк в степени окисления +III) в арсенат (мышьяк в степени окисления +V). Акцептором электронов в этой реакции служит нитрат, который восстанавливается до нитрита:
Н2АsО-3 + NO-3 —> Н2АsO-4 + NO2-,
∆С°′ = -87 кДж • моль-1 (для Н2АsО3-).
Биологическое окисление Аs (+III) с помощью нитрата — не экзотика, поскольку содержащие мышьяк минералы постоянно встречаются в золоторудных месторождениях.
Достоверные данные о других типах хемолитотрофии в настоящее время отсутствуют. В 1950-1960 гг. Н. Н. Ляликова по косвенным признакам установила, что «Stibiobactersenarmontii» использует энергию окисления сурьмы Sb(+III), входящей в состав аниона антимонита Sb(ОН)-4. Однако решающие доказательства существования сурьмяной хемолитотрофии не получены. Есть отрывочные указания о существовании медной и оловяной хемолитотрофии — возможно, что Acidithiobacillus ferrooxidans ассимилирует энергию, освобождающуюся при аэробном окислении катионов Сu+ и Sn2+.
Исчерпывается ли этим список реально существующих, а также теоретически возможных типов хемолитотрофии?
Установлено, что при дыхании прокариоты могут использовать разнообразные неорганические акцепторы электронов (см. раздел 11.4.6), к которым, в частности, относятся:
— металлы переходной валентности (например, Сг, Мо, Тс и V);
— элементные металлоиды (например, Э0 или Те0);
— ионы металлоидов (например, Sе2-);
— оксианионы, содержащие металлы (например, V и U);
— оксианионы, содержащие металлоиды (например, Sе и Те).
Редокс-системы, имеющие сродство к этим веществам, катализируют обратимые процессы. Поэтому восстановленные формы всех перечисленных субстратов теоретически могут использоваться и при хемолитотрофии.
В частности, описано бактериальное восстановленияе U(VI) до U(IV), в результате которого образуется нерастворимый осадок уранита UO2. Не исключено, что Аt. ferrooxidansспособна ассимилировать энергию, освобождающуюся при аэробном или анаэробном окислении U(IV).
Описан также «экзотический» процесс бактериального восстановления аниона теллурита ТеО2-3 в элементный теллур, что позволяет допустить возможность утилитарной окислительной реакции. Хемолитотрофии, основанная на окислении таких металлов, как Сг(III), Тс (IV), Мо(V) и V(III), или таких металлоидов, как Sе0, Sе2-, Sе(IV) и Те0, существует только гипотетически. Согласно последним данным, Geobacter metallireducens способен к ванадиевому дыханию, при котором электроны переносятся на пятивалентный ванадий с образованием аниона ванадила VO2+. В принципе, возможно использование в биоэнергетических целях обратной окислительной реакции. Наконец, известны бактерии, способные с помощью технеций (IV)-редуктазы восстанавливать анион пертехната ТсО-4 в диоксид технеция ТсО2. Теоретически допустима и обратная реакция, хотя технеций, который по свойствам сходен с марганцем, в природе не обнаружен (он производится в препаративном количестве на циклотроне).
Распространение хемолитотрофии. Способностью к хемолитотрофии обладает ряд представителей обоих прокариотных доменов. В настоящее время это свойство обнаружено в двух филах архей — АI Crenarchaeota и АII Euryarchaeota, а также в шести филах бактерий — BI Aquificae, ВVIII Nitrospirae, ВХII Proteobacteria, ВХIII Firmicutes, ВХIV Actinobacteriaи ВХV Planctomycetes.
Экологическое значение хемолитотрофии. Оценка экологической роли хемолитотрофов изменялась по мере того, как микробиология накапливала факты и приходила к новым теоретическим обобщениям.
В конце XIX в. главным источником аммиака и сульфида в микробных сообществах считали гниение органических остатков. Неудивительно, что сам С.Н.Виноградский, а также его последователи рассматривали литотрофию как последствие жизнедеятельности бактерий-деструкторов. Кроме того, литотрофов (за исключением нитрификаторов) считали гетеротрофами, т. е. принимали их за вторичных продуцентов.
Хотя Виноградский открыл хемолитотрофию в минеральных источниках Страсбурга, поступление неорганических доноров электронов из недр Земли в то время рассматривалось как экзотическое и малозначимое явление.
В почвах, континентальных водоемах, эстуариях рек и на морском шельфе развитие хемолитотрофов действительно вторично по отношению к развитию фотосинтетиков, которые являются главными первичными продуцентами, а также по отношению к развитию хемоорганогетеротрофов, которые выполняют роль деструктора органического вещества.
Время внесло существенные коррективы в первоначальные представления о глобальной экологии.
Начиная со второй половины XX в. ареной поисков новых форм микроорганизмов стали внешне «безжизненные» наземные, а также подводные и подземные ниши, где условия часто являются экстремальными. В результате было установлено, что хемосинтетики могут использовать абиогенные доноры электронов, которые прорываются из земных недр в зоне контакта тектонических плит, расположенных на суше или на морском дне (Азорские о-ва, Гренландия, п-ов Камчатка и т. д.). В частности, выяснилось, что в Калифорнийском заливе существует гиперпопуляция бесцветной серной бактерии Beggintoa, окисляющей сульфид кислородом или с помощью аниона NO3-.
11.4.4.2. Углеродная хемолитотрофия: метанотрофия, метилотрофия и формиатотрофия
С помощью анаэробного деструктивного сообщества (см. раздел 11.2.2) не менее 50% углерода, накопленного живыми организмами, превращается в метан. Помимо 8 • 108 т биогенного, ежегодно 5 • 108 т метана выбрасывается в атмосферу природными газовыми скважинами. Минорными источниками абиогенного метана служат промышленное производство (5 • 106 т) и вулканическая деятельность (2 • 105 т). Однако метан не накапливается в атмосфере, поскольку непрерывно окисляется аэробными метанотрофными бактериями в соответствии с общим уравнением:
СН4 + 2O2 —> СO2 + 2Н2O.
В итоге равновесное содержание метана в современной атмосфере составляет 1,4 • 104 объемных % (впрочем, этого достаточно, чтобы метан стал вторым по значению, после диоксида углерода, «парниковым» газом).
Помимо метана, при углеродной хемолитотрофии используются его производные, которые образуют разветвленную цепочку окисления С1-субстратов:
где X — атом азота, кислорода или серы.
Окисление метана в метанол невыгодно с энергетической и конструктивной точек зрения, поскольку, как станет ясно ниже, при этом расходуется НАД(Ф)Н. Однако последующие превращения С1-субстратов с избытком компенсируют понесенные затраты. Полученные «низкопотенциальные» электроны передаются дыхательной цепи или используются, вместе с НСНО и СО2, для автотрофных биосинтезов (см. разделы 13.2.3 и 13.3.1).
Окисление метана. Первая реакция в цепи окислительных превращений метана осуществляется с помощью метанмонооксигеназы (англ. methane monooxygenase, ММО):
СН4 + O2 + 2НАД(Ф)Н —> СН3ОН + Н2O + 2НАДФ.
Метанмонооксигеназа является представителем суперсемейства монооксигеназ, которые катализируют реакцию взаимодействия органических или неорганических субстратов с молекулярным кислородом.
При помощи этих ферментов один из двух атомов кислорода включается в состав молекулы субстрата с образованием гидрокси-группы (-ОН), кето-группы (=O) или
эпокси-группы (-O-). Второй атом кислорода восстанавливается низкопотенциальным донором электронов (чаще всего это НАДН) с образованием молекулы воды:
субстрат + О2 + DH2 —> субстрат-O + Н2О + D.
Большинство монооксигеназ принадлежит к числу растворимых ферментов, содержащих в качестве простетических групп [FenSn]-кластеры (см. раздел 10.4.1). Как правило, они состоят из трех-четырех компонентов:
— гетеродимерного белка (αβy)2или (αβ)2, который содержит [Fе2S2]-кластеры и обладает гидроксилазной активностью;
— мономерной оксидоредуктазы, у которой имеется N-концевой электронтрансдуцирующий ферредоксиновый домен и С-концевой редуктазный домен с сайтами для связывания ФАД и НАДН;
— сопрягающего эффекторного белка, который лишен простетических групп.
В некоторых случаях в состав растворимых монооксигеназ дополнительно входит четвертый компонент типа белка Риске, содержащий [Fе2S2]-кластер.
На основе генетических, структурных и энзиматических особенностей различают четыре группы растворимых «бинуклеарных» железо-монооксигеназ: метанмонооксигеназы, алкенмонооксигеназы, фенолгидроксилазы и четырехкомпонентные алкен/аренмонооксигеназы.
Метанмонооксигеназа существует в двух формах — растворимой (англ. soluble monooxygenase, sMMO) и мембраносвязанной (англ. particulate monooxygenase, рММО). Первая из них экспрессируется при медном голодании, вторая представляет собой медьсодержащий белок.
Комплекс sMMO содержит три компонента (рис. 106) — гидроксилазу А, регуляторный белок В и НАДН-зависимую оксидоредуктазу С.
Рис. 106. Монооксигеназа (по: Sullivan et al., 1998). α, β и y — субъединицы белка А; [Fе2S2] —железосерный кластер.
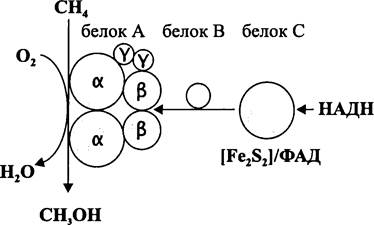
Гидроксилаза А представляет собой коричневый белок, состоящий из двух α-субъединиц (60 кДа; ген mmоХ), двух β-субъединиц (45 кДа; ген mmoY) и двух y-субъединиц (20 кДа; ген mmoZ). С помощью остатков His каждая большая субъединица α лигандирует один [Fе2S2]-кластер. Функция белка А заключается в активации метана и кислорода.
Регуляторный бесцветный белок В представляет собой димер идентичных субъединиц (15 кДа; ген mmоВ), не содержащий ни металлов, ни редокс-активных ко-
факторов. Он действует как эффектор окислительно-восстановительного процесса, а также влияет на конформацию [Fе2S2]-кластера и редокс-потенциал гидроксилазы.
Оксидоредуктаза С представляет собой коричневый белок, который состоит из одной субъединицы (45 кДа; ген mmоС) и содержит две простетические группы — ФАД и [Fе2S2]-кластер. Его функция заключается в том, чтобы восстанавливать разные акцепторы электронов, связанные с активным центром белка А.
При наличии меди экспрессируется мембраносвязанная рММО, использующая узкий спектр субстратов. Этот фермент состоит из субъединиц молекулярной массой 25, 27 и 47 кДа. Биосинтез двух первых из них (гены рmоА и рmоВ) индуцируется катионами Сu2+. Помимо медного центра, метанмонооксигеназа ММО содержит неидентифицированный [FenSn]-кластер.
Важно отметить, что метанмонооксигеназа рММО гомологична мембраносвязанной аммиакмонооксигеназе AMO (см. раздел 11.4.4.5), и эти ферменты характеризуются взаимно перекрывающейся субстратной специфичностью.
Окисление метильной группы. Эндогенный метанол синтезируется из метана с помощью метанмонооксигеназы. Наряду с ним может использоваться готовый метанол. В обоих случаях он окисляется до формальдегида при помощи периплазматической метанолдегидрогеназы.
Метанолдегидрогеназа (англ. methanol dehydrogenase, MDH) состоит из двух пар субъединиц α и β молекулярной массой 66 и 67 кДа. В состав комплекса входит атом кальция, обеспечивающий нековалентное связывание двух молекул пирролхинолин-хинона (англ. pyrrolo quinoline quinone, PQQ) (рис. 107), или метоксатина. Последний входит в качестве простетической группы во многие хинонпротеиновые дегидрогеназы, оксидазы и декарбоксилазы и является третьим по значению редокс- кофактором следом за НАД(Ф) и ФАД.
Рис. 107. Метоксатин, или пиррол-хинолин-хинон (PQQ).
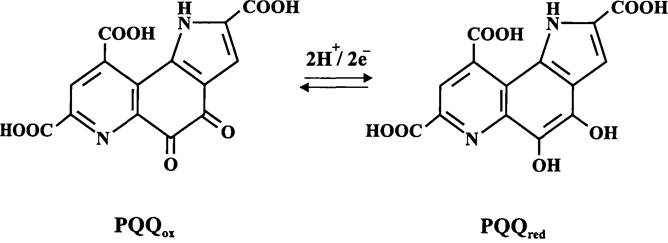
Акцептором электронов служит низкопотенциальный цитохром cL (от англ. low potential). От него электроны передаются разветвленной дыхательной цепи с цитохромоксидазами аа3- и bd-типа (см. раздел 11.4.6.1). В обоих случаях освобождающаяся энергия ассимилируется в форме Pmf.
Окисление формальдегида. Формальдегид является центральным звеном в цепочке окисления C1-соединений. Он используется в энергетическом метаболизме в качестве субстрата, за счет окисления которого создается Pmf, а также служит строительным блоком и источником восстановителя для углеродной автотрофии.
Формальдегид образуется с помощью метанолдегидрогеназы или в результате дегидрогеназного расщепления метилированных субстратов, имеющих общую формулу СН3—X—R. В качестве примеров таких субстратов можно привести метиламин СН3—NH2, диметиловый эфир СН3—О—СН3, диметилсульфоксид СН3—SO—СН3, а также метансульфонат СН3—SO3H и галогенные замещенные метана (бромистый метил СНзВг, хлористый метилен CH2CI2и др.).
Из периплазматического компартмента формальдегид с помощью неизвестного переносчика поступает в цитоплазму, где происходит его окисление. Метаболизм формальдегида, способного неспецифически реагировать с белками и нуклеиновыми кислотами, одновременно является и эффективным способом детоксикации этого вещества.
Существуют несколько путей окисления формальдегида до СО2, с помощью которых клетка получает восстановительные эквиваленты для дыхательной цепи. Остановимся только на двух из них, которые хорошо изучены на примере метилотрофа Methylobacterium extorquens.
В этих путях используются переносчики С1-блока — тетрагидрометаноптерин и тетрагидрофолат.
Тетрагидрометаноптерин (англ. tetrahydromethanopterin, Н4МРТ) участвует в редокс-превращениях С1-блока. Он связывает (см. рис. 116):
— формильную группу СНО-, с образованием N-формил-H4МРТ;
— метинильную группу =СН-, с образованием N-метинил-H4МРТ;
— метиленовую группу -СН2-, с образованием N-метилен-H4МРТ;
— метальную группу СН3-, с образованием N-метил-H4МРТ.
Тетрагидрофолат (англ. tetrahydropholate, H4фолат) также участвует в редокс-превращениях C1-блока. Он связывает (см. рис. 122):
— формильную группу СНО-, с образование N-формил-H4фолата;
— метинильную группу =СН-, с образованием N-метинил-H4фолата;
— метиленовую группу -СН2-, с образованием N-метилен-Н4фолата;
— метальную группу СН3-, с образованием N-метил-H4фолата.
Эти переносчики могут передавать С1-блок как в окислительном, так и в восстановительном направлении.
Позднее мы рассмотрим соответствующие реакции, когда будем говорить о восстановительном синтезе метальной группы у метаногенных архей (см. раздел 11.4.5.4) и ацетогенных бактерий (см. раздел 11.4.5.5).
Тетрагидрометаноптериновый путь (рис. 108, А). Он начинается с того, что формальдегид с помощью активирующего фермента связывается с Н4МРТ, в результате чего образуется N-метилен-H4МРТ. После этого с помощью НАД(Ф)-зависимой дегидрогеназы N-метилен-Н4МРТ окисляется в N-метанил-Н4МРТ. Затем с помощью циклогидролазы N-метинил-H4МРТ превращается N-формил-H4МРТ, который передает формильную группу неидентифицированному промежуточному переносчику X, аналогу метанофурана метаногенных архей (см. раздел 11.4.4.5 и рис. 116). Наконец, с помощью формилтрансферазы/гидролазы образуется формиат.
Рис. 108. Тетрагидрометаноптериновый (А) и тетрагидрофолатный (Б) пути окисления формальдегида. 1 — активирующий фермент; 2 — N-метилен-тетрагидрометаноптерин-дегидрогеназа; 3 — циклогидролаза; 4 — формилтрансфераза/гидролаза; 5 — формиатдегидрогеназа; X — неидентифицированный переносчик; 6 — N-метилен-тетрагидрофолат-дегидрогеназа; 7 — циклогидролаза; 8 — N-формил-тетрагидро- фолатсинтаза; 9 — формиатдегидрогеназа.
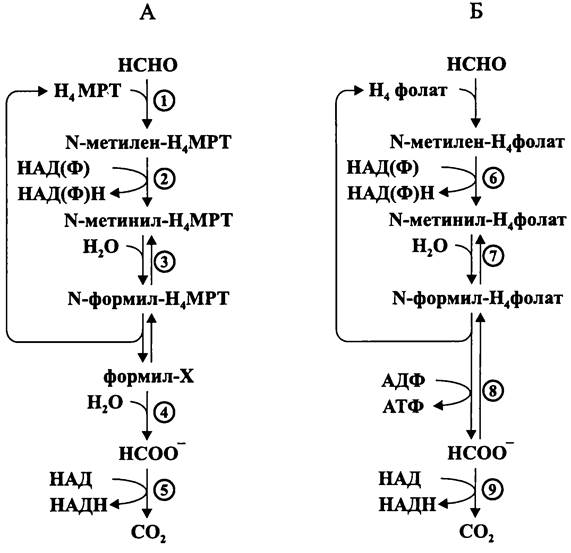
Тетрагидрофолатный путь (рис. 108, Б). Он начинается с того, что формальдегид, очень реакционноспособное соединение, спонтанно связывается с Н4фолатом, в результате чего образуется N-метилен-H4фолат. После этого с помощью НАД(Ф)- зависимой дегидрогеназы N-метилен-H4фолат окисляется в N-метинил-H4фолат. Затем с помощью циклогидролазы N-метанил-Н4фолат превращается N-формил-H4фолат. Наконец, с помощью АТФ-зависимой синтазы N-формил-H4фолат расщепляется на формиат и Н4фолат, что сопровождается фосфорилированием одной молекулы АДФ.
Оба пути окисления формальдегида — тетрагидрометаноптериновый и тетрагидрофолатный — позволяют получить восстановитель в форме НАД(Ф)Н и приводят к образованию формиата, который затем окисляется до СO2.
Окисление формиата. Окисляющая формиат растворимая «аэробная» НАД- зависимая формиатдегидрогеназа (англ, formate dehydrogenase, Fdh) состоит из двух копий α/β-субъединиц молекулярной массой 5 и 10 кДа. В качестве простетических групп используются [FenSn]-кластеры и ФМН.
Формиатдегидрогеназа катализирует следующую реакцию:
НСОО- —> СO2 + Н+ + 2е-.
Полученные восстановительные эквиваленты передаются дыхательной цепи, а также снабжают электронами метанмонооксигеназу и нитрогеназу (многие метилотрофы способны к диазотрофии).
Метанотрофы. Метанотрофными (метанокисляющими) называются аэробные бактерии, которые используют метан в качестве единственного источника энергии
и углерода, поскольку они обладают метанмонооксигеназой. Метанотрофия почти всегда является облигатной. Хотя в некоторых случаях метанотрофы могут расти на метаноле, они не растут на других C1-субстратах (соединениях типа СН3—X—R, формальдегиде НСНО и формиате НСООН), а также на субстратах, содержащих связи С—С.
Метанотрофные бактерии используют метан по двойному назначению — в качестве источника энергии и строительного материала.
При диссимиляции метана он полностью окисляется до СО2 и Н2О, а освобождающаяся энергия ассимилируется в форме Pmf.
При ассимиляции метана он окисляется до НСНО и СО2, которые с помощью автотрофных путей ассимиляции углерода включаются в состав клеточной биомассы.
Обычно говорят о двух типах метанотрофов.
Метанотрофы типа-1 принадлежат к классу «Gammaproteobacteria» (рода Methylobacter, Methylocaldium, Methylococcus, Methylomicrobium, Methylomonas и Methylosphaera). Они обладают ICM ламеллярного типа, синтезируют преимущественно С16-жирные кислоты и ассимилируют формальдегид через цикл Квайла (см. раздел 13.2.3).
Метанотрофы типа-II принадлежат к классу «Alphaproteobacteria» (рода Methylocystis и Methylosinus). Они имеют ICM везикулярного типа, синтезируют преимущественно С18-жирные кислоты и ассимилируют формальдегид и СО2 через цикл О’Коннора-Хэнсона (см. раздел 13.2.4).
Метанотрофные бактерии широко распространены в водоемах и почвах, а также в филлосфере растений, где они составляют до 10% микробной популяции и достигают численности 107 клеток • мл-1. Они играют важную роль в круговороте углерода, окисляя метан, образованный в тундре, болотах, затапливаемых почвах, рисовых полях и морских осадках.
Благодаря способности к диазотрофии они являются одними из важнейших первичных продуцентов на Земле, а в симбиотических ассоциациях с вестиментифера- ми и моллюсками служат фундаментом трофической пирамиды «второй» биосферы (см. I том учебника).
Метанмонооксигеназа обладает релаксированной субстратной специфичностью и может внедрять атом кислорода в молекулы разнообразных углеводородов — алканов, алкенов, ароматических соединений, галогенных замещенных метана, циклических углеводородов и эфиров. Трансформация побочных субстратов метанмоноок- сигеназы не имеет утилитарного значения для самих метанотрофов. Это типичный пример кометаболизма (англ. cometabolism). С его помощью в природе и в производственных установках разрушаются ксенобиотики, в частности производные бензола и трихлорэтилен.
Анаэробное окисление метана. Микроорганизмы, анаэробно окисляющие метан, принадлежат к числу некультивируемых. Поэтому механизм этого биологического процесса (англ. anaérobie oxydation of methane, АОМ) пока еще не ясен.
Возбудителем АОМ является микробный консорциум. Он состоит из архей, принадлежащих к сем. Methanosarcinales (фила АII Euryarchaeota), и сульфатредуцирующих бактерий Desulfococcus и Desulfosarcina (класс «Deltaproteobacteria»). Они образуют конусообразные маты по краю Черноморского шельфа на глубине 35- 800 м.
Метан окисляется эквимолекулярно с восстановлением сульфата, причем в результате защелачивания среды образуется карбонат кальция:
СН4 + SO2-4 + Са2+ —> СаСО3 + H2S + Н2O.
Свободная энергия данной реакции составляет-25 кДж • моль-1 метана (немного, но достаточно для медленного роста).
АОМ является важным звеном круговорота углерода в анаэробной среде, поскольку продукты этого процесса, карбонат и сульфид, могут использоваться пурпурными и тионовыми бактериями на восходящей ветви цикла.
Метилотрофы. «Метилотрофными» называются аэробные бактерии, которые не могут использовать метан в качестве единственного источника энергии и углерода, поскольку у них нет метанмонооксигеназы. Облигатные метилотрофы растут только на метаноле, галогенных замещенных метана и соединениях типа СН3— X—R. Факультативные метилотрофы могут использовать формальдегид или формиат, а также субстраты, содержащие связи С—С.
При росте на C1-соединениях (кроме формиата) метилотрофные бактерии ассимилируют формальдегид через цикл Квайла (см. раздел 13.2.3) или через цикл О’Коннора-Хэнсона (см. раздел 13.2.4). Иногда они могут использовать сразу оба цикла, а в случае Methylophilus methylotrophus — еще и цикл Кельвина-Бенсона- Бэссема (см. раздел 13.2.5).
Метилотрофные бактерии принадлежат к двум филам — ВХII Proteobacteria и ВХIII Firmicutes. В частности, к ним относятся Acetobacter methanolicus, Methylobac- terium extorquens, Paracoccus denitrificans, Xanthobacter autotrophicus (класс «Alphaproteobacteria»), Methylophilus methylotrophus (класс «Betaproteobacteria»), Amycolatopsis methanolica, Methylobacillus flagellatus и Mycobacterium gastri (фила BXIII Firmicutes).
Благодаря ферментативному аппарату, позволяющему использовать «неорганическую» метальную группу в составе разнообразных природных субстратов и ксенобиотиков, метилотрофы играют важную роль в глобальном круговороте углерода. Как и для метанотрофов, для них характерна способность к диазотрофии. В биотехнологии они обеспечивают биоремедиацию и служат ценным источником кормовой биомассы (препарат «прутин»).
Формиатотрофы. В отличие от метанотрофов и метилотрофов, использующих формиат как одно из звеньев в цепочке окисления метана и его производных, существуют облигатные формиатотрофы, для которых этот субстрат служит единственным источником энергии и углерода, а также факультативные формиатотрофы, растущие на субстратах с химическими связями С—С.
В природных экосистемах формиат накапливается в основном в качестве:
— промежуточного или конечного продукта брожений (с помощью пируват: формиат-лиазы; см. раздел 11.3.3);
— промежуточного продукта окисления C1-соединений метанотрофами и метилотрофами (с помощью систем окисления формальдегида; см. выше);
— первичного продукта ассимиляции СO2 автотрофными ацетогенными бактериями (с помощью «синтезирующей» формиатдегидрогеназы; см. раздел 11.4.5.5).
Хемолитотрофное окисление формиата происходит в аэробных и анаэробных условиях и катализируется растворимыми или мембраносвязанными формиатдегидрогеназами.
Растворимые НАД(Ф)-зависимые формиатдегидрогеназы. Они передают электроны аэробной или анаэробной дыхательной цепи. Как уже отмечалось, простетическими группами этих ферментов являются [FenSn]-кластеры и ФМН.
В качестве соответствующих примеров можно назвать «аэробную» формиатдегидрогеназу метанотрофов или метилотрофов, а также «анаэробную» формиатдегидрогеназу Desulfitobacterium sp. (фила ВХIII Firmicutes), которая передает электроны через дыхательную цепь терминальному акцептору — арсенату (см. раздел 11.4.6.2).
Мембраносвязанные формиатдегидрогеназы, не зависящие от НАД(Ф). Они имеются у факультативных и облигатных анаэробов и окисляют формиат, который образуется при катаболизме пирувата. Электроны поступают непосредственно в дыхательную цепь. В данном случае фермент содержит не только [Fе4S4]-кластеры, но и геминовое железо, а также молибденовый кофактор, относящийся к группе «бактоптеринов» — молибдоптерин-гуанидин-динуклеотид (англ. molybdopterin guanidine dinucleotide, MGD) (рис. 109).
Рис. 109. Молибдоптерин-гуанидин-динуклеотид (MGD) и молибдоптерин-цитидин-динуклеотид (MCD).
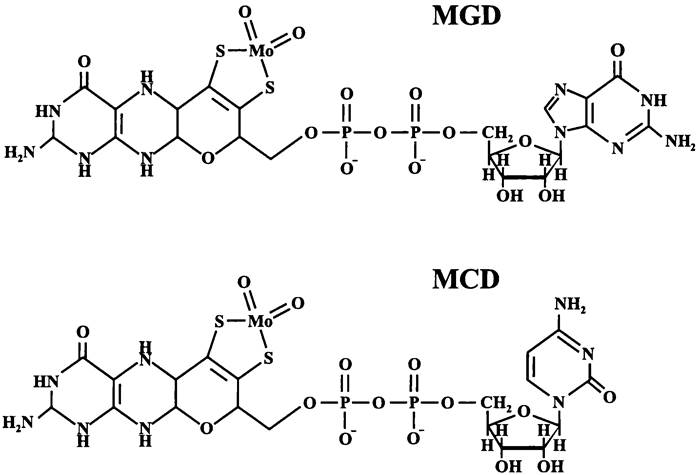
У факультативно анаэробной энтеробактерии Е. соli образуются две сходные по строению, но различающиеся по характеру своей экспрессии молибдоптерин-зависимые формиатдегидрогеназы. Это аэробная формиатдегидрогеназа Fdh-O и анаэробная формиатдегидрогеназа Fdh-N.
Анаэробная формиатдегидрогеназа Fdh-N (от англ. nitrate), или FdnGHI является компонентом нитратредуктазной системы (см. раздел 11.4.6.2). Ее молекула
имеет грибовидную форму, а ее размер составляет 12,5x15 À. С периферической α-субъединицей (100 кДа; ген fdnG) связан один [Fе4S4]-кластер и две молекулы кофактора MGD, которые с помощью четырех cis-тиолатных групп лигандируют атом молибдена в активном центре. Остаток редкой аминокислоты селеноцистеина SeCys дополнительно лигандирует атом молибдена, который получает электроны непосредственно от формиата. Амфипатическая β-субъединица (35 кДа; ген fdnH) состоит из одного трансмембранного домена. Она содержит четыре [Fе4S4]-кластера, которые получают электроны от [Fе4S4]-кластера на α-субъединице и передают их β-субъединице. Интегральная y-субъединица (25 кДа; ген fdnl)представляет собой дигемовый цитохром 6556. Она состоит из четырех трансмембранных спиралей и на своей цитоплазматической стороне образует сайт для связывания менахинона MQ. Гем bр (от англ. periplasmic), координированный остатками His в положениях 57/155, находится на периплазматической стороне мембраны и получает электроны от β-субъединицы. Гем bс (от англ. cytoplasmic) координирован остатками His в положениях 18/169, расположен на цитоплазматической стороне и передает электроны менахинону.
В то время как растворимые формиатдегидрогеназы действуют в направлении окисления формиата, мембраносвязанные формиатдегидрогеназы обладают обратимым действием. В частности, с их помощью автотрофные ацетогенные бактерии синтезируют формиат из СО2 и Н2 (см. раздел 11.4.5.5).
Облигатные формиатотрофы ассимилируют экзогенный СО2 или эндогенный СО2, полученный с помощью формиатдегидрогеназы, в цикле Кельвина-Бенсона- Бэссема (см. раздел 13.2.5).
Благодаря низкой величине редокс-потенциала пары НСOO-/СO2 (-420 мВ) бактерии имеют возможность с высокой эффективностью ассимилировать свободную энергию реакции окисления формиата. Хемолитотрофное окисление формиата, сопряженное с углеродной автотрофией, является важным звеном в круговороте углерода. Кроме того, окисление формиата, в особенности в анаэробных условиях, предотвращает закисление среды из-за накопления этого широко распространенного продукта брожения.
11.4.4.3. Углеродная хемолитотрофия — карбоксидотрофия
Главными источниками монооксида углерода, или угарного газа (СО) являются техногенные процессы и тропосферная реакция между метаном и гидроксильным радикалом СН4 + ОН —> СО + 5Н (1,5 • 109 т/год). В гораздо меньших количествах, примерно 3 • 108 т/год, он выделяется: а) подводными гидротермами; б) в качестве побочного продукта при катаболизме хлорофилла у океанического фитопланктона и высших растений; в) при природных пожарах.
Равновесное содержание СО в атмосферном воздухе не превышает 10-7 объемных %, поскольку он окисляется абиотическим путем в тропосферной реакции СО + ОН- —> СО2 + Н, а также в результате жизнедеятельности CO-окисляющих бактерий.
CO-окисляющие бактерии, или карбоксидобактерии принадлежат к филам ВХII Proteobacteria (Bradyrhizobium japonicum, Carbophilus carboxidus, Oligotropha carboxidovorans, Rhizobium sp., Zavarzinia compransoris), BXIII Firmicutes (Bacillus schlegelii) и BXIV Actinobacteria (Arthrobacter sp., Streptomyces sp.). Некоторые из них хемолитоавтотрофы, другие способны к миксотрофии или хемогетеротрофии.
Хемолитоавтотрофные бактерии, использующие СО в качестве источника энергии, называются «карбоксидотрофными». Большинство из них одновременно проявляет способность к водородной хемолитотрофии (см. ниже). Примечательно, что при карбоксидотрофии монооксид углерода служит не только энергетическим, но и конструктивным субстратом, поскольку при его окислении СО-дегидрогеназой образуется эндогенный диоксид углерода:
СО + [О:] —> 2е- + СO2.
Ключевая реакция энергетического метаболизма карбоксидотрофов — это окисление СО, которое катализируется «энергетической» СО-дегидрогеназой.
«Энергетическая» СО-дегидрогеназа. Ферменты, объединенные под общим названием «СО-дегидрогеназы» (англ. СО-dehydrogenase, COD), катализируют три реакции — они могут синтезировать ацетил-СоА, расщеплять ацетил-СоА и окислять СО. В результате этого они могут участвовать и в конструктивном, и в энергетическом метаболизме.
«Конструктивные» СО-дегидрогеназы существуют у архей и бактерий. Эти железоникелевые ферменты, или Fe/Ni-COD обладают обратимым действием. Гидрогенотрофные метаногены (см. раздел 11.4.5.4) с их помощью синтезируют ацетил-СоА из метильной группы, карбонильной группы и Со А:
[СНз-] + [СО] + CoASH —> CH3-CO~SCoA.
Ацетокластические метаногены с их помощью расщепляют ацетил-СоА на метильную группу, карбонильную группу и СоА:
СНз-CO~SCoA —> [СН3-] + [СО] + CoASH.
Конструктивные Ni/Fe-COD бактерий также обладают обратимым действием. У гомоацетогенных бактерий они синтезируют ацетил-СоА из метильной группы, карбонильной группы и СоА (см. раздел 11.4.5.5). У ацетотрофных сульфатредукторов они расщепляют ацетил-СоА на метильную группу, карбонильную группу и СоА.
«Энергетические» COD имеются только у бактерий и обладают однонаправленным действием. Они участвуют в дыхании и катализируют прямую реакцию окисления монооксида углерода.
У анаэробных факультативных хемолитотрофов (например, пурпурной бактерии Rhodocyclus gelatinosus) энергетическая COD содержит два кофактора — никель и негеминовое железо. Этот мембраносвязанный фермент работает в комплексе с водородобразующей гидрогеназой (см. раздел 11.4.4.4):
СО + Н2O —> СO2 + Н2.
В результате экзергонической реакции (∆G°′ = -20 кДж • моль-1) энергия ассимилируется в форме Pmf.
У аэробных карбоксидотрофов энергетическая COD содержит три кофактора — молибден, негеминовое железо и флавин. Этот индуцибельный мембраносвязанный фермент катализирует реакцию:
СО + Н2O + А —> СO2 + АН2, где А — акцептор электронов.
У аэробной карбоксидобактерии Oligotropha carboxydovorans в состав энергетической COD входит большая L (англ. large; 86 кДа), средняя М (англ. medium; 34 кДа)
и малая S (англ. small; 17 кДа) субъединицы, каждая из которых представлена в двух копиях. Структурные гены этого фермента находятся на плазмиде.
В качестве простетической группы, непосредственно участвующей в окислении монооксида углерода, используется бактоптерин — молибдоптерин-цитидин- динуклеотид (англ. molybdopterin cytidine dinucleotide, MCD; рис. 109). Помимо MCD, в состав энергетической COD входят два [Fе2S2]-кластера и две молекулы ФАД.
Другим примером бактоптерина является молибдоптерин-гуанидин-динуклеотид MGD (см. раздел 11.4.4.2 и рис. 109), который выполняет роль кофактора формиат- дегидрогеназы, N-формил-МF-дегидрогеназы и диметил сульфоксид-редуктазы. Молибдоптерины с более простым строением встречаются у Еucarya, в частности в роли кофактора сульфитоксидазы и ксантиноксидазы.
От СО электроны передаются акцептору — убихинону, а от него цитохром 6/с- комплексу. Роль терминальной оксидазы выполняет цитохром 6563. Благодаря исключительно высокому сродству к кислороду он постоянно находится в окисленном состоянии и не связывается с монооксидом углерода, чем и объясняется резистентность дыхательной цепи карбоксидобактерий к этому крайне ядовитому веществу (угарному газу).
В некоторых случаях у аэробных карбоксидотрофов терминальным акцептором электронов служит анион NO3-, т. е. они осуществляют нитратзависимое дыхание (см. раздел 11.4.6.2).
Карбоксидотрофные бактерии сочетают хемолитотрофию с автотрофией по углероду. В качестве одноуглеродного блока они используют СО2, который ассимилируется в цикле Кельвина-Бенсона-Бэссема (см. раздел 13.2.5).
Значение карбоксидотрофных бактерий и других прокариотов, обладающих COD, состоит в том, что они участвуют в глобальном цикле углерода. В частности, они контролируют содержание монооксида углерода в атмосфере.
Нельзя не упомянуть о том, что способность окислять монооксид углерода проявляют и метанотрофные бактерии. Однако у них эта реакция не связана с ассимиляцией энергии. Просто их метанмонооксигеназа обладает релаксированной субстратной специфичностью (см. раздел 11.4.4.2).
11.4.4.4. Водородная хемолитотрофия
Молекулярный водород — повсеместно распространенный субстрат, однако в атмосфере, водоемах и почвах он присутствует в следовых количествах (1-50 мПа). Приведенные цифры отражают равновесную концентрацию водорода, а не его валовое образование и потребление, которое ежегодно составляет 2 • 108 т. Глобальный пул водорода все время пополняется благодаря геохимическим и антропогенным процессам, а также в результате жизнедеятельности фототрофов и хемогетеротрофов-ферментаторов.
Водород представляет собой наименее специфичный из всех субстратов хемолитотрофии. Использование водорода является самым распространенным типом хемолитотрофии, причем большинство водородокисляющих литотрофов способно адаптивно переходить на фототрофию или хемогетеротрофию. Кроме того, водород могут окислять и многие облигатно хемогетеротрофные микроорганизмы, однако это не связано с ассимиляцией освобождающейся энергии.
Истинно водородные хемолитотрофы крайне редки. Примерами служат бактерии Calderobacterium hydrogenophilum и Hydrogenobacter thermophilus, а также археот Acidianus inf emus.
В филогенетическом и таксономическом планах водородные литотрофы исключительно гетерогенны: к ним относится ряд представителей бактериальных фил BI Aquificae, ВХIIProteobacteria и ВХIII Firmicutes, а также археотных фил AI Сгеnаг- chaeota и АII Euryarchaeota.
Окисление водорода может происходить как в аэробных, так и в анаэробных условиях.
Термином «водородные» обозначают бактерий и архей, растущих благодаря энергии окисления молекулярного водорода молекулярным кислородом (реакция гремучего газа):
Н2 + 1/2O2 —> Н2О.
Гораздо реже водородные бактерии и археи используют для окисления водорода другие акцепторы электронов, например, сульфат:
4Н2 + SO2-4 —> 4Н2O + S2-.
К числу аэробных водородных бактерий принадлежат, в частности, Aquifex ру- rophilus, Calderobacterium hydrogenophilum, Hydrogenobacter thermophilus (фила BI Aquificae); Acidithiobacillus ferrooxidans, Alcaligenes eutrophus, Paracoccus denitrifi- cans, Ralstonia eutropha (фила BXII Proteobacteria); Bacillus tusciae (фила BXIII Firmicutes) и Nocardia autotrophica(фила BXIV Actinobacteria). Характерным представителем анаэробных водородных бактерий является Desulfobacterium ther- molithotrophicum (фила ВХII Proteobacteria).
Примером аэробных водородных архей служит Metallosphaera sedula (фила AI Crenarchaeota), а анаэробных — Acidianus infernus (фила AI Crenarchaeota).
Водородные прокариоты часто сочетают хемолитотрофию с углеродной авто- трофией или миксотрофией (см. раздел 13.1). В качестве универсального одноуглеродного блока ими используется СО2, который ассимилируется в цикле Кельвина- Бенсона-Бэссема (примером служат A. ferroxidans, A. eutrophus, В. tusciae, D. ther- molithotrophicum, N. autotrophica, P. denitrificans и R. eutropha) или в цикле Ивенса- Бьюкенена-Эрнона (примером служат A. pyrophilus, С. hydrogenophilum и Н. thermophilus). Механизм автотрофной ассимиляции углерода у водородных архей еще не выяснен.
Способностью к водородной хемолитотрофии обладают и многие карбоксидотрофные бактерии, а также гомоацетогенные бактерии и гидрогенотрофные метаногенные археи (см. разделы 11.4.4.3, 11.4.5.5 и 11.4.5.4). Однако по отношению к ним не используют термин «водородные».
В свою очередь, некоторые водородные бактерии (например, N. autotrophica) способны к углеродной хемолитотрофии и могут окислять «неорганическую» метальную группу или формиат. Таким образом, у водородных хемолитотрофов и углеродных хемолитотрофов проявляется встречная субстратная специфичность. Позднее мы увидим, что это явление, хотя и в более слабой степени, наблюдается у серных, железных и марганцевых хемолитотрофов. Максимальную специфичность в отношении «своего» энергоносителя проявляют азотные хемолитотрофы.
Водородные хемолитоавтотрофы выполняют важную роль первичных продуцентов в наземных и подводных гидротермах — экстремальных нишах с повышенной геохимической активностью. Велика их роль и в анаэробном деструктивном сообществе (см. раздел 11.2.2). Следует добавить, что водородные хемолитотрофы участвуют в устойчивых трофических ассоциациях в качестве компонентов цианобактериальных матов, а также в качестве симбионтов инфузорий и погонофоров. Наконец, штаммы A. eutrophus являются перспективными продуцентами кормовой биомассы и уже используются в промышленности для получения биогенных пластмасс, отходы которых при попадании в окружающую среду быстро подвергаются биодеструкции (см. I том учебника).
Гидрогеназа. Чтобы понять метаболический смысл и механизм биологического окисления водорода, остановимся на гидрогеназах (Н2азах). Эти ферменты, или дегидрогеназы водорода катализируют реакцию:
Н2 ⇄ 2Н+ + 2е-.
Гидрогеназы представляют собой легко травмируемые кислородом коричневые белки, имеющие широкий максимум поглощения в сине-зеленой части видимого спектра (350-400 нм). Они состоят из нескольких субъединиц и обычно содержат металлокластеры двух типов. Стандартный «транспортный» [Fe2S2]; [Fе3S4]; или [Fе4S4]-кластер переносит электроны между редокс-партнером гидрогеназы и ее активным центром. Индивидуальный «каталитический» [FenSn]-кластер входит в состав активного центра. Он имеет редокс-потенциал -420 мВ и обратимо активирует водород. В активный центр железоникелевых гидрогеназ, или FeNi-гидрогеназ кроме железа входит никель.
Согласно результатам, молекулярного секвенирования, стандартные «транспортные» субъединицы взаимно гомологичны и входят в общее суперсемейство с растворимыми ферредоксинами. В то же время индивидуальные «каталитические» субъединицы (число которых составляет две-шесть и даже больше) взаимно гетерологичны, поэтому соответствующие гидрогеназы относятся к разным группам. Третью обособленную группу составляют «неметаллические» гидрогеназы без простетических групп, имеющиеся у некоторых метаногенов.
В функциональном отношении гидрогеназы подразделяются на «конструктивные» и «энергетические».
Конструктивные гидрогеназы — это цитозольные ферменты. Хотя в бесклеточных препаратах они обладают обратимым действием, in situ они обеспечивают только поглощение или только выделение молекулярного водорода. Физиологическая функция конструктивных гидрогеназ заключается в том, чтобы получать восстановительные эквиваленты из молекулярного водорода или расходовать избыточные восстановительные эквиваленты на его образование.
Энергетические гидрогеназы — это мембраносвязанные комплексы, которые катализируют только прямую реакцию и создают Pmf. Гидрогеназы этого типа служат примером электрогенератора, использующего механизм экстрацитоплазматического окисления «простых» субстратов.
Гидрогеназные реакции с противоположным направлением вектора равновесия реакции пространственно разобщены. Окисление водорода происходит в периплазматическом компартменте или на уровне ICM, а образование водорода — в цитозоле.
Важное различие мембранных и периплазматических гидрогеназ от цитозольных заключается в том, что ферменты обоих типов синтезируются в виде предшественника с сигнальным пептидом из 30-70 аминокислотных остатков, причем характерный мотив R-R-X-F-X-K на N-конце малой каталитической субъединицы распознается экспортными Tat-системами (см. I том учебника).
Реакции с участием молекулярного водорода входят во многие метаболические пути, причем некоторые прокариоты имеют сразу несколько гидрогеназ, выполняющих разные функции.
Бактерии-ферментаторы (например, Clostridium, sp.) образуют молекулярный водород, избавляясь таким путем от лишних восстановительных эквивалентов:
D(2e-) + 2Н+ —> D + Н2,
где D — донор электронов.
Прокариоты с дыхательным типом метаболизма, а также фототрофные бактерии могут использовать водород в качестве донора электронов для электрон-транспортной цепи:
Н2 —> 2Н+/2е-, Q + 2H+/2e- —> QH2,
где Q — хинон, взаимодействующий с цитохром bc1 (b6f)-комплексом.
Диазотрофы при помощи гидрогеназ утилизируют водород, который образуется в результате восстановления протонов при помощи нитрогеназы:
N2+ 8[Н+/е-] + 16MgATФ + 2Н+ —> 2NH4++ Н2 + 16MgAДФ + 16Ф, Н2 —> 2Н+ + 2е-.
Наиболее распространены железоникелевые гидрогеназы. Лучше всего они изучены у представителей филы ВХII Proteobacteria. Это гетеродимеры субъединиц αβ, имеющих молекулярную массу 60 и 30 кДа. Большая каталитическая субъединица связывает биметаллический NiFe-кластер. Малая субъединица связывает до трех [FenSn]-кластеров, переносящих электроны. Ген большой субъединицы обозначается как hupL (от англ. hydrogen uptake) или синонимами — hoxG (от англ. hydrogen oxidation), hydL (от англ. hydrogenase) и т. д. Ген малой субъединицы обозначается как hupS или синонимами — hoxK, hydS и т. д. Помимо этого существуют несколько вспомогательных hup-, или Лот-генов, продукты которых участвуют в процессинге «структурного» гетеродимера αβ, а также hур-гены (от англ. hydrogen pleiotropic), обеспечивающие включение СО, CN- и Ni2+/Fe2+ в активный центр. Далее, существуют регуляторные гены, контролирующие экспрессию структурных. Для биогенеза железоникелевых гидрогеназ необходимы дополнительные гены, отвечающие за импорт катионов Ni2+, в частности hoxN. Все перечисленные гены сгруппированы на хромосоме или мегаплазмиде.
Железоникелевые гидрогеназы имеются у многих бактерий и архей; у эукариотов они отсутствуют. Рассмотрим несколько типов железоникелевых гидрогеназ, различающихся по локализации и физиологической функции.
Мембраносвязанные uptake-гидрогеназы (англ. uptake — поглощение; окисляющие водород). Активные центры этих гидрогеназ ориентированы в периплазматическое пространство. Электроны передаются через цитохром b-типа, который одновременно служит докинг-площадкой для фермента, хинонному пулу, а от него — терминальному акцептору (О2, NO3-, SO42- или фумарату). Особое место среди гидрогеназ этой группы занимает VhoGA-гидрогеназа метаногенных архей, передающая электроны гетеродисульфид-редуктазе при участии цитохрома b и метанофеназина (см. раздел 11.4.5.4).
Мембраносвязанные uptake-гидрогеназы цианобактерий. Они способствуют утилизации водорода, образуемого нитрогеназой.
Растворимые F420-восстанавливающие гидрогеназы. Они имеются у гидрогенотрофных метаногенных архей, которые не обладают цитохромами и растут на СО2/Н2 или формиате. Эти ферменты окисляют водород и передают электроны 5- деазафлавину, или коэнзиму F420, который используется при восстановлении СO2
до метана (см. раздел 11.4.5.4). Они кодируются опероном frhADGB и состоят из двух каталитических субъединиц — большой FrhA и малой FrhG. Вспомогательная субъединица FrhB связывает фактор F420. Продуктом гена frhD служит протеаза, обеспечивающая посттрансляционный процессинг субъединиц AGB.
Растворимые тетрамерные бифункциональные гидрогеназы гипертермофильных архей. Их примером служит «сульфогидрогеназа» гипертермофильного археота Pyrococcus furiosus. Она может восстанавливать S0за счет окисления Н2 или использовать Н+ в качестве акцептора электронов для поддержания редокс-баланса при сбраживании органических субстратов. Этот тетрамерный фермент состоит из каталитических субъединиц αδ и вспомогательных субъединиц βy.
Растворимые НАД-сопряженные обратимые гидрогеназы. Это гетеротетрамеры, состоящие из двух димерных субкомплексов. Первый субкомплекс, или «диафораза» (гены hoxF и hoxU) взаимодействует с редокс-партнерами и содержит сайты для связывания НАД, ФМН и [FenSn]-кластеров. Второй субкомплекс (гены hoxH и hoxY)— это собственно железоникелевая гидрогеназа. Такие конститутивные гидрогеназы имеются у диазотрофных и недиазотрофных штаммов цианобактерий. Их физиологическая роль заключается в удалении лишних «низкопотенциальных» электронов или получении восстановителя для энергетического и конструктивного метаболизма.
Мембраносвязанные водородобразующие гидрогеназы. Представители этой группы железоникелевых гидрогеназ сопрягают окисление ацетата, монооксида углерода или формиата с восстановлением 2Н+ до Н2. Физиологический смысл этой реакции заключается в ассимиляции энергии в форме Pmf. Характерным примером служит гидрогеназный компонент формиат: Н2-лиазы, которая экспрессируется Е. coli в условиях строгого анаэробиоза и катализирует реакцию:
COO- + 2Н+ —> СO2 + Н2.
Каталитические субъединицы этой гидрогеназы (HycGE) — это периферические белки. Остальные компоненты формиат: Н2-лиазного комплекса выполняют роль интегральной докинг-площадки, а также переносят электроны от формиатдегидрогеназы к гидрогеназе.
В отличие от гетеродимерных железоникелевых гидрогеназ, Fe-гидрогеназы встречаются только у некоторых представителей Bacteria и Eucarya, но не обнаружены у архей. Это мономеры (реже олигомеры), молекулярная масса которых находится в пределах 50-120 кДа. Они содержат единственную субъединицу с консервативным доменом из 350 аминокислотных остатков, связывающим [Fe4S4]-кластер. Характерная функция гидрогеназ этого типа — участие, совместно с ферредоксином, в фосфорокластической реакции расщепления пирувата у некоторых анаэробов, например, С. pasteurianum (см. раздел 11.3.3).
11.4.4.5. Азотная хемолитотрофия
Азотная хемолитотрофия, при которой донором электронов служит аммиак или нитрит, встречается только у бактерий (см. табл. 12).
Глобальными источниками аммиака служат:
— дезаминирование аминокислот при распаде белков (катаболическая аммонификация);
— восстановление нитрата с целью последующего аминирования кетокислот (ассимиляционная нитратредукция);
— диазотрофия.
Значительный вклад вносят также геохимическая активность и антропогенные процессы.
Нитрит в заметных количествах в природной среде не накапливается и образуется в качестве побочного продукта жизнедеятельности «нитрозобактерий» (которые катализируют превращение NH3 —> NO2). В синтрофной симбиотической ассоциации с ними находятся нитритокисляющие «нитробактерии» (которые катализируют превращение NO2 —> NO3).
Главным субстратом азотной хемолитотрофии, или «автотрофной» нитрификации является аммиак, который окисляется до нитрата. При низком парциальном давлении кислорода в качестве побочных продуктов образуются газообразные оксиды азота NО и NO2.
Автотрофная нитрификация состоит из двух фаз: (1) NH3 —> NO2-, (2) NO2- —> NO3-. За них отвечают две разные группы бактерий — окисляющие аммиак нитрозо- бактерии (англ. ammonia oxidizing bacteria, АОВ) и окисляющие нитрит нитробактерии (англ, nitrite oxidizing bacteria, NOB).
Первая фаза нитрификации. Окисление аммиака происходит в почвах и водоемах в аэробных условиях или на границе раздела оксичной и аноксичной зон. Нитрозобактерии, или возбудители первой фазы нитрификации принадлежат к классу «Betaproteobacteria». Они облигатные аэробы, хотя и могут адаптироваться к недостатку кислорода.
Аммиак превращается в нитрит в результате двух последовательных реакций. Сначала из него образуется гидроксил амин:
NH3+ О2 + DH2 —> NH2OH + Н2О + D, где D — донор электронов.
Реакцию катализирует мембраносвязанная мультисубъединичная медьсодержащая аммиакмонооксигеназа (англ. ammonia monooxygenase, AMO). Донором двух электронов в этой эндергонической реакции служит цитохром bс1-комплекс.
Затем гидроксил амин превращается в нитрит в экзергонической реакции, которую катализирует периплазматическая гидроксиламин-дегидрогеназа, или гидрок- силамин-оксидоредуктаза (англ. hydroxylamine oxidoreductase, НАО):
NH2OH + Н2О —> HNО2 + 4Н+/4е-.
НАО представляет собой гетеротример (αβ)з молекулярной массой 200 кДа и в качестве простетических групп содержит гемы с-типа.
При окислении гидроксиламина в периплазматическое пространство высвобождаются четыре протона, что создает Pmf в соответствии с механизмом экстрацитоплазматического окисления «простых» субстратов. От гидроксиламин-оксидоре- дуктазы четыре электрона поступают на цитохром bс1-комплекс (при посредстве растворимого цитохрома с554 и периферического цитохрома с552). От него два электрона передаются аммиакмонооксигеназе, а два электрона — цитохромоксидазе аа3, в результате чего дополнительно создается Pmf (см. раздел 11.4.6.1):
Суммируя все три реакции первой фазы нитрификации, получаем:
NH3 + 3/2О2 —> HNО2 + Н2О.
Помимо собственно нитрификаторов, аэробное окисление аммиака могут вызывать метанотрофные бактерии, что связано с широкой субстратной специфичностью мембраносвязанной метанмонооксигеназы рММО.
Некоторые представители родов Alcaligenes, Arthrobacter, Pseudomonas и др., а также ряд плесневых грибов (Aspergillus sp., Pénicillium sp. и др.) обнаруживают способность к «гетеротрофной» нитрификации. Однако этот процесс не обеспечивает клетку энергией, и его физиологическое значение до сих пор неясно.
Вторая фаза нитрификации. Нитробактерии, или возбудители второй фазы нитрификации полифилетичны и принадлежат к классам «Alphaproteobacteria» (Nitrobacter sp.), «Gammaproteobacteria» (Nitrococcus sp.) и «Deltaproteobacteria» (Ni- trospina sp.), a также к филе ВVIII Nitrospirae. Данную реакцию катализирует мембраносвязанная нитритдегидрогеназа, или «нитрит-оксидоредуктаза» (англ nitrite oxidoreductase, NOR):
NO2- + Н2О ⇄ NO-3 + 2Н+/2е-.
NOR содержит в качестве простетических групп [FenSn]-кластеры и молибдоптерин (см. рис. 109). Она передает электроны цитохром bc1-комплексу, а тот цитохромоксидазе аа3, в результате чего создается Pmf.
В отличие от первой фазы вторая фаза нитрификации — это обратимый процесс, и с помощью NOR нитрат может восстанавливаться в нитрит за счет органических субстратов.
Анаэробное окисление аммиака. На рубеже XX-XXI вв. было открыто важное звено в биогеохимическом цикле азота — процесс анаэробного окисления аммиака, или «Апатшох» (от англ. anaerobic ammonia oxidation). Отвечающие за него пресноводные формы с условными именами Candidatus «Brocadia anammoxidans» и Candidatus «Kuenenia stuttgartiensis»были впервые обнаружены в 1995-2000 гг. в иле анаэробных очистных сооружений. Природный представитель этой группы, названный Candidatus «Scalindua sorokinii», был найден в 2002 г. в бассейне Черного моря ниже аноксичной зоны. Все они относятся к филе BXV Planctomycetes.
Анаэробное окисление аммиака происходит в анаммоксосоме — органелле, занимающей до 30% внутреннего объема клетки (см. I том учебника). Она обладает высокой электронной плотностью, поскольку содержит много белка и окружена унитарной мембраной из уникальных липидов «ледцеранов» (англ. ladder — лестница). Гидрофобные радикалы ледцеранов (см. I том учебника) представляют собой С20-спирты или С20-кислоты с восьмиуглеродной линейной цепью, к которой присоединяется «лестница» из пяти циклобутановых или трех циклобутановых и одного циклогексанового остатка. Такие радикалы образуют простой эфир с метанолом или глицеролом, а также смешанный (простой и сложный) эфир с глицеролом. Напомним, что простые эфиры глицерола типичны для архей; у бактерий они встречаются крайне редко и, кроме данного случая, описаны только у некоторых термофилов и сульфатредукторов (см. I том учебника). Плотно упакованные ледцераны создают непроницаемый барьер для диффузии высокотоксичного гидразина NH2—NH2, который является ключевым интермедиатом в процессе анаэробного окисления аммиака.
Мембрана анаммоксосомы содержит три фермента — гидразингидролазу, гидразиндегидрогеназу и нитритредуктазу (рис. 110).
Рис. 110. Анаэробное окисление аммиака в анаммоксосоме. НН — гидразингидролаза; HZO — гидразиндегидрогеназа; NR — нитритредуктаза.
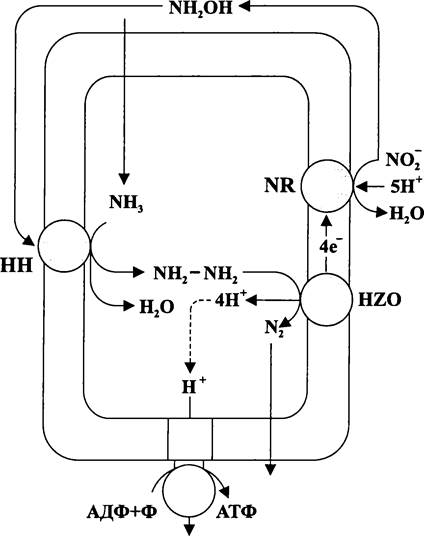
Гидразингидролаза (англ. hydrazine hydrolase, НН) катализирует реакцию между аммиаком, находящимся в анаммоксосоме, и гидроксиламином, находящимся в цитоплазме:
NH3+ NH2OH —> NH2-NH2+ Н2O.
Гидразин, который в результате этой реакции накапливается в полости анаммоксосомы, окисляется анаэробной дыхательной цепью, состоящей из гидразиндегидрогеназы (англ. hydrazine oxidizing enzyme, HZO) и нитритредуктазы (англ. nitrite reducing enzyme, NR).
При четырехэлектронном окислении молекулы гидразина внутри анаммоксосомы появляются четыре протона (механизм создания Pmf путем экстрацитоплазматического окисления «простых» субстратов):
NH2-NH2 —> N2 + 4е-/4Н+.
В свою очередь, для образования молекулы гидроксиламина и молекулы воды из цитоплазмы заимствуются пять протонов:
NO2 + 4е- + 5Н+ —> NH2OH + Н2O.
Гидроксиламин выделяется в цитоплазму, замыкая приведенную цепочку реакций. Суммарная реакция анаэробного окисления аммиака:
NH3 + NO2- + Н+ —> N2 + 2Н2O.
В мембране анаммоксосомы содержится АТФ-синтаза, которая сопрягает перенос протонов в цитоплазму с фосфорилированием АДФ. Таким образом, анаммок- сосома является уникальным дыхательным компартментом и в функциональном отношении выполняет в прокариотной клетке ту же роль, которую выполняет в эукариотной клетке симбиогенная органелла — митохондрия.
Источником нитрита для планктомицетов из группы «Аnаmmох» служит либо окисление аммиака на границе раздела между оксичной и аноксичной зонами, либо анаэробная нитратредукция. Эти биохимические процессы вызывают партнеры планктомицетов по эко ценозу, которые снабжают их нитритом, а заодно защищают их от кислорода.
Помимо планктомицетов анаэробное окисление аммиака могут осуществлять нитрификаторы (например, Nitrosomonas eutropha). В качестве окислителя они, скорее всего, используют N2O4 — димерную форму оксида азота NO2, который является одним из побочных продуктов аэробного окисления аммиака:
2NHз + 2N2O4 —> НNO2 + 1/2N2 + 4NO + Н+/е- + 2Н2O.
Возможно, что нитрификаторы способны также окислять аммиак нитритом, как делают планктомицеты из группы «Аnаmmох». Хотя такой процесс приносит мало энергии, он позволяет выжить в анаэробных условиях.
Нитрификация и анаэробное окисление аммиака имеют очень важное значение для природных и антропогенных экосистем.
Нитрификация приводит в основном к негативным последствиям, что связано с токсичным воздействием аниона нитрата на людей и животных, а также с цветением водоемов. Внесенный в почву в виде удобрения аммонийный азот переводится в более подвижную нитратную форму и легко удаляется с дренажируемых полей. Кроме того, в результате накопления нитрата лесные почвы закисляются, что вызывает «кислые» дожди. Образование нитрата на поверхности производственных сооружений, жилых строений и памятников культуры вызывает их коррозию и механическое разрушение. Побочными продуктами нитрификация являются газообразные вещества, в частности монооксид азота NO. Он разрушает озоновый экран, а также совместно с диоксидом углерода и метаном вызывает парниковый эффект, приводящий к глобальному потеплению (см. также раздел 11.4.6.2).
В то же время нитрификация отчасти полезна, поскольку она препятствует загрязнению окружающей среды токсичным аммонием. Благодаря тому, что аммиакмонооксигеназа обладает широкой субстратной специфичностью, она окисляет техногенные поллютанты — рекальцитрантные алифатические, ароматические и галоароматические соединения.
Анаэробное окисление аммиака в целом позитивно, поскольку азот выделяется в атмосферу в инертной форме, без негативного накопления нитрата в водоемах и почве.
При азотной хемолитотрофии автотрофная ассимиляция углерода осуществляется в цикле Кельвина-Бенсона-Бэссема (см. раздел 13.2.5).
11.4.4.6. Серная хемолитотрофия
Серная хемолитотрофия встречается как у бактерий, так и у архей (см. табл. 12). Источником энергии для нее служит элементная сера (S0), а также восстановленные неорганические соединения серы (англ. reduced inorganic sulfur compounds, RISC). К их числу относятся политионаты, сульфид, сульфит и тиосульфат. Основным ресурсом перечисленных субстратов служат геохимические процессы, а также энергетический и конструктивный метаболизм бактерий и архей. Кроме того, они образуются техногенным путем.
Молекула RISC может отдавать много электронов (восемь при окислении сульфида S2- в сульфат SO42-). Электроны поступают в дыхательную цепь на уровне цитохром bс1-комплекса, что позволяет синтезировать несколько молекул АТФ в расчете на молекулу окисленного субстрата.
В настоящее время реконструированы биохимические пути, которые используются прокариотами при окислении элементной серы и RISC.
Фототрофные бактерии (например, Chlorobium sp. и Chromatium sp.) используют электроны, полученные от элементной серы и RISC для восстановления НАД(Ф) и ферредоксина, необходимых для автотрофной ассимиляции углерода и азота. Довольно редко фототрофы факультативно переходят на хемолитотрофию и начинают использовать элементную серу и RISC в качестве энергетического субстрата.
Хемолитотрофные бактерии (например, Acidithiobacillus sp. и Beggiatoa sp.), а также хемолитотрофные архей (Acidianus sp. и Sulfolobus sp.) ассимилируют энергию окисления элементной серы или RISC.
Кроме того, прокариоты могут использовать электроны, полученные от элементной серы и RISC, в конструктивных восстановительных процессах. Серные прокариоты нередко сочетают хемолитотрофию с углеродной автотрофией или миксотрофией (см. раздел 13.1). Неорганический углерод ассимилируется в цикле Кельвина- Бенсона-Бэссема (например, у Acidithiobacillus ferrooxidans и Beggiatoa sp.) или в цикле Ивенса-Бьюкенена-Эрнона (например, у Acidianus sp. и Sulfolobus sp.). Механизм автотрофной ассимиляции углерода у большинства экстремофильных серных архей еще не выяснен.
Поскольку при окислении RISC филогенетически далекие друг от друга микроорганизмы катализируют одни и те же реакции, напрашивается вывод, что это очень древний биохимический процесс, который был независимо унаследован разными прокариотами от общего предка-прогенота. Согласно двум другим сценариям, способность окислять серу и RISC могла быть приобретена в результате конвергентной эволюции или «горизонтального» переноса генов.
Окисление элементной серы и растворимых RISC. Важнейшей формой RISC в почвах и водоемах служит сульфид S2-.
Окисление сульфита SO32-, тиосульфата [S-SO3]2-, симметричных политионатов -SO3 — (S)n—SO-3 (где n>1), асимметричных политионатов H-(S)n—SO-3 (где n>2) и полисульфанов (S)2-n (где n>2), а также «элементной» серы (S0) имеет подчиненное значение.
Наиболее стабильной формой элементной серы S0 являются кольцевые молекулы из восьми атомов (S8), образующие орторомбические кристаллы.
Окисление элементной серы S0(S8). Оно протекает в соответствии с суммарным уравнением:
S8 + 8O2 + 8H2O —> 8H2SO4.
Катализатором этой реакции служит оксигеназа, использующая в качестве кофактора глутатион (см. раздел 11.4.5.3). Роль восстановленного глутатиона (GS-) заключается в образовании глутатион-полисульфана GSS-8 :
S8 + GS- —> GSS-8,
GSS-8 + O2 + Н2O —> GSS-7+ SO2-3 + 2Н+.
В результате нуклеофильной атаки глутатиона на частицы орторомбической серы из них выщепляются растворимые полисульфановые цепи GSS-8, которые проникают в периплазматическое пространство. Там они окисляются с помощью оксигеназы, расположенной на наружной поверхности СМ.
Чтобы избежать нерационального выделения глутатиона в окружающее пространство, клетки должны вступить в прямой контакт с частицами S8. Поэтому при росте на среде с орторомбической серой изменяется набор адгезинов, в частности адаптивно синтезируется жгутиковый белок с молекулярной массой 40 кДа. Прикрепление к минералу осуществляется через его SН-группы, которые образуют с серой дисульфидную связь.
Окисление сульфида S2-. Сульфид накапливается в нейтральной и щелочной среде. Его окисление осуществляется с помощью периплазматической сульфидцегидрогеназы, которая использует в качестве кофакторов цитохромы с-типа или хиноны. Первичным продуктом окисления сульфида обычно называют атомарную «элементную» серу S0 (другое обозначение — [S]). Однако этот термин не следует воспринимать буквально. Истинная атомарная сера нестабильна и высокореактивна. Скорее всего, интермедиатами при окислении сульфида являются полисульфаны (Sn)2-.
Окисление недиссоциированного сероводорода H2S. Сероводород преимущественно накапливается в кислой среде и окисляется в соответствии с уравнением:
Н2S + 1/2O2 —> S0 + Н2O.
Энзиматической механизм этой реакции еще не установлен — скорее всего, на промежуточном этапе образуется связанный с СМ сульфид-сульфогидрильный комплекс [RSS-]. Кроме того, поскольку сероводород спонтанно окисляется молекулярным кислородом, реакция может идти и неферментативным путем.
Образовавшаяся в результате окисления сероводорода элементная сера откладывается в виде глобул в периплазматическом компартменте. Эти гидрофильные включения (см. I том учебника) состоят из длинноцепочечных симметричных политионатов -SO3 —(S)n—SO-3 или асимметричных политионатов Н-(S)n—SO-3 , прикрепленных к гидрофобному ядру из кольцевых молекул S8. Элементная сера, очень слабо растворяющаяся в воде, обратимо переходит в состав политионата:
S8 + HSO-3 ⇄ Н-(S)8—SO-3.
По мере надобности она окисляется до сульфита согласно уравнению реакции: S0 + O2 + Н2O —> SO3 + 2Н+.
Окисление тиосульфата [S-SO3]2- и полисульфанов (S)2-n. Оно осуществляется с помощью 8-оксигеназы, или «S-окисляющего фермента».
Тиосульфат стабилен преимущественно при нейтральном и щелочных значениях pH. В асимметричной молекуле тиосульфата различаются наружный (сульфановый**) и внутренний (сульфанильный*) атомы серы. Сульфановый атом тиосульфата или полисульфана превращается в сульфит через стадию образования промежуточного продукта [S], эквивалентного элементной сере:
[**S-*SO3]2- + SO2-3 + [S].
После этого [S] окисляется до сульфита.
Образование сульфита из [S] строгими аэробами не сопряжено с работой дыхательной цепи, тогда как у анаэробов (примером служит тионовая бактерия Thiobacillus denitrificans)происходит серазависимое восстановление цитохромов:
[S] + ЗН2O —> SO2-3 + 6Н+ + 6е-.
Окисление политпионатпов. Политионаты преимущественно устойчивы в кислых растворах. Симметричные политионаты -SO3 —(S)n—SO-3 (имеющие две терминальные сульфанильные группы) и асимметричные политионаты Н-(S)n—SO-3 (имеющие одну терминальную сульфанильную группу) образуются при окислении полисульфанов. Дитионат -SO3—SO-3 к числу политионатов не относится.
Наибольший биологический интерес представляют тритионат -SO3—S-SO-3 и тетратионат -SO3 —(S)2—SO-3.
При окислении тритионата тритионат-дегидрогеназой в числе прочих продуктов образуется тиосульфат:
2S3O2-6 + 2Н2O —> 2S2O2-3 + 2SO2-4 + 4Н+.
После этого тиосульфат окисляется молекулярным кислородом до тетратионата с помощью тиосульфат-дегидрогеназы:
2S2O2-3 + 1/2O2 + 2Н+ —> S4O2-6 + Н2O.
Ключевой промежуточный метаболит, тетратионат, расщепляется тетратионат- гидролазой, в результате чего регенерируется тиосульфат и образуется элементная сера:
S4O2-6 + Н2O —> S2O2-3+ [S] + SO2-4+ 2Н+.
В свою очередь, [S] окисляется до сульфита.
Все рассмотренные реакции локализуются в периплазматическом компартменте, и перечисленные ферменты метаболизма RISC адаптированы к низким значениям pH.
Окисление сульфита. Сульфит является сильным восстановителем (редокс-по- тенциал пары SO2-4/ SO2-3 равен -515 мВ). Хотя он токсичен и обладает широким спектром антимикробного действия, некоторые бактерии могут использовать его в качестве единственного источника энергии для хемолитотрофного роста.
Сульфит, образующийся в результате метаболизма RISC, может неферментативно окисляться в сульфат молекулярным кислородом:
SO2-3 + 1/2O2 —> SO2-4
Однако физиологически важно только окисление сульфита с помощью ферментов, что позволяет решить сразу две задачи — удалить этот токсикант и использовать его как донор электронов.
Известны два ферментативных пути окисления сульфита (рис. 111). Первый из них, прямой путь, связан с использованием сульфит: акцептор-оксидоредуктазы (sulfite: acceptor oxidoreductase, SOR). В анаэробных условиях одним из возможных акцепторов электронов служит катион Fe3+, и реакцию осуществляет мембраносвязанная сульфит: Fе3+-оксидоредуктаза:
SO2-3 + 2Fe3++ Н2O —> SO2-4+ 2Fe2++ 2Н+.
Сульфит: акцептор-оксидоредуктаза тионовой бактерии Acidithiobacillus ferrooxidans представляет собой гетероолигомер (650 кДа; субъединицы 59 и 61 кДа). У At. thiooxidans она имеет другой субъединичный состав (400 кДа; субъединицы 62, 70 и 74 кДа). В обоих случаях фермент не содержит простетических групп.
Второй, непрямой путь, заключается в АМФ-зависимом окислении сульфита с промежуточным образованием аденозин-5'-фосфосульфата (АФС) (рис. 111). Этот путь продемонстрирован у тионовых бактерий Thiobacillus denitrificans и Т. thioparus. Вначале под действием АФС-редуктазы из сульфита и АМФ образуется АФС. Сульфатная группа заменяется на фосфорильную при помощи АДФ: сульфат-аденилилтрансферазы (АДФ-сульфурилазы). В результате образуется АДФ. Затем происходит аденилаткиназная реакция: 2АДФ —> АТФ + АМФ. Сульфатная группа также может быть заменена на пирофосфатную с помощью АТФ: сульфат-аденилилтрансферазы (АТФ-сульфурилазы). В результате образуется АТФ.
Рис. 111. Прямой и непрямой путь ферментативного окисления сульфита. АФС — аденозин-5 -фосфосульфат; 1 — сульфит: акцептор-оксидоредуктаза; 2 — АФС-редуктаза; 3 — АТФ-сульфурилаза; 4 — АДФ-сульфурилаза.
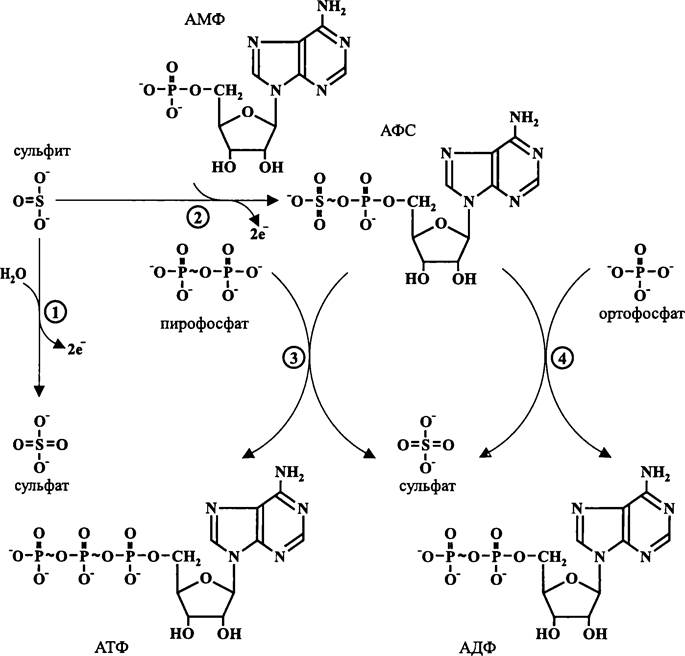
В обоих случаях энергия окисления сульфита ассимилируется в форме фосфагена (АФС). Обычно это называют «субстратным фосфорилированием», что принципиально неверно, поскольку здесь не происходит субстратное фосфорилирование АДФ. На самом деле это второй способ образования фосфагена — когда фосфорил замещает группу, присоединенную к субстрату лабильной тиоэфирной связью (см. раздел 10.3).
Конечный продукт разветвленной цепи превращений соединений серы - это анион сульфата и эквивалентное количество свободных протонов, т. е. серная кислота, при накоплении которой снижается pH среды.
Окисление нерастворимых сульфидных минералов. Из неорганических серусодержащих субстратов наиболее восстановлены и, следовательно, наиболее богаты энергией сульфиды. Природные запасы сульфида образуют сульфидные минералы-пирит FеS2, сфалерит ZnS, халькопирит СuFеS2 и другие. Однако сульфиды большинства металлов слабо растворяются в воде. Поэтому для окисления сульфидных руд бактерии прибегают к помощи двух специальных механизмов — «сульфанового» и «тиосульфатного».
Сульфановый механизм. Он используется при окислении кислоторастворимых сульфидов — например, сульфида цинка. В данном случае действующими агентами служат протоны или катионы железа.
При протонной атаке из сульфидного минерала освобождается в раствор катион металла (М2+). Образующийся одновременно с этим сероводород окисляется вначале до элементной серы, а затем до сульфата:
МS + 2Н+ —> М2+ + Н2S,
Н2S + 1/2O2 —> S0 + Н2O,
S0 + 3/2O2 + Н2O —> SO2-4 + 2Н+.
Полисульфановый минерал подвергается двойному воздействию со стороны Fе3+:
М2(S)n + 2Fе3+ —> 2М++ (S)2-n + 2Fе2+,
(S)2-n + 2Fе3+ —> [(S)n-1]2- + S0 + 2Fе2+.
Элементная сера затем окисляется до сульфата; в свою очередь, бактерии окисляют катион Fе2+ до Fе3+ (или это происходит в результате абиотической реакции). Следует отметить, что микробное выщелачивание путем окисления сульфидных минералов катионом Fе3+ лежит в основе гидрометаллургии — промышленного процесса, с помощью которого из бедных руд и заброшенных выработок дешевым способом получают медь и другие металлы.
Тиосульфатный механизм. Он используется для окисления не растворимых в кислоте сульфидных минералов, например, широко распространенного пирита FеS2. Особое значение пирита для Аt. ferrooxidans обусловлено тем, что этот неорганический субстрат является богатым источником энергии. Действительно, поскольку сера в нем находится в степени окисления -1, а железо в степени окисления +2, реакция FеS2 —>—> Fе3+ + 2SO2-4 дает 15 электронов (2S- —> 2S6+ + 2х7е-; Fе2+ —> Fе3+ + е-; 2x7+1 = 15). В данном случае катион Fе3+ действует как окислительный агент, однако образуется не полисульфан, а тиосульфат:
FеS2 + 6Fе3++ ЗН2O —>7Fe2+ + S2O2-3 + 6Н+.
В присутствииFе3+ тиосульфат нестабилен и окисляется до тетратионата, одного из важнейших интермедиатов в цикле превращений неорганической серы:
2S2O2-3 + 2Fе3+ —> S4O2-6 + 2Fе2+,
S4O2-6 + Н2O —> S2O2-3 + SO2-4+ 2Н+.
11.4.4.7. Железная хемолитотрофия
Железная хемолитотрофия встречается у бактерий и архей. Экзергоническая реакция окисления железа может поддерживать эндергонические процессы, в частности автотрофную ассимиляцию СO2. Однако бывают случаи, когда окисление субстратного железа не имеет энергетического значения, т. е. является «холостым». Таким путем устраняются токсичные формы кислорода, а накапливающиеся в покровных структурах соединения Fe3+ выполняют механопротекторную роль.
Способность аэробно окислять Fe2+ (не обязательно с целью получения энергии) широко распространена в домене Bacteria. Значительная часть железоокисляющих бактерий представлена ацидофилами, обитающими в кислых источниках или техногенных экосистемах, таких, как воды затопленных шахт и отвалы угольной породы или шлака. Некоторые из них окисляют не только водорастворимые соли Fe2+, но и сульфидные минералы, в частности пирит, что лежит в основе их использования для биологического выщелачивания металлов. Вторую крупную экологическую группу Fe2+-окисляющих бактерий составляют нейтрофилы, процветающие в богатых восстановленным железом морских и пресноводных экосистемах.
Согласно результатам секвенирования 16S рРНК, железные хемолитотрофы полифилетичны и принадлежат к нескольким сильно дивергировавшим филам бактерий. Самыми известными примерами служат Leptospirillum ferrooxidans (фила BVIII Nitrospirae), Gallionella ferruginea и Acidithiobacillus ferrooxidans (класс «Betapro- teobacteria»), а также Sulfobacillusthermosulfidooxidans (филаВХIII Firmicutes). Они обладают грамотрицательным или грамположительным морфотипом, разнообразны морфологически и гетерогенны в метаболическом плане. Способность к углеродной автотрофии у железных литотрофов наблюдается довольно редко (примером служит At. ferrooxidans), в основном это хемолитогетеротрофы или углеродные миксотрофы.
Стандартный окислительно-восстановительный потенциал пары Fe2+/Fe3+ равен +200 мВ. Изменение стандартной свободной энергии ∆G° для реакции Fe2+ —> Fe3+ + е- можно рассчитать по формуле ∆G° = -nFE° (оно относительно невелико и составляет -74,4 кДж • моль-1).
«Физиологическую» величину ∆G°', отражающую количество ассимилируемой энергии, которая преобразуется в полезную работу (например, при фосфорилировании АДФ), можно определить только экспериментальным путем, и по абсолютному значению она меньше, чем ∆G°. Таким образом, хемолитотрофные Fe2+- окисляющие бактерии могут развиваться только в богатых восстановленным железом средах.
Существенным ограничителем для использования Fe2+ в качестве донора электронов служит содержание этого катиона в растворе. В аэробных условиях соединения Fe2+устойчивы в кислой среде, тогда как при значениях pH, близких к нейтральному, катион Fe2+ окисляется кислородом воздуха. Поэтому все известные хемолитотрофные железоокисляющие бактерии либо относятся к облигатным ацидофилам — как Acidithiobacillus ferrooxidans и Leptospirillum ferrooxidans, либо предпочитают микроаэробные условия — как Gallionella ferruginea.
Механизм аэробной железной литотрофии детально изучен на примере At. ferrooxidans, которая окисляет Fe2+ согласно уравнению реакции:
4Fe2+ + O2 + 4Н+ —> 4Fe3+ + 2Н2O.
Компоненты дыхательной цепи переносят электроны от Fe2+ к кислороду (рис. 112). В окислении железа участвуют продукты генов cyc1, сус2, rus, coxA-D и открытой рамки считывания ORF1. Они объединены в оперон и котранскрибируются в составе полицистронной мРНК. Первым звеном электрон-транспортной цепи является связанная с ОМ «Fе2+-оксидаза» (правильное название — Fe-дегидрогеназа, поскольку этот фермент не передает электроны непосредственно кислороду).
Fе2+-оксидаза представляет собой высокомолекулярный цитохром с (ген сус2). Данные молекулярного секвенирования говорят о том, что он находится за пределами цитоплазматического компартмента — препротеин содержит сигнальную последовательность, которая при секреции отрезается лидер-пептидазой. Высокое
содержание полярных аминокислот делает этот цитохром устойчивым в кислой среде.
Рис. 112. Перенос электронов от железа к кислороду с участием Fе2+-оксидазы. HiPIP — высокопотенциальный железопротеин.
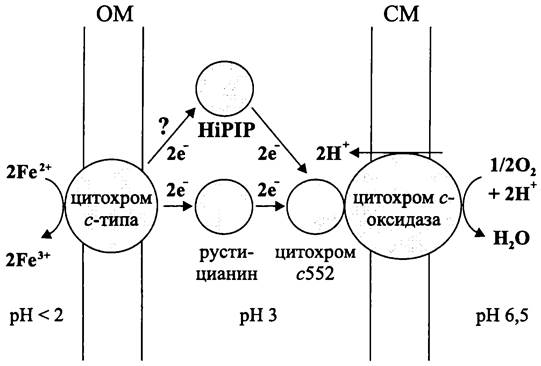
Fе2+-оксидаза передает электроны растворимому высокопотенциальному желе- зопротеину или растворимому периплазматическому медьсодержащему белку рустицианину, который кодируется геном rus. Тот, в свою очередь, восстанавливает продукт гена cyc1— периплазматический цитохром с552 (S4). Последний взаимодействует с локализованной в СМ цитохромоксидазой аа3, которая переносит электроны на молекулярный кислород. В результате работы железоокисляющей дыхательной цепи создается Pmf.
Ассимилированная энергия частично расходуется на пополнение пула АТФ, который необходим для ассимиляции СО2 в цикле Кельвина-Бенсона-Бэссема. Помимо АТФ для хемолитоавтотрофного роста нужны восстановительные эквиваленты. Однако поскольку редокс-потенциал пары Fe2+/Fe3+ выше, чем у пары НАД(Ф)/НАД(Ф)Н (соответственно +200 и -320 мВ), образование восстановленных пиридиннуклеотидов путем прямой передачи электронов от железа находится под термодинамическим запретом.
Чтобы бактерии могли получить восстановитель, часть энергии Pmf используется для «обращения» транспорта электронов. В этом случае цитохром с552 восстанавливает не цитохромоксидазу аа3, a цитохром bc1-комплекс. Последний передает электроны мембраносвязанной НАДН-дегидрогеназе (NDH-1).
Направление потока электронов по одному из альтернативных путей зависит от величины соотношения АТФ/АДФ. При высокой интенсивности конструктивного метаболизма, в частности, при активном синтезе белка энергия Рmf расходуется главным образом на восстановление НАД. В этих условиях устанавливается низкое соотношение АТФ/АДФ. По мере расходования пула аминокислот синтез белка приостанавливается, однако АТФ некоторое время продолжает накапливаться, что увеличивает соотношение АТФ/АДФ. Высокий энергетический заряд инактивирует цитохромоксидазу, в результате чего Рmf снижается. В этих условиях АТФаза гидролизует АТФ, что сопровождается выходом протонов из цитоплазматического компартмента. За счет энергии Рmf происходит «обращенный» транспорт электронов, благодаря чему синтезируется НАДН. Это продолжается до тех пор, пока концентрация АТФ не снизится до порогового значения, ингибирование цитохромоксидазы не прекратится, и направление транспорта электронов не сменится на противоположное. Таким образом, при аэробном росте Аt. ferrooxidans на среде, содержащей Fе2+, чередуются прямой и обращенный транспорт электронов, что удовлетворяет потребности клетки как в АТФ, так и в восстановительных эквивалентах.
Железо в качестве субстрата при анаэробной хемолитотрофии. На заре существования биосферы, еще до приобретения архаическими цианобактериями способности окислять воду с образованием кислорода, биогенные акцепторы электронов были в дефиците. В тот период анаэробное окисление Fе2+ имело гораздо большее значение, чем в современную геохронологическую эпоху.
В природных экосистемах при значениях pH, близких к нейтральному, соединения железа существуют главным образом в виде редокс-пар Fе(ОН)3/Fе2+или, если в среде накапливается бикарбонат, в виде Fе(ОН)3/(НСО-3 /FеСО3). Их редокс- потенциалы равны соответственно -236 и +200 мВ.
Редокс-потенциал для всех четырех сопряженных пар пути восстановления нитрата NO-3 —> NO-2 —> NO —> N2O —> N2 существенно выше этих значений. Он равен +430 мВ (для пары NO-3/NO-2), +350 мВ (для пары NO-2/NO), +1180 мВ (для пары NO/N2О) и +1350 мВ (для пары N2O/N2). Поэтому при окислении Fе2+свободную энергию можно ассимилировать за счет восстановления нитрата.
Известен ряд представителей классов «Веtaproteobacteria» и «Саmmaproteobacteria», которые растут хемолитотрофно с использованием Fe2+ в качестве единственного источника энергии. Акцептором электронов служит нитрат ион восстанавливается до молекулярного азота:
10FeCO3 + 2NO-3 + 24Н2O —> 10Fe (OH)3 + N2 + 10НСО-3 + 8Н+.
Энергетический выход приведенной реакции относительно невелик, и поэтому она имеет физиологический смысл лишь при высокой концентрации Fe2+ в экосистеме. Несмотря на широкое распространение железоокисляющих бактерий в анаэробном деструктивном сообществе, этот процесс имеет подчиненный характер по сравнению с «ацетатным» и «водородным» трофическими путями (см. раздел 11.2.2).
В целом необходимо отметить, что железо как субстрат литотрофии относительно бедно энергией. Во-первых, при окислении оно дает лишь один электрон (для сравнения, окисление сульфида до сульфата дает восемь электронов). Во-вторых, электроны поступают в дыхательную цепь на уровне цитохрома с (не цитохрома b, как в случае RISC), что сокращает число точек сопряжения до одной и сводит к минимуму количество синтезируемых молекул АТФ (0,2-0,3) в расчете на молекулу окисляемого субстрата. Железные литотрофы вынуждены компенсировать энергетическую неэффективность Fe2+ экстенсивным способом, перерабатывая очень большое количество этого субстрата. Поэтому в их среде обитания накапливаются нерастворимые оксиды и гидроксиды Fe3+, имеющие характерный охристый цвет.
11.4.4.8. Марганцевая хемолитотрофия
В отличие от железной хемолитотрофии, марганцевая хемолитотрофия возможна только у бактерий и только в аэробных условиях. Примеры марганцевой хемолитотрофии у архей неизвестны.
Бактерии, окисляющие Fe2+, могут окислять и Мn2+. Однако в природе эти процессы обычно разобщены из-за того, что окисление катиона Мn2+ происходит при pH 6-8, когда последний химически стабилен, а катион Fe2+, напротив, неустойчив.
Большинство Мn2+-окисляющих бактерий относится к филе BXII Proteobacteria. Хотя окислять марганец (не обязательно с целью получения энергии) могут многие гетеротрофные формы, до сих пор не описан ни один марганцевый хемолитоавтотроф. Наиболее вероятными марганцевыми хемолитотрофами являются представители семейства Pseudomonadaceae (класс «Gammaproteobacteria»). В частности, это морские штаммы Pseudomonas sp. В-16 и S-36 и пресноводные штаммы МnВ-1 и GB-1, а также группа Мn2+-окисляющих бактерий, отнесенная к семейству «Siderocapsaceae».
Окислительно-восстановительный потенциал пары Мn2+/МnO2 очень высокий (+1228 мВ). Соответственно, рассчетная стандартная свободная энергия ∆G° реакции
Мn2+ + 1/2O2 + Н2O —> МnO2 + 2Н+ составляет -237 кДж • моль-1.
Как и в случае Fе2+, величину ∆G°′ можно определить экспериментальным путем. Хотя она составляет только -70 кДж • моль-1, этого достаточно для хемолитотрофного роста, и Мn2+-окисляющие бактерии могут развиваться даже в бедных восстановленным марганцем экосистемах.
Биоэнергетическое окисление Мn2+ подразумевает, что в нем участвует электрон-транспортная цепь, и свободная энергия ассимилируется в форме Рmf.
Марганец окисляется «Мn2+-оксидазой», связанной с ОМ (рис. 113). Правильное название этого фермента — Мn2+-дегидрогеназа/оксигеназа, поскольку он получает электроны от субстрата, однако не передает их непосредственно кислороду (в ходе реакции вода освобождает протоны, а атом кислорода присоединяется к субстрату).
Рис. 113. Перенос электронов от марганца к кислороду с участием Мn2+-оксидазы.
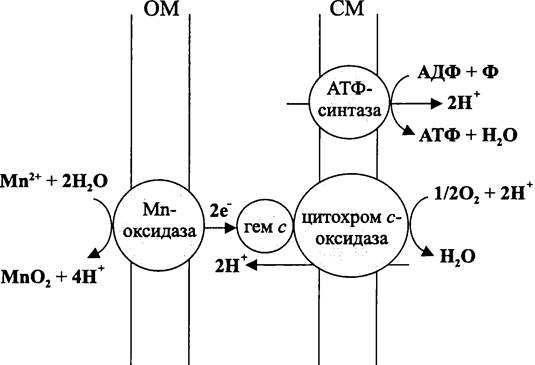
Установлено, что в окислении марганца участвует периплазматический фактор, который является посредником между Mn-оксидазой и цитохромом с. Последний, в свою очередь, передает электроны цитохромоксидазе аа3. В результате взаимодействия Mn-оксидазы с электрон-транспортной цепью создается Pmf.
Идентифицированы гены, кодирующие Mn-оксидазу Bacillus sp. SG-1, Leptothrix discophora, Pedomicrobium sp. и Pseudomonas putida GB-1. Продукты их экспрессии относят к суперсемейству медьсодержащих оксидаз.
Данные ферменты содержат «купредоксиновые» центры I, II и III типа, которые различаются по характеру и расположению лигандов.
В центре I типа (рис. 114) атом меди координирован тремя лигандами — двумя атомами азота и одним атомом серы, которые входят в состав боковых радикалов двух остатков His и остатка Cys (расположены в экваториальной области апопротеина). Возможна дополнительная координация атома меди четвертым лигандом — атомом серы бокового радикала остатка Met (расположен вне экваториальной области). Центры I типа выполняют функцию межмолекулярного переноса электронов.
Рис. 114. Мононуклеарные и бинуклеарные (А) и тринуклеарные (Б) «купредоксиновые» центры медьсодержащих оксидаз. L — атомы азота или кислорода, выполняющие роль лигандов.
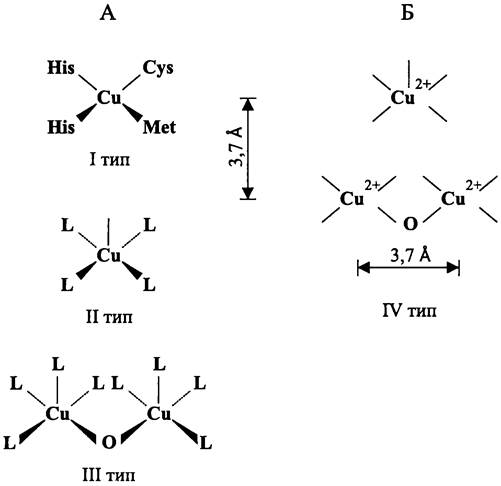
Атом меди в центре II типа (рис. 114) координирован четырьмя планарно расположенными N- или О-лигандами, которые представлены остатками His и молекулами воды. Функция этих центров — каталитическое окисление субстрата.
Атомы меди в центре III типа (рис. 114) образуют кластер, компоненты которого координированы четырьмя расположенными в одной плоскости N- или О-лигандами, причем один из атомов кислорода участвует в образовании ковалентной связи между атомами меди. Функцией центров III типа является перенос атомов кислорода.
Типичная медьсодержащая оксидаза состоит из трех купредоксиновых доменов, каждый из которых образован восемью антипараллельными β-цепями. Особенностью таких оксидаз является близкое расположение центров II и III типа, в результате чего образуется «центр IV типа» (рис. 114). Вблизи этого кластера находится центр I типа, что обеспечивает эффективный внутримолекулярный перенос электрона. Центр I типа участвует в четырех последовательных актах переноса электрона на «центр IV типа», который передает кислороду сразу четыре электрона.
Молекулярно-генетические свойства Мn2+-оксидазы изучены на примере пресноводной бактерии Pseudomonas putida GB-1. Фермент является типичной медьсодержащей оксидазой и локализован в ОМ. В составе ее оперона имеются два гена: сumА (кодирует апопротеин фермента) и сumВ (регулирует скорость роста культуры). Белок Cum А содержит сигнальную последовательность, удаляемую при секреции.
Роль Мn2+-оксидазы не ограничивается обеспечением марганцевой хемолитотрофии, поскольку она может косвенно участвовать и в окислении многих органических субстратов. Окисленные формы марганца (особенно Мn3+) действуют как химические реагенты, разрушающие ароматические соединения. Вероятно, первичной функцией медьсодержащих оксидаз было именно окисление рекальцитрантных субстратов.
Системы окисления Мn2+ (в том числе абиотические) очень разнообразны, и его биологический смысл может различаться у разных микроорганизмов. Поэтому крайне трудно доказать, что бактерия является марганцевым хемолитотрофом. В любом случае, как и при окислении железа, в среде в изобилии появляются нерастворимые оксиды и гидрооксиды марганца, имеющие характерный охристый цвет.
11.4.4.9. Хемолитотрофия во «второй биосфере» и «третьей биосфере»
Альтернативой космической энергии, или квантового излучения Солнца является внутренняя энергия Земли. Иными словами, инфракрасный свет, или геотермальное тепло может обеспечивать фототрофию в недрах нашей планеты, а поступающие на земную поверхность неорганические субстраты могут обеспечивать хемолитотрофию.
«Вторая биосфера». В начале 1980-х годов на океаническом дне в зонах контакта тектонических плит на глубине 1,5-3 км были обнаружены гидротермальные источники, вокруг которых развиваются популяции беспозвоночных животных (моллюсков Bathymodiolus и Calyptogena, а также вестиментифер Riftia). Источником питания для них служит первичная продукция эндоцитобионтов — окисляющих серу хемолитоавтотрофных бактерий. В 1990-е годы вокруг донных выбросов природного газа были обнаружены колонии двустворчатых моллюсков и других беспозвоночных, которые используют продукты автотрофного биосинтеза эндоцитобиотических бактерий, аэробно окисляющих метан.
Бедные видами экосистемы «второй биосферы» зависят только от локальных геологических ресурсов неорганического субстрата, служащего источником энергии. В результате этого подводные «оазисы жизни» существуют независимо от главной, «первой» биосферы.
«Третья биосфера». В толще земной коры, недавно были обнаружены микробные сообщества, которые не зависят от притока источников органического углерода с земной поверхности. Нишей для таких оазисов «третьей биосферы» служит рудное тело пирита FeS2-. Установлено, что в эти автономные ассоциации входят железоокисляющие бактерии, принадлежащие к родам Leptospirillum (фила BVIII Nitrospirae), Sulfobacillus (фила BXIII Firmicutes) и Acidimicrobium (фила BXIV Actinobacteria), а также железоокисляющие археи, относящиеся к роду Ferroplasma (фила АII Euryarchaeota).
11.4.5. Органические акцепторы электронов
Эффективность работы дыхательной цепи зависит от пропускной способности ее конечного звена — терминальной редуктазы, взаимодействующей с терминальным акцептором электронов. При этом особо важны два встречных обстоятельства:
— доступность акцептора электронов, т. е. его концентрация (если он растворимый) или способность клетки преодолеть расстояние до него (если он нерастворимый) ;
— сродство активного центра редуктазы к акцептору электронов.
Кроме того, очень важное значение имеет физиологическая целесообразность использования того или иного акцептора электронов. На первый взгляд, очевидно преимущество неорганических акцепторов, поскольку органику выгоднее окислять, чем восстанавливать. Однако в реальных условиях выбор акцептора зависит от взаимоотношений, складывающихся в микробиоте.
Существуют примеры очень эффективной адаптации к органическому акцептору электронов, например, фумарату, если его образует партнер по трофической ассоциации. В других случаях выгоден эндогенный синтез органического акцептора, причем это можно делать как гетеротрофным, так и автотрофным способом.
11.4.5.1. Экзогенный фумарат
Фумаратное дыхание широко распространено у бактерий, окисляющих с помощью «первичных» дегидрогеназ разнообразые доноры электронов — дигидрооротат, молекулярный водород, НАДН, формиат, 3-фосфоглицерат и т. д. К ним, в частности, относятся энтеробактерии из родов Escherichia, Klebsiella, Proteus и Salmonella (класс «Gammaproteobacteria»), Vibrio succinogenes (класс «Gammaproteobacteria»), Wolinella succinogenes (класс «Epsilonproteobacteria», а также Bacteroides succinogenes (фила BXXII Bacteroidetes).
Молекулярный механизм фумаратного дыхания лучше всего изучен на примере бактерии Wolinella succinogenes, которая была впервые выделена в начале 1960-х годов из коровьего рубца. В данном случае в качестве доноров электронов выступают формиат или водород.
При фумаратном дыхании Pmf создается таким же путем, как и при дыхательной аммонификации нитрита (см. ниже), хотя фумарат является менее сильным окислителем, чем нитрит — стандартный редокс-потенциал пары фумарат/сукцинат составляет +30 мВ, а пары NO2/NH+4 равен +340 мВ. В донорном участке дыхательной цепи в обоих случаях используется одна и та же формиатдегидрогеназа или гидрогеназа.
Главное различие фумаратной и нитритной дыхательных систем связано с природой терминальной редуктазы — при фумаратном дыхании взамен дыхательной нитритредуктазы используется фумаратредуктаза.
Фумаратредуктаза W. succinogenes состоит из обращенной в цитоплазму большой каталитической субъединицы (FrdA; 70 кДа), амфипатической субъединицы (FrdB; 27 кДа) и гидрофобной субъединицы (FrdC; 15 кДа). Субъединица FrdA содержит простетическую группу ФАД, ковалентно присоединенную к остатку His-44 (см. рис. 104). «Коннекторная» субъединица FrdB содержит [Fе2S2]-кластер, [Fе3S4]- кластер и [Fe4S4]-кластер, лигандированные остатками Cys. Гидрофобная «якорная» субъединица FrdC представляет собой содержащий две геминовые группы, или «дигемовый» цитохром b, который состоит из трех интегральных спиралей по 25 аминокислотных остатков каждая. В отдельных случаях, например, у Е. coli, имеется вторая «якорная» субъединица (FrdD, 13 кДа).
Электроны от субстрата передаются менахинонному пулу, а затем последовательно переносятся простетическими группами субъединиц FrdC, FrdB и FrdA на фумарат.
Дигемовые цитохромы b входят, помимо фумаратредуктазы, в состав мембраносвязанной uptake NiFe-гидрогеназы, нитратредуктазы, нитритредуктазы, сукци- натдегидрогеназы, формиатдегидрогеназы и цитохром bc1(b6f)-комплекса. Эти гетерологичные белки различаются по способу лигандирования гемов, ориентации в мембране и характеру взаимодействия с хинонным пулом. В частности, дигемовый цитохром b, входящий в состав фумаратредуктазы Frd, окисляет хинон на периплазматической стороне мембраны. В отличие от него дигемовый цитохром b, входящий в состав цитохром bc1(b6f)-комплекса, окисляет и восстанавливает хинон на двух противоположных сторонах мембраны (см. раздел 10.4.6).
11.4.5.2. Эндогенный фумарат
Биосинтез пропионата.Биосинтез пропионовой кислоты с ее выделением во внешнюю среду обычно называют «пропионовым брожением». Однако на самом
деле этот процесс представляет собой анаэробное дыхание, при котором в качестве терминального акцептора электронов используется эндогенный фумарат.
Члены сборной группы пропионовокислых бактерий (правильно будет — «пропионовокислотных») принадлежат к филам ВХIII Firmicutes (Clostridium propionicum, Selenomonas ruminantium, Veillonella alcalesens и др.) и BXIV Actinobacteria (Mi- cromonospora carbonacea, Propionibacterium freudenreichii и др.)- Главной нишей для них является пищеварительный тракт жвачных животных и термитов. Некоторые пропионовокислые бактерии используются в промышленности (для получения витамина В12 и швейцарского сыра). В то же время при развитии на кожных покровах человека они служат причиной локальных воспалений.
Пропионовокислые бактерии катаболизируют гексозы по гексозобисфосфатному пути (см. раздел 11.3.2.1). Кроме того, с помощью лактатдегидрогеназы они могут окислять экзогенный лактат до пирувата.
Биосинтез пропионовой кислоты служит отдельным примером «судьбы» пирувата, когда этот продукт гликолитического пути используется при биосинтезе эндогенного акцептора электронов для дыхания. На это у пропионовокислых бактерий предназначен цикл метилмалонила-СоА, побочным продуктом которого является пропионат (рис. 115).
Рис. 115. Эндогенное фумаратное дыхание, сопровождающееся биосинтезом пропионата (метилмалонил-СоА-цикл). 1 — метилмалонил-СоА-карбокситрансфераза; 2 — малатдегидрогеназа; 3 — фумарат- гидратаза; 4 — фумаратредуктаза; 5 — СоА-трансфераза; 6 — метилмалонил-СоА-мутаза; [-СОО-] — карбоксибиотин.
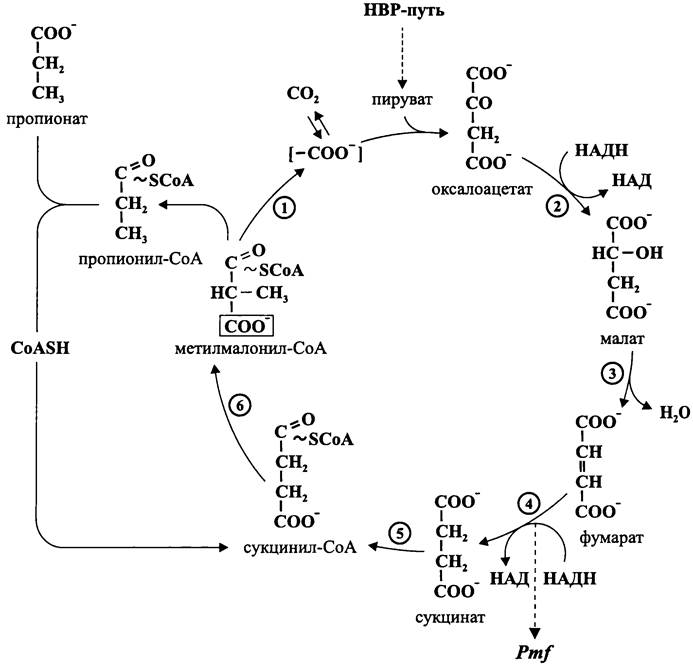
Вначале пируват карбоксилируется метилмалонил-СоА-карбокситрансферазой с образованием оксалоацетата. Эту ключевую реакцию биосинтеза пропионата в 1960 г. открыл Вуд, хотя способность бактерий из рода Propionibacterium ассимилировать СО2 он обнаружил вместе с Веркманом (С. H. Werkman) еще в середине 1930-х годов. Впоследствии оказалось, что «гетеротрофное» карбоксилирование с помощью биотинзависимых транскарбоксилаз широко используется в анаболических путях прокариотов и эукариотов (например, при биосинтезе жирных кислот).
Переносчиком карбонильной группы является ковалентно связанный кофермент — биотин, или витамин Н (см. рис. 82). Образовавшийся оксалоацетат восстанавливается до малата, который затем дегидрируется в фумарат. Теперь настает черед мембранной фумаратредуктазы (см. раздел 11.4.5.1), и благодаря фумаратному дыханию создается Pmf.
Сукцинат, полученный в результате восстановления фумарата, активируется при помощи СоА-трансферазы, причем в качестве донора СоА используется пропионил- СоА. Затем под действием метилмалонил-СоА-мутазы сукцинил-СоА превращается в метилмалонил-СоА; при этом в качестве коэнзима используется витамин В12 (см. рис. 80). На завершающей стадии цикла метилмалонил-СоА-карбокситрансфераза переносит карбоксильную группу [-СОО-] на пируват, и метилмалонил-СоА превращается в пропионил-СоА, который затем служит донором СоА-группы для сукцината. Дезактивированный пропионат выделяется в окружающую среду.
Пропиопогенез — это особый тип анаэробного дыхания, когда акцептором электронов служит эндогенный фумарат, образующийся в комплексном пути энергетического и конструктивного метаболизма, побочным продуктом которого является пропионат.
Интересно, что метилмалонил-СоА-цикл, связанный с выделением пропионата и сопровождающийся фумаратным дыханием, встречается не только у бактерий, но и у некоторых круглых и кольчатых червей, способных жить в анаэробных условиях (например, Ascaris lumbricoides и Arenicola marina).
В заключение отметим, что метилмалонил-СоА-карбокситрансфераза может действовать и в обратном направлении, в результате чего пропионил-СоА через стадию образования метилмалонил-СоА превращается в сукцинил-СоА. Такой механизм позволяет некоторым бактериям (например, Rhizobium) включать в анаболические пути остаток пропионата, образующийся в результате расщепления жирных кислот с нечетным числом атомов углерода, а также таких аминокислот, как валин и изолейцин.
Биосинтез сукцината. Сукцинат, или янтарная кислота является одним из продуктов метаболизма энтеробактерий, в частности Е. coli, которые альтернативно ассимилируют энергию — путем брожения смешанного типа (см. раздел 11.3.4.6) и путем аэробного или анаэробного дыхания.
При фумаратном дыхании фосфоэнолпируват «гетеротрофно» карбоксилируется с помощью фосфоэнолпируват-карбоксилазы, в результате чего образуется оксалоацетат. Затем оксалоацетат восстанавливается в малат, с помощью, НАДН- зависимой малатдегидрогеназы, а малат превращается в фумарат с помощью фумаратгидратазы (см. рис. 115).
Дыхательная цепь, в состав которой входит мембраносвязанная фумаратредуктаза (см. раздел 11.4.5.1), создает Рmf и восстанавливает фумарат до сукцината.
11.4.5.3. Экзогенный органический гетеродисульфид
В редких случаях при дыхании в качестве терминального акцептора электронов используются экзогенные органические гомодисульфиды или гетеродисульфиды со структурой соответственно R-SS-R или R-SS-R1.
Например, для мезофильной бактерии Desulfuromonas acetoxidans и гипертермофильного археота Pyrobaculum islandicum такими акцепторами могут быть экзогенный цистин:
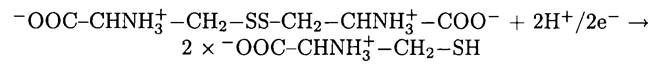
или окисленная форма экзогенного глутатиона:
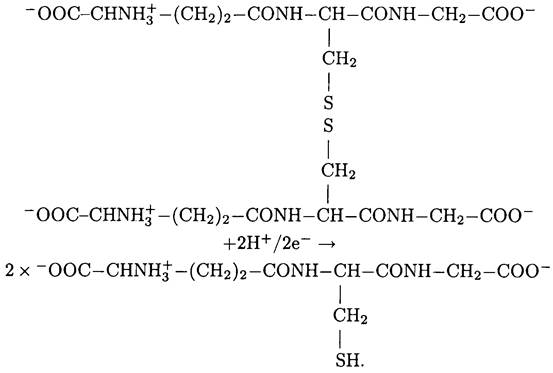
11.4.5.4. Эндогенный органический гетеродисульфид: биосинтез метана
Метаногенные археи из филы АII Euryarchaeota обладают уникальной способностью использовать в качестве терминального акцептора электронов не экзогенный, а эндогенный органический гетеродисульфид.
Физиологический смысл многоэтапного пути биосинтеза метана состоит в том, чтобы синтезировать органический гетеродисульфид СоВ-SS-СоМ, который послужит эндогенным акцептором электронов при анаэробном дыхании:
СоВ-SS-СоМ + 2е- + 2Н+ —> СоВ-SН + СоМ-SН.
Микробное образование метана является очень важным звеном в цикле углерода. С ним ассоциирован завершающий этап анаэробного распада органики при дефиците таких терминальных акцепторов, как сульфат или нитрат. Не менее 1% растительной биомассы, образующейся в результате фотосинтетической ассимиляции неорганического углерода, ежегодно превращается в 109 т метана. По примерным расчетам, в морских осадках и толще вечной мерзлоты хранятся колоссальные залежи метана (до 1013 т) в виде твердых газогидратов. За последнее столетие концентрация атмосферного метана возросла почти в 2,5 раза, что усилило парниковый эффект и привело к глобальному потеплению.
Значение метаногенов также заключается в том, что они окисляют водород и ацетат, предотвращая их вредное накопление в анаэробных экосистемах.
Существуют два способа метаногенеза— «автотрофный» («гидрогенотрофный») и «гетеротрофный».
Облигатно гидрогенотрофные метаногены используют СО2/Н2, а также физиологические эквиваленты этой пары субстратов —СО/Н2О или формиат НСОО-/Н+. К ним относятся представители порядков Мethanobacteriales, Меthanomicrobiales, Methanococcales и Меthanopyrales.
Факультативно гетеротрофные метаногены обладают более широкими метаболическими возможностями. Они также могут использовать СО2/Н2, но при дефиците водорода получают восстановитель благодаря окислению С1-субстратов— метанола, метилированных аминов и метилированных тиолов. Кроме того, они могут окислять С2-субстрат — ацетат. Одноуглеродные соединения окисляются с образованием восстановленной формы коэнзима F420 (см. ниже), а электроны, полученные при окислении ацетата, восстанавливают ферредоксин. К этой группе относятся представители порядка Меthanosarcinales.
Применительно к метаногенезу в литературе часто используются два термина — «метановое брожение» и «углекислотное дыхание».
Они оба ошибочны. Метаногенез ни в коем случае нельзя считать метановым брожением, хотя он и связан с интенсивным газообразованием, а также происходит в анаэробных условиях. В отличие от цитозольных брожений, этот процесс частично протекает на уровне СМ, и энергия первично ассимилируется не путем фосфорилирования АДФ на уровне субстрата, а в форме Рmf и Smf.
В свою очередь, метаногенез нельзя называть углекислотным дыханием, поскольку диоксид углерода не служит терминальным акцептором электронов для электрон-транспортной цепи. На самом деле СО2 при помощи цитозольных ферментов восстанавливается в конструктивном пути до метильной группы, и на это расходуется Рmf. И все же метаногенез попадает под определение дыхания — электроны от окисляемых субстратов передаются эндогенному акцептору (гетеродисульфиду) через электрон-транспортную цепь, локализованную в СМ, а энергия ассимилируется в форме Рmfи Smf.
В отличие от дыхания хемогетеротрофов, при котором субстрат окисляется цитозольными дегидрогеназами, в метаногенезе участвуют и мембраносвязанные дегидрогеназы — гидрогеназа и дегидрогеназа монооксида углерода. Кроме того, при метаногенезе используется не экзогенный, а эндогенный терминальный акцептор электронов. Но суть процессов, происходящих в экзергонической фазе дыхания и метаногенеза, одна и та же.
Метаногенез — это особый тип анаэробного дыхания, когда акцептором электронов служит эндогенный гетеродисульфид, образующийся в комплексном пути энергетического и конструктивного метаболизма, побочным продуктом которого является метан.
Таким образом, метаногенез представляет собой тесно взаимосвязанную систему реакций конструктивного и энергетического метаболизма.
Образование богатого энергией метана (стандартная энтальпия полного окисления метана составляет -882 кДж • моль-1), который не используется самими метаногенами, производит впечатление процесса, расточительного с биоэнергетической точки зрения.
Действительно, промежуточные этапы биосинтеза метана, начиная с акцептирования углекислоты, представляют собой эндергонические реакции. Однако «цель оправдывает средства» — на завершающем этапе метаногенеза, когда часть метальных групп переносится на СоМ, а затем восстанавливается до метана, археи получают возможность ассимилировать энергию, освобождающуюся при окислении экзогенного донора электронов (в частности, водорода). Остальные метальные группы используются при автотрофном биосинтезе ацетата в «пути Вулфа» (см. раздел 13.3.1).
Благодаря тому, что одна из групп архей в ходе эволюции приобрела гетеродисульфидредуктазу, возник глобальный механизм, обеспечивающий отток электронов при анаэробном окислении водорода или монооксида углерода. За счет способности не только синтезировать, но и расщеплять ацетат гетеротрофные метаногены регулируют уровень накопления этого ключевого метаболита в анаэробных экосистемах.
Биохимия метаногенеза во многом уникальна, и в первую очередь это касается используемых коферментов.
Одни из них играют роль переносчиков C1-группы в разной степени восстановленности — от формила до метила (рис. 116). К ним относятся метанофуран (англ. methanofuran, MF), тетрагидрометаноптерин (англ. tetrahydromethanopterin, Н4МРТ) и 2-меркапто-этансульфонат, или коэнзим М (англ. 2-mercaptoethanesulfonate, СоМ).
Другие кофакторы играют роль доноров электронов (рис. 117). Это 5- деазафлавин, или коэнзим F420 (англ. 5-deazaflavin), 7-меркапто-гептаноил-треонин- фосфат, или коэнзим В (англ. 2-mercaptoheptanoylthreonine phosphate, СоВ) и мета- нофеназин (англ, methanophenasine, МР).
Риг. 116. Кофакторы, испольльзуемые для переноса С1-группы при метаногенезе и окислении формальдегида. R — 4, 5-дикарбоксиоктандиоил-глутамил-глутамил-парааминоэтил-феноксиметил; R1 — фенил-рибитил-рибитилфосфат-гидроксиглутарат (фенил-рибитил-рибитил в случае окисления формальдегида).
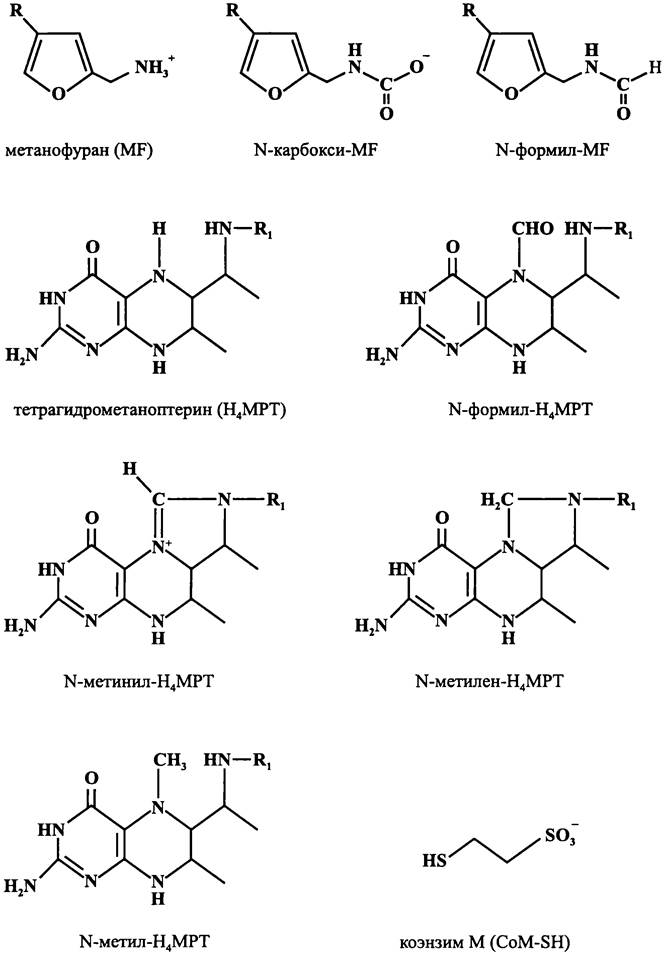
Рис. 117. Кофакторы, используемые для переноса электронов при метаногенезе. R — рибитилфосфат-лактил-глутамил-глутамат. Пунктирной рамкой выделен обратимо восстанавливающийся участок в сопряженной трициклической системе.
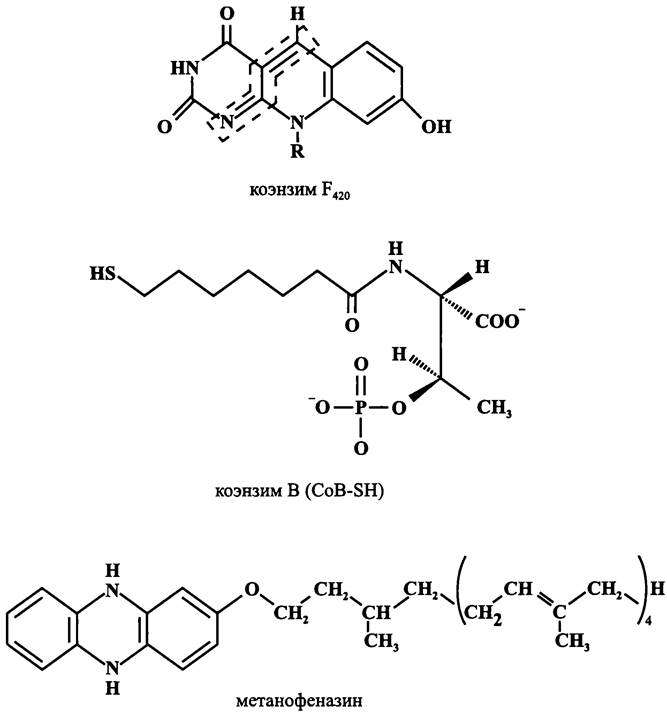
Еще совсем недавно MF, Н4МРТ, СоМ и F420считали уникальными для метаногенеза. Однако в последнее время выяснилось, что они могут участвовать в реакциях генерального и специализированного метаболизма у других прокариотов и даже у эукариотов. Примерами служат сераза- висимый археот Archaeoglobus fulgidus, бактерии Methylobacterium extorquens, Mycobacterium sp., Nocardioides simplex, Rhodococcus rhodochrous, Streptomyces sp., Synechococcus sp. и Xanthobacter sp., a также зеленая водоросль Scenedesmus acutus.
Мы уже упоминали Н4МРТ в связи с одним из двух путей окисления формиата у метилотрофной бактерии М. extorquens (см. раздел 11.4.4.2). Поскольку некоторые H4МРТ-зависимые ферменты метилотрофов и метаногенов (например, циклогидролаза) взаимно гомологичны, в ходе эволюции они могли быть переданы от архей к бактериям путем «горизонтального» переноса генов.
Автотрофный, или гидрогенотрофный метаногенез. Данный процесс протекает в соответствии с суммарным уравнением:
СO2 + 4Н2 —> СН4 + 2Н2O.
Система реакций автотрофного метаногенеза, или «цепь Вулфа» (R. S. Wolfe) состоит из четырех сопряженных циклов (рис. 118).
Рис. 118. «Гидрогенотрофный» путь метаногенеза. I, II, IIIа и IIIb — промежуточные циклы. MF — метанофуран; Vht, Frh и Vho — гидрогеназы; Pmf — протонный градиент; Smf — натриевый градиент; F420 — коэнзим F420; СоМ — коэнзим М; СоВ — коэнзим В; F430 — коэнзим F430; Hd — гетеродисульфид; Hdr — гетеродисульфид-редуктаза; 1 — М-формил-МF-дегидрогеназа; 2 — N-формил-метанофуран:Н4МРТ-формилтрансфераза; 3 — циклогидролаза; 4 — N-метилен-Н4МРТ-дегидроге- наза; 5 — N-метилен-Н4МРТ-редуктаза; G — N-метил-Н4МРТ:СоМ-SН-метилтрансфераза; 7 — S-метил- СоМ-редуктаза.
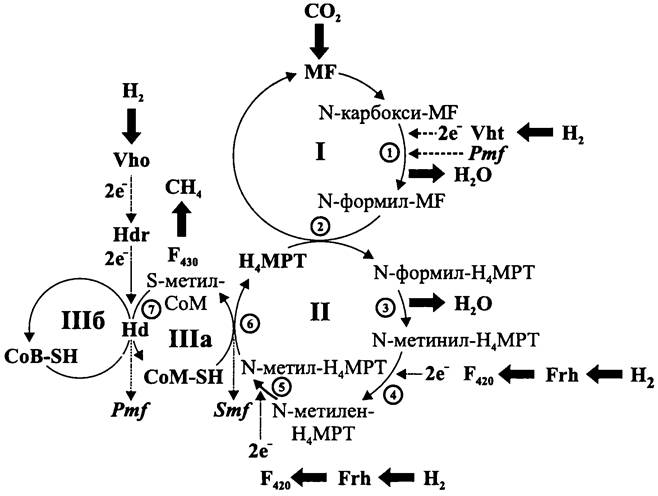
Цикл I. MF спонтанно акцептирует молекулу СO2, в результате чего образуется N-карбокси-MF.
N-карбокси-MF восстанавливается в Т-формил-MF. Катализатором служит мембраносвязанная Т-формил-МF-дегидрогеназа, которая получает электроны
от мембраносвязанной гидрогеназы. В этой эндергонической реакции (∆G°' = 16 кДж • моль-1) расходуется Рmf или Smf.
N-формил-МF-дегидрогеназа, выделенная из Мethanosarcina barkeri, состоит из пяти субъединиц и в качестве простетических групп использует несколько [Fe4S4]-кластеров, а также молибденовый кофактор — МGD (см. рис. 109). Гены, кодирующие этот фермент, образуют оперон fmdEFACDB. Субъединица FmdB содержит молибденовый активный центр и один [Fe4S4[-кластер; с субъединицей FmdF связаны восемь [Fе4S4]-кластеров.
Водород окисляется мембраносвязанной гидрогеназой, которую кодирует оперон uht. Ее гемсодержащая субъединица VhtС через серию [Fе4S4]-кластеров, расположенных на субъединице FmdF N-формил-МF-дегидрогеназы, передает электроны каталитической субъединице FmdВ. Поскольку редокс-потенциал субъединицы FmdР ниже, чем редокс-потенциал субъединицы VhtС, происходит «обращенный» транспорт электронов: VhtС + е- —> FmdF (источником энергии для этого служит Рmf или Smf).
Многие гидрогенотрофные метаногены могут использовать в качестве субстрата для метаногенеза не только водород, но и формиат (представители порядка Methanosarcinalesтакой способностью не обладают):
4НСООН —> СН4 + ЗСO2 + 2Н2O.
Формиат окисляется с помощью мембранной формиатдегидрогеназы, имеющей большое сходство с формиатдегидрогеназой Fdh-N (см. раздел 11.4.6.2). Этот фермент состоит из амфипатических субъединиц, простетическими группами которых служат молибдоптерин и [Fe4S4]-кластеры. При окислении формиата образуется восстановленная форма коэнзима F420, а также молекула СО2, поступающая в основной путь метаногенеза.
Цикл II. N-формил-MF передает формильную группу другому переносчику — Н4МРТ.
Данную реакцию катализирует растворимая N-формил-метанофуран:H4МРТ- формилтрансфераза (англ. formylmethanofuran:H4MPT formyltransferase, Ftr). Ее единственная субъединица молекулярной массой 32 кДа не имеет гомологов среди всех известных ферментов.
N-формил-H4МРТ с помощью растворимой N-метинил-H4МРТ-циклогидролазы (англ. methenyl-H4MPT cyclohydrolase, Mch) превращается в М-метинил-H4МРТ. Первичная структура единственной субъединицы этого фермента молекулярной массой 35 кДа уникальна.
Затем N-метинил-H4МРТ с помощью растворимой N-метилен-H4МРТ-дегидрогеназы (англ. methylene-H4MPT dehydrogenase, Mdh) восстанавливается в N- метилен-Н4МРТ.
Наконец, N-метилен-H4МРТ с помощью растворимой N-метилен-Н4МРТ-редук- тазы (англ. methylene-H4MPT reductase, Мег) восстанавливается в N-метил-H4МРТ. Ее единственная субъединица гомологична белкам, входящим в суперсемейство «деазафлавинзависимых» дегидрогеназ других архей и ряда бактерий.
На обоих этапах ферментативного восстановления кофактором служит деазафлавин F420 (редокс-потенциал -360 мВ). Он получает электроны от растворимой «восстанавливающей F420» гидрогеназы Frh, которая кодируется опероном frhADGB. Большая каталитическая субъединица Frh А содержит железоникелевый центр, лигандированный консервативными мотивами R-X-C-X-X-C-X-X-X-H (на N-конце) и D-P-C-X-X-C-X-X-H/R (на С-конце). Малая каталитическая субъединица FrhG содержит два-три [Fе4S4]-кластера. Субъединица FrhBсвязывает F420 и один [Fе4S4]-кластер.
Цикл IIIа. N-метил-H4МРТ передает метильную группу терминальному переносчику — восстановленной форме СоМ (CoM-SH). Катализатором этой реакции служит мембраносвязанная N-метил-Н4МРТ: СоМ-SН-метилтрансфераза (англ. methyl-H4MPT: CoM-SH-methyltransferase, Mtr). В состав этого фермента входят:
— гидрофобные субъединицы MtrB (12 кДа), MtrC (24 кДа), MtrD (20 кДа), MtrF (12 кДа) и MtrG (13 кДа);
— амфипатические субъединицы MtrE (28 кДа) и MtrH (34 кДа);
— амфипатическая субъединица Mtr А (23 кДа), с которой связаны две простети- ческие группы 5-гидроксибензимидазолил-кобамида, или витамина В12 (см. рис. 80). Редокс-потенциал пары Со3+/Со+ составляет -426 мВ. По последним данным, метилтрансфераза также содержит [Fе4S4]-кластер с редокс-потенциалом -215 мВ. Данная реакция экзергонична (∆G°' = - 29 кДж • моль-1), причем свободная энергия ассимилируется в форме Smf.
Полученный СН3—S-CoM подвергается восстановительному деметилированию. Катализатором этой реакции служит растворимая S-метил-СоМ-редуктаза (англ. metyl-S-CoMreductase, Мсг). Она представляет собой гексамер α2β2y2 молекулярной массой 300 кДа и в качестве простетических групп содержит две молекулы никель- порфиноида F430 (рис. 119).
Рис. 119. F430, или никельпорфиноид (кофактор S-метил-СоМ-редуктазы).
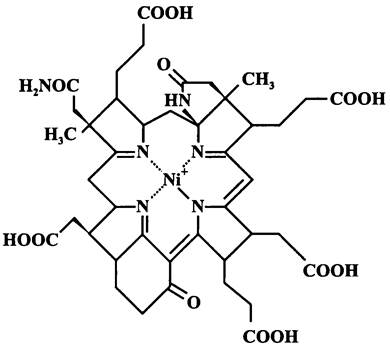
Особенностью коэнзима F430 является то, что это самый восстановленный из всех биологически важных металпорфиноидов, т. е. он содержит наименее протяженную систему двойных связей (рис. 120).
Рис. 120. Биологически важные металпорфиноиды. Система сопряженных двойных связей выделена жирной линией. А — хлорофилл; Б — протохлорофиллид; В — гем цитохромов; Г — сирогем; Д — корриноид; Е — никельпорфиноид.
Предполагается, что коэнзим F430образует промежуточное никельорганическое соединение с СН3—S-СоМ и донором электронов — восстановленной формой СоВ
(CoB-SH). Продуктами этой реакции являются молекула СН4 и гетеродисульфид CoB-SS-CoM (англ. heterodisulfide, Hd).
Цикл IIIб. На заключительном этапе гетеродисульфид Hd восстанавливается мембранным донор: гетеродисульфид-оксидоредуктазным комплексом. В этой экзергоничной реакции (∆G°′ = -40 кДж • моль-1) свободная энергия ассимилируется в форме Pmf, и регенерируются CoB-SH и CoM-SH.
Донор: дисульфид-оксидоредуктазный комплекс (рис. 121) состоит из трех функциональных блоков:
— гетеродисульфид-редуктазы;
— метанофеназинного пула;
— электрон-донорной системы.
Гетеродисульфид-редуктаза представляет собой гетеродимер субъединиц HdrD и HdrE (сокр. англ. heterodisulfide reductase; 50 и 25 кДа). Каталитическая субъединица HdrDиспользует в качестве коферментов два [Fe4S4]-кластера с редокс-потенциалами -100 и -400 мВ. Субъединица HdrE представляет собой цитохром, содержащий два гема и, редокс-потенциалы которых составляют -23 и -180 мВ.
Механизм действия гетеродисульфид-редуктазы аналогичен механизму действия цитохром bс1(b6f)-комплекса, или Q-циклу (см. раздел 10.4.6). При переносе электронов от высокопотенциального гема b к функциональному аналогу хинона — метанофеназину — из цитоплазмы поглощаются протоны. Когда восстановленный ме- натофеназин отдает электроны низкопотенциальному гему b, протоны высвобождаются в экзоплазму. Стехиометрия этого процесса составляет Н+/е-.
Метанофеназинный пул получает электроны от донорной системы (железоникелевой гидрогеназы или Р420-зависимой гидрогеназы) и восстанавливает гетеродисульфид-редуктазу.
Донором электронов при гидрогенотрофном метаногенезе служит «не восстанавливающая F420» железоникелевая гидрогеназа (рис. 121). Она кодируется генами vhoGAC и гомологична бактериальной uptake-гидрогеназе. Большая субъединица (VhoA; 60 кДа) содержит каталитический железоникелевый центр, малая субъединица (VhoG; 40 кДа) связывает [Fе4S4]-кластер. Ген vhoC кодирует интегральный дигемовый цитохром b-типа, который получает электроны от субъединиц VhoAG и передает их метанофеназинному пулу.
Гетеротрофный метаногенез (метилотрофный вариант). При «метилотрофном» метаногенезе донором электронов для гетеродисульфид-редуктазы служит протонтранслоцирующая Р420-дегидрогеназа (рис. 121). Она гомологична бактериальной НАДН: хинон-оксидоредуктазе, или НАДН-дегидрогеназе-1. У метаногенов М. barkeri и Methanolobus tindarius данный комплекс кодируется генным кластером fpoABCDHIJKLMNO. Амфипатические структурные субъединицы FpoDBCI имеют молекулярную массу 40, 22, 20 и 16 кДа. Ген пятой структурной единицы, периферического белка (37 кДа), расположенного на внутренней поверхности СМ, не входит в состав fpо-оперона и находится в другом участке хромосомы. Субъединицы FpoAHJKLMN расположены в гидрофобном ядре фермента и, видимо, образуют канал, по которому протоны из цитоплазмы транслоцируются в периплазматический компартмент.
Рис. 121. Факультативно гетеротрофный метаногенез. Суперкомплекс, состоящий из гетеродисульфид-редуктазы и «восстанавливающей F420» гидрогеназы (вверху), и суперкомплекс, состоящий из гетеродисульфид-редуктазы и «не восстанавливающей F420» гидрогеназы (внизу). НdrD и НdrЕ— субъединицы гетеродисульфид-редуктазы; VhоА, VhоС и VhоG — субъединицы гидрогеназы; Е420 — коэнзим F420; [Fe4S4] — железосерный кластер; МР — метаноптерин; СоВ — коэнзим В; СоМ — коэнзим М; [Ni/Fе] — водородокисляющий сайт.
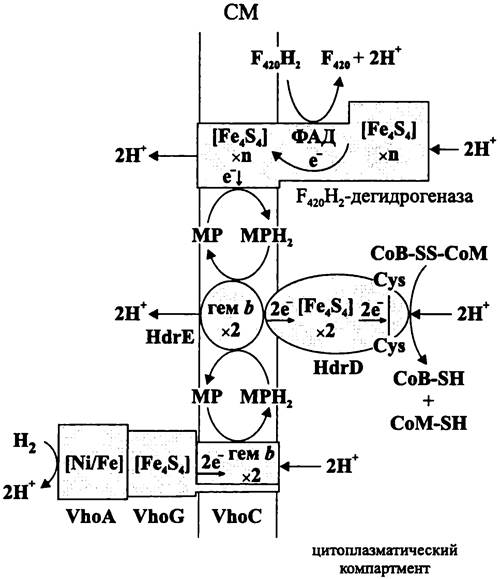
В качестве простетических групп F420-дегидрогеназа использует ФАД и несколько [Fe4S4]-кластеров. Связанный ФАД выполняет роль молекулярного «переключателя» между двухэлектропным переносчиком F420 и одноэлектронными переносчиками — [Fе4S4]-кластерами, по цепи которых восстановительные эквиваленты передаются метанофеназинному пулу.
Представители пор. Methanosarcinales получают восстановительные эквиваленты путем окисления С1-субстратов — метанола, метилированных аминов и метилированных тиолов. Они в изобилии накапливаются на дне морей и солоноватых водоемов при анаэробном разложении мортмассы фитопланктона и водных растений, содержащих осмопротекторы (бетаин, диметилсульфанил-пропионат, триметиламиноксид, производные холина и др.). Метанол частично используется в качестве источника одноуглеродной группы для образования метана, а частично окисляется с выделением СО2:
3СН3ОН + 6Н+/6е- —> 3СН4 + 3Н2O,
СН3ОН + Н2O —> СO2 + 6Н+/6е-.
Суммируя две реакции, получаем:
4СН3ОН —> 3СН4 + СО2 + 2Н2О.
Таким образом, при «метанольном» метаногенезе происходит диспропорционирование четырех молекул метанола. Три из них восстанавливаются до метана, а четвертая окисляется до СО2.
При восстановлении метанола метальная группа переносится на СоМ с участием растворимой метилтрансферазы, которая состоит из субъединиц MtаА, MtaB и МtаС (последняя в качестве простетической группы содержит Ni-порфиноид F430; см. рис. 119).
При окислении метанола его метильная группа в несколько этапов окисляется до СO2. Для этого используются обратимые реакции восстановительного пути метаногенеза. Однако на сей раз они идут в окислительном направлении:
—N-метил-Н4МРТ: СоМ-SН-метилтрансферазная реакция осуществляется с использованием энергии Smf;
— при окислении N-метил-Н4МРТ и N-метален-Н4МРТ регенерируется восстановленная форма коэнзима Р420;
— на завершающем этапе при участии N-формил-МF-дегидрогеназы образуется СO2 и регенерируется МF (последняя реакция сопряжена с ассимиляцией энергии в форме Рmf и Smf).
При использовании других С1-субстратов — метилированных аминов и метилированных тиолов — метильная группа с помощью корриноидзависимой метилтрансферазы Мtt в два этапа переносится на СоМ:
(СН3)3N + МttС —> (СН3)2NH + СНз-МttС,
СНз-МttС + СоМ-SН —> МttС + СН3-S-СоМ.
Гетеротрофный метаногенез (ацетотрофный вариант). Представители порядка Methanosarcinales могут получать восстановительные эквиваленты из ацетата. При этом основная часть биогенного метана образуется в результате суммарной реакции:
СНзСООН —> СН4 + СO2.
Вначале ацетат активируется ацетокиназой, а затем с помощью фосфотрансаце- тилазы превращается в ацетил-СоА:
СНзСОО- + АТФ —> СН3СОО~Р + АДФ,
СН3СОО~Р + СоА-SН —> СН3СО~SСоА + Ф.
После этого СО-дегидрогеназа/ацетил-СоА-синтаза разрывает связь С-С и связь С~S в молекуле СНзСО~SСоА. Этот фермент обладает обратимым действием и может синтезировать ацетат из двух молекул СO2 (см. разделы 13.3.1 и 13.3.2).
При расщеплении ацетата электроны передаются ферредоксину, метильная группа переносится на Н4МРТ, а карбонильная группа окисляется до СO2.
От ферредоксина электроны поступают на мембраносвязанную гидрогеназу Есh. В ее состав входят интегральные субъединицы ЕсhА и ЕсhВ, а также обращенные в
цитоплазму периферические субъединицы ЕсhС-F. Субъединица ЕсhЕ гомологична большой субъединице бактериальной гидрогеназы VhoА и содержит железоникелевый центр, а с субъединицами EchD и ЕсhF связаны [Fe4S4]-кластеры. Гидрогеназа Есh через метанофеназинный пул взаимодействует с гетеродисульфид-редуктазой.
С1-группа преобразуется в метан в ходе стандартных реакций восстановительного пути.
Различие механизмов ассимиляции энергии у облигатно гидрогенотрофных и факультативно гетеротрофных метаногенов. Детали механизма ассимиляции энергии у облигатно гидрогенотрофных метаногенов отличаются от таковых у факультативно гетеротрофных представителей порядка Мethanosarcinales.
Прежде всего, у облигатных гидрогенотрофов отсутствуют цитохромы b- и с- типа — таким образом, гетеродисульфид-редуктаза не содержит геминовых групп, и они функционально заменяются [Fе4S4]-кластерами. В качестве донора электронов облигатные гидрогенотрофы используют мембраносвязанную F420-дегидрогеназу, а не мембранную железоникелевую гидрогеназу. В свою очередь, терминальным донором электронов у них служит растворимая «восстанавливающая F420» гидрогеназа Frh.
11.4.5.5. Эндогенный метилен-тетрагидрофолат: биосинтез ацетата
Четвертый пример использования эндогенного органического акцептора при дыхании связан с ацетогенными бактериями.
Ацетат образуется при неполном окислении органических субстратов в ходе брожения. Этот вопрос мы уже рассматривали в разделе 11.3.4.2. Кроме того, ацетат является побочным продуктом неполного окисления органических субстратов при дыхании уксуснокислых бактерий.
Наряду с этим до 10% ацетата образуют ацетогенные бактерии, которые подразделяются на две группы — «гомоацетогенные» и «автотрофные ацетогенные».
Гомоацетогенные бактерии (например, Moorella thermoacetica) используют в качестве исходного субстрата целлюлозу или простые сахара и образуют из них ацетат в результате двух суммарных реакций:
Глюкоза —> 2СН3СООН + 2СO3 + 8Н+/8е-,
2СO2 + 8Н+/8е- —> СН3СООН + 2Н2O.
Первая реакция соответствует уксуснокислому брожению (гликолиз в сочетании с образованием при помощи декарбоксилирующей пируватферредоксин-оксидоредуктазы двух молекул ацетата из двух молекул пирувата; см. разделы 11.3.2.1 и 11.3.3). Вторая реакция соответствует восстановительному биосинтезу третьей молекулы ацетата из двух молекул СО2 за счет 4Н+/4е- (продукта гликолиза) и 4Н+/4е- (продукта пируватферредоксин-оксидоредуктазной реакции). Суммирование этих двух реакций дает итоговое уравнение гомоацетогенеза:
С6H12O6 —> 3СН3СООН.
Автотрофные ацетогенные бактерии (например, Моогеllа thermoautotrophica) восстанавливают СО2 молекулярным водородом:
2СO2 + 4Н2 —> СНзСООН + 2Н2O.
В качестве альтернативного окисляемого субстрата (а также источника углерода) может использоваться СО.
Эти облигатно анаэробные бактерии живут в морских и пресноводных осадках, почвах, затопленных полях, очистных сооружениях, а также в пищеварительном тракте насекомых, жвачных животных и человека. Большинство из них относится к филе ВХIII Firmicutes (Acetobacterium woodii, Acetogenium koivui, Moorella thermoacetica, M. thermoautotrophica, Ruminococcus productus, Sporomusa ovata и др.).
К автотрофным ацетогенам можно причислить и некоторых сульфатредуцирующих бактерий, например, Acetitomaculum orumonis (фила ВХIII Firmicutes).
Автотрофные ацетогены играют важную роль в анаэробных деструктивных сообществах, особенно если в них ограничивается развитие сульфатредукторов. Кроме того, они утилизируют СO2 и водород, которые образуются при сбраживании целлюлозы в пищеварительном тракте термитов и жвачных животных. В результате ежегодно до 1,2 • 109 т ацетата поглощается кишечным эпителием, что обеспечивает макроорганизмы дополнительным питанием.
Гибкая физиология позволяет многим автотрофным ацетогенам переключаться на хемоорганогетеротрофию, а также окислять рекальцитрантные соединения, в том числе лигнин и ксенобиотики.
При автотрофном ацетогенезе энергия первично ассимилируется в трех формах — Рmf, Smf и АТФ, а в «линейной» системе сопряженных реакций с тремя встроенными циклами, или «пути Вуда-Льюнгдала» (Н. G. Wood-L. G. Ljungdahl), из двух молекул СO2 образуется ацетил-СоА.
Сначала СO2 восстанавливается до формиата формиатдегидрогеназой, кофактором которой является молибдоптерин MGD (см. рис. 109). Затем формиат активируется АТФ и при помощи N-формил-тетрагидрофолат-синтазы связывается с тетрагидрофолатом (H4фолатом, рис. 122). Тетрагидрофолат является гомологом тетрагидрометаноптерина и также служит переносчиком С1-группы.
Рис. 122. Тетрагидрофолат, используемый в качестве переносчика С1-группы (в разной степени восстановленности) при ацетогенезе или окислении формальдегида.
R — бензоат-глутамил.
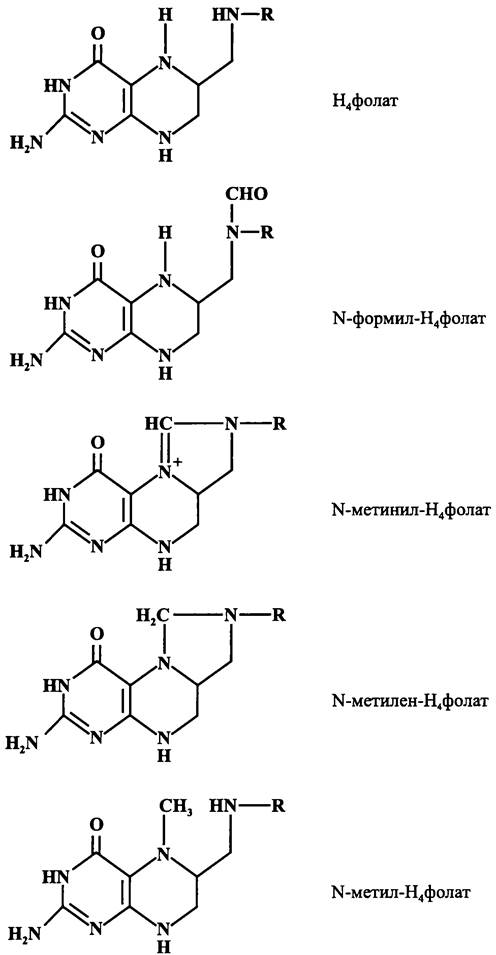
Цикл I. N-метинил-H4фолат-циклогидролаза отщепляет от N-формил-H4фолата молекулу Н2O с образованием N-метинил-H4фолата (рис. 123). Затем N-метинил- H4фолат восстанавливается N-метилен-H4фолат-дегидрогеназой в N-метилен- Н4фолат.
Рис. 123. Автотрофный путь ацетогенеза, или путь Вуда-Льюнгдала. I — III — промежуточные циклы; Нуd — гидрогеназа; Рmf — протонный градиент; Smf — натриевый градиент; [FenSn] — железо-серный кластер; С/Fе-SР — железо-серный белок, содержащий корриноид в качестве простетической группы; СOD/АS — дегидрогеназа оксида углерода/ацетил-СоА-синтаза; [СО] — карбонильная группа или молекула монооксида углерода; СоА — коэнзим А; 1 — N-формил-H4фолат-синтаза; 2 — N-метинил-H4фолат-циклогидролаза; 3 — N-метилен-Н4фолат-дегидрогеназа; 4 — N-метилен-H4фолат-редуктаза; 5 — метилтрансфераза.
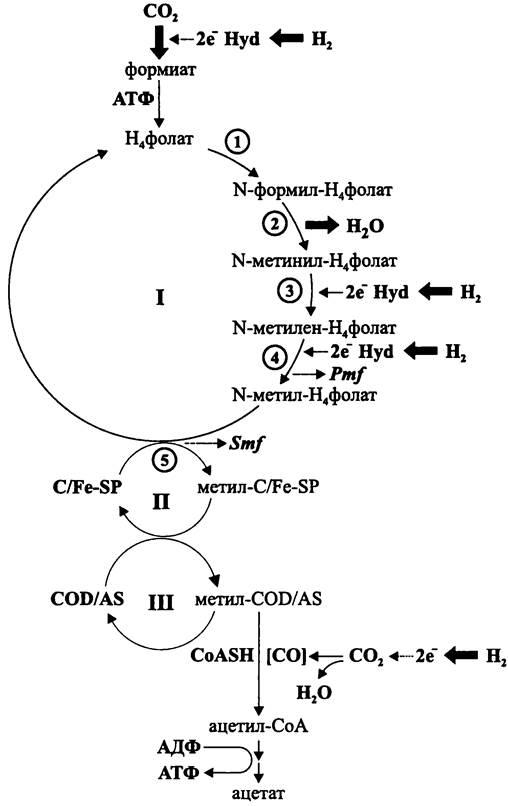
N-метилен-Н4фолат служит эндогенным акцептором электронов для N-метилен- H4фолат-редуктазы, ассимилирующей энергию в форме Pmf. Этот мембранный биотрансформатор взаимодействует с менахинонным пулом и по механизму действия аналогичен цитохром bc1(b6f)-комплексу. Продуктом восстановления является N-метил-H4фолат.
На всех восстановительных этапах электроны поступают от молекулярного водорода, который активируется мембраносвязанной гидрогеназой.
Цикл II. При помощи метилтрансферазы метильная группа, связанная с Н4фолатом, передается железосерному белку C/Fe-SP (от англ. corrinoid/Fe-sulfur protein), содержащему в качестве простетической группы кобальт-порфиноид — 5-гидроксибензимидазолилкобамид (см. рис. 80).
При реакции трансметилирования свободная энергия ассимилируется в форме Smf.
Цикл III. Белок C/Fe-SP передает метильную группу СО-дегидрогеназе/ацетил- СоА-синтазе (англ. COD/AS). Она образует ацетил-СоА, используя в качестве ко- субстратов карбонильную группу [СО] и CoASH. Важнейшие свойства этого фермента будут описаны в разделе 13.3.2.
Ацетил-СоА превращается в ацетилфосфат, в результате чего регенерируется СоАSН. Затем ацетилфосфат передает свой фосфорильный остаток АДФ, и в результате субстратного фосфорилирования образуется АТФ. В конечном счете, неактивированный ацетат покидает клетку.
На основе вышеизложенного можно дать следующее определение для механизма хемолитотрофного синтеза ацетата.
Автотрофный ацетогенез — это комплекс реакций конструктивного и энергетического метаболизма, когда в результате окисления водорода энергия ассимилируется в форме Рmf и Smf (путем N-метилен-тетрагидрофолатного дыхания и трансметилирования), а также в форме АТФ (путем фосфорилирования АДФ на уровне субстрата); в качестве побочного продукта образуется ацетат (из метильной группы и карбонильной группы).
Интересно, что биологический механизм синтеза ацетата сходен с каталитическим процессом, который применяется в химической промышленности. Речь идет о так называемом «процессе Монсанто» (англ. Monsanto process; по названию лаборатории, где он был разработан). В качестве исходного сырья используются метанол и монооксид углерода, а катализатором служит карбонилированный йодид родия RhJ2 (рис. 124). Вначале метанол реагирует с йодистым водородом и превращается в йодистый метил. Затем йодистый метил связывается с карбонилированным родиевым катализатором. После этого к ним присоединяется монооксид углерода. В результате миграции метильной группы образуется ацетильно-родиевый интермедиат, который распадается на йодистый ацетил и свободный катализатор. Наконец, после гидролиза йодистого ацетила образуются ацетат и йодистый водород.
Таким образом, в промышленности ацетил образуется на родиевом катализаторе (в природе это железоникелевый кофактор СО-дегидрогеназы), а его переносчиком служит йодид (в природе это СоА).
Рис. 124. Схема реакций, используемых в производственном процессе Monsanto для химического синтеза ацетата.
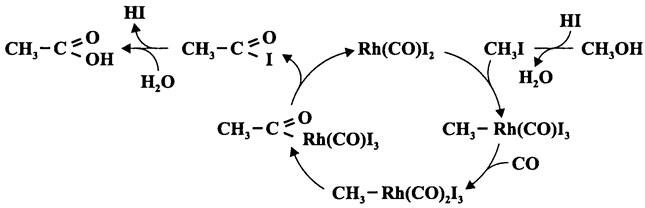
На этом мы заканчиваем обзор важнейших органических акцепторов электронов, которые используются дыхательной цепью бактерий и архей, и переходим к неорганическим акцепторам.
11.4.6. Неорганические акцепторы электронов
Природные ресурсы неорганических акцепторов электронов для дыхательной цепи гораздо шире и богаче, чем ресурсы органических акцепторов. Однако даже они никогда не бывают в избытке — например, содержание доступного кислорода служит лимитирующим фактором для энергетического метаболизма. Поэтому к использованию неорганических акцепторов привлекаются клеточные системы с разным уровнем сложности.
Простейшая стратегия адаптации к неорганическому акцептору электронов — это экспрессия дублирующих кислородредуктаз, и позже мы рассмотрим это явление на примере Аzotobacter vinelandii.
Одним из наиболее курьезных решений проблемы неорганического акцептора электронов является запасание впрок в том случае, если его источник находится на значительном удалении от клетки. Уникальным примером служат периодические «вылазки» серной бактерии Thioploca chileae за нитратом, который накапливается в нитратной вакуоли (см. I том учебника). Такая стратегия основана уже не на экспрессии отдельной молекулярной системы, а требует сложного комплекса структурно-функциональных, регуляторных и локомоторных приспособлений.
11.4.6.1. Аэробные терминальные кислородредуктазы (терминальные оксидазы)
В современной биосфере важнейшим из неорганических акцепторов электронов является молекулярный кислород, который активируется с помощью терминальных кислородредуктаз.
Терминальные кислородредуктазы (терминальные оксидазы) — это наиболее ответственные компоненты аэробной дыхательной цепи, поскольку от них зависит к. п. д. аэробного дыхания.
Терминальные оксидазы восстанавливают молекулу О2 с образованием двух молекул Н2О. Для этого используются четыре электрона, полученные от периплазма- тического одноэлектронного донора («высокопотенциального» цитохрома или железопротеина) или от мембраносвязанного двухэлектронного донора (хинола), а также четыре протона:
O2 + 4е- + 4Н+ —> 2Н2O.
Окислительно-восстановительная реакция сопряжена с переносом еще четырех протонов из цитоплазматического компартмента в периплазматический, в результате чего создается Pmf.
Большинство терминальных оксидаз бактерий и архей принадлежит к суперсемейству геминовых медьсодержащих кислородредуктаз. Его представители различаются по составу белковых субъединиц (чаще всего их две — I и II, хотя бывает четыре), а также простетических групп и металлических кофакторов. Кроме того, они используют разные доноры электронов.
Для обозначения кислородредуктаз применяют буквенные индексы, обозначающие тип гема в составе фермента, что дает разные полигемовые комбинации — аа3, b2, ba3, bb3, саа3, сbb3 и т. д. (см. раздел 10.4.1 и рис. 70).
Наиболее консервативной и важнейшей в функциональном отношении является субъединица I. Она содержит две простетические группы, лигандированные консервативными остатками His в положениях 94, 276, 325, 326, 411 и 413. Одна простетическая группа представляет собой гем, другая — уникальный биметаллический центр, состоящий из гема и катиона меди (отсюда название «геминовые медьсодержащие кислородредуктазы»). Гем передает электроны биметаллическому центру, в котором и происходит ферментативная реакция.
Медьсодержащие кислородредуктазы можно подразделить на два типа — Сох и FixP.
Кислородредуктазы Cox-типа (от англ, cytochrome oxidase) содержат субъединицу I и дополнительную субъединицу, которая состоит из одной-двух трансмембранных спиралей и периферического домена. К этому типу кислородредуктаз принадлежат цитохром с-оксидаза аа3 и HiPIP- оксидаза, окисляющая «высокопотенциальные» железопротеины. Периферический домен их дополнительной субъединицы связывает бинуклеарный медный кластер и в некоторых случаях гем. К медьсодержащим кислородредуктазам Сох-типа принадлежит и хинолоксидаза. Периферический домен ее дополнительной субъединицы лишен простетических групп. Примером хинолоксидаз служит кислородредуктаза о, ее субъединица I содержит гемы b555 и b562. Этот фермент часто называют «цитохромом о», что приводит к терминологической путанице — буква «о» обозначает не тип гема, а служит сокращением от слова «кислород» (англ, oxygen). Данный фермент выполняет роль главной кислородредуктазы в клетках, растущих при высоком парциальном давлении кислорода.
Кислородредуктазы FixP-типа (название происходит от гена их дигемовой субъединицы — fixP), или цитохромоксидазы сbb3 сильно дивергировали с кислородредуктазами Сох-типа. Помимо субъединицы I в их состав входят две дополнительные субъединицы, которые связывают соответственно гем с и два гема 6. Эти ферменты обнаружены только у некоторых пурпурных бактерий, а также у хемотрофных бактерий из родов Bacteroides, Cytophaga и Flexibacter.
Цитохром с-оксидаза аа3. У бактерий и архей цитохром с-оксидаза аа3 состоит из трех субъединиц — «каталитической» субъединицы CoxI, «донорной» субъединицы СохII и субъединицы СохIII, одновременно выполняющей «якорную» и регуляторную функции (рис. 125). Их молекулярная масса 30-60 кДа, и они содержат несколько трансмембранных доменов, соединенных гидрофильными шпильками, выступающими на обе поверхности мембраны. Цитохромоксидаза аа3 содержит четыре кофактора — гем а, гем а3, бинуклеарный медный кластер СuA х 2 и моно- нуклеарный медный кластер СuB.
Рис. 125. Цитохром с-оксидаза аа3. CoxI, CoxII и СохIII — белковые субъединицы; СuA и CuB — медные центры; К и D — каналы для транспорта протонов; Н+W — протон, который используется для образования молекулы воды; Нр — протон, который транслоцируется в периплазматический компартмент.
Каталитическая субъединица I связывает три кофактора (гем а, гем а3 и СuB)- консервативные остатки His определяют пространственное расположение металла. Донорная субъединица II содержит два кофактора СuA, которые непосредственно взаимодействуют с растворимым цитохромом с. На стыке субъединиц I и II локализуются два вспомогательных кофактора— Са2+ и Mg2+. Якорная субъединица СохIII не обладает ни простетическими группами, ни металлическими кофакторами.
При ферментативной реакции активный центр а3 /СuB получает через гем а два электрона от кластера СuA х 2 и присоединяет к себе молекулярный кислород. Последний восстанавливается до пероксида, который в виде аддукта сохраняет связь с ферментом, пока не восстанавливается в две молекулы воды. Этот процесс включает в себя промежуточную стадию образования дважды протонированного трехэлектронного продукта с разорванной связью между атомами кислорода. Молекулы воды in statu nascendiлигандируются катионом Mg2+, расположенным на расстоянии 13Á от активного центра.
Протоны, необходимые для образования воды, поступают из цитоплазмы. Другие протоны переносятся в экзоплазматическое пространство. Стехиометрия процесса составляет Н+/е-.
В общих чертах известно, как цитохром с-оксидаза аа3 восстанавливает кислород и создает Pmf. Внутри субъединицы CoxI находятся два канала для протонов — К и D (рис. 125). «Субстратные» протоны (от англ. water — вода), которые используются для образования воды, проходят по каналу К. «К» соответствует кодовому обозначению лизина (остаток Lys-362 выполняет в этом транспортном процессе ключевую роль). В свою очередь, «осмотические» протоны Нр (от англ. pumping — перекачивание) поступают по каналу D. «D» соответствует кодовому обозначению аспарагиновой кислоты (остаток Asp-132 выполняет ключевую роль в создании Pmf).
На дне канала D расположен остаток Сlu-286, который служит «выпускным клапаном» для протонов.
Механизм сопряжения окислительно-восстановительной реакции с переносом протонов через мембрану неизвестен. В частности, не установлено, где именно расположен канал для выхода протонов.
Возможны два варианта механизма сопряжения: прямой и непрямой. В первом случае по аналогии с работой Q-цикла перенос протонов связан с (де)протонированием редокс-сайтов или их лигандов. Во втором случае он происходит без участия редокс-сайтов или их лигандов и вызван дистанционными конформационными изменениями в апопротеинах.
Термоацидофильный археот Sulfolobus acidocadarius, принадлежащий к филе АI Crenarchaeota, обладает гибридной терминальной кислородредуктазой SохАВСD. У субъединиц этого фермента существуют гомологи и в составе цитохром с-оксидазы аа3, и в составе цитохром bс1(b6f)-комплекса.
В то время как бактерии и археи используют разные варианты кислородредуктаз Сох-типа, митохондрии содержат только цитохром с-оксидазу аа3. В нее входят до 13 субъединиц (напомним, что ее прокариотные аналоги содержат не более четырех субъединиц). Высокогидрофобные крупные субъединицы I-III кодируются геномом самой органеллы. Малые, менее гидрофобные субъединицы (5-15 кДа) кодируются ядерным геномом и выполняют регуляторную роль.
Кислородредуктаза bd. Как мы уже говорили, большинство терминальных оксидаз прокариотного типа, в том числе митохондриальная цитохром с-оксидаза, принадлежит к суперсемейству медьсодержащих кислородредуктаз, которые переносят протоны со стехиометрией Н+/е-.
Помимо них существуют гетерологичные, не содержащие меди терминальные оксидазы, которые создают Pmf в отсутствии переноса протонов. В настоящее время из ферментов данной группы охарактеризованы не чувствительные к цианиду цитохром bd-комплексы Е. coli и Azotobacter vinelandii.
Цитохром bd-комплекс Е. coli состоит из двух субъединиц (36 и 48 кДа). Более крупная из них (субъединица I) состоит из семи интегральных доменов и обладает сайтом для связывания восстановленного убихинона-8. Она содержит простетическую группу — гем b558 (+150 мВ), которую лигандируют консервативные остатки His-19 и His-186. Меньшая по размеру субъединица II состоит из восьми интегральных доменов. С ней связаны две простетические группы — гем b595 (+150 мВ), играющий роль промежуточного переносчика электронов, и гем d (+250 мВ), который непосредственно реагирует с молекулярным кислородом.
Цитохром öd-комплекс действует как хинолоксидаза. При окислении QH2 на экзоплазматической поверхности мембраны освобождаются два протона (рис. 126). В свою очередь, для восстановления молекулы кислорода до двух молекул воды из цитоплазмы заимствуются четыре протона. Таким образом, когда цитохром bd- оксидаза переносит через мембрану четыре электрона, четыре протона появляются в экзоплазме и четыре протона удаляются из цитоплазмы, что эквивалентно транслокации протонов со стехиометрией Н+/е-; при этом возникает «положительный снаружи» трансмембранный электрохимический потенциал величиной около +180 мВ.
Рис. 126. Кислород редуктаза bd. Q — хинон.
Дублирующие кислородредуктазы и разветвленные дыхательные цепи. Бактерии часто имеют больше, чем одну терминальную оксидазу, которые функционально дублируют друг друга. Благодаря альтернативной экспрессии оксидаз клетки адаптируются к разной концентрации кислорода. При одновременной экспрессии оксидаз поток электронов к кислороду от донора — хинола, цитохрома или HiPIP — разделяется, в результате чего дыхательные цепи становятся разветвленными.
Физиологический смысл дифференциальной экспрессии кислородредуктаз, обладающих разным сродством к молекулярному кислороду, заключается в том, чтобы дыхание происходило и при низком, и при высоком содержании акцептора электронов. Кроме того, кислород восстанавливается до воды, что предотвращает накопление его токсичных радикалов, вызывающих окислительный стресс (это называется «дыхательной защитой»). В частности, кислородредуктаза bd обладает очень высоким сродством к кислороду, и с ее помощью бактерии могут ассимилировать энергию в микроаэробных условиях. При мутационной потере цитохром bd-комплекса Е. coli лишается дыхательной защиты и приобретает повышенную чувствительность к окислительному стрессу.
Диазотрофная бактерия A. vinelandii обладает самой активной дыхательной цепью. Это позволяет не только снабжать нитрогеназу энергией, но и предохраняет фермент от инактивации кислородом. Кислородредуктаза bd этой бактерии активнее синтезируется при сильной аэрации. Дублирующая ее кислородредуктаза о, напротив, доминирует при недостатке кислорода. Интересно, что у Е. coli наблюдается противоположный паттерн регуляции — биогенез кислородредуктазы bd индуцируется в микроаэробных условиях, тогда как кислородредуктаза о преимущественно образуется при высоком парциальном давлении кислорода.
Экспрессия кислородредуктаз bd и о контролируется глобальными системами регуляции аэробного и анаэробного дыхания — Arc и Fnr. При кислородном голодании Е. coli активность кислородредуктазы bd изменяется не так сильно, как активность кислородредуктазы о — в первом случае она возрастает в два-три раза, а во втором случае в 100-200 раз.
11.4.6.2. Анаэробные терминальные редуктазы
Современная биосфера существует при сочетании локальных макро- и микрониш, где накапливается молекулярный кислород и устанавливаются динамические градиенты его концентрации (или он отсутствует).
Большинство прокариотов, населяющих аэрируемую поверхностную зону суши и водоемов, принадлежит к аэробам. В свою очередь, большинство аэробов использует при дыхании молекулярный кислород, и он активируется кислородредуктазами (см. раздел 11.4.6.1).
Оказавшись в аноксичных условиях, аэробы испытывают кислородный стресс, при котором индуцируются альтернативные дыхательные системы. Главную роль в них играют анаэробные дыхательные редуктазы. Эти ферменты не только активируют молекулы терминального неорганического или органического акцептора, служащие ловушкой для электронов, но и способствуют ассимиляции энергии в форме Рmf.
Помимо дыхательных аэробов и факультативных дыхательных анаэробов существует множество дыхательных анаэробов. Успехи «подводной» и «подземной» микробиологии перечеркнули старую точку зрения о пространственном доминировании аэробных ниш, а также о том, что аэробы преобладают в спектре биоразнообразия прокариотов и численно доминируют над анаэробами. Однако из-за методических трудностей анаэробные бактерии и археи изучены хуже, чем аэробные.
Дыхательные анаэробы довольно редко ограничиваются только одним типом терминального акцептора — они способны переключаться с одного акцептора на другой в зависимости от их присутствия и концентрации во внешней среде.
Среди терминальных неорганических акцепторов, используемых дыхательными анаэробами, есть широко распространенные, например, «классические» нитрат и сульфат. Однако встречаются и «экзотические» акцепторы, например, теллурит.
Несмотря на неравноценное значение терминальных неорганических акцепторов, все они с помощью бактерий вовлекаются в глобальный геохимический круговорот.
Некоторые токсичные акцепторы, в частности селенат, в результате дыхания обезвреживаются, что имеет большое значение для биоремедиации.
Наконец, бактерии, дышащие металлами или оксианионами металлоидов, имеют практическое значение как источники сырья для электронной промышленности.
Нитратное дыхание. В анаэробных условиях некоторые бактерии переходят на нитратное или на нитритное дыхание.
При нитратном дыхании нитрат восстанавливается в нитрит с помощью дыхательной нитратредуктазы:
NO3- + 2е-+ 2Н+ —> NO2 + Н2O.
Существуют два типа дыхательных нитратредуктаз — периплазматическая нитратредуктаза Nap (от англ. nitrate reductase, periplasmic) и мембраносвязанные нитратредуктазы NarGHI и NarZYV (от англ. nitrate reductase).
Периплазматическая дыхательная нитратредуктаза Nap состоит из субъединиц NapA (75 кДа) и NapB (15 кДа). Ее кофакторы —молибдоптерин, [Fe4S4]-кластеры и гемы с. Функция этого фермента, получающего электроны от хинонов при посредстве амфипатического тетрагемового цитохрома с (NapC), заключается в поддержании редокс-гомеостаза при переходе к анаэробному росту.
Мембраносвязанная дыхательная нитратредуктаза NarGHI входит в состав нит- ратзависимой дыхательной цепи, которая изучена на примере Е. coli и Paracoccus denitrificans. Она состоит из двух функциональных блоков — донорного, или формиатдегидрогеназы (см. раздел 11.4.4.2), и акцепторного, или дыхательной нитратредуктазы. Они взаимодействуют друг с другом с помощью менахинонного пула (рис. 127).
Рис. 127. Суперкомплекс, состоящий из формиатдегидрогеназы (вверху) и «дыхательной» нитратредуктазы (внизу). NaгI, NarH и NaгG — субъединицы нитратредуктазы; FdhА, FdhВ и FdhС— субъединицы формиатдегидрогеназы; МGD — молибдоптерин-гуанидин-динуклеотид; [Fe4S4] — железосерный кластер; MQ — менахинон.
Формиатдегидрогеназный блок сходен по составу субъединиц с мембраносвязанной формиатдегидрогеназой Fdh-N и содержит такие же кофакторы (см. раздел 11.4.4.2). Однако по сравнению с ней он зеркально ориентирован в СМ и не восстанавливает менахинон, а окисляет его.
Мембраносвязанная нитратредуктаза NarGHI состоит из следующих субъединиц (рис. 127):
— периферической а-субъединицы (125 кДа; ген narG), которая содержит один [Fe4S4]-кластер и два кофактора MGD (см. рис. 109);
— амфипатической β-субъединицы (50 кДа; ген narН), которая содержит четыре [Fe4S4]-кластера или один [FезS4]-кластер и три [Fe4S4]-кластера;
— интегральной y-субъединицы с пятью трансмембранными спиралями (20 кДа; ген narl), которая содержит гемы bL (от англ. low potential; +20 мВ) и bH (от англ. high potential; +120 мВ), лигандированные остатками His в положениях 55, 66, 187 и 205 и расположенные соответственно на периплазматической и цитоплазматической стороне СМ.
Гены narGHI сгруппированы на хромосоме Е. coli в локусе chlC вместе с другими структурными и регуляторными генами метаболизма нитрата. В частности, ген narJ кодирует шаперон (25 кДа), ответственный за созревание и сборку субъединиц NarGHI. Продуктом гена nагК является интегральный белок, обеспечивающий экскрецию токсичного нитрита. Гены naгL и narХ кодируют белки двухкомпонентной сигнальной системы, участвующей в нитрат/нитрит-зависимой регуляции генной активности.
Механизм взаимодействия формиатдегидрогеназы Fdh-N и нитратредуктазы NarGHI схематически представлен на рис. 127. Электроны, полученные при окислении формиата (-420 мВ) А-субъединицей FdhN, восстанавливают менахинон (-75 мВ), который расположен на цитоплазматической стороне мембраны. При этом из цитоплазмы поглощаются два протона. Восстановленный менахинон диффундирует на периплазматическую сторону мембраны, окисляется y-субъединицей NarGHI и отдает два протона в периплазматический компартмент. Электроны через β-субъединицу NarGHI переносятся на α-субъединицу, молибденовый центр которой восстанавливает нитрат в нитрит с поглощением двух протонов из цитоплазматического компартмента. В данном случае два компонента Pmf — электрический и осмотический — создаются при действии электрон-протонофорной окислительновосстановительной петли.
Помимо NarGHI, энтеробактерия Е. coli образует вторую мембраносвязанную дыхательную нитратредуктазу NаrZУV, которая также состоит из субъединиц αβy и также использует в качестве кофактора молибдоптерин. Она синтезируется в небольшом количестве независимо от парциального давления кислорода и используется при переходе к анаэробному росту.
Нитритное дыхание: дыхательная аммонификация нитрита. Нитрит, образующийся при нитратзависимом дыхании, далее используется при нитритзависимом дыхании. При этом он может восстанавливаться в аммиак или в молекулярный азот:
NO2- —> NH4+,
NO-2 —>—>—> N2.
Первый процесс называется «дыхательной аммонификацией нитрита», а второй — «дыхательной денитрификацией». Они никогда не осуществляются одновременно одним и тем же микроорганизмом.
Дыхательная аммонификация нитрита отличается от дыхательной денитрификации тем, что при ней нитрит превращается в аммиак за один этап, без образования свободных промежуточных продуктов. Электроны от окисляемого субстрата, главным образом формиата или Н2, переносятся на дыхательную нитритредуктазу через менахинонный пул.
Дыхательная аммонификация нитрита и дыхательная денитрификация имеют глобальное значение. В первом случае связанный азот переходит из более подвижной формы в менее подвижную, поскольку катион аммония сильнее связывается почвенными коллоидами, чем анионы нитрата или нитрита. Во втором случае азот благодаря диазотрофии возвращается в биологический цикл.
Индуцибельная нитритзависимая дыхательная цепь изучена на примере анаэробной бактерии IW. succinogenes. Она состоит из донорного и акцепторного блоков. Акцепторный блок — это нитритредуктаза, а донорный блок — это формиатдегидрогеназа (см. раздел 11.4.4.2) или гидрогеназа (см. раздел 11.4.4.4). Подобно донорному и акцепторному блокам нитратредуктазы, они сопрягаются через менахинонный пул и заякориваются в СМ при помощи цитохромов b и с (рис. 128). Центры для окисления формиата или водорода, а также центры для восстановления нитрита ориентированы в периплазматический компартмент. Электрический и осмотический компоненты Рmf создаются при действии электрон-протонофорной петли.
Рис. 128. Суперкомплекс, состоящий из формиатдегидрогеназы (сверху), «дыхательной» нитритреду). NrfA и NrfH —уктазы (посередине) и гидрогеназы (сниз субъединицы нитритредуктазы; FdhA, FdhB и FdhC — субъединицы формиатдегидрогеназы; HydB, HydA и HydC — субъединицы гидрогеназы; MGD — молибдоптерин-гуанидин-динуклеотид; (Fe4S4] — железо-серный кластер; MQ — менахинон; [Ni/Fe] — водородокисляющий сайт.
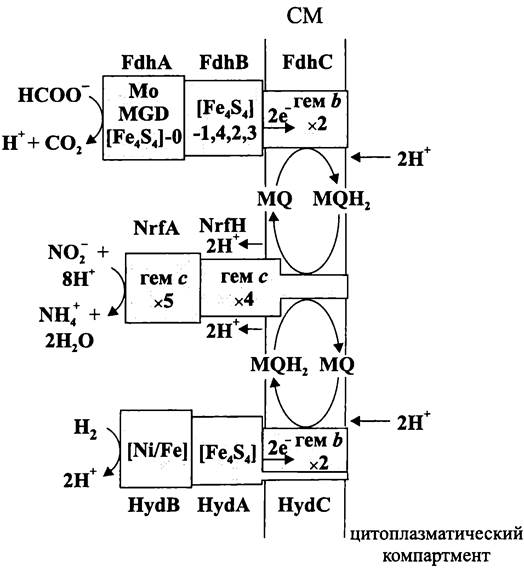
Дыхательная нитритредуктаза катализирует реакцию восстановления нитритного аниона:
NO2 + 6Н+/6е- + 2Н+ —> NH+4 + 2Н2O.
По аналогии с дыхательной нитратредуктазой, дыхательная нитритедуктаза бывает периплазматической и мембраносвязанной.
Периплазматическая дыхательная нитритредуктаза Nir (от англ. nitrite reductase), или цитохром cd1-нитритредуктаза представляет собой растворимый димер идентичных субъединиц NirS, содержащих гемы с и d1. Этот фермент получает электроны от хинонов с помощью интегрального тетрагемового цитохромома с (NirT). Подобно периплазматической нитратредуктазе, функция периплазматической нитритредуктазы заключается в поддержании редокс-гомеостаза при переходе к анаэробному росту.
Мембраносвязанная дыхательная нитритредуктаза Nrf (от англ. nitrite reducing factor), или цитохром с-нитритредуктаза состоит из периферической и интегральной субъединиц. Периферическая субъединица NfrA (45 кДа) представляет собой цитохром с552, который содержит пять ковалентно связанных гемов. Она синтезируется в виде препротеина с сигнальной последовательностью из 22 аминокислотных остатков и доставляется в периплазматический компартмент при помощи генеральной экспортной Sec-системы. Атом железа первой геминовой группы лигандирован остатком Lys-134, входящим в состав мотива С-Х-Х-С-К. Каждый атом железа второй-пятой геминовой группы лигандирован двумя остатками His. Порфириновые кольца второй и третьей геминовой группы, а также четвертой и пятой геминовой группы взаимно перпендикулярны и образуют «локоть» (англ, diheme elbowmotif). Порфириновые кольца третьей и четвертой геминовой группы взаимно параллельны и сложены в «стопку» (англ, heme stacking motif). Активный центр субъединицы NfrAполучает электроны от субъединицы NfrH и восстанавливает нитрит в аммиак с образованием связанных интермедиатов -NO и NH2OH.
«Якорная» субъединица NrfH (20 кДа) представляет собой тетрагемовый цитохром с; геминовые группы лигандируются остатками His, которые входят в мотив С-Х-Х-С-Н. Она относится к амфипатическим цитохромам, которые передают электроны от хинонного пула растворимым или периферическим оксидоредуктазам. В эту группу цитохромов также входят ранее упомянутые тетрагемовый цитохром NapC (донор электронов для периплазматической нитратредуктазы) и цитохром NirT (донор электронов для периплазматической нитритредуктазы).
«Нитритредуктазная» формиатдегидрогеназа FdhABC в случае W. succinogenes имеет такую же структуру, как «нитратредуктазная» формиатдегидрогеназа Fdh-N, имеющаяся у Е. coli. Периферическая каталитическая субъединица FdliA содержит молибдоптерин и [Fe4S4]-кластер; амфипатическая субъединица FdhB три или четыре [Fе4S4]-кластера и один [Fе3S4]-кластер. Интегральная «якорная» субъединица FdhC представляет собой дигемовый цитохром b и восстанавливает менахинон.
«Нитритредуктазная» гидрогеназа является членом суперсемейства мембраносвязанных uptake NiFe-гидрогеназ (см. раздел 11.4.4.4). Фермент состоит из периферической субъединицы HydB, амфипатической субъединицы HydA и интегральной субъединицы HydC. На субъединице HydB расположен никелевый центр, окисляющий водород. Субъединица HydA содержит три [FenSn]-кластера и передает электроны от субъединицы HydB субъединице HydC. «Якорная» субъединица HydC представляет собой дигемовый цитохром b; она состоит из четырех трансмембранных спиралей и содержит сайт для восстановления менахинона. Структурные субъединицы HydABC кодируются первыми тремя генами оперона hydABCDE. Продукт четвертого гена hydD, по-видимому, является протеазой, которая участвует в процессинге субъединицы HydB. Функция продукта пятого гена hydE неизвестна.
Дыхательная денитрификация. В результате этого процесса, проходящего в три этапа, нитрит превращается в молекулярный азот:
NO2- —> NO —> N2O —> N2.
Ферменты, катализирующие эти этапы (NO-образующая нитритредуктаза, редуктаза NO и редуктаза N2O), последовательно индуцируются при переходе к анаэробиозу.
При дыхательной денитрификации регистрируются промежуточные газообразные продукты — окись азота NO и закись азота N2O. В последнее время эти соединения привлекают повышенный интерес как разрушители озонового экрана. Наряду с диоксидом углерода и метаном они выполняют роль парниковых газов (англ. greenhouse gas), задерживающих инфракрасное излучение, что служит одной из причин глобального потепления. Кроме того, NO является ключевым сигнальным субстратом у млекопитающих, хотя влияние микробных симбионтов на его содержание в макроорганизме не показано.
Наконец, дыхательная денитрификация представляет интерес в связи с актуальными задачами биоремедиации. Если аэрация в очистных сооружениях поддерживается на низком уровне, то накопление нитрата может привести к анаэробной эвтрификации. Однако с помощью дыхательной денитрификации азот удаляется из сточных вод и поступает в атмосферу.
Механизм дыхательной денитрификации изучен на примере Achromobacter су- cloclastes, Paracoccus denitrificans, Pseudomonas aureofaciens и ряда других грамотрицательных бактерий.
Как и при дыхательной аммонификации нитрита, дыхательной денитрификации предшествует образование нитрита. Еще недавно предлагались две конкурирующие гипотезы о механизме его дальнейшего восстановления.
Согласно первой гипотезе, NO2- превращается в N2О с помощью нитритредуктазы без образования NОв качестве свободного интермедиата (прямой путь).
Согласно второй гипотезе, нитритредуктаза и редуктаза окиси азота последовательно превращают NO2- в NO и N2O (непрямой путь). В настоящее время с применением биохимических и генетических методов доказано, что верна именно она, и NО действительно служит не только обязательным, но и важнейшим интермедиатом дыхательной денитрификации.
Нитритредуктазы Nir, участвующие в дыхательной денитрификации, отличаются от вышерассмотренных «аммонифицирующих» мембранных нитритредуктаз и представляют собой медьсодержащие белки (36 кДа). Это либо гомотримеры, либо гомодимерные дигемовые цитохромы cd1-типа (60 кДа). В обоих случаях Nir локализованы в периплазматическом компартменте.
Редуктаза окиси азота (англ. nitric oxide reductase, Nor) представляет собой мембраносвязанный гетеродимер (гены norС и norВ), который действует аналогично цитохром bci-комплексу и в ходе восстановительного превращения NO —> N2O транслоцирует протоны со стехиометрией 0,5H+/NO.
Редуктаза закиси азота (англ. nitrous oxide reductase, Nos) восстанавливает N2O в N2. Этот фермент локализован в периплазматическом компартменте.
Кислородная регуляция анаэробного дыхания. Ключевую роль в генетической регуляции энтеробактерий и псевдомонад играет однокомпонентный регулятор транскрипции — Fnr(от англ. fumarate and nitrate reductase regulation). Этот регуляторный белок может действовать как главный активатор генов анаэробного дыхания, как репрессор генов аэробного метаболизма и как авторепрессор.
Регулятор Fnr представляет собой растворимый белок, снабженный [Fe4S4]-кластером и активный в димерной форме. Его мономер (30 кДа) состоит из:
— «сенсорного» N-концевого домена (50 аминокислотных остатков);
— аллостерического центрального домена (содержит сайт Gly-85 для активации РНК- полимеразы и сайт Asp-154 для димеризации);
— ДНК-связывающего С-концевого домена.
[Fe4S4]-кластер имеет редокс-потенциал -700 мВ и окисляется молекулярным кислородом с образованием [Fе3S4]-кластера или [Fе2S2]-кластера, которые сохраняют связь с апопротеином, однако уже не могут обеспечить его димеризацию. Если контакт с кислородом продолжается, то простетическая группа отщепляется от апопротеина. Напротив, после восстановления железосерного кластера неактивный мономер изменяет свою конформацию, димеризуется и приобретает способность взаимодействовать с ДНК.
Сайт в ДНК для связывания регуляторного белка Fnr, или «Fnr-бокс» образован инвертированным повтором TTGAT. .. АТСАА, который соседствует с Fnr-активируемыми промоторами. Запуск транскрипции обеспечивается не только прямым связыванием Fnr с этим локусом ДНК, но и белок-белковым взаимодействием между сайтом Gly-85 центрального домена Fnr и субъединицей δ70 рнК-полимеразы. В результате этих взаимодействий каскадно активируется транскрипция генов анаэробного метаболизма. При негативной регуляции (например, происходящей в отношении гена ndh НАДН-дегидрогеназы II, авторегулируемого гена fnr и др.) Fnr-бокс находится слишком близко от промотора, и Fnr аллостерически блокирует РНК-полимеразу.
Нитратная и нитритная регуляция анаэробного дыхания. Е. coli обладает двумя гомологичными и взаимодействующими друг с другом двухкомпонентными сигнальными системами, которые регулируют нитрат- и нитритзависимую экспрессию генов. Они состоят из проводников сигнала (NarX и NarQ) и регуляторов ответа (NarL и NarP).
Белки NarX и NarQ реагируют на присутствие соответственно нитрата и нитрита в периплазматическом компартменте. Они обладают характерной для сенсорных киназ топологией — на N-конце полипептидной цепи находятся два трансмембранных домена, разделенные периплазматическим доменом из 120 аминокислотных остатков. Трансмембранные домены состоят из гидрофобных субдоменов по 20 аминокислотных остатков, фланкированных полярными субдоменами из 20 аминокислотных остатков. На С-конце полипептидной цепи находится большой цитоплазматический домен из 420 аминокислотных остатков. При взаимодействии «P-боксов» периплазматических доменов белков NarX и NarQ с анионами NO3-и NO2- изменение конформации передается через трансмембранный домен соответствующим цитоплазматическим доменам, которые в результате этого автофосфорилируются по консервативным остаткам His-399 или His-370. Фосфорилированные проводники сигнала NarX и NarQ, в свою очередь, фосфорилируют по остаткам Asp-59 растворимые регуляторы ответа NarL и NarР (25 кДа). В результате этого регуляторы ответа изменяют свою конформацию и приобретают способность связываться с регуляторными участками оперонов-мишеней, а также непосредственно взаимодействовать с РНК-полимеразой. Обратная связь обеспечивается фосфатазной активностью белков NarХ и NarQ. Она по-разному проявляется в отношении NаrL~Р и NarР~Р и зависит от присутствия в окружающей среде анионов NO3- и NO2-.
Регулятор транскрипции Каг влияет на экспрессию не менее 12 оперонов, в том числе — на экспрессию оперона формиатдегидрогеназы (fdnGHI), фумаратредуктазы (frdABCD), периплазматической нитратредуктазы (парАВС) и мембраносвязанной нитратредуктазы (narGHIJ).
Хлоратное и перхлоратное дыхание. Оксианионы хлората CIO3- и перхлората СIO4- , в которых хлор находится в степени окисления соответственно +5 и +7, являются более эффективными акцепторами электронов, чем молекулярный кислород. Например, изменение свободной энергии ∆G°′ при реакциях:
СН3СОО- + 4/ЗСO3- + ОН- —> 2НСО3- + Н2O + 4/ЗСI-,
СН3СOO- + 2O2 + ОН- —> 2НСО3 + Н2O
составляет соответственно -132 и -110 кДж • (моль электронов)-1.
Оксианион хлората СIO3- имеет искусственное происхождение и попадает в окружающую среду вместе с отходами текстильной и бумажной промышленности, а также с бытовыми сточными водами, которые содержат отбеливающие средства. Хлорат токсичен для многих водных растений. Оксианион перхлората СIO4-, за исключением уникальных минеральных залежей в Чили, также имеет искусственное происхождение и загрязняет окружающую среду в результате производства боеприпасов, ракетного топлива, осушителей и пестицидов. Его присутствие в питьевой воде нарушает образование тиреоидных гормонов и приводит к смертельным патологиям костного мозга. Поэтому способность ряда бактерий устранять хлорат и перхлорат имеет важное значение для биоремедиации.
В настоящее время выявлен ряд хемогетеротрофных бактерий, которые используют оксианионы СI (+5) и СI (+7) в качестве терминальных акцепторов электронов при дыхании:
CIO3- + 6Н+/6е- —> СI- + ЗН2O,
СIO4- + 8Н+/8е- —> СI- + 4Н2O.
Самыми распространенными из них являются Dechloromonas agitata, Dechlorosoma suillum, Ideonella dechloratans (класс «Betaproteobacteria») и Wolinella succino- genes (класс «Epsilonproteobacteria»).
Хлоратное и перхлоратное дыхание наблюдается у одних и тех же бактерий и обеспечивается соответствующими редуктазами, по-видимому, сходными с нитратредуктазой.
Загрязнение среды оксианионами хлора началось не более 100 лет назад, и удивительно, насколько быстро бактерии приобрели способность использовать их при дыхании. Предполагается, что в основе хлоратредуктазной и перхлоратредуктазной систем лежит модифицированная нитратредуктазная система, гены которой были приобретены от штаммов Pseudomonas путем «горизонтального» переноса.
Сульфатное дыхание. Бактерии и археи, восстанавливающие сульфат, широко распространены в илах, а также в симбиотических анаэробных нишах. Они являются ключевым звеном природного цикла серы. При сульфатном дыхании могут окисляться неорганические и органические субстраты, прежде всего водород и ацетат.
Ацетотрофные сульфатредукторы, в частности Desulfobacterium sp., Desulfoccus sp. и Desulfosarcina sp. действуют по аналогии с ацетотрофными метаногенами (см. раздел 11.4.5.4) — расщепляют ацетил-СоА при помощи СО-дегидрогеназы. Продукты этой реакции, метильная и карбонильная группа, окисляются через дыхательную цепь.
Раньше считали, что сульфатредуцирующие прокариоты способны окислять только очень узкий круг органических веществ. Однако в настоящее время установлено, что их субстратами служат многие ароматические соединения и ксенобиотики.
Мезофильные аспорогенные представители этой группы бактерий относятся в первую очередь к роду Desulfovibrio. Дыхание у них называют «сульфатным», однако на самом деле нужно говорить «сульфатзависимое», поскольку терминальным акцептором электронов служит не сульфат, а его активированное производное — аденозинфосфосульфат (АФС).
АФС (см. рис. 111) образуется в эндергонической реакции, которая катализируется цитоплазматической сульфат-аденилил-трансферазой (АТФ-сульфурилазой):
SO2-4+ АТФ —> АФС + ФФ.
Следом за этим АФС восстанавливается дыхательной АФС-редуктазой до сульфита, а сульфит восстанавливается дыхательной сульфитредуктазой до сульфида:
АФС + 2Н+/2е- —> SO32- + Н2O + АМФ,
SO2-3+ 6Н+/6е- —> S2- + 3Н2O.
Донорами электронов в обеих восстановительных реакциях могут быть молекулярный водород, катионы металлов переходной валентности (например, Fe3+), а также органические субстраты (лактат, пируват, углеводороды и др.).
АФС-зависимая дыхательная цепь Desulfovibrio sp. служит типичным примером системы мембранной ассимиляции энергии с помощью экстрацитоплазматического окисления «простых» субстратов (см. раздел 10.4.7).
АФС-зависимая дыхательная цепь Desulfovibrio sp. схематически представлена на рис. 129. Первичным источником электронов для восстановления АФС служит молекулярный водород, который окисляется гидрогеназой.
Рис. 129. Сульфатзависимая дыхательная цепь.
Оrf2, ОrfЗ, Огf4, Оrf5 и Оrf6 — субъединицы аденозинфосфосульфат-редуктазы и сульфитредуктазы; Нmс — эпимембранный 16-гемовый цитохром с; с3 — растворимый тетрагемовый цитохром с; Нуd — гидрогеназа; [Fe4S4] —железосерный кластер.
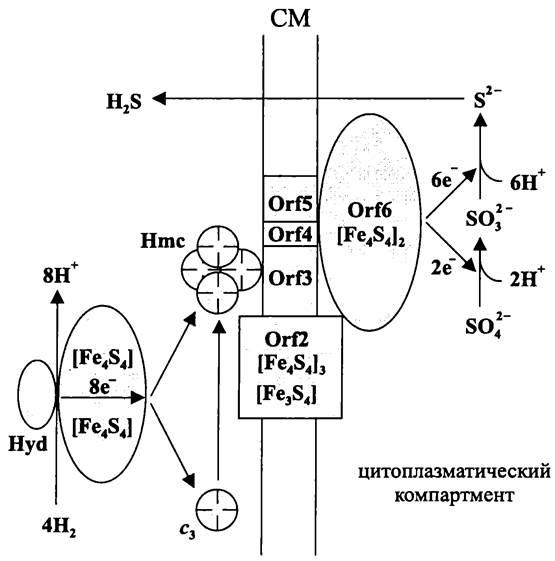
Периплазматическая гидрогеназа существует в растворимом виде или связана с наружной поверхностью СМ. Она представляет собой гетеродимер большой (62 кДа) и малой (28 кДа) субъединиц и содержит каталитический центр с атомом никеля, а также один [Fе3S4]-кластер или два [Fе4S4]-кластера. Значительно реже встречаются периплазматическая Fe-гидрогеназа и Ni/Fe/Se-гидрогеназа. Гидрогеназа непосредственно или через растворимый тетрагемовый цитохром с3 передает электроны комплексу Нmс (от англ. heme multisubunitcomplex), который служит центральным звеном дыхательной цепи и сопрягает гидрогеназную реакцию с АФС- редуктазной реакцией.
В состав hmс-оперона входят гены, кодирующие белок Нmс (55 кДа) и пять открытых рамок считывания — Orf2 (40 кДа), Orf3 (43 кДа), Orf4 (6 кДа), Orf5 (25 кДа) и Orf6 (53 кДа). Белок Нmс состоит из четырех молекул тетрагемового цитохрома c3. Субъединица Orf2 — это трансмембранный редокс-белок, содержащий один [Fе3S4]-кластер и три [Fe4S4]-кластepa. Субъединицы Orf3 Orf5 представляют собой интегральные белки, лишенные простетических групп. Наконец, субъединица
Orf6 — это периферический белок, расположенный на внутренней поверхности СМ и содержащий несколько [Fе4S4]-кластеров.
От белка Нmс электроны передаются белку Orf6 (через мембраносвязанные субъединицы Orf3-Orf5 или через белок Orf2), а от него растворимым белкам — дыхательной АФС-редуктазе или дыхательной сульфитредуктазе Dsr (от англ. dissimilatory sulfite reductase). Последняя представляет собой тетрамер, состоящий из двух α-субъединиц (50 кДа; ген dsrА)и двух β-субъединиц (40 кДа; ген dsrB). Простетической группой служит сирогем (см. рис. 70). Гены dsrAB высококонсервативны и, видимо, унаследованы бактериями и археями от общего предка-прогенота.
Серное дыхание. Способность восстанавливать элементную серу при дыхательном окислении водорода или органических субстратов широко распространена среди мезофильных и термофильных бактерий, а также среди гипертермофильных архей.
Поскольку при умеренной температуре элементная сера S0 очень слабо растворяется в воде (5 мкг • л-1 при 25°С), к наружной поверхности СМ вместо нее поступает полисульфан (полисульфид), который образуется в результате нуклеофильной атаки гидросульфида на циклические молекулы орторомбической серы, или серного цвета:
S8 + НS- —> S2-7 + Н+.
Таким образом, истинным акцептором электронов при серном дыхании является не сера, а полисульфан. При взаимодействии с дыхательной цепью от него отщепляется атом серы, который восстанавливается до гидросульфида:
S2-7 + 2е- + Н+ —> S2-6 + HS-.
Анаэробная дыхательная цепь, катализирующая восстановление полисульфана с использованием водорода или формиата в качестве первичных доноров электронов, изучена на примере W. succinogenes. Она состоит из двух мембраносвязанных ферментов — полисульфанредуктазы Psr (от англ. polysulfane reductase) и гидрогеназы или из полисульфанредуктазы и формиатдегидрогеназы (рис. 130). Каталитические центры этих ферментов находятся на периплазматической поверхности СМ.
Рис. 130. Редуктаза серы. НуdBАС — субъединицы никельзависимой гидрогеназы; РsrАВС — субъединицы полисульфанредуктазы; Sud — сульфиддегидрогеназа; MQb — связанный менахинон; МGD — молибдоптерин-гуанидин-динуклеотид.
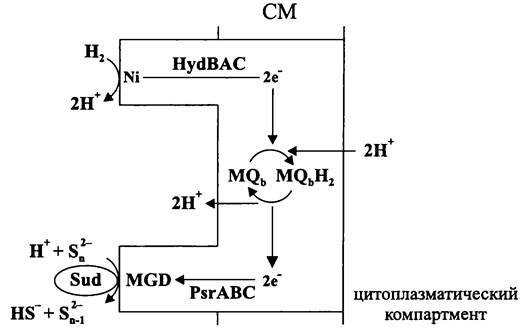
Полисульфанредуктаза состоит из субъединиц РsrАВС. Периферическая субъединица РsrА (80 кДа) гомологична субъединицам молибденсодержащих оксидоредуктаз, в частности субъединице ЕdhА формиатдегидрогеназы Е. соli. Ее простетическими группами служат две молекулы молибдоптерина и один [Fe4S4]-кластер. Амфипатическая субъединица РsгВ (20 кДа) содержит четыре [FеnSn]-кластера. Интегральная «якорная» субъединица РsrС (35 кДа) представляет собой дигемовый цитохром b.
«Полисульфановая» гидрогеназа — это та же НуdВАС, которая участвует в нитритном или фумаратном дыхании, а «полисульфановая» формиатдегидрогеназа — та же Fdh, которая используется при нитратном, нитритном и фумаратном дыхании.
Механизм, с помощью которого при серном дыхании создается Рmf, неизвестен. По аналогии с другими типами анаэробного дыхания, первичная дегидрогеназа должна быть сопряжена с редуктазой с помощью свободно диффундирующих молекул менахинона, однако проблема заключается в том, что стандартный редокс-потенциал последнего выше, чем у полисульфана (соответственно -75 и -260 мВ). Остается предположить, что при серном дыхании менахинон непосредственно входит в состав комплекса Рsr. Возможно, что якорная субъединица РsrС каким-то образом участвует в передаче электронов от гидрогеназы к полисульфанредуктазе, используя менахинон в качестве простетической группы, получающей электроны от субъединицы НуdС.
С комплексом Psr тесно взаимодействует периплазматический белок Sud (от англ. sulfide dehydrogenase), состоящий из двух идентичных субъединиц (14 кДа) и не содержащий простетических групп. Он выполняет роль полисульфан: S0- трансферазы — отщепляет от полисульфана атом серы, который попадает в активный центр Psr и там восстанавливается до гидросульфида.
Серное дыхание гипертермофильных архей мало изучено, однако известно, что оно имеет ряд специфических черт. В частности, в состав дыхательной цепи Руrodictium brockii входит железоникелевая гидрогеназа с двумя субъединицами (65 и 45 кДа), уникальный неидентифицированный хинон и мембранный цитохром с (15 кДа). Терминальным акцептором электронов служит элементная сера, растворимость которой в воде возрастает с повышением температуры. Сера диффундирует в цитоплазму и через промежуточную стадию образования полисульфана восстанавливается неидентифицированной редуктазой. В случае Р. abyssii комплекс H2:S0- оксидоредуктазы состоит по меньшей мере из девяти субъединиц, в том числе из двух цитохромов b и одного цитохрома с (30 кДа).
Селенатное дыхание. Селен — это металлоид, по химическим свойствам сходный с серой.
Несмотря на его низкое содержание в земной коре (10-4%, 21-е место) селен распространен очень широко и образует ряд минералов, например, феррозелит. Антропогенными источниками накопления селена становится сжигание сланцев, углей и нефти, а также загрязнение водоемов пестицидами, отходами полупроводниковой промышленности и т. д. В качестве микроэлемента селен входит в состав аминокислот селенометионина и селеноцистеина, а также служит кофактором некоторых ферментов, например, СО-дегидрогеназы. В то же время в концентрации свыше 10-6М оксианионы селена вызывают смертельные отравления или врожденные уродства (тератогенное действие). Оксианионы селена являются сильными окислителями. В частности, редокс-потенциал пары SeO2-4/SeO2-3 равен +425 мВ, и как акцептор электронов селенат занимает промежуточное положение между марганцем и нитратом.
Прокариоты восстанавливают селенат SeO2-4 в селенит SeO2-3 или селенит в элементный селен, что обезвреживает этот токсичный элемент и является важным этапом его биогеохимического цикла:
Н2 + SeO2-4 —> Н2О + SeO2-3, ∆G°' = -15,5 кДж • (моль электронов)-1,
3Н2 + SеО3 —> 3Н2О + SeO, ∆G°' = -8,9 кДж • (моль электронов)-1.
В настоящее время известно около 15 видов бактерий, которые окисляют молекулярный водород или органические субстраты, восстанавливая селенат в селенит. К ним относятся, в частности, Thauera selenatis (класс «Betaproteobacteria») и Sulfо spirillum barnesii (класс «Epsilonproteobacteria»), а также Bacillus arsenicoselenatis и Desulfotomaculum auripigmentum(фила BXII Firmicutes). Среди архей этим свойством обладают некоторые термоацидофилы (фила AI Crenarchaeota), а также экстремальные галофилы (фила АII Euryarchaeota).
Примером бактерии, которая восстанавливает селенит до элементного селена, служит В. selenitireducens.
Селенат и селенит восстанавливаются соответствующими редуктазами дыхательной цепи, расположенной в СМ. В результате образуются красные внеклеточные микросферы (0,3 мкм) элементного селена, состоящие из цепочек по 3-12 атомов. Похожие микросферы образуются в цитоплазме в результате восстановительной детоксикации селена (при высокой концентрации во внешней среде он неспецифически импортируется при помощи сульфатпермеазы или нитратпермеазы).
Диссимиляционная селенатредуктаза Т. selenatis состоит из субъединиц α (96 кДа), β (40 кДа) и 7 (23 кДа). В качестве кофакторов она использует молибден и [FеnSn]-кластеры, а также геминовое железо (субъединица y — это цитохром b-типа). Селенатредуктаза S. barnesii отличается от нее по субъединичному составу (82, 53, 34 и 21 кДа), однако у нее тоже есть молибденовый кофактор.
Арсенатное дыхание. Как и селен, мышьяк по химическим свойствам сходен с серой.
При низком содержании в земной коре (2 • 10-4%) мышьяк, тем не менее, является обычным компонентом вулканических пород и морских осадков, а также образует ряд минералов, в частности арсенопирит. Как и для селена, антропогенными источниками его накопления служит сжигание сланцев, углей и нефти, загрязнение водоемов пестицидами и отходами полупроводниковой промышленности и т. д. Оксианионы мышьяка очень токсичны и вызывают генерализованные отравления — арсеникозы. Оксианионы мышьяка — хорошие окислители. Редокс-потепциал пары AsO3-4/AsO3-3 равен +139 мВ, и как акцептор электронов арсенат занимает промежуточное положение между селенатом и сульфатом.
Прокариоты восстанавливают арсенатный (AsO3-4) или арсенитный (AsO3-3) оксианион до мышьяка, что обезвреживает данный элемент и является важным этапом его биогеохимического цикла:
4Н2 + AsO3-4 —> 4Н2O + As0, ∆G°' = -5,5 кДж • (моль электронов)
3Н2 + АsО3 —> 3Н2O + As0, ∆G°' = -2,6 кДж • (моль электронов)-1.
Большинство бактерий, восстанавливающих оксианионы мышьяка, способно восстанавливать и оксианионы селена. Многие из них анаэробно растут на природных минералах мышьяка. В частности, это S. barnesii (класс «Epsilonproteobacteria»), а также В. arsenicoselenatis и D. auripigmenturn (фила ВХIII Firmicutes). Обособленное положение занимает единственный представитель филы BV Chrysiogenetes — Chrysiogenium arsenatis.
Арсенат и арсенит восстанавливаются соответствующими редуктазами дыхательной цепи, расположенной в СМ. Арсенатредуктаза S. barnesii содержит субъединицы α (65 кДа), β(31 кДа) и y (22 кДа). По аналогии с селенатредуктазой, малая субъединица — это цитохром b-типа. Арсенатредуктаза С. arsenatis состоит из двух субъединиц (87 и 29 кДа). В качестве кофакторов в обоих случаях используются молибден, цинк, геминовое железо и [FenSn]-кластеры. Анализ аминокислотной последовательности большой субъединицы арсенатредуктазы С. arsenatis показал ее высокую гомологию с другими молибденсодержащими дыхательными ферментами — полисульфидредуктазой W. succinigenes и формиатдегидрогеназой Е. coli.
В отличие от мембраносвязанных арсенатредуктаз, существуют растворимые арсенатредуктазы, функция которых заключается в детоксикации проникшего в клетку мышьяка путем его «холостого» окисления. Они кодируются хромосомным, плазмидным или транспозонным опероном ars, в состав которого входят гены arsA (АТФаза), arsB (экспортер арсенита), arsС (растворимая арсенатредуктаза), arsD и arsR (регуляторные белки).
Теллуритное дыхание. По химическим свойствам теллур также сходен с серой.
Содержание теллура в земной коре (2 • 10-7%) на три порядка меньше, чем мышьяка. В виде элементного металлоида он сопровождает серу, а в валентном состоянии Te(IV) образует теллуритные минералы меди, свинца, серебра или сурьмы. Оксианионами теллура часто обогащены сточные воды промышленных предприятий. Оксианион теллурита (ТеО2-3) обладает сильными окислительными свойствами и токсичен для бактерий в концентрации >10 мкг • мл-1. В случае проникновения в клетку резистентные штаммы обезвреживают его путем экскреции, метилирования или комплексообразования. Квази-фототрофные бактерии, например, Erythromicrobium ramosum, восстанавливают теллурит в инертный элементный теллур, игольчатые кристаллы которого откладываются в цитоплазме:
ТеО2-3 + 6Н+/6е- —> Те0 + 3Н2O.
Эффективным способом детоксикации теллурита служит теллуритное дыхание, к которому, в частности, способны Thermus thermophilus (фила BIV «Deinococcus- Thermus»), Agrobacterium tumefaciens (класс «Alphaproteobacteria») и Pseudomonas aeruginosa (класс «Gammaproteobacteria»). Локализация образующихся микрокристаллов элементного теллура зависит от того, как ориентирован активный центр терминальной редуктазы (см. раздел 11.4.6.1). При использовании медьсодержащей редуктазы Сох-типа (активный центр ближе к наружной поверхности СМ) и редуктазы bd-типа (активный центр ближе к внутренней поверхности СМ) кристаллы теллурита образуются соответственно в периплазматическом и цитоплазматическом компартментах.
Считается, что свойство бактерий извлекать теллур из раствора и накапливать его на поверхности или внутри клеток в будущем найдет применение при производстве полупроводников.
Металзависимое дыхание. Изучая анаэробную ветвь цикла углерода, а также учитывая окислительно-восстановительные свойства катионов железа и марганца, исследователи в области микробной экологии и биоэнергетики уже давно склонялись к мысли о том, что существуют бактерии, окисляющие органические субстраты сопряженно с восстановлением металлов.
Первое доказательство было получено в конце 1980-х годов, когда из заиленных почв и донных осадков была выделена факультативно анаэробная бактерия Shewanella oneidensis, метаболизм которой относится к дыхательному типу. В качестве терминального акцептора электронов она использует трехвалентное железо — Fe(III) и четырехвалентный марганец — Mn(IV).
В дальнейшем оказалось, что «дышащие металлами» бактерии и археи являются существенным компонентом глобальной микробиоты. Они заселяют большинство анаэробных ниш и выполняют роль ответственного звена в циклах биогенных элементов. Большинство бактерий, осуществляющих диссимиляционное восстановление железа и марганца, относится к двум филам — BIX Deferribacteres и ВХII Proteobacteria. Обладающие этим свойством археи принадлежат к филам AI Сгеn- archaeota и АII Euryarchaeota.
В отличие от аэробного дыхания, когда акцептором электронов служит свободно диффундирующий кислород, при дыхательном восстановлении железа и марганца экзоплазматический терминальный акцептор находится в нерастворимом состоянии. Это создает проблему «дистанционной» доставки электронов от поверхности СМ.
Цитохромзависимое восстановление Fe(III) и Mn(IV) у Geobacter sulfurreducens. Основным средством, с помощью которого электроны доставляются к нерастворимым оксидам этих металлов, являются специализированные цитохромы. При анализе генома Geobacter sulfurreducens (класс «Deltaproteobacteria») была выявлена генная дупликация, состоящая из двух кластеров, по три гена в каждом. Один из них кодирует локализованный в ОМ полигемовый цитохром с-типа (ОmсВ), который
экспрессируется при росте на среде с Fe (III) и выполняет функцию железоредукта- зы. Другой железоредуктазой является недавно обнаруженный у G. sulfurreducensмультиферментный комплекс (300 кДа), ассоциированный с ОМ. В его состав входит моногемовый цитохром с-типа FerA (90 кДа), имеющий редокс-потенциал -100 мВ, что позволяет ему восстанавливать железо. В обоих случаях для восстановления Fe(III) требуется периплазматический посредник, который сопрягает процессы, происходящие на СМ и на ОМ. Роль такого посредника выполняет тригемовый цитохром c7 (ген ррсА), а также недавно обнаруженный у G. sulfurreducens цитохром c3. Последний не только восстанавливает Fe (III) при помощи цитохрома ОmсВ, но и взаимодействует с альтернативными акцепторами электронов, к которым относятся Mn(IV), молекулярный кислород и элементная сера (за счет мультивариантности терминального участка дыхательной цепи может происходить адаптационная смена дыхательных систем). Цитохром с3 накапливается в количестве до 5% суммарного клеточного белка и, имея небольшой размер, секретируется во внешнюю среду, где его концентрация достигает 200 нМ. Этот переносчик способен восстанавливать ферригидрит без участия цитохрома ОmсВ. Хотя такая стратегия расточительна, она эффективна в том случае, если на поверхности оксида железа формируется биопленка. В результате удается, во-первых, сконцентрировать молекулы восстановленного цитохрома c3 в ограниченном пространстве, а во-вторых, легко регенерировать его окисленную форму. Внеклеточный цитохром c3 может выступать в роли межвидового переносчика электронов в синтрофных ассоциациях. Примером служит совместный рост G. sulfurreducens и Wolinella succinogenes на среде с ацетатом в качестве донора и нитратом в качестве акцептора электронов. Нитратредуктаза W. succinogenes восстанавливает нитрат в результате окисления растворимого цитохрома с3, который секретируется клетками G. sulfurreducens. Таким образом, цитохром с3 сочетает функцию железоредуктазы и функцию переносчика электронов между электрон-транспортными цепями, принадлежащими разным бактериям.
Цитпохромзависимое восстановление Fe(III) и Mn(IV) у Shewanella oneidensis. Благодаря высокой пластичности своих метаболических путей представители рода Shewanella (класс «Gammaproteobacteria») широко распространены в природных экосистемах. Например, S. oneidensis использует в качестве донора электронов молекулярный водород и разнообразные органические соединения (аминокислоты, лактат, пиру ват, формиат и т. д.). Выбор среди акцепторов электронов также широк — помимо Fe(III) и Mn(IV), восстанавливаются молекулярный кислород, нитрат, тиосульфат, фумарат, элементная сера, Cr(VI) и U(VI). По аналогии с представителями рода Geobacter компоненты электрон-транспортной цепи, восстанавливающие Fe(III) и Mn(IV), локализованы в обеих мембранах клеточной оболочки. В зависимости от типа донора электроны поступают в энергетическую систему на уровне той или иной дегидрогеназы - например, НАДН-дегидрогеназы или формиатдегидрогеназы. Следующий этап, приводящий к восстановлению Fe(III) и Mn(IV) — это перенос электронов к менахинону, а он передает электроны цитохромам, которые либо связаны с СМ, либо находятся в периплазматическом пространстве, либо входят в состав ОМ. В настоящее время описан ряд периплазматических цитохромов, участвующих в восстановлении Fe(III) и Mn(IV) — цитохромы С4-типа (СуmА, MtrА) и цитохром с3-типа (CctА). В состав ОМ у S. oneidensis входят цитохромы, выполняющие функцию железоредуктазы и марганецредуктазы (цитохром с, ОmсА и ОmсВ). Для S. oneidensis получена серия точечных мутантов, у которых избирательно подавлена функция одной из альтернативных редуктаз. Оказалось, что можно заблокировать восстановление Fе(III), сохранив нормальную марганец- редуктазную активность, и наоборот. Таким образом, несмотря на частичное перекрывание этих активностей, Fе(III) и Мn(IV) могут восстанавливаться совершенно разными ферментами.
Железоредуктаза и марганецредуктаза связаны с ОМ, и поэтому нужна транспортная система, которая обеспечивает их секрецию в периплазматический компартмент с последующей интеграцией в эту мембрану.
Установлено, что в экспорте железоредуктазы и марганецредуктазы участвует специализированная Sес-зависимая секреторная система II (см. I том учебника). Кроме того, у S. oneidensis в составе ОМ имеется белок МtrВ, который сам по себе не обладает редуктазной активностью, однако необходим для восстановления Fе(III) и Мn(IV). При нарушении структуры гена mtrВ две редуктазы — ОmсА и ОmсВ — начинают встраиваться не в ОМ, а в СМ и неправильно ориентируются по отношению к клеточной поверхности. Скорее всего, белок МtгВ отвечает за интеграцию обоих цитохромов в ОМ.
В середине 2005 г. пришло сообщение об уникальном дистанционном средстве доставки электронов на нерастворимые оксиды металлов «по проводам». Данные, полученные группой исследователей из Массачусеттского университета (США), свидетельствуют о том, что G. sulfurreducens использует в качестве токопроводящего устройства адгезионные фимбрии (см. I том учебника). В недалеком будущем с помощью генноинженерных методов можно будет контролировать физические свойства этих органелл, их длину, а также уровень их экспрессии. Практическое использование жестких и ультратонких (3-5 нм X 10 мкм) самособирающихся нитей открывает большие перспективы для наноэлектроники.
Восстановление металлов, входящих в состав растворимых оксиионов. В 1990 г. Н. Н. Ляликова выделила из сточных вод металлургических предприятий и из морской воды на Курильских о-вах два новых вида факультативно анаэробных бактерий — «Pseudomonas vanadiumreductans» и «Р. isachenkovii» (класс «Gammaproteobacteria»), которые в качестве терминального акцептора электронов используют пятивалентный ванадий. Восстановление ванадия до четырехвалентного и трехвалентного состояния протекает в две стадии. Сначала растворимый оксианион метаванадата восстанавливается до растворимого оксикатиона ванадила, а затем из ванадила образуется нерастворимый оксид ванадия:
VO-3 + е- + 4Н+ —> VO2+ + 2Н2O,
2VO2+ + 2е- + Н2O —> V2O3 + 2Н+.
Окисляемыми субстратами служат сахара и аминокислоты, а также Н2 или СО.
Другим примером восстановления металлов, входящих в состав растворимых оксиионов, служит реакция восстановления U(VI) в U(IV), которую обнаружил в
1991 г. американский бактериолог Лавли (D.Lovley). Ее осуществляют железовосстанавливающие бактерии Alteromonas putrefaciens (класс «Gammaproteobacteria») и Geobactermetallireducens GS-15 (класс «Deltaproteobacteria»). Они распространены в илах техногенных аномалий, приуроченных к разработкам этого редкого металла, а также к отходам атомной энергетики. Шестивалентный уран в составе растворимого катиона уранила UO2+2 или аниона диураната U2O(OH)2-12 превращается в нерастворимый диоксид урана UO2. Донором электронов служит ацетат, и при реакции освобождается вдвое больше энергии, чем при использовании железа в качестве акцептора электронов:
СН3СОО- + 4U(VI) + 4Н2O —> 4U(IV) + 2НСО-3 + 9Н+.
Перевод урана в иммобилизованное состояние имеет большое практическое значение. С одной стороны, так формируются биогенные урановые руды, а с другой стороны — из воды удаляются вредные примеси этого металла.
В свете современных проблем ремедиации большой интерес представляют бактерии, способные к диссимиляционному восстановлению таких высокотоксичных и подвижных металлов, как Сг(VI) и Hg(II). Также привлекают внимание Ag(I); Аu(III); Со(III); Сu(II); Мо(VI); Np(V); Рd(II); Рu(IV); и Тс(VII)-редукторы. Однако все они очень слабо изучены, и связь дыхательного метаболизма с восстановлением этих металлов, особенно актинидов и продуктов ядерного распада, не доказана.
На этом мы завершаем тему хемотрофии и переходим к альтернативному типу энергетического метаболизма — фототрофии.