МИКРОБИОЛОГИЯ БИОЛОГИЯ ПРОКАРИОТОВ ТОМ III - А. В. ПИНЕВИЧ - 2009
ГЛАВА 16. ЦИТОГЕНЕТИКА
Modern biology, then, rests its case on the assumption, sometimes amounting to a conviction as the result of wide experience, that the properties of living things are the outcome of their chemical and physical configuration.
(Современная биология основана на предположении, порой доходящем до убеждения в силу широкого опыта, что свойства живых существ вытекают из их химической и физической структуры).
T. Н. Morgan. The Scientific Basis of Evolution (London, 1932).
Цитогенетику часто определяют, как раздел общей генетики, в котором, явления наследственности и изменчивости рассматриваются на клеточном и субклеточном уровнях. Встречаются и развернутые определения данного предмета. Например, во введении к одноименному вузовскому учебнику сказано: «Цитогенетикой можно назвать науку, изучающую особенности воспроизведения, рекомбинации, изменения и функционирования генетически значимых структур клетки, их распределение в митозе, мейозе и при оплодотворении в зависимости от их числа и генетического строения» (В. Г. Смирнов, 1991).
Таким образом, объектом цитогенетики в ее традиционном понимании выступают цитологические и генетические свойства ядерных хромосом, а также, в меньшей степени, хромосом симбиотических органелл (митохондрий и пластид). В то же время молекулярно-информационные аспекты наследственности и изменчивости, т. е. полиморфизм генома, его размер и инфраструктура, консерватизм и непостоянство, а также эволюция отданы на рассмотрение другой дисциплине — геномике.
Иначе обстоит дело с прокариотами, у которых цитогенетику не удается оторвать от геномики по трем причинам.
Во-первых, прокариоты — это клетки-организмы, и поэтому их генетический потенциал раскрывается на клеточном, т. е. цитогенетическом уровне.
Во-вторых, хромосомы прокариотов, в отличие от эукариотных хромосом, которые на определенной стадии клеточного цикла представляют собой дискретные микроскопические образования, выявляются только с помощью специального окрашивания или зондирования в виде ДНК-содержащей зоны, т. е. как геномная молекула.
Втретьих, у прокариотов теснее связь между геном и признаком, что позволяет рассматривать в едином контексте молекулярно-информационные аспекты геномики и цитологическое поведение генетического аппарата.
Сведения о морфологии и молекулярном строении хромосом и плазмид, т. е. архитектурные основы цитогенетики прокариотов, уже приводились в I томе учебника. Приступал к углубленному изложению данной темы, остановимся вначале на репликонах.
16.1. Репликоны
В 1963 г. Франсуа Жакоб (F. Jacob, Нобелевская премия по физиологии и медицине, 1965 г.) и Сидней Бреннер (S. Brenner) предложили репликонную модель бактериальной хромосомы. В ее основу легли результаты цитологических и генетических исследований, выполненных на Е. coli и В. subtilis.
Термином «репликон» (англ. replicón; от лат. replicatio — возобновление и греч. ontos — сущее; «нечто реплицирующееся») обозначается группа сцепления, или структурная совокупность всех последовательно копируемых хромосомных генов.
Физической основой репликона служит двухспиральная кольцевая ДНК, в которой есть строго определенный локус начала репликации — ориджин, или репликатор. От него хромосома копируется в двух направлениях до диаметрально противоположного локуса конца репликации — терминуса. Переход ориджина из латентного состояния в репликативную форму происходит под воздействием индуцибельных инициаторных белков.
Репликация возможна только при условии, если ДНК в области ориджина дестабилизируется, а затем денатурируется, т. е. расплетается на одиночные цепи. По мере продвижения зоны денатурации за пределы ориджина в хромосоме образуются две репликационные вилки, в которых происходит матричное копирование комплементарных цепей ДНК.
За время, прошедшее с момента создания исходного варианта репликонной модели, она подверглась существенному уточнению и была дополнена:
— теперь понятие «репликон» относится не только к хромосомам, но и к нехромосомным генетическим элементам (плазмидам);
— показано, что, наряду с генами, в состав репликона входят некодирующие последовательности, в том числе с регуляторной функцией;
— установлено, что репликация кольцевой ДНК может быть не только двунаправленной, но и однонаправленной;
— выяснено, что помимо кольцевых хромосом и плазмид встречаются репликоны линейной формы.
Кардинально изменились и представления о механизме, с помощью которого сестринские хромосомы «расходятся» по дочерним клеткам.
Как известно, при эукариотном митозе сестринские хромосомы взаимодействуют своими кинетохорами (специализированными мультиполипептидными комплексами) с тубулиновыми микротрубочками митотического веретена и при помощи кинезинового мотора переносятся к противоположным полюсам клетки, на что расходуется энергия, освобождаемая при гидролизе терминальной фосфодиэфирной связи АТФ.
У бактерий не существует истинного митотического аппарата, который у эукариотов состоит из конденсированных хромосом, кинетохоров, направляющего веретена и кинезинового мотора. Поэтому задача расхождения сестринских хромосом у них решается иным способом.
Согласно одному из постулатов репликонной модели, альтернативой митотического аппарата у прокариотов служит комплекс хромосомного ориджина репликации с участком СМ, расположенным на экваторе клетки. По мере того, как в эту зону встраивается новый мембранный материал, СМ разрастается, сестринские хромосомы отодвигаются друг от друга и, таким образом, пассивно доставляются к противоположным клеточным полюсам.
Однако недавно было показано, что расхождение бактериальных хромосом в действительности представляет собой активный процесс (см. раздел 16.4.2). Иными словами, у прокариотов все-таки существует аналог митотического аппарата.
16.1.1. Хромосомы
Главными носителями генома прокариотной клетки служат хромосомы. Среднего размера прокариотная хромосома (~4,5 млн. п. н.) имеет контурную длину ~1,5 мм и занимает объем <0,5 мкм3. Однако даже в таком тысячекратно компактизированном, или «сложенном» виде (англ. folded chromosome) прокариотная хромосома находится в динамическом состоянии. Она доступна репликазам, которые осуществляют ее воспроизведение, и ДНК-зависимым РНК-полимеразам, которые считывают с нее генетическую информацию.
Помимо хромосом в бактериях и археях нередко содержатся сателлитные генетические элементы, или плазмиды.
Два генома — хромосомный и плазмидный — формально объединяются понятием «клеточный геном». Тем не менее в информационном отношении между плазмидой и хромосомой существует принципиальное различие.
Корни различий между хромосомой и плазмидой. Хромосомный и плазмидный геномы содержат разные наборы генов. Кроме того, хромосомы отличаются от плазмид тем, как они реплицируются.
Хромосома обязательно содержит незаменимые гены (англ. essential gene). К ним относятся все информационные гены, т. е. гены репликации, транскрипции и трансляции, а также большинство генов домашнего хозяйства, в частности, гены транспортных белков и гены биосинтеза клеточной стенки. Для облигатно патогенных бактерий незаменимыми являются гены, кодирующие адгезины и токсины. Незаменимые гены нужны клетке в любой физиологической ситуации; без них она теряет способность к автономному существованию, выживанию и репродукции. Плазмида, в отличие от хромосомы, не содержит незаменимых генов, и поэтому ее присутствие для клетки-хозяина не обязательно.
Репликация хромосомной ДНК инициируется только единожды на протяжении клеточного цикла, причем в его относительно короткой, строго определенной фазе С (см. раздел16.4.1.1). В то же время репликация плазмидной ДНК не зависит от репликации хромосомной ДНК; она инициируется в произвольный момент клеточного цикла и может происходить многократно на его протяжении. Иногда плазмида, напротив, вообще не реплицируется.
Кольцевые и линейные хромосомы. У большинства бактерий хромосома ковалентно замкнута в кольцо. Линейные бактериальные хромосомы встречаются довольно редко. В частности, они обнаружены у Agrobacterium tumefaciens (класс «Alphaproteobacteria»), Rhodococcus fascians (фила BXIII Firmicutes), Streptomyces coelicolor и S. lividans (фила BXIV Actinobacteria), а также Borrelia burgdorferi B31 (фила BXVII Spirochaetes).
Первая линейная хромосома размером 1 млн.п. н. была обнаружена в 1989 г. у В. burgdorferi В31 — возбудителя клещевого спирохетоза, или болезни Лайма (англ. Lime disease).
Открытие линейных хромосом состоялось благодаря использованию гель-электрофореза в пульсирующем электрическом поле (англ. pulse field gel electrophoresis, PFGE). Этот метод позволяет разделить в крупнопористом агарозном геле линейные ДНК-содержащие структуры (как нативные, так и лишенные кольцевой формы или фрагментированные крупнощепящими рестриктазами). При этом используется электрическое поле постоянной полярности, которое периодически реориентируется под углом 120°. Благодаря «раскачке» в сочетании с непрерывной миграцией к аноду образуется набор полос в размерном диапазоне 0,3-3 млн. п. н., наименее подвижная из которых соответствует полноконтурной хромосомной ДНК.
Поскольку кольцевые молекулы ДНК не проникают в агарозный гель, перед электрофорезом их необходимо перевести в линейную форму. Для определения размера генома и физического картирования полноконтурные молекулы кольцевой или линейной ДНК режут рестриктазами.
Элементарное доказательство линейной структуры хромосомы основано на специфике паттерна рестрикции — при PFGE-электрофорезе кольцевой хромосомы количество полос в геле равно числу использованных эндонуклеаз с одним сайтом рестрикции (рис. 164, А), в то время как для линейной хромосомы оно на одну больше (рис. 164, Б).
Рис. 164. Пульс-электрофореграммы кольцевой (А) и линейной (Б) хромосом. С — кольцевая хромосома; L — линейная хромосома. Черными треугольниками обозначены сайты рестрикции рестриктазами R1-R6.
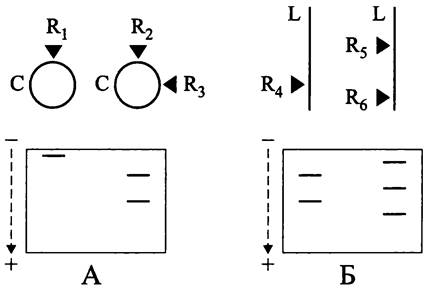
У архей описаны только кольцевые хромосомы.
Партитность генома. Партитностью называется физическое существование генома в виде того или иного числа неидентичных групп сцепления.
Партитность не следует смешивать с плоидностью, или копийностью, т. е. количеством идентичных копий хромосом(ы) или плазмид(ы).
Плоидность прокариотной клетки зависит от природы объекта и фазы роста. Например, Deinococcus radiodurans (фила BIV «Deinococcus-Thermus») имеет 4-10, Borrelia hermsii (фила BXVII Spirochaetes) 8-16, Desulfovibrio gigas (класс «Deltaproteobacteria») 9-17, Azotobacter vinelandii (класс «Gammaproteobacteria») до 80, a Buchnera aphidicola (класс «Gammaproteobacteria») — в среднем 120 копий хромосомы. На сегодня, абсолютным чемпионом является гигантская некультивируемая бактерия Epulopiscium sp. тип В (см. I том учебника и раздел 17.5.2.2 настоящего тома), которая содержит десятки тысяч копий генома размером ~3,8 млн. п. н.
При активном росте бактерии имеют больше копий хромосом(ы), чем в состоянии покоя, в частности, Е. coli содержит 1-2 хромосомы в стационарной и 2-8 хромосом в экспоненциальной фазе
У архей, как и у бактерий, плоидность клеток зависит от объекта и фазы роста. Старые клетки Sulfolobus acidocaldarius содержат 1-2, a Methanococcus voltae 3-10 хромосом. Аналогично, в молодых клетках архей обычно больше хромосом, чем в старых. В частности, М. jannashii содержит 1-5 хромосом в стационарной и 3-15 хромосом в экспоненциальной фазе.
Унипартитным (англ. unipartite; от лат. unus — один и pars — часть) называется геном, сосредоточенный в одной хромосоме, которая может быть одно- или многокопийной. В свою очередь, мультипартитным (англ. multipartite; от лат. multus — многочисленный и pars — часть) называется геном, который распределен между несколькими разными хромосомами, причем каждая из них можег быть одно- или многокопийной. Иногда понятие мультипартитности распространяют на геномы, распределенные между одной хромосомой и одной или несколькими мегаплазмидами (см. ниже).
До недавнего времени считали, что мультипартитность генома свойственна только эукариотам. Однако сейчас известно свыше 20 примеров мультипартитных прокариотных геномов, в основном у бактерий (см. ниже). Почти все они полностью секвенированы.
Мультипартитные геномы чаще всего распределены между двумя хромосомами — большего размера, или доминирующей (англ. dominant) и меньшего размера, или вторичной (англ. secondary). Примеры мультипартитных геномов у прокариотов приведены в табл. 17.
Мультипартитность часто, но не обязательно связана с крупным размером генома. Для примера, сопоставим суммарный размер двух хромосом Brucella melitensis (~3 млн. п. н.) или двух хромосом Burkholderia pseudomallei (~7 млн. п. н.) с размером единственной хромосомы Myxococcus xanthus (~9 млн. п. н.).
В инфраструктурном отношении компоненты мультипартитных геномов обнаруживают как сходство, так и различия. Сходство выражается в близкой величине молярного %GC-nap, что может свидетельствовать о совместной эволюции компонентов мультипартитного генома. Различие, прежде всего, связано со спецификой строения ориджина репликации (см. раздел 16.4.1.1). Кроме того, незаменимые гены, как правило, неравноценно распределены между доминирующей и вторичной хромосомами.
В доминирующей хромосоме находится большинство незаменимых генов, тогда как вторичные хромосомы обычно содержат только несколько незаменимых генов, например, гены оперона рРНК (rrn). Как исключение, можно назвать геном Rhodobacter sphaeroides, где незаменимые гены примерно поровну поделены между двумя хромосомами размером ~3 и 1 млн. п. н. (см. табл. 17). В свою очередь, вторичные хромосомы, как правило, содержат относительно больше открытых рамок считывания (см. раздел 16.3.1), функциональная роль которых неизвестна. В целом можно сказать, что вторичные хромосомы преимущественно содержат такие гены, которые имеют приспособительное значение для жизни в определенной экологической нише.
Одним из наиболее изученных мультипартитных геномов является геном Vibrio cholerae. Он распределен между двумя кольцевыми хромосомами. Доминирующая хромосома (xi-хромосома; 2,96 млн.п.н.) содержит большинство незаменимых генов. Во вторичной хромосоме (х2-хромосоме; 1,07 млн. п. н.) незаменимых генов только несколько. В частности, это rpml (ген рибосомного белка L22), rplT (ген рибосомного белка L35), infС (ген фактора инициации трансляции) и thrS (ген синтазы триптофанил-тРНК).
Таблица 17. Примеры мультипартитных геномов у прокариотов
Фила или класс |
Вид |
Тип и геометрия репликона |
Ориджин (или соседние с ним гены) |
Размер репликона (млн. п. н.) |
Число открытых Рамок считыв. |
AI Euryarchaeota |
Halobacterium salinarium |
х, к |
- |
2,00 |
- |
м, к |
- |
0,10 |
- |
||
BIV «Deinococcus- Thermus» |
Deinococcus radiodurans |
x1, к |
dnaA, dnaN |
2,65 |
2633 |
x2, к |
par А |
0,41 |
369 |
||
«Alphaproteobacteria» |
Agrobacterium tumefaciens |
x1, к |
Cori-типа |
2,84 |
2789 |
x2, л |
rep А ВС |
2,08 |
1882 |
||
Brucella melitensis |
х1, к |
Cori-типа |
2,12 |
2059 |
|
х2, к |
rep АВС |
1,18 |
1138 |
||
B. suis |
х1, к |
Согг-типа |
2,11 |
2185 |
|
х2, к |
герАВС |
1,21 |
1203 |
||
Sinorhizobium meliloti |
х, к |
Согi-типа |
3,65 |
3341 |
|
м, к |
герАВС |
1,68 |
1570 |
||
Rhodobacter sphaeroides |
х1, к |
- |
3,05 |
3106 |
|
х2, к |
- |
0,91 |
874 |
||
«Betaproteobacteria» |
Ralstonia eutropha eutrophus |
х1, к |
- |
||
м1, к |
- |
0,45 |
- |
||
Burkholderia cepacia |
х1, к |
- |
3,65 |
- |
|
х2, к |
- |
3,17 |
- |
||
х3, к |
- |
1,07 |
- |
||
В. mallei |
х1, к |
dnaA. dnaN |
3,51 |
3344 |
|
х2, к |
par АВ |
2,33 |
2091 |
||
В. pseudomallei |
х1, к |
dnaA, dnaN |
4,07 |
3460 |
|
х2, к |
par АВ |
3,17 |
2395 |
||
R. solanacearum |
х, к |
dnaA, dnaN |
3,72 |
3448 |
|
м, к |
repA |
2,09 |
1681 |
||
«Gammaproteobacteria» |
Египта herbicola |
х1, к |
- |
- |
|
х2, к |
- |
0,52 |
- |
||
Vibrio cholerae |
х1, к |
OriClvc |
2,96 |
2770 |
|
х2, к |
oiCIIvc |
1,07 |
1115 |
||
V. parahaemolyticus |
х1, к |
oriCIvc-типа |
3,29 |
3080 |
|
х2, к |
oriCIIvc- типа |
1,88 |
1752 |
||
V. vulnificus |
х1, к |
oriCIvc-типа |
3,35 |
3262 |
|
х2, к |
oriCIIvc-типа |
1,86 |
1697 |
||
BXIII Firmicutes |
Bacillus cereus |
х, к |
- |
- |
- |
м, к |
- |
- |
- |
||
BXVII Spirochaetes |
Leptospira interrogans |
х, к |
parAВ, dnaA |
4,33 |
4360 |
м, к |
parAВ |
0,36 |
367 |
Примечание: х — хромосома; м — мегаплазмида; к — кольцевая; л — линейная; «-» — данные отсутствуют.
Для объяснения происхождения мультипартитных геномов предложены альтернативные гипотезы. Согласно «схизматической» гипотезе (англ. schism — раскольничество), в ходе эволюции хромосома-предшественник расщепилась на две отдельные хромосомы, каждая из которых приобрела способность к самостоятельной репликации. Согласно «плазмидной» гипотезе, бактерия с унипартитным геномом горизонтальным путем получила мегаплазмиду, в которую мигрировала часть незаменимых хромосомных генов.
То, что вторичная хромосома имеет относительно меньший размер и, как правило, бедна незаменимыми генами, а также использует ориджин репликации плазмидного типа (см. раздел 16.4.1.2), дает основание считать более правдоподобной плазмидную гипотезу.
16.1.2. Плазмиды
Термин «плазмида» (англ. plasmid; от греч. plasma — нечто оформленное и eidos — способ действия; в данном случае — цитоплазматический фактор) был предложен в 1952 г. Джошуа Ледербергом (J. Lederberg; Нобелевская премия по химии, 1958 г.) для обозначения вспомогательных генетических элементов, которые существуют в цитоплазме либо автономно, либо в интеграции с хромосомой.
У прокариотов плазмиды распространены исключительно широко. Например, до 50% изолятов Bacteroides spp., самой многочисленной бактерии пищеварительного тракта человека, содержат плазмиды.
Плазмиды также найдены у ряда архей. Однако истинный масштаб их распространения в этом домене пока неизвестен.
Плазмида — это нехромосомная ДНК. Другими словами, геном-сателлит, играющий роль цитоплазматического молекулярного симбионта.
Плазмиды по величине в целом уступают хромосомам (1,5 т. п. н —1,5 млн. п. н. против 500 т. п. н. — 10 млн. п. н.). Однако в данном случае размерный критерий не имеет решающего значения — репликон считается хромосомой, даже если он мал по размеру, однако несет хотя бы один незаменимый ген. Примером служит репликон pLeu симбионта тлей, бактерии Budinera sp. APS. Он небольшого размера (7,8 т. п. н.), однако в нем есть незаменимые гены, которые отвечают за биосинтез лейцина и отсутствуют в доминирующей хромосоме. В свою очередь, в мегаплазмиде фитопатогенной бактерии Erwinia herbicola (520 т. п. н.) имеется незаменимый ген прототрофности по тиамину, и поэтому ее также следует считать хромосомой.
Поскольку в плазмидах, в отличие от хромосом, отсутствуют незаменимые гены (особенно информационные), они распространены не универсально. При элиминации плазмиды клетка-хозяин не теряет жизнеспособности.
Плазмида содержит гены, необходимые для ее собственного сохранения в клетке-хозяине. Прежде всего, это гены, ответственные за инициацию и контроль репликации плазмидной ДНК (в том числе, контролирующие копийность плазмиды). Кроме того, в плазмиде могут находиться гены, контролирующие ее гарантированное наследование — в частности, благодаря равномерному распределению плазмидных копий при клеточном делении или за счет переноса плазмиды между клетками-партнерами при конъюгации.
Так называемый «базовый репликон» плазмиды имеет размер 2-3 т. п. н. и состоит из локуса orí, который обеспечивает инициацию репликации, а также из генов гер, inc и сор, отвечающих за ее контроль. Иными словами, базовый репликон — это минимальная часть плазмиды, способная реплицироваться в определенном количестве копий.
Может сложиться впечатление, что все плазмиды эгоистичны. Однако это не так — многие плазмиды, помимо генов, определяющих их собственную экспансию, несут гены, которые кодируют селективно-полезные признаки и приносят пользу хозяйской клетке, в частности гены биодеградации, вирулентности, лекарственной устойчивости и т. д. Поскольку эти гены нередко входят в состав транспозонов (см. раздел 16.3.1.3), генетическая изменчивость плазмид и спектр биологических свойств их хозяев расширяется. Дополнительным фактором изменчивости служит общая, или RecA-зависимая и сайтспецифичная, или RecA-независимая рекомбинация между разными плазмидами (см. раздел 16.6.1.2).
Одни плазмиды структурно изолированы от хозяйской хромосомы и реплицируются самостоятельно. Другие способны временно интегрироваться в хромосому
с образованием общего репликона (в этом случае их называют эписомами (англ. episome; от греч. epi — дополнять что-либо; в данном случае — генетический элемент, дополняющий хромосому). Встраивание плазмиды в хромосому называется интеграцией, а обратный процесс — исключением, или эксцизией (англ. excision — вырезание).
Копии плазмид передаются дочерним клеткам, т. е. вертикально распространяются в популяции своих хозяев. Помимо этого, некоторые плазмиды могут переноситься от клетки-донора гетерологичной клетке-реципиенту, т. е. распространяются не только вертикально, но и горизонтально.
При горизонтальном переносе по типу конъюгации или генетической трансформации роль вектора выполняет сама плазмида. В остальных случаях ей нужна помощь самостоятельно переносящегося вектора, которым служит конъюгативная плазмида или трансдуцирующий бактериофаг (см. раздел 16.6.1.3).
16.1.2.1. Классификация плазмид
Плазмиды по молекулярному размеру можно условно подразделить на три группы: мелкие (2-50 т. п. н.), средние (50-100 т. п. н.) и крупные (>100 т. п. н.). Крупные плазмиды называются мегаплазмидами.
Однако главное значение при классификации плазмид придается не размерному, а функциональному критерию. Это, прежде всего:
— свойства, которые плазмида сообщает своему хозяину;
— способ горизонтального переноса плазмиды;
— взаимная совместимость плазмид.
Классификация плазмид по свойствам, которые они сообщают своему хозяину. Данная классификация носит исторический характер. После открытия первых плазмид их по фенотипическому проявлению стали подразделять на:
— F-плазмиды (сокр. англ. fertility factor), или половые факторы, которые определяют способность бактерий к векторному переносу генов при конъюгации;
— R-плазмиды (сокр. англ. resistance factor), или факторы резистентности, которые определяют устойчивость бактерий к химиотерапевтическим препаратам;
— Col-плазмиды (сокр. англ. colicinogenic factor), или факторы колициногенности, которые кодируют колицин, белковый агент антагонизма между близкородственными кишечными бактериями;
— плазмиды-фаги ![]() , Р2 и Р22), которые, в числе прочего, кодируют капсомеры, или субъединицы белковой оболочки зрелой вирусной частицы.
, Р2 и Р22), которые, в числе прочего, кодируют капсомеры, или субъединицы белковой оболочки зрелой вирусной частицы.
В ходе изучения плазмид выяснилось, что многие из них придают своим хозяевам и другие функциональные свойства, важные в селективном плане (см. табл. 18).
Прежде всего, плазмиды могут иметь значение для автоэкологии бактерий, а также представляют интерес в плане биоремедиации. Например, имеющиеся у Pseudomonas spp. TOL-плазмиды размером 50-120 т. п. н. (сокр. англ. toluene) содержат гены, ответственные за ферментативное разрушение алканов, аренов и других ксенобиотиков. Помимо TOL-плазмид, можно назвать ряд других «плазмид биодеградации» (NAH, SAH, XYL и др.), которые взаимно гомологичны и способны к общей рекомбинации.
Таблица 18. Примеры функциональных свойств, кодируемых плазмидами
Свойство |
Бактерия |
Размер плазмиды (т. п. н.) |
|
Образование |
ферментов конструктивного метаболизма |
||
β- Галактозидаза |
Klebsiella pneumoniae |
65 |
|
Синтаза целлюлозы |
Gluconacetobacter xylinus |
130 |
|
Уреаза |
Providencia stuartii |
95 |
|
Деградация ксенобиотиков |
|||
Алканы |
Pseudomonas oleovorans |
130 |
|
Пестициды |
Alcaligenes eutrophus |
40 |
|
Хлорбензол |
Pseudomonas sp. |
40 |
|
Симбиотическая диазотрофия |
|||
Факторы нодуляции |
Rhizobium leguminosarum |
130 |
|
Факторы симбиоза |
Sinorhizobium meliloti |
130 |
|
Факторы диазотрофии |
Rh. trifolii |
160 |
|
Образование иммуногенных и антибиотических соединений |
|||
Антиген |
Shigella sonnei |
80 |
|
Колицин |
Salmonella entérica серовар Typhimurium |
46 |
|
δ-Эндотоксин |
Bacillus thuringiensis |
50 |
|
Инфекционность для человека и животных |
|||
Инвазивность |
Shigella flexneri |
90 |
|
Вирулентность |
Corynebacterium fascians |
50 |
|
Патогенность |
E. coli |
40 |
|
Устойчивость к внешним (а)биотическим факторам |
|||
Антибиотики |
Serratia marcescens |
65 |
|
Тяжелые металлы |
Pseudomonas sp. |
130 |
|
УФ-излучение |
S. entérica серовар Typhimurium |
45 |
|
Чувствительность к внешним (а)биотическим факторам |
|||
Бактериофаг |
S. meliloti |
40 |
|
Высокая температура |
Yersinia ruckeri |
30 |
|
Плазмиды могут иметь существенное значение для синэкологии бактерий. Например, у патогена человека и животных Salmonella entérica серовар Typhimurium
гены вирулентности содержатся в Vir-плазмиде (сокр. англ, virulence), размер которой составляет 90 т. п.н. В свою очередь, у клубеньковой бактерии Sinorhizobium meliloti до 50 генов, отвечающих за симбиоз с донником, расположены на pSym-мегаплазмиде размером 1,5 млн.п.н. У ассоциативного диазотрофа Azospirillum brasiliense (см. раздел 20.3.3) гены, контролирующие дистанционные взаимоотношения с корнями злаков, локализованы в плазмиде размером 60 т. п.н. Наконец, в случае Agrobacterium tumefaciens Ti-плазмиды и Ri-плазмиды размером от 200 до >800 т. п. н. (сокр. англ. tumor inducing; root inducing) интегрируются в растительную хромосому, что вызывает образование коронарных галлов и индуцирует биосинтез специфических азотсодержащих субстратов-опинов, которые поддерживают эндофитный рост этой бактерии (см. I том учебника и раздел 20.6.3 настоящего тома).
Большинство генов, содержащихся в плазмидах, несущественно для выживания прокариотных хозяев. Однако при энергетическом стрессе они иногда приобретают принципиальное значение.
В качестве примера можно назвать мегаплазмиду экстремально галофильного археота Halobacterium salinarium, которая содержит информацию о газовых везикулах — цитоплазматических микроном парт ментах, обеспечивающих плавучесть клетки и оптимальный световой режим для факультативной квази-фототрофии (см. I и II тома учебника).
В свою очередь, у Ralstonia eutropha мегаплазмида HUP несет структурные гены гидрогеназы и компонентов дыхательной цепи, а также регуляторные гены, отвечающие за факультативную водородную хемолитотрофию (см. II том учебника).
Хотя по расчетам на мегаплазмиде размером >100 т. п. н. смогли бы поместиться свыше ста генов, реально их не более одного-двух десятков. Функциональное значение 90% нуклеотидных последовательностей таких плазмид неизвестно. Возможно, это так называемая эгоистичная ДНК (англ. selfish DNA), не имеющая фенотипического проявления.
Классификация плазмид по способу горизонтального переноса. Согласно этому критерию, плазмиды подразделяются на трансмиссивные и нетрансмиссивные.
Трансмиссивные плазмиды (англ. self-transmissible — самопередающиеся) передаются от донора к реципиенту при конъюгации. К ним относятся половые факторы и коинтегративные плазмиды (см. ниже).
Нетрансмиссивные плазмиды (англ. not self-transmissible) либо не участвуют в конъюгации, либо передаются от донора к реципиенту в составе временно образующегося комплекса, который содержит трансмиссивную плазмиду. В этом случае их называют мобилизуемыми плазмидами (англ. mobilizable plasmid).
Половые факторы. Половые факторы (англ. fertility factor), или факторы переноса (англ. transfer factor) -это такие плазмиды, которые содержат только гены репликации плазмидной ДНК и гены tra (сокр. англ. transfer — перенос; отвечают за перенос плазмидной ДНК от донора к реципиенту при конъюгации). Благодаря экспрессии указанных генов половые факторы непрерывно поддерживаются в цепи поколений своих хозяев, а также горизонтально переносятся между гетерологичными клетками (см. раздел 16.6.1.3). Иными словами, это «эгоистичные» генетические системы.
Классическим примером полового фактора служит F-плазмида Е. coli.
В состав полового фактора входят гены, кодирующие половые фимбрии (англ. sex pilus). Известны два варианта таких фимбрий — длинные гибкие F-фимбрии (сокр. англ. fertility) и короткие жесткие Р-фимбрии (сокр. англ. pilus). Чаще встречающаяся F-фимбрия имеет длину 2-20 мкм, наружный диаметр 8 нм и внутренний канал шириной 2 нм. Она образована спирально уложенным белком F-пилином (7 кДа). F-фимбрия выполняет еще роль рецептора «мужских» нитчатых фагов, которые адсорбируются либо вдоль нее (f2, MS2, R17 и Qβ),либо на ее дистальном конце (f1, fd и М13). Образование F-пилина контролируют три гена. Структурный ген traA кодирует белок- предшественник препилин молекулярной массой 13 кДа. Сигнальная пептидаза LepB (ген traQ) осуществляет процессинг препилина на внутренней поверхности СМ, отрезая от него макропептид длиной в 51 аминокислоту. Ацетилаза (продукт гена traX) образует из оставшегося фрагмента зрелый пилин (7 кДа). В секреции пилина и сборке F-фимбрии участвуют до 17 генов, кодирующих структурные и регуляторные белки (см. I том учебника).
С помощью F-фимбрии «мужская» клетка-донор (F+) распознает рецепторы на поверхности «женской» клетки-акцептора (F-). Роль рецептора, в частности, играют порины в составе ОМ. После прикрепления к женской клетке F-фимбрия сокращается, и оболочки половых партнеров вступают во взаимный контакт. Сокращение F-фимбрии после ее адгезии к женской клетке или после адсорбции на ней мужского фага не требует затраты энергии и осуществляется путем спонтанной разборки проксимальных субъединиц пилина. В результате женская клетка или адсорбированный бактериофаг подтягиваются к мужской клетке, и между ними векторно переносится ДНК.
Половой фактор может на время встраиваться в хромосому. Позднее, в случае неточного исключения, он захватывает с собой соседние участки хозяйской хромосомной ДНК, что создает предпосылку для сексдукции, или горизонтального переноса хромосомных генов. Штаммы Е. coli, содержащие интегрированный F-фактор, обозначаются как «часто рекомбинирующие», или Hfr-штаммы (сокр. англ. high frequency of recombination). В свою очередь, F-плазмиды с присоединенными к ним хромосомными генами называются F'-факторами.
Схема интеграции полового фактора или иной плазмиды в бактериальную хромосому была предложена в начале 1960-х гг. Кэмпбелом. В настоящее время она общепризнана (рис. 165).
Рис. 165. Механизм интеграции плазмиды в бактериальную хромосому (схема Кэмпбела). аttВ — хромосомный и аttР — плазмидный сайты интеграции; а, b и с — плазмидные гены; х и у — хромосомные гены.
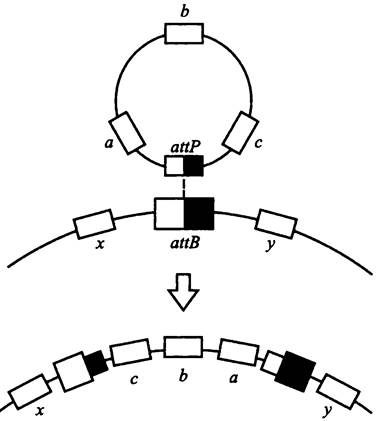
На хромосоме имеются один или несколько сайтов аttВ для интеграции F-фактора. На плазмиде, в свою очередь, имеется сайт аttР. По этим сайтам между хромосомой и плазмидой возникает синапс, или локальный гетеродуплекс. С помощью плазмидной интеграэы в нем образуются точечные разрезы, а затем осуществляется сайтспецифичная рекомбинация (реципрокный кроссинговер).
Если в свободном состоянии плазмида была линейной, то для интеграции в хромосому она предварительно должна приобрести кольцевую форму. В свою очередь, чтобы интегрироваться в хромосому, т. е. превратиться в профаг, линейная инъекционная форма вирусной ДНК должна перейти в кольцевую (см. разделы 16.6.1.2 и 16.6.1.3).
Коинтегративные плазмиды. Согласно названию, такие плазмиды представляют собой коинтеграты (англ. cointegrate) — гибридные генетические конструкции, образующие единую группу сцепления. В состав коинтегративных плазмид входят:
— половой фактор, который обеспечивает конъюгативный перенос ДНК;
— гены, кодирующие те или иные селективно полезные признаки.
Примером коинтегративных плазмид служат R-плазмиды, состоящие из полового фактора F, и генов, которые обеспечивают устойчивость к сульфамидным препаратам и антибиотикам. Таким образом, R-плазмиды принадлежат к числу F'- факторов. Распространение R-плазмид в популяциях Е. coli, Shigella flexneri и других энтеробактерий вызывает феномен множественной лекарственной устойчивости.
Другим примером коинтегративных плазмид являются Col-плазмиды S. enterica серовар Typhimurium. Они также принадлежат к числу F'-факторов и состоят из полового фактора F, который сцеплен с генами, ответственными за биосинтез колицинов.
Мегаплазмиды размером более 100 т. и. н., как правило, относятся к группе коинтегративных.
Нетрансмиссивные плазмиды. Как уже отмечалось, такие плазмиды или вообще не передаются, или «мобилизуются» и передаются одним из двух способов — либо путем образования коинтеграта с трансмиссивной плазмидой, либо за счет использования mob-сайта трансмиссивной плазмиды (см. разд/вл16.6.1.3).
В качестве примера можно привести коинтеграт Pseudomonas oleovorans, состоящий из:
— нетрансмиссивной плазмиды биодеградации ОСТ;
— трансмиссивной плазмиды, несущей ген устойчивости против ртути.
Классификация плазмид по взаимной совместимости. Еще одна классификация плазмид основана на феномене поверхностного исключения (англ. plasmid surface exclusion) и феномене внутриклеточной несовместимости (англ. plasmid incompatibility).
Резидентные плазмиды не терпят конкурентов; при поверхностном исключении они мешают внедрению другой плазмиды в клетку хозяина, а при несовместимости препятствуют репликации другой плазмиды. В первом случае блокируется механизм переноса плазмиды, во втором случае — негативно регулируется ее копийность.
В соответствии с феноменом внутриклеточной несовместимости различают группы несовместимости плазмид. Члены одной и той же группы неспособны устойчиво наследоваться в одной и той же клеточной линии (это не относится к членам разных групп). Плазмиды несовместимы из-за своей гомологии, поскольку они содержат одинаковые системы контроля репликации и паритетного распределения плазмидной ДНК между дочерними клетками.
Классификация плазмид по группам несовместимости была предложена в начале 1970-х гг. В настоящее время она сильно детализировалась, в частности, у энтеробактерий различают около 30 групп, у стафилококков — 7 групп несовместимости.
Среди групп несовместимости плазмид Е. coli особо выделяется группа IncP. Она интересна тем, что вместе с группами IncC, IncN, IncQ и IncW содержит плазмиды, которые характеризуются промискуитетом (англ. promiscuity; от лат. promiscuus — беспорядочный), т. е. способностью к конъюгативному переносу практически между любыми грамотрицательными бактериями. Благодаря этому устойчивость к антибиотикам распространяется между очень разными в фенотипическом плане бактериями, например, Anabaenaspp., Gluconacetobacter xylinus, Legionella pneumophila, Myxococcus xanthus и Xanthomonas spp.
16.1.2.2. Строение плазмид
Напомним, что размер плазмид лежит в диапазоне 1,5-1500 т. п. н., причем чаще всего встречаются представители двух групп (5-10 и 75-100 т. п. н.).
Автономные плазмиды бактерий и архей обычно представляют собой кольцевые суперспирализованные молекулы ДНК.
Линейные бактериальные плазмиды встречаются редко. Впервые они были найдены в 1977 г. у Streptomyces rochei. Позднее их обнаружили у других актинобактерий (в частности, Nocardia opaca), у фирмикута Rhodococcus fascians, спирохеты Borrelia sp., а также у тионовой бактерии Thiobacillus versutas.
У архей до сих пор обнаружены только линейные плазмиды; например, экстремальный галофил Halofetrax mediterránea содержит отрицательно суперспирализованные кольцевые мегаплазмиды размером >500 т. п. н.
16.1.2.3. Природное и практическое значение плазмид
Плазмиды в живой природе — это, прежде всего, векторы для переноса селективо полезных генов. Например, в популяции аллохтонных бактерий (см. I том учебника) при соответствующем давлении естественного отбора широко распространяются коинтегративные плазмиды биодеградации, которые исходно имелись только у относительно небольшой части особей.
Велико и методическое значение плазмид для создания рекомбинантных генов и/или клонирования практически любых генов.
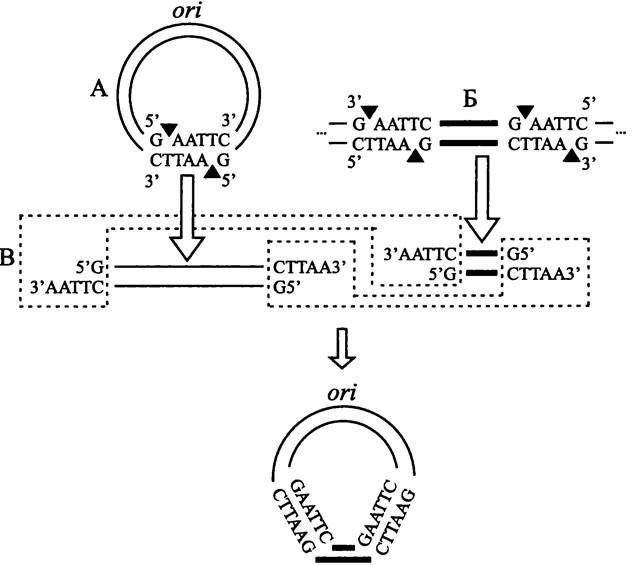
Некоторые плазмиды содержат одиночный палиндром (англ. palindrome; от греч. palin — назад и dromos — бег), т. е. короткую нуклеотидную последовательность, которая одинаково прочитывается во встречных направлениях на комплементарных цепях ДНК, например, GAATTC. Такие последовательности служат сайтами узнавания для рестриктаз того или иного типа (в данном случае — для рестриктазы Eco RI). Необходимо, чтобы сайт узнавания находился в области, не отвечающей за репликацию плазмиды.
Путем подбора рестриктазы и проведения рестрикции плазмиде придается форма линейного дуплекса с «липкими» концами. Если с помощью той же самой рестриктазы вырезать фрагмент (в частности, ген) из ДНК другого происхождения, то у него появятся липкие концы, комплементарные липким концам предварительно рестрицированной плазмиды (рис. 166). Используя ДНК- лигазу, можно встроить такой фрагмент ДНК в плазмидный вектор, в результате чего получится кольцевая молекула рекомбинантной ДНК.
Рис. 166. Конструирование рекомбинантной плазмиды со встроенным фрагментом чужеродной ДНК. А — разрезание кольцевой плазмиды при помощи рестриктазы EcoRI, образование липких концов; Б — вырезание фрагмента чужеродной ДНК при помощи той же рестриктазы, образование комплементарных липких концов; В — воссоединение липких концов при помощи ДНК-лигазы, восстановление кольцевой формы плазмиды, ori — плазмидный ориджин репликации.
Черными треугольниками обозначены сайты рестрикции.
Если гибридным вектором, без потери им способности к репликации, трансформировать бактерию, то можно осуществить экспрессию чужеродного гена in situ или амплифицировать изучаемый ген в количестве, достаточном для секвенирования.
Отдельно от рекомбинантных ДНК следует рассматривать искусственные плазмиды, которые изначально конструируются с помощью генноинженерных методов (примером служит плазмида pBR322).