МИКРОБИОЛОГИЯ БИОЛОГИЯ ПРОКАРИОТОВ ТОМ III - А. В. ПИНЕВИЧ - 2009
ГЛАВА 16. ЦИТОГЕНЕТИКА
16.7. Экспрессия генома
Самовоспроизведение генома представляет собой вертикальную и горизонтальную экспансию полинуклеотидных матриц (см. I том учебника). По сути дела, это эгоистический процесс. Однако он всегда развертывается в конкретной экологической обстановке, где остро стоит проблема источников субстрата и энергии. Для ее
решения необходимы обслуживающие системы домашнего хозяйства, на кодирование которых нацелена основная часть информационной емкости генома.
Универсальным посредником между геномом и организмом, точнее сказать, между геномом и продуктом экспрессии информационных и операционных генов, служит аппарат транскрипции. Именно он создает информационную базу для аппарата трансляции (см. I том учебника).
16.7.1. Транскрипция
Транскрипцией (англ. transcription; от лат. transcribo — переписывать) называется полимеризация рибонуклеотидов A, G, С и U на полипуклеотидной матрице согласно правилу комплементарности Уотсона-Крика, в результате чего образуется смысловая (колинеарная гену) РНК, либо комплементарная ей антисмысловая РНК.
Под определение транскрипции попадает синтез только такой РНК, которая структурно обособляется после считывания с генного участка. Поэтому мы не называем транскрипцией посттрансляционную модификацию 3'-конца мРНК под воздействием «кэппирующей» поли-А-синтетазы, хотя данная нуклеотид-полимеразная реакция имеет стандартный химический механизм (см. раздел 16.7.4). Не считается транскрипцией и образование коротких РНК-праймеров с помощью праймазы DnaG, которые гибридизуются с отстающей цепью ДНК и инициируют синтез фрагментов Оказаки при репликации (см. раздел 16.4.1.1). Зато под определение транскрипции попадает синтез мРНК с помощью РНК-зависимой РНК-полимеразы, которую кодируют вирусы, содержащие матричную РНК (антисмысловую, или «минус» РНК).
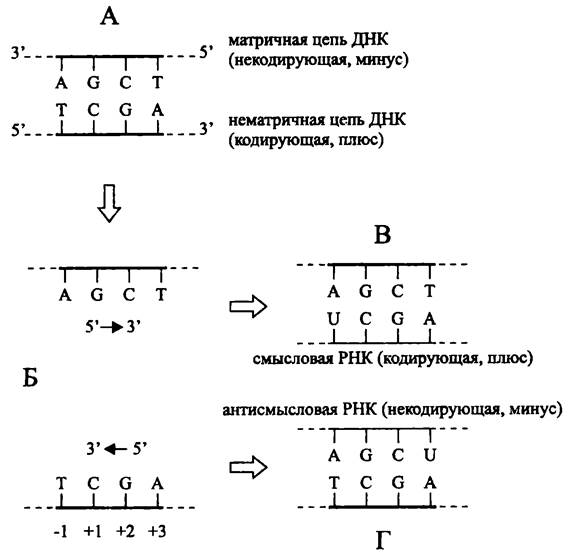
Повторим, что транскрипция подчиняется правилу комплементарности нуклеотидов, которые позиционно совпадают в матрице и ее копии. Если источником информации служит двухцепочечная ДНК, то транскрибируемая цепь называется матричной, а комплементарная ей цепь — нематричной. Нематричная цепь ДНК также называется кодирующей, или смысловой («плюс») поскольку она колинеарна цепи РНК, которая содержит транскрибируемые гены, в первую очередь, открытые рамки считывания (рис. 212).
Рис. 212. Транскрипция с образованием смысловой и антисмысловой РНК. А — матрица ДНК; Б — образование транскрипционного пузырька; В — образование смысловой РНК; Г — образование антисмысловой РНК.
Цифры со знаками + или — обозначают координаты нуклеотидов относительно стартовой точки транскрипции.
Субстратами РНК-полимеразной реакции служат 5'-рибонуклеозидтрифосфаты. Они последовательно присоединяются к 3'-концу наращиваемой цепи, т. е. синтез РНК при транскрипции происходит в направлении 5' —> 3', точно так же, как синтез ДНК при репликации (см. рис. 176).
В начале транскрипции двухцепочечная ДНК расплавляется на участке средней длиной 17 п. н. В образовавшемся транскрипционном пузырьке (англ, transcription bubble) одна из одиночных цепей выбирается в качестве матрицы.
ДНК-зависимая РНК-полимераза движется по матричной цепи в направлении 3' —> 5', образуя смысловую РНК. Если фермент перемещается в том же направлении, но уже по нематричной цепи, образуется некодирующая, или антисмысловая мРНК (рис. 212). Хотя антисмысловая РНК не транслируется в белок, она участвует в посттранскрипционном процессинге мРНК — спаривается с ней и блокирует ее трансляцию (см. ниже).
После ответственного выбора между матричной и нематричной цепями совершается не менее ответственный выбор точки инициации (начала) и терминации (завершения) транскрипции, которые обозначают границы транскрипционной единицы — гена или оперона.
Гены «переписаны» в транскрипт, который имеет одинаковую нуклеотидную последовательность с нематричной цепью. Поэтому нуклеотид нематричной цепи ДНК, соответствующий началу транскрипции, называется стартовой точкой и обозначается как 4-1. После стартовой точки, т. е. по ходу транскрипции (англ. downstream — по течению) расположены нуклеотиды с положительными номерами, а до стартовой точки, т. е. против хода транскрипции (англ. upstream — против течения) — нуклеотиды с отрицательными номерами (рис. 212).
Слева (upstream) от 5'-старта транскрипции в матричной ДНК находится участок для исходного связывания РНК-полимеразы, или промотор. За инициацией транскрипции следует элонгация (удлинение полинуклеотидной цепи РНК). Синтез полинуклеотидной цепи РНК прерывается в терминаторе, или точке завершения транскрипции, и РНК-полимераза отделяется от матричной цепи ДНК, что соответствует терминации транскрипции.
В результате считывания транскрипционной единицы образуется первичный транскрипт с однозначно заданными 5'-началом и 3'-концом. В дальнейшем он может быть подвергнут посттранскрипционному процессингу, в частности путем сплайсинга или полиаденилирования (см. разделы 16.3.1.4 и 16.7.4).
РНК-полимеразы. Под общим названием «РНК-полимеразы» объединяются олигомерные ферменты, которые проявляют взаимную гомологию на уровне отдельных субъединиц. Наиболее просто устроенные РНК-полимеразы некоторых Т- нечетных фагов состоят из единственной субъединицы (~110 кДа).
Представители трех глобальных филогенетических доменов — Eucarya, Archaea и Bacteria — различаются между собой по типу используемых ими РНК-полимераз.
Прокариоты, а также произошедшие от бактерий симбиотические органеллы- ксеносомы (см. раздел 20.4) содержат «многоцелевую» РНК-полимеразу, которая транскрибирует все гены и, в частности, образует все три основные типа РНК (мРНК, рРНК и тРНК).
Эукариоты обладают тремя «специализированными» РНК-полимеразами — для мРНК, для рРНК и для тРНК.
Эукариотные РНК-полимеразы. К числу ядерных РНК-полимераз относятся:
— РНК-полимераза I, которая локализована в ядрышке и транскрибирует гены 5,5S рРНК, 18S рРНК и 28S рРНК;
— «главная» РНК-полимераза И, которая локализована в нуклеоплазме и транскрибирует гены мРНК;
— РНК-полимераза III, которая локализована в ядрышке и синтезирует малые стабильные РНК (5S рРНК, тРНК и sn-PHK, а также sn-PHK сплайсосомы и 7S РНК секреторной SRP-частицы; см. I том учебника).
Эукариотные РНК-полимеразы обладают сложным строением и содержат, как минимум, две большие (>100 кДа) и 8-12 малых субъединиц.
Археотная РНК-полимераза. Полимеразы этого типа преимущественно состоят из 7-11 субъединиц и сходны с 8-13 субъединичной РНК-полимеразой II. Однако они функционально отличаются от канонических РНК-полимераз эукариотов. В частности, они не чувствительны к ингибитору эукариотной элонгации α- аманитину. В свою очередь, на них не влияют специфичные для прокариотов ингибиторы — рифампицин (ингибитор инициации транскрипции) и стрептолидигин (ингибитор элонгации).
Бактериальная РНК-полимераза. РНК-полимераза бактерий, в частности Е. coli, может находиться в двух состояниях — кор-фермента («минимального» фермента) и голофермента («максимального» фермента).
Кор-фермент образуется из субъединиц α, β, β' и ω в численном соотношении α2ββ'ω и обозначается как Е (сокр. англ. enzyme). Кор-фермент способен неспецифически синтезировать полинуклеотиды, но, чтобы обеспечить специфическую инициацию транскрипции в промоторном участке, т. е. превратиться в функционально полезный голофермент, он должен присоединить к себе сигма-фактор, или субъединицу пятого типа — σ (табл.28). Она состоит из четырех доменов, среди которых особо важны два функциональных домена: домен для связывания с кор-ферментом и домен для связывания с ДНК.
Таблица 28. Состав и функции субъединиц РНК-полимеразы E. coli
Субъединица |
Число субъединиц в голоферменте |
Ген |
Мол. масса (кДа) |
Функция |
α |
2 |
rроА |
36,5 |
Связывание ββ'-субъединиц с образованием корфермента |
β |
1 |
rроВ |
150,6 |
Связывание субстратов (нуклеозидтрифосфатов); связывание продукта (РНК); катализ инициации транскрипции и элонгации; узнавание терминаторов; «строгий» контроль; авторегуляция оперона rроВС: связывание ингибиторов транскрипции (рифампицина и стрептолидигина) |
β' |
1 |
rроС |
155,2 |
Связывание σ-субъединицы; связывание ДНК-матрицы |
ω |
1 (или субстехиометрическое) |
rроЕ |
13,6 |
Молекулярный шаперон, обеспечивающий правильный фолдинг β'-субъединицы |
σ70 (главный σ-фактор) |
1 (или субстехиометрическое) |
rpoD |
70,3 |
Узнавание общих промоторов с консенсусными блоками -10 (5'-ТАТААТ-3') и -35 (5'-ТТGАСА-3'); стимуляция образования транскрипционного пузырька |
σ32 (σ-фактор теплового шока) |
1 (или субстехиометрическое) |
rроН |
32,4 |
Узнавание альтернативных промоторов с консенсусными блоками -10 (5'-СССАТИТ-3') и -35 (5'-СТТСААА-3'); стимуляция образования транскрипционного пузырька |
Порознь кор-фермент и субъединица σ почти не проявляют сродства к «неспецифической» ДНК, в то время как голофермент имеет очень высокое сродство к специфическим промоторным последовательностям (константа ассоциации 1 • 10-9М).
Сборка субъединиц голофермента протекает в следующем порядке: α + α —> α2β —> α2ββ'ω —> α2ββ'ωσ.
У разных бактерий компоненты РНК-полимеразы обладают высокой взаимной гомологией и в модельных экспериментах взаимозаменяемы, хотя различаются по молекулярной массе. В частности, у грамотрицательных бактерий субъединица β' обычно крупнее субъединицы β (у грамположигельных бактерий —наоборот). В
свою очередь, субъединицы σ у грамотрицательных бактерий крупнее, чем у грамположительных бактерий (70-90 кДа против 40-60 кДа).
Главная РНК-полимераза Е. coli образуется в количестве ~3 тыс молекул на клетку, и размер ее частицы составляет 8,5 х 10,5 х 14 нм (примерно половина размера рибосомы).
Рабочий цикл РНК-полимеразы. Реконструкция цепи событий, происходящих с момента сборки голофермента РНК-полимеразы до высвобождения первичного транскрипта, и их точная локализация стали возможны на основе рентгеноструктурного анализа препаратов, полученных на рубеже XX-XXI вв. из бактерии Thermus aquations.
Установлено, что кор-фермент имеет вид клешни, образованной субъединицами β и β'. На их внутренних поверхностях имеются выступы в виде клапана и зажима. «Клешня» окружает главный канал диаметром 2,7 нм, достаточно просторный для размещения двухцепочечной ДНК. Активный центр с катионом Mg2+ находится посередине канала, на ег о внутренней стенке. По трем сторонам от активного центра расположены расходящиеся туннели — один для входа мономеров и выхода коротких абортивных транскриптов (см. ниже), второй для выхода РНК, третий для выхода «прочитанной» ДНК (DBS-туннель; сокр. англ. downstream double-stranded DNA binding site). Помимо этих трех туннелей вблизи активного центра находятся два взаимно параллельных туннеля — соответственно, для матричной и нематричной цепей ДНК (рис. 213, А).
Рис. 213. Рабочий цикл РНК-полимеразы. А — голофермент; Б — открытый комплекс; В — элонгирующий комплекс. Тм — туннель для матричной цепи ДНК; Тн — туннель для нематричной цепи ДНК; Тттр — туннель для нуклеозидтрифосфатов; Трнк — туннель дня выхода РНК; TDBS — туннель (сайт) для связывания посттранскрипционной (downstream) двухцепочечной ДНК.
Цифрами 1-4 обозначены домены σ-фактора; стрелка указывает направление «продевания» ДНК сквозь фермент в ходе транскрипции.
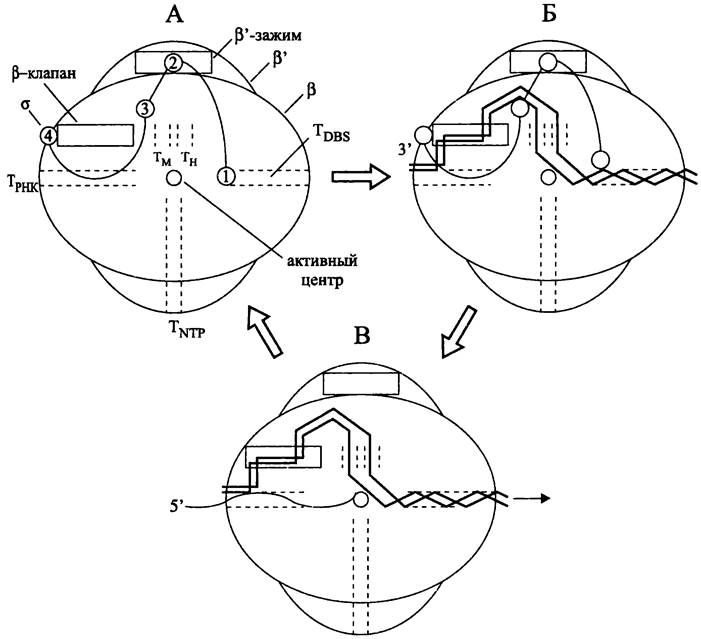
При соединении кор-фермента с субъединицей σ образуется голофермент. Четыре домена субъединицы с связаны между собой линкерами и ассоциированы, соответственно, с DBS-туннелем, β'-зажимом, главным каналом и β-клапаном (рис. 213, А). При узнавании промотора домен σ2 связывается с блоком -10 (см. ниже), что способствует расплавлению ДНК с образованием транскрипционного пузырька, а домен σ4 связывается с блоком -35. После присоединения субъединицы σ субъединицы β и β' изменяют свою конформацию; зажим закрывается клапаном, и главный канал, ведущий к активному центру, сужается до 1,5 нм, что недостаточно для размещения двухцепочечной ДНК. В итоге образуется так называемый «закрытый» комплекс (англ. RNA polymerase- promoter closed complex, RPc; на рис. 204 не показан).
Для образования «открытого» комплекса (англ. polymerase-promoter open complex, RPo) необходимо второе конформационное изменение РНК-полимеразы, в результате которого главный канал снова расширяется настолько, чтобы пропустить двухцепочечную ДНК. Разъединенные цепи ДНК занимают отдельные каналы, а домен σ1 покидает DBS-канал, освобождая путь для downstream-ДНК (рис. 213, Б).
При переходе к стадии элонгации субъединица о покидает кор-фермент, что образно называется «освобождением» промотора (англ. promoter escape). ДНК в области активного центра изгибается под углом ~ 90° и продевается сквозь фермент. Первоначально синтезируемые мелкие транскрипты длиной 2-8 н., образующие гетеродуплекс с матрицей, представляют собой абортивный материал и удаляются через туннель для входа мономеров. После того, как транскрипт достигает длины 10- 12 н., начинается продуктивная транскрипция, и РНК поступает в туннель для выхода (рис. 213, В).
16.7.1.1. Инициация транскрипции
Дифференциальная экспрессия генов у прокариотов зависит от экофизиологической обстановки и, как правило, контролируется на уровне инициации транскрипции. Поскольку невозможно иметь набор РНК-полимераз на все случаи жизни (т. е. отдельно для каждого типа транскрипционной единицы), число типов РНК-полимераз на порядок меньше, чем число генов. При этом множественные формы голоэнзима различаются только субъединицами σ, которые узнают в матричной ДНК «свой» промотор транскрипции, или просто промотор (англ. promoter — букв, покровитель). Иначе говоря, субъединицы σ определяют специфичность РНК-полимераз в отношении промоторов, и поэтому они называются факторами инициации транскрипции; каждый класс промоторов распознается специфической субъединицей σ.
Разные типы субъединиц с (сигма-факторов) взаимно конкурируют за связь с кор-ферментом. Однако, каким образом осуществляется дифференциальная транскрипция их собственных генов, точно не известно.
Промоторы. Наиболее изучены промоторные участки Е. coli (свыше 150 типов). Как показал сравнительный анализ их последовательностей, существует главная форма РНК-полимеразы, которая отвечает за конститутивную транскрипцию информационных генов и генов домашнего хозяйства — Еσ70 (надстрочная цифра указывает молекулярную массу, кДа).
У другого модельного объекта, В. subtilis, главной формой РНК-полимеразы является голофермент ЕσА (Еσ43).
Скорость синтеза субъединиц главных РНК-полимераз прямо пропорциональна скорости роста бактерий, как и скорость синтеза рибосомных белков.
Внутри промоторных участков, связывающих голофермент Еσ70, расположены две высоко консервативные гексануклеотидные последовательности, которые имеют консенсусную (т. е. среднестатистическую) структуру TTGACA и ТАТААТ. Они служат сигналами для связывания РНК-полимеразы и инициации транскрипции. Поскольку центры этих последовательностей лежат на расстоянии 35 и 10 нуклеотидов левее (upstream) стартовой точки транскрипции, они называются блоком -35 и блоком -10. Третьим консервативным участком промотора является спейсер размером 17±1 нуклеотид, расположенный между концом блока -35 и началом блока -10 (рис. 214).
Рис. 214. Консенсусные последовательности промоторов с сайтами узнавания для главной РНК-полимеразы Е. coli (Ест70).
Рамкой обозначаются наиболее консервативные нулеотиды (> 75% сайтов).

Мутации, изменяющие длину спейсера, оказывают существенное воздействие на уровень транскрипции.
Помимо главной формы РНК-полимеразы существуют минорные, или альтернативные РНК-полимеразы. Они распознают специальные консенсусные последовательности в индуцибельных промоторах. Е. coli образует пять таких РНК-полимераз. Например, голофермент Еσ32 отвечает за транскрипцию генов теплового шока (см. раздел 19.1.1).
К числу других альтернативных РНК-полимераз относится голофермент Еσ54. В частности, у энтеробактерий и Klebsiella pneumoniae он распознает консервативные последовательности -24 (5'-TGGCAC-3') и -12 (5'-TTGCA-3') в промоторах ntr- генов азотного голодания и nif-генов диазотрофии.
Сигма-фактор σ54 (ген rpoN) интересен тем, что имеет очень низкую степень гомологии с остальными сигма-факторами. В свою очередь, сигма-фактор σ38 (ген rpoS), управляет стрессовым ответом при переходе в стационарную фазу роста (см. раздел 18.1.2), а сигма-фактор σ28 (ген rpoF) определяет экспрессию генов жгутиков и генов хемотаксиса. В образовании эндоспор В. subtilis принимают участие до шести альтернативных сигма-факторов (в частности, σЕ, σF. σG, σН и σК; см. раздел 17.5.2.2), а всего у этой бактерии их около 17. Дополнительные сведения о сигма-факторах приводятся в разделе 18.1.1.1.
Промоторы не только отмечают сайт инициации транскрипции, но и определяют ее скорость. «Сила» промотора (англ. promoter strength) зависит от его сродства к РНК-полимеразе, а также от темпа перехода к открытому комплексу, в котором образуется транскрипционный пузырек и начинается копирование матричной цепи ДНК (см. ниже). Сильные промоторы, в отличие от слабых, имеют высокую константу связывания с РНК-полимеразой и задают высокий темп образования открытого комплекса. Самые слабые промоторы способны инициировать только абортивную транскрипцию, которая прерывается уже на стадии инициации.
Регуляторная роль промотора в инициации транскрипции определяется его собственным расположением; кроме того, у гена или оперона может быть несколько промоторов, причем иногда они находятся в разной взаимной ориентации.
Активация. Для бактерий характерна регуляция экспрессии генов на уровне инициации транскрипции. Бактериальные мРНК являются короткоживущими молекулами, и поэтому синтезом белка выгодно управлять в самом начале информационного каскада. Чаще всего инициация транскрипции регулируется путем выбора альтернативных сигма-факторов, а также с помощью репрессоров или активаторов (см. ниже).
Уровень транскрипции, который поддерживается главной РНК-полимеразой и обеспечивает стандартный набор жизненных функций, называется базовым (англ. basal transcription). При нем все субъединицы голофермента образуются конститутивно, т. е. их общее содержание не коррелирует с характером метаболизма и темпом клеточной репродукции. Если бы такая регуляторная стратегия распространялась на реально существующее многообразие внутриклеточных систем и процессов взаимодействия с окружающей средой, все гены транскрибировались бы с постоянной скоростью пропорционально силе своих промоторов, что полностью исключило бы возможность эндогенной и экологической адаптации.
Однако на деле все выглядит иначе. Прокариоты обладают ярко выраженной способностью к дифференциальной экспрессии генов, которая контролируется факторами транскрипции. Они имеют белковую природу и выполняют роль регуляторных элементов по отношению к генам-мишеням, которые находятся в цис-положении по отношению к промоторам, т. е. в той же группе сцепления.
Одни из факторов транскрипции, или активаторы транскрипции повышают ее уровень по сравнению с базовым уровнем. Другие, или репрессоры транскрипции действуют противоположным образом.
Отдельным механизмом контроля инициации транскрипции является ковалентная модификация РНК-полимеразы путем фосфорилирования отдельных субъединиц.
Полиморфизм РНК-полимеразы может также обеспечиваться ее взаимодействием с сигнальным метаболитом — (p)ppGpp (см. рис. 254), который играет роль регуляторного фактора «строгого» ответа в стрессовых условиях, например, при аминокислотном голодании (см. раздел 18.1.4).
Стимуляция образования закрытого комплекса. Существуют два механизма активации инициации транскрипции:
— стимуляция образования закрытого комплекса;
— стимуляция изомеризации закрытого комплекса в открытый.
Первый механизм более распространен. Его образно называют рекрутированием РНК-полимеразы (англ. RNA polymerase recruitment), поскольку он способствует взаимодействию голофермента с промотором.
В основе образования закрытого комплекса изначально лежит сила промотора, а она тем больше, чем выше сходство последовательностей блоков -35 и -10 с консенсусными. Неудивительно, что одними из наиболее консервативных и, соответственно, наиболее сильных промоторов являются тг-промоторы оперонов рРНК. При высокой скорости роста они обеспечивают свыше половины валового объема транскрипции.
Сила rrn-промоторов дополнительно увеличивается за счет третьего сайта связывания РНК-полимеразы, или UP-элсмента (сокр. англ. upstream palindrome). Эта AT-богатая последовательность длиной ~20 п. н. имеет консенсусную структуру 5'- AAA(A/T)(A/T)T(A/T)TTTTNNAAAA-3' и расположена слева от блока -35.
РНК-полимераза взаимодействует с UP-элементом при помощи С-коицевых доменов своих α-субъединиц (рис. 215, Б), что повышает ее сродство к «специфической» ДНК и, соответственно, способствует образованию закрытого комплекса.
Рис. 215. Комплексы голофермента РНК- полимеразы с промотором. А — без участия UP-последовательности; Б — с участием UP-последовательности; В — с участием CRP-белка и промоторов I класса; Г — с участием CRP-белка и промоторов II класса. α, β, β' и σ — субъединицы РНК-полимеразы; αс — С-концевой домен α-субъединицы РНК-полимеразы; αN — N-концевой домен α-субъединицы РНК-полимеразы; UP — UP-последовательность; CRP — CRP-белок.
Стрелкой указано направление хода транскрипции.
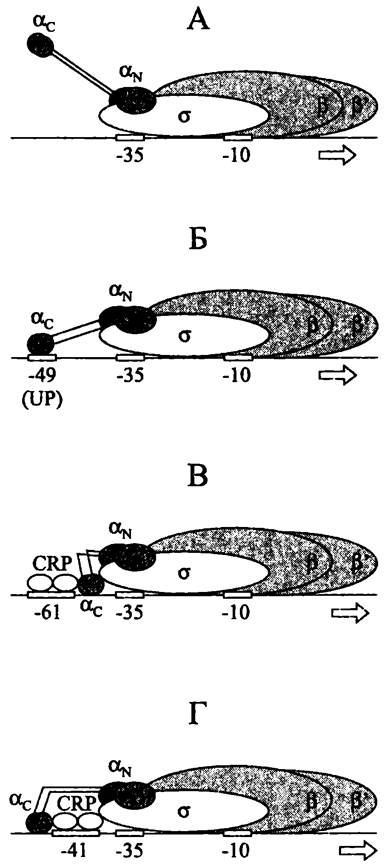
В отсутствии UP-последовательностей повышенное сродство РНК-полимеразы к промоторным участкам ДНК обеспечивают белки-активаторы. Типичные регуляторные участки ДНК, с которыми они взаимодействуют, находятся на близком расстоянии (<150 н.) слева от промоторов и поэтому называются 5'-активирующими, или UАS-последовательностями (сокр. англ. upstream activating sequence).
UAS-последователыюсти следует отличать от энхансеров (англ. enhancer — усилитель), которые расположены на дальнем расстоянии от промоторов (до нескольких т. н.), причем не только слева, но иногда и справа от них.
В обоих случаях белки-активаторы содержат два домена — связывающий домен (англ. binding domain; BD), который узнает специфическую последовательность регуляторного участка, и активаторный домен (англ. activation domain; AD), который взаимодействует с комплексом РНК-полимераза/промотор.
Характерным примером белков-активаторов, взаимодействующих с UAS-последовательностями, служат димерные CRP-белки (сокр. англ. cyclic АМР receptory protein; 23 кДа).
После активации с помощью аллостерического эффектора —циклического аденозинмонофосфата (3',5'-цикло-АМФ) (см. рис. 260) они приобретают способность взаимодействовать с UAS-последовательностью длиной 22 п. н., которая имеет консенсусную структуру 5'-AAATGTGATCTAGATCACATTT-3'. Следом за этим активаторный домен CRP-белка образует тройственный комплекс с бинарным комплексом РНК-полимераза/промотор.
Белки-активаторы, взаимодействующие с UAS-последовательностями, равно как и их мишени — опероны или промоторы — подразделяются на два класса.
В комплексах I класса CRP-белок связывается с регуляторным участком в консенсусном положении -61; при этом проксимальный мономер взаимодействует с С-концевым доменом α-субъединицы РНК-полимеразы (рис. 215, В). Таким путем, в частности, активируется промотор лактозного оперона lac. Характерными примерами активаторов I класса служат белок АгаС (активатор арабинозного оперона), белок OmpR (активатор синтеза главных поринов ОmрС и OmpF; см. I том учебника), а также белки OxyR и SoxR (активаторы генов защиты при окислительном стрессе; см. раздел 19.1.6.2).
В комплексах II класса CRP-белок связывается с регуляторным участком в консенсусном положении -41; при этом дистальный мономер взаимодействует с С-концевым доменом субъединицы а РНК-полимеразы, а проксимальный — с субъединицей а (рис. 215, Г). Так, в частности, активируется промотор галактозного оперона gaIР2. Характерным примером активатора II класса служит белок SохS (активатор генов защиты при окислительном стрессе; см. раздел 19.1.6.2).
Наряду с комплексами типа активирующий белок/UAS-последовательность, образование закрытого комплекса могут стимулировать комплексы типа активирующий белок/энхансер. Возникает вопрос, как они это делают, занимая положение вдали от промотора?
По современным представлениям, данная проблема решается путем сближения регуляторного участка с сайтом-мишенью за счет изменения третичной структуры ДНК. Локальный изгиб с образованием энхансосомы могут вызывать как сами активаторы транскрипции, например, CRP-белки, так и многофункциональные специализированные ДНК-изгибающие белки — H-NS, Fis и IHF (см. I том учебника, а также раздел 16.6.1.2).
В частности, гетеродимерный белок IHF (2 x 11 кДа; гены himА и himD) связывается с консенсусной последовательностью 5'-((A/T)-ATCAANNNNTT(G/A))-3', в результате чего ДНК изгибается под углом ~160°.
Покажем это на примере активации оперона нитрогеназы nifHDK у свободноживущего диазотрофа Klebsiella pneumoniae (рис. 216).
Рис. 216. Участие ДНК-изгибающего белка IHF в образовании закрытого комплекса при активации транскрипции оперона nifHDK. NifA — активаторный белок; Еσ54 — голофермент РНК-полимеразы. Пунктирной стрелкой указано направление хода транскрипции.
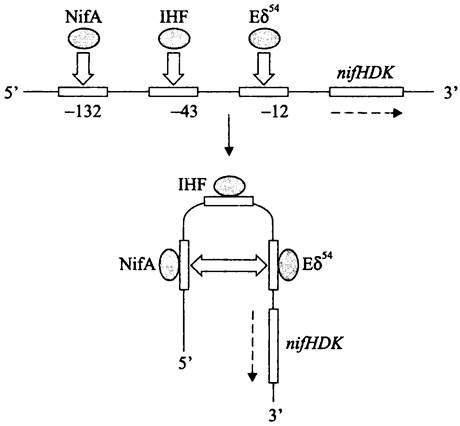
В данном случае транскрипцию осуществляет альтернативная РНК-полимераза Eσ54 (см. выше). Активатором служит белок NifA; он связывается с регуляторным сайтом, центр которого находится в положении -132 (слишком далеко от промотора, чтобы образовать тройственный комплекс с РНК-полимеразой). При связывании IНF-белка в ДНК возникает локальный изгиб, и регуляторный участок сближается с сайтом-мишенью.
Стимуляция изомеризации закрытого комплекса в открытый комплекс. Данный механизм используется в относительно редких случаях, когда РНК- полимераза образует с промотором закрытый комплекс (RРс), однако его переход в открытый комплекс (RРо) происходит с низкой скоростью.
Характерным примером служат альтернативные РНК-полимеразы Еσ54, участвующие в экспрессии генов азотного метаболизма. Хотя в данном случае голофермент обладает высоким сродством к консенсусным блокам -24 и -12, из-за короткого размера спейсерного участка промотор работает «вполсилы», и образование транскрипционного пузырька замедляется (рис. 217). Для стимуляции изомеризации в отрытый комплекс требуется АТФаза, которая играет роль атипичного активатора транскрипции.
Рис. 217. Стимуляция изомеризации закрытого комплекса в открытый комплекс с помощью регуляторного белка NtrС. А — закрытый комплекс; Б — переход к открытому комплексу; В — открытый комплекс. NtrС~Р —фосфорилированная форма регуляторного белка NtrС.
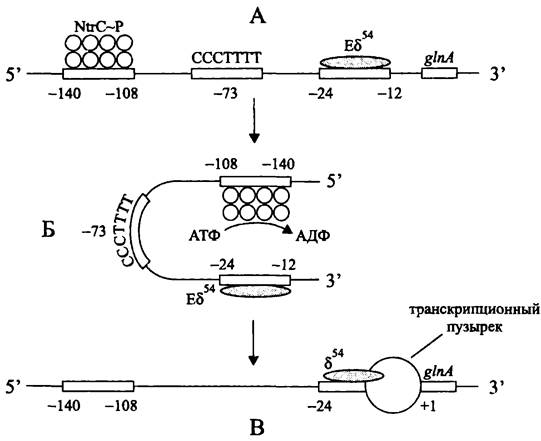
Активатором гена glnA, кодирующего глутаминсинтетазу, ключевой фермент ассимиляции аммония (см. II том учебника), служит белок NtrC. Он связывается с регуляторным участком, 5'- и З'-концы которого занимают, соответственно, положения -140 и -108. Как и в случае уже рассмотренного нами активаторного белка NifA, расстояние до промотора вдоль цепи ДНК слишком велико, чтобы образовать тройственный комплекс с РНК-полимеразой. Однако необходимость в локальном изгибе ДНК в данном случае отсутствует — он и так имеется благодаря последовательности СССТТТТ, центр которой занимает положение -73.
Белок NtrC служит регулятором ответа в двухкомпонентной сигнальной системе (см. раздел 18.1.1.3). После фосфорилирования сенсорной киназой NtrB он связывается с регуляторной последовательностью гена glnA, образуя октамерный агрегат, обладающий АТФазной активностью. За счет энергии гидролиза АТФ изменяется конформация Еσ54, и закрытый комплекс превращается в открытый.
Репрессия. Инициация транскрипции может не только активироваться, но и частично или полностью подавляться, т. е. репрессироваться. Специфические белки-репрессоры присоединяются к операторам — сайтам, расположенным вблизи от промоторов, не дальше положения -60. Поэтому в большинстве случаев операторы перекрываются с консенсусными блоками -35 и -10 или даже находятся правее последнего, так что их центр имеет координату +12. Гораздо реже операторные сайты расположены левее блока -35 и перекрываются с UP-последовательностями или с регуляторными участками для связывания активаторов.
По современным представлениям, механизм репрессии состоит в том, что комплекс репрессор/оператор стерически блокирует образование комплекса РНК-поли- мераза/промотор (если они рядом). А поскольку константа ассоциации репрессора с оператором на несколько порядков выше, чем у РНК-полимеразы с промотором, спор за связь с одним и тем же участком ДНК решается в пользу репрессора.
Прочность связи репрессора с ДНК объясняется тем, что при взаимодействии с оператором он образует димеры и более крупные мультимерные агрегаты (помимо домена для связывания ДНК мономер репрессора содержит домен олигомеризации). Оператор, со своей стороны, содержит симметричные палиндромные участки, которые способствуют димеризации репрессора.
В случае перекрывания оператора с позитивной регуляторной последовательностью репрессор мешает С-концевому домену α-субъединицы взаимодействовать с UP-элементом или не позволяет белку-активатору десантироваться на ДНК.
Другой тип «архитектурной» репрессии транскрипции вызывает ДНК-связывающий белок H-NS (см. I том учебника). Его олигомеры негативно контролируют экспрессию до 5% генов Е. coli, связываясь с изгибами ДНК в области промоторов с образованием петель, в которых запутывается РНК-полимераза. На стабильность таких репрессорных комплексов могут влиять внешние стимулы (в частности, повышение температуры и изменение осмолярности среды), которые локально изменяют суперспирализацию ДНК.
В свою очередь, «архитектурным» активатором транскрипции является ДНК- изгибающий белок Fis (см. I том учебника и раздел 16.6.1.2 настоящего тома).
Данный тип регуляции имеет особое значение для экспрессии генов инвазии и вирулентности у ряда патогенных энтеробактерий, испытывающих экологический стресс при попадании в организм хозяина (Е. соli, Salmonella entérica серовар Туphimurium, Shigella flexneri и др.).
Контроль над активаторами и репрессорами. Итак, мы видим, что функция регуляторных факторов транскрипции — активаторов и репрессоров — заключается в том, чтобы первично влиять на экспрессию генов. Такое влияние носит раздельный, или дифференциальный характер и служит частью сложного клеточного ответа на эндогенные команды или сигналы, поступающие из внешней среды.
Как и все, что происходит в жизни прокариотов, действие факторов транскрипции сугубо рационально, а это возможно только в том случае, если они, в свою очередь, будут регулироваться. Иными словами, существует феномен регуляции регуляторов.
Контроль над факторами транскрипции может осуществляться двумя способами:
— на транскрипционном и трансляционном уровнях (путем воздействия на экспрессию гена белка-активатора или белка-репрессора);
— на посттрансляционном уровне (путем изменения активности уже синтезированного активатора или репрессора).
Дополнительными формами контроля служит процессинг первичного транскрипта или процессинг первичного продукта трансляции.
Транскрипционный и трансляционный уровни. Решающее значение имеет регуляция на транскрипционном уровне, в первую очередь, на уровне инициации транскрипции. Она может осуществляться двумя способами.
В первом случае активатор и репрессор авторегулируются, т. е. контролируют экспрессию собственных генов.
Во втором случае экспрессия генов белков-регуляторов находится под контролем регулятора более высокого уровня, вплоть до глобального мастер-регулятора (см. раздел 18.1).
Типичным примером второго способа регуляции служит белок SoxS, который активирует транскрипцию структурных генов, относящихся к регулону окислительного стресса (см. раздел 19.1.6).
В свою очередь, собственная транскрипция белка SoxS активируется регуляторным белком SoxR, который взаимодействует с промотором гена soxS.
Наконец, «старший» регулятор SoxR тоже должен быть активирован. Это происходит в результате превращения его неактивной восстановленной формы в активную окисленную форму под прямым воздействием экзогенного или эндогенного индуктора окислительного стресса — супероксидного анион-радикала (O-2).
Авторегуляция по типу активации или репрессии гораздо экономичнее и поэтому она распространена шире, чем регуляция белком, расположенным выше в регуляторном каскаде. Однако еще более экономична регуляция активности уже синтезированного белка.
Посттрансляционный уровень. Белки-активаторы и белки-репрессоры могут изменять свою активность в результате связывания с низкомолекулярными лигандами, которые изменяют их молекулярную конформацию.
В качестве примера регулируемого активатора можно привести CRP-белки (см. выше), влияющие на экспрессию катаболитных генов. Они активируются в результате конформационного изменения, вызванного лигандом-эффектором, - 3',5'-цикло- АМФ. Константа ассоциации между CRP-белком и UAS-последовательностью на пять порядков выше для его активной формы, чем для неактивной (5 • 1010 М-1 против 1 • 105 М-1).
В случае регулируемого репрессора репрессия прекращается из-за уменьшения сродства к оператору в результате связывания лиганда-индуктора. Хрестоматийным примером служит белок-репрессор LacI лактозного оперона Е. coli, который связывается с оператором lасO (см. раздел 16.3.1.2). Константа ассоциации между репрессором и оператором в отсутствии природного или искусственного лиганда- индуктора, соответственно аллолактозы и IPTG, на три порядка выше, чем без индуктора (1 • 1013 М-1 против 1 • 1010М-1). Возьмем другой пример, когда для прочной связи репрессора с оператором требуется лиганд-эффектор, который в данном случае называется корепрессором (см. раздел 16.3.1.2). Так, в случае Е. coli репрессор TrpR только тогда оказывает подавляющее воздействие на транскрипцию структурных генов триптофанового оперона, когда он связывается с лигандом — триптофаном.
Наряду со связыванием лиганда, существует другой способ посттрансляционного контроля факторов транскрипции, а именно — их ковалентная модификация. Чаще всего это происходит путем обратимого фосфорилирования (см. раздел 18.2).
Примером более специфичной ковалентной модификации регулятора является уже упомянутый нами сенсор окислительного стресса SoxR. Он переходит в активную окисленную форму под воздействием супероксидного анион-радикала. Непосредственной мишенью служит высоколабильный [Fе2S2)-кластер.
Другой пример ковалентной редокс-модификации — это окисление пероксидом водорода сульфгидрильных групп регуляторного белка ОхуR, который регулирует экспрессию генов защиты при окислительном стрессе. Благодаря образованию внутримолекулярных дисульфидных сшивок изменяется конформация белковой молекулы и, соответственно, сродство к промоторному сайту. Более подробно об этих белках мы поговорим в разделе 19.1.6.2.
Наконец, существует еще один, самый радикальный способ регуляции на пост- транскрипционном уровне — это протеолитическая деградация активатора или репрессора. Так происходит с некоторыми факторами транскрипции, в частности с сигма-фактором теплового шока σ32 или с репрессором SOS-ответа LехА (см. раздел 19.1), которые разрушаются под воздействием специализированных протеаз.
16.7.1.2. Элонгация
Открытый комплекс РНК-полимеразы способен транскрибировать разные по длине участки ДНК-матрицы, эквивалентные как отдельному гену, так и целому оперону. Первичный транскрипт имеет размер до 10 т. н. (~10 генов).
Элонгация, или наращивание полинуклеотидной цепи РНК необратимо завершается после освобождения транскрипта («нельзя дважды войти в одну и ту же реку»). Завершение транскрипции строго контролируется и происходит только в особых сайтах — терминаторах.
Элонгация, темп которой в среднем составляет 100 н.-с-1, не является монотонным процессом. Существуют специальные сайты торможения (англ. pause) и остановки (англ. arrest). В первом случае скорость элонгации снижается на порядки; во втором случае терминация приостанавливается с сохранением тройственного комплекса ДНК/РНК-полимераза/РНК.
С конца 1980-х гг. было предложено несколько моделей элонгирующих комплексов РНК-полимеразы, однако ни одна из них не получила решающего подтверждения.
Наиболее актуальна модель скользящего зажима (англ. sliding clamp). Она исходит из того, что внутри элонгирующей РНК-полимеразы имеется канал, в котором зажат участок матрицы ДНК с координатами от -15 до +15 (см. рис. 214).
Активный центр расположен на расстоянии 1-2 н. от начала транскрипционного пузырька. В этой области вновь синтезированный участок РНК образует гетеродуплекс с матричной цепью ДНК, длина которого составляет ~8 п. н. (положение от -1 до -8).
Плавление гетеродуплекса осуществляет специализированный участок на внутренней поверхности главного канала, который обладает геликазной активностью и называется «рулем» (англ. rudder). Освобожденная цепь РНК на участке от -9 до -18 попадает в свой выходной туннель.
В данной модели РНК-полимераза играет роль зажима, скользящего вдоль по матрице ДНК. Несмотря на свою жесткость, зажим способен к коротким перемещениям по гетеродуплексу в прямом (5' —> 3') и обратном (3' —> 5') направлениях. Во втором случае каталитический центр периодически теряет связь с наращиваемым 3'-концом РНК, и тогда элонгирующий комплекс временно переходит в неактивное состояние.
Осцилляции зажима усиливаются в сайтах торможения или сайтах задержки транскрипции; после их преодоления процесс приобретает монотонный характер. Хотя точная структура этих сайтов не установлена, предполагается, что они представляют собой инвертированные повторы, богатые остатками U.
Способность воспринимать сигналы и за счет этого принимать участие в регуляторных процессах долго считали прерогативой белков. Однако, как оказалось, к этому способны и РНК. Речь идет о некодирующих последовательностях двух типов: рибовыключателях и малых РНК. Первые принимают участие в регуляции элонгации транскрипции, а вторые в регуляции инициации трансляции (см. раздел 18.2.2).
Рибовыключатели. Термином «рибовыключатель» (англ. riboswitch) обозначается часть нетранслируемой 5'-области некоторых мРНК, которые имеются у представителей всех трех доменов глобального древа.
Рибовыключатели, или РНК-сенсоры связывают небольшие лиганды — аминокислоты (например, лизин), азотистые основания (например, аденин или гуанин), модифицированные сахара (например, глюкозамин-6-фосфат), флавиновые нуклеотиды (например, ФМН) или катионы Mg2+. При связывании лиганда конформация рибовыключатели изменяется. В результате либо создается терминаторная структура, что не дает РНК-полимеразе продолжить элонгацию, либо возникает препятствие для трансляции полноразмерной мРНК.
Как правило, рибовыключатель состоит из 5'-концевого аптамера (англ. aptamer; от лат. apto — прилаживать), или области связывания лиганда и расположенной правее от него области контроля экспрессии генов.
Обычно рибовыключатель реагирует на лиганд только одного типа, однако недавно были описаны тандемные рибовыключатели, взаимодействующие с двумя разными лигандами (S-аденозил- метионином и витамином В12.
Согласно своему названию, рибовыключатель работает в режиме «вкл./выкл.»; иначе говоря, связывание лиганда вызывает конформационпое изменение мРНК, что прекращает экспрессию генов, и наоборот.
В противовес сайтам торможения или задержки транскрипции существуют особые факторы элонгации (GreB), которые каким-то образом помогают элонгирующе- му комплексу вернуться в активное состояние.
16.7.1.3. Терминация
Терминация транскрипции у бактерий происходит в терминаторных сайтах и часто зависит от специализированных факторов терминации.
При продвижении по ДНК-матрице РНК-полимераза синтезирует РНК до тех пор, пока не доходит до терминаторного сайта. Тогда она перестает наращивать РНК, которая освобождается из элонгирующего комплекса.
По аналогии с промоторами, терминаторы могут быть конститутивными или индуцибельными.
В первом случае РНК освобождается из тройственного комплекса с матрицей и РНК-полимеразой без посторонней помощи. Такие терминаторы называются самостоятельными (англ. intrinsic). Во втором случае силы терминатора для этого недостаточно, и ему требуются вспомогательные белковые факторы. Такие терминаторы называются фактор-зависимыми (англ. factor dependent).
Самостоятельный терминатор обычно содержит GC-богатый палиндром, перед которым в матричной цепи находится последовательность поли-А. Соответственно, на 3'-конце транскрипта образуется шпилька (которая затормаживает РНК-полимеразу), а правее нее находится последовательность поли-U (которая из-за плохого спаривания с поли-А участком ДНК способствует распаду гетеродуплекса).
Фактор-зависимые терминаторы тоже обеспечивают образование шпильки на 3'- конце транскрипта, однако правее нее отсутствует последовательность поли-U. Это делает гетеродуплекс устойчивым, и РНК-полимераза не может без посторонней помощи отделиться от матрицы ДНК.
Фактор-зависимые терминаторы различаются по составу, однако для них характерно свойство активироваться с помощью белка Rho.
Белок Rho. Фактор терминации Rho (46,8 кДа; ген rho, от греческой буквы р (ро), которая созвучна первой букве английского слова release — освобождение; в данном случае — содействие освобождению РНК из тройственного комплекса с матрицей и РНК-полимеразой) важен для сохранения жизнеспособности и поэтому распространен у бактерий практически универсально. Мутации по гену rho по большей части летальны, поскольку из-за них образуются многооперонные транскрипты, что вызывает контрпродуктивный сверхсинтез РНК.
Белок Rho относится к суперсемейству АТФ-зависимых гесксамерных геликаз, членами которого также являются ДНК-геликаза DnaB (см. раздел 16.4.1.1) и рекомбиназа RecA (см. раздел 16.6.1.2).
Белок Rho содержит N-концевой домен для связывания РНК и С-концевой домен, который связывает и гидролизует АТФ. Соответственно, он проявляет две ферментативные активности — геликазную (для расплетания гетеродуплекса ДНК/РНК) и РНК-зависимую АТФазную. При связывании с цепью РНК белок Rho образует вокруг нее кольцевой гексамер.
Исходный терминаторный сайт для связывания белка — rut (сокр. англ. Rho utilization site) имеет размер 70-80 н. Это С-богатая и одновременно G-бедная вырожденная последовательность без характерной вторичной структуры. После посадки на РНК белок Rho использует энергию гидролиза АТФ для своего перемещения в направлении 5' —> 3' до гетеродуплекса ДНК-РНК.
Каким образом белок Rho участвует в терминации транскрипции, точно не установлено. Скорее всего, он догоняет PHК-полимеразу, которая затормозилась на Rho-зависимом терминаторе, и расплетает гетеродуплекс. Он также может изменять конформацию РНК-полимеразы, что способствует ее отделению от матрицы ДНК.
Вспомогательный белок Rho сам нуждается в ассистенте, роль которого выполняет белок NusG (21 кДа).
Сопряжение транскрипции и трансляции. Напомним, что РНК-полимераза расплавляет участок двухспиральной ДНК размером ~17 п. н. В транскрипционном пузырьке образуется гетеродуплексный участок между кодирующей цепью ДНК и новообразованной РНК. По мере элонгации первичный транскрипт вытесняется, а одиночная цепь ДНК отжигается комплементарной цепью, т. е. регибридизуется с восстановлением исходной двухцепочечной структуры. Освобожденная мРНК быстро вступает во взаимодействие с рибосомами (см. I том учебника).
При трансляции мРНК сайты для связывания белка Rho экранируются рибосомами. Соответственно, для взаимодействия белка Rho с РНК-полимеразой РНК должна оголиться. Иначе говоря, для начала транскрипции downstream-генов необходимо завершить трансляцию мРНК upstream- гена. Такое явление называется полярностью трансляции (англ. translational polarity).
Нонсенс-мутации (англ. nonsense — бессмыслица) эквивалентны стоп-кодонам и вызывают разрушение трансляционного комплекса. Белок Rho получает свободу действий, и терминация наступает раньше положенного. В результате дистальный конец транскрипционной единицы оказывается нетранскрибированным.
Антитерминация. Термином «антитерминация» (англ. antitermination) обозначается ослабление или устранение терминации. Механизм антитерминации может быть разным.
В одном случае перед 3'-концом транскрипта расположена сигнальная последовательность, с которой взаимодействуют рибосомы или специальные антитерминаторные белки, препятствующие распаду гетеродуплекса с ДНК-матрицей. Иными словами, наблюдается своего рода эффект «анти-Rho».
У бактерий существуют три основных типа антитерминаторов, от которых, в частности, зависит эффективность использования простых сахаров.
Примерами антитерминатора первого типа служат обратимо фосфорилируемый BglB-белок Е. coli, а также SacY- и LicT-белки В. subtilis. В ответ на появление индуктора они становятся объектами контроля со стороны фосфотрансферазной системы (см. раздел 18.3.2.2).
Пример второго типа антитерминатора — GlpP-белок В. subtilis, который непосредственно связывается с эффектором, глицеролом.
Третий тип антитерминатора представлен AmiR-белком Р. aeruginosa, который регулирует использование алифатических амидов опосредованно, связываясь с периплазматическим лигандочувствительным AmiC-белком.
В другом случае терминация предотвращается с помощью особых факторов, взаимодействующих непосредственно с РНК-полимеразой, и транскрипция продолжается «поверх терминатора» (англ. read through).
Антитерминация затрагивает только один из терминаторов (непроцессивная антитерминация) или охватывает все downstream-терминаторы (процессивная антитерминация).
Аттенуация. В отличие от антитерминации, которая направлена на ослабление или устранение терминации, аттенуация использует эффект терминации для регулирования элонгации.
Дело в том, что терминаторные сайты могут занимать положение не только на конце гена или оперона, но и недалеко от сайтов инициации. В случае их постоянной активности транскрипция приняла бы абортивный характер.
Однако, действие таких терминаторов носит временный характер. Они прекращают элонгацию с определенной периодичностью, что в итоге не репрессирует ее полностью, а только замедляет. Такой эффект называется аттенуацией (англ. attenuation — ослабление).
По принципу аттенуации в первую очередь регулируются те опероны, которые отвечают за чувствительный к регуляторным воздействиям «белковый» сектор домашнего хозяйства (метаболизм аминокислот, биосинтез аминоацил-тРНК, биогенез рибосом и протеасом).
В аттенуации в основном участвуют Rho-независимые терминаторы. Транскрипция прерывается на уровне коротких «лидерных» РНК (англ. leader RNA). Продуктом их трансляции служат только сигнальные пептиды, а иногда они вообще не транслируются.
Механизм аттенуации выглядит следующим образом. Напомним, что при использовании самостоятельного терминатора на 3'-конце транскрипта расположена шпилька, тормозящая РНК-полимеразу. Однако под воздействием некоторых регуляторных факторов этот тип вторичной структуры может смениться альтернативным, который уже не вызывает терминацию. Сильно упрощая, можно сказать, что такими регуляторами могут быть либо транслирующие рибосомы (феномен сопряжения транскрипции с трансляцией; см. выше), либо специальные белки.
16.7.2. Обратная транскрипция
Согласно «центральной догме» молекулярной биологии, которую в начале 1960- х гг. сформулировал Френсис Крик, поток генетической информации течет только водном направлении: ДНК —> РНК (транскрипция) —> белок (трансляция).
Однако довольно быстро выяснилось, что транскрипционный этап может получить обратный ход. В 1970 г. Говард Темин (Н. М. Теmin; Нобелевская премия по
физиологии и медицине, 1975 г.), Дэвид Бэлтимор (D. Baltimore, Нобелевская премия по физиологии и медицине, 1975 г.) и Сейко Мицутани (S. Mizutani) открыли ретроэлементы, т. е. генетические структуры — в данном случае это были РНК- содержащие онкогенные вирусы — в состав которых входит ген фермента, синтезирующего ДНК на матрице РНК. В соответствии с характером своего действия этот фермент был назван обратной транскриптазой (англ, reverse transcriptase), или ревертазой (англ. revértase; от лат. re-verto - идти назад).
Позднее в круг ретроэлементов были включены некоторые ДНК-содержащие вирусы (вирус гепатита В и колимовирусы), плазмиды (в митохондриях N. crassa) и способные к хоумингу интроны (см. раздел 16.3.1.4), а также ретротранспозоны животных, растений и плесневых грибов.
Ретротранспозоны (англ. retrotransposon) представляют собой такие мобильные генетические элементы эукариотов, транспозиция которых происходит через образование РНК-овых интермедиатов. Иными словами, они сначала «прямо» транскрибируются в РНК, а потом «обратно» транскрибируются в ДНК и реинтегрируются в геном. Благодаря своей репликативной транспозиции (по аналогии с бактериальными транспозонами: см. раздел 16.3.1.3) ретротранспозоны способствуют увеличению размера генома, а также вызывают генные мутации. Наиболее архаичные «парат ретротранспозоны» потеряли способность к транспозиции и интеграции.
Различают два типа ретротранспозонов — с длинными терминальными повторами (англ. long terminal repeat, LTR) и без них (non-LTR).
В эукариотных геномах ретротранспозоны представлены универсально. Особо богаты ими растения (в случае Zеa mays они составляют 50 75% ядерной ДНК). Животные также содержат очень много ретротранспозонов (42% геномной ДНК Н. sapiens). Ретровирусы, в частности HIV-1 и HTLV-1. кодируют обратную транскриптазу и интегразу и также ведут себя, как ретротранспозоны.
Вопрос о существовании ретроэлементов у прокариотов оставался открытым до середины 1980-х гг., пока Масайори Инуэ (М. Inoue), проводя электрофоретический анализ ДНК миксобактерий Myxococcus xanthus и Stigmatella aurantiaca, не обнаружил сателлитную фракцию одноцепочечных молекул размером 65 -163 н. Поскольку в обоих случаях число их копий составляло 500-700 на клетку, они были названы мультикопийными одноцепочечными ms-ДНК (англ. multicopy single-stranded DNA, msDNA). Вскоре выяснилось, что ms-ДНК имеет необычное строение: с ее 5'-концом ковалентно связана молекула РНК (76 н.), а это предполагало использование последней в качестве праймера. Необычен и характер связи — вместо того, чтобы образовать каноническую 3'-5' фосфодиэфирную связь с РНК, ДНК ответвляется от 20-го гуанилового рибонуклеотида через связь 2'-5'. Кроме того, восемь последних оснований на 3'-конце ms-ДНК образуют гетеродуплекс с 3'-концом РНК. Оба компонента содержат шпильки, т. е. участки стабильной вторичной структуры (рис. 218).
Помимо миксобактерий, у которых широко распространена ms-ДНК, ее содержат ~5% клинических штаммов Е. coli. В данном случае молекула ДНК имеет размер 86 н. и присоединяется к молекуле РНК (82 н.) через 14-й остаток G.
Биосинтез ms-ДНК происходит следующим образом (рис. 218). Однокопийный хромосомный локус содержит частично перекрывающиеся гены msr (кодирующие РНК-компонент ms-ДНК) и msd (кодирующие ДНК-компонент ms-ДНК), а также открытую рамку считывания ревертазы. Участок первичного транскрипта, содержащий гены msr и msd, одновременно служит праймером и матрицей.
Рис. 218. Синтез ms-ДНК. А — участок хромосомы; Б — первичный транскрипт; В — РНК, выполняющая роль праймера и матрицы; Г — синтез и процессинг РНК/ДНК-интермедиата; Д —ms-ДНК. 1 — промотор первичного транскрипта; 2 — инвертированный повтор; msR — кодирующая последовательность ms-РНК; msD — кодирующая последовательность ms-ДНК; ОRFRT—открытая рамка считывания обратной транскриптазы; RT — обратная транскриптаза; G20 — остаток G20, к которому через связь 2'-5' присоединяются дезоксирибонуклеотиды.
Черными треугольниками указаны точки разреза РНКазой Н.
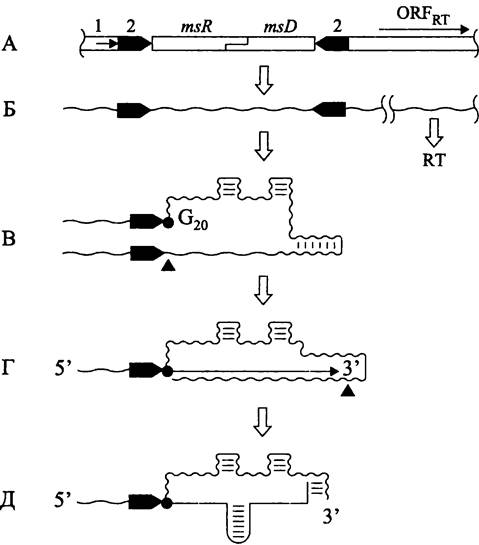
По предложению Темина, хромосомные ретроэлементы бактерий были названы ретронами (англ. retron, от лат. retro — назад и греч. ontos — сущее; «нечто, производящее обратное действие», в данном случае — агент обратной транскрипции). Это наиболее примитивная форма ретроэлементов, поскольку они кодируют только ревертазу. В отличие от мобильных интронов и ретротранспозонов они неспособны к транспозиции, а в отличие от ретровирусов — не образуют зрелые вирусные частицы.
Все известные к настоящему времени ревертазы взаимно гомологичны, что предполагает их общее эволюционное происхождение. Но если у миксобактерий ревертаза коэволюционировала с другими хромосомными генами (судя по одинаково высокому содержанию GC-nap из-за предпочтительного использования кодонов), то в случае Е. coli этот фермент, видимо, был приобретен позднее, причем горизонтальным путем. Напрашивается вывод о том, что эволюция ретроэлементов проходила по схеме: ретроны —> ретротранспозоны —> РНК-содержащие ретровирусы —> ДНК- содержащие ретровирусы.
Остается нерешенным вопрос, какую роль в бактериальной клетке играют ревертаза и ретроны. По современным представлениям, обратная транскрипция обеспечила переход от «мира РНК» к «миру ДНК» (см. I том учебника).
Что касается ретронов, то их, с одной стороны, можно считать генетическими паразитами, которые обеспечивают только собственную репродукцию. Но как тогда объяснить тот факт, что у миксобактерий и Е. coli гены ревертазы присутствуют только в одной копии?
С другой стороны, процессу копирования с помощью ревертазы свойственна низкая надежность, что приводит к «супермутагенности» ms-ДНК. И если современные ретроны сохранились как рудименты, в свое время они могли быть важным фактором эволюции геномов.
О существовании или отсутствии обратной транскрипции у архей в настоящее время ничего не известно.
16.7.3. Транскрипция у архей
Сведений о базовой и регулируемой транскрипции у архей значительно меньше, чем для бактерий и эукариотов. Однако показано, что у всех изученных представителей этого домена транскрипционный аппарат организован по общему плану. Он отличается от бактериального транскрипционного аппарата и сходен с эукариотным, хотя и не идентичен ему.
Промоторы. По контрасту с бактериями, у архей отсутствуют консенсусные гексануклеотидные блоки -35 и -10. Вместо них имеются октануклеотидные ТАТА- боксы («A-боксы», или «дистальные промоторные элементы»), которые аналогичны ТАТА-боксам в промоторах эукариотной РНК-полимеразы II. Как у эукариотов, ТАТА-боксы незаменимы, и их конкретная последовательность определяет не только индивидуальную активность, но и силу промотора. Центр ТАТА-боксов лежит на расстоянии 26-27 нуклеотидов левее стартовой точки транскрипции (рис. 219). Нуклеотидная последовательность ТАТА-бокса не идентична у представителей разных групп архей, в частности для филы Crenarchaeota это — ТТТТТААА, для метано- генов — ТТТАТАТА, а для экстремальных галофилов — NTTTWWWN (W означает А или T; N — один из четырех дезоксирибонуклеотидов). Для распознавания ТАТА- боксов используется белок ТВР (см. ниже). Поскольку архей, подобно бактериям, обладают многоцелевой РНК-полимеразой, ТАТА-боксы участвуют в транскрипции не только мРНК, но и стабильных РНК (тРНК и рРНК).
Рис. 219. Сравнительная организация промоторов у бактерий (А), архей (Б) и эукариотов (В). BRE — элемент, узнающий транскрипционный фактор TFIIB; ТАТА — ТАТА-бокс; INR — инициаторный элемент; DPE — downstream-промоторный элемент; ORF — открытая рамка считывания.
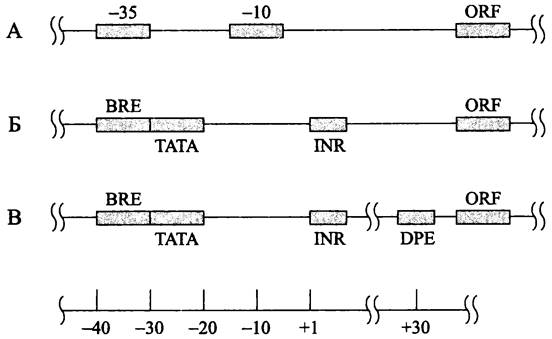
Левее ТАТА-бокса в промоторном участке расположен богатый пуринами элемент, узнающий транскрипционный фактор В (англ. transcription factor В recognition element, BRE). Сведений о нем мало; вероятно, он повышает силу промотора. Интересно, что сходный базовый элемент присутствует в промоторах Н. sapiens.
Третьим компонентом промоторов у архей является инициаторный элемент (англ. initiator element, INR). Данных о нем крайне мало, и даже неизвестно, какой белок используется для его распознавания.
Другие базовые элементы в промоторах архей не обнаружены; в частности, отсутствует характерный для эукариотов элемент, расположенный правее промотора (англ. downstreampromoter element, DPE).
Факторы инициации транскрипции. Напомним, что распознавание промотора у бактерий осуществляется комплексом кор-фермента РНК-полимеразы и субъединицы а, которая теряется в ходе элонгации. Эукариоты используют принципиально другой механизм — сначала факторы инициации транскрипции (TFII-AB- DEFH) распознают промотор, а затем к ним присоединяется РНК-полимераза. Аналогичный механизм имеется у архей. Главными, а может быть, единственными факторами инициации транскрипции у них служат два белка — белок, связывающийся с ТАТА-боксом (англ. ТАТА box binding protein, ТВР), и транскрипционный фактор В (англ, transcription factor В, TFB).
Белок ТВР (ген tbp) состоит из двух повторяющихся доменов по 90 а. о., что свидетельствует о его происхождении на основе дупликации предкового гена. Он содержит участки, обладающие 20-40%-ным сходством с одноименным эукариотным белком.
Фактор TFB (ген tfb) состоит из N-концевого домена (120 а. о.) и двух повторяющихся доменов (по 90 а.о.) на С-конце. Он обладает 20-30%-ным сходством с эукариотным фактором TFIIB, который связывается с промоторами вслед за фактором ТВР. Как уже отмечалось, фактор TFB распознает BRE-элемент, расположенный левее от ТАТА-бокса.
Фазы транскрипции. В состав преинициаторного комплекса у архей входит участок ДНК (с BRE-элементом, ТАТА-боксом и INR-элементом), два транскрипционных фактора (ТВР и TFB) и PHК-полимераза. В отличие от эукариотов, для перехода к открытому комплексу не требуются дополнительные транскрипционные факторы и энергия АТФ; достаточно тройственного комплекса TBP/TFB/PHK-полимераза.
Предполагается, что, как у эукариотов и бактерий (см. выше), за образованием открытого комплекса следует фаза абортивной транскрипции, т. е. синтез свободных РНК размером 2-10 н., после чего происходит освобождение промотора, и РНК- полимераза приступает к стабильной элонгации.
Фактор элонгации архей (англ. transcription factor S, TFS; 130 а. о.) гомологичен эукариотному фактору TFIIS.
Каким образом осуществляется терминация у архей, неизвестно; в частности, так и не найден общий терминаторный сигнал (возможно, что разные представители домена используют специфические терминаторы).
РНК-полимераза. Напомним, что у бактерий кор-фермент «многоцелевой» РНК-полимеразы образован четырьмя субъединицами молекулярной массой от ~14 до ~190 кДа и имеет состав α2ββ'ω. В отличие от этого, у эукариотов три «специализированные» РНК-полимеразы представляют собой многокомпонентные ферменты, состоящие из 12-17 субъединиц (в случае S. cerevisiae это субъединицы RPb1-Rpb12; 191,6-7,7 кДа).
Археи, как и бактерии, используют «многоцелевую» РНК-полимеразу, которая по числу субъединиц (в случае М. thermoautotrophicum это субъединицы А'А"В'В'DFHKE'Е"NLР) и их молекулярной массе (от ~190 до ~8 кДа) соответствует эукариотной РНК-полимеразе II. Самые крупные субъединицы (АВБ) взаимно гомологичны трем самым крупным субъединицам эукариотов (Rрb1-Rрb3) и трем самым крупным субъединицам бактерий (β'βα).
Кор-фермент РНК-полимеразы архей, как и кор-ферменты бактерий или эукариотов, взаимодействует со специфическими транскрипционными факторами.
Предполагается, что механизм действия и рабочий цикл РНК-полимеразы архей в целом такие же, как у бактерий и эукариотов. Имеются клешни из двух самых крупных субъединиц; активный центр содержит катион Mg2+; на участке из 8 п. н. образуется транскрипционный пузырек; кодирующая и некодирующая цепи ДНК занимают отдельные туннели и т. д. (см. выше).
Проблема, отсутствующая у бактерий, но общая у архей с эукариотами — это обеспечение доступа РНК-полимеразы к матрице, экранированной гистонами и образующей вместе с ними нуклеосомы (см. I том учебника). У эукариотов разрыхление хроматина осуществляется путем ацетилирования или метилирования гистонов. Как это происходит у архей, пока не ясно.
Регуляция транскрипции. Напомним, что у архей роль регуляторных факторов транскрипции выполняют белки ТВР и ТFВ. Хотя в большинстве археотных геномов гены tbр и tfbпредставлены единственной копией, экстремальные галофилы содержат до восьми аллелей этих генов, что позволяет создавать несколько десятков парных комбинаций и, соответственно, осуществлять дифференциальную экспрессию генов с разных промоторов.
Предполагается также, что регуляцию транскрипции у архей дополнительно обеспечивают специализированные белки, связывающиеся с ТВР-белком, а также такой архитектурный фактор, как плотность суперепирализации хромосомной ДНК. Подробнее этот вопрос рассматривается в разделе 18.1.1.3.
16.7.4. Посттранскрипционный процессинг мРНК
Во многих случаях продукты РНК-полимеразной реакции, или первичные транскрипты представляют собой ювенильные, еще не ставшие функциональными молекулы РНК.
Созревание таких пре-РНК происходит за счет посттранскрипционных структурных изменений, которые называются процессингом (англ. processing — обработка). Соответствующие биохимические системы имеются у представителей всех трех глобальных доменов, причем и в этом отношении бактерии с археями существенно отличаются от эукариотов.
У прокариотов мРНК транслируется практически сразу же после терминации транскрипции или даже котранскрипционно, т. е. в процессе считывания с матрицы ДНК (см. I том учебника). То, что трансляция быстро следует за транскрипцией, связано с нестабильностью мРНК и ее полицистронным характером.
В свою очередь, для эукариотов характерен пространственно-временной барьер между транскрипцией и трансляцией. Иными словами, мРНК синтезируется в ядре, а транслируется в цитоплазме (см. I том учебника). Перед тем, как транскрипт попадает в цитоплазму, он подвергается ядерному сплайсингу, что окончательно придает ему моноцистронный вид, а также подвергается процессингу, что увеличивает продолжительность жизни мРНК.
Механизмы процессинга мРНК у эукариотов сложны и разнообразны. В частности, процессинг ядерной пре-мРНК включает в себя три типа превращений:
— кэпирование 5'-конца и полиаденилирование 3'-конца первичного транскрипта;
— эксцизию интронов и сплайсинг экзонов;
— редактирование транскрипта путем частичного изменения его нуклеотидной последовательности по сравнению с матрицей ДНК.
Кэпирование (от англ. cap — колпачок) заключается в добавлении к 5'-концу первичного транскрипта через 5'-5' трифосфатный мостик 7-метилгуанилового нуклеотида (m7G). Процесс кэпи- рования состоит из трех ферментативных реакций. Вначале 5'-концевой трифосфат гидролизуется РНК-трифосфатазой с образованием концевого дифосфата:
РРР - (N)n —> РР - (PN)n + Фн.
Затем РНК-гуанилилтрансфераяа переносит от ГТФ остаток ГМФ на 5'-конец полинуклеотидной цепи:
PP-(N)n + PPP-G —> G(5')-PPP-(N)n + ФФн.
В заключение, метилтрансфераза переносит метильную группу от универсального донора, S-аденозилметионина (см. рис. 196), в 7-е положение 5'-концевого гуанилового нуклеотида:
G(5’)-PPP-(N)n + S-аденозилметионин —> m7G(5’)-PPP-(N)n+ S-аденозилгомоцистеин.
Кэпирование влияет на процессинг мРНК и на транспорт пре-мРНК, защищает 5'-конец мРНК от экзонуклеаз, а также позволяет рибосомному фактору инициации трансляции «узнать» мРНК.
Редактирование (англ, editing) выражается в окислительном дезаминировании типа С —> U, А —> I, происходящем в экзонах зрелой мРНК, что приводит к смене кодонов и, соответственно, к замене одного аминокислотного остатка другим.
В отличие от эукариотов, прокариоты лишены способности к кэпированию и редактированию мРНК. В то же время у них существуют мозаичные гены и, соответственно, такой тип процессинга пре-мРНК, как удаление интронов/сплайсинг экзонов (см. раздел 16.3.1.4)- Кроме того, у прокариотов может происходить полиаденилирование, хотя очень долго считалось, что такая биохимическая модификация мРНК свойственна исключительно эукариотам.
Полиаденилированные прокариотные мРНК были впервые найдены во второй половине 1970-х гг.—середине 1980-х гг. у В. brevis, В. subtilis, Е. coli, Hyphomicrobium sp. и ряда штаммов нитчатых цианобактерий, а также у архей Halobacterium salinarium и Methanococcus vannielii. В конце 1970-х гг. полиаденилирование мРНК было обнаружено у митохондрий, а к середине 1990-х гг. — у пластид.
В отличие от эукариотов, у прокариотов, за исключением митохондрий и пластид, полиА- участки имеют меньшую длину (14-60 н. против 80-200 н.), и ими обладают не все, а только 1-40% мРНК. Кроме того, полиаденилированию могут подвергаться незащищенные 3'-концы любой РНК, независимо от нуклеотидной последовательности и вторичной структуры, в частности, это могут быть продукты деградации мРНК и даже рРНК (в то время как у эукариотов избирательно полиаденилируется нетранслируемый участок мРНК размером 10-30 н., расположенный правее гексануклеотида AAUAAA).
Не зависящее от матрицы полиаденилирование осуществляется с помощью полиА-полиме- разы (АТФ: полирибонуклеотид-аденилилтрансферазы). Она поочередно присоединяет аденилатные остатки к 3'-концу молекулы РНК в соответствии с уравнением реакции: РНК + nАТФ —> РНК(А)n + nФФн.
Главная полиА-полимераза Е. coli (PAP I) имеет молекулярную массу 52 кДа. Ее ген был обнаружен в 1992 г. международной группой, возглавляемой американским исследователем Пилимой Саркар (N. Sarkar), и обозначен как рспВ (сокр. англ. plasmid copy number; первоначально его идентифицировали как ген, регулируюгций копийностъ плазмиды ColE1). Важно отметить, что продукт экспрессии этого гена не гомологичен эукариотным полиА-полимеразам.
Наряду с главной полиА-полимеразой у Е. coli имеется вторая полиА-полимераза (PAP II), которая представляет собой гидрофобный белок молекулярной массой 35 кДа (кодируется открытой рамкой считывания f310). Главная и вторая полиА-полимеразы функционально перекрываются и взаимно подстраховывают друг друга.
Каков смысл полиаденилирования, в частности, у прокариотов? Окончательный ответ на данный вопрос еще не получен.
Скорее всего, оно затрагивает ряд не связанных функций. Одной из них может быть регулирование репликации плазмид, в частности ColEl. Контроль копийности осуществляется плазмидной антисмысловой РНК (РНК I). Она блокирует РНК-нраймер (РНК II), инициирующий репликацию плазмиды. В свою очередь, концентрация РНК I контролируется РНКазой Е. Продукт гена рcnВ (PAP I) способствует репликации, поскольку аденилированная РНК I разрушается быстрее, чем неаденилированная. Дело в том, что 3'-экзонуклеазному расщеплению РНК под воздействием РНКазы PNP и РНКазы II препятствуют концевые структуры типа стебель-петля (англ. stem-loop), образующиеся при Rho-незавнсимой терминации. А поскольку полиаденилированный транскрипт уже не заканчивается такой структурой, он более чувствителен к деградации. Эукариотные транскрипты не несут на себе концевые структуры типа стебель-петля, и поэтому их 3'-полиаденилирование выполняет стабилизирующую роль.
За счет полиаденилирования, по-видимому, может дестабилизироваться не только антисмысловая плазмидная РНК, но и мРНК.
Наконец, участок поли-А помогает связыванию транскрипта с белком S1, который входит в состав малой рибосомной субъединицы (см. I том учебника).
16.7.5. Деградация мРНК
Если термин «посттранскрипционный процессинг» использовать в расширенном смысле, имея в виду любые биохимические изменения структуры, то отдельным типом процессинга мРНК можно считать ее ферментативную деградацию до поли- и мононуклеотидов.
В отличие от стабильных типов РНК (рРНК, тРНК и др.), мРНК нестабильна — особенно у прокариотов, где время ее жизни измеряется несколькими минутами. Однако прокариоты сумели обратить этот недостаток себе во благо, поскольку они быстро реагируют на внутренние и внешние стимулы, репрограммируя трансляцию посредством количественного и качественного изменения пула мРНК.
Наряду с транскрипционным контролем на уровне промоторов, существует посттранскрипционный контроль экспрессии генов, основанный на распаде мРНК. Действие этого простого и радикального механизма неизбежно, поскольку мРНК должна постоянно выводиться из оборота. Такое обновление пула мРНК дает возможность перенастраивать трансляционный аппарат — сообразно контексту эндогенной и экологической адаптации. Кроме того, в результате частичной деградации поли- цистронной мРНК образуется набор мРНК разной продолжительности жизни, что также влияет на паттерн трансляции. Наконец, обновление транскриптов позволяет синтезировать нуклеиновые кислоты из «вторсырья» (см. раздел 16.4).
Общие закономерности эндо- и экзонуклеолитической деградации мРНК уже рассматривались в I томе учебника (см. раздел, посвященный деградосоме). В дополнение к сказанному приведем некоторые существенные подробности.
Е. coli обладает, как минимум, пятью эндо-РНКазами (III, Е. G, I и М) и двумя 3' —> 5' экзо-РНКазами (II и PNP).
Эндо-РНКаза III специфически расщепляет двухцепочечные участки РНК, или структуры типа стебель-петля.
Эндо-РНКаза Е многофункциональна; в частности, она производит процессинг тРНК и процессинг 9S рРНК —> 5S рРНК; участвует в процессинге 5'-конца 16S рРНК; осуществляет деградацию антисмысловой РНК I и т. д. Она предпочитает одноцепочечные участки, богатые остатками А и U, и служит каркасом для сборки компонентов деградосомы.
Эндо-РНКазы G, I и М наносят разрезы по относительно неспецифичным сайтам, расположенным в области 5'-конца полинуклеотидной цепи.
Экзо-РНКаза II и полинуклеотид-фосфорилаза PNP различаются по субстратной специфичности — первая предпочитает 3'-конец мРНК, а вторая 3'-конец рРНК.
Мы уже упоминали о том, что ферментативная деградация мРНК зависит от того, полиаденилирован субстрат или нет. В частности, РНКазы II и PNP ингибируются концевыми вторичными структурами типа стебель-петля. Очень многие транскрипты Е. coli терминируются Rho-независимым путем, с образованием структуры стебель-петля и очень короткого одноцепочечного хвоста, устойчивого к экзонуклеазам. И только добавление полиА-участка делает молекулу РНК восприимчивой к этим ферментам.
Деградация мРНК является индуцибельным процессом. Образование многих компонентов деградосомы находится под посттранскрипционным контролем. В частности, эндо-РНКаза III регулирует свой собственный синтез путем расщепления структур стебель-петля, расположенных левее сайта для связывания рибосомы.