ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 20. Иммунология опухолей
ИММУННЫЙ ОТВЕТ НА ОПУХОЛИ У ЧЕЛОВЕКА И МЕХАНИЗМЫ, ПОЗВОЛЯЮЩИЕ ОПУХОЛЯМ «УСКОЛЬЗАТЬ» ОТ ЕГО ДЕЙСТВИЯ
Большинство опухолей инфильтрировано лимфоидными клетками
Гистологический анализ опухолей человека в большинстве случаев показывает, что они инфильтрированы клетками зоны воспаления (рис. 20.8). В инфильтрате обычно доминируют лимфоциты и макрофаги, но могут присутствовать и клетки других типов, в том числе дендритные клетки, гранулоциты и тучные клетки. Более точный анализ типов составляющих опухоли клеток с применением моноклональных антител (мАт), позволяющий выявлять субпопуляции лимфоидных клеток (рис. 20.9), показывает, что в опухолях может присутствовать большинство основных субпопуляций лимфоцитов.
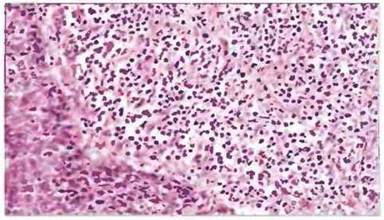
Рис. 20.8. Иммунологическая реакция при раке молочной железы. Срез опухоли, окруженной плотным инфильтратом из мононуклеарных клеток. Воспалительный процесс указывает, что опухолевые клетки распознаются клетками иммунной системы, которые потенциально способны замедлять рост опухоли или уничтожать опухолевые клетки. Окрашивание гематоксилином и эозином.
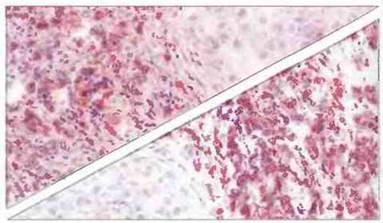
Рис. 20.9. Т-клетки CD4+и CD8+в раковой опухоли молочной железы. Эти клетки выявлены с помощью иммунологического метода окрашивания на щелочную фосфатазу (розовый цвет) с использованием моноклональных антител. Срезы контрастированы гематоксилином Видны окружающие опухоль клетки CD4+(вверху) и в меньшем количестве CD8+(внизу), а также редкие лимфоциты внутри опухоли.
С помощью моноклональных антител, специфичных к рецептору для ИЛ-2, антигенам МНС класса II и другим маркерам активации, можно установить также степень активации клеток. Однако пока не выявлены выраженные ассоциации между определенными субпопуляциями лимфоидных клеток и прогнозом развития злокачественной опухоли. Это может быть обусловлено тем, что в действительности лишь небольшая часть инфильтрирующих клеток специфична к опухоли. Предпринят ряд исследований для выяснения функций инфильтрирующих опухоли лимфоцитов invitro; они рассмотрены в следующем разделе.
Противоопухолевые реакции обнаружены в смешанных культурах лимфоцитов и опухолевых клеток
Идея о том, что ответ примированных антигеном Тх- и Тц-клеток можно выявить путем повторной стимуляции их специфическим антигеном in vitro, была проверена в следующих экспериментах. С целью установить, способна ли иммунная система больного реагировать на опухоль, лимфоциты больных стимулировали инактивированными опухолевыми клетками в смешанных культурах лимфоцитов и опухолевых клеток (СКЛОК) (рис. 20.10). Лимфоциты для этого могли быть взяты из периферической крови, из дренирующих опухоль лимфатических узлов или из самой опухоли (последние названы инфильтрирующими опухоль лимфоцитами).
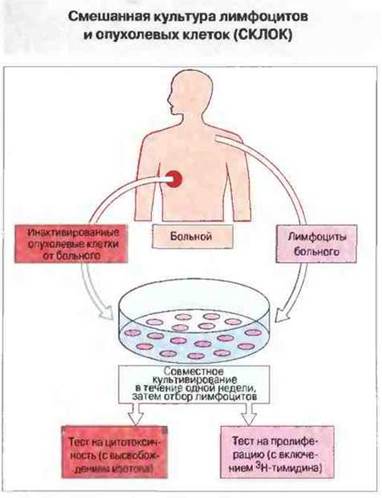
Рис. 20.10. Лимфоциты, выделенные из крови, из дренирующих область опухоли лимфоузлов или непосредственно из опухолевой ткани, культивировали совместно с аутологичными опухолевыми клетками, инактивированными рентгеновским облучением или обработкой митомицином С. После этого определяли способность лимфоцитов к пролиферации (по включению 3Н-тимидина). Разработан также тест для определения способности лимфоцитов лизировать клетки-мишени, основанный на высвобождении изотопа.
Как установлено, в подобных смешанных культурах возможна стимуляция Тх-клеток CD4+, в результате которой они пролиферируют и выделяют эффекторные цитокины. В тех же культурах образуются Tц-клетки CD8+; их цитотоксическую активность можно определить в тесте с высвобождением 51Сr (см. рис. 29.26). Tц-клетки могут быть также получены при культивировании лимфоцитов в присутствии ИЛ-2 для увеличения популяции эффекторных клеток, образовавшихся in vivo. Активность Тц-клеток следует отличать от активности нормальных киллеров (НК); для их дифференциации возросшую популяцию лимфоцитов исследуют с использованием соответствующих стандартных культур.
В СКЛОК образуется много различных специфичностей Т-клеток
Специфичности Тх- и Тц-клеток сходны между собой и обнаруживают различную реакционную способность по отношению к тем или иным клеткам-мишеням у различных больных (рис. 20.11).
✵ В обоих случаях лишь незначительная часть клонированных Т-клеток специфична в отношении аутологичной опухоли.
✵ Некоторые клоны реагируют с аутологичной опухолью и со всеми или с частью аутологичных тестированных тканей.
✵ Ряд клонов обнаруживает реактивность по отношению к аутологичным и некоторым аплогенным опухолям.
✵ Остальные клетки обнаруживают специфичность ко многим опухолевым клеткам-мишеням
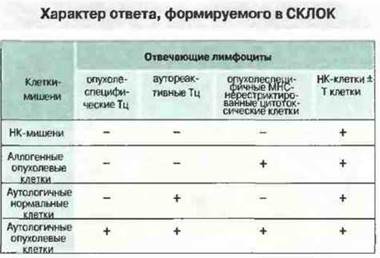
Рис. 20.11. Лимфоциты, отобранные из СКЛОК, исследовали в тесте с высвобождением изотопа 51Сr, используя различные типы опухолевых и нормальных клеток (высвобождение изотопа в культуральную среду указывает на гибель клеток). Лимфоциты от различных больных различаются по специфичности; их свойства варьируют от способности лизировать только аутологичные опухолевые клетки до неспецифического визирования всех клеток-мишеней. В последнем случае, возможно, действуют активированные НК-клетки или Т-клетки. Среди Т-лимфоцитов популяции CD4+и CD8+функционируют сходным образом, обнаруживая одинаковое разнообразие ответов.
Опухолеспецифичные Т-клетки обнаруживаются у больных с различными типами опухолей. Особой иммуногенностью, по-видимому, обладает меланома. Выявлено несколько антигенов, ассоциированных с меланомой (ААМ) и определяемых с помощью моноклональных мышиных антител. Мишенями для Тц-клеток служат ААМ, экспрессируемые некоторыми нормальными клетками, и тирозиназа — фермент, связанный с пигментными клетками. В опухолевых клетках не выявлены мутации ни в генах ААМ, ни в гене тирозиназы. У больных с опухолями выявляется также ответ на продукт мутантного онкогена ras и продукт гена супрессора опухолей, р53.
Третий тип Т-клеточных клонов был выделен от больных раком молочной железы и яичников. Недавно получены данные о том, что эти линии способны отвечать специфически, но нерестриктированно на повторяющийся сердцевинный пептид муцина. Пока неизвестно, презентируется ли указанный пептид в комплексе с молекулами МНС или другим способом (например, действуя как суперантиген). Отвечающие на муцин клетки принадлежат к Тх- или Тц-лимфоцитам (CD4+или CD8+).
Какое значение in vivo имеют цитотоксические ответные реакции, обнаруженные in vitro, остается неясным, однако в модельных экспериментах на животных культивируемые противоопухолевые цитолитические клетки могут вызывать регрессию опухолей.
Опухоли способны многими путями избегать действия иммунного ответа
Спонтанно возникающие опухоли способны к прогрессирующему росту со смертельным исходом для организма, следовательно во многих случаях они избегают действия иммунного ответа. Для объяснения этого предложены разнообразные гипотезы. Наиболее очевидное предположение состоит в том, что опухоли неиммуногенны. Причиной неимунногенности может быть не отсутствие опухолеспецифических антигенов, а недостаточность их презентации на опухолевых клетках. Дли индукции иммунного ответа необходимы костимулирующие факторы, которыми могут служить молекулы клеточной поверхности или цитокины, секретируемые антигенпрезентирующими клетками (АПК). Обнаруженная на специализированных АПК молекула В7, как сейчас известно, служит ключевым костимулирующим фактором; она действует путем связывания с маркером CD28 на поверхности Т-клеток (см. гл. i I). В эксперименте презентация комплексов молекула МНС—антигенный пептид Т-клеточным рецепторам в отсутствие В7 может вызывать анергию. Давно известно, что при онкологических заболеваниях иммунные реакции у больных подавлены. Недавно при исследовании лимфоцитов периферической крови таких больных было выявлено нарушение Т-клеточной передачи сигнала; лимфоциты, инфильтрирующие опухоль, в некоторых случаях могут быть энергичными. Кроме того, если клетки опухоли не несут антигенов МНС класса II, инициация Тх-клеточного ответа зависит от процессинга опухолевых антигенов специализированными АПК (рис. 20.12).
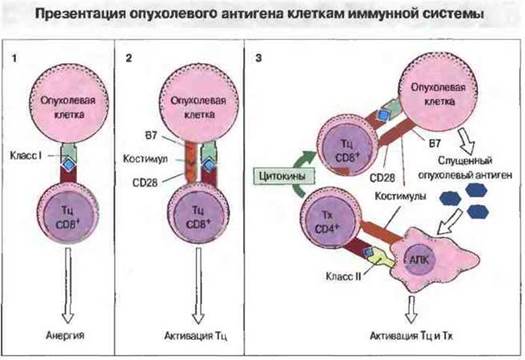
Рис. 20.12. Опухолевый антиген может быть презентирован Т-клеткам различным образом. 1. Непосредственная презентация антигена в отсутствие костимулирующих молекул, приводящая к анергии. 2. Непосредственная презентация антигена на клетках опухоли, которые экспрессируют костимулирующие молекулы, приводит к активации Тц-клеток. 3. Непосредственная презентация на опухолевых клетках и опосредованная презентация специализированными АПК, приводящая к активации и Тц-, и Тх-клеток.
Опухолевые клетки могут также быть лишены других молекул, например LFA-1 и LFA-3 или ICAM-1, необходимых для лимфоцитарной адгезии (см. гл. 5), либо могут экспрессировать антиадгезивные молекулы, такие как муцин. Клетки опухолей способны секретировать и иммуносупрессивные цитокины, например ТФРβ. Особо важный механизм обхода опухолями иммунного ответа — это утрата ими антигенов МНС, приводящая к неспособности презентировать пептиды опухолевых антигенов. В более чем 50 % случаев опухоли утрачивают один или большее число аллелей МНС класса I, а иногда и все эти аллели (рис. 20.13).
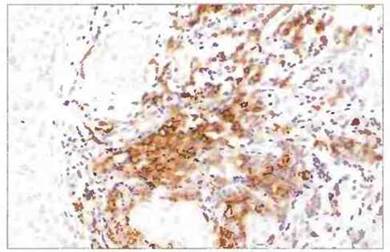
Рис. 20.13. Ткань раковой опухоли молочной железы реагирует с моноклональными антителами к мономорфной детерминанте антигенов HLA класса I. Окрашены только стромальные клетки (коричневый цвет), поскольку злокачественные эпителиальные клетки утрачивают способность экспрессировать нормальные антигены МНС класса I. Примерно 50 % первичных злокачественных опухолей человека относятся к опухолям эпителиального происхождения. На клетках некоторых опухолей происходит аберрантная экспрессия антигенов МНС класса II. (Метод непрямого иммунопероксидазного окрашивания; контрастирование гематоксилином.)