ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 21. Первичная иммунологическая недостаточность
НЕДОСТАТОЧНОСТЬ БЕЛКОВ СИСТЕМЫ КОМПЛЕМЕНТА
Компоненты комплемента и их взаимодействие с иммунной системой описаны в гл. 4. У человека встречается генетически обусловленный дефицит различных белков комплемента (рис. 21.11); изучение таких состояний помогает выяснить нормальные функции системы комплемента.
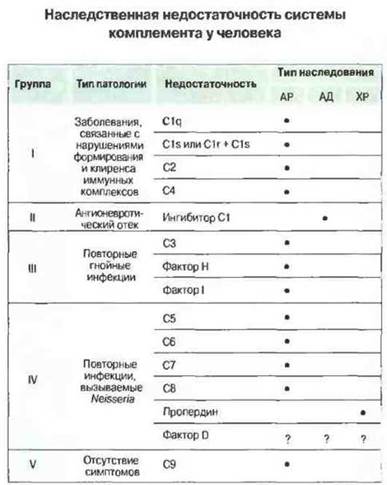
Рис. 21.11. Генетически обусловленные дефекты системы комплемента у человека. (Типы наследования: АР - аутосомно-рецессивный, АД - аутосомно-доминантный, ХР - Х-сцепленный рецессивный).
Нарушения в системе комплемента могут влиять на элиминацию иммунных комплексов, воспаление, фагоцитоз и бактериолиз
Дефицит компонентов классического пути активации комплемента — C1q, С1r и С1s, С4 или С2 — вызывает предрасположенность к заболеваниям, обусловленным нарушениями в формировании и клиренсе иммунных комплексов, например к возникновению системной красной волчанки. Это коррелируете известной ролью классического пути в элиминации иммунных комплексов. Дефицит С3, фактора В или фактора I приводит к повышению чувствительности организма к гнойным инфекциям, что коррелирует с данными о важном значении С3 для опсонизации возбудителей этих инфекций. Недостаточность терминальных компонентов — С5, С6, С7 и С8, а также компонентов альтернативного пути активации комплемента — фактора D и пропердина — создает особую предрасположенность к инфекциям, вызываемым двумя видами Neisseria — N. gonorrhoeae и N. meningitidis. Это ясно указывает на важную роль альтернативного пути активации комплемента и лизирующего мембрану комплекса в элиминации бактерий указанных видов.
Все перечисленные формы недостаточности компонентов комплемента наследуются как аутосомно-рецессивные признаки, за исключением дефицита пропердина (Х-сцепленный рецессивный тип наследования) и недостаточности ингибитора О (аутосомно-доминантный тип наследования).
Наследственный ангионевротический отек (НАО) как результат недостаточности ингибитора С1
Наиболее тяжелые клинические проявления имеет нарушение функции комплемента, связанное с недостаточностью ингибитора С1. Эта молекула вызывает диссоциацию активированного С1, связываясь с C1r2C1s2. Недостаточность ингибитора С1 является причиной наследственного ангионевротического отека (НАО), хорошо изученного заболевания (рис. 21.12), которое передается как аутосомно-доминантный признак. Болезнь характеризуется периодическим возникновением ограниченного отека различных частей тела. Если процесс развивается в кишечнике, он вызывает чрезвычайно резкие спазмы и боли в области живота, сопровождающиеся неукротимой рвотой. Отек верхних дыхательных путей может привести к гибельному для больного удушью и требует немедленного медицинского вмешательства для восстановления нормального дыхания.
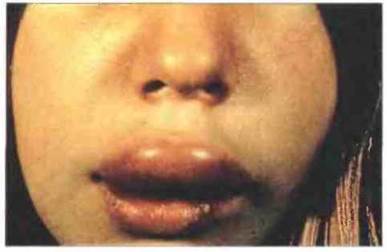
Рис. 21.12. Наследственный ангионевротический отек. На фотографии виден характерный для этого вида патологии преходящий местный отек.
Ингибитор С1 блокирует не только классический путь активации комплемента, но подавляет также активность связанных с ним элементов хининовой и плазминовой систем, а также системы свертывания крови. Возникновение отека опосредовано двумя пептидами, образующимися в результате неингибируемой активации комплемента и связанных с ним систем. Один из пептидов - кинин С2 - представляет собой продукт активации компонента С2, другой — браликинин — возникает при активации кининовой системы (рис. 21.13). В результате действия этих пептидов на посткапиллярные венулы происходит сокращение эндотелиальных клеток с образованием между ними щелей, через которые плазма выхолит в ткани (см. гл. 5).
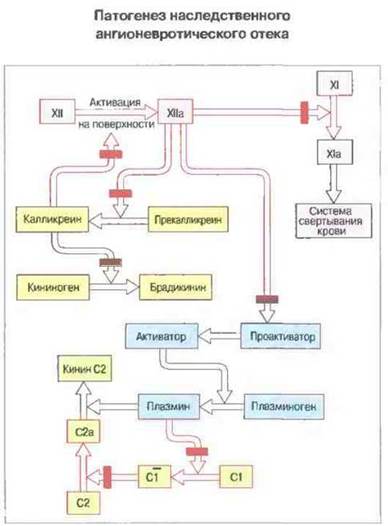
Рис. 21.13. Ингибитор С1 участвует в инактивации элементов свертывающей системы крови, кининовой и плазминовой систем и комплемента. Он может активироваться вслед за поверхностнозависимой активацией фактора XII (фактор Хагемана). Красным цветом обозначены участки действия ингибитора С1. Нерегулируемая активация всех этих процессов ведет к образованию брадикинина и кинина С2, вызывающих отеки.
Существуют две генетически различающиеся формы НАО. Тип I НАО обусловлен дефектом в гене ингибитора С1, вследствие которого не образуются РНК-транскрипты. При типе II НАО ген ингибитора имеет точковые мутации, и молекулы ингибитора синтезируются, но имеют дефекты. Различие между двумя типами НАО важно учитывать, поскольку заболевание II типа путем только количественного определения ингибитора C1 в сыворотке крови диагностировать невозможно. Необходимо также исследовать содержание компонента С4. Уровень последнего в сыворотке больных НАО всегда снижен вследствие его разрушения неингибируемым, активированным C1.
Недостаточность ингибитора С1 может появиться в позднем возрасте. В некоторых случаях при этом обнаруживаются аутоантитела к ингибитору С1, в других — пролиферация моноклонов В-клеток (как это имеет место при хроническом лимфолейкозе), множественная миелома или В-клеточная лимфома. У больных присутствуют антиидиотипические антитела к продуцируемому в избытке иммуноглобулину; по неизвестным причинам взаимодействие идиотип—антиидиотип сопровождается потреблением С1, С4, С2 и ингибитора C1 без образования эффективной С3-конвертазы (которая вызывает отложение С3 и удаление комплексов комплемента).