ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 24. Гиперчувствительность - тип II
РЕАКЦИИ ПРОТИВ ТКАНЕВЫХ АНТИГЕНОВ
Существует ряд аутоиммунных заболеваний, при которых аутоантитела к тканевым антигенам повреждают ткани посредством механизмов гиперчувствительности II типа. Антигены при этом расположены вне клеток, а именно на структурных белках ткани или на клеточной поверхности. Примеры таких заболеваний — синдром Гудпасчера, пузырчатка и злокачественная миастения — рассмотрены ниже.
Нередко можно обнаружить антитела и к внутриклеточным антигенам различных клеток, но их роль в механизмах гиперчувствительности II типа менее изучена. В таких случаях большее значение имеет, вероятно, взаимодействие антигена с Т-клетками, аутоантитела же образуются вторично.
Нефрит при синдроме Гудпасчера вызывают антитела к базальной мембране
У многих больных нефритом обнаруживаются антитела к гликопротеину базальной мембраны клубочковых капилляров. Обычно эти антитела принадлежат к классу IgG и по меньшей мере у 50 % больных они способны фиксировать комплемент. При таком нефрите, как правило, развивается некроз клубочков с отложением фибрина.
Гудпасчер (Goodpasture) впервые описал сочетание нефрита этого типа с кровоизлияниями в легких (отсюда «синдром Гудпасчера»), Легочные симптомы имеют место не у всех больных, однако сочетание легочных и почечных повреждений обусловлено наличием перекрестнореагируюших аутоантигенов в двух этих тканях.
Существует ряд экспериментальных моделей синдрома Гудпасчера. Так, введение крысам или кроликам гетерологичных антител к базальной мембране почечных клубочков вызывает у животных нефротоксический нефрит [гломерулонефрит Масуги (Masugi)]. Введенные антитела откладываются на базальных мембранах, затем на этих антителах происходит отложение уже антител хозяина, что вызывает острый нефрит. Развитие нефрита и протеинурии обусловлено накоплением нейтрофилов, которые связываются по комллемент-зависимому и по комплемент-независимому механизмам. Аналогичные повреждения можно вызвать иммунизацией животных гетерологичными базальными мембранами [модель Стебли (Steblay)].
Еще одна модель заболевания [нефрит Хейманна (Heymann)], напоминающего мембранный гломерулонефрит у человека, воспроизводится у животных при выработке у них аутоантител к белку щеточной каемки эпителиальных клеток клубочковых капилляров. В этом случае повреждение опосредуется в основном комплементом: истощение животных по комплементу уменьшает тяжесть заболевания.
Пузырчатку вызывают аутоантитела к молекуле межклеточной адгезии
Обыкновенная пузырчатка представляет собой тяжелое заболевание, сопровождающееся образованием пузырей на коже и слизистых оболочках. У больных определяются аутоантитела к десмоглеину-3 — компоненту десмосом, формирующему контакты между клетками эпидермиса (рис. 24.15). Эти антитела нарушают связь между клетками, что приводит к нарушению целостности эпидермального слоя. Заболевание коррелирует с присутствием антител IgG4 к различным участкам молекулы десмоглеина-3. Пузырчатка тесно ассоциирована с редким гаплотипом HLA-DR4 (DRB1*0402), причем установлено, что данная молекула в отличие от других субтипов DR4 презентирует пептид дссмоглеина-3. Таким образом, пузырчатка служит наглядным примером аутоиммунных заболеваний, при которых патологический процесс связан с механизмами гиперчувствительности II типа.
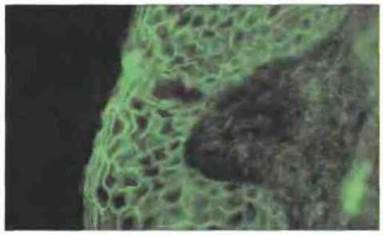
Рис. 24.15. При пузырчатке выявляются аутоантитела в местах межклеточных соединений (иммунофлуоресцентный метод). Антиген входит в состав десмосом, обеспечивающих межклеточную адгезию. Иммунофлуоресценция кожи человека, окрашенной анти-IgA. (Микрофотография любезно предоставлена д-ром R. Mirakian и г-ном Р. Collins.)
Злокачественную миастению и синдром Ламберта-Итона (Lambert-Eaton) вызывают антитела, уменьшающие доступность ацетилхолина в концевых пластинках двигательных нейронов
При злокачественной миастении (заболевание, характеризующееся крайней мышечной слабостью) образуются антитела к рецепторам ацетилхолина па поверхности мышечных мембран. Рецепторы ацетилхолина расположены на концевой пластинке мышечного волокна, там, где двигательный нейрон контактирует с мышцей. Передача импульсов с нерва на мышцу происходит путем выделения ацетилхолина из нервного окончания и его диффузии через синаптическую щель к мышечному волокну.
Иммунизация очищенным препаратом рецептора к ацетилхолину вызывает у экспериментальных животных состояние мышечной слабости, напоминающее миастению у человека; на основании этого было высказано предположение о роли антител к рецептору ацетилхолина в патогенезе этого заболевания. Анализ мышечной патологии при миастении показал, что при данном заболевании ни синтез ацетилхолина, ни его выделение в ответ на нервный импульс не нарушаются; по-видимому, выделяющийся ацетилхолин слабее деполяризует мышечную мембрану (рис. 24.16).
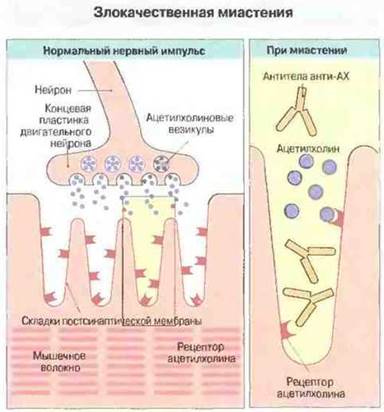
Рис. 24.16. Проходящий по нейрону нервный импульс в норме достигает концевой пластинки и вызывает выделение ацетилхолина (АХ). Последний диффундирует через нервно-мышечный синапс, связывается с ацетилхолиновыми рецепторами мышцы и вызывает открытие ионных каналов в мышечной мембране, что инициирует мышечное сокращение. При злокачественной миастении антитела к рецепторам блокируют связывание медиатора (ацетилхолина). Поэтому эффект выброса ацетилхолина из везикул уменьшается и мышца становится очень слабой. Вероятно, это лишь один из факторов патогенеза данного заболевания.
Иммунохимическое исследование концевых пластинок нейро-мышечных синапсов обнаружило присутствие IgG и белков комплемента С3 и С9 на складках постсинаптической мышечной мембраны (рис. 24.17). (Дополнительным доказательством патогенной роли IgG при этом заболевании стало обнаружение транзиторной мышечной слабости у новорожденных от страдающих миастенией матерей. Это веский аргумент, поскольку известно, что IgG способен проникать через плаценту в кровоток плода.) Считается, что IgG и комплемент действуют двумя путями: увеличивая скорость оборота рецепторов ацетилхолина и частично блокируя связывание ацетилхолина. Клеточная инфильтрация концевых пластинок при миастении наблюдается редко и поэтому высказано предположение, что эффекторные клетки в развитии патологического процесса не участвуют.
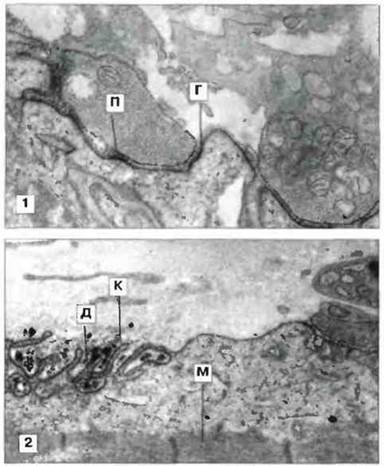
Рис. 24.17. Электронные микрофотографии, показывающие локализацию IgG-аутоантител (1) и компонента С9 комплемента на концевой пластинке двигательного нейрона при злокачественной миастении. На верхнем фото видны дискретные отложения IgG (Г) на постсинаптической мембране (П), х13 000. На нижнем фото видна постсинаптическая область, лишенная нервного окончания; она представлена обрывками и дегенерирующими складками (Д). Эти распадающиеся обрывки дают сильную реакцию при окраске на С9 (К). (М мышечное волокно) х 9000. (Фото любезно предоставлены д-ром A G. Engel.)
При сходном состоянии, синдроме Ламберта-Итона, мышечная слабость обусловлена нарушением выделения ацетилхолина из нейронов. При введении мышам сыворотки или IgG от больных с этим синдромом у животных развивается аналогичное состояние, что свидетельствует о присутствии у больных аутоантител. Такие аутоантитела взаимодействуют с компонентами потенциал-зависимых кальциевых каналов или белком синаптических пузырьков синаптотагмином. Считается, что различные формы синдрома обусловлены аутоантителами к разным антигенам, а также разными классами и титрами антител. Оба эти заболевания служат примерами состояний, при которых аутоантитела к рецепторам блокируют их нормальную функцию. Однако существуют и такие заболевания, при которых аутоантитела оказывают противоположный эффект. Например, при некоторых формах аутоиммунного поражения щитовидной железы антитела к рецепторам ТТГ (тиреотропного гормона) имитируют действие самого ТТГ, т. е. стимулируют функцию щитовидной железы (см. гл. 27).
Аутоантитела к тканевым антигенам не обязательно вызывают реакцию гиперчувствительности II типа
Хотя существует множество аутоантител, взаимодействующих с тканевыми антигенами, их значение как факторов, вызывающих патологический процесс в тканях in vivo, не всегда очевидно. Например, в сыворотке некоторых больных диабетом можно обнаружить in vitro аутоантитела к островковым клеткам поджелудочной железы (рис. 24.18), но основные иммунопатологические процессы при аутоиммунном диабете индуцируются, по-видимому, аутореактивными Т-клетками.
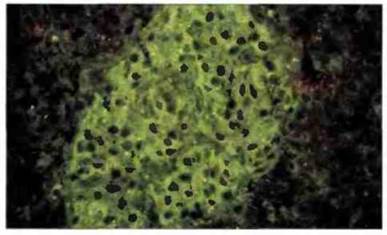
Рис. 24.18. Аутоантитела к островковым клеткам. С помощью метода иммунофлуоресценции при сахарном диабете можно обнаружить аутоантитела к клеткам поджелудочной железы. Они имеют диагностическое и, возможно, патогенетическое значение. (Микрофотография любезно предоставлена д-ром В. Dean.)
До недавнего времени считалось, что аутоантитела к внутриклеточным антигенам, как правило, не вызывают иммунопатологических процессов, поскольку не могут контактировать со «своим» антигеном в живой клетке. Однако в последние годы удалось выяснить, что такие антитела, как анти-РНП и анти-ДНК, способны проникать даже в клеточные ядра и изменять функцию клеток. В некоторых случаях они могут индуцировать апоптоз. Несмотря на то, что роль таких антител в повреждении клеток остается спорной, они часто служат надежными маркерами болезни, поскольку нередко обнаруживаются еще до развития иммунопатологического процесса.
Вопросы для размышления
■ Какие эффекторные клетки иммунной системы активируются при реакциях гиперчувствительности II типа?
■ Что происходит с аллогенными эритроцитами при их первой или последующей трансфузии человеку, полностью лишенному компонента С5 комплемента?
■ Почему антитела к антигенам клеточной поверхности часто вызывают патологические реакции, тогда как антитела к внутриклеточным антигенам обычно такого действия не оказывают?
■ Почему ГБН встречается только у 1 из 20 резус-несовместимых пар мать-плод?
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Alarcon-Segovia D., Ruiz-Arguelles A., Ltorente L. 1996. Broken dogma: penetration of autoantibodies into living cells. Immunol. Today 17: 163-14.
Anstee D.J. 1990. Blood group substances of the human red blood cell. Vox Sang. 58: 1.
Bhol K., Natarajan K., Nagarwalla N. et al. 1995. Correlation of peptide specificity and IgG subclass with pathogenic and non-pathogenic autoantibodies in pemphigus vulgaris: a model for autoimmunity. Proc. Nat. Acad. Sci. USA 92: 5239-43.
Bloy C., Blanchard D., Lambin P. et al. 1988. Characterization of the D, С, E and G antigens of the Rh blood group system with human monoclonal antibodies. Mol. Immunol. 25: 926-30.
Druet P., Glotz D. 1984. Experimental autoimmune nephropathies: induction and regulation. Adv. Nephrol. 13: 115.
Hughes-Jones N.C. 1987. Monoclonal antibodies as potential blood-typing reagents. Immunol. Today 9: 68.
Le van Kim C., Mouro I., Chenif-Zahar B. et al. 1992. Molecular cloning and primary structure of the human blood group RhD polypeptide. Proc. Nat. Acad. Sci. USA 89: 10925-29.
King M.J. 1994. Blood group antigens on human erythrocytes - distribution, structure and possible functions. Biochim. Biophys. Acta 1197: 14-44.
Lang B., Newson-Davis J. 1995. Immunopathology of the Lambert Eaton myasthenic syndrome. Springer Semin, in Immunopathol. 17: 3-15.
Lindstrom J. 1985. Immunobiology of myasthenia gravis, experimental autoimmune myasthenia gravis and Lambert-Eaton syndrome. Annu. Rev. Immunol. 3: 109-31.
Mauro I., Colin Y., Chenif-Zahar B. et al. 1993. Molecular genetic basis of the human rRhesus blood group system. Nature - Genet. 5: 62-5.
Naparstek Y., Plotz P.H. 1993. The role of autoantibodies in autoimmune disease. Annu. Rev. Imminol. 11: 79 -104.
Race R., Sanger R. 1975. Blood Groups in Man 6th edn, Oxford: Blackwell Scientific Publications.
Yamamoto F-l., Clausen H., White T. et al. 1990. Molecular genetic basis of the histo-blood group ABO system. Nature 345: 229.