ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 25. Гиперчувствительность - тип III
ЭКСПЕРИМЕНТАЛЬНЫЕ МОДЕЛИ БОЛЕЗНЕЙ ИММУННЫХ КОМПЛЕКСОВ
Существуют экспериментальные модели всех трех описанных выше типов болезней иммунных комплексов.
✵ Эффект хронической инфекции имитирует сывороточная болезнь, вызываемая инъекциями чужеродного антигена.
✵ Аутоиммунные процессы развиваются у мышей NZB/NZW.
✵ Моделью местного повреждения, вызываемого наружным антигеном, является реакция Артюса.
К интерпретации результатов, получаемых на экспериментальных моделях, необходимо подходить с осторожностью, учитывая, что эритроциты грызунов и кроликов лишены рецепторов С3b(называемых CR1), которые легко связывают иммунные комплексы после фиксации ими комплемента. У приматов же эти рецепторы присутствуют на эритроцитах.
Сывороточную болезнь можно воспроизвести введением больших количеств чужеродного антигена
При сывороточной болезни циркулирующие в крови иммунные комплексы откладываются в стенках кровеносных сосудов и тканях, что приводит к повышению сосудистой проницаемости и тем самым к развитию воспаления, как это происходит при гломерулонефрите и артрите.
Пока не были открыты антибиотики, сывороточная болезнь часто осложняла лечение таких болезней, как, например, дифтерия, при которых больному вводили массивные дозы антител. Обычно применяли лошадиную антидифтерийную сыворотку, и у некоторых больных образовывались антитела к лошадиным белкам.
В настоящее время сывороточную болезнь изучают, как правило, на кроликах, которым внутривенно вводят растворимый чужеродный белок, например бычий сывороточный альбумин (БС'А). Спустя примерно 1 нед у кролика образуются антитела, которые в крови связываются с антигеном. Поскольку эта реакция происходит при избытке антигена, образующиеся иммунные комплексы имеют небольшие размеры (рис. 25.7). Такие мелкие комплексы медленно удаляются лишь системой мононуклеарных фагоцитов и поэтому долго сохраняются в крови. Вслед за образованием комплексов происходит резкое падение общего содержания комплемента; клинические признаки сывороточной болезни обусловлены зернистыми отложениями комплексов антиген антитело и образованием С3 вдоль базальной мембраны почечных клубочковых капилляров и других мелких сосудов. По мере образования все большего количества антител и сдвиге реакции в сторону их избытка размеры комплексов увеличиваются и они начинают поглощаться быстрее; животное выздоравливает. При ежедневном введении антигена болезнь приобретает хроническое течение.
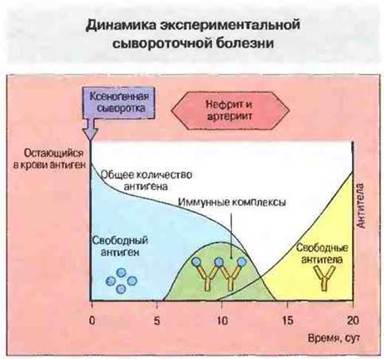
Рис. 25.7. После введения ксеногенной сыворотки наступает длящийся примерно 5 сут латентный период, в течение которого антиген в сыворотке присутствует только в свободной форме. Затем образуются антитела к чужеродным белкам и в сыворотке появляются иммунные комплексы; именно в это время возникают симптомы нефрита и артериита. Вначале, при избытке антигена, происходит образование лишь мелких растворимых иммунных комплексов. С увеличением титра антител формируются более крупные комплексы и происходит их отложение в тканях, но при этом и быстрое разрушение. На этой стадии симптомы заболевания исчезают.
Аутоиммунные реакции у мышей NZB/NZW сопровождаются болезнью иммунных комплексов
У гибридных мышей (NZBxNZW) F1 образуются различные аутоантитела (в том числе к эритроцитам, клеточным ядрам, ДНК и Sm) и развивается болезнь иммунных комплексов, во многом сходная с наблюдаемой у человека при СКВ. Мыши NZB/NZW рождаются клинически нормальными (здоровыми), но в 2-3-месячном возрасте у них появляются признаки гемолитической анемии. Пробы на антиэритроцитарные (тест Кумбса) и антиядерные антитела, на волчаночные клетки и циркулирующие иммунные комплексы дают положительные результаты, а в почечных клубочках и хориоидном сплетении обнаруживаются отложения комплексов. Заболевание гораздо более выражено у самок; они погибают через несколько месяцев после появления симптомов (рис. 25.8).
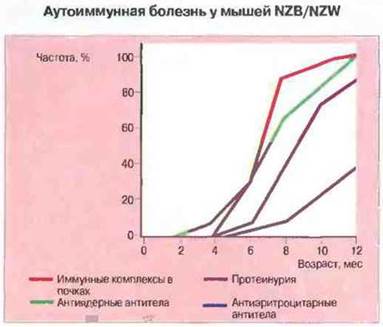
Рис. 25.8. На графике показана зависимость появления различных признаков аутоиммунного заболевания от возраста у самок мышей NZB/NZW. По оси ординат отложена «частота» - доля мышей данного возраста, у которых выявляются указанные признаки. Иммунные комплексы определяли с помощью иммунофлуоресцентного окрашивания почечных срезов, антиядерные антитела в сыворотке - методом непрямой иммунофлуоресценции. Показателем поражения почек служила протеинурия. Аутоантитела к эритроцитам при данном заболевании появляются позднее и поэтому, вероятно, менее связаны с возникновением почечной патологии. У мышей-самцов заболевание возникает примерно на 3 мес позднее.
Внутрикожное введение антигена предварительно сенсибилизированным животным вызывает реакцию Артюса
Реакция Артюса развивается локально, внутри и вокруг стенок мелких кровеносных сосудов; чаше всего ее воспроизводят в коже.
Животное многократно иммунизируют, пока содержание антител (главным образом IgG) в сыворотке не достигнет определимого уровня. Последующее подкожное или внутрикожное введение антигена приводит к развитию местной реакции, иногда с выраженным отеком и кровоизлияниями (в зависимости от количества введенного антигена). Реакция достигает пика через 4—10 ч, а затем затухает, и через 48 ч обычно остаются лишь минимальные ее проявления (рис. 25.9). Иммунофлуоресцентные исследования показывают, что вслед за отложением антигена, антител и комплемента в стенках сосудов происходит их нейтрофильная инфильтрация, а внутри сосудов скапливаются тромбоциты (рис. 25.10). Все это может приводить к окклюзии сосудов и в тяжелых случаях к некрозу ткани. Через 24-48 ч нейтрофилы замешаются мононуклеарными клетками и в конце концов появляется некоторое количество плазматических клеток.
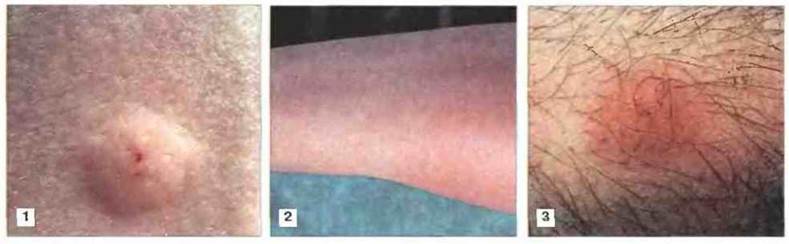
Рис. 25.9. Иллюстрация трех основных кожных тестов. Реакция гиперчувствительности I типа (1) сопровождается появлением примерно через 15 мин волдыря диаметром 5-7 мм с четкими краями. При гиперчувствительности III типа (2) через 5-12 ч развивается реакция Артюса, участок которой захватывает большую площадь (50 мм или больше) и имеет менее четкие края. Реакция гиперчувствительности IV типа (замедленная) проявляется через 24-48 ч краснотой и индурацией примерно 5-мм участка кожи (3).
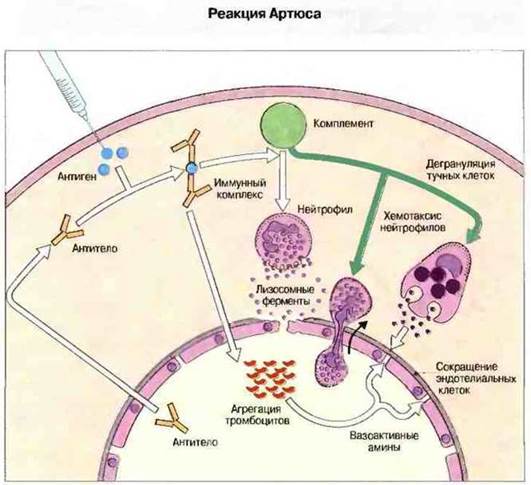
Рис. 25.10. Антиген, введенный внутрикожно, соединяется с поступающими из крови специфическими антителами, что приводит к образованию иммунных комплексов. Комплексы активируют комплемент и влияют на тромбоциты, выделяющие вазоактивные амины. Иммунные комплексы индуцируют также выброс ФИО и ИЛ-1 макрофагами (не показан). Фрагменты комплемента С3а и С5а вызывают дегрануляцию тучных клеток и привлекают в ткань нейтрофилы. Продукты тучных клеток, в том числе гистамин и лейкотриены, повышают кровоток и проницаемость капилляров. Воспалительную реакцию стимулируют лизосомные ферменты, которые выделяются полиморфноядерными клетками. Кроме того, откладывающийся на комплексах С3b опсонизирует их, способствуя фагоцитозу. Реакция Артюса возникает у тех лиц, кровь которых содержит преципитирующие антитела, например у сельскохозяйственных рабочих, страдающих экзогенным аллергическим альвеолитом («легкое фермера»).
Важное значение для развития реакции Артюса имеет активация комплемента по классическому или альтернативному пути. В отсутствие комплемента не происходит привлечения нейтрофилов к месту реакции и последняя ограничивается лишь легким отеком.
Цитокин ФНОα многими путями усиливает клеточный иммунный отпет (см. гл. 10). Введение антител к ФНОα ослабляет реакцию Артюса. Имеются сообщения об эффективности антител анти-ФНО и при ревматоидном артрите.
Выраженность реакции прямо зависит от соотношения антител и антигена. Комплексы, образующиеся в условиях избытка либо антигена, либо антител, гораздо менее токсичны, чем те, которые образуются при балансе этих факторов.