ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 5. Миграция клеток и воспаление
МОЛЕКУЛЫ МЕЖКЛЕТОЧНОЙ АДГЕЗИИ
Молекулы межклеточной адгезии - это связанные с плазматической мембраной белки, которые обеспечивают механическое взаимодействие клеток друг с другом. Часто это молекулы, пронизывающие мембрану и присоединенные к цитоскелету; с их помощью клетки при движении могут подтягиваться к другим клеткам или перемещаться по внеклеточному матриксу. Во многих случаях отдельная молекула межклеточной адгезии способна взаимодействовать не с одним, а с несколькими лигандами, для чего служат разные участки связывания. Хотя связывание индивидуальных молекул адгезии со своими лигандами обычно происходит с низким сродством, авидность взаимодействия может быть довольно высокой, за счет того что молекулы адгезии расположены на поверхности клеток компактными «пятнами», или кластерами, и образуют участки многоточечного связывания.
Адгезия клеток одного типа к клеткам другого типа может изменяться в результате увеличения числа молекул адгезии на клеточной поверхности либо при изменении их аффинности и/или авидности (рис. 5.5). Существуют два механизма увеличения числа молекул адгезии на поверхности клеток: у многих клеток большие запасы этих молекул хранятся во внутриклеточных везикулах, которые способны через несколько минут после активации устремляться к поверхности цитоплазматической мембраны; другой механизм состоит в синтезе таких молекул de novo и переносе их на поверхность (эти процессы занимают, как правило, несколько часов).
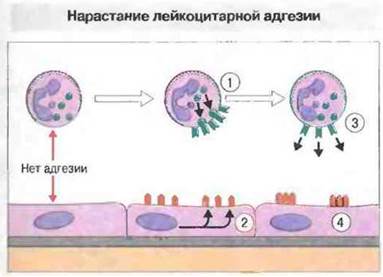
Рис. 5.5. Четыре механизма для усиления связывания лейкоцитов с эндотелием. 1. Многие лейкоциты обладают внутренними запасами молекул адгезии, которые могут быстро доставляться на поверхность. 2. Эндотелиальные клетки в очагах воспаления способны синтезировать молекулы межклеточной адгезии de novo. 3. В результате активации клеток возможно возрастание аффинности связывания, например LFA-1.4. Перераспределение молекул адгезии на клеточной поверхности приводит к образованию высокоавидных участков связывания В реальных условиях клетки одновременно используют несколько механизмов и после первоначального межклеточного взаимодействия аффинность связывания молекул адгезии может существенно изменяться.
Число известных молекул межклеточной адгезии, имеющих значение для лейкоцитарной миграции, ошеломляюще велико. Тем не менее все их можно распределить по четырем семействам структурно родственных молекул. Миграция клеток - это сложный процесс, в котором на разных стадиях принимают участие несколько наборов молекул адгезии.
Некоторые эндотелиальные молекулы адгезии относятся к иммуноглобулиновому суперсемейству
К суперсемейству иммуноглобулинов принадлежит ряд молекул адгезии эндотелиальных клеток, в том числе молекула межклеточной адгезии I типа (IСАМ-1, от англ. intercellular adhesionmolecula-1) и 2 типа (IСАМ-2), молекула адгезии сосудистого эндотелия I типа (VCAM-I, от от англ. vascular cellular adhesion molecula-1) и молекула адгезии ВЭВ лимфоидных образований в слизистых оболочках, названная ранее адрессином I типа — MAdCAM-l (от от англ. mucosal adressin САМ-1). Экспрессия этих молекул на эндотелии сосудов может быть постоянной или индуцибельной. ICAM-1 имеет пять внеклеточных доменов, из которых два N-концевых структурно гомологичны двум внеклеточным доменам ICAM-2. В составе VCAM-I шесть внеклеточных доменов: эти же данные присутствуют в структуре MAdCAM-1 (рис. 5.6).
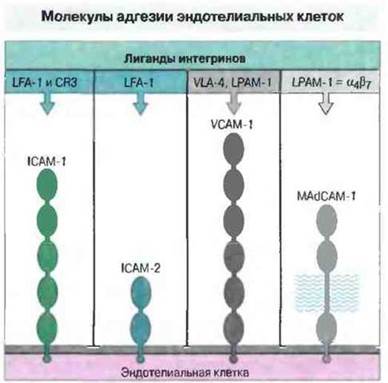
Рис. 5.6. Схематическое изображение эндотелиальных молекул межклеточной адгезии ICAM-1, ICAM-2, VCAM-1 и МАССАМ-1 с Ig-подобными доменами. Их лиганды, входящие в семейство интегринов, приведены в верхней части рисунка. В структуре MAdCAM-1 имеется также обильно гликозилированный сегмент, который связывает L-селектин.
В адгезии лейкоцитов к эндотелию и внеклеточному матриксу участвуют интегрины
Интегрины — это обширная группа молекул межклеточной адгезии, которые присутствуют на поверхности различных клеток, в том числе лейкоцитов. Все белки, входящие в это крупное семейство, состоят из двух нековалентно связанных полипептидных цепей (α и β); обе цепи пронизывают клеточную мембрану. Семейство интегринов делят на три основные подсемейства по типу β-цепи (β1, β2 или β3). Тип α-цепи, соединенной с β-цепью, оказался не так важен для функциональной активности, как предполагали первоначально. В основном β1-интегрины участвуют в связывании клеток со структурами внеклеточного матрикса, β2-интегрины — в адгезии лейкоцитов к эндотелию или другим клеткам иммунной системы, а β3-интегрины (цитоадгезины) — в слипании тромбоцитов с нейтрофилами в очагах воспаления или местах повреждения сосудов. Из этой простой схемы имеется, однако, несколько исключений и, кроме того, описаны дополнительные β-цепи (например, β7). Каждая β-цепь может ассоциировать с одной из различных α-цепей, в результате чего образуются разнообразные молекулы адгезии. Способность интегринов связываться со своими лигандами зависит от двухчленных катионов. Например, LFA-I (α1β2-интегрин) в норме экспрессирован на лейкоцитах в низкоаффинном состоянии, но при повышении концентрации Mg2+ становится высокоаффинным. При повышении концентрации Са2+ интегрины на поверхности клеток перераспределяются, формируя высокоавидные «пятна». Некоторые интегрины, важные для миграции, указаны на рис. 5.7.
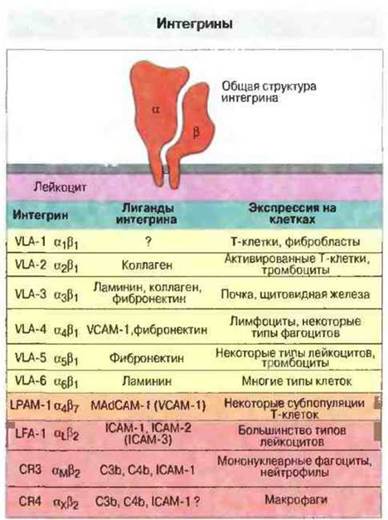
Рис. 5.7. Вверху схематически изображена молекула интегрина, состоящая из двух нековалентно связанных полипептидных цепей. В таблице указаны свойства некоторых интегринов, опосредующих связывание (прилипание) лейкоцитов с сосудистым эндотелием или внеклеточным матриксом.
Селектины - группа лейкоцитарных и эндотелиальных молекул межклеточной адгезии, которые связываются с углеводами
Группа селектинов включает Е-селектин, Р-селектин и L-селектин, экспрессируемые на эндотелии, тромбоцитах и некоторых типах лейкоцитов соответственно (рис. 5.8). Молекулы селектинов пронизывают мембрану и имеют ряд внеклеточных доменов, гомологичных доменам регуляторных белков комплемента, например фактору Н. Внеклеточная часть их молекул содержит также домен, близкий по структуре рецептору для фактора роста эпидермиса (ФРЭ), и N-концевой домен, обладающий лектиноподобными свойствами, т. е. связывающий углеводные остатки (отсюда название «селектины»). Соответственно этому в состав лигандов, с которыми связываются селектины, входят углеводы.
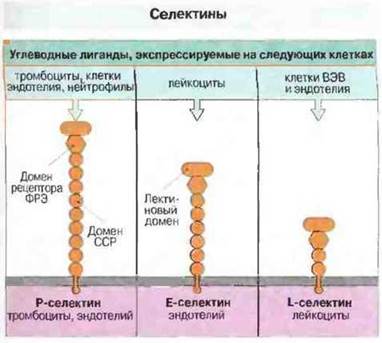
Рис. 5.8. Строение трех селектинов. Концевой пектиновый до мен каждого из них связывается с углеводными лигандами клеток, указанных вверху. Селектины имеют также и другие общие структурные характеристики.
Лиганды селектинов - это углеводные компоненты различных гликопротеинов лимфоцитарной и эндотелиальной поверхности
Углеводные лиганды для селектинов встречаются в структуре разнообразных белков. Так, много численные О-связанные углеводные остатки, которые служат лигандами для лимфоцитарного L-селектина, содержит гликопротеин Sgp-200, экспрессируемый на эндотелии ВЭВ. (Вследствие связывания L-селектина с этими углеводными остатками лимфоциты из кровотока направляются в периферические лимфоузлы.) L-селектины могут также связываться с углеводами в составе MAdCAM I, который экспрессирован на эндотелии ВЭВ лимфоидных образований в слизистых оболочках. Эти гликопротеины, названные в соответствии с их функцией сосудистыми адресатами, присутствуют главным образом на клетках ВЭВ в лимфоидных тканях, но могут быть индуцированы при хроническом воспалении и в других участках организма (рис. 5.9).
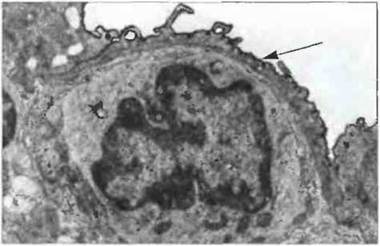
Рис. 5.9. Адрессины слизистых оболочек на поверхности эндотелия. Электронная микрофотография среза мозга при хроническом экспериментальном рецидивирующем аллергическом энцефаломиелите у мышей линии Biozzi АВ/Н, вызванном иммунизацией основным белком миелина. Срез окрашен для выявления MAdCAM-1 (темная кайма, указанная стрелкой), экспрессированного на поверхности эндотелия в просвете мозгового сосуда. (Фото любезно предоставлено д-ром J.K. O'Neill и д-ром С. Butter с разрешения издательства; Immunology, 1991; 72: 520-525.)
Е- и Р-селектины, экспрессируемые на активированных эндотелиоцитах, связываются с сиалированной формой углеводной детерминанты Lex (групповой антиген крови системы Льюис — Lеwis-X), ассоциированной с белком CD15, который присутствует на лейкоцитах многих субпопуляций. В результате этого связывания движение лейкоцитов с током крови прекращается и наступает первая фаза миграции (рис. 5.10).