ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 13. Регуляция иммунного ответа
ГЕНЕТИЧЕСКАЯ РЕГУЛЯЦИЯ ИММУННОГО ОТВЕТА
Хорошо известно, что разные индивиды неодинаково реагируют на один и тот же антиген. Результаты семейного анализа чувствительности к Corynebacterium diphtheriae позволили предположить, что резистентность или чувствительность к инфекции может быть наследуемым признаком. В пользу этого свидетельствуют и данные, полученные на морских свинках разных линий, неодинаково резистентных к дифтерии; различия были определены как генетически детерминированные. В 1943 г. Фьёрд-Шайбель в исследованиях по селекции линий морских свинок с высокой и низкой иммунореактивностью продемонстрировал, что продукцию дифтерийного антитоксина контролирует один ген и она наследуется как доминантный менделевский признак. В этом исследовании впервые был установлен также доминантный тип наследования высокой иммунореактивности. В потомстве первого поколения, полученном от скрещивания животных с высокой иммунореактивностью, 90% особей продуцировали антитоксин, тогда как при скрещивании низкореагирующих свинок лишь в пятом поколении удалось получить 90% животных с низкой иммунореактивностью.
Способность отвечать на антиген зависит от гаплотипа МНС
Получение инбредных, или чистых, линий мышей позволило более глубоко исследовать влияние генетических факторов и окончательно доказать их роль в иммунологической реактивности. Мыши с различными гаплотипами МНС различаются по способности к гуморальному ответу на специфические антигены (рис. 13.16). Эта функция зависит от МНС-молекул класса II и специфична для каждого антигена: линия с высоким уровнем ответа на один антиген может на другие отвечать слабо. Гены МНС, как было установлено, выполняют наиболее важную роль в регуляции ответа на инфекционные агенты (см. гл. 7 и 9).
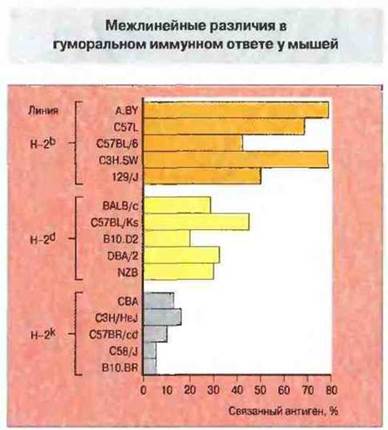
Рис. 13.16. Мышам 15 линий вводили стандартную дозу синтетического антигена (TG)-A-L. Содержание антител в сыворотке определили по ее антигенсвязывающей активности. Животные с гаплотипом Н-2b - высокореагирующие, H-2d - с промежуточным типом ответа, Н-2k — низкореагирующие. Однако у некоторых линий разных гаплотипов уровни ответа сходные, что указывает на регуляцию образования антител и со стороны генов, не сцепленных с комплексом Н-2.
Не сцепленные с МНС гены также влияют на иммунный ответ
Достигнутые в последние годы в иммунологии значительные успехи - выяснение структуры молекул МНС классов I и II, изучение полиморфизма аминокислотных последовательностей молекул МНС и его значения для связывания пептидов, разработка молекулярных методов контроля за формированием репертуара Т-клеточных рецепторов и технологии получения трансгенных мышей - внесли вклад в выяснение того, каким образом генетические факторы влияют на иммунный ответ. К числу этих факторов относятся не только гены, сцепленные с МНС. Например, тяжелый комбинированный иммунодефицит обусловлен отсутствием гена рекомбиназы, а недостаточность адгезии лейкоцитов возникает вследствие мутаций гена, кодирующего субъединицу β2-интегрина, и вызванного ими нарушения экспрессии LFA-1, CR3 и CR4.
Сцепленные с МНС гены иммунного ответа регулируют все иммунные реакции, в основе которых лежит распознавание антигена Т-клетками
Как описано в предыдущих главах, иммунный ответ зависит от активации клонов лимфоцитов. Т-клетки распознают антиген только в том случае, если он презентирован им в виде комплекса антигенного пептида с антигенами МНС классов I или II. Поэтому, например, мышиные Тц-клетки CD8+, специфичные к гликопротеину ВЛХМ, способны лизировать лишь такие инфицированные вирусом клетки-мишени, которые получены от мышей, совместимых но МНС-антигенам класса I с донорами клеток-эффекторов (рис. 13.17). Способность к такому распознаванию развивается в онтогенезе (рис. 13.18).
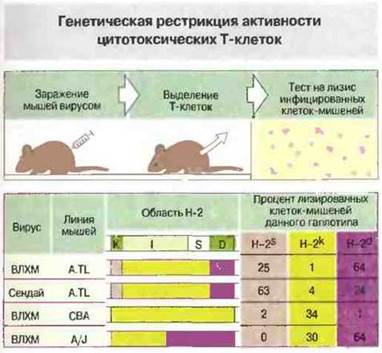
Рис. 13.17. Изучена способность цитотоксических (Тц) клеток взрослых мышей (линий A.TL, СВА и A/J), зараженных вирусом лимфоцитарного хориоменингита (ВЛХМ), лизировать инфицированные вирусом клетки-мишени гаплотипов H-2k, H-2S и H-2d. Мыши линии A.TL имеют гаплотип H-2Ks, H-2lk, H-2Dd и их Тц-клетки лизируют лишь те инфицированные ВЛХМ клетки-мишени, которые имеют общий с эффекторами гаплотип H-2Ks или H-2Dd. Это показывает, что противовирусные Тц-клетки рестриктированы по антигенам МНС класса I, причем цитотоксичность в отношении ВЛХМ детерминирована в основном локусом H-2D. В отличие от этого у мышей линии A.TL, инфицированных вирусом Сендай, цитотоксичность определяется главным образом локусом Н-2k. О значении генетической рестрикции при этих ответах говорят также результаты экспериментов на мышах линии СВА, инфицированных ВЛХМ. То, что наиболее выраженная цитотоксичность в отношении ВЛХМ определяется совместимостью клеток-эффекторов и клеток-мишеней по локусу H-2d, подтверждают данные исследований на мышах линии A/J. Различные вирусы могут связываться преимущественно с определенными Н-2k- или Н-2d-молекулами клеток-мишеней, что создает оптимальные условия для их презентации цитотоксическим клеткам.
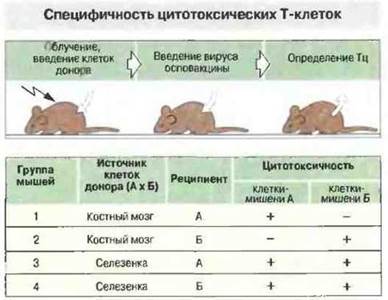
Рис. 13.18. Облученным мышам-реципиентам двух типов (А и Б) вводили для восстановления кроветворения лимфоциты доноров А х Б (клетки костного мозга или селезенки). Таким способом получали мышей-химер, у которых лимфоциты имели тип донора (А х Б), а все другие ткани - тип реципиента. После этого животных иммунизировали вирусом осповакцины, получали от них Т-клетки селезенки и определяли их цитотоксическую активность по отношению к В-клеткзм типа А или Б, инфицированным вирусом. Клетки мышей, получивших после облучения клетки костного мозга, могли лизировать только клетки-мишени, относящиеся к тому же типу, что и реципиент (1 и 2). В отличие от этого зрелые лимфоциты животных, получивших клетки селезенки (А х Б), были способны лизировать клетки-мишени обоих типов - А и Б, независимо от типа реципиента (3 и 4). Полученные данные можно объяснить следующим образом. Незрелые стволовые клетки костного мозга после введения облученным мышам проходили «обучение» в тимусе реципиента и после этого могли распознавать антиген лишь в ассоциации с молекулами МНС гаплотипа реципиента. Однако зрелые клетки селезенки донора уже были «обученными». В большинстве случаев для успешного «обучения» клеток донора в тимусе реципиента необходимо, чтобы донор и реципиент имели по крайней мере один общий МНС-гаплотип с идентичными генами класса II.
Формирование репертуара периферических Т-лимфоцитов зависит как от разнообразных аутоантигенов, так и от способности Т-клеток связываться с собственными антигенами МНС. Способность пептида к образованию комплекса с молекулой МНС определяется последовательностью аминокислотных остатков ее пептидсвязывающего участка. Теперь мы знаем, что большая часть полиморфных аминокислотных остатков молекулы МНС локализована в ее пептидсвязывающей полости. Поэтому высокий полиморфизм аминокислотных последовательностей МНС-антигенов очень важен для связывания пептидов и вследствие этого для активации Т-клеток. Как установлено, при развитии в тимусе Т клетки подвергаются селекции двух типов.
✵ Положительная селекция основана на взаимодействии ТкР с молекулами МНС на поверхности эпителиальных клеток корковой зоны тимуса.
✵ Отрицательная селекция происходит в результате высокоаффинного взаимодействия между ТкР и комплексом МНС—пептид, презентированным на клетках костномозгового происхождения в мозговой зоне тимуса.
Положительная селекция в тимусе означает отбор Т-клеток по способности распознавать антигены, презентированные в комплексе с собственными молекулами МНС
Первые исследования в этой области проводились по сложной схеме, включавшей тимэктомию, облучение, введение костного мозга и пересадку тимуса (см. гл. 12). Их результаты показали, что цитотоксические лимфоциты лизируют только клетки-мишени с такими же МНС-антигенами, какие экспрессируют клетки тимуса, в котором происходило развитие Т-клеток. Эти и другие данные позволяют предполагать, что созревающие Т-клетки «учатся» распознавать антигены только в контексте молекул МНС, с которыми они первоначально контактировали в тимусе.
Этот процесс прояснили эксперименты на трансгенных мышах, когда стало возможным получать таких трансгенных животных, у которых основная часть Т-клеток несет всего один анти- генспецифичный рецептор. Соответствующий антиген также может экспрессироваться как продукт трансгена. Это значительно упрощает анализ, поскольку исследуемые Т-клетки составляют большую часть Т-клеточной популяции и их можно определить при помощи клонотипических, или Vβ-специфичных, антител (Vβ является вариабельным доменом ТкР-комплекса). Так, можно получить трансгенных мышей, у которых Т-клетки в основном экспрессируют ТкР клона Тц CD8+, распознающий гликопротеин ВЛХМ в комплексе с молекулой H-2Db класса I, и использовать этих животных для демонстрации положительной селекции. Данный ТкР идентифицируют при помощи антител, специфичных к Vβ8.
Различные молекулы МНС по-разному влияют на образование зрелых Т-клеток CD8+, экспрессирующих трансгенный ТкР (рис. 13.19). Положительная селекция Т-клеток CD8+с трансгенным ТкР, содержащим Vβ8-цепь, была зарегистрирована лишь у тех мышей, которые экспрессировали молекулу H-2Db. Таким образом, положительная селекция данного рецептора происходит только при экспрессии соответствующего МНС-гаплотипа. Подобный отбор протекает на поверхности эпителиальных клеток корковой зоны тимуса. Предполагается, что пептидами, опосредующими положительную селекцию, служат в норме присутствующие в тимусе аутопептиды.
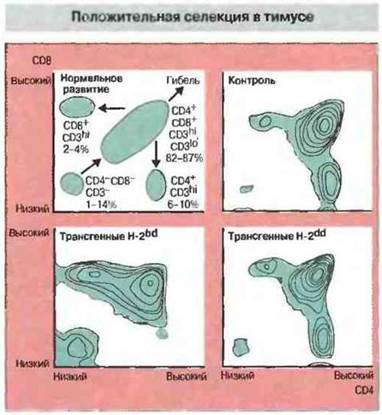
Рис. 13.19. Тимоциты получали от трансгенных мышей, Т-клетки CD8+которых несли ТкР, распознающий ВЛХМ в ассоциации с молекулой Н-2b. При помощи флуоресцентного клеточного сортера изучали экспрессию молекул CD4 и CD8 тимоцитами. При нормальном развитии клетки CD4-CD8-становились CD4+CD8+, а затем превращались в зрелые CD4+CD8-или CD4-CD8+либо погибали. В контроле (нетрансгенные мыши) основную популяцию тимоцитов составляли клетки CD4+CD8+и меньшие популяции - CD4+CD8-и CD4-CD8+. У трансгенных мышей, экспрессирующих аллель Н-2b, происходила положительная селекция Т-клеток в тимусе, в результате чего формировалась гораздо более многочисленная популяция CD4-CD8+. Такая селекция не происходила в отсутствие аллеля Н-2b. (Обозначения «высокий», «низкий», hl иlo относятся к уровню экспрессии маркеров CD.)
Т-клетки, распознающие аутоантигены, подвергаются отрицательной селекции
Отрицательная селекция путем клональной делеции продемонстрирована с использованием моноклональных антител, специфичных к Vβ-цепям мышиных ТкР. Таким способом были идентифицированы и подсчитаны Т-клетки, несущие ТкР с данной Vβ-цепью, и этот анализ показал, что у мышей, экспрессирующих I—Е, Т-клетки Vβ17a+ делетируются в тимусе. Присутствие Т-клеток Vβ17a+CD4+CD8+, но не зрелых Т-клеток Vβ17a+CD4+или Vβ17a+CD8.1+, позволило предположить, что делеция происходит на стадии дважды положительных (CD4+CD8+) Т-клеток в процессе их созревания. При этом было установлено, что для делении необходима экспрессия наряду с I—Е и эндогенного лиганда, а не только одного I—Е.
Суперантигены могут вызывать полную делецию отдельных серий Т-клеточных рецепторов
У мышей ряда линий в тимусе происходит делеция целых популяций Т клеток, несущих определенные ТкР. Так, у мышей, экспрессирующих минорный, стимулирующий лимфоциты антиген МIs-1а и некоторые МНС-молекулы класса II, делетируются Т-клетки Vβ6+и Vβ8.1+ (рис. 13.20). Способностью целых семейств Т-лимфоцитов распознавать антигены MIs объясняется интенсивный пролиферативный ответ, наблюдаемый при совместном культивировании несовместимых по MIs клеток. В ответе на некоторые антигены участвуют все Т-клетки, экспрессирующие определенные Vβ-цепи (рис. 13.21).
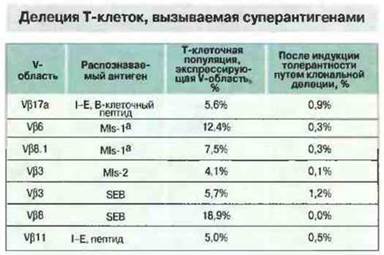
Рис. 13.20. Суперантигены могут вызывать клональную делецию Т-клеток, экспрессирующих определенные Vβ-цепи. Абсолютное число Т-клеток, ТкР которых содержит ту или иную Vβ-цепь, неодинаково у мышей разных линий, однако феномен Т-клеточной делеции под влиянием суперантигенов проявляется во всех случаях. В таблице приведена количественная характеристика клональной делеции у мышей некоторых линий. (SEB - стафилококковый энтеротоксин В.)
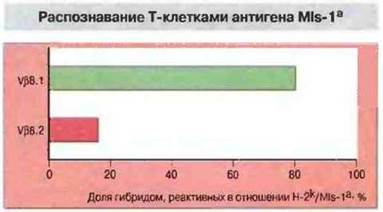
Рис. 13.21. Значительная часть Т-клеток, экспрессирующих цепь Vβ8.1, распознает антиген MIs-1a. Путем слияния Т-лимфобластов (экспрессирующих Vβ8.1 или Vβ8.2), выделенных из лимфатических узлов мышей линии B10.BR (МIа-1b), с вариантом Т-клеточной тимомы BW5147 (не экспрессирующей ни Vα, ни Vβ) были получены Т-клеточные гибридомы. Клетки-гибриды отделяли при помощи скрининга с использованием антител, распознающих Vβ8.1 и (для сравнения) Vβ8.2, затем исследовали реактивность гибридом в отношении антигенов MIs-1а на поверхности клеток-стимуляторов Н-2k. Подавляющее большинство гибридом, реагирующих на антиген MIs-1a, экспрессировало Vβ8.1 и незначительное - Vβ8.2. Эти результаты показывают, что в распознавании антигена MIs-1а главную роль играет цепь Vβ8.1.
Вызывающие такой сильный ответ антигены, как экзогенные, так и эндогенные, названы суперантигенами. Они связываются не в пептидсвязывающей полости антигенов МНС, а непосредственно (без процессинга) с молекулами МНС класса I и II и β-цепями ТкР (см. гл. II). Примером экзогенного суперантигена может служить стафилококковый энтеротоксин В. Реагирующие на этот антиген Т-клетки мышей имеют ТкР, содержащий Vβ3- или Vβ8-аепи. MIs-антигены относятся к классу эндогенных суперантигенов (см. гл. II). Однако к настоящему времени установлено, что наличие MIs-антигенов в действительности определяется присутствием эндогенных вирусов опухоли молочной железы мыши (MMTV), кодируемых длинным 3'-тeрминальным повтором в геноме мышей данной линии. Существует множество различных MMTV, и мыши каждой линии имеют в геноме лишь некоторые из них. Эти эндогенные суперантигены, экспрессированные в тимусе, вызывают делецию (отрицательную селекцию) Т-клеток, несущих ТкР с цепью Vβ3, Vβ6 или Vβ8.1. Для изучения того, каким образом селекция в тимусе на ранних стадиях развития организма может повлиять на способность взрослого животного формировать ответ, были использованы также трансгенные мыши, описанные в предыдущем разделе (с трансгенами, кодирующими α- и β-цепи ТкР, специфичных к гликопротеину ВЛХМ в контексте H-2Db). При инфицировании ВЛХМ в неонатальный период у мышей развивалась толерантность и они становились носителями вируса. Анализ созревающих Т-клеточных популяций у этих неонатально инфицированных мышей показал значительное снижение числа Т-клеток CD4+CD8+— возможное последствие клональной делении Т-клеток на ранней стадии онтогенеза (рис. 13.22). Таким образом, формирование репертуара периферических Т-лимфоцитов происходит в результате как положительной, так и отрицательной селекции (рис. 13.23), и соответственно оба эти типа отбора влияют на иммунореактивность.
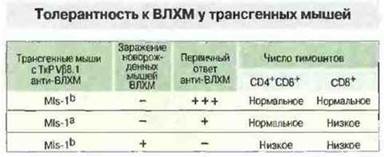
Рис. 13.22. Индукция толерантности у трансгенных мышей варьирует в зависимости от антигена. В приведенном опыте исследовали способность клеток трансгенных мышей, экспрессирующих ТкР, специфичный к ВЛХМ в контексте молекул H-2Db, давать пролиферативный и цитотоксический ответ при взаимодействии с инфицированными ВЛХМ клетками. Данный ТкР экспрессирует также Vβ8.1, что позволяет определить влияние MIs-1a на способность к подобного рода первичному ответу на ВЛХМ. Инфицирование мышей ВЛХМ при рождении дает возможность установить эффект неонатального контакта с антигеном, распознаваемым трансгенным ТкР. У животных, экспрессирующих MIs-1а, наблюдалось частичное снижение пролиферативного и цитотоксического ответа, а в случае контакта со специфическим антигеном при рождении ответ полностью отсутствовал. Анализ Т-клеточных популяций этих животных показал, что толерантные к ВЛХМ мыши имели пониженное число тимоцитов CD4+CD8+ и зрелых Т-клеток CD8+. Однако воздействие только собственного суперантигена (MIs-1a) приводило к делении лишь зрелых Т-клеток CD8+. Представленные данные свидетельствуют о том, что различные антигены могут индуцировать толерантность Т-клеток в разные периоды их развития.
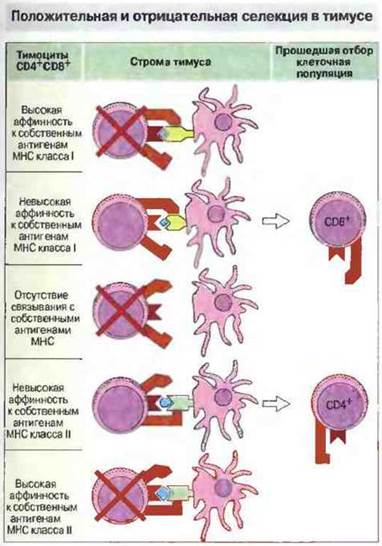
Рис. 13.23. Тимоциты CD4+CD8+взаимодействуют со стромальными клетками тимуса, экспрессирующими МНС-молекулы классов I и II в виде комплексов с собственными пептидами. Клетки, обладающие высокой аффинностью к собственным антигенам МНС классов I или II, делегируются, так же как и тимоциты, которые не распознают эти антигены. Клетки с невысокой аффинностью к собственным МНС-антигенам класса I проходят отбор (положительная селекция), утрачивают маркер CD4 и становятся T-клетками CD8+. 8 отличие от этого тимоциты с невысокой аффинностью к собственным МНС-антигенам класса II образуют популяцию зрелых Т-лимфоцитов CD4+.
Сцепленные с МНС гены регулируют ответ на инфекционные агенты
Определенную роль в развитии ответа на инфекционные агенты, а также на аутоантигены выполняют, как установлено, гены, сцепленные с МНС. В некоторых случаях эту функцию несут гены, входящие в МНС.
Чувствительность мышей к инвазии Trichinella spiralis определяется локусом I-Е
Первое наблюдение, свидетельствующее о том, что гены, сцепленные с МНС (Ts-1 и Ts-2), могут влиять на иммунный ответ против паразитарной инвазии, было сделано на модели трихинеллеза, вызываемого Trichinella spiralis. (Следует отметить, что это организм со сложным антигенным составом, причем на разных стадиях жизненного цикла он экспрессирует различные антигены, презентация которых требует участия разных АПК.) При заражении Trichinella spiralis мышей ряда рекомбинантных линий обнаружено, что резистентность или восприимчивость животных зависит от локуса I-Е: мыши, экспрессирующие I-Е, восприимчивы к инвазии (рис. 13.24). На ответ влияет также один сцепленный с МНС ген. Он нe входит в состав МНС, а находится в неравновесии по сцеплению с МНС. Этот ген, названный Ts-2, картирован вблизи гена ФНО.
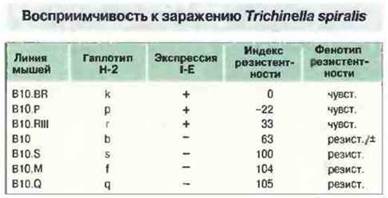
Рис. 13.24. Ассоциация H-2-гаплотипа и экспрессии молекул I-Е на клеточной поверхности с восприимчивостью к заражению Trichinella spiralis. Индекс резистентности рассчитывали, как отношение числа паразитов, присутствующих после заражения стандартной дозой, к соответствующему показателю у мышей линии B10.BR [чувствительные (чувст.) = 0% резистентность] и B10.S [резистентные (резист.) = 100% резистентность]. Мыши линии В10 имеют промежуточную резистентность.
Локус I-Е влияет также на чувствительность к Leishmania donovani
Субрайон I-Е влияет также на чувствительность мышей к Leishmania donovani. В исследованиях па мышах, конгенных по комплексу Н-2, установлено, что экспрессирующие I-Е мыши не обладают резистентностью к висцеральной форме лейшманиоза. Прямое участие продукта I-Е в определении чувствительности к данной инвазии обнаружено по действию антител анти-I-Е (но не анти-I-A), которые усиливали элиминацию паразитов из организма. Кроме того, перенос трансгена I-Е мышам, лишенным этого локуса, делал животных неспособными уничтожать лейшманий, локализующихся в печени и селезенке, как это происходит у мышей исходной линии.
Некоторые HLA-гаплотипы обеспечивают защиту против Plasmodium falciparum
Изучение ассоциации HLA-гаплотипов с тяжелой формой анемии у больных малярией, показало, что распространенный среди населения Западной Африки и редко встречающийся в других расовых группах гаплотип DRB1*1302-DQB1*0501 обеспечивает защиту от летального исхода при малярии, вызываемой Plasmodium falciparum. Установлено, что молекулы DRB1*1302 и DRB1*1301, различающиеся одним аминокислотным остатком в β-цепи, связывают разные пептиды и это различие, очевидно, влияет на иммунный ответ против этого возбудителя малярии.
Сцепленные с МНС гены существенно влияют на чувствительность к аутоиммунным заболеваниям
Ассоциации с МНС-генами. Инсулин-зависимый сахарный диабет (ИЗСД) — аутоиммунное заболевание, при котором β-клетки поджелудочной железы разрушаются клетками иммунной системы, — ассоциирован с антигенами HLA-DR3 и HLA-DR4. Наибольший риск развития заболевания существует в случае гетерозиготности HLA-DR3/DR4. В действительности ИЗСД ассоциирован с генами DQ, хотя вследствие неравновесия по сцеплению первоначально была описана ассоциация с DR. С помощью молекулярно-генетических методов эту ассоциацию удалось изучить более детально, и оказалось, что у европеоидов заболевание первично ассоциировано с геном DQB1*0302. Ревматоидный артрит в разных этнических группах ассоциирован главным образом с HLA-DR4 или HLA-DR1 и лишь в небольшом числе случаев с HLA-DQ. Механизмы, лежащие в основе повышенной чувствительности к указанным заболеваниям, пока неясны. Одной из возможных причин ее связи с гаплотипом может быть различие в репертуарах генов класса II, возникающее как результат положительной и отрицательной селекции. Не исключено также, что вызывающие иммунный ответ эпитопы на поверхности бактерий или вирусов связываются преимущественно с теми или иными молекулами МНС. Подтверждением этой гипотезы могут служить данные, полученные при анализе аминокислотных последовательностей, образующих пептидсвязывающие полости молекул HLA-DR4 и HLA-DR1: ассоциированные с чувствительностью или резистентностью субтипы HLA-DR содержат различно заряженные аминокислотные остатки.
Ассоциации с МНС-областью. Другим примером неравновесия по сцеплению служит ассоциация аутоиммунного процесса у мышей (NZB x NZW)F1 с гаплотипом H-2Z родительской линии NZW. Четко установлено, что заболевание ассоциировано не с самими МНС-генами, а с геном ФНОα, тесно сцепленным с МНС. Аллель ФНОα у мышей линии NZW детерминирует низкий уровень продукции ФНОα. Если концентрация цитокина возрастает, животные приобретают устойчивость к волчаночному нефриту (рис. 13.25).
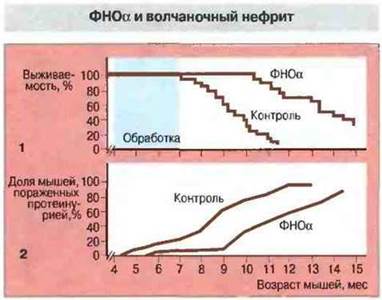
Рис. 13.25.
1. Мышей-самок (NZW х NZB) F1 опытной группы (n = 20) обрабатывали рекомбинантным мышиным ФНОα. Контрольную группу составляли мыши F1 того же возраста и пола. Сравнивали выживаемость мышей в опыте и контроле.
2. Кумулятивная частота возникновения тяжелой протеинурии (≥300 мг/100 мл) у мышей (NZW х NZB)F1. обработанных ФНОα, и у контрольных животных.
Ассоциации с генами, регулирующими процессинг антигенов. Недавно были идентифицированы и другие сцепленные с МНС гены, способные влиять на иммунный ответ. Эти гены имеют отношение к протеолитическому расщеплению антигенов с образованием антигенных фрагментов и к их транспорту. Данные гены отличаются полиморфизмом, имеющим функциональное значение. Так, например, у крысы различные аллельные формы локуса cim (кодирующего белок ТАР2) определяют эффективность образования комплексов молекул МНС класса I с пептидами, а она в свою очередь влияет на возможность распознавания МНС-молекул этого класса как аллоантигенов. Таким образом, возможно, что установленные ассоциации некоторых заболеваний с МНС обусловлены генами подобного типа, регулирующими протеолиз антигенов и транспорт антигенных пептидов к молекулам МНС, которые презентируют их клеткам иммунной системы.
Многие не-МНС-гены также модулируют иммунные ответы
Иммунный ответ регулируют также некоторые гены, расположенные вне области МНС. Однако в целом эти гены отличаются меньшим полиморфизмом по сравнению с МНС, в связи с чем их вклад в определение чувствительности к заболеваниям не столь велик, как генов МНС. Тем не менее не-МНС-гены могут играть определенную роль при аутоиммунных болезнях, аллергии и инфекциях (рис. 13.26). Об этом свидетельствуют следующие факты.
✵ Лица, имеющие дефекты компонента комплемента С3, обнаруживают повышенную чувствительность к бактериальным инфекциям и предрасположенность к болезни иммунных комплексов.
✵ В некоторых семьях с предрасположенностью к аллергии обнаружен высокий уровень продукции IgE, ассоциированный с «геном атопии», который локализован в хромосоме IIq.
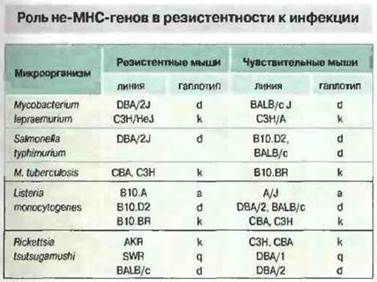
Рис 13.26. Разные линии мышей различаются по устойчивости к указанным микроорганизмам. Линии, имеющие один и тот же МНС-гаплотип, могут быть чувствительными или резистентными. Это показывает что МНС-гаплотип не играет решающей роли в устойчивости к инфекции.
Гены, не сцепленные с МНС, влияют на чувствительность к инфекциям
Макрофаги играют ключевую роль в иммунной системе. Поэтому гены, регулирующие их активность, могут определять результат многих иммунных реакций. Примером генетической регуляции функций макрофагов могут служить эффекты гена Lsh/Ity/Bcg. Этот ген регулирует ранний ответ на инфицирование Leishmania donovani, Salmonella typhimurium, Mycobacterium bovis, M. lepraemurium и M. intracellutare. Он влияет на раннюю фазу примирования и активации макрофагов, и с ним связан целый ряд эффектов, включая следующие:
✵ усиление клеточного дыхания,
✵ повышение противоопухолевой активности,
✵ усиление антимикробной активности и
✵ повышение экспрессии МНС-антигенов класса II.
Недавно проведенные исследования позволили идентифицировать ген Nramp, потенциально способный функционировать в качестве гена Beg у мыши. Поскольку Nramp кодирует мембранный белок, гомологичный известным транспортным белкам, было высказано предположение, что его экспрессия может влиять на транспорт NO2- в фаголизосомы и тем самым на уничтожение внутриклеточных микроорганизмов. Однако пока экспериментально не доказано (с помощью трансфекции или трансгенсза), что этот ген кодирует продукт Bсg, данное предположение остается чисто гипотетическим.
Путем направленного отбора получены две линии мышей Biozzi (названы по имени получившего их исследователя), различающиеся уровнем реактивности после иммунизации чужеродными эритроцитами (высоко- и низкоотвечающие животные). Одним из факторов, определяющих неодинаковую способность мышей этих линий отвечать на эритроцитарные антигены, служат генетически детерминированные различия в активности макрофагов. Иммунные реакции на паразитарные инвазии у мышей высоко- и низкоотвечаюших линий также существенно различаются, и эти различия не обязательно коррелируют с количеством продуцируемых антител к эритроцитам барана (рис. 13.27).
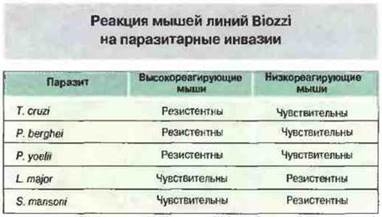
Рис. 13.27. Чувствительность мышей линий Biozzi к паразитарным инвазиям неодинакова и не коррелирует с их принадлежностью к высоко- или низкореагирующей линии.
Эозинофилы играют важную роль в реакции организма на паразитарные инвазии. Установлено, что степень эозинофилии, развивающейся при инвазии, генетически детерминирована, и у мышей разных линий этот показатель значительно варьирует. Подобное же явление наблюдается у морской свинки и овиы: найдена выраженная корреляция между резистентностью к инвазии, вызываемой нематодами, и интенсивностью эозинофилии.
Не сцепленные с МНС гены влияют на развитие аутоиммунных заболеваний
Крупным успехом в изучении генетических основ аутоиммунной патологии стало проведенное недавно картирование локусов, регулирующих предрасположенность к инсулин-зависимому сахарному диабету (ИЗСД). Работа была проведена в основном на мышах линии NOD, у которых спонтанно развивается аутоиммунное заболевание, сходное с ИЗСД человека. У этих мышей картированы по меньшей мере 15 генетических локусов (Idd-1-15), и только один из них Idd-1) оказался сцепленным с МНС в хромосоме 17. Предполагается, что этот ген непосредственно кодирует молекулы МНС класса II. Другие гены картированы в разных хромосомах, однако их природа и роль в резистентности или предрасположенности к заболеванию пока неизвестны.
У мышей, несущих встроенный ген lpr, возникает лимфопролиферативное заболевание с характерными клиническими признаками. Животные продуцируют антитела против ДНК и ревматоидный фактор; у них образуются циркулирующие иммунные комплексы и развивается гломерулонeфрит. Наблюдается также лимфаденопатия с экспансией Т-клеток CD4-CD8-на периферии. Эти Т-клетки нe являются моноклональными, но имеют различную структуру ТкР. Первоначально для объяснения причин этого синдрома было высказано предположение о дефекте отрицательной селекции, однако трудно было представить, каким образом ген, подобный lpr, может опосредовать такой эффект. Позднее выяснилось, что у мышей, несущих ген lpr, имеется дефект молекулы CD95, или Fas, ген которой расположен в хромосоме 19. Fas представляет собой трансмeмбранную молекулу, принадлежащую к суперсeмeйству рецепторов ФНО; взаимодействуя со своим лигандом CD95L, или FasL, она индуцирует запрограммированную клеточную гибель — апоптоз. Молекула CD95L входит в семейство факторов некроза опухолей и роста нервов. Дефект Fas-антигена, возникающий вследствие мутации lpr, приводит к отсутствию апоптоза. Однако этот дефект, по-видимому, не затрагивает процесс отрицательной селекции и формирование нормального репертуара зрелых моноположительных Т-клеток в тимусе. Очевидно, Fas служит лишь одним из лигандов, опосредующих апоптоз. В настоящее время предполагается, что этот дефект ведет к экспансии дважды отрицательных Т-клеток на периферии и ускорению аутоиммунного синдрома. Нарушение апоптоза происходит также у В-клеток, приводя к накоплению периферических аутореактивных В-лимфоцитов.
В других исследованиях было установлено, что ген gld, присутствие которого обусловливает возникновение аутоиммунного заболевания, сходного с наблюдаемым у мышей lpr/lpr, кодирует дефектный FasL. Таким образом, у мышей gld/gld, т. е. не экспрессирующих функциональный лиганд, также наблюдается недостаточность апоптоза периферических В- и Т-клеток и развитие аутоиммунитета. Ген gld локализован у мыши в хромосоме 1 и, таким образом, служит примером гена, влияющего на иммунную функцию, но нe сцепленного с МНС. Синдромы, сходные с описанными выше, встречаются у человека; они также связаны с дефектами активности и функции Fas.
Вопросы для размышления
■ Эндогенные ретровирусные последовательности модифицируют экспрессированный Т-клеточный репертуар у мыши. Каково биологическое значение такой модификации?
■ Зачем в иммунной системе сохраняется столь большое число разнообразных механизмов регуляции иммунного ответа?
■ Примеры регуляции, описанные в этой главе, получены в исследованиях на искусственно созданных модельных системах. Возможно ли установить, какова вероятность их действия уздоровых людей?
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Aichele Р., Kyburz D., Ohashi P S. et al. 1994. Peptide-induced T-cell tolerance to prevent autoimmune diabetes in a transgenic mouse model. Proc. Natl. Acad. Sci. USA 91: 444-48
Blalock J.E., Bost K.L., (ed). 1994 Shared ligands and receptors as a molecular mechanism for communication between immune and neuroeridrocrine systems. Ann. NY Acad. Sci. 741: 292-98.
Eisenberg R.A., Sobel E.S., Reap E.A. et al. 1994. The role of В cell abnormalities in the systemic autoimmune syndromes of Ipr and gld mice. Semin. Immunol. 6: 49-54
Gaulton G.N., Greene M.l. 1986. Idiotypic mimicry of biological receptors. Annu. Rev. Immunol. 4: 253-80.
GoodnowC.C., Adelstein S., Basten A. 1990. The need for central and peripheral tolerance in the В cell repertoire. Science 248: 1373-79.
Herman A., Kappler J.W., Marrack P. et al. 1991. Superantigens: mechanisms of T cell stimulation and role in immune responses. Annu. Rev. Immunol. 9: 745-72.
Holt P.G. 1994. Immunoprophylaxis of atopy: light at the end of the funnel? Immunol. Today 15: 484-89.
Jeme N.J. 1974. Towards a network theory of the immune system. Ann. Immunol. (Paris) 125c. 373-89.
Mason D., MacPhee I., Antoni F. 1990. The role of the neuroendocrine system in determining genetic susceptibility to experimental allergic encephalomyelitis in the rat. Immunology 70: 1-5.
Metzler B., Wraith D.C. 1993. Inhibition of experimental autoimmune encephalomyelitis by inhalation but not oral administration of the encephalitogenic peptide: influence of MHC binding affinity. Int. Immunol. 5: 1159-65.
Nagata S., Suda T. 1995. Fas and Fas ligand: Ipr and gld mutations. Immunol Today 16: 39-43.
Nossal G.J.V. 1994. Negative selection of lymphocytes. Cell 76: 229-39.
Powell D., Mason D. 1993. Evidence that the T cell repertoire of normal rats contains cells with the potential to cause diabetes. Characterization of the CD4+ T cell subset that inhibits this autoimmune potential. J. Exp. Med. 177: 627-36.
Powrie F., Leach M.W., Mauze S. etal. 1994. Inhibition of Th1 responses prevents inflammatory bowel disease in scid mice reconstituted with CD45Rbhi CD4+ T cells. Immunity 1: 553-62.
Reiner S.L., Locksley R.M. 1995. The regulation of immunity to Leishmania major. Annu. Rev. Immunol. 13: 151-77.
Ridge J.P., Fuchs E.J., Matzinger P. 1996. Neonataltol-erance revisited: turning on newborn T cells with dendritic cells. Science 271: 1723-26.
Rozzo S.J., Eisenberg R.A., Cohen P.L. et al. 1994. Development of the T cell receptor repertoire in Ipr mice. Semin. Immunol. 6: 19-26.
Sarzotti M,. Robbins D.S., Hoffman P.M. 1996. Induction of protective CTL responses in newborn mice by a murine retrovirus. Science 271: 1726-28.
Schwartz R.H. 1990. A cell culture method for T cell clonal anergy. Science 248: 1349-56.
Stein K.E., Soderstrom T. 1984. Neonatal administration of idiotype or antiidiotype primes for protection against Escherichia coli K13 infection in mice. J. Exp. Med. 160: 1001-1011.
Vidal S.M., Malo D.M., Vogan К. et al. 1993. Natural resistance to infection with intracellular parasites: isolation of a candidate for Beg. Cell. 73: 469-85.
Von Boehmer H. 1994. Positive selection of lymphocytes. Cell 76: 219-28.
Wicker L.S., Todd J.A., Peterson L.B. 1995. Genetic control of autoimmune diabetes in the NOD mouse. Annu. Rev. Immunol. 13: 179-200.
Wilder R.L. 1995. Neuroendocririe-immurie system interactions and autoimmunity. Annu. Rev. Immunol. 13:307-38.
Zinkermagel R.M., Pircher H.P., Ohashi P. etal. 1991. T and В cell tolerance and responses to viral antigens in transgenic mice: implications for the pathogenesis of autoimmune versus immunopathological disease. Immunol. Rev. 122: 133-71.