ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 17. Иммунитет к бактериальным и грибковым инфекциям
ИММУНИТЕТ К ГРИБАМ
Четыре типа микозов
О тонких механизмах иммунитета к грибковым заболеваниям известно очень немногое, но предполагается, что они в основном подобны механизмам устойчивости к бактериальным инфекциям. Микозы человека можно разделить на четыре основных типа.
✵ Поверхностные микозы; их вызывают грибы-дерматофиты, как правило поражающие только отмершие кератинизированные компоненты эпидермиса кожи, волосы и ногти.
✵ Подкожные микозы; это, например, хромомикоз, споротрихоз и мицетома, при которых в подкожной клетчатке образуются хронически воспаленные изъязвляющиеся узелки. Эти заболевания вызывают грибы-сапрофиты, проникающие в организм через травмированную кожу.
✵ Респираторные микозы; примеры — гистоплазмоз и кокцидиомикоз, скрытно или остро протекающие, очаговые (изредка диссеминированные) поражения легких, часто с образованием специфических гранулем.
✵ Кандидоз — поверхностное (редко системное) поражение кожи и слизистых оболочек, вызываемое обычным компонентом микрофлоры человека, грибом-комменсалом Candida albicans.
Основу устойчивости к микотической инфекции составляет, по-видимому, клеточный иммунитет
Кожные грибковые инфекции обычно протекают как самоограничивающиеся, оставляя некоторую весьма ограниченную устойчивость к повторному заражению. Основой этой устойчивости скорее всего служит клеточный иммунитет, судя по тому, что у выздоровевших пробы на гиперчувствительность замедленного (IV) типа с грибными антигенами дают положительный результат, тогда как у больных с хроническими поражениями, как правило, отрицательный. Т-клеточный иммунитет важен как защитный механизм и при глубоких микозах — иногда устойчивость к ним удается перенести иммунными Т-клетками. Предположительно Тх-клетки выделяют цитокины, мобилизующие макрофаги на уничтожение грибов (рис. 17.18). При респираторных микозах клинические проявления до некоторой степени напоминают наблюдаемые при проказе (см. гл. 26). Нарушение иммунофизиологии под действием иммунодепрессивных лекарственных средств или подавление антибиотиками нормальной микрофлоры могут стать причиной поражения организма грибами рода Candida. Кандидоз часто развивается также при синдромах иммунологической недостаточности (тяжелый комбинированный иммунодефицит, аплазия тимуса, СПИД и т. п.), что свидетельствует о важном значении иммунной системы для удержания грибов в нормальном статусе комменсалов.
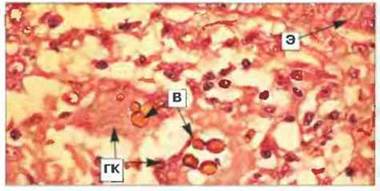
Рис. 17.18. Проявления Т-клеточного иммунитета при хромомикозе (подкожный микоз). Пигментированные клетки возбудителя хромомикоза (В) располагаются в коже больного внутри гигантских клеток (ГК). Вокруг виден лейкоцитарный инфильтрат, состоящий преимущественно из мононуклеаров. Вверху заметен участок базального слоя эпидермиса (Э). Окрашивание гематоксилином и эозином, х 400. (Микрофотография любезно предоставлена проф. R.J. Нау.)
Кроме того, имеются доказательства участия полиморфноядерных нейтрофилов в иммунном ответе при респираторных микозах, например вызванных мукоровыми грибами (рис. 17.19). Важная роль в устойчивости к грибам принадлежит, возможно, катионным белкам дефензинам: фагоциты больных с нарушенными механизмами восстановления О2 способны тем не менее уничтожать дрожжевые клетки и мицелий грибов почти так же эффективно, как в норме (рис. 17.20). Против Criptococcus активно действует NO-механизм, и не исключено, что он важен для устойчивости ко многим грибам.
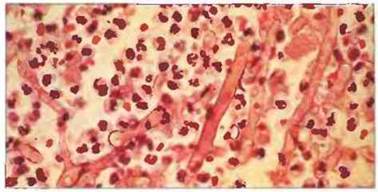
Рис. 17.19. Нейтрофилы в качестве эффекторных клеток иммунного ответа при микозе, вызванном мукоровым грибом. Представлен срез из легочной ткани больного этим типом микоза; в данном случае это оппортунистическая инфекция, возникшая при нарушении иммунитета. Воспалительный инфильтрат вокруг грибных гиф состоит почти исключительно из полиморфноядерных нейтрофилов. Это заболевание особенно часто возникает при нейтропении (отсутствии нейтрофилов). Окрашивание гематоксилином и эозином, х 400. (Микрофотография любезно предоставлена проф. R.J. Нау.)
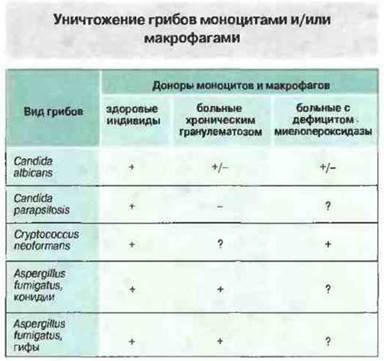
Рис. 17.20. В норме моноциты и макрофаги способны уничтожать многие грибы. В отношении определенных видов грибов эта способность сохраняется при хроническом гранулематозе и наследственном дефиците миелопероксидазы, что свидетельствует о важном значении кислород-независимых защитных механизмов. («+» — уничтожение; «-» — не уничтожают; «+/-» — иногда уничтожают; «?» — нет данных.)
Вопросы для размышления
■ Какими бактерицидными механизмами обладают фагоциты?
■ Как связана перегрузка иммунной системы антигенами кишечной микрофлоры с патогенезом аутоиммунных заболеваний?
■ Каким образом поглощенные фагоцитами бактерии могут избежать лизиса? Приведите примеры различных способов микробной самозащиты.
■ Как можно выявить участие комплемента и фагоцитов в уничтожении различных микробов? Какие генетические и молекулярно-биологические методы позволяют выяснить способы защитыбактерий от разрушения комплементом и от фагоцитоза?
■ Каким образом цитокины активируют макрофаги для разрушения поглощенных бактерий? Всегда ли эта активация выгодна организму-хозяину?
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Roitt I.M., Delves P.J. (ed). 1992. Encyclopedia of immunology. London: Academic Press. (См. многочисленные статьи по отдельным видам грибов и бактерий.)
Бактерии
Catterall J.R., Black С.М., Leventhal J.P. et al. 1987. Monoxidative microbicidal activity in normal human alveolar and peritoneal macrophages. Infect. Immun 55: 1635-1640.
Cohen I.R., Young D.8. 1991. Autoimmunity, microbial immunity and the immunological homunculus. Immunol. Today 12: 105-110.
Falkow S., Isberg R.R., Portnoy D.A. 1992. The interaction of bacteria with mammalian cells. Ann. Rev. Cell. Biol. 8: 333-363.
Heeg K., Miethke T., Wagner H. 1996. Superantigen-mediated lethal shock: the functional state of ligand-reactive T cells. Cure Top. Microbiol. Immunol. 216: 83-100.
Henderson В., Poole S., Wilson M. 1996. Bacterial modulins: a novel class of virulence factors which cause host tissue pathology by inducing cytokine synthesis. Microbiol. Rev. 60: 316 341.
Jones B., Pascopella L., Falkow S. 1995. Entry of microbes into the host using M cells to break the mucosal barrier. Curr. Opin. Immunol. 7: 474-478.
Kagan B.L., Ganz T., Lehrer R.l. 1994. Defensins: a family of antimicrobial and cytotoxic peptides. Toxicology 87: 131-149.
Kaufmann S.H. 1993. Immunity to intracellular bacteria. Anna Rev. Immunol. 11: 129-163.
Levy O. 1996. Antibiotic proteins of polymorphonuclear leukocytes. Eur. J. Haematol. 56: 263-277.
Moffitt M.C., Frank M.M. 1994. Complement resistance in microbes. Springer Semin. Immunopathol. 15: 327-344.
Moors M.A., Portnoy D.A. 1995. Identification of bacterial genes that contribute to survival and growth in an intracellular environment. Trends Microbiol 3: 83-85.
Ofek I., Goldhar J., Keisari Y. et al. 1995. Nonopsomc phagocytosis of microorganisms. Annu. Rev. Microbiol. 49: 239-276.
Оrmе I., Flynn J.L., Bloom B.R. 1993. The role of CD8+ T cells in immunity to tuberculosis. Trends Microbiol. 1(3): 77-78.
Rietschel E.T., Brade H., Holst O. et al. 1996. Bacterial endotoxin: Chemical constitution, biological recognition, host response, and immunological detoxication. Curr. Top. Microbiol. Immunol. 216: 39-81.
Rook G.A.W., Hernandez-Pando R., The pathogenesis of tuberculosis. Ann. Rev. Microbiol. 50: 259-284.
Rothstein J.L., Schreiber H., 1988. Synergy between tumour necrosis factor and bacterial products causes haemorrhagic necrosis and lethal shock in normal mice. Proc. Natl. Acad. Sci. USA 85: 607-611.
Thiel S. 1992. Mannan-bmding protein, a complement activating animal lectin. Immunopharmacology 24: 91-99.
Ulevitch R.J., Tobias P S. 1995. Receptor-dependent mechanisms of cell stimulation by bacterial endotoxin. Annu. Rev Immunol. 13: 437.
Vouldoukis I., Riveros-Moreno V., Dugas B. et al. 1995. The killing of Leischmania major by human macrophages is mediated by nitric oxide induced after ligation of the Fc epsilon RII/CD23 surface antigen. Proc. Natl. Acad. Sci. USA 92: 7804-7808.
Yamamura M., Uyemura K., Deans R. et al. 1991 Defining protect the responses to pathogens: cytokine profiles in leprosy lesions. Science 254: 277-279.
Yu B., Wright S.D., 1996. Catalytic properties of lipopolysaccharide (LPS) binding protein. Transfer of LPS to soluble CD14. J. Biol. Chem. 271: 4100-4105.
Грибы
Jones H.E. 1993. Immune response and host resistance of humans to dermatophyte infection. J, Am. Acad. Dermatol. 28: S12-18.
Leibovici V., Evron R., Axelrod O. et al. 1995. Imbalance of immune responses in patients with chronic and widespread fungal skin infection. Clin. Exp. Dermatol. 20: 390-394.
Levitz S.M. 1992. Overview of host defenses in fungal infections. Clin. Infect. Dis. 14: S37-42.
Murphy J.W. 1991. Mechanisms of natural resistance to human pathogenic fungi. Annu. Rev. Microbiol. 45: 509-538.