ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 18. Иммунитет к паразитарным инвазиям
Т-ЛИМФОЦИТЫ ВЫПОЛНЯЮТ ОСНОВНУЮ РОЛЬ В РАЗВИТИИ ИММУНИТЕТА
При большинстве паразитарных инвазий защитный ответ может быть экспериментально передан здоровым животным путем переноса им клеток селезенки, в первую очередь Т-лимфоцитов, от иммунных животных. Необходимость Т-лимфоцитов для развития иммунитета подтверждается и тем, что мыши, истощенные по Т-клеткам, и бестимусные (голые) мыши не способны противостоять нелегальным протозойным инфекциям, например вызванным Т. cruzi или Р yoelii, а истощенные по Т-клеткам крысы — освободиться от кишечных гельминтов Nippostrongylusbrasiliensis (рис. 18.9). Однако в некоторых случаях перенос Т-клеток от сильно зараженных животных может подавлять протективный ответ и вызывать гибель реципиентов. Причина такого эффекта состоит в том, что эти Т-клетки секретируют ИЛ-4 и ИЛ-10 - цитокины, ингибирующие образование и активность ИФγ, необходимого для активации макрофагов и уничтожения паразитов.
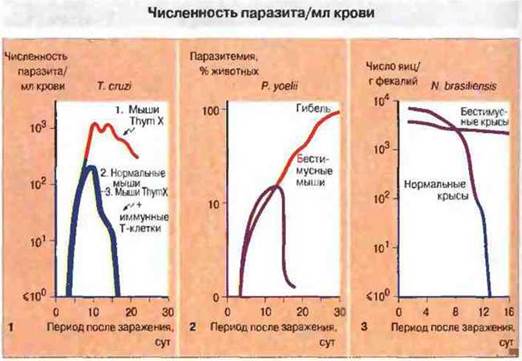
Рис. 18.9. Первые два графика показывают увеличение числа клеток простейших, размножающихся в крови (паразитемия), после заражения.
1. У мышей с удаленным тимусом и облученных с целью разрушения Т-клеток (Thym X) клетки Trypanosoma cruzi размножаются быстрее, чем у нормальных животных, и вызывают гибель. У нормальных мышей трипаносомы на 16 сут после заражения исчезают из крови. Перенос мышам, истощенным по Т-клеткам, Т-лимфоцитов от иммунных животных (иммунные Т-клетки) восстанавливает способность организма ликвидировать инфекцию. В этих экспериментах тимэктомированным животным обеих групп вводили клетки печени плода для восстановления жизненно важной гемопоэтической функции. 2. У нормальных мышей Plasmodium уоеlii вызывает самоограничивающуюся инфекцию и удаляется из крови на 20 сут. В организме бестимусных (голых) мышей плазмодий продолжает размножаться, вызывая гибель животных примерно через 30 сут после инфицирования. 3. Этот график иллюстрирует динамику изгнания кишечной нематоды Nippostrongyfus brasiliensis у крыс. У нормальных животных гельминт полностью изгоняется к 13 сут, что определяют по числу яиц, обнаруживаемых в фекалиях. В то же время у бестимусных крыс развивается хроническая инвазия кишечника; таким образом, для изгнания гельминтов необходимы Т-клетки.
Ранее роль цитокинов при паразитарных инвазиях можно было изучать только путем введения того или иного цитокина зараженным животным или путем его удаления с помощью моноклональных антител. Сейчас появился новый, более продуктивный подход, основанный на получении трансгенных по определенному цитокину мышей, а также мышей, у которых ген данного цитокина разрушен методом генного нокаута (нокаутные мыши). С помощью этого подхода установлено, что многие цитокины не только воздействуют на эффекторные клетки, усиливая их цитотоксическую или цитостагическую активность, но и функционируют как факторы роста, способствуя пролиферации определенных типов клеток. Так, наблюдаемые при малярии моноцитоз и увеличение селезенки, вызванное огромным ростом числа клеток, зависят от продуктов Т-лимфоцитов. Другие примеры Т-зависимых эффектов — это накопление макрофагов в гранулемах, образующихся в печени при шистосомозе, эозинофилия, характерная для гельминтозов, а также миграция эозинофилов и тучных клеток в слизистую кишечника при поражении гельминтами желудочно-кишечного тракта. Важные для освобождения от гельминтов тучные клетки слизистой и эозинофилы пролиферируют в ответ на продукты Т-клеток, а именно ИЛ-3 + ГМ-КСФ и ИЛ-5 соответственно.
Однако увеличение числа клеток может иметь и неблагоприятные последствия. Так, введение ИЛ-3 мышам, инфицированным Leishmania major, способно обострить локальную инфекцию и усилить распространение паразита, возможно вызывая пролиферацию костномозговых предшественников заражаемых им клеток.
Для защиты от некоторых паразитов необходимы Т-лимфоциты как CD4+, так и CD8+
Тип Т-лимфоцитов, участвующих в борьбе с инвазией, варьирует в зависимости от природы паразита и стадии заболевания и определяется тем, какой цитокин эти клетки продуцируют. Например, Т-лимфоциты CD4+и CD8+действуют против различных стадий малярийных паразитов: Т-клетки CD4+опосредуют иммунный ответ против эритроцитарной стадии Р. yoelii, а Т-клетки CD8+ против печеночной стадии Р. berghei. Действие Т-лимфоцитов CD8+двоякое; они секретируют ИФγ, ингибирующий размножение паразитов в гепатоцитах, и разрушают инфицированные гепатоциты. Гепатоциты экспрессируют антигены МНС класса I, но не класса II, поэтому Т-лимфоциты CD4+не распознают их и не активируются для секреции ИФγ. В свою очередь Т-клетки CD8+не эффективны в отношении эритроцитарной стадии паразитов, поскольку эритроциты не экспрессируют антигены МНС класса I.
Иммунный ответ против Т. cruzi зависит не только от Т-лимфоцитов CD4+и CD8+, но и от нормальных клеток-киллеров (НК) и продукции антител; то же характерно и для иммунного ответа против Т. gondii. В эксперименте Т-клетки CD8+обеспечивают защитный ответ у мышей, истощенных по Т-клеткам CD4+, как путем выделения ИФγ, так и путем цитотоксического действия на инфицированные макрофаги. Другим источником ИФγ служат К-клетки, активированные выделяемым макрофагами ИЛ-12. Хронические инвазии ассоциированы с пониженной продукцией ИФγ. Все эти данные, возможно, объясняют высокую заболеваемость токсоплазмозом среди больных СПИДом, для которого характерна супрессия Т-лимфоцитов CD4+.
При различных инвазиях Т-клетки CD4+ функционируют неодинаково
Хелперные Т-клетки CD4+подразделяются на две субпопуляции: Тх1 и Тх2 (см. гл. 10). В начальной стадии инвазии возможно равное присутствие обоих типов клеток; в дальнейшем их соотношение может меняться, сдвигаясь в сторону того или иного типа клеток по прошествии длительного периода заболевания. Поскольку цитокины Тх1- и Тх2-клеток взаимно антагонистичны, субпопуляция Т-лимфоцитов, которая в конечном счете окажется доминирующей, будет иметь решающее значение для устранения паразита (тип ответа существенным образом зависит от природы паразита и может быть непредсказуемым). Поскольку относительное значение Тх1- и Тх2-клеток при протозойных инфекциях, как правило, различно и варьирует при различных гельминтозах, лучше рассматривать заболевании по отдельности. (Цитокины, продуцируемые указанными субпопуляциями клеток, и их роль в развитии иммунитета рассмотрены в гл. 10 и 11.)
Активность Тх1-и Тх2-клеток при малярии. Tx1-клетки действуют против печеночной стадии мааярийного плазмодия: введение ИФγ (цитокина, продуцируемого Тх1-клетками) шимпанзе, инфицированным спорозоитами Р. vivax, снижает паразитемию. Кроме того, установлено, что устойчивость иммунных мышей к заражению спорозоитами Р. berghei может быть преодолена введением антител против ИФγ. Лимфоциты Тх2 обычно способствуют продукции антител, усиливая специфичность иммунной реакции. Антителозависимой реакцией является, например, уничтожение эритроцитарной стадии малярийного паразита в селезенке активированными эффекторными клетками (антителозависимая цитотоксичность). Для поддержания иммунитета важна функция адаптированной селезенки.
Субпопуляция Тх1 усиливает элиминацию внутриклеточных простейших. Цитокин ИФγ активирует макрофаги для уничтожения паразитирующих внутри них простейших, например L. major, Т. cruzi и Т. gondii (рис. 18.10 и 18.11), и усиливает также эффекторный ответ при инвазиях, вызванных другими паразитами. Действие ИФγ убедительно подтверждают данные по заражению мышей лейшманиями. У мышей резистентных линий развитию кожных повреждений, вызываемых L. major, препятствует действие ИФγ (цитокин, выделяемый Tx1-клетками). У чувствительных животных с прогрессирующим заболеванием доминируют Тх2-клетки - секретируемый ими ИЛ-4 подавляет образование ИФγ. Введение антител к ИЛ-4 ликвидирует инфекцию, вызывая уменьшение активности Тх2-клеток и увеличение популяции Tx1. Непосредственного введения рекомбинантного ИФγ чувствительным мышам для этого недостаточно; таким образом, чувствительность в данном случае обусловлена избыточной активностью Тх2-клеток, а не дефицитом активности Тх1-клеток. В то же время ИЛ-12 (продукт макрофагов и В-клеток), стимулируя пролиферацию активированных Тх1-клеток и НК, а также синтез активных в отношении Leishmania цитокинов, в том числе ИФγ, подавляет развитие Тх2-клеток и обеспечивает излечение при введении чувствительным мышам на ранней стадии инфекции.
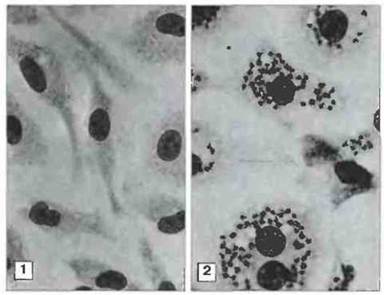
Рис. 18.10. Подавление размножения паразита в макрофагах, обработанных цитокинами. Перитонеальные макрофаги мышей BALB/c, зараженных амастиготами Leishmania donovani, через 72 ч после заражения обрабатывали экстрактом активированных Т-клеток (содержащим цитокины) или контрольных Т-клеток. При последующем культивировании: в клетках, обработанных цитокинами, паразиты не были обнаружены (1), тогда как необработанные макрофаги содержали большое количество паразитов (2). Дальнейшие эксперименты с использованием рекомбинантного ИФγ и моноклональных антител к ИФγ показали, что подавление паразитов вызывает этот цитокин. (Микрофото графии любезно предоставлены д-ром Н. Murray; с разрешения из J. Immunol., 1982; 129: 344-357, © American Association ofImmunologists.)
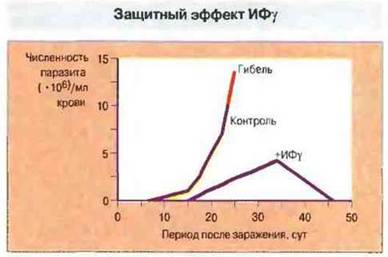
Рис. 18.11. Эффект введения Т-клеточного цитокина ИФγ при острой инфекции, вызванной Trypanosoma cruzi. У мышей данной линии паразиты размножаются, вызывая гибель животных примерно через 3 нед после заражения. Введение рекомбинантного ИФγ подавляет размножение трипаносом и обеспечивает их уничтожение.
У человека в случаях диффузного кожного лейшманиоза и прогрессирующего висцерального лейшманиоза обнаруживается недостаточность синтеза ИФγ и повышенная экспрессия ИЛ-10 - Тх2-ассоциированного цитокина, который подавляет пролиферацию и функцию Тх1-клеток. В условиях in vitro индуцированную ИФγ-активность моноцитов человека против L. donovani ингибирует ИЛ-4 (рис. 18.12). Эти данные позволяют предполагать, что при лейшманиозе, возможно, было бы эффективным терапевтическое применение ИЛ-12 с одновременной нейтрализацией антагонистических цитокинов ИЛ-4, ИЛ-10 и ТФРβ.
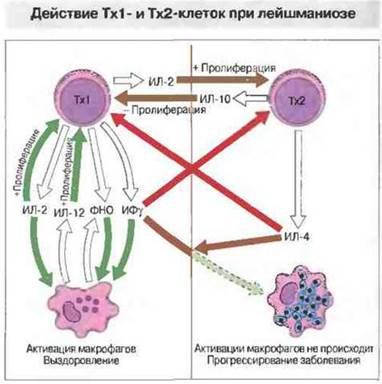
Рис. 18.12. При иммунном ответе на заражение Leishmania цитокины, выделяемые различными субпопуляциями Т-клеток, способствуют устранению инфекции или развитию заболевания. Обратите внимание, что ИЛ-12, продуцируемый также В-клетками, способствует пролиферации и НК-клеток, и Тх1-клеток; эти клетки выделяют ИФγ—цитокин, важный для уничтожения паразитов.
Тx1- и Тх2-реакции важны для защиты от гельминтов. Характерные признаки развития иммунного ответа при заражении гельминтами — высокий уровень IgE и эозинофилия — зависят от действия цитокинов, секретируемых Тх2-лимфоиитами. Однако относительный вклад субпопуляций Тх1 и Тх2 в развитие иммунитета к этим паразитам пока неясен. Изучение данного вопроса осложнено тем, что реакции у мыши, крысы и человека различаются, по крайней мере в случае шистосомоза: у человека, по-видимому, важное значение в развитии иммунитета имеют Тх2-эффекты, поскольку устойчивость к повторному заражению после применения лекарственного препарата коррелирует с образованием IgE, но у мыши в индуцированном вакцинацией защитном ответе участвуют Тх1 -клетки и ИФγ, а Тх2- клетки ассоциированы с иммунопатологией, вызванной откладкой паразитами яиц (переключение на образование Тх2-клеток инициируют антигены яиц).
По набору синтезируемых цитокинов зараженные животные могут отличаться от вакцинированных. Например, у мышей, зараженных S. mansoni, преобладают Тх2-клетки, продуцирующие ИЛ-5. У иммунизированных мышей уровень IgE и число эозинофилов относительно низки и доминируют Тх1-лимфоциты. Секреция ИФγ Tx1-клетками обеспечивает активацию эффекторных клеток, которые разрушают шистосомул на легочной стадии миграции посредством выделения оксида азота. Когда половозрелые особи откладывают яйца, последние выделяют растворимый антиген, действие которого проявляется только у чувствительных животных. Этот антиген яиц снижает функцию Тх1-клеток и уровень ИФγ, но повышает продукцию ИЛ-5 клетками Тх2.
При некоторых паразитарных инвазиях иммунная система не способна полностью устранить паразитов, но изолирует от него ткани организма с помощью клеток зоны воспаления. При этом организм-хозяин реагирует на локально высвобождаемый антиген, который стимулирует секрецию цитокинов, привлекающих клетки в соответствующий участок. Подобные реакции продемонстрированы на мышах, вакцинированных ослабленными облучением церкариями шистосом. Инфильтрирующие клетки, в основном представленные Тх1-лимфоцитами, окружают
Иммунитет к паразитарным инвазиям шистосомул в легочной ткани уже через 24 ч после внутривенного введения паразита (рис. 18.13). Это предотвращает последующую миграцию шистосомул в органы и ткани организма, где возможно их развитие в половозрелые особи. Другой пример реакции хозяина, направленной на изолирование паразитов, — образование гранулем в печени в местах откладки яиц шистосомами. Эта реакция — хронический клеточноопосредованный ответ на растворимые антигены яиц, задержанных таким образом в печени. Макрофаги аккумулируют и выделяют фиброгенные факторы, стимулирующие образование гранулематозной ткани и в конечном счете развитие фиброза. Данная реакция, несмотря на то что она может быть полезной для хозяина, поскольку изолирует клетки печени от секретируемых яйцами паразита токсинов, служит также и основной причиной патологии, так как вызывает необратимые изменения в печени и утрату печенью своей функции. В отсутствие Т-клеток гранулемы не образуются и последующей фиброзной инкапсуляции не происходит.
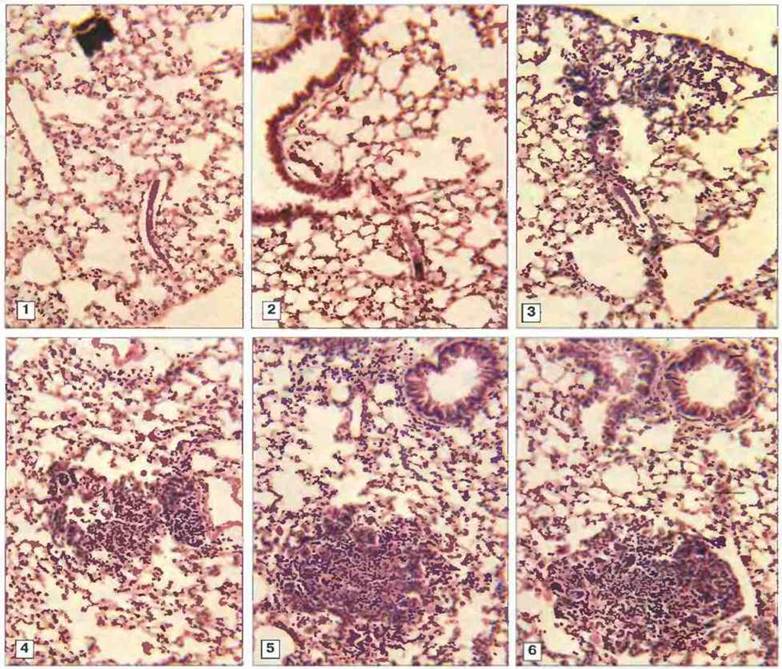
Рис. 18.13. Микрофотографии легочной ткани мыши, показывающие образование очагов вокруг мигрирующих шистосомул Schistosoma mansoni. Шистосомулы были введены внутривенно. 1. Легкие невакцинированной мыши через 24 ч после введения паразита. У мышей, защищенных путем вакцинации ослабленными облучением церкариями, инфильтрирующие клетки появляются уже через 24 ч (2). 3-6. Последовательное развитие очагов на 2, 4, 8 и 12 сут после заражения. Иммуноцитохимический анализ бронхоальвеолярных образцов показал, что основным компонентом легочных инфильтратов являются Т-лимфоциты CD4+. Основной цитокин, продуцируемый этими клетками в культуре - ИФγ; синтез мРНК для ИФγ индуцируется по всей легочной ткани, из чего следует, что защитная реакция опосредована Тх1-клетками. (Фото любезно предоставлены д-ром L. Smythies; с разрешения из Parasite Immunol. 1996; 18: 359-69.)
Для борьбы с гельминтами, поражающими различные участки организма — кишечник (например, Trichuris irichura) или ткани (например, Onchocerca volvulus), и различными стадиями жизненного цикла паразитов (например, с шистосомулами в легких и половозрелыми шистосомами в венах) могут быть задействованы разнообразные механизмы.
Тх2-клетки необходимы для изгнания кишечных гельминтов. Экспериментально установлено, что Тх2-клетки имеют важное значение для борьбы с гельминтами, поражающими кишечник. Например, у мышей, в норме устойчивых к заражению власоглавом, развивается хроническая инвазия, если нейтрализовать цитокин ИЛ-4, продуцируемый Тх2-клетками. Напротив, чувствительные мыши освобождаются от гельминтов, если активность ИЛ-4 усилена введением нейтрализующих антител к ИФγ. Сходным образом, введение ИЛ-12 крысам вскоре после заражения кишечным гельминтом N. brasiliensis стимулирует образование ИФγ и задерживает изгнание. Действие цитокина ИЛ-12 состоит в подавлении синтеза цитокинов Тх2-клетками, в частности ИЛ-4 и ИЛ-5; эти эффекты препятствуют синтезу IgE и гипертрофии тучных клеток кишечника (эффекты, опосредуемые ИЛ-4), а также развитию эозинофилии (опосредуемому ИЛ-5).
Механизм изгнания гельминтов включает дегрануляцию тучных клеток слизистой кишечника, вызванную продуктами активированных антигеном Т-клеток. Продукты тучных клеток усиливают интенсивность других эффекторных процессов, взаимодействуют с эозинофилами и ускоряют изгнание гельминтов (рис. 18.14). Цитоплазматические гранулы тучных клеток содержат предобразованные медиаторы (см. гл. 23), различные цитокины и протеазу. Компоненты гранул вызывают изменения в проницаемости стенок кишечника и слущивание эпителия, что способствует также устранению и некоторых паразитических простейших. При заражении кишечными нематодами бокаловидные клетки секретируют слизь, которая покрывает гельминтов и обеспечивает их изгнание. Это специфическая ответная реакция, наблюдаемая только у иммунных животных. Изменяя проницаемость слизистой оболочки, медиаторы тучных клеток обеспечивают проникновение комплемента и сывороточных антител в просвет кишечника и могут воздействовать на его гладкую мускулатуру, обеспечивая изгнание паразитов в результате усиления перистальтики.
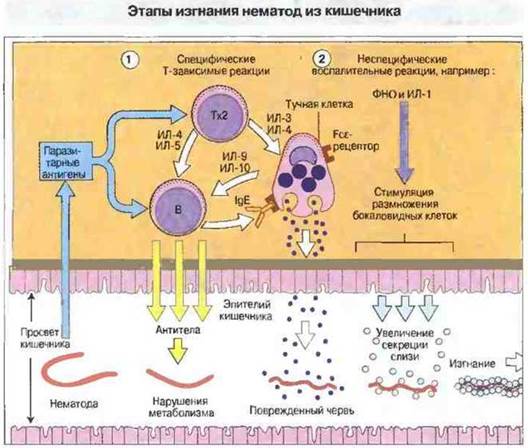
Рис. 18.14. Изгнание некоторых кишечных нематод происходит спонтанно через несколько недель после заражения. По-видимому, освобождение от паразитов происходит в две стадии и обеспечено совместным действием Т-зависимых и Т-независимых механизмов. 1. Т-клетки (преимущественно Тх2) отвечают на паразитарные антигены и индуцируют а) образование антител В-клетками, которые пролиферируют в ответ на ИЛ-4 и ИЛ-5, б) пролиферацию тучных клеток слизистой оболочки в ответ на ИЛ-3, ИЛ-4, ИЛ-9 и ИЛ-10 и в) гиперплазию секретирующих слизь бокаловидных клеток кишечного эпителия. Повреждение гельминтов вызывают антитела и продукты IgE-сенсибилизированных тучных клеток, дегранулирующих после контакта с антигеном и высвобождающих гистамин, который повышает проницаемость кишечного эпителия. Однако этих эффектов недостаточно для изгнания гельминтов. 2. Секретируемые макрофагами неспецифические молекулы воспаления, в том числе ФHО и ИЛ-1, способствуют пролиферации бокаловидных клеток и вызывают усиленную секрецию ими слизи. Обволакивая червей, слизь способствует их изгнанию. Число бокаловидных клеток в эпителии тощей кишки и секреция слизи возрастают пропорционально количеству паразитов. Антигенспецифичные эффекторные Т-клетки образуются на ранних стадиях инвазии; лимитирующий ее развитие этап — это начало повреждения червей под действием антител. Относительный вклад указанных реакций в процесс изгнания зависит от вида нематод.
Паразиты индуцируют образование неспецифических и специфических антител
При многих паразитарных инвазиях развивается неспецифическая гипергаммаглобулинемия, в основном, вероятно, под действием высвобождаемых паразитами соединений, вызывающих В-митогенный эффект. Повышается общее содержание иммуноглобулинов: IgM при трипаносомозе и малярии, IgG — при малярии и висцеральном лейшманиозе. Относительное значение антителозависимого и антителонезависимого ответов определяется видом инвазии (рис. 18.15). Механизмы действия специфических антител при паразитарных инвазиях и их эффекты суммированы на рис. 18.16 и перечислены ниже.
✵ Антитела могут действовать на клетки простейших непосредственным образом или путем активации комплемента (рис. 18.17).
✵ Антитела способны непосредственно нейтрализовывать паразитов, препятствуя их прикреплению к новым клеткам; например, при инфекциях, вызываемых различными видами малярийных паразитов, мерозоиты проникают в эритроциты с помощью специального рецептора — этот процесс ингибируют специфические антитела (рис. 18.18). Антитела могут также предотвращать распространение инфекции, как в острой фазе инфекции, вызванной Т. cruzi.
✵ Осуществляемый макрофагами фагоцитоз усиливается антителами, наиболее эффективно при участии комплемента. Указанные эффекты опосредованы Fc- и С3-рецепторами, число которых может увеличиваться в результате активации макрофагов.
✵ Антитела участвуют в реакциях антителозависимой клеточной цитотоксичности, например в случае инвазий, вызываемых Т. cruzi, Т. spiralis, S. mansoni и филяриями. Цитотоксические клетки, такие как макрофаги, нейтрофилы и эозинофилы, прикрепляются к покрытым антителами простейшим и гельминтам посредством Fc- и С3-рецепторов и осуществляют экзоцитоз паразитов.
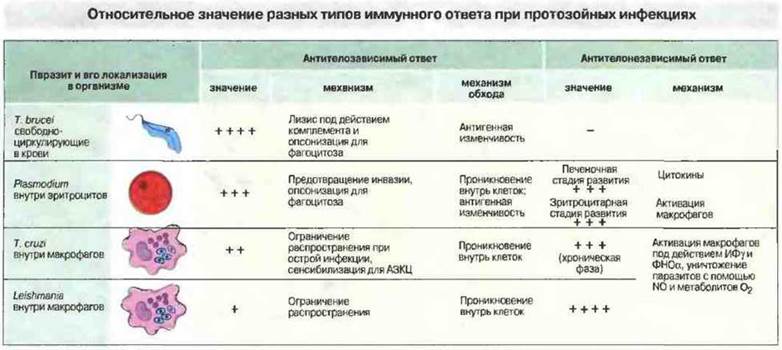
Рис. 18.15. Относительное значение двух типов иммунного ответа, их механизмы и способы обхода паразитами повреждающего действия антител при протозойных инфекциях. Антитела наиболее важны для защиты от простейших, размножающихся в крови, таких как африканские трипаносомы и малярийные паразиты, а клеточный иммунитет эффективен против тканевых паразитов, например лейшманий. Антитела способны непосредственно повреждать клетки паразитов, а также стимулировать фагоцитоз, активировать комплемент или блокировать проникновение паразитов в клетки организма-хозяина и тем самым ограничивать распространение инфекции. Проникнув внутрь клеток, паразиты избегают всех этих эффектов антител. Клетки Trypanosoma cruzi и Leishmania чувствительны к метаболитам кислорода, образующимся при вспышке дыхания в макрофагах, и к оксиду азота. Обработка макрофагов цитокинами усиливает образование указанных продуктов, препятствует проникновению в клетки и снижает выживаемость паразитов. Малярийные паразиты в эритроцитах могут разрушаться продуктами активированных макрофагов, в том числе пероксидом водорода и другими цитотоксическими продуктами.
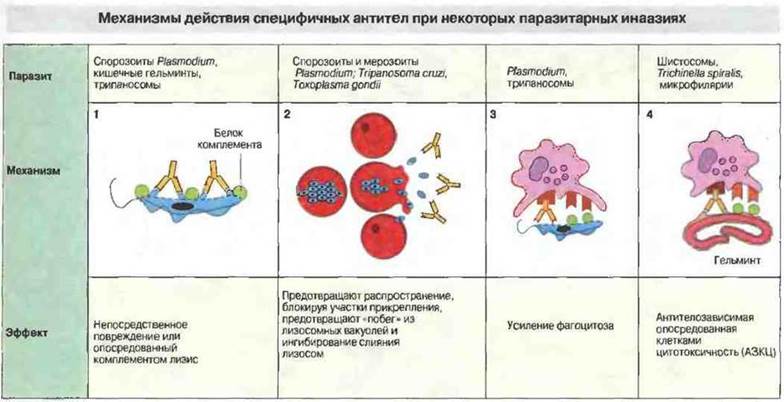
Рис. 18.16.
1. Непосредственное повреждение паразитов антителами. Антитела инициируют активацию комплемента по классическому пути, что приводит к повреждению клеточной мембраны простейшего и увеличению его чувствительности к другим медиаторам.
2. Нейтрализация. Некоторые паразиты, например Plasmodium spp., проникают в клетки, используя специфические клеточные рецепторы; антитела блокируют эти участки связывания и предотвращают тем самым прикрепление к эритроцитам и соответственно дальнейшее размножение мерозоитов.
3. Усиление фагоцитоза. Отложение фрагмента С3b комплемента на поверхности паразита опсонизирует его для фагоцитоза клетками, имеющими С3b-рецепторы (например, макрофагами). Макрофаги обладают также Fc-рецепторами.
4. Эозинофилы, нейтрофилы, тромбоциты и макрофаги могут оказывать цитотоксическое действие (АЗКЦ) на некоторых паразитов, распознавая их с помощью специфических антител. Эту реакцию усиливает комплемент.
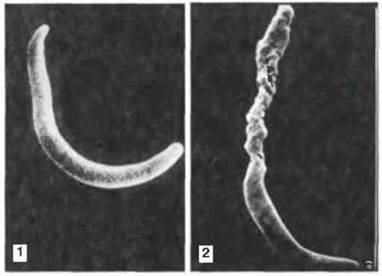
Рис. 18.17. Непосредственное действие специфических антител на спорозоиты малярийного паразита. Эти микрофотографии, сделанные с помощью сканирующего электронного микроскопа, показывают спорозоит Plasmodium berghei, возбудителя малярии грызунов, до (1) и после (2) инкубации с иммунной сывороткой. Антитела повреждают поверхность спорозоита, действуя на наружную мембрану, и вызывают потерю жидкости. Специфичные антитела обеспечивают защиту от инфекции Plasmodium spp. на определенных внеклеточных стадиях жизненного цикла. Антитела являются специфическими для каждой стадии. (Фото любезно предоставлены д-ром R. Nussenzweig.)
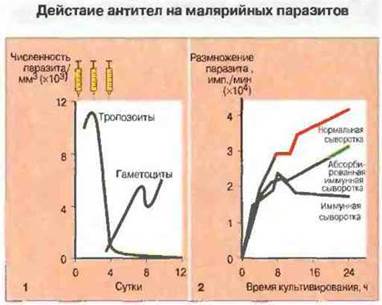
Рис. 18.18.
1. Введение гамма-глобулина от иммунных взрослых ребенку, инфицированному Plasmodium falciparum, вызывает резкое снижение паразитемии. Специфичные антитела действуют на мерозоиты - одну из стадий жизненного цикла паразита - и предотвращают их дальнейшее размножение в крови. При этом развитие гаметоцитов из уже присутствующих внутриклеточных форм не подавляется.
2. Иммунная сыворотка блокирует размножение Р. knowlesi (возбудитель малярии обезьян) в культуре, на что указывают данные по включению 3Н-лейцина. Размножение плазмодия подавляется на стадии, следующей за разрывом шизонтов; вышедшие из них мерозоиты не могут проникнуть в новые эритроциты. Активность иммунной сыворотки может снижаться в результате предварительной абсорбции специфичных антител свободными шизонтами.
Различные изотипы антител могут действовать разными путями. Как отмечено выше, при шистосомозе специфические антитела IgE ассоциированы с устойчивостью к инфекции и имеется обратная связь между количеством IgE в крови и возможностью повторного заражения. Антитела IgG4, по-видимому, блокируют действие IgE; повторное заражение наиболее вероятно в детском возрасте, для которого характерен высокий уровень IgG4. Развитие иммунитета скорее всего зависит от переключения с образования IgG4 на синтез IgE, которое происходите возрастом; частота заражения максимальна в возрасте 10-14 лет, когда уровень IgG4 особенно высок.
Для многих инвазий трудно разграничить клеточный и гуморальный ответы, поскольку они развиваются одновременно. Это иллюстрирует рис. 18.19, на котором суммированы данные об иммунных механизмах, действующих против шистосом.