Эволюция вирусов - Жданов В. М. 1990
Специальная часть
Пикорнавирусы
Пикорнавирусы составляют большую группу вирусов, поражающих человека и теплокровных животных. Согласно последней классификации и номенклатуре вирусов [Matthews R., 1982; см. также Каверин Н. В., 1982], вирионы имеют кубический тип симметрии, без внешних оболочек. Генетический материал представлен однонитевой РНК с молекулярной массой порядка 2,5 х 106, что составляет около 30% массы вирионов, а белков — около 70%.
Семейство пикорнавирусов (Picornaviridae) включает 4 рода — Enterovirus (энтеровирусы), Cardiovirus (вирус энцефаломиокардита), Rhinovirus (риновирусы), Aphthovirus (вирус ящура) и ряд неклассифицированных вирусов. Подразделение на роды основано на деталях структуры РНК, физико-химических свойствах вирионов, типе патологических процессов и совокупности других признаков. Роды энтеро- и риновирусов многочисленны и насчитывают соответственно более 100 и 110 вирусов, в остальных родах — менее 10 вирусов в каждом. Общее число вирусов этого семейства превышает 230.
Вирионы являются икосаэдрами с диаметром 24—30 нм. Капсид состоит из 60 морфологических единиц, а каждый капсомер является четвертичной надмолекулярной структурой, состоящей из 4 молекул белка. Кроме того, в состав вириона входят 1—2 молекулы протомера VPO, из которых формируются белки VP2 и VP4. Субструктурой капсида являются пентамеры, оболочка вириона представляется как ассамблея 12 пентамеров, в связи с чем моделью капсида служит додекаэдр. Четыре молекулы протомера (капсомера, составляющего 60 структурных единиц капсида) «смонтированы» таким образом, что части белков VP1, VP2 и VP3 экспонированы наружу, а белок VP4 находится на внутренней части протомера и ковалентно связан с вирусной РНК. С белком VP1 связаны распознавание вирусных рецепторов и протективный иммунитет, однако антигенные свойства определяются преимущественно четвертичной структурой капсомера.
Геном пикорнавирусов представляет собой положительнополярную однонитевую РНК, содержащую от 7209 (риновирус 14 человека), до 8450 (вирус ящура) оснований (молекулярная масса от 2,50 х 106 до 2,74 х 106) с кодирующей областью размером 2178—2332 аминокислотных остатка. На ее 5'-конце имеется ковалентно связанный полипептид, состоящий из 22—24 аминокислотных остатков (VPg), и на 3'-конце — поли (А)-последовательность из 35—100 оснований.
Кроме того, у кардио- и афтовирусой имеются поли (Ц) -последовательности.
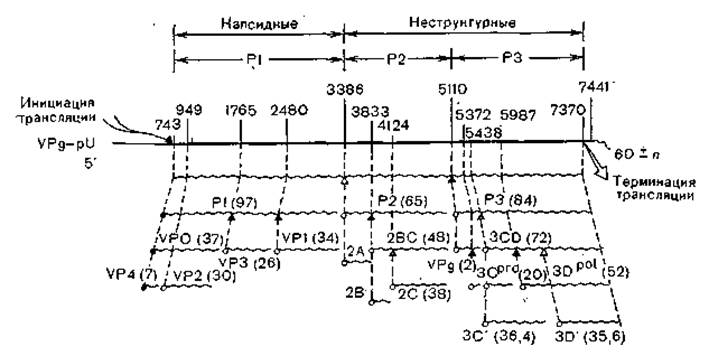
Рис. 9. Нарезание белков полиовируса (схема). P1, Р2 и РЗ обозначают три основных процессированных участка вирусного полипротеина. В скобках указаны молекулярные массы белков.
Схематически геном пикорнавирусов можно разделить на три части: примыкающую к 5'-концу, среднюю и примыкающую к 3'-концу. Первая треть генома (Р1) у кардно- и афтовирусов начинается с поли (Ц) -последовательности (соответственно 180 и 400 оснований), затем следует лидерная последовательность (L); эти две последовательности отсутствуют у энтеро- и риновирусов. У всех пикорнавирусов следуют гены структурных белков в следующем порядке: VP4—VP2— VP3—VP1 (области ІА, IB, 1C и ID). Вторая часть генома (Р2) имеет кодирующие области 2А, 2В и 2С, функции которых неясны. Третья часть генома (РЗ) содержит последовательно гены VPg (3А или 3А, 3В), гены протеазы (3С) и полимеразы (3D).
Как уже указывалось, вирионы имеют 4 капсидных белка с молекулярной массой 23 267—33 521 (VP1), 24 699—29 985 (VP2), 24 323—24 410 (VP3) и 7178—8480 (VP4) и белок VPg. Кроме того, в ходе репликации синтезируется еще 5 белков, в числе которых вирусные РНК-полимераза и протеаза (рис. 9).
Здесь же целесообразно отметить, что определенная для каждого вируса антигенная структура формируется лишь при образовании плотной, с наиболее низким уровнем свободной энергии, надмолекулярной структуры из 4 вирионных белков. Причем экспонированными наружу оказываются антигенные детерминанты белка VP1 и, возможно, VP2, тогда как остальные два белка обращены к полости капсида. Только в этом случае инфекция или иммунизация сопровождается выработкой протективных антител. Сами же по себе белки VP1— VP4 формируют другие антигенные детерминанты, и даже более того вирионы и пустые капсиды с менее плотной упаковкой надмолекулярных структур вирионных белков имеют не только меньшую плотность, но и антигенную структуру, отличную от антигенной структуры плотно упакованных в капсомерах вирионных белков. Соответственно антигенную специфичность интактных вирионов обозначают D или N, а пустых капсидов — С или Я. У них не обнаруживается общих антигенных детерминант. Последние имеются у пустых капсидов (в том числе искусственно образованных) и прокапсидов, у которых место белков VP2 и VP4 занимает их предшественник VP0.
В клетках обнаружены предшественники прокапсидов — 14 S-структуры, которые могут быть получены и искусственно в виде пентамеров при искусственной диссоциации капсидов. Обе структуры имеют одинаковую антигенную специфичность, обозначаемую как S-специфичность. При дальнейшей диссоциации образуются 5S структуры, содержащие по одной молекуле VP1, VP2 и VP3.
Основными этапами репродукции вирусов этой группы являются адсорбция на клеточных рецепторах, проникновение через эндоцитарные вакуоли, депротеинизация вирионов и проникновение РНК в цитоплазму, синтез пропептида, кодируемого всей вирионной РНК и котрансляционное его нарезание, репликация вирусной РНК, формирование прокапсидов, заполнение их дочерней вирионной РНК, формирование нуклеокапсидов и выход вирионов из клеток (рис. 10).
Вирионы взаимодействуют с клеточными рецепторами белком VP1, который является «антирецептором», имея комплементарный сайт узнавания. В процессе взаимодействия с клеточной мембраной и проникновения в клетку с помощью пиноцитоза вирионы теряют белок VP4 и разрушаются, вирионная РНК попадает в цитоплазму. Взаимодействуя с рибосомами, РНК теряет VPg и кодирует синтез полипротеида, соответствующего полному геному. В процессе синтеза происходит протеолитическое расщепление (с помощью клеточных протеаз) на три предшественника — P1, Р2 и РЗ. Последний расщепляется автокаталитически на VPg, протеазу и полимеразу (в 2—3 этапа). При синтезе полимеразы начинается репликация вирусной РНК, которая происходит с участием VPg как затравки, образуются минус-нити и многонитевые структуры репликативного предшественника. Одновременно в 2 этапа расщепляется область Р1, при этом отщепляются VP1, VP3 и VP0 — предшественник VP2+VP4. Сборка вирионов протекает поэтапно: сначала формируются 5S протомеры, затем 14S пентамеры, из которых образуются предшественники вирионов (рис. 11). После вхождения в них дочерних молекул вирионной РНК белок VP0 расщепляется на VP2 и VP4, происходит плотная укладка капсомеров и формируются зрелые вирионы.
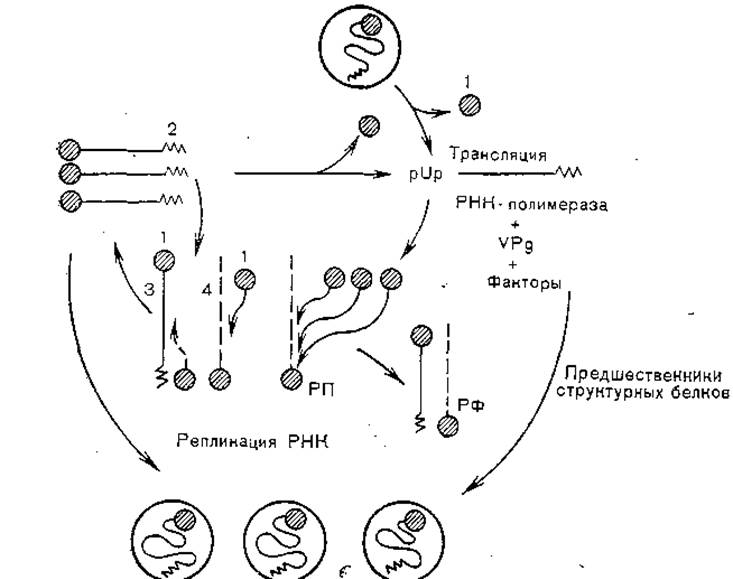
Рис. 10. Репликация пикорнавирусов и возможные функции VPg (схема). 1 - VPg; 2 — поли (А); 3 — плюс-цепь РНК; 4 — минус-цепь РНК; РФ — репликативная форма; РП — репликативный предшественник.
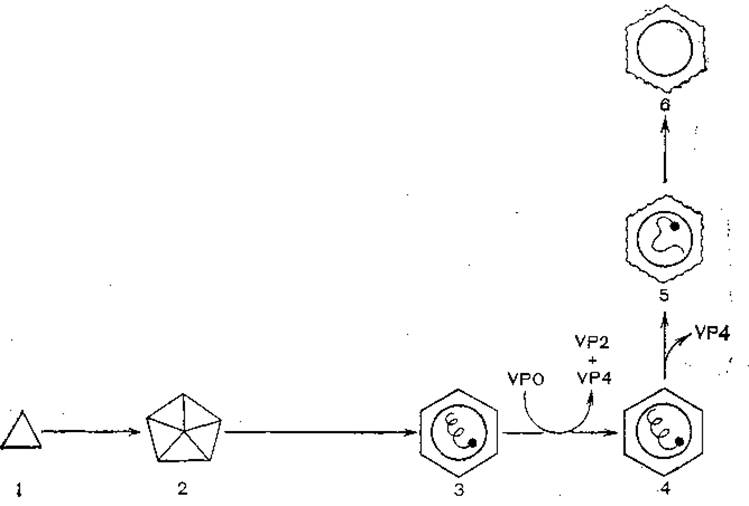
Рис. 11. Морфогенез пикорнавирусов.
Нарезание VP0→VP4+ VP2 приводит к появлению инфекционных вирионов (N-антиген); 1 — протомер 5S (S-антиген); 2 — пентамер 14S (N- и H-аитиген); 3 — провирион; 4 — вирион (155S), Я-антиген; 5 — прогретый вирион 80—125S (H-антиген); 6 — вирион, прогретый или обработанный при высоком значении pH, 80S (Н-антиген).
В опытах с сыворотками против отдельных пептидов, составляющих капсид полиовируса, было показано, что во время морфогенеза вируса развиваются конформационные изменения белков [Wiegers, Dernick R., 1985]. Так, антигенные сайты VP1 и VP2, перекрестно реагирующие у всех трех серотипов вируса полиомиелита, постепенно теряются с поверхности частиц прокапсида, а у зрелого вируса вовсе отсутствуют. Но сыворотка против VP3 распознает максимально экспонируемые антигенные сайты зрелого вируса. Эта сыворотка не обнаруживает межтиповых «перекрестов» в зрелом вирусе, пустых капсидах и 145 предшественниках, однако такие «перекресты» выявляются в денатурированных полипептидах и 5S частицах каждого серотипа. Таким образом, при созревании вируса происходит глубокая конформационная перестройка капсидных полипептидов. В результате этого формируется четвертичная структура капсомеров, маскирующая иммунологические «перекресты» и выявляющая иммунологические различия между капсидами полиовирусов, которые принадлежат к разным серотипам.
Разрушению клетки при выходе из нее вирионов предшествуют многие повреждающие ее воздействия вируса: угнетение синтеза клеточных ДНК, РНК и белка, причем последний блокируется на стадии инициации, в результате чего рибосомы, начавшие уже синтез, диссоциируют, а новые комплексы не образуются. Это воздействие пикорнавирусов проявляется и при смешанной инфекции. Предполагают, что неструктурные белки пикорнавирусов модифицируют рибосомы таким образом, что они перестают взаимодействовать с обычными мРНК [Медведкина О. А. и др., 1974]. Возможно, что это связано с инактивацией одного из клеточных факторов инициации, ненужного для пикорнавирусов [Rose J. et al., 1978]. Однако само по себе подавление синтеза клеточных макромолекул еще не объясняет причин лизиса клеток, сопровождающего выход из них вирионов.
Перейдем к обсуждению возможных источников происхождения и путей эволюции пикорнавирусов.
Пикорнавирусы составляют большую группу (семейство) вирусов. В пределах группы выделяют более мелкие группы (роды): энтеровйрусы, кардиовирусы, риновирусы, афтовирусы, которые поражают человека, 36 энтеровирусов животных, 3 кардиовируса, 113 риновирусов человека, 4 риновируса животных, 7 вирусов ящура и более 30 вирусов, поражающих насекомых. Среди энтеровирусов человека отдельно выделяют по ряду признаков 3 полиовируса, 23 вируса Коксаки А и 6 вирусов Коксаки В, 1—3 вируса гепатита А, вирус острого геморрагического конъюнктивита; остальные либо относят к вирусам ECHO, либо обозначают как энтеровирусы. Подразделения на роды проведены по разным признакам (стабильность в кислой среде, плотность вирионов, характеристика генов), а внутри родов — по характеристике вызываемых заболеваний (полиомиелит, гепатит и др.) и «рангу хозяев». Пикорнавирусы насекомых пока не классифицированы, хотя формально они разделены на 3 рода.
Более объективное соотношение между разными представителями этого обширного семейства дают исследования нуклеотидных последовательностей. В частности, при сравнении генов протеазы и VPg вирусов ECHO, риновирусов, вирусов ящура и энцефаломиокардита было выявлено большое сходство VPg и наличие консервативной области в гене протеазы вирусов человека.
Ранее к пикорнавирусам относили также изометрические рибофаги (Leviviridae) и некоторые вирусы растений. Позже они были исключены из этой группы, хотя возможное родство некоторых вирусов растений с пикорнавирусами будет позже обозначено. Вирус Нодамура также исключен из этой группы, поскольку он имеет сегментированный геном.
Калицивирусы имеют слишком много отличий от пикорнавирусов и потому были выделены в самостоятельное семейство [Cooper Р. et al., 1978].
Для понимания возможных источников происхождения пикорнавирусов рассмотрим примыкающие к ним группы РНК-содержащих вирусов, у которых геномом является однонитевая РНК с позитивной полярностью. При этом постараемся отвлечься от привычных представлений, что есть главное, а что второстепенное в классификации вирусов. R. Matthews (1982) описал 29 таких групп вирусов, преимущественно поражающих растения. О 13 из них слишком мало известно, 11 имеют на 5'-конце кэп-структуры. Рассмотрим поэтому оставшиеся 5 групп. Две из них имеют геномы без метилированных кэп-структур, но и без ковалентно связанного с 5'-концом терминального белка. Три других группы — вирусы группы мозаики южных бобов (Sobemovirus), вирусы группы мозаики коровьего гороха (Comovirus) и вирусы группы кольцевой пятнистости табака (Nepovirus), — обладая геномом в виде однонитевой РНК с позитивной полярностью, имеют на 5'-конце ковалентно соединенный белок (полипептид) с небольшой молекулярной массой. Любопытно, что у группы первой вирусов (вирусы мозаики южных бобов, розеток турнепса) небольшая РНК (1,4 х 106) не имеет на 3'-конце ни поли (А)-последовательности, характерной для РНК с позитивной полярностью у многих вирусов, ни тРНК-подобной структуры, которые имеют РНК многих вирусов растений.
Оба сегмента РНК вируса Нодамура кодируют синтез разных белков: РНК1 — белка с молекулярной массой 6105 х 103, РНК2 — белка с молекулярной массой 43 000 — предшественника капсидного белка р40 [Newman J. et al., 1978].
Две группы вирусов являются бипартитньши, но каждая из двух молекул их РНК построена одинаково: на 5'-конце имеется ковалентно связанный белок с молекулярной массой около 5000 (комовирусы) или 30 000—60 000 (неповирусы), а на 3'-конце— поли (А)-последовательности. Суммарная молекулярная масса РНК У вирусов первой группы составляет 3,8 х 106, 2-й — 4,1 х 106—5 x 106.
Более подробно изучен вирус мозаики коровьего гороха. Несмотря на бипартитность, суммарная РНК его построена по типу РНК пикорнавирусов. На РНК1 с молекулярной массой 2,4 x 106 закодированы геномно-связанный белок и протеолитический белок, а также, вероятно, вирусспецифическая полимераза, т. е. эта РНК соответствует участку РНК полиовирусов, начиная с генов для неструктурных белков. На РНК2 с молекулярной массой 1,4 х 106 закодированы два, а по более новым данным, 4 структурных белка вируса. Вирус образовывает три вида частиц с коэффициентами седиментации 58; 98 и 118S (частицы Т, М и В) и разными плотностями (1,29; 1,41 и 1,44 г/мл). Все три вида частиц имеют один и тот же диаметр — около 28 нм, разные их плотность и коэффициенты седиментации зависят от различного содержания в них РНК (25% и 37%). Все они построены по кубическому типу симметрии и состоят из 60 капсомеров. Известны 12—13 членов этой группы, между которыми существует серологическое родство. Они поражают разные виды растений.
Вирус мозаики коровьего гороха реплицируется по типу репликации пикорнавирусов. Меньшая нить РНК кодирует 4 структурных белка, предшественником которых является полипротеид с молекулярной массой 105000. Большая нить РНК кодирует полипротеид с молекулярной массой 200 000, продуктами которого являются белки с молекулярной массой 32000, 58000, 24 000, 87 000 и VPg. Протеолитическое расщепление происходит, как показано на рис. 12, многоэтапно, с участием двух вирусных протеаз [Wellink J. et al., 1986].
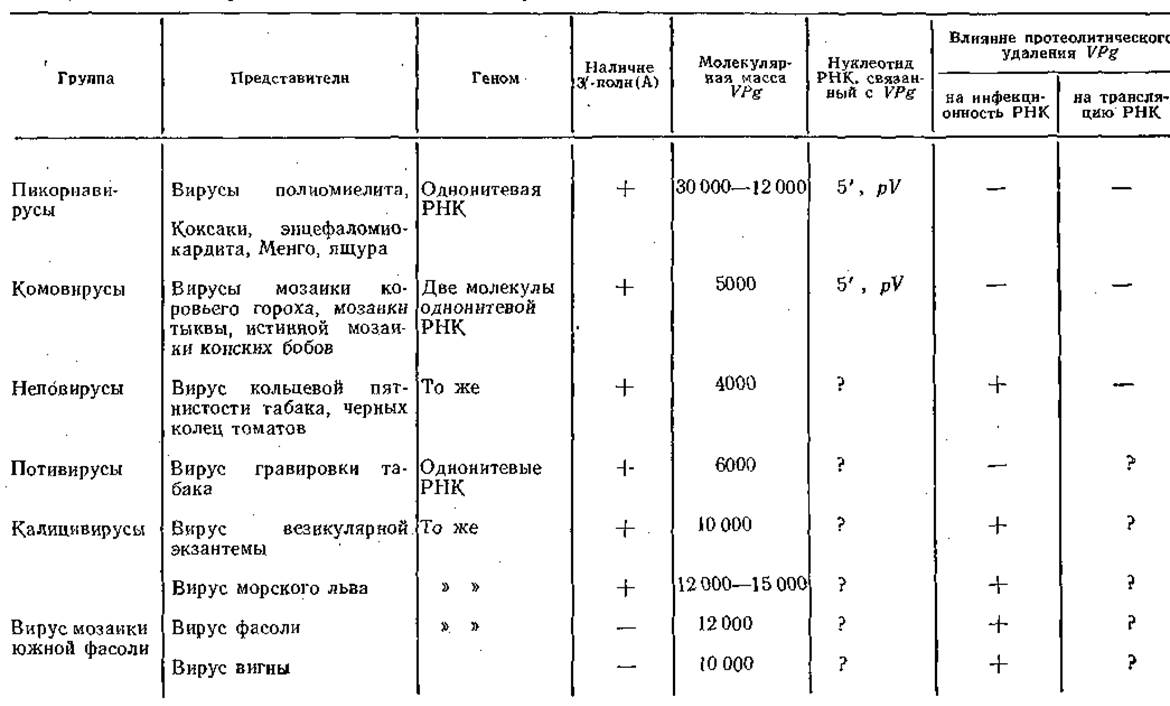
Стратегия генома вируса мозаики коровьего гороха, таким образом, весьма сходна со стратегией генома пикорнавирусов. В табл. 6 представлены вирусы, имеющие VPg на 5'-концах их позитивно-геномных РНК '[Вартапетян А. Б., 1982].
В группе вирусов кольцевой пятнистости табака насчитывается 28 вирусов; лишь некоторые из них имеют серологическое родство. Строение их генома примерно такое же, как у вирусов предыдущей группы: ген структурного белка расположен на РНК1, гены функциональных белков — на РНК2. Три вида частиц (Т; М и ß) различаются по содержанию в них РНК, коэффициенту седиментации и по плотности, но морфологически одинаковы, представляют собой икосаэдры диаметром около 28 нм.
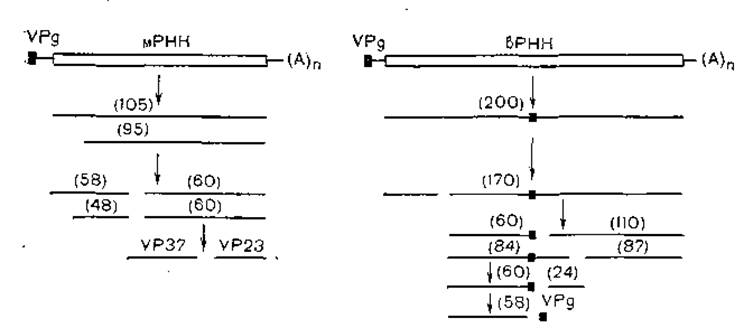
Рис. 12. Протеолитическое нарезание первичных продуктов трансляции мРНК и вРНК CPMV (схема). Двойными линиями показаны открытые рамки считывания; в скобках — молекулярная масса (х 103).
Третичная структура белков сходна у риновирусов и вируса мозаики южной фасоли — собемовируса [Rossman М. et al., 1985].
Попытаемся определить возможное происхождение пикорнавирусов и сходных с ними групп вирусов. Несомненно, что вирусы, поражающие про- и эукариотов, различаются синтезом макромолекул в этих системах. Так, мелкие фаги типа MS2 (левивирусы), кстати, довольно многочисленные, имеют просто устроенный геном, на котором закодированы три гена, считывающиеся отдельно, как и мРНК прокариотов. У вирусов эукариотов с позитивно-полярным геномом независимо от морфологии (палочковидные, икосаэдрические, оболочечные) РНК нередко имеет кэп-структуру на 5’-конце и поли (А)-последовательность на 3'-конце молекулы, а у вирусов растений нередко вместо поли (А)-последовательности к 3'-концу прикреплена ковалентно одна из тРНК.
У 4 групп вирусов — пикорнавирусов, вирусов групп мозаики южных бобов, мозаики коровьего гороха и кольцевой пятнистости табака — вместо кэп-структуры к 5'-концу молекулы РНК прикреплен ковалентно небольшой белок (полипептид), который не играет никакой роли в трансляции, поскольку РНК, образующая полирибосомы, вначале лишается этого белка. Группа калицивирусов в этом отношении сходна с 4 названными группами вирусов, так как не имеет кэп-структуры, хотя не имеет и 5'-терминального полипептида, стратегия генома этой группы вирусов имеет отличия oт таковой рассматриваемых 4 групп вирусов (см. табл. 6), Поэтому напрашивается вывод о том, что пикорнавирусы, собемавирусы, комовирусы и неповирусы имеют общее происхождение, являясь дериватами сравнительно поздних, эукариотов — насекомых, млекопитающих, высших растений. Возможно, насекомые явились «передатчиками» своих вирусов животным и растениям или же переносчиками этих групп: вирусов от растений животным, о чем свидетельствует передача некоторых комовирусов насекомыми. Переносчиками неповирусов могут быть нематоды, у которых пока не обнаружены, вирусы, хотя, можно не сомневаться, что они существуют. Сходство структуры и стратегии геномов 4 групп вирусов, поражающих насекомых, млекопитающих и высшие растения, позволяет отнести время их возникновения к сравнительно позднему периоду эволюции органического мира.
Таблица 6. Рибовирусы, позитивные геномы которых ковалентно связаны с белком
Вместе с тем становится понятным, что такой признак, как фрагментарность генетического материала и даже мультипартитность вирусов, является не столь уже важным в плане- эволюционной систематики.
О возможном источнике происхождения по крайней мере некоторых РНК-содержащих вирусов свидетельствуют результаты опытов по гибридизации их РНК с рибосомными и другими клеточными РНК.
Так, РНК вирусов полиомиелита, Менго и Коксаки гибридизуются с 28S и 185 РНК высших эукариотов, но не низших (дрожжей), и прокариотов, причем это не было связано с гибридизацией участков, богатых Г + Ц [McClure М., Реrrault J., 1985]. Затем в жестких условиях была проведена гибридизация геномов вирусов Синдбис, везикулярного стоматита и реовирусов с 285 РНК клеток HeLa. М. McClure и J. Perrault (1986) - полагают, что феномен «Patchy complementary» лежит в основе полученных ими результатов, которые были дополнены опытами по взаимной гибридизации геномов. При этом были выбраны вирусы с разной величиной, и разной стратегией геномов: позитивно-полярный вирус Синдбис (11,7 кб), мультисегментный реовирус с двунитевой РНК (23 кб) и негативно-полярный вирус везикулярного стоматита (11,2 кб). В опытах по взаимной гибридизации были получены положительные результаты гибридизации геномов реовируса и вируса Синдбис с геномом полиовируса. Необходимо, однако, отметить, что гибриды были получены как с VSV (—) РНК и 28S РНК, так и VSV (+)РНК и 285 РНК. Что же касается реовируса, то гибридизация рибосомных РНК происходила с большими (L) фрагментами генома реовируса, причем реовирусная РНК гибридизовалась как с 28S, так и с 18S рибосомной РНК. Полученные данные можно трактовать по-разному: либо речь идет об эволюционной (отдаленной) общности, либо о возможной репликации вирусных и клеточных РНК, либо гибридизация отражает особенности вторичной структуры РНК рибосом и вирусов.
Возвращаясь к пикорнавирусам, отметим следующее. Вирус паралича сверчков оказался серологически близким к вирусу энцефаломиокардита мышей. Первый вирус был выделен сначала в Австралии от сверчка Teleogryllus Oceanian, он вызывал у нимф паралич задних ног, а затем смерть. Потом его обнаружили у нескольких видов. CrPV и DCV серологически родственны, остальные вирусы изучены плохо. Механизмы репликации исследованы мало. Что же общее для грызунов и сверчков? Может быть то, что мыши иногда поедают этих насекомых? Любопытно также, что некоторые пикорнавирусы насекомых нейротропны и вызывают паралитические заболевания (вирусы паралича пчел). Не обеспечивает ли специализация в виде нейротропности возможность выхода пикорнавbрусов в новые экологические ниши — завоевание новых «хозяев»?
Небезынтересно отметить, что антитела против вируса паралича сверчков обнаружены у свиней, лошадей и рогатого -скота в Новозеландии [Scotti Р., Longworth J., 1980]. Причем эти антитела относятся к IgM, что свидетельствовало о недавно перенесенной инфекции, а в Малайзии (чаще) и Великобритании (реже) в сыворотке крови людей были обнаружены преципитирующие антитела против вируса Dama trima, относящегося к группе Nudaurelia ß [McCallum F. et al.? 1979].
К пикорнавирусам отнесены многие вирусы, поражающие насекомых. В обзоре М. Moore и соавт. (1985) упомянуты 22 таких вируса, у которых морфология, размер генома и виды белков в общем укладываются в рамки семейства пикорнавирусов. Однако только три из них — вирус Gonometa, вирус паралича сверчков и вирус дрозофилы С — отнесены к собственно пикорнавирусам, остальные пока остаются неклассифицированными.
Вообще же эта группа вирусов, с одной стороны, распространена среди насекомых, с другой — поражает многие виды млекопитающих, поскольку серологически «следы» инфекции обнаружены у многих из них — свиней, лошадей, слонов. Вирус паралича сверчков, выделенный в Австралии, оказался тождественным вирусу дрозофилы С [Reingenum С., Scotti Р., 1976]. Однако большинство вирусов насекомых не имеют серологического родства между собой [Moore М. et al., 1985].
К сказанному надо добавить, что пикорнавирусы могут длительно персистировать в тканях нервной системы [Вга- hic М. et al., 1985].
Поскольку многие пикорнавирусы, поражающие человека, имеют аналоги, поражающие млекопитающих, можно предположить, что эволюция их шла вместе с эволюцией млекопитающих. Причем наряду с внутривидовой эволюцией приматов, обезьян, человека был возможен обмен генами между более отдаленными видами, например, человеком и прирученными домашними животными или заселившими жилища грызунами.
Среди пикорнавирусов выделяют 4 рода, представители которых имеют более сходные черты в пределах рода, нежели между разными родами. Четко очерчен род афтовирусов — вирусы ящура, 7 сероваров которых близки между собой и по тонкому строению генома, и по кругу «хозяев» (парнокопытные), и по характеру вызываемых инфекций [Brooksley J., 1982]. Это, несомненно, обособившаяся зволюционно ветвь-вирусов, поражающих млекопитающих. Столь же обособленрод кардиовирусов — и по тонкому строению генома, и по серологическим связям, по которым три мышиных вируса (EMC, Megro, ME) надо дополнить неожиданно сходным серо- логически вирусом паралича сверчков, настолько близким к вирусу энцефаломиокардита мышей, что оба вируса могут трактоваться как штаммы одного и того же вируса [Tonslav Т. et al., 1984].
То же самое следует сказать и о роде риновирусрв. Среди 113 риновирусов, поражающих человека, отмечаются сложные антигенные связи, а сами они имеют выраженный тропизм к дыхательным путям. Обилие риновирусов человека нейдет ни в какое сравнение с немногими риновирусами домашних животных (два коровьих и два лошадиных). Учитывая воздушно-капельный путь передачи риновирусов человека и острый характер вызываемых ими инфекций, следует думать о сравнительно позднем происхождении этих вирусов. Они могли возникнуть при довольно развитом обществе, с плотно населенными городами и интенсивно общающимся населением. Многочисленность сероваров риновирусов человека свидетельствует об интенсивно продолжающейся их эволюции. Что же касается риновирусов животных, то скорее следует думать о передаче их от человека к стойловым животным. Содержание коров и лошадей в стойле допускает возможность передачи заболеваний не столько воздушнокапельным путем (инфекции говорящих существ — людей), сколько через ведра и кормушки.
Наиболее пестрым по патогенезу вызываемых болезней является род энтеровирусов, для которых главным местом размножения служит кишечник. Поэтому можно полагать, что эволюция этих вирусов могла идти как сопряженно с эволюцией «хозяев» (энтеровирусы обезьян и человека), так и путем межвидовых обменов (грызуны, домашние животные, люди). К сожалению, пока не представляется возможным не только составить родословное древо этой большой группы вирусов, но и хотя бы наметить межвидовые переходы. Вероятно, с помощью исследования геномов данных вирусов этот вопрос будет решен в ближайшее время.
С этой точки зрения интересны результаты сравнительных исследований вируса ECHO 9 и двух риновирусов (IA и 14СР): их протеаза в высокой степени консервативна и в то же время отличается от протеазы вирусов животных (ЕМС, вирус ящура) и растений (вирус коровьего гороха). Очень сходны белки VPg. Трехмерная структура у сравниваемых вирусов также сходна [Werner G. et al., 1986].
Впрочем, некоторые соображения можно уже высказать. Например, вирусы Коксаки А патогенны для грызунов, что может указывать на источник их происхождения. Среди вирусов Коксаки В один из них (В5) весьма близок к вирусу везикулярной болезни свиней. Вирусы ECHO патогенны только для человека и обезьян, что также вряд ли случайно; то же относится к вирусам полиомиелита и гепатита А. Итак, даже имеющаяся информация может дать повод для размышлений о том, где могла иметь место внутривидовая эволюция, а где межвидовые переходы. Естественно, что более точные данные дают молекулярно-биологические исследования. Показано, что белки VP3 и 2с наиболее консервативны. Выявлена близость группы полиовирусов и вируса Коксаки А21, менее выраженная близость с вирусами Коксаки В1 и В3 [Emini et al., 1985].
Вирусы Коксаки и вирусы ECHO, развиваясь в кишечном тракте, могут поражать и другие ткани — мышцы, паренхиму внутренних органов, ткань нервной системы, будучи таким образом, не только энтеротропными, но и пантропными. При этом клиническое течение болезней варьирует как по выраженности (бессимптомные, субклинические, манифестные формы), так и характеру (миалгии менингиты, менингоэнцефалиты, невриты и др.). Наряду с этим имеются явно нейротропные вирусы (вирусы полиомиелита), гепатотропные (вирусы гепатита А) и даже вирус геморрагического конъюнктивита, а у мышей кардиотропные вирусы.
Возможные пути становления тропности были изучены у вирусов Коксаки В и полиомиелита. При изучении вирусов Коксаки В была показана гетерогенность их природных популяций, при этом некоторые антигенные варианты были связаны с изменениями тканевого тропизма, а также с кругом восприимчивых «хозяев». Последнее было выявлено при «сравнении иммунологически родственных вирусов Коксаки В5 человека и вируса везикулярной болезни свиней (серологически и методом молекулярной гибридизации) [Brown F. et al., 1976]. Далее, оказалось, что диабетогенный штамм вируса Коксаки В4, выделенный от больного, был ближе к варианту этого вируса, пассированного на ß-клетках, нежели к исходному прототипному вирусу [Yeon J. et al., 1979]. С помощью метода моноклональных антител было показано, что вирусы Коксаки В4, изолированные от больных, обнаруживают значительную гетерогенность. Среди выделенных серологических вариантов были отмечены штаммы с выраженной кардиотропностью, вызывающие миокардиты, причем эти свойства коррелировали с резистентностью к нейтрализации определенными клонами антител [Cao Y. et al., 1984]. Эти данные указывают на возможность селекции вариантов энтеровирусов с разной патогенностью и различным тканевым тропизмом.
При более детальном изучении нейротропности вирусов полиомиелита выявлено, что при рекомбинации двух вирусов и получении рекомбинднта, у которого 5'-половина генома была от нейровирулентнного штамма серовара 3, а 3'-половина — от аттенуированного штамма серовара 1, нейтротропность сохранялась независимо от ts-мутаций в вирулентной половине [Agol V. et al., 1985]. С этими данными согласуются результаты сравнительного секвенирования геномов вирулентного и аттенуированного штаммов полиовируса серовара 1: наибольшие изменения мутации (кластер мутаций) вызвали в белке VP1, в NН2-терминальной части его молекулы [Nomoto A. et al., 1982].
Связь нейротропности с капсидными белками была также продемонстрирована при аналогичном исследовании вариантов полиовируса серовара 2 (Лансинг), невирулентных и нейровирулентных для мышей [La Monica N. et al., 1986].
Была прослежена эволюция энтеровируса типа 70, вызывающего геморрагический конъюнктивит. Для этого сравнивали штаммы, выделенные в 1971—1981 гг. Были установлены прогрессирующие с годами изменение олигонуклеотидных карт и дивергенция штаммов вируса. N. Takeda и соавт. (1984) пришли к выводу о том, что вирусы имели общего предка, возникшего в 1966 г. в Африке, за 3 года до первой эпидемии в Аккре (Гана). За 10 лет изменилось 4% оснований генома вируса.
К проблеме «эволюция на наших глазах» относится появление энтеровируса 71, вызвавшего, с одной стороны, эпидемии болезни рук, стоп и рта (Hand, foot, mouth, disease — HEMD), с другой стороны, эпидемии поражения центральной нервной системы с тяжелым течением и летальными исходами. Генетическое исследование штаммов вирусов, вызвавших столь разные синдромы, не обнаружило существенных различий между этими штаммами [Hagiwara A. et al., 1984].
Подводя итоги, можно предположить, что энтеровирусы, объединенные в один род, на самом деле имеют полифилетическое происхождение. Поэтому классификационные признаки, на основании которых они выделены в отдельный род, несущественны. Можно также предположить, что группа вирусов Коксаки «пришла» к человеку от мышевидных грызунов, в этом случае кардиотропность сближает их с кардиовирусами. Однако сходство одного из вирусов Коксаки со свиным вирусом указывает на возможность перехода их от домашних животных к человеку, если не имел место противоположный процесс.
Основная группа вирусов ECHO и энтеровирусов человека могла быть получена им от предков (приматов) и пройти коэволюцию с человеком. Остается рассмотреть эволюцию- таких сложившихся групп, как вирусы полиомиелита и вирусы гепатита А.
Возможность отбора нейтротропных штаммов энтеровирусов была рассмотрена. Какие эволюционные преимущества могли получить такие вирусы, сказать трудно, а вернее будет ответить — никаких. Скорее речь может идти о случайном отборе, «зафиксировавшем» нейротропность. Последняя ничуть не вредила сохранению биологического вида вируса, так как полиомиелит чаще всего протекает как бессимптомная кишечная инфекция, а его проявления в виде поражения центральной нервной системы нечасты. И все же трудно расстаться с мыслью о неслучайном появлении нейротропных энтеровирусов, которыми являются вирусы полиомиелита. Существование трех сероваров, вызывающих одну и ту же болезнь, выраженная гомология между этими тремя вариантами, позволяющая выделить их среди других многочисленных энтеровирусов, возможность межтиповых рекомбинаций между ними — все это свидетельствует о монофилетическом происхождении трех вирусов и о каком-то, до сих пор непонятном естественном отборе, вызвавшем их появление и; эволюцию.
Дальнейшая история полиомиелита более или менее ясна. Полиомиелит мог возникнуть, когда человек перешел к оседлому образу жизни и жилища его заселили грызуны. Длительность носительства допускала возможность укоренения его в период варварства. И действительно, первые свидетельства о полиомиелите относятся к IV в. до новой эры (Египет). В книге Гиппократа об эпидемиях имеются довольно точные описания полиомиелита. Существующие в настоящее время три разновидности болезни, вызываемые разными вирусами, по-видимому, являются результатом длительной эволюции.
История полиомиелита в прошлом не была драматичной, что можно объяснить невысокой восприимчивостью людей к нему, в результате чего «паралитические» заболевания составляют ничтожный процент заражений. Полиомиелит стал привлекать внимание в XX в., особенно в годы Второй мировой войны, когда он стал распространяться пандемически. В некоторых странах насчитывались десятки тысяч заболевших.
Борьба с полиомиелитом обрела прочную основу после того, как были получены эффективные профилактические вакцины — инактивированная вакцина Солка и живая вакцина Сэбина. Если первая обеспечивала возможность индивидуальной защиты (гуморальный иммунитет), то вторая, при иммунизации которой вырабатывается, кроме того, местная невосприимчивость кишечника к вирусам полиомиелита (как это бывает после естественной инфекции), позволяет влиять также на эпидемический процесс, ограничивая и даже полностью предотвращая циркуляцию возбудителей среди населения.
М. П. Чумаков разработал технологический регламент производства вакцины, что позволило в короткий срок полностью обеспечить нужды страны в препарате и экспортировать вакцину в 40 стран. В результате иммунизации всех детей эпидемический полиомиелит в стране был ликвидирован, хотя единичные случаи заболевания (особенно в среднеазиатских республиках) еще наблюдаются. Полиомиелит еще широко распространен в мире, особенно в странах с жарким климатом.
Самостоятельной эволюционной ветвью является вирус гепатита А человека, не имеющий аналогов среди вирусов животных. Геном этого вируса был секвенирован и сравнен с геномом вируса полиомиелита. В общем он оказался сходным. Однако выявлена небольшая гомология при сравнении с вирусом энцефаломиокардита и ящура. Все же он ближе к энтеровирусам, так как не имеет поли (Ц)-последовательности вблизи 5'-конца, характерной для больших по размерам геномов афто- и кардиовирусов [Baroudly В. et al., 1985]. При полном секвенировании оказалось, что геном вируса гепатита А2 содержит 7478 нуклеотидов, открытая рамка считывания начинается с 734-го нуклеотида и оканчивается на 7415-м нуклеотиде. Геном кодирует полипротеид с молекулярной массой 251 940 [Najarian R. et al., 1985].
Появление этой ветви эволюции более понятно. Инфекция клеток кишечного тракта «подкрепляется» поражением печени, что при сравнительно доброкачественном течении болезни резко повышает возможности циркуляции вируса среди людей. При довольно продолжительном инкубационном периоде интенсивность эпидемического процесса (не считая водные вспышки) снижается, поэтому эта инфекция могла «укорениться» уже в античном обществе.
Сходные по клинике и эпидемиологии болезни вызываются по крайней мере двумя морфологически похожими вирусами. Болезни получили довольно неудачное наименование — гепатиты ни А ни В, путь передачи через фекалии и оральный [WHO, 1973, 1975]. Существование трех сероваров вируса-гепатита А было предположено на основании результатов иммунологических и электронно-микроскопических исследований [Стаханова В. М. и др., 1980]. Новый серовар вируса гепатита А (точнее ни А ни В) обнаружили в Индии и других государствах Юго-Восточной Азии [Kane М. et al., 1984], а позже и в СССР — в Средней Азии [Balayan М. S. et al., 1983]. Недавно была описана [Кетиладзе Е. С. и др., 1986] вспышка аналогичных заболеваний в северной Туркмении. Они характеризовались тяжелым течением и высокой смертностью среди беременных женщин. Обнаруженный в фекалиях вирус был серологически отличен от вируса гепатита А и вируса, выделенного М. С. Балаяном. По-видимому, этот вирус тождествен вирусу, выделенному в Пакистане. Будущее покажет, являются ли эти вирусы сероварами вируса гепатита А или разными вирусами, систематическое положение которых пока неясно.
В настоящее время гепатит А широко распространен во» всем мире. В развивающихся странах пока не получено дешевых и эффективных вакцин для массовой профилактической иммунизации против этой инфекции, на пути их получения стоят большие трудности. Когда эти трудности будут преодолены, можно ожидать, что победа над гепатитом А будет столь же быстрой и эффективной, как победа над полиомиелитом.