Эволюция вирусов - Жданов В. М. 1990
Специальная часть
Ретровирусы
Большая группа ретровирусов — семейство Retroviridae— представляет собой довольно компактную группу вирусов, построенную по одному плану [Matthews R., 1982]. Геном их состоит из инвертированного димера — линейных однонитевых РНК с позитивной полярностью, связанных 5'-концами с помощью водородных связей между парами нуклеотидов. На 5'-концах имеются кэп-структуры m7GbpppG5'NmpNp, а на 3'-концах— поли (А)-последовательности. Молекулярная масса каждой нити РНК около 3х106, она составляет около 2% массы вирионов. На обоих концах имеются терминальные повторы. На расстоянии около 100 нуклеотидов от 5'-конца с помощью водородных связей между парами оснований прикреплена клеточная тРНК, разная у различных ретровирусов, которая служит праймером для обратной транскрипции.
У всех вирусов этого семейства геном устроен одинаково и содержит 3 гена и соответственно 3 открытые рамки считывания. Вблизи 5'-конца расположен ген, кодирующий синтез внутренних белков (gag), затем — ген, кодирующий синтез обратной транскриптазы (pol), и около 3'-конца— ген, кодирующий синтез поверхностных белков (env). Ген pol ретровирусов птиц содержит также ген для синтеза эндонуклеазы (32 000), которая играет определенную роль в. процессе интеграции, удаляя нуклеотиды с концов LTR [Grandgenett D. et ah, 1986]. У разных групп ретровирусов могут быть и другие гены: у онкогенных вирусов обычно вблизи 3'-конца — онкогены, у лентивирусов (СПИД) между генами pol и env — ген фактора трансактивации. В целом же геном ретровирусов напоминает транспозоны прокариотов. РНК ретровирусов неинфекционна.
Вирионы имеют сферическую форму, диаметр 80—100 нм. Капсид икосаэдрический, содержит спиральный рибонуклеопротеид, заключенный во внутреннюю белковую мембрану, окружен наружной липидной оболочкой, в которую встроены наружные гликопротеиды в виде выступов с диаметром 8 нм. Морфологически вирионы выглядят в виде плотного нуклеоида, окруженного двумя оболочками.
Репродукция вирусов осуществляется следующим образом. Гликопротеиды внешней оболочки взаимодействуют с рецепторами клеточной мембраны, и вирионы проникают в клетку в результате слияния вирусной и клеточной мембран. Затем происходит обратная транскрипция вирионной РНК в двунитевую ДНК в результате синтезов РНК — ДНК, ДНК — ДНК и разрушения исходной матрицы РНК, в результате чего образуется линейная ДНК с большими терминальными повторами (5'3'— 3'5'). ДНК приобретает циркулярную форму и интегрирует в ДНК хромосом клетки наподобие транспозонов прокариотов. После этого происходит транскрипция интегрированной ДНК с помощью клеточной РНК-полимеразы II, в результате чего образуются как дочерняя вирионная РНК, так и мРНК. Последние проходят сплайсинг, после чего взаимодействуют с рибосомами, кодируя синтез вирусспецифических белков. Первичные полипротеиды расщепляются, в результате этого образуются зрелые функционально активные белки (рис. 30). Нуклеоид формируется путем самосборки, внешние оболочки формируются на клеточной мембране, и выход вирионов происходит путем почкования.
Семейство Retroviridae подразделяется на три подсемейства — Oncovirinae (РНК-содержащие опухолеродные вирусы), Spumavirinae (пенящие вирусы) и Lentivirinae (медленные вирусы группы maedi/visna). В свою очередь Оnсоvirinae подразделяются на 3 рода — вирусы типа С, В и D. В группах онковирусов типа С выделяют вирусы млекопитающих, птиц и рептилий. Однако это подразделение весьма условно, поскольку между онковирусами С, В и D существуют серологические связи, а между некоторыми вирусами типа С серологическое родство отсутствует. Неясно также, куда следует отнести вирусы HTLV-l, HTLV-11 (о HTLV-III/ LAV будет сказано ниже).
Одним словом, классификация ретровирусов еще далека от завершения и уже требует пересмотра.
Неясно и происхождение всей в общем довольно компактной группы ретровирусов. Компактной потому, что, во-первых, геном этой обширной группы вирусов устроен примерно одинаково, одинакова и его стратегия у разных вирусов, во-вторых, вирусы поражают в общем только высших позвоночных — пресмыкающихся, птиц и млекопитающих. Можно поэтому заключить, что эти вирусы возникли относительно недавно — не ранее, чем появились пресмыкающиеся.
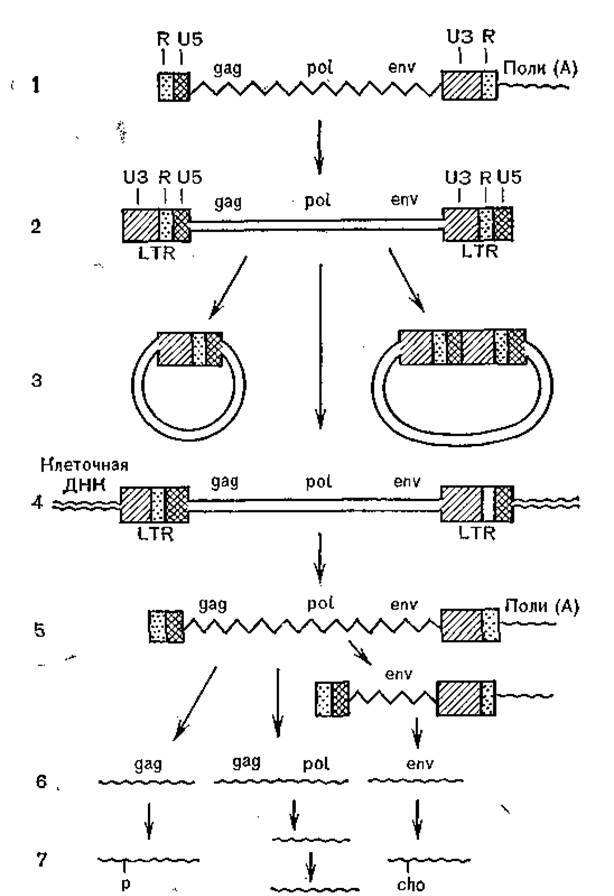
Рис. 30. Репликация генома ретровирусов и синтез вирусных белкой (схема).
1 — структура вирусного РНК-генома (одноиитевая РНК); — концевые повторы, U3, U5 — уникальные последовательности; 2 — структура иеинтегрированной (свободной) линейной ДНК (двунитевая); 3 — структура неинтегрированной (свободной) кольцевой ДНК (двунитевая); 4 — структура интегрированной ДНК (провируса); 5 — вирусная РНК (геномная и мРНК); 6— первичные продукты трансляции; 7 — зрелые-белки.
На самом же деле это не совсем так. У дрозофилы обнаружены сходные с ретровирусами частицы, содержащие PHК длиной 5 кб, гомологичную подвижным генетическим элементам (транспозонам) copia, находящимся в хромосомах [Shiba Т., Saigo К., 1983]. Цитированные исследователи предполагают, что эти вирусоподобные частицы (VLP) представляют собой дефектный вирус дрозофилы, их геном интегрирован в ДНК хромосомы «хозяина». Характерно, что РНК этих частиц может индуцировать синтез полипептидов, которые преципитируются анти-VLР-сывороткой, в частности, главный белок с молекулярной массой 31 000. В этих частицах обнаружена активность обратной транскриптазы. Фермент функционирует в присутствии двухвалентных катионов, стимулируется poly (rA)∙oligo(dT) и его активность снижается в присутствии рибонуклеазы. Что же касается генетического элемента copia, то он состоит из внутреннего сегмента длиной 4,5 кб с длинными терминальными повторами, ограниченными динуклеотидами 5'-TG — СA-3' и фланкированными короткими повторами «хозяйской» ДНК. Также обнаружено, что подвижный генетический элемент дрозофилы 17,6 высокогомологичен РНК вирусов птичьих лейкозов — саркомы [Kugimiya W. et al., 1984] дрозофилы есть также гены, гомологичные онкогенам src и abl (ем. ниже). Если также учесть, что структура геномов ретровирусов сходна со структурой бактериальных транспозонов, то происхождение ретровирусов не представляется столь однозначным. При изучении локуса TL большого комплекса гистосовместимости (клеточного генома мышей, клонированного в плазмидах и космидах) были выделены две последовательности: TLev2, гибридизируемая с областью pol провируса AKR, и TLevl, гибридизируемая с областями gag, pol и env провируса AKR [Pampeno С., Meruelo D., 1986]. К этому уместно добавить, что в нормальных клетках плаценты, злокачественной опухоли прямой кишки и молочной железы найдены последовательности, соответствующие гену env млекопитающих, кодирующему синтез белка gp70 [Robson A. et al., 1985], и даже последовательности полного генома предполагаемого ретровируса человека [Repaska R. et al., 1985].
При исследовании библиотеки ДНК человека оказалось, что имеется 30—40 копий родства (52% гомологии) гену pol MMTV\Deen К., Sweet R., 1986].
Согласно Н. Temin (1982), длинные терминальные повторы (LTR), находящиеся на обоих концах проретровируса: клетка — U3 R U5 — кодирующая последовательность — U3 R U5 — клетка — выполняют несколько функций: обеспечение синтеза вирионной РНК, синтеза вирусной мРНК, обратной транскрипции вирионной РНК обратной транскриптазой и интеграции вирусной ДНК в клеточную ДНК. LTR образуется во время обратной транскрипции путем копирования регионов U5 и R от 5'-конца вирусной РНК и переноса их к 3'-концу вирусной РНК. Затем они действуют как праймер для копирования региона на 3'-конце вирусной РНК, делая одну копню LTR. Затем эта копия служит матрицей для синтеза другой копии LTR, которая переносится к 5'-концу вирусной РНК [Temin Н., 1981] (рис. 31). LTR имеет гомологию с 5'-некодируюгцим и 3'-некодирующим регионам эукариотических генов, что указывает на возможную их роль в транскрипции РНК. Они также имеют гомологию с клеточными мобильными генетическими элементами, что свидетельствует об их возможной роли в интеграции. Таким образом, LTR имеет последовательности, которые делают ретровирусы автономно реплицирующимися элементами, т. е. «вирусами».
Гипотеза Н. Temin критикуется. Оппоненты исходят из того, что эндемичные ретровирусы являются нормальными компонентами клеток, предназначенными для переноса генетической информации в организме, они способны собираться в вирусный геном. А. Д. Альштейн и Н. В., Каверин (1980) считают, что все ретровирусы имеют общее происхождение и дивергировали в ходе эволюции.
Можно предположить, что вирусы, имеющие РНК-геном и реплицирующиеся через обратную транскрипцию, возникали на разных этапах развития органического мира и источником их возникновения явились мобильные генетические элементы (транспозоны). Вряд ли можно вести происхождение ретровирусов позвоночных от вирусоподобных образований насекомых, обнаруженных у дрозофил; скорее речь здесь может идти о полифилетическом их происхождении и молекулярной конвергенции. Их транспозонобразующаяся структура, свойство мобильности и интеграбельности явились исходным свойством, объединяющим транспозоны прокариотов, мобильные генетические элементы растений и животных. Вероятно, решающим моментом их эволюции явилось формирование гена обратной транскриптазы и возможность появления РНК как автономной генетической структуры.
Обратная транскрипция присуща и нормальным клеткам эукариотов, особенно растениям, ее наличие у животных было спорным. В этом плане заслуживают упоминания другая группа вирусов — гепаднавирусы и их аналоги среди вирусов растений, что будет специально рассмотрено в соответствующей главе. Поэтому ретровирусам не надо было «изобретать» обратную транскрипцию, достаточно было усовершенствовать предшествовавшую в клетках систему. Такое событие могло происходить неоднократно, как на более ранних (насекомые), так и более поздних (позвоночные) этапах эволюции органического мира. Но возможны и другие пути эволюции ретровирусов, например, передача их от насекомых позвоночным. Специальные исследования, направленные на поиски ретровирусов у насекомых и в других группах беспозвоночных, а также на изучение гомологии их геномов, позволят выяснить возможные пути их происхождения.
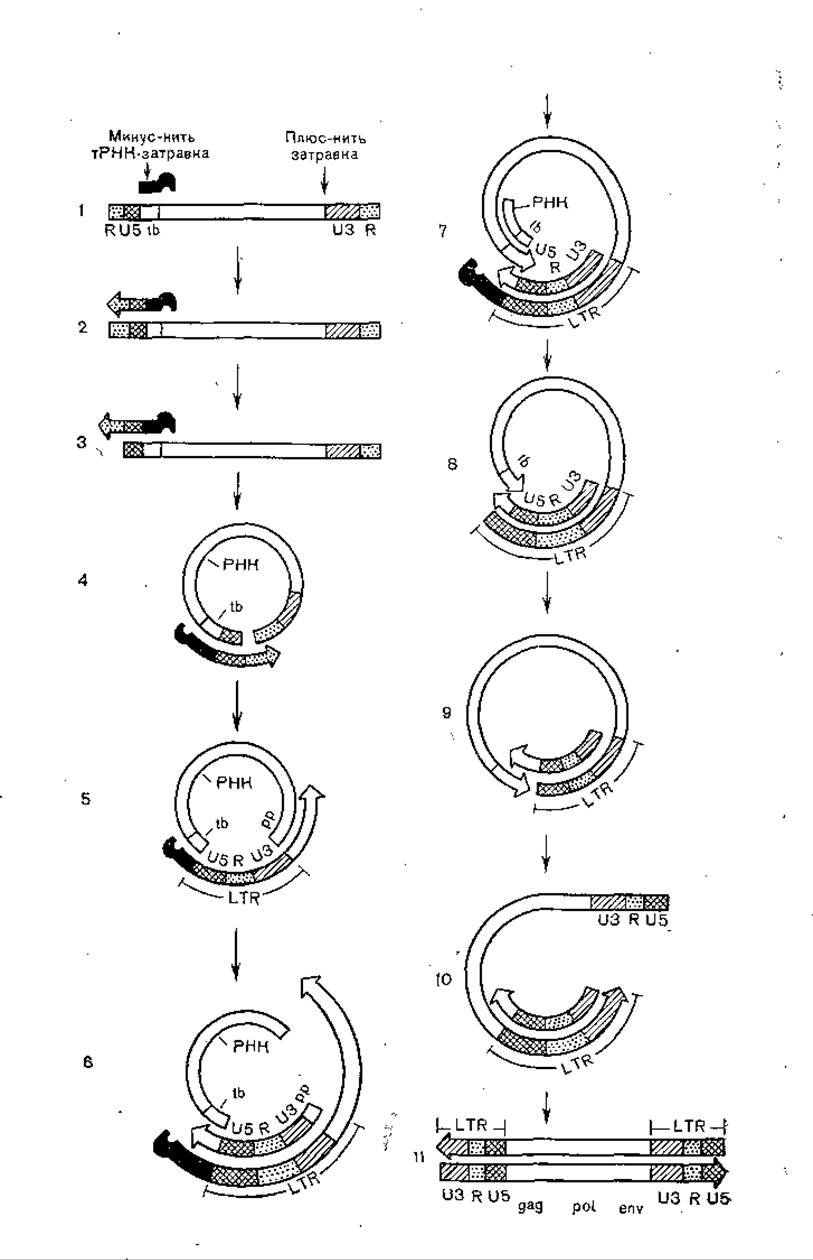
Рис. 31. Этапы репликации генома ретровирусов от РНК до свободной двунитевой линейной ДНК.
tb— участок связывания шРНК, рр, плюс-нитевая затравка; 1 — структура геномной РНК, стрелками показаны минус-нить, тРНК-затравки и плюс-нить затравки; 2 — синтез минус-нити ДНК; 3 — РНКаза Н разрушает 5'ДРНК в гибриде РНК: ДНК; 4 — минус-нить RД НК связывается с 3'RРНК; 5 — синтез минус-нити ДНК от 3'-коида РНК матрицы; 6 — начало синтеза плюс-нити ДНК (LTR+tb); 7 — синтез минус-нити ДНК через tb; 8 — РНКаза Н разрушает tb РНК в гибриде РНК: ДНК: 9 — минус- нить tb связывается с плюс-нитью tb: 10 — синтез второй (левой) минус-нити LTR на матрице плюс-нити ДНК; 11 — синтез плюс-нити ДНК.
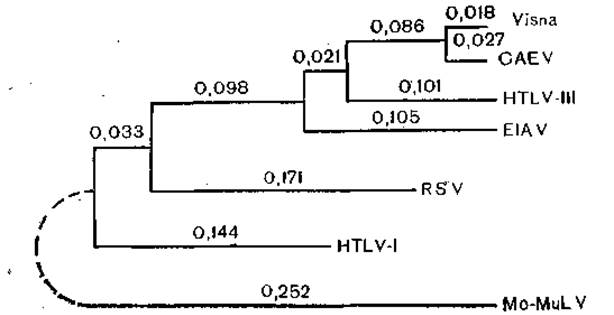
Рис. 32. Филогенетическое древо взаимоотношений лентивирусов с ретровирусами, основанных на первичной структуре гена pol. Длина ветвей соответствует единицам М, где М — частота совпадающих нуклеотидов.
В некоторых работах были суммированы данные о вирусах и других генетических элементах, с которыми связана активность обратной транскриптазы. Круг их оказался широким, включая ретровирусы, гепадна- и каулимовирусы, внутрицистернальные частицы А, гены VL30, транспозонообразные элементы Ту дрожжей, гены дрозофилы, генетические элементы Bs1 и Cin1 кукурузы. Все эти структуры сходны с интегрированными ретровирусами. На рис. 32 [Hull, Covey, 1986] схематически представлены некоторые из этих элементов.
Теперь остановимся на возможных путях эволюции разных групп ретровирусов и прежде всего наиболее изученной группы онковирусов.
Происхождение ретро-, гепадна- и каулимовирусов проанализировано Hull и Covey (1986). Авторы обратили внимание на сходство РНК-геномов (или соответственно РНК- стадий ДНК-содержащих вирусов) названных вирусов с геномами внутрицистернальных частиц А позвоночных, а также некоторых транспозабельных элементов типа элементов copia дрозофилы, DIRS-1, элементов дактиостелий, элементов кукурузы Bsl и Cinl и элементов Ту дрожжей. Для всех них характерны обратная транскрипция РНК в ДНК и наличие в геноме этих вирусов элементов обратной транскриптазы. На рис. 33 представлена генетическая организация этих транспозонов, плазмид и вирусов. Как видно, общими для них являются два сцепленных, а иногда перекрывающихся гена — ген gag, кодирующий синтез белка (или белков), связывающегося с геномом (РНК или ДНК), а также ген полимеразы, обеспечивающий либо копирование генома, либо его транскрипцию, либо обратную транскрипцию (все эти функции обеспечиваются продуктом гена pol, в составе которого имеется протеаза и эндонуклеаза или активные сайты, обеспечивающие эти функции). У транспозабельных элементов copia дрозофилы и элементов Ту. дрожжей геном больше ничего не содержит, так как эти элементы распределяются между дочерними клетками при их делении, а у дрозофилы — также по клеточным анастомозам. Отметим также, что у всех сравниваемых вирусов и транспозабельных элементов, за исключением, может быть, копиеобразных элементов 17,6 дрозофил, на обоих концах молекулы РНК (ДНК) имеются терминальные повторы.
Уже у элементов 17,6, а также у всех вирусов появляется третий ген — env, кодирующий синтез белков, которые взаимодействуют с рецепторами клеточных мембран и поэтому обеспечивают возможность горизонтального (из клетки в клетку, из организма в организм) перехода вируса или соответственно транспозона. У различных сравниваемых представителей этот процесс происходит по-разному. У транспозонов 17,6 появляется дополнительный ген, аналогичный генам env ретровирусов. У онковирусов (вируса саркомы Рауса), помимо него, обычно захватывается и усваивается также ген one (хотя, как это показано на примере вируса лейкемии Молони, не обязательно). Более сложные соотношения наблюдаются у вирусов Т-клеточного лейкоза (дополнительная область А) (рис. 34) и особенно у вируса иммунодефицита человека (ВИЧ). У последнего имеется трансактивирующий ген (tat-III), экопрессирующийся путем сложного механизма сплайсинга. Не менее сложно устроен относительно крупный геном вируса цветной мозаики капусты у которого тандему gag — pol — env предшествует группа четырех генов (VII, I, II, III), обеспечивающих структуры, в области которых происходит обратная транскрипция и сборка вирионов (рис. 35).
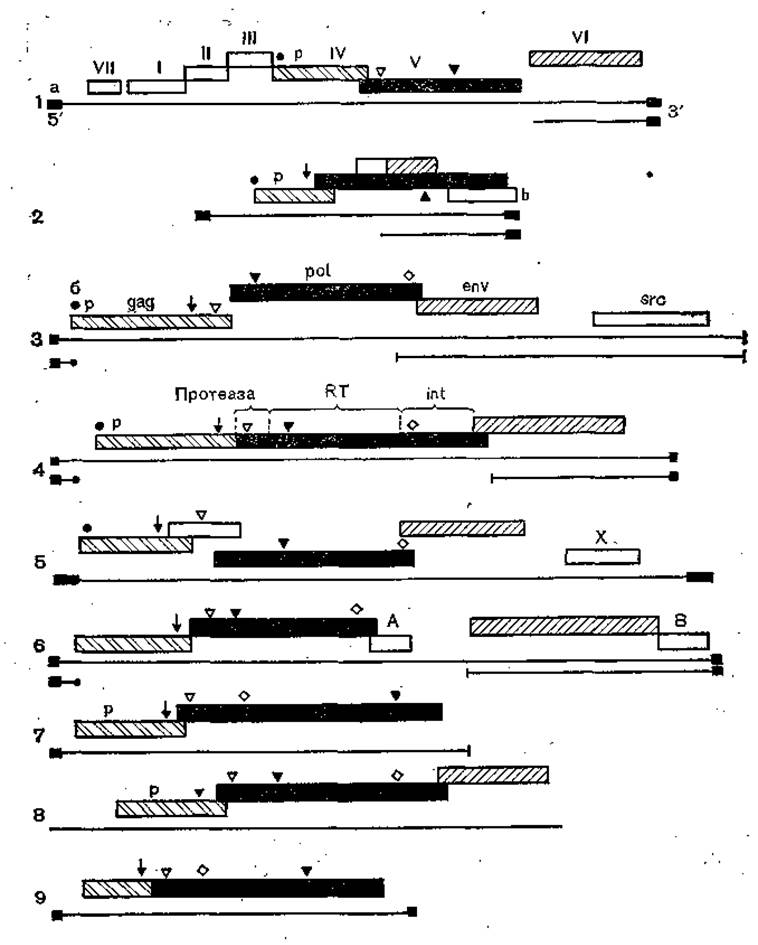
Рис. 33. Организация геномов вирусов мозаики цветной капусты (1), гепатита земляной белки (2), саркомы Рауса (3), лейкемии мышей Молони (4), HTLV-II (5), HTLV-III (6), Tу-элемента дрожжей (7), copia-элементов дрозофилы 17,6 (8) и copia дрозофилы (9).
I—VIIА, В, X, gag, pol, env, src — гены; а — концевые повторы; б — гидрофобные ооласти; ЦТ — обратная транскриптаза; int — иитеграза; стрелками показаны области связывания; Р — фосфопротеид; субгеиомиые РНК показаны под геномными РНК
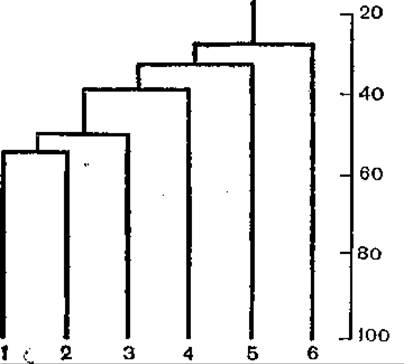
Рис 34. Филогенетическое древо геномов онковирусов. По оси ординат — гомология последовательностей аминокислот (в %).
1 —SMRV (D); 2 — MMTV (В); 3 — IAР (A); 4 — RSV (A—С); 5 — HTLV-1; 6 — MuLV (С).
В свете этих данных происхождение ретровирусов и ДНК-содержащих вирусов с обратной транскрипцией в настоящее время представляется значительно и более древним, и более всеобщим, чем в недавнем прошлом, когда предполагалось, что они поражают лишь позвоночных, при том преимущественно теплокровных. Вместе с тем обратная транскрипция в свете этих данных является столь же древней, как простейшие эукариоты.
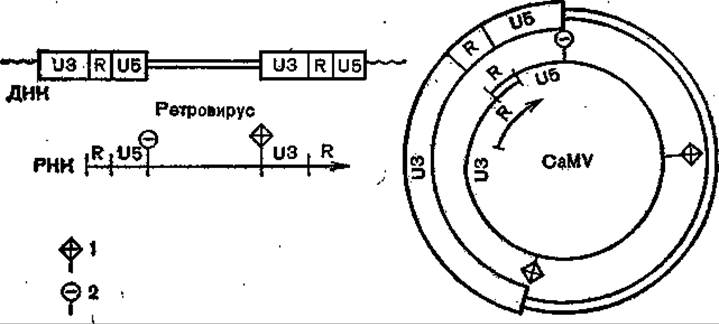
Рис. 35. Строение ДНК н РНК геномов ретровируса и вируса мозаики цветной капусты (схема).
1 - плюс-нить затравки; 2 — минус-нить в области связывания затравки.
Онковирусы
Онковирусы выделяются среди других ретровирусов выраженными потенциями вызывать неопластическую трансформацию клеток позвоночных животных — млекопитающих, птиц, пресмыкающихся. Строение генома онковирусов типично для такового других ретровирусов. На нити РНК последовательно располагаются три гена: 5'-gag — pol — env-3'. Стратегия генома включает обратную транскрипцию РНК в линейную двунитевую ДНК, причем происходит формирование длинных терминальных повторов. Линейная ДНК образует «кольцо», которое интегрирует в геном клетки «хозяина»; все дальнейшие события происходят, как и у других ретровирусов.
Синтез белков, кодируемый указанными тремя генами, осуществляется через образование полипротеидов и последующее их расщепление. Ген gag кодирует полипротеид Pr65gag, продуктами двустадийного расщепления которого являются белки Pr27gag (р15+р12) и Pr40gag (p30+p10). Протеолитическое расщепление обеспечивается вирионной протеазой, которая у онковирусов птиц ассоциируется с белком р15, «закодированным» у 3'-конца РНК. У онковирусов мышей протеаза закодирована в области gag — pol, состоит из 125 аминокислотных остатков и имеет молекулярную массу 13 315. Ее СООН-конец примыкает к NН2-концу обратной транскриптазы, а NН2-конец — к С-концу белка р10. В целом же этот участок генома выглядит следующим образом [Yoshinaka Y. et al., 1985]: 5'-р15—p12—р30—p10 — протеаза — обратная транскриптаза — эндонуклеаза — env-3'. Подобному расщеплению подвергаются и другие полипротеиды; полипротеид, кодируемый геном env, нарезается на гликопротеиды наружной оболочки.
Онковирусы обладают некоторыми особенностями, выделяющими их среди других ретровирусов, — способностью захватывать клеточные гены, с функционированием которых связан канцерогенез. С этой точки зрения онковирусы подразделяются на две группы — вирусы лейкоза, не имеющие онкогенов, и вирусы саркомы, имеющие онкогены. Причем нередко захват клеточных онкогенов сопровождается делениями вирусных генов, и такие вирусы являются дефектными, способными реплицироваться в присутствии полноценного родственного вируса-помощника. Не вдаваясь в подробности, напомним, что в вирусной теории рака [Зильбер Л. А. и др., 1975; Huebner R., Тобаго G., 1969] постулировано, что все неопластические процессы вызываются вирусами, в то время как другим факторам (канцерогены, радиация) принадлежит вспомогательна» роль. Несмотря на ошибочность этой посылки, данная теория сыграла большую положительную роль как в современном понимании молекулярных механизмов канцерогенеза, так и в выяснении механизмов трансформации, вызываемой онкогенными вирусами, в частности онковирусами.
Онковирусам придавалось особое значение в канцерогенезе, особенно после того, как было установлено существование наряду с экзогенными эндогенных онковирусов, интегрированных в виде провирусов во все клетки (включая половые) того или иного биологического вида и передающихся по закону Менделя. Эти провирусы в ходе эволюции могут стать дефектными по полимеразе или другим генам вследствие мутаций и в этом случае они уже не могут дать начало экстрахромооомным вирусам. Вместе с тем при введении в клетки сходных экзогенных вирусов, имеющих дефект по другим генам, возможны процессы рекомбинации между ними и появление таким образом полноценного по репликации рекомбинанта [Schwartzberg Р. et al., 1985].
Полный эндогенный провирус человека (ERV-3) был выделен из библиотеки генома человека с помощью гибридизации его с ДНК эндогенного вируса павианов и субклоном pol-env эндогенного провируса шимпанзе [O’Connell С. et al., 1984]. Он имеет выраженную гомологию с другими ретровирусами типа С и занимает один локус в хромосоме 7.
Несмотря на различия в онкогенных взаимодействиях с клеткой онковирусов и других ретровирусов, вероятно, любые из последних могут обладать онкогенными потенциями, и наоборот, такие типичные онкогенные вирусы, как вирус мышиного лейкоза Молони, может вызвать нейродегенеративные процессы [Bilello J. et al., 1986].
В дальнейшем было показано, что онковирусы могут быть ксено- и эктотропными. Первые поражают собственный вид, так как каждая клетка этого вида содержит провирус и не способна реинфицироваться этим же вирусом. Вторые являются вариантом первых, способным инфицировать клетки собственного вида. Затем было выявлено существование амфотропных вирусов [Cloyd М., Chattopadhyay S., 1986].
Развитие исследований онковирусов привело к идее о существовании онкогенов, продукты которых вызывают трансформацию клеток. Р. Duesberg и Р. Vogt (1973) обнаружили, что в геноме вируса саркомы птиц в отличие от генома вируса лейкоза птиц имеется дополнительный ген — фрагмент ДНК, который впоследствии был обозначен как ген src. Аналогичные гены были открыты у всех онковирусов, вызывающих, трансформацию клеточных культур и развитие опухолей у экспериментальных животных. Обычно, но не всегда, они локализированы вблизи 3'-конца генома онковирусов. Функциональные свойства продуктов этих генов разнообразны: одни из них обладают фосфопротеинкиназной активностью, другие сходны с рецепторами эпидермального фактора роста, третьи связывают ди- и тригуанидинфосфатазу, четвертые сходны с тромбоцитарным фактором роста, пятые локализируются в ядре. В табл. 15 приведены некоторые сведения об изученных онкогенах РНК-содержащих вирусов. Было также показано [Duesberg Р., 1983], что сходные гены, обладающие трансформирующей активностью, есть в нормальных клетках и, таким образом, онкогены РНК-содержащих вирусов имеют клеточное происхождение, что предполагалось и раньше [Vogt Р., 1972].
Некоторые онковирусы обладают повышенной способностью захватывать клеточные гены. Так, высокоонкогенный вирус ретикулоэндотелиоза птиц за счет делеций генов env, gag и pol включает в состав своего генома разные фрагменты клеточной ДНК, действуя в этом случае как сильный транспозон [Miller С., Temin Н., 1986]. В отличие от клеточных сложно устроенных генов вирусные онкогены построены более просто и содержат только кодирующие последовательности. В дальнейшем была показана не только высокая гомология между онкогенами онковирусов и онкогенами раковых и нормальных клеток, но и выраженный их консерватизм. Это было выявлено при сравнении онкогенов эволюционно отдаленных видов, например, птиц и млекопитающих и даже дрозофилы [Parada L. et al., 1982; Boyle W. et al., 1986].
При изучений вирусных и клеточных онкогенов оказалось, что они, возможно, играют определенную роль в дифференциации и трансформации. С этой точки зрения большой интерес представляет исследование онкогена, обнаруженного у птиц и человека, который оказался эволюционно высококонсервативным [Sheiness D., Bishop J., 1979].
Сходный с ним ген с-mус был обнаружен в клеточной линии HL-60, полученной от больного острым промиелоцитным лейкозом. В культуре этих клеток происходит дифференциация в макрофаги или гранулоциты под воздействием некоторых веществ. С помощью гена mуc удалось показать экспрессию гена с-mус как в неопластических, так и профилирующих нормальных клетках человека. В культуре клеток HL-60 этот ген амплифицирован до 16 копий с-mус, то же наблюдается и в первичных лейкемических клетках самого больного.
После открытия многочисленных вирусных онкогенов (v-onc) и установления их клеточного происхождения были обнаружены аналоги вирусных онкогенов — клеточные онкогены (с-оnс). Естественно, что эти онкогены имеют нормальные, пока недостаточно изученные функции. В некоторых случаях удалось показать, что клеточные онкогены играют существенную роль в эмбриональном развитии [Müller J. et al., 1982]. Это было продемонстрировано на примере вируса мышиной остеосаркомы (FBI), онкоген которого (v-fos) имеет клеточный аналог (c-fos). Продуктами обоих генов является белок с молекулярной массой 55 000. Экспрессия гена c-fos была обнаружена в периоде пренатального развития плаценты у мышей, в частности, в накоплении трофобластов, которые рассматриваются как псевдозлокачественные клетки. Наконец, было показано, что при инъекции миелоидных лейкемических клеток мышей в мышиные 10-дневные эмбрионы эти клетки участвуют в эмбриогенезе. В результате развиваются нормальные животные, их гранулоциты содержат маркеры, присущие введенным лейкемическим клеткам.
Таблица 15. Вирусные онкогены и их продукты
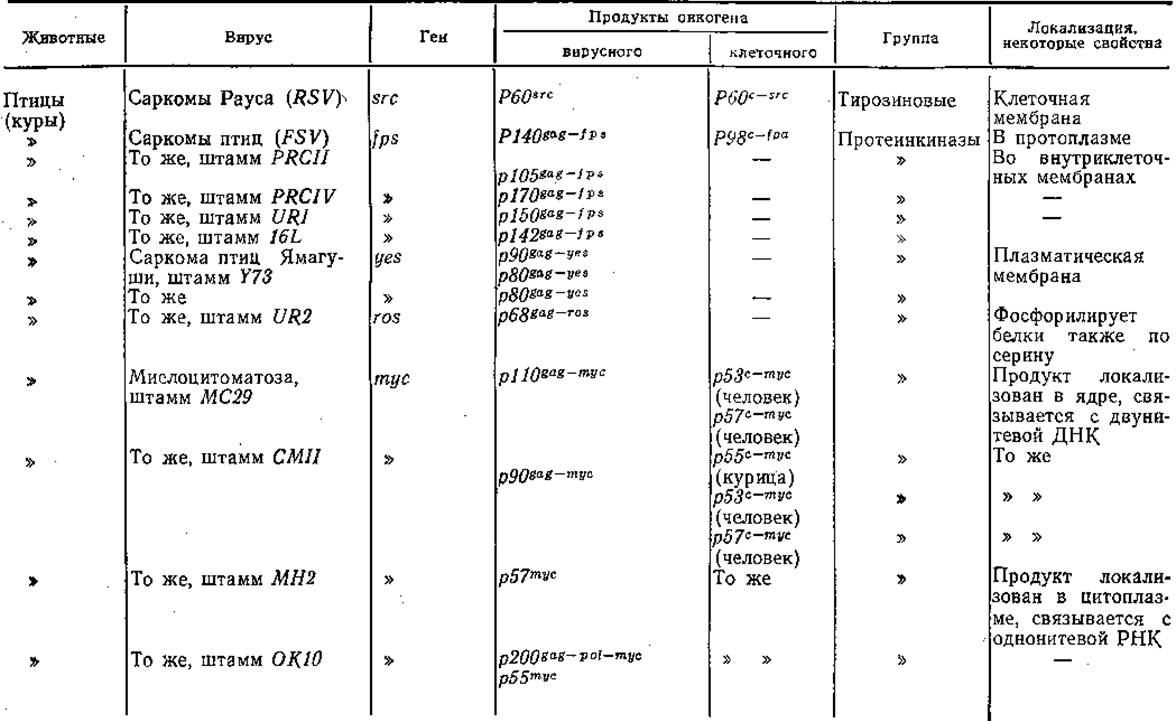

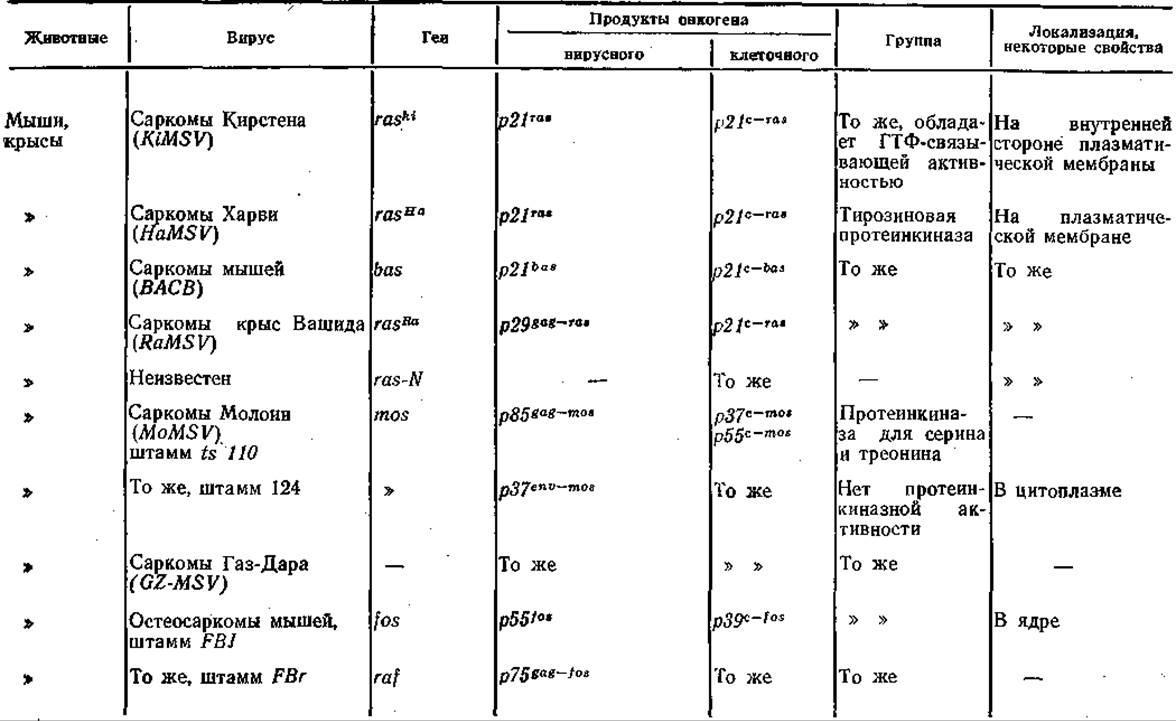

Примечание. Одни и те же клеточные белки (например, белок р53) могут играть важную роль в процессах как дифференциации, так и трансформации, приобретая при этом дополнительные эпитопы. Прочерк нет данных.
Так называемые онкогены на редкость консервативны. Так, белок pp60srcвируса саркомы Рауса перекрестно реагирует с клеточными белками рр60srс тканей птиц и млекопитающих [Parsons S. et al., 1984].
У дрожжей были обнаружены гены ras1 и ras2, обладающие высокой степенью гомологии с генами ras млекопитающих. У патогенных онковирусов эти гены вызывают трансформацию клеток, изменяя их пролиферативные свойства. В опытах с перемещением генов ras1 и ras2 показано, что сами они не являются существенными генами. Однако споры, содержащие гены ras1- и ras2-, не способны к вегетативному прорастанию [Kataoka Т. et al., 1984].
Хотя считалось, что онковирусы типа С обнаруживаются в эволюционном ряду начиная с пресмыкающихся, недавно частицы типа С были выявлены у щуки с эпидермальной гиперплазией, вызванной герпесвируcом [Yamamoto Н. et al., 1984]. Морфология и морфогенез их («почкование») типичны для онковирусов типа С.
В ДНК клеток человека обнаружены два семейства родственных ретровирусам последовательностей: сходные с геномами ретровирусов типа С, генами pol вирусов А и В млекопитающих и С (птиц), а также D [Horn Т. et al., 1986]. При изучении трансформирующего гликопротеида вируса саркомы обезьян (SSV) была показана иммунологическая близость его к тромбоцитарному фактору роста человека [Thiel Н., Hafenrichter R., 1984]. Показано также, что белок сердцевины ретровирусов имеет области гомологии и антигенного родства с фактором стимуляции предшественников эритроцитов (ЕРА) и тканевым ингибитором металлопротеаз (TIMP). При исследовании 6 ретровирусов птиц, млекопитающих и человека были найдены 4 консервативных домена, соответствующих ЕРА и ТІМР [Patarca R., Haseltine W., 1985]. В связи с этими находками сложились новые представления о канцерогенезе и роли протоонкогенов (нормальных клеточных генов), активных клеточных и вирусных онкогенов в канцерогенезе [Георгиев Г. П., 1981; Дубинин В. Б., 1984; Жданов В. М., 1984; Заборовский Е. Д., 1985; Cairns J., 1981; Bishop J., 1983].
В соответствии с этими представлениями, протоонкогены, являясь генами нормальных клеток, выполняют разнообразные функции, регулирующие рост и развитие клеток, которые находятся под строгим контролем. Причиной превращения их в онкогены, вызывающие злокачественную трансформацию клеток, являются мутации, перенос или встраивание под сильные промоторы, встраивание в транспозоны или онкогенные вирусы, где они выходят из-под контроля клетки.
Интеграция, экспрессия и туморогенез детально изучены на модели вируса рака молочных желез мышей [Ponta Н. et al., 1985], который передается вертикально и горизонтально. У мышей имеется, до 20 локусов в хромосомах, содержащих этот провирус или его отдельные гены. Провирус, как и у других ретровирусов, содержит гены gag, pol и env и ограничен LTR (1328 нуклеотидов), включающими в себя регулирующие элементы и кодирующими синтез белка с молекулярной массой 36 000. Провирусная ДНК не содержит онкоген, и трансформация клеток происходит непрямым путем. Экспрессия провирусов регулируется клеткой, и поэтому большинство провирусов неактивно. Активация отдельных провирусов может «обеспечиваться» гормонами и стать цепью событий, завершающихся туморогенезом.
Несбалансированный синтез продуктов онкогенов превращает нормальную клетку в злокачественную, причем этот процесс может происходить в два этапа: сначала иммортализация, затем злокачественная трансформация. Встраивание генов под транспозоны является, таким образом, основным механизмом канцерогенеза. Кроме того, онковирусы по структуре сходны с транспозонами.
Мы намеренно упростили представления о молекулярных механизмах канцерогенеза, так. как он не является предметом настоящего обсуждения. Отметим далее, что протоонкогены и сходные с ними белки не только широко распространены в клетках высших животных, но и аналоги их обнаружены у насекомых [Shilo В. et al., 1981; Lev Z. et al., 1985], а также в митохондриях [Gay N. et al., 1983]. Между прочим, эти данные свидетельствуют, во-первых, о выраженном консерватизме протоонкогенов, важной роли их в метаболизме организмов. Гены позвоночных возникли более 300 млн лет назад, если же учитывать сходные гены беспозвоночных, то время их возникновения отдаляется на 800 млн — 1 млрд лет назад.
Прежде чем рассматривать возможные пути эволюции отдельных групп онковирусов, следует высказaть соображения о темпах их эволюции. При сравнении клеточных и вирусных одноименных онкогенов было показано, что скорость замены на сайт в год составляет для c-mos 1,71x109, а для v-mos 1,31х103, иными словами, скорость мутаций вирусного гена в 106 раз больше [Goiobari Т. et al., 1985]; Это и понятно, поскольку клеточный ген не только уникален, но и необходим для нормального функционирования клетки и поэтому его мутации, большинство из которых нарушает функции этого гена, детальны и отбор стабилизирует эти гены, чем и обусловлена их крайняя консервативность. Этого не происходит с геном, захваченным провирусом, «а механизм которого естественный отбор не оказывает стабилизирующего действия, с чем и связаны быстрые темпы его изменчивости.
Как указывалось, онковирусы образуют несколько групп, различающихся по морфологии вирионов, серологически, а также по особенностям цикла репродукции и другим биологическим свойствам. Была предпринята попытка на основании гомологии гена для синтеза полимеразы вирусов типа А, В и С (птиц и млекопитающих), D, HTLV-I составить филогенетическое древо этих вирусов исходя из предположения о монофилетическом их происхождении (табл. 16) [Ono М. et а]., 1985]. Для сравнения были взяты ретровирус беличьей обезьяны (SMRV) D, вирус опухолей молочной железы (MMTV) В, интрацистерный вирус сирийского хомяка (JAP) А, вирус саркомы Рауса (RSV) С, вирус лимфатического лейкоза человека (HTLV-I) и вирус лейкемии мышей
Таблица 16. Гомология аминокислот в области эндонуклеазы, кодируемой геном pol ретровирусов
Геном вируса |
Тип |
Гомология (%) с |
|||||
SMRV |
MMTV |
ІАР |
RSV |
HTLV-І |
MuLV |
||
SMRV |
D |
100 |
|||||
MMTV |
В |
54 |
100 |
||||
IAP |
А |
50 |
49 |
100 |
|||
RSV |
С птиц |
38 |
39 |
37 |
100 |
||
HTLV-I |
36 |
30 |
32 |
31 |
100 |
||
MuLV |
С млекопитающих |
||||||
27 |
28 |
25 |
23 |
32 |
100 |
||
Примечание. Гомология последовательностей аминокислот определена как процент идентичных остатков.
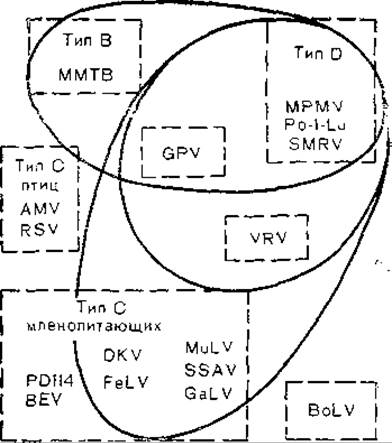
Рис. 36. Распределение общих антигенных детерминант онковирусов (схема). Эллипсоиды обозначают общие антигенные детерминанты.
(MuLV) С. Однако эти данные нуждаются в коррективах, так как мажорные структурные белки онковирусов типа В, С и D имеют межвидовые антигенные детерминанты, причем перекрестные серологические реакции сложны и неоднозначны. Так, имеются несколько перекрестов: один из них объединяет вирусы типа В и D, другой — вирусы типа С млекопитающих и вирусы типа D [Barbacid М. et al., 1930]. На рис. 36 показаны перекресты между вирусами В (MMTV), D (MPMV) и С [эндогенный вирус лонгура P-1-Lu, SMRV, вирус морской свинки (GPV), змеиный вирус (VRK), вирус саркомы Раушера (RMuLV), саркомы обезьян (SSАV), вирус гиббона (GaLV), вирусы лейкемии кошек (FeLV, RD114), эндогенный вирус павиана (BEV), вирусы птиц типа С (RSV, AMV), вирус лейкоза коров (BoLV)]. Как видно из рис. 36, взаимоотношения между разными вирусами достаточно сложны и, помимо дивергентной эволюции, здесь возможны рекомбинационные процессы, приведшие к обмену генами у разных вирусов. С этой точки зрения заслуживают внимание данные, указывающие на высокую степень гомологии гена pol вируса лейкоза коров с соответствующим геном птичьих, но не мышиных онковирусов, в то время как ген для синтеза белка gp30 имеет большую степень гомологии с мышиными, но не птичьими онковирусами. Величина и организация генома вируса лейкоза коров сходна с таковой генома вируса HTLV-I человека [Sagata N. et al., 1985].
Особый интерес в последнее время привлекают вирусы T-клеточного лейкоза человека, [Киселев Ф. Л., 1986]. Вначале был открыт вирус, получивший в последующем обозначение IITLV-I [Poiesz В. et al., 1980], который оказался распространенным в ряде стран. Затем был обнаружен отличный от него иммунологически и по нуклеотидной последовательности вирус HTLV-II [Chen S. et al., 1984]. В остальном геномы этих вирусов весьма сходны. Размер их составляет около 8800 пар нуклеотидов, на обоих концах геномов имеются длинные терминальные повторы. При различных нуклеотидных последовательностях геномов этих вирусов длинные терминальные повторы (области U3, R и U5) оказались крайне консервативными. Так, штаммы вируса HTLV-I, выделенные в США и Японии, имели различия лишь в 15—16 из 754 оснований, составляющих терминальные повторы [Josephs S. et al., 1984]. Оба вируса лейкоза взрослых больных передаются здоровым людям половым путем, через молоко матери, препараты крови и при тесном бытовом контакте (повреждения кожи, слизистых оболочек). Существуют бессимптомные формы болезни. Основными антигенами, определяющими иммунитет у больных, являются белки внутренних компонентов вирионов (р24) и наружной оболочки (gp61), а также минорные gp68, р54, р46 и р12.
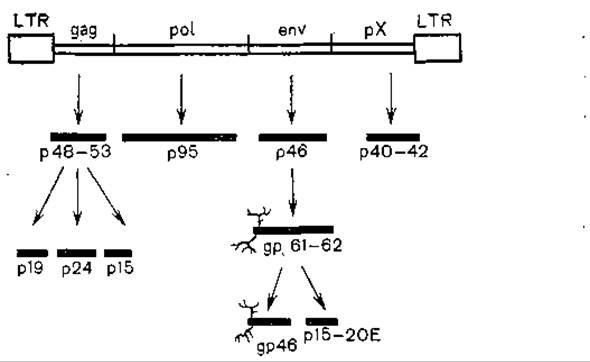
Рис. 37. Провирусный геном лимфотропного вируса н белки. «Ветвистые» линии обозначают гликозилированные области.
Инфекция может поражать обезьян (японских макак). До 20—30% животных имеют антитела против вируса серотипа I. В общем вирус серотипа I вызывает более тяжелые заболевания, нежели вирус серотипа II. Структура их генома показана на рис. 37 [Yamamoto N., Hinuma Y., 1985]. Как видно из рис. 37, она сходна со структурой генома других онковирусов, но отличается наличием области рХ у 3'-конца генома. Эта область гомологична геномной ДНК нормальных крыс и. мышей, что может свидетельствовать о происхождешш этого гена от грызунов, как равным образом и вируса от вируса грызунов [Fukui К. et al., 1984]. Эта область, являющаяся длинной открытой рамкой считывания (LOR), кодирует синтез белка с молекулярной массой 42 000. Последний служит трансактиватором транскрипции вирусных генов [Goh W. et al., 1985]. При секвенировании генома HTLV-II, провирус которого содержит 8952 пар нуклеотидов, был обнаружен ген, кодирующий протеазу. Этот ген частично захватывает области генов gag и pol и имеет соответственную рамку считывания. Таким образом, гены в геноме расположены следующим образом [Shimotohuo К. et al., 1985]: LTR — gag — ген протеазы — pol — env—x—LTR. Сходную структуру генома имеют вирусы лейкоза коров и СПИДа, а также, по-видимому, еще один вирус этой группы, ассоциирующийся с множественным склерозом [Koprowski Н. et al., 1985], и Т-лимфотропный вирус африканских обезьян (STLV) [Watanabe Т. et al., 1986].
К вирусу HTLV-I близок вирус обезьян PT-STLV, выделенный из свинохвостой обезьяны: гомология нуклеотидных последовательностей этих провирусов составляет 90% [Ino- ue J. et al., 1986]. Любопытно, что нуклеотидная последовательность рируса HTLV-I обнаруживает с геномом Т-лимфотропного вируса африканских обезьян (95%) большую гомологию, чем с вирусом азиатского подтипа (90%). С вирусом Т-клеточного лейкоза человека сходны два Т-лимфотропных вируса обезьян (STLV), имеющих с ним высокую степень гомологии LTR. Один из этих вирусов поражает макак в Азии, другой — зеленых мартышек и шимпанзе в Африке [Watanabe Т. et al., 1986]. Вирус человека более родствен африканскому, нежели азиатскому подтипу. (О связи этих вирусов со СПИД см. ниже.)
В эволюции онковирусов можно обнаружить две противоречивые тенденции. С одной стороны, их эволюция происходит сопряженно с эволюцией «хозяев», онковирусы как бы заключены в рамки эволюционирующей ветви животных. С другой стороны, онковирусы «перескакивают» на отдаленные ветви эволюции органического мира. Первая тенденция хорошо иллюстрируется данными, полученными при изучении эндогенных вирусов типа. С млекопитающих. У обезьян Старого Света, человекообразных обезьян, а также у человека в геномах клеток имеются последовательности, родственные РНК эндогенного вируса павианов. Степень гомологии при исследовании образцов разных видов прогрессирует [Benveniste R., Тобаго G., 1976]. Как видно из рис. 38, эволюционный ряд приматов представляет собой дивергентно эволюционную ветвь, в которой прослеживается прямая ветвь от приматов к человеку через азиатских обезьян (гиббона и орангутанга), в то время как горилла и шимпанзе «образуют» самостоятельную ветвь. Сделано заключение, что большая часть эволюции человека происходила вне Африки, вероятно, в Азии.
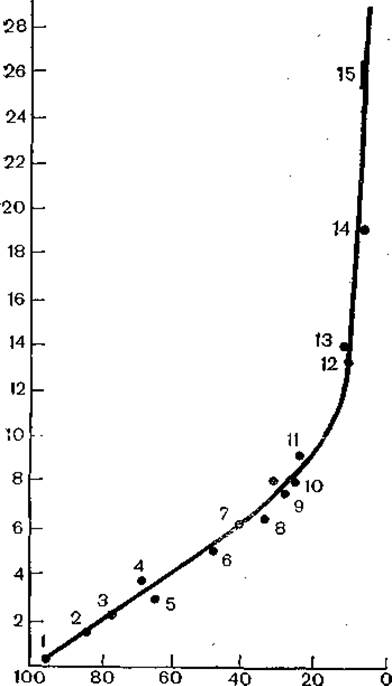
Рис. 38. Гибридизация ДНК- зонда вируса павиана типа С с клеточными ДНК приматов. Степень гибридизации определяли после обработки гибридов S1-нуклеазой. По оси ординат — ∆Тm (°С) для ДНК-гибридов относительно гибрида [3H]-ДНК вируса павиана с гомологичной клеточной ДНК; по оси абсцисс — количество гибридов после обработки ферментом (%).
Другую тенденцию можно видеть при изучении гомологии онковирусов, поражающих разные виды животных. Принципиальная возможность перехода онковирусов на эволюционно отдаленные виды была показана в опытах по заражению грызунов вирусами саркомы птиц. Реализация, этих возможностей встречается на каждом шагу. Так, онковирусы кошек весьма близки к онковирусам грызунов. Как уже упоминалось, иммунологические перекресты имеются почти у всех онковирусов млекопитающих и птиц. Есть веские основания предполагать, что многие из них являются рекомбинантами. Мы хотели бы возможность переходов онковирусов в новые виды организмов проиллюстрировать на примере вируса RD114. Этот вирус является вторым эндогенным вирусом кошек; первый из них, вернее, первая группа эндогенных вирусов, произошла явно от вирусов грызунов. Вирус RD114 весьма близок к эндогенному вирусу павианов, и его иммунологическая близость к нему свидетельствует о сравнительно позднем происхождении вируса. При исследовании геномов семейства кошек было установлено, что провирус RD114 имеется у мелких кошек и отсутствует у крупных кошек (львов, тигров, леопардов и др.). Поскольку кошачьи разделились на крупных и мелких кошек 3—4 млн лет назад, то и заселение вирусами организма мелких кошек не могло произойти раньше. Этот небольшой срок был достаточен не только для перехода вирусов болезней обезьян в новую экологическую нишу, но и для заселения ими организма всех особей этой эволюционной ветви кошачьих, для которых вирус RD114 является эндогенным.
Возникает вопрос, когда возникли онковирусы и почему они получили столь широкое распространение, ставши эндогенными. На этот вопрос можно ответить предположительно. Тот факт, что онковирусы обнаружены у позвоночных начиная с рыб или пресмыкающихся, свидетельствует о сравнительно позднем их происхождении, хотя, как уже было указано, структуры, сходные с ретровирусами, обнаружены и у беспозвоночных (насекомые). Среди ретровирусов онковирусы выделяются способностью захватывать клеточные гены, в то же время они, как и другие ретровирусы, имеют структуру транспозонов (наличие терминальных повторов, содержащих промоторы). В силу этого ретровирусы в целом и особенно онковирусы можно трактовать как транспозоны [Жданов В. М., 1984].
Какую роль они могут играть в эволюции позвоночных и какие факторы способствуют их сохранению, а не элиминации? Как транспозоны онковирусы, безусловно, полезны, и, чтобы не повторяться, мы отошлем читателя к разделам книги, в которых описана эволюция генетического материала. Не следует забывать, что интеграция провируса создает иммунитет клетки против сходного экзогенного вируса, — отсюда возникает ксенотропность многих онковирусов. Что же касается неоплазий, вызываемых онковирусами, то они поражают старых особей, потерявших способность к репродукции, и поэтому онкогенность вируса вряд ли наносит вред популяции. В то же время онковирусы, вернее, их интегрированные провирусы, могут играть определенную роль в процессах дифференциации и регенерации.
Установлено, что антигены дифференциации (лучше всего изучены антигены вилочковой железы) или по крайней мере часть их детерминируется онковирусами типа С. Не случайно поэтому активация эндогенных онковирусов наблюдается в эмбриогенезе. Основываясь на этих данных, А. С. Шевелев (1977) выдвигает предположение, что у эукариотов существует феномен трансгрессии, т. е. передача онковирусами генетической информации, детерминирующей полезные для вида физиологические функции клеток.
Об особой роли онковирусов в распространении генетической информации могут служить наблюдения С. Bergmann и соавт. (1981). Они обнаружили в ДНК всех позвоночных
филогенетически высших, чем рыбы, нуклеотидные последовательности, около 1000 нуклеотидов, общих е таковыми трансформирующего гена вируса миелобластоза птиц. Консерватизм этих последовательностей указывает либо на стабилизирующий отбор данного гена на протяжении сотен миллионов лет эволюции, либо о векторном их распространении онковирусами, как это имело место, например, в случае вируса RD114 кошек, происшедшего от вируса приматов.
С этими данными согласуются соображения R. Dulbecco (1985) о роли ретровирусов в природе. Он считает ретровирусы транспозонами особого вида, у которых транспозиция основана на обратной транскрипции. Их биологическая роль как и других транспозонов, использующих обратную транскрипцию, связана с эволюцией. Будучи интегрированными в геном клеток, они передаются по законам Менделя, в то же время в результате активации и образования вирионов они могут передаваться горизонтально. Однако имеются ретрогены, которые никогда не генерируют полных внеклеточных вирионов, хотя находятся в сотнях копий в геномах мышиных клеток — интрацистернальные частицы типа А. Наличие в длинных терминальных повторах ретровирусов промоторов, терминаторов, энхансеров, полиаденилатных сайтов, а также мобильность делают их важными регуляторами работы клеточного генома. Мобильность их приводит к тому, что они могут активировать функционирование клеточных генов или, наоборот, разрушать их. Но эти же свойства, а также способность захватывать клеточные гены могут явиться причиной неопластической трансформации клеток. Наконец, указанные свойства ретровирусов делают возможным перенос генов от одного вида другому (что отражается в сложных серологических отношениях), а также родство онкогенов, обнаруженных у разных онковирусов, которые поражают разных животных.
Мы лишены возможности рассматривать пути эволюции подсемейства спумавирусов. Что же касается лентивирусов, то возможные пути эволюции их будут рассмотрены на примере вирусов СПИД.
Вирусы иммунодефицита человека1
1 Здесь мы оставляем авторский текст без существенной правки, далее будет изложено современное (данные на 1989 г.) состояние вопроса. — Примеч. ред.
Синдром приобретенного иммунодефицита (СПИД) был выделен в самостоятельную нозологическую единицу в 1981 г. Центром по контролю болезней США, который тогда же признал эпидемическую природу заболевания [CDC, 1981]. Болезнь была выявлена в связи с увеличением числа случаев пневмоцистных заболеваний и саркомы Капоши. Ранее эти заболевания регистрировались у лиц, получавших иммунодепрессивную терапию, а с 1978 г. были обнаружены у здоровых людей, у которых отмечались нарушения в системе клеточного иммунитета, не врожденные, а приобретенные и не связанные с применением иммунодепрессантов.
В основе СПИД лежит избирательное поражение одной из популяций Т-клеток, а именно Т-хелперов (Т4-лимфоцитов). В результате поражения и гибели популяции Т-хелперов абсолютное число их уменьшается и отношение Т-хелперы: Т-супрессоры (ОКТ4 : ОКТ8), которое в норме составляет 1,5—2,0, падает до долей единицы. Поскольку Т-хелперы играют важную роль в активации клеточного иммунитета, а Т-супрессоры угнетают его, нарушается вся система клеточного иммунитета. С этим патогенетическим механизмом СПИД связаны и его проявления: увеличение лимфатических узлов и нарушение их структуры; развитие пневмонии, вызываемой Pneumocystis carinii, генерализация саркомы Капоши, длительная диарея, продолжительная лихорадка, большая потеря массы тела, а также разнообразные оппортунистические инфекции вирусной, грибковой и бактериальной природы. Болезнь протекает тяжело и около 50% заболевших умирают в течение первого года после появления выраженных признаков заболевания. Более подробное определение СПИД дано в сводке ВОЗ [WHO, 1986].
Ретровирусная этиология заболевания была установлена группой ученых под руководством L. Montagnier, обозначившими выделенный вирус Lymphadenopathy-assodated, virus— LAV [Barre-Sinoussi P. et al., 1983], и подтверждена американскими исследователями, обозначившими вирус human Т-lymphotropic virus III — HTLV-III [Gallo R. et al., 1984] и AIDS-related virus — ARV-2 [Levy J. et al., 1984]. Вирус избирательно поражает популяцию Т-хелперов [Sarin Р., Gallo R., 1986]. Вирус обнаружен также в сперме, костном мозге, лимфатических узлах, мозговой ткани и даже в моче [Salahuddin S. et al., 1985]. Однако в наибольшей концентрации вирус выявляется в крови и сперме, в связи с чем и определяется эпидемиология СПИД как кровяной и половой (венерической) болезни. Позже Международным комитетом по номенклатуре вирусов вирус был обозначен HIV (ВИЧ) — вирус иммунодефицита человека.
Пожалуй, ни одна из болезней не вызвала столь панических настроений у населения, как СПИД. Это и неудивительно: со времени регистрации первых заболеваний число их в США и некоторых странах Европы удваивалось каждые полгода, а смертность среди зарегистрированных больных достигла 50% или даже превысила эту величину. В табл. 17 представлены данные по США, где к тому времени регистрировалось основное число (до 90%) заболеваний. Возрастной и социальный профиль заболевших весьма характерен (табл. 18). За этот же период в остальных государствах Америки было зарегистрировано 1685 случаев, в том числе в Бразилии 540, в Канаде 435 и в Гаити 377 случаев.
Таблица 17. Время удвоения числа случаев СПИД в США (данные приводятся на 13 января 1986 г.)
Число случаев ОПИД |
Дата |
Время удвоення, мес |
129 |
Сентябрь 1981 г. |
|
257 |
Февраль 1982 г. |
5 |
514 |
Июль 1982 г. |
5 |
1029 |
Январь 1983 г. |
6 |
2057 |
Август 1983 г. |
7 |
4115 |
Апрель 1984 г. |
8 |
8229 |
Февраль 1985 г. |
10 |
16 458 |
Январь 1986 г. |
11 |
Число заболеваний в Европе [WHO, 1986] за это время превысило 2000 человек, умерли 1005 человек (50,1%). Наибольшее число заболеваний зарегистрировано во Франции (573), ФРГ (377), Великобритании (287), Италии (140), Бельгии (131). Выходцы из Африки составляют небольшую часть заболевших (175 человек, 8,8%). Среди заболевших преобладают мужчины (91%) и примерно те же группы населения — гомо- и гетеросексуалисты, наркоманы, проститутки и в меньшей мере лица, получившие гемотрансфузию, и больные гемофилией. В разных странах удельный вес этих групп колеблется в довольно широких пределах [Curran J. et al., 1985; Dowdle W., 1985]. В этом отношении интересны наблюдения, проведенные в Испании [WHO, 1986] (табл. 19). Среди групп риска наиболее пораженными оказались больные гемофилией, наркоманы, дети «серопозитивных» матерей и только на 4-м месте гомо- и гетеросексуалисты, хотя во всех этих группах процент пораженных оказался необычайно высоким. Возможно, однако, что имели место ложноположительные реакции, связанные с применением иммуноферментного метода.
В США при первичном обследовании с использованием этого теста 593831 донора положительные результаты были получены в 0,80%, а при повторном — результаты совпали в 0,25% случаев. В связи с этим были предприняты попытки усовершенствовать методы определения антител против вируса СПИД, в частности, было введено применение подтверждающих тестов типа метода иммуноблотта.
Таблица 18. Число пациентов с диагнозом СПИД среди различных групп риска в США
До 14 янв. 1984 г. |
14 янв. 13 янв |
1984 г.— 1985 г. |
14 янв. 13 янв |
1985 г.— 1986 г. |
||
Группа пациентов |
абс. число |
% |
абс. число |
% |
абс. число |
% |
Взрослые Гомосексуалисты/бисексуальные мужчины и наркоманы |
293 |
9,3 |
418 |
9,2 |
599 |
7 |
Гомосексуалисты/бисексуальные мужчины |
1992 |
63 |
2939 |
64,8 |
5669 |
66,5 |
не наркоманы Наркоманы |
552 |
17,4 |
785 |
17,3 |
1429 |
16,8 |
Больные гемофилией |
17 |
0,5 |
38 |
0,8 |
69 |
0,8 |
Лица, имевшие гетеросексуальные контакты |
29 |
0,9 |
53 |
1,2 |
100 |
1,2 |
Лица, получившие донорскую кровь |
34 |
1,1 |
56 |
1.2 |
171 |
1,2 |
Прочие: Неидентифицированные группы риска |
107 |
3,4 |
131 |
2,9 |
348 |
4,1 |
Лица, родившиеся за пределами США* |
140 |
4,4 |
114 |
2,5 |
144 |
1,7 |
Всего: |
3164 |
— |
4534 |
— |
8529 |
— |
Дети Дети, родители которых больны СПИД или принадлежат к одной из групп риска |
78 |
74,5 |
40 |
83,3 |
97 |
73,5 |
Больные гемофилией |
3 |
5,9 |
1 |
2,1 |
7 |
5,3 |
Дети, получившие донорскую кровь |
6 |
11,8 |
6 |
12,5 |
21 |
15,9 |
Прочие |
4 |
7,8 |
1 |
2,1 |
7 |
5,3 |
Всего |
51 |
і |
48 |
— |
132 |
— |
Общее число |
3215 |
— |
4582 |
— |
8661 |
— |
* Лица, родившиеся в странах, где большинство случаев СПИД не связано с известными факторами риска.
Таблица 19. Число случаев обнаружения антител против вируса СПИД у лиц, принадлежащих к различным группам риска, в Испании (по данным на 1985 г.)
Группа риска |
Число обследованных, имеющих антитела против вируса СПИД |
||
общее |
абс. число |
% |
|
Наркоманы |
538 |
342 |
64 |
Гомосексуалисты (бисексуальные мужчины) |
226 |
29 |
13 |
Гомосексуалисты (бисексуальные мужчины, получавшие лекарственные препараты внутривенно) |
18 |
10 |
56 |
Больные гемофилией |
297 |
203 |
68 |
Дети «серопозитивных» матерей |
5 |
3 |
60 |
Прочие |
50 |
11 |
22 |
Общее число |
1134 |
598 |
53 |
СПИД обнаружен в Африке, особенно в государствах Центральной Африки. В отличие от Северной Америки и Европы здесь мужчины и женщины болеют одинаково часто, велика заболеваемость среди детей, у которых нередко развивается саркома Капоши. Главным путем заражения являются половой и семейный контакты. В Азии заболевания СПИД относительно редки [Kapita В., 1986].
О все более возрастающем значении СПИД как проблемы здравоохранения красноречиво свидетельствовали цифры, приведенные G. Mahler (1986). К концу 1985 г. было зарегистрировано более 20 000 больных СПИД, из которых более 50% умерли. Из них 45% зарегистрировано в 1985 г. и более 75% за 1984—1985 гг. Ко времени конференции в Париже (июнь 1986 г.) 22 025 случаев были в Америке, 2283 — в Европе, 379 — в Африке, 214 — в Океании и 50 — в Азии. Хотя число заболеваний, зарегистрированных в Африке, пока невелико, по данным В. Kapita (1986), антитела против вируса обнаруживаются при обследовании населения в 4—6% (Сенегал, Заир) до 18—23% (Руанда, Уганда) случаев. Еще более- устрашающие цифры были приведены в докладе J. Curran (1985). По расчетным данным, хорошо совпадающим со статистикой в США, к 1991 г. будет 1,5 млн инфицированных, из которых заболеют до 270 000 человек (возможные колебания от 201 000 до 311 000). Из них умрут 179 000 (колебания 218 от 141 000 до 201000) и в 1991 г. заболеют 74 000 человек. При расходе на лечение одного больного 46 000 долларов стоимость лечения больных СПИД достигнет 8 млрд долларов.
Учитывая это, имеются веские основания предполагать, что инфекция чаще всего протекает бессимптомно, реже в выраженной форме, а та статистика, по данным которой 50% заболевших умирают в течение ближайшего года, является своего рода вершиной айсберга. В этом смысле можно понимать оценки, согласно которым в США поражены 1—2 млн человек, а в Африке — до 10 млн человек.
При СПИД наиболее часто появляются антитела против белков наружной оболочки (gp41env) и нуклеокапсида (р24gаg). При этом частота реакций с внутренним белком зависит от тяжести болезни: она велика при выраженных признаках болезни и меньше — маловыраженных. По-видимому, антиген выходит в кровь и вызывает образование антител при массовом разрушении лимфоцитов, что характерно для далекозашедшей болезни. Для инфицированных вирусом СПИД характерно образование антител не только против процессированных белков, но и против предшественников. При этом спектр антител зависит от стадии развития и выраженности болезни.
О малой заразности свидетельствует редкость заболеваний среди медицинских работников; единичные заражения описаны только после уколов иглами при взятии крови у больных СПИД.
Однако вернемся к вирусу СПИД, который, напомним, получил обозначение LAV/HTLV-ІІI, отражавшее сложный характер приоритетов, а затем унифицированное наименование HIV (ВИЧ)—вирус иммунодефицита человека (human immunodeficiency virus). Спор между Р. Галло и Л. Монтанье окончился в пользу последнего, и ВИЧ теперь относят к лентивирусам, к которым также относятся вирус инфекционной анемии лошадей и вирус Висна овец [Montagnier L., 1985]. Однако ближайшими родственниками ВИЧ (теперь его обозначают как ВИЧ-I) являются серологическая разновидность ВИЧ, распространенная в Западной Африке (ВИЧ-I распространен в Центральной Африке) и обозначаемая как ВИЧ-ІІ а также вирус иммунодефицита обезьян STLV-III. Все три вируса имеют иммунологически родственные антигены core и отличаются по антигенам env, причем вирусы ВИЧ-I и ВИЧ-ІІ менее, а вирусы ВИЧ-ІІ и STLV-III более родственны между собой. Вирусы иммунодефицита человека и обезьян имеют отдаленное родство с 3 другими лентивирусами (инфекционной анемии лошадей, Висна и артроза — энцефалита коз) по внутренним антигенам, включая гены полимеразы и регуляторные гены [Pyper J. et al., 1986]. На основании молекулярной! структуры было составлено [Gonda М. et al., 1986] генеалогическое древо лентивирусов.
Структура генома ВИЧ и родственных им вирусов изучена достаточно детально. На геноме размещены гены в следующем порядке: 5'-LTR — gag — pol — sor — tat — trs/art — env — orf- 3'. Продуктом гена gag является пропептид Рr55, который подвергается расщеплению с помощью вирусной протеазы сначала на промежуточные продукты Рr42 и Рr15, а затем на конечные полипептиды р17, р24 и р7/р9. Продуктом гена env служит гликозилированный белок Рr160, расщепляющийся на gpl20 и gp41. Продуктами гена pol являются белки комплекса полимеразы (обратная транскриптаза) р66/р51 и эндонуклеазы р34. Возможно, их предшественником служит продукт Рr150, расщепляющийся на р22, р64/р53 и р34. Предположительные продукты генов sor и orf — это белки р23 и р27. Продуктом гена tat является р13 — трансактивирующий фактор транскрипции tаtIII присутствие которого увеличивает уровень синтеза вирусной РНК в 20—100 раз. Белок tatlll кодируется двумя участками ДНК в области 5376—5590 и 7936— 7979 (табл. 20).
Необходимо отметить, что в отличие от всех ранее описанных механизмов регуляции транскрипции эукариотических и вирусных генов область LTR, находящаяся под контролем tatlll, расположена правее стартовой точки инициации синтеза мРНК и обозначена TAR. У некоторых больных обнаружены антитела против белка tat. Есть данные" о том, что трансактиватор, продукт гена tat, действует не только на уровне транскрипции, но и на посттранскрипционном уровне. В, отличие от этого белка продукт гена trs/art, также являющийся трансактиватором, действует только на посттранскрипционном уровне. Третий трансактиватор, продукт гена sor, действует на поздних стадиях репродукции, предположительно на стадии сборки вирусных частиц. Таким образом; все 3 трансактиватора действуют последовательно, активируя разные стадии инфекционного цикла.
Как уже указывалось, основные проявления патогенеза СПИД связаны с поражением популяции T-хелперов, в которых происходит размножение ВИЧ, сопровождающееся гибелью клеток этой популяции. Однако эта первоначальная схема нуждается в серьезных коррективах. Действительно, рецепторами ВИЧ являются 74-рецепторы лимфоцитов, с которыми взаимодействуют поверхностные гликопротеиды (gp120) вируса. Но для гибели лимфоцитов не обязательно размножение в них вируса, так как трансмембранные гликопротеиды (gp120/gp41) могут вызывать образование сим- пластов и гибель клеток и без размножения [Maddon Н. et al.; 1986]. Кроме того, чувствительны к вирусу макрофаги [Gendelman Н. et al., 1986], которые первично поражаются вирусом, поскольку на поверхности также имеют рецепторы для ВИЧ. Между прочим, причиной частого поражения СПИД гомосексуалистов является не только высокая концентрация вируса в сперме, но и обилие скоплений макрофагов в стенках прямой кишки. Что же касается поражений мозга, то и в этом случае вирус размножается преимущественно в макрофагах [Koenig R. et al., 1986].
Таблица 20. Продукты генов ВИЧ
Область генома |
Первый кодон |
Метионин |
Терминатор |
Число аминокислот |
Кодируемые белки |
Свойства белков |
gag |
312 |
336 |
1872 |
512 |
р55 |
Белок-предшествеиник |
' |
245 |
р24 |
Основной белок сердцевины |
|||
135 |
р18 |
3'-Концевая часть предшественника, матриксный белок |
||||
132(377) |
р15 |
5'-Концевая часть предшественника — белки нуклеокапсида |
||||
pol |
1631 |
1940 |
4676 |
(1015) |
р65 |
Ревертаза? |
р51 |
Ревертаза? |
|||||
pH |
5'-Концевая часть — эндопептидаза |
|||||
р34 |
3'-Концевая часть — эндонуклеаза |
|||||
env |
5783 |
5804 |
8372 |
856 |
gp160 |
Белок-предшественник |
511 |
gp120 |
5'-Концевая часть предшественника, надмембранный белок |
||||
gp41 |
3'-Концевая часть предшественника, трансмембранный белок |
|||||
orf-Q |
4590 |
4623 |
5199 |
192 |
Трансактивирующий белок |
|
orf-F |
8346 |
8376 |
8994 |
206 |
р27 |
То же |
5360—5626/ 7958—9214 |
5411 |
8001 |
86 |
» » |
Поражение макрофагов приводит к нарушению синтеза и процессинга С3-компонента комплемента, причем это является ранним симптомом: у инфицированных ВИЧ характерная полоса СЗ-компонента комплемента исчезает задолго до проявления заболевания и инверсии отношения Т4 : Т8. Таким образом, поражение Т-хелперов является вторичным, хотя и решающим проявлением патогенеза СПИД. В противоположность этому ß-лимфоциты активируются, с чем, по-видимому, связано раннее появление специфических антител при СПИД.
Для изучения вариабельности генома ВИЧ были сравнены нуклеотидные последовательности генов env, а также участков генов gag и pol. Оказалось, что небольшим вариациям подвержены участки молекулы гена env, выступающие снаружи ободочки вириона, которые кодируют потенциальные антигенные сайты. В то же время значительные участки этого гена, а также генов gag и pol в высокой степени консервативны, что позволяет сдержанно относиться к предвзято негативной оценке возможности получения вакцин против этой инфекции.
По ряду свойств ВИЧ сближается с другим лентивирусом — вирусом инфекционной анемии лошадей. Его гликопротеиды gp90 и gp15 меняют антигенную структуру в ходе инфекционного процесса, чем обусловлены особенности течения этой инфекции — длительные ремиссии, сменяющиеся обострениями. Внутренние белки (р15, р26, р9) такой изменчивостью не обладают [Salinovich О. et al., 1986].
Как уже указывалось, ВИЧ имеет четко выраженный тропизм к Т-хелперам, что связывают с тропизмом вируса к Т4-рецепторам, которые в то же время являются рецепторами для интерлейкина-2 [Dalgleish A. et al., 1984].
Существенным компонентом рецепторов для ВИЧ является антиген СД4 (Т4) — антиген популяции Т-хелперов. Это было показано в опытах с инфекцией клеток псевдотипом вируса везикулярного стоматита и ВИЧ и нейтрализацией этих антигенов, препятствующей развитию инфекции [Dalgleish А. et al., 1984].
По-видимому, репликация ВИЧ мало отличается от репликации других ретровирусов, за исключением того, что ВИЧ имеет выраженные цитопатические свойства, буквально истребляя популяцию Т-хелперов. Пока что не вызывают оптимизма попытки химиотерапии СПИД (начиная от иммуностимуляторов и кончая ингибиторами обратной транскриптазы) [Rouvray D. et al., 1985; Lane H. et al., 1985; Norman C., 1985; Fox J., 1986]. Поэтому большое значение придается изменению социального поведения лиц, относящихся к группам повышенного риска.
У шимпанзе ВИЧ вызывает персистентную инфекцию [Fultz Р. et al., 1986] с поражением центральной нервной системы [Gajdusek D. et al., 1985], сходным с поражением ее у людей [Snider W. et al., 1983]. Похожие на СПИД человека заболевания у низших обезьян (макак) вызываются разными вирусами, в частности, онковирусами типа Д, отличными от вируса Мезона — Пфайзера [Marx Р. et al., 1984]. Однако для проблемы СПИД человека не эти вирусы представляют интерес, а вирусы иммунологически родственные ВИЧ. От африканских зеленых мартышек (Cerroplithe cus aethiops) был выделен вирус, серологически близкий LAV/HTLV-III [Ranki Р. et al., 1985]. Проблема вирусов, вызывающих СПИД у обезьян, явилась предметом специального обсуждения ВОЗ [WHO, 1985]. Было показано, что наряду с вирусами, родственными Т-лимфотропному онковирусу человека (HTLV-I) и вирусу Мезона — Пфайзера, от обезьян с признаками СПИД были выделены вирусы, иммунологически родственные вирусу LAV/HTVL-III.
Теперь после изложения элементарных данных о вирусе и вызываемых им заболеваниях можно рассмотреть проблему происхождения и эволюции СПИД. Прежде всего следует отбросить как неверное утверждение о том, что СПИД — новая болезнь, возникшая если не в 1981 г., то, скажем, в 1978 г. Она так же «нова», как болезнь легионеров, которую до известной вспышки не диагностировали, или как инфаркт миокарда, который в прошлом столетии называли разрывом сердца. Рассмотрим СПИД в СССР, который начали изучать только в 1984 г.
Первой выявленной и зарегистрированной больной оказалась девочка 11 лет, которая в возрасте около 2 лет получала гемотрансфузии, а в 5 лет заболела лимфоаденопатией. Диагноз СПИД был установлен с помощью серологических и иммунологических тестов. Девочка заболела в 1977 г., а заразилась в 1974 г. А когда же был инфицирован один из доноров, чью кровь она получила? Наверное, ранее 1974 г. Аналогично можно рассуждать и в отношении случаев СПИД в США и в любой другой стране. Таким образом, совершенно ясно, что СПИД начал существовать не в 80-е и не в 70-е годы, а значительно раньше. Или, например, в Африке эпидемиология СПИД наиболее «натуральна», так как заражение происходит путем естественного полового и бытового контакта и характерные проявления болезни в виде саркомы Капоши часто и давно встречаются у детей. Нет решительно никаких оснований говорить о СПИД как о новой болезни для Африки.
Нам представляется СПИД такой же древней болезнью, как и человечество. Вероятно, «колыбель» его — Африка — явилась местом происхождения, там был и источник происхождения вируса. Сходный вирус макак резусов или зеленых мартышек [Montagnier L., 1986] имеет гомологию нуклеотидов и серологическое родство с вирусом СПИД. Возможно, что речь идет о дивергентном развитии нескольких вирусов, один из которых эволюционировал вместе с человеком, возможна и рекомбинантная природа этого вируса на основе взаимодействия онковирусов типа В и С [Toh Н., Miyata Т., 1985]. «Становление» этого вируса могло произойти 3—5 млн лет назад, и с тех пор он проделал определенную эволюцию как в месте своего происхождения (Африка), так и на других континентах, где расселился человек. Обращает на себя внимание отсутствие «собственных» заболеваний в Юго-Восточной Азии. Что это — низкая восприимчивость монголоидной расы к вирусу, или низкая заселенность вирусом этой экологической ниши, или просто отсутствие достоверных сведений о распространенности СПИД в этом регионе?
Применительно к СССР можно оценить автохтонную пораженность порядка 1 : 100 000. Если исходить из этой цифры, то ежегодно заражаются около 2500 человек, а за 10 лет «кумулируется» 25 000 инфицированных. У значительной части (80%), по-видимому, инфекция бессимптомная или в субклинической форме. Поэтому если даже будет обследовано 10% населения, то будет выявлено не более 2500 инфицированных, а среди них только 500 больных. Конечно, эти расчеты весьма произвольны, но цель их — поставить вопрос: а мог ли при такой небольшой интенсивности эпидемического процесса выжить вирус? Думается, что мог, так как невысокая заразительность инфицированного компенсируется длительным, иногда пожизненным носительством вируса. Таким образом, имеются и «медленный» вирус, и «медленная» инфекция, и «медленная» эпидемиология. Вероятно, этот тип эпидемического процесса был характерен для первой половины нашего столетия в странах Европы и Америки. Во второй половине XX в. многие страны освободились от колониальной зависимости и общение между людьми резко интенсифицировалось. В частности и в особенности это относится к странам Африки, где, несомненно, существуют свои «естественные» очаги СПИД, мужчины и женщины поражаются с примерно одинаковой частотой, среди населения 3—7% человек имеют антитела против вируса СПИД, а у проституток частота их обнаружения доходит до 35—30% [Georges А., 1985]. Отметим, что гомосексуализм в этих местах относительно редок.
Для колониальных стран процесс реинтродукции вируса СПИД начался раньше — во второй половине прошлого столетия, и население именно этих стран, владевших колониями в Африке (Франция, Бельгия и др.), оказалось наиболее пораженным СПИД.
В особом положении оказались США, так как, во-первых, ввоз рабов в США и страны Карибского бассейна начал интенсивно проводиться еще с конца XVIII в., во-вторых, в начале 60-х годов в США произошла так называемая «сексуальная» революция (она охватила и ряд стран Западной Европы), легализировавшая промисквитет и гомосексуализм и другие аналогичные проявления «свободной личности». Все это не могло не привести к взрыву эпидемии СПИД, принявшей характер национальной катастрофы. Быть может, реинтродуцированные африканские штаммы вируса СПИД обладали повышенной вирулентностью по сравнению с эндемическими штаммами Европы и Северной Америки. Уже говорят об обратном оттоке СПИД из США и Европы в Африку [Biggar R., 1986].
Перспективы борьбы со СПИД пока не слишком оптимистичны, поскольку эффективных лечебных средств пока не найдено [Fox J., 1986], а выраженная изменчивость вируса ставит препятствия на пути получения эффективных вакцин. Впрочем, оценки темпов изменчивости этого вируса некоторыми авторами [Haseltine W., 1986] нам представляются явно завышенными. Не следует также недооценивать санитарных мер, диагностики СПИД у доноров и, наконец, изменения уклада общественной жизни вплоть до необходимости «ущемления» юридическими законами прав «свободных личностей», угрожающих здоровью и жизни народа. В этом отношении здравый смысл советского народа и юридических законов является залогом того, что нашей стране СПИД не угрожает катастрофой, хотя и остается серьезной проблемой медицины и здравоохранения.
Дополнение к авторскому тексту1. Немногим более двух лет прошло со времени написания настоящей книги, а уже появились новые данные о возбудителе СПИД, болезни, принявшей характер пандемии. Если учесть, что ВИЧ был открыт в 1983 г., а его этиологическая роль при СПИД окончательно доказана в 1984 г., то период исследований измеряется 5—6 годами. За такой короткий срок был достигнут поразительный прогресс в этой области знаний. Большую роль сыграли молниеносная перестройка научных исследований, создание новых лабораторий и даже институтов, установление широких научных международных контактов, которые обеспечили высокий темп научных исследований. Нет сомнения в том, что ВИЧ является наиболее сложным среди других, патогенных для человека вирусов. Однако в настоящее время о нем известно больше, чем о многих других патогенных агентах. На примере ВИЧ были открыты новые классы явлений: и механизмы патогенности, а некоторые из них впоследствии были обнаружены и у других вирусов.
1 Раздел написан А. Г. Букринской.
Несомненно, ошеломительные успехи в изучении возбудителя СПИД оказались возможны благодаря высокому методическому уровню исследований по молекулярной биологии и генной инженерии. Следует упомянуть, что всего лишь 3 года назад рядом ученых высказывалось мнение о том, что человечество не подготовлено к решению такой сложной проблемы, как СПИД, и на фоне наших скудных знаний о молекулярных основах жизнедеятельности клетки едва ли возможно выявить причины многочисленных и необычных патологических изменений при СПИД [Haseltine W. А., 1986]. По мнению У. Хазелтайна, любой успех в области контроля СПИД будет случайной удачей исследователя и «подобен удачному выстрелу в темноте» (так и называется его статья: «Выстрелы в темноте», 1986 г.), поскольку не будет основан: на научных знаниях. Однако пессимизм ведущего специалиста в области молекулярной биологии СПИД оказался чрезмерным, и за короткий срок, через 2—3 года, были получены, ответы на большинство поставленных им вопросов. К сожалению, в настоящее время приобретенные знания не получили непосредственного выхода в область профилактики и лечения СПИД. Это положение отражает сказанная на III международной конференции по СПИД в 1988 г. крылатая фраза: «Блестящие победы в лаборатории и полный провал на улице». Тем не менее нет сомнения в том, что эти неудачи временные и вскоре будут выработаны меры борьбы с пандемией СПИД такие же не тривиальные, как и сам вирус.
Не будет преувеличением сказать, что В. М. Жданов, как опытный эпидемиолог (одна из его основных специальностей), первый в нашей стране распознал ту угрозу, которую несет СПИД для населения страны. На фоне общего благодушия прозвучал его тревожный голос со страниц центральных газет и научных журналов как предупреждение о том, что нам неизбежать эпидемии СПИД и на нашу страну неуклонно надвигается ее угроза. В своей последней статье он писал: «Хотя число заболеваний СПИД в СССР невелико и большая часть их приходится на лиц иностранного происхождения, было бы величайшей и непростительной беспечностью полагать, что пандемия СПИД пройдет мимо нас стороной... СПИД — не национальная, а глобальная проблема, требующая для своего решения объединения международных усилий под эгидой Всемирной организации здравоохранения, необходима наступательная стратегия и тактика борьбы со СПИДом. Здесь может пригодиться опыт, накопленный при искоренении оспы. Но борьба со СПИДом значительно сложнее, потребует несравненно больше сил и средств, займет не одно десятилетие. Нельзя допустить, чтобы СПИД стал чумой XXI века, истребляющей сотни миллионов» [Жданов В. М., 1987]. В. М. Жданов настаивал на том, что необходимы безотлагательные меры для заслона ввоза вируса в нашу страну, пока еще не поздно. Вскоре после смерти В. М. Жданова принят ряд соответствующих правительственных указов.
В последние годы жизни В. М. Жданова СПИД стал основной проблемой, над которой он работал и в которую вложил много сил и здоровья. В Институте вирусологии им. Д. И. Ивановского АМН СССР, который он возглавлял, очень оперативно были развернуты научные исследования по изучению вируса и созданию двух диагностических тест-систем, по получению рекомбинантных вирусных белков и моноклональных антител. В. М. Жданова волновал вопрос о происхождении вируса и его эволюции, о взаимоотношении его с другими ретровирусами и лентивирусами животных.
Вскоре после открытия возбудителя СПИД появились сообщения, в том числе и в нашей стране, об искусственном происхождении вируса и его создании в лабораториях Пентагона как вида биологического оружия. Эта кампания, используя неубедительные аргументы, нанесла большой вред научным контактам СССР и США и на несколько лет затормозила начало совместной работы советских и американских ученых. В. М. Жданов категорически выступал против этой концепции. По его мнению, чрезмерно сложная структура генетического аппарата вируса полностью исключает возможность создания вируса с помощью человеческих рук. Правота этого соображения подтвердилась позже. Лишь совсем недавно стали известны генетические элементы вирусного генома, функционирующие в сложном взаимодействии друг с другом и с другими вирусными генами.
Во время работы В. М. Жданова над книгой появились первые сообщения о выделении на территории Западной Африки вируса иммунодефицита обезьян (ВИО), которым были заражены африканские зеленые мартышки, а вскоре и вируса иммунодефицита человека типа 2 (ВИЧ-2), который занимает промежуточное положение между ВИЧ-1 и ВИО. В. М. Жданов немедленно оценил значение этих вирусов для понимания эволюции ВИЧ и использовал данные о первичной структуре их геномов для трактовки эволюционных представлений. Как оказалось, помимо 3 структурных генов gag, pol и env, находящихся в составе всех ретровирусов, ВИЧ имеет в своем составе еще 6 неструктурных генов, продукты 4 из них являются трансактиваторами. Это новая группа регуляторных белков, обладающих уникальной способностью активировать, функцию структурных и неструктурных генов, в том числе и самих себя. С экспрессией этих генов в значительной степени связаны активация и экспрессия провируса. Функции данных генов были изучены и уточнены лишь в последнее время, в связи с чем они получили новые названия, не фигурирующие в предыдущем разделе книги.
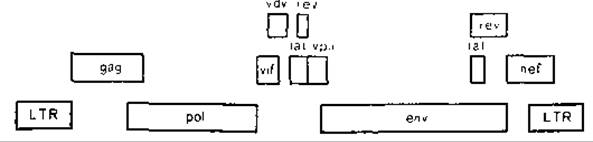
Эти гены следующие: 1) tat (от англ, transractivator of transcription), название гена сохранено; 2) rev (от англ. regulator of expression of virus proteins), прежнее название art, trs\ 3) vif (от англ, virion Infectivity factor), старое название sor; 4) nef (от англ, negative regulatory factor), прежнее название 3'-orf. Гены с неизвестными функциями — vpr и vpu. Наиболее активным регуляторным геном является tat, включение которого способно в 1000 раз усилить репликацию вируса. Его действие обусловлено связыванием продукта гена с областью TAR, находящейся в месте транскрипционного старт-сигнала в LTR и распространяющейся на 70—80 нуклеотидов в лидерную область. Стимулирующий эффект распространяется на все вирусные гены, как на структурные, так и регуляторные, и приводит к их одновременной транскрипции, благодаря чему начинается взрывообразное образование вирусных частиц.
Второй регуляторный ген rev приводит к избирательной активации синтеза структурных белков, замедляя синтез регуляторных белков. Продукт гена rev взаимодействует с кэп-структурой в составе длинных мРНК.
Третий регуляторный ген nef является негативным регулятором, который замедляет транскрипцию вирусных генов1. Вторично он обеспечивает состояние равновесия, устанавливающееся между вирусом и организмом. Продукт гена nef взаимодействует с начальной последовательностью в LTR, негативным регуляторным элементом NRE. Взаимодействие механизмов, включающихся генами nef и tat, может приводить к стационарному состоянию, при котором вирус может лишь ограниченно реплицироваться и не вызывать гибели клеток. Взаимодействие продуктов генов nef и rev также будет угнетать синтез регуляторных и структурных белков, и провирус будет находиться в негативном состоянии. Скорее всего взаимодействие этих 3 генов обеспечивает ответ по принципу «все или ничего». Четвертый ген vif кодирует синтез белка, который повышает способность зрелой вирусной частицы заражать клетку. Механизм действия этого белка пока не выяснен. Остальные два гена vpr и vpu, по-видимому, также кодируют синтез регуляторных белков, однако их функции еще не установлены [Хазелтайн У., Вонг-Стааль Ф., 1988].
ВИЧ-2 имеет сходную с ВИЧ-1 организацию генома, что указывает на их общее эволюционное происхождение. Не очень высокая гомология генома подтверждает, что оба вируса являются различными членами группы ВИЧ, а не вариантами одного и того же вируса [Guyader М. et al., 1987]. По структурной организации генома ВИЧ-2 ближе к ВИО, чем к ВИЧ-1. Длина генома ВИЧ-2 и ВИО несколько больше, чем у ВИЧ-1 (соответственно 9671 и 9200 нуклеотидов). В составе генома ВИЧ-2 и ВИО есть ген vpx, отсутствующий у ВИЧ-1, и в то же время нет гена vpu. Гомология ВИЧ-1 и ВИЧ-2 по наиболее консервативным генам gag и pol равна соответственно 56 и 60%, по другим генам она не превышает 30—40% [Guyader М. et al., 1987], ВИЧ-2 имеет более высокую гомологию генома с геномом ВИО и более широкие антигенные перекресты не только по антигенам pol и gag, но и env. Антигенные связи ВИЧ-1 и ВИЧ-2 ограничиваются антигенами pol и gag.
В. М. Жданов придерживался точки зрения, что источником происхождения ВИЧ является сходный вирус африканских обезьян резусов или зеленых мартышек, который сохранил гомологию нуклеотидов и серологическое родство с ВИЧ, и все 3 вируса произошли от общего предка. В настоящее время это мнение является общепринятым, но оно вызвало немало нареканий, когда впервые несколько лет назад В. М. Жданов опубликовал ряд журнальных и газетных статей.
Почти одновременное появление очагов инфекции ВИЧ-1 в Центральной Африке и ВИЧ-2 в Западной Африке едва ли можно объяснить одновременными мутациями в предшествующем непатогенном ретровирусе или случайным возникновением двух новых для человека вирусов. В. М. Жданов полагал, что СПИД — столь же древняя болезнь, сколь древне человечество, и местом происхождения его является Африка, а источником происхождения — сходный вирус обезьян резусов или зеленых мартышек. Вирусы могли возникнуть 3—5 млн лет назад и с тех пор проделали определенную эволюцию как в месте своего происхождения (Африка), так и на других континентах. Эта точка зрения, впервые высказанная В. М. Ждановым, имеет своих последователей. М. Фуказава и соавт. (1988) также полагают, что ВИЧ и ВИО дивергировали миллионы лет назад и эволюционировали постепенно с эволюцией приматов. Авторы определили нуклеотидные последовательности ВИО, выделенного от африканских зеленых мартышек, и провели их сравнение с геномами ВИЧ-1, ВИЧ-2 и ВИО азиатских макак. ВИО, выделенный от африканских зеленых мартышек, отличается от других вирусов иммунодефицита, хотя он несколько ближе к ВИЧ-2 и ВИО азиатских макак, чем к ВИЧ-1. В то же время ВИО макак очень сходен с ВИЧ-2, а ВИО зеленых мартышек значительно отличается от ВИО макак. Определение нуклеотидных последовательностей ВИО, выделенного от мандрил, также показало, что этот вирус отличается от других ВИЧ и ВИО, включая ВИО африканских зеленых мартышек, и почти в равной степени «удален» от ВИЧ-1, ВИЧ-2, ВИО макак и зеленых мартышек. М. Фуказава и соавт. трактуют эти данные как доказательства дивергенции вирусов в период дивергенции приматов и появления в результате эволюции приматов видоспецифических вирусов. Если и произошла межвидовая трансмиссия вируса, полагают авторы, это случилось в древние времена. Что касается ВИЧ-1 и ВИЧ-2, они также отделились в то время, дивергировали в процессе эволюции человека, по-видимому, в различных изолированных популяциях и различных ареалах. Такой же точки зрения придерживался К. Мульдер (1988). Сравнивая первичную структуру геномов ВИЧ и ВИО, он приходит к выводу, что их существенные отличия отвергают возможность происхождения ВИЧ от вирусов африканских зеленых мартышек в обозримом прошлом и лентивирусы произошли от общего предшественника вирусов приматов Старого Света и человека и эволюционировали вместе со своими «хозяевами».
Несомненно, эта концепция вызывает ряд вопросов. Если ВИЧ-1 и ВИЧ-2 дивергировали в результате эволюции человека, почему ВИЧ-2 имеет большее генетическое родство с ВИО? Почему ВИО вызывает болезнь лишь у азиатских макак, содержащихся в неволе? Каким образом ВИЧ сохранился в организме человека до 60-х годов? Сомнения в. правоте этой концепции у некоторых авторов вызывает то, что болезнь не регистрировалась и вирус не проявлял себя. Однако и это может иметь ряд объяснений. В. М. Жданов предполагал, что патогенность вируса была невысокой и вирус не вызывал клинических форм заболеваний благодаря установившемуся равновесию между вирусом и организмом, вызванному как низкой вирулентностью вируса, так и относительной устойчивостью организма. В настоящее время появилась материальная основа для такого предположения: наличие в составе ВИЧ и ВИО гена nef с негативной регуляцией, продукт которого способен подавлять функции структурных и неструктурных генов. Такую ситуацию можно сравнить с зараженностью обезьян ВИО. Эти вирусы были выделены от разных видов обезьян в Африке и Азии.
ВИО широко распространен среди африканских зеленых мартышек, заражая 30—70% популяции, однако он лишен патогенных свойств и у этих обезьян не вызывает заболевания. При этом вирус способен к активной репликации в лимфоцитах крови зеленых мартышек, но не вызывает цитопатического эффекта. Однако вирус иммунодефицита, выделенный от содержащихся в неволе азиатских макак, обладает патогенными свойствами и вызывает у обезьян заболевания, сходные со СПИД человека. Он заражает ту же популяцию T-лимфоцитов — T-помощников, рецептором для него также являются молекулы CD4 на поверхности N-клеток, он вызывает состояние иммунодефицита, обусловленное, так же как и у человека, снижением количества N4-клеток и нарушением их функции. Животные погибают от вторичных инфекций, похожих на оппортунистические инфекции при СПИД. Однако вирус не был обнаружен у диких азиатских макак. Предполагалось, что больные макаки были заражены в неволе и источником их заражения были африканские зеленые мартышки, содержащиеся в том же питомнике. Но при изучении геномов вирусов, выделенных от азиатских макак и африканских зеленых мартышек, показаны существенные различия между ними, свидетельствующие о независимой эволюции этих вирусов [Fukasawa М. et al., 1988].
В то же время обнаружено и большое сходство в организации геномов ВИЧ и ВИО и их серологических свойствах. Есть данные о том, что по вирулентности для людей ВИЧ-1 и ВИЧ-2 также существенно различаются. При заражении ВИЧ-2 заболевание протекает менее остро, чем при заражении ВИЧ-1, и не ведет к столь неотвратимому и быстрому концу. Генетический аппарат этих вирусов имеет различия. Например, в составе ВИЧ-2 и ВИО отсутствует ген vpu, продукт которого, возможно, повышает патогенность вирусов. Напротив, у ВИЧ-2 и ВИО есть ген vpx, продукт которого может обладать функцией репрессора активаторов и уменьшать патогенность вирусов. Вирулентность изолятов ВИЧ-1 также может варьировать в широких пределах. Можно допустить возможность длительного сосуществования вируса и организма, тем более что сама биологическая природа ретро-вирусов — обязательный этап интеграции вирусного генома с геномом клетки-хозяина, образование провируса и наследование его вместе с хромосомной ДНК, наличие непатогенных эндогенных ретровирусов, передающихся вертикально — обосновывает возможность сосуществования представителей этого семейства с клеткой без губительных последствий для «хозяина».
Подтверждением этой возможности является, например, более высокий уровень антител против ВИЧ-2 у старших по возрасту африканских проституток по сравнению с таковым у молодых. Следовательно, с возрастом увеличивается число случаев контакта с вирусом и инфекция не заканчивается летальным исходом. Известны случаи заражения обоими вирусами. Например, проститутки Западной Африки, зараженные ВИЧ-2, часто позже заражались ВИЧ-1. В том случае, если эта инфекция будет протекать не столь тяжело и не вызывать губительных последствий, могут быть определены новые подходы к созданию вакцины против СПИД с «участием» ВИЧ-2.
Аналогичные соображения об эволюции ретровирусов высказывались и по поводу происхождения N-лимфоцитарных вирусов человека HTLV-I и HTLV-II. Как и в случае возбудителя СПИД, вскоре после открытия HTLV был выделен близкий ему по свойствам вирус у обезьян (японских макак), который обозначен как STLV. Организация генома обоих вирусов идентична, а их нуклеотидные последовательности почти одинаковы, гомология достигала 90—95%. Вирус обезьян вызывал у макак рак лимфоидной ткани подобно тому, как вирус человека вызывал лейкоз. Вскоре было обнаружено, что STLV заражает и африканских, и азиатских обезьян Старого Света; уровень зараженности варьирует от 1 до 40%. При этом вирус человека более родствен вирусу, выделенному от африканского шимпанзе и африканской зеленой мартышки (95% гомологии), чем вирусу азиатской макаки (90% гомологии). На этом основаны гипотезы о происхождении HTLV от вирусов обезьян. Большую роль в возникновении и эволюции вируса человека сыграл вирус, заражающий африканских обезьян. В соответствии с одной из гипотез HTLV произошел от вируса, заражавшего общего предка крупных человекообразных приматов в эпоху эоцена, т. е. около 40 млн лет назад. Это заключение основано на том, что 5% различие в нуклеотидных последовательностях вирусов человека и обезьян достаточно существенно и свидетельствует о дивергенции вирусов параллельно с дивергенцией линии приматов Нового и Старого Света. После этого вирусы обезьян и человека проделали параллельную эволюцию вместе со своими «хозяевами» [Эссекс М., Канки Ф., 1988].
В то же время при такой длительной независимой эволюции двух вирусов едва ли могла сохраниться столь высокая степень гомологии, как 95%. Поэтому другая концепция происхождения HTLV предполагает, что HTLV возник в менее отдаленные времена. Например, он мог возникнуть в Африке, когда один из вариантов вируса обезьян приобрел способность циркулировать среди людей, а затем этот вариант распространился в страны Нового Света в результате работорговли и в Японию, куда его завезли португальские торговцы-мореплаватели.
Как и в случае HTVL, альтернативная изложенной выше точка зрения на происхождение вирусов иммунодефицита основывается на том, что эти вирусы дивергировали не миллионы лет назад, в далекие доисторические времена, а в обозримом прошлом, менее 1000 лет назад. Срок возникновения вирусов у разных авторов варьирует от 40 [Smith Т. et al., 1988] до 140 [Sharp Р., Vi W.-H., 1988] и 280 [Yokoyama S. et al., 1988] лет. Эта концепция основана на том факте, что нуклеотидные замены в геномах ретровирусов накапливаются в миллионы раз быстрее, чем в ядерных ДНК высших организмов. Огромная скорость мутационного процесса обусловлена высокой скоростью ошибок при репликации вирусных РНК И синтезе ДНК на РНК-матрице. В результате возможна одна ошибка на 103 или 104 оснований, в то время как для ДНК скорость ошибки не превышает одной на 109[Penny D., 1988]. Поэтому эволюция у ретровирусов могла протекать в миллион раз быстрее, чем в случае ДНК-геномов.
Для определения филогенетической истории возникновения вирусов иммунодефицита были использованы традиционные подходы, основанные на расчете числа мутаций в вирусных геномах. В основе такого расчета лежит определение времени по скорости замен нуклеотидов на один сайт за один год. Однако для ВИЧ такой подход оказался осложненным по нескольким причинам: недостаточное число изолятов с известной структурой генома, высокая вариабельность известных штаммов ВИЧ-1, которая затрудняет идентификацию гомологичных последовательностей, и, главное, отсутствуют данные о временных соотношениях штаммов как калибровочных точек из-за короткой эпидемиологической истории вирусов. Наиболее старый изолят ВИЧ-1, выделенный в Заире из хранившегося образца крови, относится всего лишь к 1976 г. [Smith Т. et al., 1988].
Т. Смит и соавт. (1988) построили эволюционное древо для вирусов иммунодефицита, используя 5 изолятов ВИЧ-1, два ВИЧ-2 и два ВИО. Сравнения проводили по наиболее вариабельному гену env с целью выявления наиболее консервативных сайтов и исключения недостоверных различий. В гене env имеются 3 консервативные области, связанные с функцией белка: цистеиновые остатки, сайты гликозилирования и сайт протеолитического нарезания. Авторы исходили из того, что скорость мутаций была постоянной в течение всей филогенетической истории вирусов (теория молекулярных часов). У всех изолятов отличие ВИЧ-1 1976 г. от более «свежих» изолятов составляет 11,6±2,0 замен на 1000 в год для 3-го нуклеотида кодона. У двух изолятов ВИЧ-2, выделенных с разницей в 1 1/2 года, обнаружено 21 ±5 замен на 1000 в год. Это позволяет определить период дивергенции ВИЧ-1 и ВИЧ-2 в 37 лет, что совпадает, как полагают авторы, с началом эпидемии в Африке, на Гайте и в США. Действительно, серологические и клинические данные указывают на распространение ВИЧ-инфекции в Африке в середине 50-х годов [Plot Р. et al., 1988; Curran J. W. et al., 1988], а в США в 1969 r. [Smith Т. et al., 1988]. На основании полученных данных построено эволюционное древо, которое, однако, показано без корней. Эта схема не исключает того, что вирусы обезьян могли произойти от вирусов человека, а не вирусы человека от вирусов обезьян.
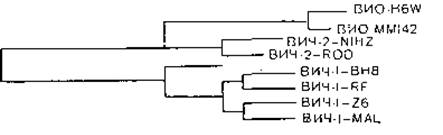
Анализируя данные Т. Смита и соавт. Д. Пенни (1988) пытается выявить те корни эволюционного древа, которые позволили бы определить происхождение вирусов. Если Т. Смит и соавт. уравнивают скорости эволюции ВИЧ-1 и ВИЧ-2, то Д. Пенни останавливается скорее на том варианте эволюции, при котором корень древа ближе к ВИЧ-2, поскольку скорость мутационного процесса у ВИЧ-1, как у более вирулентного штамма, должна быть выше.
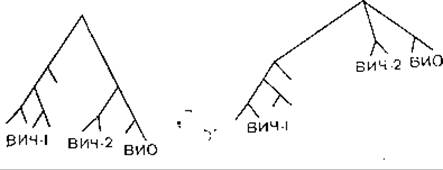
М. Мак-Клюре и соавт. (1988) построили эволюционное древо для 17 ретровирусов, включая ВИЧ, по скорости мутаций в наиболее консервативном гене pol и наименее консервативном гене env. Как и следовало ожидать, в первом случае было получено более однородное древо, чем во втором.
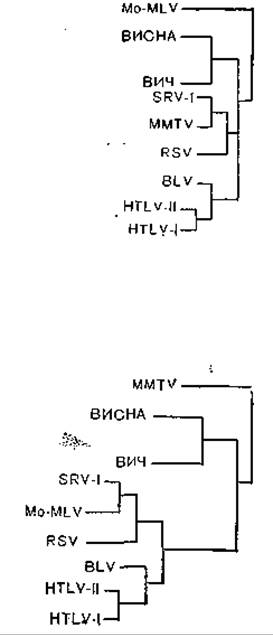
Срок эволюции ВИЧ, равный 280 годам, был определен исходя из предположения, что наиболее консервативный ген pol лентивирусов мутирует с той же скоростью, как и вирусные онкогены, т. е. 500 замен на один сайт в год [Yokoyama С. et al., 1988]. Однако другие авторы исходят из более высокой скорости замен в гене pol — 960 и полагают, что ВИЧ-1 и ВИО дивергировали примерно 150 лет назад, ВИЧ-2 и ВИО — 30 лет назад, а лентивирусы приматов отделились от вирусов Висна около 300 лет назад [Sharp Р., Li W.-H., 1988].
Авторы эволюционных теорий не исключают возможности, что ВИЧ-1 и ВИЧ-2 возникли независимо друг от друга от ВИО. Рассматривается возможность того, что ВИЧ-1 произошел от ВИЧ-2 как особо вирулентный штамм в соответствии с более коротким инкубационным периодом и, следовательно, с большей скоростью эволюции в связи с большим количеством мутаций [Penny D., 1988].
Подобные расчеты вызывают критику некоторых эволюционистов. Так, К. Мульдер (1988) считает эти определения ошибочными, так как они основаны на ложной идентичности. Поскольку вирус африканских зеленых мартышек значительно отличается от ВИЧ, вирусы человека не могли произойти от вирусов обезьян в недавнем прошлом. Скорее всего эти вирусы имели общего предшественника среди вирусов приматов. Таким образом, К. Мульдер полностью разделяет точку зрения В. М. Жданова. В. М. Жданов полагал, что все 3 вируса, ВИЧ-1, ВИЧ-2 и ВИО, дивергировали от общего предка и все они были патогенны, но вирус африканских зеленых мартышек утратил патогенность после дивергенции. Возможна и другая трактовка: все 3 вируса были непатогенны и ВИЧ-1 и ВИЧ-2 приобрели патогенность после дивергенции. Возможно, вирус стал возбудителем иммунодефицита лишь после того, как произошли изменения в его генетической структуре и активировались гены-регуляторы, в несколько сотен раз усиливающие репродукцию вируса и патологический процесс.
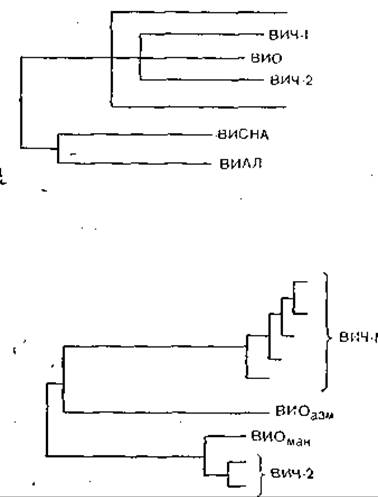
Благодаря продуктам этих генов происходят активация провируса в Т-лимфоцитах и переход из латентной стадии в клиническую, при этом механизмы активации провируса могут быть многообразными. Включение активной экспрессии генов может произойти в результате взаимодействия трансактиватора — продукта гена tat— с последовательностью TAR. Активация может произойти в результате образования клеточного белка NF-kB в Т-лимфоцитах, стимулированных иммуногеном. В этом случае механизм включения провируса отличается от предыдущего, так как белок NF-kB связывается с другой областью LTR — усилителем (в составе LTR ВИЧ-1 этот белок связывают две последовательности, а у ВИЧ-2 — одна). Форболовые эфиры, образующиеся при активации Г-лимфоцитов, активируют провирус, связываясь с областью LTR, синергичной с tat. Трансактиваторы других вирусов — вируса гепатита В, аденовируса, герпесвирусов — обладают иным механизмом действия. Например, активация ВИЧ белком аденовируса EIA зависит от ТАТА box, а активаторы вируса простого герпеса работают по другому механизму. Хотя еще далеко не все пути активации провируса известны, очевидно, что этот процесс может быть вызван многими факторами, взаимодействующими с разными регуляторными элементами самого вируса и друг с другом. Изучение механизма их действия может способствовать созданию новых подходов к лечению и профилактике СПИД, а данные о меньшей патогенности ВИЧ-2 по сравнению с ВИЧ-1 могут определить новые подходы к созданию вакцины против СПИД. Таким образом, изучение взаимоотношений вирусов иммунодефицита, их происхождения и эволюции может быть не отвлеченной абстракцией и игрой ума, а проблемой, тесно связанной с пониманием эпидемиологии СПИД и перспективой контроля болезни.
Интерес к происхождению -И эволюции возбудителей СПИД возрастает с каждым годом, накапливаются новые научные факты, увеличиваются возможности, позволяющие обосновать эволюционные теории. Несомненный вклад в эту проблему при ее зарождении внес В. М. Жданов.