Эволюция вирусов - Жданов В. М. 1990
Специальная часть
Аденовирусы
Аденовирусы составляют обширную группу вирусов, поражающих теплокровных животных. Эти вирусы по строению генома и морфологии вирионов отличаются от других групп вирусов. Аденовирусы выделены в семейство Adenoviridae с двумя родами — аденовирусы млекопитающих и птиц — Mastadenovirus и Aviadenovirus [Дрейзин Р. С., 1982; Norrby Е. et al., 1976; Matthews R., 1982]. Дальнейшие подразделения в обоих родах проводят по сероварам и видам «хозяев»: аденовирусы человека hl — h41, коров bos1 — bos9, свиней susi — sus4, овец ovil — ovi5, лошадей equl, собак саn1 — can2, коз сарі, мышей musi, кур gall—gall9, индюков mell—mel2, гусей ansi, фазанов phal, уток anal. Аденовирусы человека подразделяют на 5 подродов, представители которых отличаются длиной фибр, степенью гомологии, молекулярной массой внутренних белков и др. По онкогенным свойствам для грызунов выделяют группы А: высокоонкогенные (серовары 12; 18 и 31), умеренно онкогенные (3; 7; 11; 14; 16; 21; 34 и 35) и низкоонкогенные (остальные серовары). В культурах тканей практически все аденовирусы способны трансформировать клетки. Имеются попытки связать высокую онкогенность с низким содержанием Г+ Ц-пар.
Геномом является двунитевая ДНК с молекулярной массой около 23,8х106. Длина ДНК. 11 мкм, к 5'-концу молекулы ковалентно присоединен терминальный белок. ДНК аденовируса в вирионах циркулярной формы, при этом терминальные белки взаимодействуют между собой нековалентно. На концах ДНК имеются терминальные инвертированные повторы из 100—140 пар оснований. Поэтому при удалении молекул терминального белка аденовируса ДНК образует циркулярные формы вследствие спаривания оснований. Терминальный белок участвует в циркуляризации ДНК. Аденовирусная ДНК инфекционна; инфекционность резко повышается при наличии терминального белка.
Вирионы имеют плотность 1,33—1,34 г/мл в градиенте плотности хлорида цезия, икосаэдральную симметрию, диаметр 70—90 нм. Они состоят из 252 капсомеров диаметром 8—9 нм, в том числе 240 гексонов и 12 оснований пентонов, к которым прикреплены булавовидные фибры, заканчивающиеся головкой. ДНК находится в полости капсида и ассоциирована с белком сердцевины, уложена в виде петель.
В вирионах имеются 11 —15 полипептидов, которые обозначают римскими цифрами от II до XII: пептиды гексона (II), основания пентона (III), связанный с ним белок и фибры (ІІІа, IV), белки сердцевины (V, VII), гексонассоциированные белки (VI, VIII—XII). Молекулярная масса белков капсида составляет 120 000 (II), 24 000 (VI), 13 000 (VIII), 19 000 (IX), 85000 (III), 62 000 (IV), белков сердцевины — 48000 (V) и 18 500 (VII). Белки сердцевины сходны с гистонами. Протективными белками являются гексоны, пентоны и фибры, с последними связан типоспецифический иммунитет.
Репродукция аденовирусов протекает стадийно: адсорбция, проникновение вирионов в клетку и частичная депротеинизация, ранние синтезы, репликация ДНК, поздние синтезы, сборка вирионов, выход из клетки. Репликация вирусной ДНК и сборка вирионов происходят в ядрах зараженных клеток, поток мРИК идет из ядра в цитоплазму, а синтезированные в цитоплазме белки транспортируются в ядра в места сборки вирионов. Вирионы прикрепляются к специфическим клеточным рецепторам клеточной мембраны с помощью фибр, проникают в клетку посредством эндоцитоза, теряя при этом часть белков капсида. По микротрубкам вирион транспортируется к ядерным порам и здесь теряет большую часть белков, сохраняя гистоноподобные внутренние белки (V, VII), терминальный белок, низкомолекулярный (4000) белок μ.
Ранняя транскрипция охватывает 5—18% длины генома и локализуется в левой 5' (EА) и правой 3' (Е3) частях генома. Существуют еще более тонкие различия ранних синтезов, выделяют сверхранние (L1), предранние (E1А), запоздало ранние (Е1В—Е4) и промежуточные (ІVa2, IX) области генома. Область E1 (E1А) интересна и тем, что в ней есть гены, кодирующие синтез трансформирующих белков (рис. 43). Синтез мРНК аденовируса катализируется клеточной РНК- лолимеразой II, при этом происходят формирование кэп-структур, сплайсинг, полиаденилирование. При этом кэп-структуры для областей Е1А и Е1В разные.
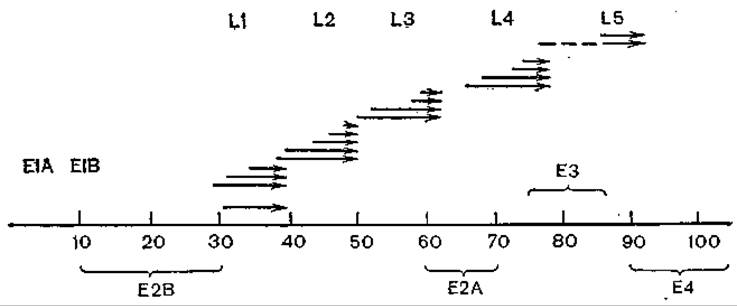
Рис. 43. Гены и продукты генов аденовирусов.
Вирусные мРНК показаны стрелками; L — поздние, Е — ранние белкн. По оси абсцисс — относительные величины.
Ранние белки Е2А и Е2В обеспечивают репликацию вирусной ДНК, белками Е1А и Е1В обусловливается трансформация, причем образование опухолей у хомяков связывают с синтезом ранних антигенов Т, которые в отличие от антигенов Т паповавирусов многочисленны. Помимо обычных мРНК, в зараженных клетках синтезируются низкомолекулярные VA (virus-associated) ДНК. Этот синтез катализируется клеточной РНК-полимеразой III, ДНК регулирует этапы поздней трансляции.
После заражения клеток аденовирусами ДНК проникает в ядра и образует комплексы с клеточными гистонами. В этом виде на ней происходит транскрипция ранних генов. Репликация ДНК осуществляется под «защитой» ДНК-связывающих белков, а затем — гистонов. На этой структуре происходит транскрипция поздних генов. Затем вновь синтезированная ДНК образует комплексы с белками сердцевины и инкапсидируется, формируя вирионы [Dery С. et al., 1985]. Пока изучены лишь немногие гены аденовирусов. Так, известно, что с геном E1А связана литическая и трансформирующая активность, с геном 1В — репликация и трансформация, с геном E1 — иммортализация клеток.
Репликация аденовирусной ДНК сопровождается 90% угнетением синтеза «хозяйской» ДНК. В отличие от репликации «хозяйской» ДНК путем образования фрагментов Оказаки синтез аденовирусной ДНК происходит непрерывно с двух ее концов. При этом терминальный К-белок с молекулярной массой 55 000, ковалентно связанный с 5'-концами нитей, является затравкой для инициации синтеза вирусной ДНК. Предложены и другие варианты модели репликации аденовирусной ДНК, учитывающие участие дополнительных факторов клеточного и вирусного происхождения (рис. 44).
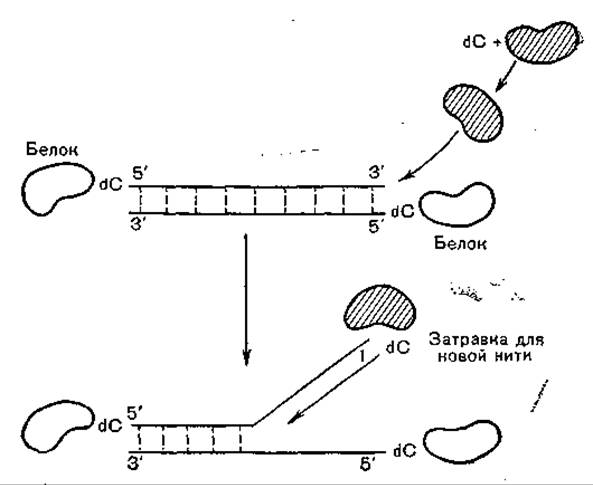
Рис. 44. Модель белковой затравки для инициации синтеза аденовирусной ДНК. Вновь образованные нити ДНК (1) ковалентно связаны с белком.
С началом, репликации ДНК ранние синтезы выключаются и их заменяют поздние синтезы. Большинство полипептидов, синтезируемых в поздней стадии, являются структурными белками или их предшественниками. Однако некоторые синтезируемые белки (молекулярная масса 100 000, 50000 и 39 000) не являются структурными, хотя участвуют в сборке вирионов. Последняя происходит в ядрах и представляет собой многоступенчатый процесс. Сначала формируются гексоны из тримеров полипептида II и пентоны. В этом процессе участвует неструктурный белок с молекулярной массой 100 000. Затем образуются «легкие капсиды» (600S, 1,315г/мл), содержащие, помимо геномов, белки VI, VIII, IIIа, белки с молекулярной массой 55 000 и 39 000. ДНК входит в формирующиеся капсиды через одну из открытых вершин, и капсиды становятся более плотными (600S, 1,35 г/мл). «Юные» вирионы становятся «зрелыми», накапливаясь в ядрах. При этом клеточные синтезы полностью блокируются и клетки погибают.
Наряду с описанной продуктивной инфекцией при заражении клеток могут происходить интегративные процессы. Предполагают даже, что в процессе репликации имеются быстро преходящие стадии интеграции вирусного генома с клеточным. Что же касается интегративного типа взаимодействия, то оно имеет место преимущественно при инфекции клеток высокоонкогенными аденовирусами, причем интегрируется; обычно не весь геном аденовируса, а часть его, несущая онкогены в области ранней транскрипции. Области ранних генов (E1A, Е1В) являются началом репликации и трансформации. Полагают, что инициация трансформации и ее поддержание обеспечиваются разными генами, вернее, их продуктами [Hurwitz D., Chinnadurai G., 1985] и в этом процессе участвуют клеточные гены (белок pp60c-src). Это справедливо не только- в отношении аденовирусов, но и других онкогенных ДНК-содержащих вирусов — полиома и папилломавирусов [Amini S., et al., 1986].
Онкогенные свойства аденовирусов и ряда других онкогенных ДНК-содержащих вирусов с эволюционной точки зрения могут казаться бессмысленными, тем более что у естественных «хозяев» они часто не вызывают трансформации клеток. Это, в частности, относится к аденовирусам, длительно персистирующим в миндалинах и тем не менее не являющимся причиной рака и сарком дыхательных путей и верхнего» отдела пищевода. Некоторый свет на этот своеобразный путь эволюции проливают исследования ранней области (1В) генома высокоонкогенного аденовируса 5. Эта область, занимающая 0—11,2 участка генома, имеет две разные транскрипционные единицы, Е1А и Е1В, и их продукты необходимы как для литической инфекции, так и трансформации. Мутации в области Е1В, поражающие гены этой области, кодирующие синтез антигенов с молекулярной массой 19 000 или 21 000; сопровождаются деградацией хромосомной ДНК [White Е. et al., 1984] или вирусной и клеточной ДНК [Pilder S. et al., 1984]. Из других особенностей аденовирусов заслуживают особого упоминания две: существование дефектных сателлитов аденовирусов и особый тип взаимодействия аденовирусов с паповавирусами. Первая рассмотрена в главе 22, здесь же имеет смысл остановиться на второй.
Взаимодействие аденовирусов с SV40 имеет своеобразный характер. Аденовирусы размножаются в некоторых видах клеток лишь в присутствии SV40, который в этом случае является хелпером, поскольку удаление его (например, с помощью иммунной сыворотки) прекращает и размножение аденовируса в клетках почек обезьян вследствие блокирования синтеза некоторых структурных белков. В этом случае антиген Т SV40 является трансактивирующим фактором, более активно (нежели терминальный белок аденовируса) связывающимся с аденовирусной ДНК, что необходимо для инициации ее репликации.
Аденовирусы образуют рекомбинанты при совместном культивировании, между мутантами может осуществляться комплементация. Из других генетических особенностей интересна способность образовывать гибриды с SV40, включающие полный геном или часть генома паповавируса. Аденовирусы также обеспечивают репродукцию дефектных парвовирусов — сателлитов аденовирусов или аденоассоциированных вирусов. Как уже упоминалось, семейство аденовирусов подразделяется на два рода, вирусы в пределах рода имеют серологическое родство, в то время как серологические связи между родами отсутствуют.
Род мастаденовирусов насчитывает более 80 представителей, поражающих человека, обезьян, лошадей, крупный рогатый скот, овец, коз, свиней, собак и мышей. Хотя аденовирусы могут размножаться в тканях разных животных, в естественных условиях они поражают один или немногие близкие виды.
Аденовирусы человека по некоторым свойствам, включая онкогенные потенции, подразделяются на 6 групп, обозначаемых буквами латинского алфавита. Вирусы серотипов 1—35 вызывают заболевания дыхательных путей и конъюнктивиты, фарингоконъюнктивную лихорадку, ангины, они легко культивируются в клеточных культурах; вирусы сероваров 36—42 вызывают кишечные заболевания, не культивируются. Высокоонкогенные вирусы (группа А, серовары 12; 18 и 31, группа С, серовары 2, 4 и др.) онкогенны для новорожденных хомяков и вызывают трансформацию клеточных культур, но для человека они не онкогенны, хотя могут длительно персистировать в миндалинах. Онкогенными потенциями обладают некоторые аденовирусы, поражающие обезьян и других животных. У животных аденовирусы вызывают поражения дыхательных путей, кератоконъюнктивиты, поражения кишечного тракта, гепатит у собак. Многие из них вызывают субклинические и бессимптомные инфекции, что, впрочем, относится и к аденовирусам человека.
Род аденовирусов птиц насчитывает 15 представителей, поражающих домашних (куры, индюшки, утки, гуси) и диких (перепелки, фазаны) птиц. Вирусы вызывают поражения дыхательных путей и другие заболевания, включая летальные поражения эмбрионов.
Четко очерченная группа аденовирусов не имеет аналогов среди других групп вирусов. Если даже считать эволюционно общим признаком наличие терминального белка на 5'-конце ДНК, то этот признак существует у вирусов многих разнородных групп. Помимо РНК'Содержащих пикорнавирусов, а также вирусов заболеваний растений (собемо-, комо- и нейовирусов), которые образуют группу с одинаковой стратегией генома, терминальные белки имеют многие ДНК-содержащие вирусы, а также многочисленные вирусы, содержащие одно- и двунитевую РНК и даже митохондриальная ДНК кукурузы. [Garcia Р. et al., 1986]. Естественно, что при таком разнообразии генетических структур, имеющих терминальные белки, вряд ли можно их наличие принимать во внимание для оценки эволюционной общности вирусов, хотя у некоторых фагов (Ср-1, ф29), помимо терминальных белков, имеются инвертированные повторы на концах молекулы ДНК. Более того, есть веские основания считать, что схема репликации аденовирусов и фагов ф29 и Ср-1 имеет много общих черт [Вартапетян А. Б., 1982; Garcia Р. et al., 1986]. Кстати, хвостатые фаги следует считать филогенетически древними. И все-таки непонятно, как возникли аденовирусы, ограничив свои экологические ниши теплокровными животными, а также человеком.
Дальнейшие пути эволюции понятны. По-видимому, эволюция большинства вирусов была сопряжена с эволюцией их «хозяев», и этим можно объяснить четкую очерченность двух родов аденовирусов, дивергенция которых привела к утрате иммунологических связей между представителями разных родов. В то же время существование серологического родства между вирусами внутри родов и высокая степень гомологии ДНК не только внутри групп (70—95%), но и между вирусами, поражающими разные виды (10—25%), свидетельствуют об эволюционной связи сложившихся в ходе эволюции родов. С этой точки зрения аденовирусы человека можно рассматривать как потомков аденовирусов предшествовавших, ему приматов, а разнообразие аденовирусов человека отражает эволюционное процветание этой группы вирусов.
Тем не менее многое остается непонятным и прежде всего наличие у аденовирусов онкогенных потенций, не проявляющихся фенотипически. Вероятно, онкогены аденовирусов имеют клеточное происхождение, о чем свидетельствует обнаружение гомологических участков геномов клеток млекопитающих и аденовирусов. Однако эти гены давно уже стали генами аденовирусов, необходимыми им для репродукции. Возможно, в этом и состоит ответ на поставленный вопрос, поскольку, как известно, клеточные онкогены «предназначены» не для- канцерогенеза, а выполняют важные регуляторные функции. По-видимому, это и явилось причиной инкорпорации клеточных генов в геном аденовирусов в далеком прошлом, когда возникли эти вирусы. Весьма характерно с этой точки зрения, что ген E1А аденовирусов серотипов 2 и 5, с которого образуются 3 транскрипта (185, 12S и 9S) обеспечивает и литическую, и трансформирующую активность. Точно так же ген 18 (58 000-М2) аденовируса серотипа 12 является ранним теном, продукт которого обеспечивает начало репликации вирусной ДНК, а также трансформации. Это «а так же», по- видимому, никогда не реализуется при инфекции вирусом своего естественного «хозяина», и потенциальная трансформирующая активность этого гена, как, впрочем, и нормальных клеточных онкогенов, реализуется лишь в особых, искусственно созданных условиях — при размножении вируса в культуре ткани или при заражении им новорожденных хомяков.
Здесь же в разделе об аденовирусах целесообразно упомянуть две группы фагов, морфология вирионов которых имеет сходство с таковой аденовирусов. Семейство Tectiviridae, насчитывающее около 10 фагов (группа RRD), имеет геном в виде двунитевой ДНК с молекулярной массой 9х106, что составляет 14% массы вирионов. В вирионах содержатся 16— 18 белков. Вирионы построены по типу икосаэдров диаметром 65 нм с булавовидными отростками на углах. Двойной капсид состоит из ригидной внешней и гибкой внутренних оболочек. Репликация изучена мало, вирусы поражают многие виды -бактерий. Семейство Corticoviridae включает в себя 1—2 фага (группа РМ2), геномом является циркулярная суперспирализованная ДНК с молекулярной массой 6х106, что составляет 14% массы вирионов. В вирионах содержатся 4 белка с молекулярной массой 5х103—43х103. На вершинах углов есть щеткообразные выступы. Вирионы имеют также два капсида диаметром около 60 нм. Репликация изучена мало, вирусы паразитируют в морских Pseudomonas.
Какие-либо соображения о происхождении и эволюции этих вирусов пока невозможны.