Эволюция вирусов - Жданов В. М. 1990
Специальная часть
Заключение
Академик АМН СССР В. М. Жданов занимался проблемой органической эволюции всю свою творческую жизнь. В подходе к этим вопросам он придерживался широких биологических взглядов на природу рассматриваемых явлений. В. М. Жданов считал, что развитие материи приводит к возникновению биологической жизни и результатом ее совершенствования может стать появление разума. Это естественный этап биологической эволюции. Вид, наделенный разумом, получает огромные селективные преимущества и возможности для своего выживания и процветания. Природа совершила три попытки создать разум. Две из них, это мозг общественных насекомых и мозг осьминога, закончились неудачно, а последняя принесла успех и дала восходящую ветвь прогрессивной эволюции в виде особого вида — человека разумного. В. М. Жданова интересовали космологические проблемы. Он был сторонником идеи о множественности очагов жизни во Вселенной. Один из таких очагов, т. е. наша планета Земля и существующая на ней биосфера, стал предметом его научного творчества. Исследуя эволюционную историю биосферы, В. М. Жданов как специалист-вирусолог изучал эволюцию царства Вира. Соединяя частное с общим, он подходил к эволюции вирусов с общебиологических позиций и раскрывал значение для эволюционной теории данных, накопленных вирусологией. Творческое наследие В. М. Жданова по эволюции включает 5 монографий, вышедших в свет в 1953—1984 гг. Работа над последней книгой «Эволюция вирусов» оборвалась в 1987 г. Эти книги оказали большое влияние на становление научных взглядов на процесс эволюции вирусов и органической эволюции в целом. В данной связи интересно рассмотреть современное состояние и пути дальнейшего развития учения об эволюции вирусов, а также новейшие достижения в этой области. Наше заключение посвящено решению этой задачи. Рассматривается период 1987—1988 гг. Изложение не претендует на полноту ни по кругу затронутых проблем, ни по числу использованных литературных источников. Цель работы заключалась в выделении нескольких ключевых вопросов, представляющихся наиболее существенными. Определенное место занимают также обсуждение дискуссионных эволюционных проблем и определение места в этой дискуссии позиции Б. М. Жданова.
Эволюционные основы систематики вирусов. Таксономия вирусов внесла позитивный вклад в общую систематику. В вирусологии создана так называемая универсальная классификация, в которой выделение надвидовых таксонов проводится не только по фенотипическим признакам, но и на основе фундаментальных свойств. Учитываются тип нуклеиновой кислоты, организация генома, способ реализации генетической информации, строение вириона и другие молекулярно-биологические, биохимические и функциональные показатели. Подобный подход мало используется в систематике высших эукариотов. Практическая классификация этих организмов до сих пор основывается на морфологических критериях. Опередив систематику высших эукариотов в указанном отношении, систематика вирусов отстала от нее по биологическим принципам построения. В систематике вирусов при выделении таксонов высокого ранга не учтываются эволюционные связи между ними. Это обусловлено тем, что они до самого последнего времени не были раскрыты.
Успехи науки и в первую очередь накопление данных о первичной структуре вирусных генов и их белковых продуктов создали предпосылки для построения эволюционных начал систематики вирусов. В. М. Жданов принял активное участие в этой работе. В основу системы, предложенной им для РНК- геномных вирусов, положена стратегия вирусного генома, а сами вирусы сгруппированы по мере возрастания сложности строения.
В настоящее время в литературе появились данные, позволившие произвести дальнейший анализ эволюционных связей между рядом РНК-геномных вирусов, между вирусными и клеточными геномами, а также рассмотреть эволюционные взаимоотношения вироидов, вириоидов и клетки [Kingsbury D. W., 1988; Goldbach R., 1988]. На основании результатов секвенирования вирусных РНК, сопоставления стратегии генома, структуры и функции белков R. Goldbaсh (1987), R. Goldbach и J. Wellink (1988) приходят к выводу, что РНК-геномные вирусы растений с положительной полярностью РНК имеют сходство с вирусами животных и разделяются на две супергруппы — пикорна-подобных и Синдбис-подобных вирусов. К супергруппе пикорна-подобных вирусов растений относятся комо-, непо- и потигреквирусы. Общность между этими вирусами и пикорнавирусами, поражающими животных, заключается в следующем. 1. Во всех случаях к 5'-концу геномной РНК присоединен белок VPg с небольшой молекулярной массой, а на 3'-конце генома имеется поли (А)-участок. 2. Первичным продуктом трансляции вирусного генома является гигантский полипептид-предшественник, который путем протеолитического расщепления нарезается на функциональные белки. 3. Неструктурные белки кодируются одинаковым набором генов, который может рассматриваться как постоянный генный модуль. 4. Степень гомологии неструктурных белков превышает 20%. Во всех случаях эти белки вовлекаются в репликацию РНК.
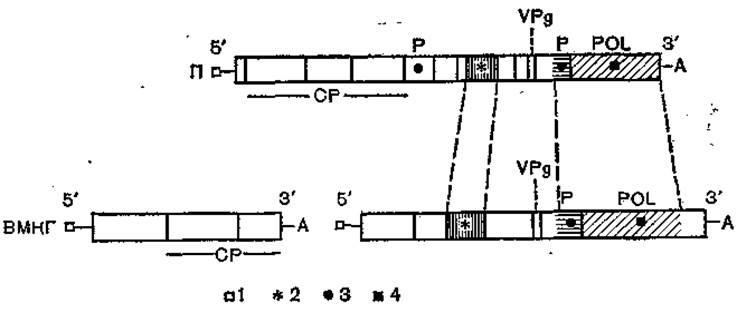
Рис. 63. Сравнение геномов пикорнавирусов (полиовирус — II) и комовирусов (вирус мозаики коровьего гороха — ВМКГ) [по Goldbach R., Wellink W., 1988].
Прямоугольники — открытые читающие рамки; заштриховано — области высокой (более 20%) гомологии; 1 — белок VPg иа 5'-конце генома; 2-нуклеотндсвязывающая область; 3 — область цистеинпротеазы; 4 — полимеразная область; А — поли(А)-последовательность на 3'-конце генома; VPg — область капсидных белков VPg: Р — область протеазы; POL — область РНК-зависимой РНК-полимеразы.
Черты сходства в организации генома полиовируса (монопартитный вирус) и комовируса мозаики коровьего гороха (разобщенный дипартитный геном) представлены на рис. 63. Обнаруживается сходство в порядке расположения и функции генов капсидных белков, белка VPg, полимеразного комплекса и протеаз. В полимеразной и нуклеотидсвязывающей областях имеются гомологичные последовательности.
К супергруппе Синдбис-подобных вирусов растений относятся илярвирусы, бромовирусы, кукумовирусы, тобамовирусы, тобравирусы, фуровирусы, хордейвирусы, кармовирусы и томбурвирусы. Общим признаком этих вирусов являются сохранение гомологичных участков генома, наличие кэп-структуры на 5'-конце РНК и образование субгеномных РНК в процессе вирусного репликативного цикла. Неструктурные белки Синдбис-подобных вирусов имеют гомологичные участки с неструктурными белками вируса Синдбис и кодируются генами, организованными сходным образом. Эти белки имеют нуклеотид-связывающую область, обладают РНК-полимеразной активностью и вовлекаются в репликацию РНК. Таким образом, члены этой группы обнаруживают сходство с вирусом Синдбис в расположении и функции генов полимеразы или, иначе, все эти вирусы имеют общий репликативный модуль. Это-указывает на общие эволюционные корни. Аналогичный вывод можно сделать в отношении пикорна-подобных вирусов растений и пикорнавирусов животных.
Растительное и животное царства разошлись в своей эволюции около 1,2х109 млн лет назад. Учитывая высокую скорость эволюции РНК-геномов, возникновение предков современных РНК-геномных вирусов растений и позвоночных животных следует отнести к более поздней эпохе. В дальнейшем эти провирусы разошлись в своей эволюции, дали многочисленные ветви, заняли различные экологические ниши и закрепились в растениях и позвоночных «хозяевах».
Известные в настоящее время пикорна-подобные вирусы растений существенно различаются между собой по морфологии вириона и ряду других признаков. Вирионы комо- и неповирусов сферические, а вирионы потигреквирусов палочкообразные. Геном комо- и неповирусов разобщен в двух частицах, а потигреквирусы являются монопартитными. Еще большим разнообразием характеризуются Синдбис-подобные вирусы. Для большинства из них характерны мультипартитность и различия в трансляционной стратегии генома. Все эти признаки относятся к вторичным, приобретенным в ходе эволюции. Возникновение мультипартитных геномов РНК-содержащих вирусов связывается, например, с сочетанным действием экологических факторов и влиянием природы генетического материала [Nee S., 1987]. Ведущую роль для эволюции в этом направлении играют высокая множественность переноса вирусов растений, отсутствие полноценной иммунной системы «хозяина», способной ограничивать размножение вируса, и значительная ошибка репликации РНК, определяющая селективные преимущества разобщенных геномов.
Важным экологическим фактором эволюционного развития положительных РНК-геномных вирусов было использование членистоногих переносчиков, обеспечивающих контакт между растениями и организмом позвоночных «хозяев». Интересно отметить, что одним из механизмов создания изменчивости служили рекомбинации. Роль последних в эволюции положительных РНК-геномов оставалась недостаточно ясной. Результаты происшедших рекомбинационных событий можно видеть при сравнении геномов некоторых пикорна- и Синдбис- подобных вирусов растений [Goldbach R., Wellink J., 1988]. В целом итогом эволюции является образование двух ветвей положительных РНК-геномных вирусов, объединенных общностью происхождения, сохранивших элементы структурно- функционального единства и использующих в качестве «хозяев» представителей животных и растительных царств.
В. М. Жданов разделял мнение об эволюционных связях вирусов с генетическими элементами клетки. Эта идея получает все большее развитие. На основании структурно-функционального сходства и гомологии генома построены две филогенетические линии: 1) интроны группы I — вироиды — вирусоиды — дельта-агент и 2) транспозоны — ретровирусы — гепаднавирусы [Kingsbury D. W., 1988]. Общность первой филогенетической линии определяется тем, что геном составляющих ее агентов во всех случаях представлен небольшой по размеру однонитевой РНК, богатой комплементарными участками. Имеются области высокой гомологии. Прародительской формой, по-видимому, являются подвижные генетические элементы клетки, подобные интронам группы I, давшие начало вироидам.
Известно 14 вироидов. Все они используют в качестве «хозяев» растения. Представляют собой «голую» РНК, не имеющую белковой оболочки. Протяженность генома 246—371 нуклеотидов. Не требуют для своей репликации вируса-помощника. Репликация вироидов управляется ДНК-зависимой РНК- полимеразой клетки «хозяина» с использованием кРНК-олигомеров в качестве матрицы. Летальное действие вироидов на растительную клетку связывается с подавлением пре-мРНК-процессинга [Smarda S., 1987; Albanese J., La Rosa R., 1988].
Вирусоиды рассматриваются как вироиды, утратившие способность к самостоятельной репликации. Репликация вирусоидов осуществляется при помощи вируса-помощника. Используют в качестве «хозяев» растения. Геном имеет протяженность 350—400 оснований и содержит протеинкодирующие последовательности, направляющие синтез белков, которые участвуют в образовании оболочки вирусоидов.
Особое место в рассматриваемой филогенетической линий занимает дельта-агент, представляющий собой единственный известный в настоящее время вирусоид-подобный патоген человека. Его репликация происходит при помощи вируса гепатита В. Геном дельта-агента состоит из 1683 нуклеотидов. Имеются 5 открытых рамок считывания, две из которых находятся в геномной, а три — в антигеномной ориентации [Makino Sh. et al., 1987]. Кодируемый вирусным геномом белок с молекулярной массой 24 000 фосфорилирован по серину. Этот фосфопротеид обладает РНК-связывающей активностью и участвует в образовании частиц дельта-агента [Chang Ming-Fu et al., 1988]. Дельта-агент не имеет аналогов среди вирусов животных. Не ясно, происходит ли дельта-агент непосредственно от нитронов группы I или же его эволюция шла по этапам через вироиды и вирусоиды. С последними дельта-агент имеет значительную гомологию [Makino Sh. et al., 1987].
Возможность построения филогенетической линии транспозоны — ретровирусы — гепаднавирусы обусловлена тем, что входящие в нее ретро- и гепаднавирусы используют для своей репликации механизм обратной транскрипции. Область генома, кодирующая обратную транскриптазу, имеет участки высокой гомологии. Геномная ДНК гепаднавирусов и ДНК-копия ретровирусного генома обладают способностью встраиваться в клеточный геном, образуя при этом транспозон-подобные структуры. Структурно-функциональное сходство транспозонов с интегрированными геномами ретро- и гепаднавирусов указывает на их эволюционную общность. Однако сложность организации не позволяет сказать, какой элемент в этой системе является первичным. Не исключена также возможность эволюционного движения в двух направлениях, т. е. от клетки к трансмиссивным генетическим элементам и от них к клетке. Ретро- и гепаднавирусы при интеграции в геном клетки способны вызывать инсерционные мутации. Такие процессы, вероятно, являются важным механизмом формирования эукариотического генома в процессе эволюции [Jolais F., Sabo А., 1988].
Скорость молекулярной эволюции ДНК-геномных вирусов. РНК- и ДНК-геномные вирусы существенно различаются по уровню мутабельности. Репликация РНК происходит с низкой точностью. В передающуюся информацию вносится значительная ошибка. Частота мутаций за генерацию достигает 10-3—10-4. Это в 100 000 выше, чем частота мутаций ДНК. За 33 поколения РНК-геномные вирусы могут накопить такой запас изменчивости, на создание которого у ДНК-геномных вирусов потребовалось бы 10 млн поколений. Низкая мутабельность ДНК определяется природой этого генетического материала, способом репликации и способностью к репарации. Приведенные данные позволяли считать, что ДНК-геномные вирусы характеризуются глубоким консерватизмом наследственности. В настоящее время это традиционное мнение требует если не пересмотра, то уточнения.
Вопрос о мутабельности ДНК-геномных вирусов является частью более общего вопроса о скорости молекулярной эволюции ДНК на различных ступенях эволюционной лестницы. Дискуссия по этому поводу в научнной литературе ведется более 15 лет. На основании накопленных данных можно считать установленным, что скорость молекулярной эволюции неодинакова в различных таксономических группах и единых молекулярных часов эволюции не существует. Основываясь на результатах гибридизации уникальных последовательностей ДНК и данных секвенирования гомологичных генов и псевдогенов у разных видов, R. J. Britten (1986) пришел к выводу, что скорость молекулярной эволюции может различаться в 5 раз и составлять от 1,3х10-9 до 6,6х10-9 замен на участок в год. Наиболее низкие скорости эволюции ДНК обнаружены у высших приматов и птиц, а наиболее высокие — у грызунов, морских ежей и дрозофилы. Li Wen-Hsiung и. соавт. (1987) считают, что скорость нуклеотидных замещений у грызунов в 4—8 раз выше, чем у высших приматов, и в 2—4 раза выше, чем у копытных. Темп молекулярной эволюции гоминоидов ниже, чем высших приматов. У человека по сравнению с шимпанзе и орангутангом отмечается более низкая частота нуклеотидных замещений. В качестве причин различий в скорости молекулярной эволюции называют продолжительность поколений и число репликаций ДНК в клетках зародышевого пути. Указывается также на особенности механизмов репликации ДНК и эффективность репарации.
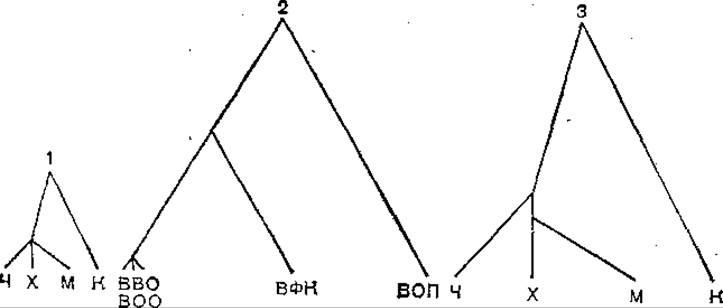
Рис. 64. Филогенетические древа позвоночных и поксвирусов [по Gentry G. A. et ah, 1988].
1 — позвоночные; 2 — поксвирусы; 3 — позвоночные. Скорость эволюции уравнена со скоростью эволюции поксвирусов (коэффициент 2,8). Длина ветвей в случаях 1 в 2 пропорциональна эволюционному расстоянию, выраженному в числе мутаций на 100 аминокислотных остатков в молекуле тимидинкиназы позвоночных или вирусов. Ч — человек; X — хомяк; М — мышь; К — курица; ВВО — вирус ветряной оспы; ВОО — вирус оспы обезьяны; ВОВ — вирус осповакцины; ВФК, — вирус фибромы кролика; ВОП — вирус оспы птиц.
ДНК-теномные вирусы не составляют исключения в общем порядке. Скорость их молекулярной эволюции как агентов с более коротким жизненным циклом превышает скорость молекулярной эволюции позвоночных «хозяев». Обзор данных по этому вопросу сделали G. A. Gentry и соавт. (1988).
Представление о различиях в скорости молекулярной эволюции поксвирусов и их «хозяев» дает следующий наглядный пример. На рис. 64 показаны филогенетические древа поксвирусов и позвоночных, начерченные на основании результатов сравнения аминокислотной последовательности дезокситимидинкиназы. В случаях 1 и 2 филогенетические древа построены по единому принципу, но в различном масштабе. Длина ветвей пропорциональна эволюционному расстоянию, выраженному в числе мутаций на 100 аминокислотных остатков. Мутабельность поксвирусов превышает соответствующий показатель для позвоночных в 2,8 раза. Сравнение древа 1 и древа 2 показывает, что они различаются по высоте. Это свидетельствует, что скорость эволюции позвоночных меньше скорости эволюции поксвирусов. Древо позвоночных 3 построено в масштабе филогенетического древа поксвирусов. Использован добавочный коэффициент 2,8. Различия в протяженности древа позвоночных и древа поксвирусов, обусловленные неодинаковой скоростью замещения аминокислотных остатков дезокситимидинкиназы, стираются.
Вирусы ветряной оспы — опоясывающего лишая и вирусы герпеса типа 1 и 2 разошлись в своей эволюции около 48,6 млн лет назад. Скорость аминокислотных замен в малой субъединице рибонуклеотидредуктазы за этот период превышала соответствующий показатель для фермента «хозяев» в 38 раз. Рассмотренные данные показывают, что ДНК-геномные вирусы существенно отстают по уровню мутабельности от РНК-геномных, но несколько опережают своих позвоночных «хозяев». Это позволяет говорить об относительно низком консерватизме наследственности ДНК-геномных вирусов и выделять их среди организмов, использующих в качестве генетического материала ДНК.
Мутабельность вирусного генома создает предпосылки для осуществления микроэволюции ДНК-геномных вирусов, которая, судя по состоянию естественных вирусных популяций, протекает достаточно интенсивно. Об этом свидетельствуют насыщенность вирусных популяций мутациями и наличие внутрипопуляционных различий. Особенно интересные данные получены при изучении аденовирусов. В этих исследованиях применялась единая методика рестрикционного анализа вирионной ДНК. Поэтому результаты различных авторов сопоставимы. Li Quan-Gen и G. Wadell (1988) использовали для анализа 61 штамм аденовируса типа 3, изолированный на 6 континентах, эндонуклеазы Bell, Bglll, Hpal, Sail и Smal. Выделены 17 геномных типов, которые разделены на 3 геномные группы. Штаммы, отнесенные к 1-й группе, были выделены в Африке, Европе, Северной и Южной Америке, ко 2-й — в Африке, к 3-й отнесены штаммы, которые имели глобальное распространение, за исключением стран Южной Америки. У аденовируса типа 16 описано 16 геномных вариантов, причем участки изменчивости равномерно распределялись по всему геному. Среди 76 штаммов аденовируса типа 37, выделенных за последние 10 лет от больных на трех континентах, обнаружено 20 штаммов, отличающихся по физическим картам геномной ДНК от прототипного штамма. Изменение физических карт в некоторых случаях сопровождалось серологическими различиями, выявляемыми в РТГА и PH. Однако эти различия были невелики и не соответствовали расхождению, которое ожидалось по данным рестрикционного анализа [Adrian Fh. et al., 1988].
Роль популяций в эволюции. Непонятным на первый взгляд эволюционным представлением В. М. Жданова является отрицание реальности существования популяций у вирусов. В настоящей книге можно прочесть следующее: «Столь же неприемлемым к вирусам является и понятие популяции, так как внутриклеточная стадия репродукции, а тем более интеграционные процессы нацело лишают смысла трактовку репродуцирующегося вируса как популяции и т. д.».
Трудности введения в вирусологию понятия категории «популяция» легко преодолеваются, если учесть, что популяция есть категория историческая. Структура и принципы организации популяции изменялись в ходе эволюции. Вирусные популяции характеризуются своеобразием и существенно отличаются по своему строению от популяций высших эукариотов, которые служат эталоном популяции для большинства биологов [Цилинский Я. Я., 1988]. В. М. Жданов прошел мимо этой очевидной истины. Это прямо связано с состоянием современной эволюционной биологии и со взглядами В. М. Жданова на движущие силы эволюции.
Синтетическая теория эволюции переживает глубокий кризис. Ее центральная догма, согласно которой накопления в популяциях случайных мутаций и их последующая оценка естественным отбором являются необходимыми и достаточными условиями для осуществления микро- и макроэволюции, уже не может претендовать на монополию в изучении эволюционного процесса. Современная эволюционная теория должна учитывать непостоянство генома, нейтральность молекулярной эволюции и многие другие явления [Antonovics J., 1987; Но Mae-Wan, 1987; Pollard J. W., 1987; David J. R., 1988]. Отрицание В. M. Ждановым очевидного факта существования популяций у вирусов является своеобразным протестом против бессилия классической синтетической теории эволюции (в основном ограничивающейся рассмотрением популяционных процессов) объяснить развитие органического мира.
Одновременно с пересмотром и модернизацией синтетической теории эволюции в современной науке происходит рождение новой философии биологии. Работы В. М. Жданова по эволюции способствовали этому. В. М. Жданов назвал силу, которая может ускорить эволюционное развитие. Такой силой служит вирусная трансдукция. Мысль о роли вирусов в горизонтальном переносе генетической информации высказывалась в общем виде неоднократно. Заслуга В. М. Жданова заключается в том, что он, как профессионал-вирусолог, всесторонне обосновал эту идею.
Развитие теории эволюции не означает забвения достижений прошлого [Futuyma D. J., 1988]. Не признавая реальность существования вирусных популяций, В. М. Жданов фактически не порывал с синтетической теорией эволюции и широко использовал в своих работах популяционный и экологический подходы к эволюционным явлениям. Рассмотрим развитие этого направления.
Классическими и постоянно действующими источниками наследственной изменчивости для вирусов являются мутации, истинные рекомбинации и перераспределение фрагментов генома. Накопленные данные свидетельствуют о том, что эти источники создают в популяциях огромный запас генетической изменчивости и обеспечивают микроэволюцию. Эту функцию могут выполнять не только значительные по протяженности, но и единичные точковые мутации. К имеющимся доказательствам влияния точечных мутаций на фенотип добавилась работа Jooh Ji-Woon и соавт. (1988), установивших, что диабетический вариант вируса энцефаломиокардита отличается от недиабетического наличием одного олигонуклеотида, который не выявляется на Ti-олигонуклеотидных картах недиабетического варианта. Изменение Ti-олигонуклеотидной карты недиабетического варианта было обусловлено единичной точковой заменой А→С, локализованной в участке генома, соответствующей утраченному олигонуклеотиду. Других замен ни в этом, ни в смежных участках не обнаружено. Полученные результаты позволяют предполагать, что существенное изменение патогенных потенций вируса энцефаломиокардита, выражающееся в потере способности вызывать диабет, может быть обусловлено одной точковой мутацией типа замены. Вызывают интерес также данные, относящиеся к ретровирусам. Единичная мутация в гене оболочечных белков, приводящая к замене лизина на аргинин, нарушает их процессинг и лишает эндогенный онкотропный вирус лейкоза мышей линии С3Н/Не способности к репликации и ряда других свойств. Обратно направленная мутация в сайте процессинга (замещение аргинина на лизин) ведет к реверсии к дикому типу [Sithanandam G., Rapp U. R., 1988].
Продолжается накопление данных о роли перераспределения фрагментов генома в изменчивости орбивирусов. J. L. Stott и соавт. (1987) изучали образование реассортантов в организме телят, инфицированных двумя серотипами вируса синего языка. Преобладающее количество (89%) вирусных клонов, изолированных из крови зараженных животных, было реассортантами. В их образовании участвовали 6 из 10 сегментов, имеющихся в вирусном геноме. Идентифицировано 16 видов реассортантов. Р. D. Oberst и соавт. (1987) показали, что генетическое взаимодействие между штаммами вируса синего языка в организме естественных «хозяев» происходит не только при острой, но и длительно текущей инфекции. Авторы выделяли реассортанты из организма быка на протяжении 41 дня, в течение которых продолжалась виремия. Полученные результаты указывают, что пересортировка геномных сегментов вносит значительный вклад в образование фено- и генотипических различий, характерных для циркулирующих в природе штаммов вируса синего языка.
Благодаря высокой мутабельности генетического материала эволюция РНК-геномных вирусов происходит в организме зараженного «хозяина» во время инфекционного процесса. Вирус, внедрившийся в организм «хозяина», генетически отличается от вируса, который в последующем накапливается у больного. F. Gebauer и соавт. (1988) проследили изменчивость вируса ящура серотипа С3 в организме крупного рогатого скота на протяжении 539 дней персистентной инфекции. Скорость молекулярной эволюции вирусного генома составила 0,9х10-2—7,4х10-2 замен на участок в год; 59% мутаций РНК влекли за собой аминокислотные замены. В процессе инфекции от быка были получены изоляты вируса, отличающиеся в антигенном отношении от родительского штамма. Эти данные указывают, что крупные жвачные животные не только выполняют роль резервуаров вируса ящура, но й служат источником измененных вариантов.
Накопление мутаций и изменчивости, «поставляемой» рекомбинациями, ведет к формированию внутри- и межпопуляционных различий. В этом отношении чрезвычайно показательны данные о полиовирусе, рассмотренные в обзоре Ю. 3. Гендона (1988). Использование Т1-олигонуклеотидного картирования, определение последовательностей нуклеотидов и аминокислот, а также антигенный анализ, проведенный с помощью панели моноклональных антител, позволили установить, что штаммы полиовируса, циркулирующие в различных географических зонах, характеризуются фено- и генотипической индивидуальностью. Выделены 10 групп (Среднеазиатская, Северной Америки, Южноафриканская, Индийская и т. д.). R. Rico-Hesse и соавт. (1987) провели сравнительное изучение последовательностей генома, кодирующих участки капсидного белка VP1 и некапсидного протеина А2 у 62 штаммов полиовируса типа 1. Штаммы были выделены за последний 31 год на 5 континентах от больных паралитическим полиомиелитом. Проведена группировка и выявлены фокусы циркуляции сходных штаммов. Установлено рекомбинантное происхождение (дикий — дикий, вакцинный — дикий) некоторых изолятов. В практическом отношении важно отметить, что в естественных популяциях полиовируса могут появляться антигенно атипичные штаммы, которые преодолевают иммунологический барьер, создаваемый вакцинацией. Изменчивость в этом направлении связана с неполным охватом населения иммунизацией и невысоким уровнем коллективного иммунитета [Цилинский Я. Я., 1988]. Перед здравоохранением возникает проблема принятия мер по защите от антигенно измененных вариантов и созданию соответствующих вакцин. Новые возможности для решения этой задачи открывают успехи в получении жизнеспособных межтиповых гибридов полиовируса генно-инженерными методами [Hogle J. М., 1988].
В процессе эволюции вирусные популяции приспосабливаются к среде обитания, занимают определенную экологическую нишу и расходятся генетически. Важные данные получены при изучении вирусов рода Hantaanvirus семейства Виunyaviridae [Le Due J. W., 1987]. Род включает в себя возбудителя корейской геморрагической лихорадки, вирус хантаан, выделенный в 1978 г. в Корее, и хантаан-подобные вирусы, которые разделяются на 3 серологические группы. Все названные вирусы сходны по своей экологии, способу передачи и механизму выживания в природе. Они вызывают у грызунов хроническую асимптоматическую инфекцию. Несмотря на высокий иммунный ответ, вирус может сохраняться в организме «хозяина» пожизненно. Вирус выделяется и распространяется во внешней среде со слюной, мочой и фекалиями грызунов; за счет этого механизма передается в популяциях грызунов горизонтально. Вирус хантаан и хантаан-подобные вирусы служат причиной различных геморрагических лихорадок у человека. Заражение человека осуществляется аэрогенным, а также контактным путем и через укус грызунов.
Хантаанвирусы имеют глобальное распространение и в зависимости от занимаемой географической зоны различаются серологически, по степени вирулентности для человека и др. Вирус хантаан и близкие к нему штаммы циркулируют в Китае, Корее, на Дальнем Востоке, а также на юге Сибири и в Европейской части СССР. У человека он вызывает тяжелую геморрагическую лихорадку с почечным синдромом, сопровождающуюся высокой смертностью. В противоположность этому хантаан-подобные вирусы, циркулирующие в Скандинавии, Западной и Центральной Европе, а также в некоторых районах Европейской части СССР (прототипный штамм Puumala), служат причиной относительно легко протекающего и доброкачественного заболевания — геморрагической нефропатии. Хантаан-подобные вирусы, распространенные в США и Канаде (прототипный штамм Prospect Hill), не обладают вирулентностью для человека. Причиной указанных различий, помимо географической изоляции, является действие экологического фактора — использование различных «хозяев». «Хозяином» вируса хантаан служат мыши Apodemus agrarius, вируса Puumala — обыкновенная полевка Clethrionomys glareolus, а вирус Prospect Hill экологически связан с грызунами Microtus californicus. На значение экологического фактора в дифференцировке хантаанвирусов указывает тот факт, что ареалы Apodemus agrarius и Clethrionomys glareolus в Европе перекрываются. В результате на одной и той же территории циркулируют штаммы вирусов, которые различаются как серологически, так и по патогенным потенциям для человека.
Хантаанвирусы не являются единственной вирусной группой, представители которой разошлись между собой в результате не только географической, но и экологической изоляции. Важные данные получены в отношении вирусов рода Вunуа- viruses семейства Bunyaviridae [Calisher Ch. Н., 1988]. Относящиеся к этому роду вирусы антигенной группы С четко дифференцируются друг от друга серологически в РТГА, РСК и PH и различаются по первичной структуре поверхностного гликопротеида G. Их ареал включает Бразилию и ряд других стран Южной Америки. Вирусы группы С способны к перераспределению фрагментов генома и потенциально образуют единый генный пул. Тем не менее генетическая индивидуальность членов группы сохраняется. Это достигается тем, что каждый вирус занимает свою экологическую нишу, в силу чего пути их циркуляции в позвоночных «хозяевах» и переносчиках не скрещиваются. Экологическая изоляция характерна также для многих буньявирусов, встречающихся на одной территории и относящихся к антигенным группам Гуама, Патоис, Симбу и Калифорния.
Неоднородность популяций вирусов и их быстрая микроэволюция относятся к числу общих явлений, характерных для вирусов различных систематических групп. Вместе с тем даже у близких вирусов этот процесс имеет свою специфику. М. Yamashita и соавт. (1988) изучили особенности молекулярной эволюции вируса гриппа В и закономерности смены штаммов за последние 40 лет.
С этой целью была определена первичная структура гена гемагглютинина (НА) и гена неструктурных белков (NS) у вирусных изолятов, полученных в 1940—1987 гг. Для секвенирования использовали ДНК-копии соответствующих сегментов генома. Эволюционное расстояние между изолятами определяли исходя из числа нуклеотидных замен в указанных генах. Результаты сравнивали с аналогичными данными, имеющимися в литературе в отношении вирусов гриппа А и С.
Как следует из рис. 65, на котором представлены данные, полученные за 7 последовательных эпидсезонов, закономерности движения генетического материала в популяциях вирусов гриппа А, В и С различались. Родоначальником штаммов, преобладающих в тот или иной эпидсезон, для вируса гриппа А служит лишь один родительский штамм, а для вирусов гриппа В и С — несколько. Это явление особенно выражено в случае вируса гриппа С. В результате в популяциях вирусов создается различный разброс признаков. В каждый эпидсезон популяция вируса гриппа А представлена одной, а популяции вирусов В и С — несколькими родословными. В последнем случае выживает две линии или более. Из результатов сравнения протяженности ветвей, соединяющих штаммы, следует, что эволюция вируса гриппа В идет медленней, чем вируса гриппа А, но быстрей, чем вируса гриппа С.
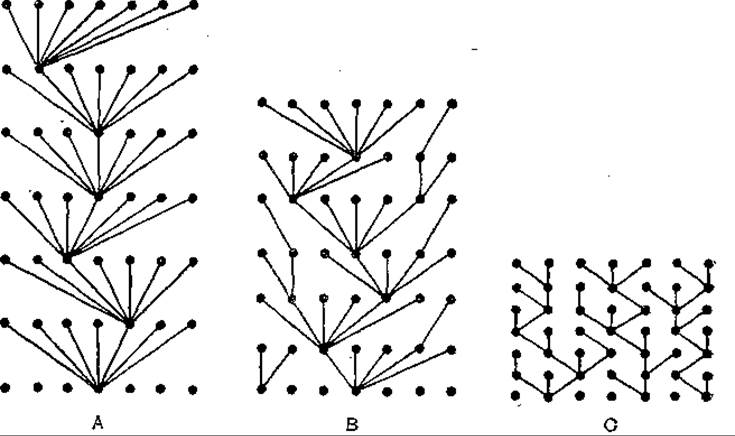
Рис. 65. Разброс признаков и смена штаммов в популяциях вирусов гриппа А, В и С [nо Yamasbita М. et аl., 1988]. Точки, лежащие на горизонтальной плоскости, соответствуют штаммам, выделенным в один и тот же эпидсезон. Протяженность линий, соединяющих эти точки, соответствует эволюционному расстоянию между штаммами.
Порядок смены штаммов у вируса гриппа А, по-видимому обусловлен более высокой мутабельностью вирусного генома, а также меньшей продолжительностью жизненного цикла и более быстрой сменой поколений за единицу времени в масштабе популяции. Это способствует накоплению мутантов, среди которых имеются единичные мутанты, способные преодолеть коллективный иммунитет. Они обеспечивают продолжение рода и существование вируса во времени. Остальная часть родительской популяции утрачивается. Вирусы гриппа В и С испытывают меньшее иммунное давление. Это, несмотря на меньший спектр антигенной изменчивости, обусловленной относительно низкой мутабельностью, обеспечивает продолжительную циркуляцию штаммов на продолжении нескольких эпидсезонов. Вирус гриппа В изменяется в 2—6 раз медленней, чем вирус гриппа А. Показателем низкой мутабельности вируса гриппа С являются отсутствие мутаций в гене NS у вирусных изолятов, разделенных интервалом в 19 лет, и изменения только по двум нуклеотидам в гене НА у изолятов, полученных с интервалом в 31 год. Молекулярная эволюция вируса гриппа В протекает со скоростью 1,1х10-3 нуклеотидных замен на участок в год.
Экологическая ниша, которую занимают вирусы, включает в себя не только организм и популяцию «хозяина», но и восприимчивые клетки, в которых происходит репродукция вирусов. Долгое время считалось, что видовая специфичность вируоа по отношению к «хозяину» и выбор определенных клеток-мишеней в организме последнего обеспечиваются специфичностью взаимодействия вируса с клеточными рецепторами. Позднее были получены доказательства того, что ограничение круга «хозяев» обусловлено также условиями репродукции вируса в чувствительных клетках. Из новых работ, посвященных этой проблеме, можно выделить сообщение J. Ветеvente и A. Shatkin (1988), изучавших причину неспособности реовируса птиц к репродукции в клетках мыши. Вирус специфически взаимодействовал с культурой мышиных L-клеток и проникал в цитоплазму, в которой происходило образование вирусных транскриптов. Однако вирусные мРНК не связывались с полисомами, и синтез вирусных белков не осуществлялся. Инфекционный цикл прерывался. Вирусспецифические РНК, синтезирующиеся в L-клетках, были функционально активны и транслировались на белки в условиях in vitro в ретикулоцитах кролика. Таким образом, репродукция реовируса птиц в клетках мыши блокировалась на стадии инициации синтеза белков.
Одним из путей эволюции вирусов является расхождение в организме «хозяина». Такой путь проделали герпетические вирусы человека, которые используют различные клетки-мишени, имеют определенный тканевый тропизм и различаются по патогенезу вызываемых им заболеваний. Тканевый тропизм этих вирусов в значительной степени обеспечивается биохимическими механизмами: модификацией регуляции транскрипции, посттрансляционным изменением структурных белков и активностью регуляторных генов. Эти свойства приобретены в процессе эволюции и вносят свой вклад в специфичность взаимодействия вируса с клетками [Mach М. et ah, 1988].
Приведенные данные показывают, что в микроэволюции вирусных популяций прослеживаются элементы градуалистического формообразования и важную роль для его осуществления играет экологический фактор. В целом это укладывается в концепцию синтетической теории эволюции о медленном накоплении незначительных изменений и постепенном расхождении популяций, занимающих свои экологические ниши. Особенности градуалистической эволюции вирусов, обусловленные эволюционными возможностями генома и структурой популяций вирусов, обсуждались ранее [Цилинский Я. Я., 1988]. Градуалистическое формообразование не является единственным путем, по которому следуют вирусы. Эволюция вирусов происходит также в результате взрывов, скачков, сальтационно. Одна из возможностей для этого открывается благодаря нейтральности молекулярной эволюции.
Значение теории нейтральности молекулярной эволюции для вирусологии. В. М. Жданов быстро воспринимал новые идеи эволюционного учения. Он не прошел мимо теории нейтральности молекулярной эволюции М. Kimura (1985), постулаты которой изложены в настоящей книге.
Огромный фактический материал, накопленный в вирусологии, подтверждает концепцию М. Кимуры и свидетельствует, что молекулярная эволюция вирусов идет по пути нейтрализма. Это относится не только к ДНК-геномным, но и РНК- геномным вирусам. Для утверждения нейтралистской теории последнее особенно важно. Эта теория была разработана на основе фактических данных, полученных при изучении организмов, которые используют в качестве генетического материала ДНК. Характер молекулярной эволюции РНК-геномных вирусов показывает, что принципы нейтрализма универсальны и распространяются на всю биосферу.
Использование РНК-геномных вирусов как объекта исследований открыло новые возможности для познания закономерностей молекулярной эволюции. Общий ход развития жизни на Земле прослежен на протяжении 3,5 млрд лет. Мутационные изменения накапливаются в геноме и в белках всех организмов из поколения в поколение. Благодаря низкой мутабельности ДНК скорость молекулярной эволюции организмов, использующих этот генетический материал, относительно невелика. Для белков млекопитающих определены следующие величины: инсулин — 0,44, миоглобин — 0,89, a-цепь гемоглобина — 1,2, лизоцим — 2,0, панкреатическая РНКаза— 2,1, фибринопептиды — 8,3х10-9 на участок в год и т. д. Скорость молекулярной эволюции генов паповавирусов, кодирующих малый t-антиген, большой T-антиген и белки VP1 и VP2, составляет 4,1х10-9—6,5х10-9 на участок в год. Кратковременность человеческого существования не позволяет непосредственно наблюдать эти процессы. Для восстановления хода молекулярной эволюции прибегают к косвенному методу — к сравнению организмов, происходящих из общего корня и разошедшихся эволюционно. По масштабу различий судят о времени появления организмов и о пройденном эволюционном пути. Высокая мутабельность РНК, превышающая мутабельность ДНК в 100 000 раз, и быстрое накопление молекулярных изменений позволяют восстанавливать ход молекулярной эволюции РНК-геномных вирусов с помощью более совершенного метода, т. е. прямого сравнения современных вирусов и их предков. Материалом для исследований служат штаммы вирусов, выделенные с интервалом в 5; 10; 20 лет и более и разделенные эволюционной дистанцией в 5000; 10 000 и 20 000 поколений и т. д. (при среднем жизненном цикле вируса, равном 8 ч). Сравнение этих штаммов дает возможность проследить ход молекулярной эволюции и определить ее характер. Таким образом, о молекулярной эволюции РНК-геномных вирусов судят не по готовым результатам истории прошлого, а непосредственно по изменению архаичных форм.
Центральным положением нейтралистской теории является ее третий постулат, согласно которому мутационные замены, приводящие к меньшим нарушениям структуры и функции молекулы (консервативные замены), в ходе эволюции происходят чаще тех, которые вызывают более существенное нарушение структуры и функции данной молекулы. Речь идет о преимущественном накоплении нейтральных или почти нейтральных мутаций, т. е. мутаций, существенно не влияющих на фенотип или же дающих слабый отрицательный эффект.
Рассмотрим пример, показывающий фиксацию нейтральных мутаций в вирусном геноме. В. J. Jonson и соавт. (1986) провели секвенирование ДНК-копий 26S РНК вирулентного штамма вируса венесуэльского энцефаломиелита лошадей Тринидад и полученного из него аттенуированного штамма ТС-83. К аттенуации привели длительное пассирование и селекция вируса в культурах клеток. Молекула 26S РНК содержит гены 3 структурных белков вириона: поверхностных гликопротеидов Е2 и El и внутреннего белка С. Показано, что ни последовательность генов, ни протяженность молекулы, ни положение открытой рамки считывания при аттенуации не изменялись. Аттенуированный штамм ТС-83 отличался от вирулентного предшественника штамма Тринидад по 13 нуклеотидным заменам, из. которых только 5 вели к заменам аминокислот. Все 5 мутаций, влияющих на аминокислотную последовательность, локализовались в гене для белка Е2. Этот ген, а также некодирующая область у 5'-конца молекулы 26S РНК рассматриваются как возможные генетические детерминанты вирулентности. В функциональном плане гликопротеид Е2 вызывает образование протективных антител и, по-видимому, определяет специфичность при взаимодействии вируса с клеткой. У вирусов комплекса венесуэльского энцефаломиелита лошадей белок Е2 характеризуется значительной антигенной изменчивостью. Все 7 мутаций, выявленные в генах белков для El я С аттенуированного штамма ТС-83, носили нейтральный характер и не влекли за собой аминокислотных замен.
Возможность возникновения и фиксации в геноме нейтральных мутаций определяется свойствами генетического кода. Нуклеотиды, составляющие кодоны, имеют неодинаковую смысловую нагрузку. Происхождение этих различий связано с эволюцией генетического кода. Из 3 нуклеотидов, составляющих кодоны, наибольшая смысловая нагрузка ложится на первый и второй. Третий нуклеотид характеризуется низкой специфичностью. В результате этого сродство кодонов в отношении аминокислот часто определяется двумя первыми нуклеотидами. Третья позиция может быть представлена одним из нескольких нуклеотидов. Смысл триплета и его способность кодировать синтез определенной аминокислоты при этом не изменяются. Таким образом, нуклеотидные замены в третьем положении кодона чаще всего нейтральны или, иначе, нейтральные мутации обычно фиксируются именно в этой позиции.
Преимущественное накопление мутаций в третьем положении кодона характерно для вирусного генома. N. Saitou (1987) обобщил данные о характере и локализации нуклеотидных замен, обнаруженных в генах для гемагглютининов Н1 и Н2, генах нейраминидазы N1 и N2, а также генах неструктурного белка NS и матриксного белка М вируса гриппа А человека. Всего в третьем положении кодона отмечалось 268 мутаций, а в первом и втором — только 189.
Мутации в третьем положении кодона чаще всего синонимичны, т. е. они не приводят к заменам аминокислотных остатков в молекуле белка. J. R. Wiener и W. К. Joklik (1988) провели сравнение нуклеотидных последовательностей геномного сегмента М2 реовирусов человека типа 1; 2 и 3, разошедшихся в своей эволюции и различающихся серологически и по некоторым другим биологическим свойствам. Сегмент М2 кодирует синтез кислого белка μ1, характеризующегося низким содержанием цистина, гистидина и метионина и богатого пролином. Около 27% аминокислотных остатков находятся в а-спиральной конфигурации. В результате протеолитического расщепления белка μ1, которое происходит между аминокислотными остатками, находящимися в позициях 42 и 43, образуется белок μ1С, который является основным структурным компонентом вириона. Сегменты М2 серотипов 1 и 2, 1 и 3 и 2 и 3 имели соответственно 15%, 23% и 23% общих оснований. В противоположность этому продукт гена М2, белок μ1, характеризовался высокой степенью гомологии — 97%. Консерватизм белка μ1 достигался тем, что большинство мутаций РНК фиксировалось в третьем положении кодона и не приводило к аминокислотным заменам. При сравнении геномного сегмента М2 серотипа 1 и 3 в третьем положении кодона было обнаружено 87,6%, серотипов 1 и 2 — 86,4% и серотипов 2 и 3— 86,6% всех выявленных мутаций. Относительная частота мутаций в первом положении кодона была 9,6%; 11,8% и 11,2%, а во втором—2,8%; 1,8% и 2,2% соответственно для серотипов 1 и 3, 1 и 2 и 2 и 3. Только 18 из 324 мутаций, выявленных при сравнении серотипов 1 и 3, приводили к аминокислотным заменам. Для серотипов 1 и 2, 2 и 3 этот показатель составлял соответственно 20 из 501 и 23 из 507.
Помимо свойств генетического кода, нейтральный характер мутаций определяется особенностями структуры белковой молекулы. Молекула белка состоит из небольшого функционально активного центра и значительной по протяженности «пассивной» части. Фиксация мутаций в «пассивной» части не изменяет и функцию белка и не влияет на фенотип. Кроме того, корреляция между первичной структурой молекулы белка и структурами высшего порядка, которые определяют функциональную активность молекулы, носит вырожденный характер. Поэтому изменение аминокислотной последовательности, наступающее в результате мутаций, может не влиять на структуры высшего порядка и на функцию белка. Мутации носят нейтральный характер.
Классическим примером сохранения функциональной активности вирусного белка в условиях накопления нейтральных мутаций служит следующее. J. Blok и G. М. Air (1982) сравнили первичную структуру участков нейраминидазы 8 подтипов вируса гриппа А. Молекула нейраминидазы имеет трехмерную структуру: ножка, головка и трансмембранный сегмент с гидрофобным участком на NH2-конце. С головкой связана антигенная и ферментативная активность белка. Гидрофобный участок обеспечивает прикрепление молекулы к липидному бислою вириона. Ножка соединяет эти участки молекулы. Стабилизация ножки обеспечивается углеводами и дисульфидными связями. Сравнение первичной структуры трансмембранного сегмента и ножки нейраминидазы показало, что эти участки отличаются по аминокислотной последовательности. Несмотря на низкую гомологию, общий характер полипептидных цепей и их свойства сохранялись. Трансмембранный сегмент у всех подтипов нейраминидазы содержал высокий процент гидрофобных аминокислот. В структуре ножки обнаружены остатки цистеина, способные формировать дисульфидные связи, и сайты гликозилирования. Дисульфидные связи и присоединение углеводов обеспечивают стабилизацию трехмерной структуры ножки. Показано, что выраженная мутационная перестройка первичной структуры не влияла на третичную структуру изученных участков молекулы нейраминидазы и не изменила их функцию. Накопившиеся мутации носили нейтральный характер.
Таким образом, нейтральные мутации разделяются на два типа. Мутации первого типа фиксируются в геноме, но не влияют на аминокислотную последовательность молекулы белка, а второго—изменяют нуклеотидную последовательность и последовательность аминокислотных остатков в молекуле белка, но не нарушают его функцию. Как следует из приведенных примеров, оба типа нейтральных мутаций встречаются у вирусов. Молекулярная эволюция вирусов идет по пути преимущественного накопления этих мутаций. В результате вирусный геном становится готовым к взрыву, скачку, резкому преобразованию. Это создает возможность для появления новых форм или приводит вирус к гибели.
Биологический смысл нейтралистской теории заключается в том, что в основе эволюционных изменений на молекулярном уровне, т. е. перестройки самого генетического материала, лежат не воздействия внешней среды, а независимые от них внутренние генетические процессы. Изменение ДНК и РНК в основном происходит путем фиксации нейтральных и почти нейтральных мутаций, накопление которых не контролируется отбором и осуществляется без его вмешательства. Скорость закрепления этих мутаций определяется главным образом частотой мутирования. Синтетическая теория эволюции поддерживает противоположное мнение о том, что фиксированные мутационные изменения адаптивны и обусловлены положительным дарвиновским отбором. Преимущественно закрепляются мутации, имеющие фенотипическое проявление и дающие положительный эффект. Факт накопления нейтральных и почти нейтральных мутаций подтвержден обширным фактическим материалом, полученным при сравнительном изучении первичной структуры генома и белков различных организмов. Данные о вирусах также свидетельствуют в пользу нейтралистской теории.
Нейтральные и почти нейтральные мутации аккумулируются в геноме и белках, но до поры существенно не влияют на выживаемость и воспроизведение вида. При изменении условий среды положение может измениться, мутации, которые были нейтральными, становятся селективно ценными и превращаются в исходный материал для адаптивной эволюции. Этот материал предсуществует в геноме и увеличивает тем самым эволюционный потенциал организмов. По-видимому, такой резерв активно используется в периоды повышения эволюционной активности, во время которых, согласно концепции прерывистого равновесия, происходит видообразование.
Эволюционное значение нейтральных и почти нейтральных мутаций заключается также в том, что они создают возможность для осуществления резких эволюционных сдвигов. К такому сдвигу может привести даже одна «удачная» мутация, которая происходит в геноме, насыщенном молчащими и не проявляющими себя мутациями, и создающая за счет этого новую комбинацию генетических факторов. Образуется ген с новыми свойствами. Резко изменяется фенотип. Процесс носит характер фазового перехода и происходит скачком, сальтационно. Возможен как положительный, так и отрицательный эффект. На последнем мы остановимся ниже при обсуждении проблемы массовых вымираний. Как накопление нейтральных и почти нейтральных мутаций, так и переход этого материала в новое качество осуществляются без участия отбора. Поэтому появившиеся признаки могут не иметь адаптивного значения. Примером таких приобретений является большинство случаев полиморфизма белков, широко распространенного у высших эукариотов. Преобладающая часть полиморфных аллелей, имеющихся у какого-либо вида, поддерживается за счет мутационного процесса и случайной элиминации.
Особенность рассмотренного эволюционного пути заключается в том, что отбор не создает новых форм, Он производит лишь их апробацию и браковку. Новые формы, прошедшие эту проверку, далее «дошлифовываются» отбором. В противоположность этому синтетическая теория эволюции отводит отбору ведущую роль в формообразовательных процессах. Следует отметить, что указанные эволюционные пути не исключают, а дополняют друг друга, обеспечивая эволюционное развитие биосферы.
Анализ изменчивости природных популяций вирусов и рассмотрение движения заболеваемости показывают, что одним из способов эволюции вирусов является внезапное скачкообразное формообразование. За последние 20 лет обнаружены вирусы, вызывающие новые болезни человека и животных. Это этиологические агенты СПИД ВИЧ-1 и ВИЧ-2, вирусы иммунодефицита обезьян, кошек и крупного рогатого скота, вызывающие иммунодефицитные состояния у своих «хозяев»; энтеровирус 70, служащий причиной геморрагического кератоконъюнктивита человека; парвовирус, вызывающий миокардит и диарею у щенков; этиологический агент Т-клеточного лейкоза человека и тропического спастического парапареза; вирус Т-клеточного лейкоза человека типа 1; энтеритные вирусы человека (рота-, кальци-, астровирусы, Норфолк-подобные агенты и т. д.). В большинстве случаев речь идет не о появлении новых вирусов, а о распознавании оставшихся неизвестными агентов и вызываемых ими заболеваний. Наряду с этим известны примеры образования новых форм. Наиболее достоверными из них являются возникновение ВИЧ-1, парвовируса миокардита и диареи щенков и энтеровируса 70. Эти вирусы появились внезапно и быстро распространились среди неиммунных «хозяев». Их нашествие привело к эпидемиям неизвестных ранее болезней. Оценивая размер произошедших эволюционных сдвигов, следует отметить, что в каждом случае дело ограничилось пополнением уже известных родов и семейств (родов Parvovirus и Enterovirus, семейства Retroviridae) новыми представителями. Образовались новые виды.
Внезапное скачкообразное появление измененных штаммов уже известных вирусов происходит более часто и является характерной особенностью внутривидовой микроэволюции РНК- геномных вирусов. Такие штаммы играют большую роль в эпидемиологии и эпизоотологии гриппа, ящура и многих других инфекций. Новый штамм вируса гриппа А птиц, например, преодолел межвидовой барьер и вызвал в 1979—1980 гг. на Атлантическом побережье США опустошительную эпизоотию гриппа среди тюленей. Это первый и пока единственный известный случай прямого перехода достаточно специализированного вируса гриппа А птиц к млекопитающим. Возможно, что рассмотренные эволюционные явления в ряде случаев обусловлены мутациями, которые «падают на подготовленную почву», т. е. возникают в геноме, насыщенном нейтральными мутациями и готовом к перестройке.
Помимо эволюционной роли, нейтральные мутации выполняют у РНК-геномных вирусов еще одну чрезвычайно своеобразную функцию. Это защита от форсированной эволюции. Благодаря высокой мутабельности генетического материала молекулярная эволюция РНК-геномных вирусов идет чрезвычайно быстро. Обобщая данные о вирусах гриппа А, В и С, ящура, реовирусах, ВИЧ и др., можно сказать, что скорость молекулярной эволюции вирусного генома составляет 2х10-2—5x10-5 замен на участок в год. Показатели колеблются от вируса к вирусу и от гена к гену. Важные в функциональном отношении белки и кодирующие их участки генома изменяются медленнее, чем менее важные. Например, при сравнении матричного белка изолятов вируса гриппа А (H3N2) 1972 и 1979 гг. обнаружены всего две аминокислотные замены. Матричный белок несет значительную функциональную нагрузку: образует домен на внутренней поверхности цитоплазматической мембраны, где происходит объединение сегментов генома при сборке вирионов, специфически распознает вирусные гликопротеиды и обеспечивает формирование и стабильность оболочки под липидным бислоем вириона. По-видимому, в аминокислотной последовательности молекулы матричного белка фиксировались лишь те замены, которые не нарушали его функцию. В противоположность этому в молекуле легкой цепи гемагглютинина вируса гриппа А (H3N2) ежегодно заменялось 0,24—0,57%, а в тяжелой — 0,2—0,91% аминокислотных остатков. Остается неясным, протекает ли молекулярная эволюция РНК-геномных вирусов равномерно во времени. Данные об этом противоречивы. В пользу постоянной скорости эволюции свидетельствует тот факт, что некоторые работы, в которых утверждалось противное, были выполнены на небольшом материале и их результаты в дальнейшем не подтвердились. В частности, изменилось представление о течении молекулярной эволюции вируса гриппа В. Исследуя представительную группу штаммов, М. Yamashita и соавт. (1988) показали, что она идет постоянно во времени. В целом можно сказать, что у РНК-геномных вирусов существуют молекулярные часы эволюции и эти часы движутся на несколько порядков быстрее, чем у ДНК-геномных вирусов.
Наиболее известной причиной вымирания организмов является неспособность приспособляться к изменяющимся абиотическим и биотическим условиям среды силами своего генофонда. Быстрая молекулярная эволюция РНК-геномных вирусов позволяет назвать еще одну возможную, теперь уже внутреннюю причину вымирания — разрушение сложившейся генетической структуры под влиянием избытка мутаций. Нейтральный характер молекулярной эволюции замедляет этот процесс. Как генетический материал, так продукты генов белки обладают значительной буферностью и принимают на себя поток мутаций. Нейтральные мутации накапливаются в молекулах РНК и белков, но не вызывают отрицательного эффекта. Высокая скорость мутационных замещений в генах совмещается с сохранением жизненно важных функций. Создается защита от форсированной эволюции. Возникает вопрос, как долго установившийся барьер может выдерживать давление мутаций. При обсуждении этого вопроса следует обратиться к проблеме массовых вымираний как к общебиологическому явлению.
Постоянно повторяющимся эпизодом жизни на Земле являются массовые вымирания видов и более высоких таксономических групп организмов. В мезозое эти события происходили с периодичностью 26 млн лет, а в кайнозое — 35—40 млн лет. Массовые вымирания не носят всеобщего характера. Их избирательной жертвой становятся определенные таксоны. Причины массовых вымираний недостаточно ясны. Многочисленные гипотезы, связывающие массовые вымирания с внешними причинами (мировые катастрофы, вызванные падением астероидов, вспышками сверхновых звезд, прохождением Немезиды и т. д.), пригодны для частных случаев, но не объясняют всего явления в целом. По мнению М. В. Волькенштейна и Т. С. Расса (1987), массовые вымирания зависят не только от изменения внешних биотических и абиотических факторов, но и от внутренних причин. Виды могут вымирать в результате накопления нейтральных мутаций, которые становятся вредными при своем сочетании. Механизм вымирания связан также с псевдонейтральными мутациями, оказывающими лишь незначительное отрицательное воздействие. Накопление нейтральных мутаций может нарушить состояние компенсации псевдонейтральных мутаций и привести к ухудшению приспособленности и гибели вида. Вымирание в целом есть автокаталитический процесс. «Видиоисчезновение» наступает внезапно и носит характер фазового перехода. Следует добавить, что события могут получить и другое направление. В этом случае перестройка генома дает положительный эффект. Создаются предпосылки для дальнейшего эволюционного развития. В эволюционной истории биосферы одни виды погибали, не оставив потомства, а другие давали ветви последующей эволюции.
Эта гипотеза применима к РНК-геномным вирусам с их высокой скоростью молекулярной эволюции. Можно предположить, что внутренние причины, которые снижают жизнеспособность вируса и создают предпосылки для его исчезновения, определяются прогрессирующим накоплением нейтральных и псевдонейтральных мутаций. Первоначально последние приносят лишь незначительный вред. Однако в дальнейшем изменения умножаются. Возможность компенсации мутаций уменьшается. Этот процесс неотвратим, как и старение. В результате вырожденности генетического кода и вырожденности корреляции между первичной и пространственной структурой белка изменения накапливаются подспудно. Затем хледует фазовый переход, в своей основе имеющий резкую перестройку генома и внезапное изменение пространственной структуры молекул белка. Наступают функциональные нарушения. Жизнеспособность вируса снижается. Создаются предпосылки для его исчезновения.
Одряхление, старость и смерть — это удел всего живого. К такому итогу приходят не только индивидуальный организм, но и сообщества. У высших эукариотов, размножающихся половым путем, единицей вымирания является вид. Видовое сообщество обладает объединенным генофондом, который целиком вовлекается в процесс молекулярной эволюции, создающей предпосылки для вымирания. Все особи, составляющие вид, разделяют общую судьбу и теряют жизненные потенции. Популяция и вид у РНК-геномных вирусов имеют иное генетическое строение. Они представляют собой совокупность отдельных клонов, которые в последовательном ряду поколений образуют обособленные чистые линии. Генетический обмен между ними не происходит совсем или же он очень слаб. За счет случайных процессов молекулярная эволюция составляющих популяцию линий носит индивидуальный характер. В одних случаях эволюция протекает благоприятно и перестройка генома не препятствует продолжению рода и дальнейшему существованию линии, а в других—снижает жизнеспособность вируса. Такие линии становятся жертвами вымирания.
Выражением этих процессов при естественном круговороте вирусов служат внезапное прекращение эпидемий и исчезновение циркулирующих штаммов. Резкий спад эпидемических вспышек и быстрое сокращение заболеваемости, которые происходят, несмотря на наличие восприимчивого населения, отмечаются при гриппе на протяжении эры господства того или иного шифтового варианта вируса гриппа А. Создается впечатление, что инфекция постепенно затухает при передаче от «хозяина» к «хозяину» [Kendal А. Р., 1987]. Периоды преобладания каждого шифтового варианта вируса гриппа А также прекращались внезапно. Если измерять события в глобальном масштабе, то можно сказать, что вирус утрачивался из циркуляции меньше чем за год. Внезапное прекращение циркуляции прежде господствовавших штаммов нельзя объяснить только давлением коллективного иммунитета. По-видимому, шифтовые штаммы вируса гриппа А и их дрейфовые варианты в ряде случаев способны пройти лишь ограниченное число генераций, не могут бесконечно передаваться от «хозяина» к «хозяину» и заходят в конце концов в эволюционный тупик. Возможность снижения жизнеспособности и гибели вируса определяется тем, что штаммы, вызывающие эпидемии и пандемии, происходят от селективно ценных мутантов или реассортантов и генеалогически представляют собой чистые линии. Молекулярная эволюция многих из них проходит неблагоприятно и накладывает ограничения на продолжительность существования вируса.
Остается неясным, распространяется ли процесс вымирания, которому, вероятно, подвержены отдельные штаммы, на популяции в целом и вид. Нельзя исключить, что время существования известных на сегодня РНК-геномных вирусов в их современной форме ограничено. По-видимому, перед ними открываются два пути — погибнуть или измениться. Некоторые РНК-геномные вирусы с высокой скоростью эволюции могут стать жертвами вымирания. Вместе с тем нельзя не учитывать, что высокая скорость эволюции РНК сочетается с сохранением жизненно важных функций, обеспечивающих генетический гомеостаз. Помимо способности к быстрой эволюции, для РНК-геномных вирусов характерен глубокий эволюционный застой, который выражается в значительном консерватизме наследственности и длительном сохранении фундаментальных свойств и основных биологических характеристик возбудителя [Цилинский Я. Я., 1988]. Судя по письменным памятникам истории, желтая лихордка поражала человека не менее чем 190 лет, крымская геморрагическая лихордка не менее чем 600 лет и бешенство 2000 лет назад. Этиологические агенты этих инфекций пронесли свои определяющие видовые свойства, выражающиеся в способности вызывать характерное заболевание, через века. Ориентировочно эта эволюционная дистанция для вируса желтой лихорадки соответствует величине порядка 130 000, а для вирусов крымской геморрагической лихорадки и бешенства — соответственно 350 000 и 145 000 поколений. Эта дистанция по числу поколений превышает расстояние, которое отделяет современного человека от его обезьяноподобного предка. У РНК-геномных вирусов отмечаются длительная консервация и сохранение определенных генных модулей, имеющих древнее происхождение. Наличие таких модулей, представляющих собой системы репликации однонитевой РНК с положительной полярностью, объединяет в единые группы пикорна- и Синдбис-подобных вирусов далеко разошедшиеся в своей эволюции вирусы животных и растений. Эти вирусы прошли длительный эволюционный путь от общих предков, но сохранили функционально важный участок генома. Все это указывает на то, что масоовые вымирания РНК-геномных вирусов, если они и имеют место, избирательны. Аналогичный порядок наблюдается при вымирании видов у высших организмов.
Происхождение пандемических вариантов вируса гриппа А. Центральным и до сих пор нерешенным вопросом учения о гриппе является вопрос об источниках происхождения пандемических вариантов вируса гриппа А, циркулирующих в человеческой популяции, или, иначе, вопрос о механизме антигенного сдвига. В. М. Жданов придерживался экологической концепции и чрезвычайно много сделал для ее развития. Согласно данной концепции, возникновение пандемических вариантов обусловлено включением в геном вируса гриппа А человека генов вируса гриппа животных.
Эта гипотеза была высказана около 20 лет назад и быстро завоевала большую популярность среди различных специалистов, занимающихся изучением вируса гриппа и гриппозной инфекции — вирусологов, молекулярных биологов, биологов, медиков и ветеринаров. Казалось, что вопрос о происхождении пандемических вариантов вируса гриппа А принципиально решился. Штаммы, вызывающие пандемии, возникают в результате перераспределения фрагментов генома между вирусами гриппа человека и животных, эти вирусы относятся к одному виду и образуют единый генный пул. Однако шло время, а решающие доказательства в пользу экологической концепции получены не были. Мало того, эта концепция стала испытывать трудности в связи с накоплением фактов о специализации вируса гриппа А к своим «хозяевам», о проблематичности преодоления видового барьера, об образовании дисгармоничных сочетаний генов при их перераспределении, о низкой жизнеспособности реассортантов вирусов гриппа человека и животных и т. д. В результате пересортировки фрагментов генома между вирусами гриппа человека и животных в условиях лаборатории были получены реассортанты, которые имеют антигенные формулы, соответствующие таковым известных пандемических вариантов. Это, однако, не подкрепило экологическую концепцию. Реассортанты представляли собой лишь антигенные, а не биологические аналоги пандемических вариантов. Пересортировка фрагментов генома нарушала видоспецифическую вирулентность вируса и лишала его потенции к передаче и эпидемическому распространению в популяции. Экологическая концепция не смогла объяснить причины последнего антигенного сдвига, имевшего место в 1977 г. и выразившегося во внезапном возвращении в циркуляцию вируса гриппа A (H1N1). Происхождение этого вируса не было связано с перераспределением- генетического материала между вирусами гриппа китов, свиней и птиц. Штаммы 1977 г. оказались аналогичны штаммам вируса гриппа А (H1N1), циркулировавшим в человеческой популяции в 1950—1952 гг. Приведенные факты указывают на прямую преемственность штаммов и длительное сохранение вируса, обеспечившее возможность его возвращения в циркуляцию.
Все это повысило интерес к альтернативному мнению, согласно которому грипп А человека является антропонозной инфекцией, которая вызывается штаммами, связанными исключительно с человеческой популяцией. Переход генов из «животных резервуаров», даже если это возможно, не имеет отношения к антигенному сдвигу. Последний возникает в результате возвращения в циркуляцию штаммов, длительно сохраняющихся в человеческой популяции. Как ученый широкого профиля и энциклопедически образованный человек В. М. Жданов не замыкался в рамках тех взглядов, которым отдавал предпочтение, а стремился охватить всю проблему в целом. Это относилось и к учению о гриппе. В. М. Жданов был сторонником плюрализма мнений и полагал, что такая идеология обеспечивает прогресс науки. В этой связи интересно остановиться на положениях антропонозной гипотезы происхождения пандемических вариантов гриппа Л человека и на ее развитии.
Современные взгляды на гриппозную инфекцию как на антропоноз обоснованы в работе R. Е. Hope-Simpson и D. В. Golubev (1987), выдвинувших новую концепцию эпидемического процесса при гриппе А. Авторы обращают внимание на то, что число шифтовых вариантов вируса, которые вызывают гриппа А у человека, не три (H1N1 1946—1957 гг. л после 1977 г.; H2N2 1957—1968 гг. и H3N2 после 1968 г.), а четыре. Четвертым вариантом является вирус гриппа А (H0N1), появившийся в 1929 г. и циркулировавший до 1946 г. Опираясь на серологические данные, можно говорить также о пятом шифтовом варианте гриппа А (Hsω1N1), циркулировавшем в 1918—1929 гг. и перешедшем в популяцию свиней, где он сохранился до настоящего времени. Объединение вирусов гриппа А (Hsω1N1), (H0N1) и (H1N1) в один подтип принципиально неверно. Эти вирусы вызывают неполный перекрестный иммунитет.
Появление каждого из них носило характер антигенного сдвига. В случае смены вируса гриппа А (H0N1) на (H1N1) этот сдвиг произошел не в результате пересортировки фрагментов генома. Документировано, что причиной возникновения вируса гриппа А (H1N1) послужила значительная мутация в гене для гемагглютинина вируса гриппа А (H0N1). Ограниченность числа пандемических вариантов вируса гриппа А человека не находит объяснения с позиций экологической концепции. По смыслу концепции, свободная пересортировка фрагментов генома между вирусами гриппа человека, животных и птиц могла бы привести к образованию десятков и сотен реассортантов, не испытывающих иммунного давления со стороны «хозяина»-человека и распространяющихся в популяции.
Экологическая концепция возникновения пандемических вариантов вируса гриппа А не объясняет не только ограниченность их числа, но и рецикличность появления в человеческой популяции. Порядок смены вариантов прослежен на протяжении 100 лет. Серологические исследования сывороток крови пожилых людей показали, что вариант H2N2, по-видимому, циркулировал в последней четверти XIX в. На смену ему пришел вариант H3N2, доминировавший предположительно в 1900—1918 гг. Приблизительно в 1907 г. к варианту H3N2 (так же как и в наше время) присоединился вариант H1N1. Последующая очередность смены штаммов рассматривалась выше.
R. Е. Hope-Simpson, D. В. Golubev (1987) останавливаются на рецикличности шифтовых вариантов вируса гриппа А человека и ограниченности их числа не для того, чтобы подчеркнуть слабость экологической гипотезы. Эти факты используются для обоснования предложенной ими концепции. Авторы рассматривают эпидемиологические данные, согласно которым развитие вспышек и движение заболеваемости при гриппе нельзя объяснить только непрерывной и последовательной передачей вируса от больного к больному, как это происходит при кори. Многочисленные попытки построить математические модели эпидемий гриппа, основанные на этом принципе, закончились безрезультатно. Движение заболеваемости при гриппе в ряде случаев напоминает модель, при которой инфекция возникает во многих первоначальных фокусах и затем затухает при передаче от «хозяина» к «хозяину». Это подтверждается эпидемиологическими наблюдениями об одновременном возникновении случаев гриппа на больших территориях и в разобщенных регионах. Характер таких эпидемий в свое время создавал иллюзию заноса вируса гриппа из космоса.
Авторы предполагают, что вирус гриппа А не способен бесконечно долго передаваться от человека к человеку и сохраняется в межэпидемический период не в организме животных и птиц, а в организме человека в форме латентной или персистентной инфекции. Через многие месяцы и даже годы под влиянием факторов внешней среды и при изменении состояния организма «хозяина» вирус реактивируется у скрытых носителей и распространяется в человеческой популяции. Внешние факторы действуют на всю популяцию «хозяев». Поэтому вирус выделяется от массы носителей и эпидемия начинается из многих первоначальных фокусов. За счет этого механизма новые порции вируса включаются в циркуляцию в процессе развития эпидемии. Реактивированный вирус встречается с иммунной защитой «хозяина», в результате чего происходит антигенный дрейф.
Интересно отметить, что эпизоотический процесс при гриппе у домашних животных может носить подобный характер. В 50-х годах в США отмечалось одновременное возникновение вспышек гриппа А у свиней на разобщенных территориально фермах. Предполагалось, что вирус персистировал у животных и активировался под влиянием метеорологических факторов.
Периодическая активация вируса у скрытых носителей и его распространение в человеческой популяции приводят как к развитию эпидемий, которые с интервалом в 1—2 года следуют друг за другом в период преобладания того или иного шифтового варианта, так и к антигенному сдвигу и возникновению пандемий. Все 5 шифтовых вариантов вируса гриппа А человека сохраняются в популяции и периодически реактивируются. Особенно длительный латентный период имела пандемия вируса гриппа А (H3N2), который сохранялся в человеческой популяции с начала XX в. и не давал эпидемических проявлений до 1988 г. Отдельные вирусологические и серологические находки указывают на возможность продолжительной консервации архаичных вариантов.
Важную роль в обосновании концепции, предложенной R. Е. Hope-Simpson и D. В. Golubev (1987), играют данные, полученные в межэпидемический период. В периоды между эпидемиями на фоне прекращения циркуляции возбудителя обычно регистрируются отдельные случаи гриппа, имеющие вирусологическое подтверждение. Их возникновение можно истолковать как результат активации вируса у носителей и его последующего ограниченного распространения.
Слабым местом антропонозной концепции о гриппе А человека в прошлом было отсутствие доказательств длительного вирусоносительства. В настоящее время положение изменилось. Как справедливо отмечают R. Е. Hope-Simpson, D. В. Golubev (1987), возможность латентной и персистентной инфекции человека вирусом гриппа А не вызывает сомнений, хотя формы носительства требуют изучения. По-видимому, важную роль в становлении носительства играет действие дефектного вируса. Значительный позитивный вклад в проблему вносят данные о персистентной инфекции вируса гриппа А в культурах клеток. Этот факт не является прямым доказательством в пользу персистенции вируса в организме и его сохранения в популяции «хозяев» за счет указанного механизма. Тем не менее данные, полученные на уровне культур клеток, указывают на такую возможность.
Обсуждая причины и периодичность реактивации вируса гриппа А в организме человека, следует отметить цикличность природных явлений. Это общебиологическая закономерность. Повторяемость и цикличность процессов жизнедеятельности выражаются в многолетних колебаниях численности животных, обратимых перестройках видовых структур биоценозов, пульсации очагов зоонозных инфекций, изменении свойств возбудителя, повышении его вирулентности и т. д. Циклы природы обусловлены влиянием факторов внешней среды, которые действуют и на человека. Среди этих факторов важное место занимает солнечная энергия. На значение потока энергии Солнца указывал крупнейший ученый А. Л. Чижевский (1976).
В своей книге «Земное эхо солнечных бурь», вышедшей в свет в 1937 г., он отмечал, что солнечная активность является регулятором эпидемических процессов в масштабе планеты. Анализируя материалы о возникновении и течении гриппозных эпидемий почти за 500 лет, А. Л. Чижевский (1976) приходит к выводу, что период повторяемости эпидемий гриппа (имеются в виду пандемии) в среднем равен 11,3 года. Отклонение начальных лет эпидемии от максимума солнечной деятельности в ту или иную сторону составляет в среднем 2,3 года. Иначе, эпидемии гриппа имеют тенденцию начинаться за 2,3 года до максимума или спустя 2,3 года после такового.
Интенсивность эпидемии, по-видимому, находится в известной зависимости от интенсивности деятельности Солнца. Солнечная активность влияет на жизнедеятельность организмов и уменьшает сопротивляемость организма болезнетворному началу. Факт биологического действия энергии Солнца на различные организмы и природные процессы достаточно очевиден, но механизм этого воздействия остается неясен. Вместе с тем в различных областях знаний накоплены обширные данные о факторах солнечной радиации. В общем можно сказать, что в периоды усиления активности Солнца резко нарастает коротковолновое жесткое излучение. Это приводит к возникновению электрических, магнитных и электромагнитных бурь, что воздействует на макроорганизм, а также на вирус как прямо, так и опосредованно, через организм «хозяина». Можно думать, что при скрытой гриппозной инфекции энергия Солнца способна активизировать перcистирующий вирус.
Рассмотрение малоизвестной антропонозной концепции показывает, что учение о гриппе развивается не только на основе экологических взглядов на природу этой инфекции, но и других представлений. В. М. Жданов поддерживал такой широкий подход к решению научных проблем.
В целом вопрос о происхождении пандемических штаммов вируса гриппа А человека в его современном виде превратился в эволюционную проблему. Одним из путей эволюции вирусов является медленная эволюция вместе со своими «хозяевами». По мере эволюционного расхождения «хозяев» расходятся и вирусы. Сопряженная эволюция ведет к специализации и адаптации вируса к определенным видам. Устанавливаются 'межвидовые барьеры. Специализация мешает вирусу совершить переход к другому «хозяину» [Цилинский Я. Я., 1988]. Вирусы гриппа А человека и животных находятся на этом эволюционном пути. Об общности их корней, свидетельствуют единая стратегия генома, высокая степень гомологии генетического материала, способность к перераспределению фрагментов генома, серологические связи и др. Показателями эволюционного расхождения служат неполная гомология генома и белков, образование при реаcсоциации фрагментов генома дисгармоничных сочетаний, приводящее к низкой жизнеспособности реассортантов, и специализация к определенному «хозяину», снижающая возможность как вируса, так и реассортантов преодолевать межвидовой барьер. Оценивая прочность последнего, следует учитывать, что специфичность вируса гриппа к «хозяину» определяется не только рецепторным аппаратом при взаимодействии вируса с поверхностью клетки. Важную роль в определении круга «хозяев» играет процесс взаимодействия нуклеокапсида и клеточных компонентов, который также носит специфический характер и происходит на внутриклеточной стадии вирусного инфекционного цикла.
Из сказанного следует, что возможность поступления в популяцию вируса гриппа А человека генов из «животных» резервуаров определяется тем, как далеко зашла дивергентная эволюция вирусов гриппа А и как глубоко адаптировались они к своим «хозяевам». Речь идет именно о поступлении отдельных генов, а не целого вируса. Имеющиеся данные исключают возможность включения в циркуляцию в человеческой популяции вируса гриппа А, перешедшего к человеку от животных. В 1976 г. на свиных фермах в США у людей, непосредственно контактировавших с животными, наблюдались спорадические случаи гриппа, вызванного вирусом гриппа А свиней, близким к вирусу А (HsωlNl). Выплеск вируса из популяции животных, несмотря на полное отсутствие иммунитета к нему в человеческом коллективе, не привел к развитию вспышки. Вирус не передавался далее от первичных случаев по эпидемической цепочке. Такой итог наблюдался, несмотря на то что вирус гриппа свиней к вирусу гриппа человека стоит ближе, чем вирусы гриппа других животных и птиц.
Взгляды В. М. Жданова на обмен генами между вирусами гриппа А человека и животных изменялись со временем. Первоначально он рассматривал эти вирусы как один вид, в пределах которого происходит интенсивное перераспределение генов. Последующие его высказывания на этот счет более осторожны. Вирус гриппа А человека называется формирующимся видом, который еще окончательно не потерял связей с вирусами гриппа А животных. За счет сохранившихся связей возможно эпизодическое пополнение генофонда вируса гриппа А человека генами вируса гриппа А животных.
Очевидно, что возможность обмена определяется степенью эволюционного расхождения между вирусами и их адаптацией к «хозяевам». В данной связи принципиально важным направлением исследований, заложенным В. М. Ждановым, представляется изучение молекулярно-биологической природы хозяйской специфичности вируса-гриппа А, а также препятствий, которые встречают вирус и его реассортанты при преодолении межвидового барьера. Эти исследования помогут ответить на вопрос, возникают ли пандемические варианты вируса гриппа А в результате внесения генов извне или же за счет смены вариантов, фиксированных в человеческой популяции.