ЗООЛОГІЯ НАВЧАЛЬНИЙ ПОСІБНИК - Є. О. Неведомська - 2013
ЛЕКЦІЯ 3. МОЛЕКУЛЯРНИЙ РІВЕНЬ ОРГАНІЗАЦІЇ ЖИВОЇ МАТЕРІЇ ТВАРИН
5.Органічні сполуки: білки
Білки, або протеїни — це високомолекулярні біополімери, мономерами яких є залишки амінокислот. Назва «білки» пов’язана зі здатністю багатьох білків біліти при нагріванні. Висока температура призводить до зміни їхньої конформації (від лат. konphormatio — розміщення) (просторової структури). А назва «протеїни» походить від грецького слова «перші» і відображає їхню роль у живих організмах. Білки входять до складу всіх живих систем, на них припадає від 50 до 80% сухої маси клітини.
У самій назві амінокислот відображено наявність у їхньому складі: аміногрупи (-NH2), якій притаманні лужні властивості, та карбоксильної групи (-СООН) з кислотними властивостями. Таким чином, амінокислоти — це амфотерні (від грецьк. amphoteros — обидва) сполуки, які реагують не лише з лугами, а й з кислотами.
Аміногрупа та карбоксильна група зв’язані з одним і тим самим атомом карбону. Групи атомів, за якими амінокислоти розрізняються між собою, називають радикалами, або R-групами.
Загальна формула амінокислоти:
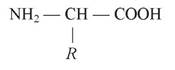
Нескінченна різноманітність білкових молекул забезпечується різними комбінаціями залишків 20 амінокислот. Ці 20 амінокислот називають основними.
Розрізняють замінні та незамінні амінокислоти. Замінні амінокислоти можуть синтезуватись в організмі тварин з продуктів обміну речовин. Незамінні амінокислоти в організмі тварин не синтезуються. Вони надходять разом з їжею. їх синтезують рослини, гриби, бактерії.
Білки, які містять усі незамінні амінокислоти, називають повноцінними. Білки, до складу яких не входять ті чи інші незамінні амінокислоти, називають неповноцінними.
Реакція полімеризації амінокислот пов’язана із взаємодією між карбоксильною групою (- СООН) однієї амінокислоти і аміногрупою (- NH2) ІНШОЇ. У ХОДІ реакції виділяється молекула води і утворюється пептид (від грецьк. peptos — зварений). Тому ковалентний зв’язок між залишками амінокислот називається пептидним.
Схема пептидного зв’язку: — СО — NH—
До вільних карбоксильної та аміногрупи можуть приєднуватися інші амінокислоти, подовжуючи ланцюг, який має назву поліпептидного:
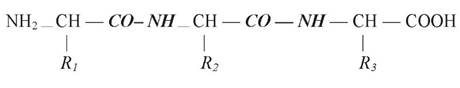
Поліпептидні ланцюжки мають певну конформацію. При зміні її білок втрачає здатність взаємодіяти з іншими молекулами. Конформація білка залежить від послідовності амінокислотних залишків та від середовища. Поліпептидний ланцюг білків на відміну від полісахаридів не має розгалуженої структури.
Властивості білка визначаються послідовністю амінокислотних залишків, що входять до складу його молекули. Первинна структура білка — це сполучені пептидними зв’язками залишки амінокислот, що мають вигляд лінійного ланцюга. Отже, первинна структура білка визначається якісним і кількісним складом амінокислотних залишків, а також їхньою послідовністю. Однак молекула білка у вигляді лінійного ланцюга нездатна виконувати специфічні функції. Для цього вона має набути просторової структури.
Вторинна структура білка характеризує просторову організацію білкової молекули, яка повністю або частково закручується в спіраль. Отже, вторинна структура білка — закручений у спіраль поліпептидний ланцюг. Радикали амінокислот при цьому залишаються ззовні спіралі. У підтриманні вторинної структури важлива роль належить водневим зв’язкам, які виникають між атомами гідрогену NH-групи (пептидної) одного витка спіралі та оксигену СО-групи іншого. Водневі зв’язки значно слабші за ковалентні, але завдяки тому, що спіраль «прошита» численними водневими зв’язками, її структура дуже міцна. Таким чином, вторинна структура білка стабілізується водневими зв’язками між пептидними групами, розташованими на сусідніх витках спіралі.
Третинна структура білка зумовлена здатністю поліпептидної спіралі закручуватись певним чином у грудку, або глобулу (від лат. globulus — кулька). Скручування відбувається внаслідок взаємодії амінокислотних радикалів на віддалених ділянках ланцюга. Третинна структура білка підтримується кількома типами зв’язків: водневими, гідрофобними, ковалентними дисульфідними (-S-S-). Міоглобін — білок, що служить для запасання кисню в м’язах, є прикладом третинної структури білку. Стабільність третинної структури залежить від внутрішньоклітинного середовища, зокрема від pH і температур. Значні коливання температури або зміни хімічного складу клітини порушують третинну структуру білка і негайно впливають на його функціонування. Надмірне нагрівання або вплив сильнодіючих хімічних речовин призводить до денатурації (від лат. de — рух униз, втрата, natura — природні властивості) — незворотного руйнування певної структури білка. При денатурації первинна структура білка лишається незмінною, а порушуються вищі її рівні.
Чимало білків складаються з кількох поліпептидних ланцюгів, які утримуються разом завдяки гідрофобним взаємодіям, а також водневим та іонним зв’язкам. Поєднання кількох поліпептидних ланцюгів називається четвертинною структурою білка. Наприклад, еритроцити крові містять білок гемоглобін, який складається з чотирьох поліпептидних ланцюгів.
За складністю будови та функціями білки поділяють на окремі класи:
✵ прості — протеїни (від грецьк. protos — перший), що складаються тільки з амінокислот;
✵ складні — протеїди (від грецьк. protos — перший, eidos — вигляд) — такі білки, що містять, крім амінокислотного ланцюга, ще й небілковий компонент. Розрізняють:
а) нуклеопротеїди — складаються із залишку нуклеїнової кислоти і амінокислоти (хромосоми);
б) глікопротеїди — складаються з вуглеводів і амінокислот (плазма крові);
в) хромопротеїди — складаються з пігменту і амінокислоти (гемоглобін, міоглобін);
г) фосфопротеїди — складаються з залишків фосфорної кислоти і амінокислоти (казеїн молока, білки яєчного жовтка);
д) ліпопротеїди — містять ліпіди і амінокислоти (входять до складу біологічних мембран).
Функції білків:
✵ структурна, або будівельна — білки входять до складу всіх органів і тканин, є структурними компонентами клітинних мембран;
✵ регуляторна — білкові гормони регулюють процеси життєдіяльності організмів (наприклад, гормон інсулін регулює обмін глюкози, зокрема, знижує рівень її в крові);
✵ транспортна — окремі білки беруть участь у перенесенні речовин і енергії в клітинах та організмі (наприклад, гемоглобін крові хребетних та гемоціанін у деяких безхребетних переносять кисень);
✵ каталітична, або ферментативна — особлива група білків — ферментів, які виконують функцію біологічних каталізаторів (біокаталізу), тобто здатні регулювати (прискорювати або гальмувати) хімічні реакції; основу ферментів складають білки, до яких може приєднуватися небілкова частина (вітаміни, метали). Ферменти каталізують лише певні реакції. Кожна молекула ферменту здатна здійснювати від декількох тисяч до декількох мільйонів операцій за хвилину. Для ферментів характерна закономірна локалізація, оскільки процес розщеплення або синтезу будь-якої речовини у клітині поділений на ряд хімічних операцій, які закономірно ідуть одна за одною. Кожну з цих операцій каталізує свій фермент. Дія ферментів залежить від температури і pH середовища;
✵ скоротлива, або рухова — особливі скоротливі білки (наприклад, актин і міозин, що входять до складу м’язів) забезпечують рух клітин і внутрішньоклітинних структур та організму в цілому;
✵ захисна — антитіла, або імуноглобуліни (глікопротеїди), які синтезуються в імунних клітинах організму, зв’язуються з чужорідними речовинами (антигенами) в комплекси, що їх потім розщеплюють і знешкоджують спеціальні клітини (тобто беруть участь у механізмі створення імунітету); а також захисні білки крові — фібрин, тромбопластин, тромбін, що забезпечують її зсідання при ушкодженні кровоносних судин;
✵ енергетична — при повному окисненні 1 г білка виділяється 17,2 кДж енергії;
✵ сигнальна — окремі складні білки клітинних мембран, змінюючи свою структуру, передають сигнали із зовнішнього середовища на інші ділянки мембрани або всередину клітини.