Универсальные поурочные разработки по Физике 8 класс к учебнику А. В. Перышкина
Плавление и отвердевание кристаллических тел - Изменение агрегатных состояний вещества
Цели: научить учащихся понимать суть таких тепловых явлений, как плавление и кристаллизация; изучить особенности в поведении вещества при переходе из твердого состояния в жидкое и обратно.
Демонстрации: исследование зависимости температуры смеси «лед - вода» от времени при плавлении; наблюдение за процессами плавления и кристаллизации твердых тел.
Ход урока
I. Повторение изученного
Повторение материала можно провести в виде опроса по карточкам: учитель заранее готовит два варианта карточек с 5-6 качественными задачами по изученной теме. Примером таких заданий могут быть:
Вариант I
- Что происходит с внутренней энергией пара при конденсации?
- Лед, который плавили в воде, имеет температуру 0 °С. Будет ли таять лед?
- Какой процесс перехода соответствует переходу вещества из газа в жидкость?
- Как меняется энергия вещества в процессе плавления твердого тела?
- Почему при одинаковой температуре самая высокая внутренняя энергия у пара?
- Приведите примеры десублимации.
- Какие агрегатные состояния вещества вы знаете?
Вариант II
- Что такое конденсация?
- Как изменяется внутренняя энергия вещества при испарении?
- Что такое сублимация? Приведите примеры.
- Примеры применения переходов из одного агрегатного состояния в другое в технике.
- Может ли вещество одновременно находиться в трех агрегатных состояниях?
- Как изменяется скорость молекул вещества при переходе из жидкого состояния в твердое?
II. Изучение нового материала
План изложения нового материала:
1. Демонстрация плавления льда.
2. Температура плавления; температура кристаллизации.
1. Рассмотрение нового материала очень удобно начать с демонстрации опыта по плавлению льда на спиртовке. Термометр, опущенный в сосуд со льдом, показывает текущую температуру, а секундомер фиксирует время процесса.
При этом легко обнаружить, что на начальном этапе нагревание льда происходит с ростом его температуры. Так он нагревается до 0 °С. Затем мы наблюдаем процесс плавления, который идет при постоянной температуре 0 °С. Через определенное время весь лед превращается в воду. Только после этого температура воды начинает подниматься.
На доске можно построить график зависимости температуры от времени нагрева (рис. 5). Участок АВ - нагрев льда. Вся энергия идет на увеличение внутренней энергии вещества. Колебания молекул льда увеличиваются.
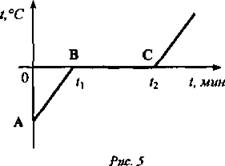
Участок ВС - плавление льда.
Этот процесс во времени более длительный, чем нагрев льда, и он идет при постоянной температуре. Все количество теплоты уходит на разрушение кристаллических решеток.
Следующий участок - нагревание воды.
После демонстрации опытов по таянию льда, плавлению и отвердеванию кристаллических тел учащиеся должны твердо усвоить три следующих положения:
а) Существует температура, выше которой вещество в твердом состоянии не может находиться.
б) Температура во время плавления остается постоянной.
в) Процесс плавления требует притока энергии к плавящемуся веществу.
2. Та температура, при которой происходит переход твердого вещества в жидкое, называется температурой плавления. Температура плавления различных веществ - табличная величина.
Далее необходимо проанализировать таблицу 3 в учебнике (с. 32). Из таблицы видно, в каких пределах лежат температуры плавления различных веществ. Учитель может задать ряд вопросов по таблице:
- Какой из металлов, приведенных в таблице, самый легкоплавкий?
- Какой из металлов самый тугоплавкий?
Если сосуд с водой поместить в среду, где температура меньше 0 °С, то будет наблюдать процесс охлаждения воды с последующим отвердеванием.
Процесс кристаллизации будет идти также при постоянной температуре. Она называется температурой кристаллизации. При этом:
![]()
Таким образом, плавление и кристаллизация - два симметричных процесса. В первом случае вещество поглощает энергию извне, а во втором - отдает в окружающую среду.
Различные температуры плавления определяют области применения различных твердых тел в быту, технике. Из тугоплавких металлов изготавливают жаропрочные конструкции в самолетах и ракетах, атомных реакторах и электротехнике.
III. Закрепление изученного
С целью закрепления материала, можно коллективно разобрать несколько качественных задач по теме, например:
- Можно ли в алюминиевом сосуде расплавить медь? Цинк? Ответ обоснуйте.
- Какие металлы можно расплавить в медном сосуде?
- Будет ли плавиться чугунная деталь, брошенная в расплавленную медь?
- В каком состоянии (твердом или жидком) находится серебро и вольфрам при температуре 1000 °С?
- Может ли внутренняя энергия тела изменяться без изменения температуры? Приведите примеры, подтверждающие ваш ответ.
Домашнее задание
1. § 13-14 учебника; вопросы и задания к параграфу.
2. Упражнение 7.
3. Сборник задач В. И. Лукашика, Е. В. Ивановой, № 1055-1057.