Основы биохимии (Общебиологическое введение. Статическая биохимия) - И.В. Березин - 1990 год
Основы биохимии (Общебиологическое введение. Статическая биохимия) - И.В. Березин - 1990 год
Предисловие
Последние три-четыре десятилетия характеризуются стремительным развитием биохимических исследований. Благодаря совершенствованию физических, химических и физико-химических методов выделения, очистки, анализа и изучения веществ живой природы на базе классической биохимии за это время возникли новые научные направления: молекулярная биология, биоорганическая и бионеорганическая химия, биофизхимия, физическая биохимия, физико-химическая биология, химическая энзимология и другие, более узкие. На основе их фундаментальных достижений получила признание как прикладное направление биотехнология.
В связи с тем что в современных биохимических исследованиях широко используются физические и химические методы и подходы, компьютерная техника и математическое моделирование, возрастает необходимость в специалистах-биохимиках с глубокими знаниями по химии, физике и математике. Эта тенденция стала заметна, в общем, давно. О необходимости определенной переориентации в подготовке специалистов-биохимиков высказались еще 20 лет назад академик А. А. Баев и проф. А. М. Варшавский. В предисловии к знаменитому переводному учебнику "Основы биохимии" Г. Малера и Ю. Кордеса они писали: "К сожалению, по традиции биологическую химию у нас до сих пор относят к разряду биологических дисциплин и поэтому готовят специалистов-биохимиков в медицинских институтах и на биологических факультетах. Между тем биохимия в ее современном виде уже давно является по существу разделом химии. Безусловно, меньшим злом для биохимика была бы недостаточно хорошая подготовка по ботанике и зоологии, чем слабое знание математики, физики и химии".
Необходимость преподавания биохимии как общеобразовательного и специального предмета на химических факультетах, кажется, уже не оспаривается (отметим, кстати, что подготовка специалистов по биофизике и на биологических и на физическихфакультетах университетов никогда не считалась ненужным дублированием). Уже второй десяток лет химический факультет МГУ (кафедра химической энзимологии) готовит специалистов по ферментативному катализу, т. е. в одной из главных областей биохимии. Хотя уровень их специальных знаний, судя по отзывам, оценивается весьма высоко, постоянно ощущалась необходимость расширить их общеобразовательную подготовку по биохимии в целом, сделать ее более системной. Для этого несколько лет назад был введен курс лекций объемом 54 часа. Он читается студентам IV курса после завершения ими общей химической, физической и математической подготовки, но до того, как они начнут слушать спецкурсы. Цель этого вводного курса - помочь студентам получить в определенном смысле "начальное", но широкое базовое образование по всем аспектам современной биохимии, что дало бы им возможность в дальнейшем легко адаптироваться в любом более узком научном направлении биохимического или даже медико-биологического профиля. Особенность этого курса лекций в том, что он рассчитан на студентов не биологических или медицинских, а химических и других факультетов. Кроме того, для его восприятия не требуется предварительно хорошая подготовка по химии, физике или математике, равно как и по биологии. Активным сторонником такого подхода выступает биохимик, ученый и педагог А. Ленинджер. Он считает, что наступило время, когда вводный курс биохимии должен быть включен в программу не только биологических и медицинских, но и химических, физических и других факультетов высших учебных заведений. А. Ленинджер обосновывает свою точку зрения положением, которое занимает сегодняшняя биохимия в современном естествознании, и той ролью, которую она играет в становлении мировоззрения любого образованного человека, независимо от рода его деятельности, и в понимании им важности бережного отношения к живой природе и здоровью людей.
Предлагаемая читателям книга содержит материал лишь первой половины того вводного курса лекций по биохимии, о котором речь шла выше. В нее вошли общебиологическое введение в биохимию и статическая биохимия.
Общебиологическое введение знакомит со строением и разнообразием живой природы на уровне клетки, тканей, органов, организмов. Здесь собран и систематизирован материал, который обычно мало известен студентам небиологических специальностей, но который непременно понадобится будущим биохимикам.
Статическая биохимия знакомит со строением и свойствами основных веществ живой природы на молекулярном уровне. Везде, где это важно, упоминается их функциональное назначение. Здесь собран и систематизирован материал, который в общих курсах даже на химических факультетах дается в весьма отрывочном виде. Хорошее знание строения и свойств основных химических компонентов живой природы, несомненно, облегчит в дальнейшем освоение разделов биохимии, посвященных протеканию биологических процессов.
Общебиологическое введение и статическая биохимия, таким образом, могут рассматриваться как базовая "азбука", т. е. основа для тех, кто собирается овладеть "языком" биохимии. В дальнейшем предполагается издать и материал по второй половине курса лекций, в который войдут главы по динамической биохимии и молекулярной биологии с возможным включением материала по функциональной биохимии.
По форме учебное пособие представляет собой конспект лекций. Это означает, что основная информация размещена на рисунках, а текст часто идет как сжатый комментарий к ним. Авторы надеются, что представленное учебное пособие окажется полезным студентам химических и других факультетов, а также выпускникам этих факультетов, имеющим научные интересы в той или иной области, расположенной на стыке химии, физики и биологии.
В заключение хотелось бы поблагодарить профессоров Н. Н. Угарову, А. К. Яцимирского, С. Д. Варфоломеева, доктора биологических наук А. М. Егорова, а также заведующую редакцией Издательства МГУ Н. М. Глазков у за помощь, оказанную при работе с рукописью и позволившую завершить ее, несмотря на неожиданную и тяжелую утрату - кончину Ильи Васильевича Березина. Хотелось бы также выразить признательность K. И. Саутиевой и В. В. Зайцеву за тщательную техническую подготовку рукописи к печати.
Ю. В. САВИН
Введение
ОПРЕДЕЛЕНИЕ СОВРЕМЕННОЙ БИОХИМИИ
§ 1.
Предмет биохимии
Всякая наука определяется объектом, методами и целями изучения. Что с этой точки зрения представляет собой биохимия? Само ее название говорит лишь о том, что она каким-то образом связана как с биологией, так и с химией. Каким же?
Химия - это наука, которая изучает состав, строение, свойства и превращения веществ природы с целью их получения и синтеза новых веществ в интересах человека.
Биология - это наука, которая изучает многообразие организмов живой природы, их строение и функционирование, взаимоотношения со средой обитания с целью лучшего познания человека и определения его места в живом мире.
В связи с тем что в определении биологии использован термин "живая природа", необходимо уточнить, чем она отличается от остальной, т. е. неживой, природы.
Отличительные признаки живой природы:
сложность строения при весьма небольшом разнообразий простых составных компонентов;
высокая степень внутренней организации со строго определенной функцией у каждой составной части;
способность поддерживать живое состояние за счет извлечения энергии и материи из окружающей среды;
способность воспроизводить себя неопределенно долго.
Исходя из определения химии и биологии, становится понятным, как с ними связана биохимия. Биохимия - этохимия, потому что она изучает состав, строение, свойства и превращения веществ, абиологическойона становится, во-первых, потому, что изучает не всякие вещества, а лишь те, которые встречаются и претерпевают различные превращения в живой природе, и, во-вторых, потому, что это изучение направлено на понимание функционирования живых объектов.
Итак, биохимия - это наука, которая изучает состав, строение и свойства веществ живой природы, а также их превращения в процессе жизнедеятельности живых объектов с целью познания молекулярных основ жизни. Решение этой последней задачи влечет за собой прогресс в областях знаний, затрагивающих здравоохранение и условия жизни человека, а в итоге дает возможность получить ответ на кардинальный вопрос естествознания о происхождении жизни.
§ 2.
Современная биохимия - качественно
и количественно новый этап
в развитии биохимии
Развитие всякой науки происходит скачкообразно. Период количественного накопления фактов завершается на определенном этапе открытием ряда общих закономерностей и созданием обобщающих теорий, которые становятся качественно новой базой для нового количественного накопления фактов.
Например, в развитии химии известны три периода. Алхимия - донаучный период накопления экспериментальных данных с древних времен до XVIII в. Новая химия возникла в середине XVIII в. с открытием первых количественных законов и утверждением атомистической теории в работах Ломоносова, Лавуазье, Дальтона. Современная химия началась с открытия Д. И. Менделеевым периодического закона, который систематизировал накопленные в предыдущем периоде знания и позволил с качественно новой точки зрения не только объяснить экспериментальные данные, но и предвидеть новые.
В развитии биохимии также можно выделить три периода.
Донаучная биохимия - период накопления практических знаний (выпечка хлеба, приготовление сыра, вина, пива, выделка кож и т. д.) с древних времен до середины XIX в.
Биохимия классическая выделяется как самостоятельная наука из физиологии во второй половине XIX в. Ее возникновение связано с понятным желанием объяснить физиологические процессы с помощью химических реакций. Но как биохимики могли приступить к решению этой химической задачи, если много десятков лет им пришлось работать не с чистыми веществами, а с суспензиями тканей, тканевыми жидкостями и т. д.? По этой причине классическую биохимию справедливо не относят к химическим наукам.
Современная биохимия возникла на базе классической во второй половине XIX в. с переходом биохимических исследований на качественно новый уровень - молекулярный. Это стало возможным благодаря совершенствованию к этому времени химических, физических и физико-химических методов выделения, очистки, анализа и изучения веществ живой природы. Качественно новый уровень исследований повлек за собой количественное расширение биохимических направлений. Так, на базе классической биохимии возникли молекулярная биология, биоорганическая и бионеорганическая химия, биофизхимия и физическая биохимия, физико-химическая биология, химическая энзимология и другие, которые отличаются друг от друга лишь исследовательскими методами и подходами, выбором конкретных биологических объектов, а преследуют все ту же цель биохимии - познание химических основ процессов жизнедеятельности. Качественно новый уровень исследования - молекулярный, т. е. химический, позволяет отнести современную биохимию к химическим наукам.
Часть I
ОБЩЕБИОЛОГИЧЕСКОЕ ВВЕДЕНИЕ
§ 1.
Классификация живых объектов
по характеру взаимодействия
с окружающей средой
Как видно из приведенного выше определения живого, функционирование живых объектов обеспечивается поступлением из внешней среды, во-первых,материи, из атомов которой (С, Н, N, S, Р и др.) они синтезируют свои собственные структуры, и, во-вторых,энергии, за счет которой и протекает биосинтез. В связи с этим все живые организмы принято делить (рис. 1.1)
по виду используемой материи на:
литотрофы(автотрофы), которые потребляют простые неорганические соединения, такие, как СО2, Н2О, N2, NH3, H2S, H2PO4-и др., иореанотрофы(гетеротрофы), которые потребляют различные органические соединения;
по виду используемой энергии на:
фотографы, использующие энергию света, ихемотрофы, использующие энергию химических связей материи, которая поступает из внешней среды;
по отношению к атмосферному кислороду на:
аэробы, которые используют кислород в качестве окислителя, в его отсутствие они гибнут;анаэробы факультативные, которые могут использовать кислород в качестве окислителя и не погибают в его отсутствие;анаэробы облигатные, для которых кислород является метаболическим ядом.
У фотолитотрофов, например у зеленых растений, водорослей, цианобактерий, в процессе фотосинтеза выделяется кислород:
nН2О +nСО2
(СН2О)n+nО2. |
(I.1) |
У других фотолитотрофных, а именно у пурпурных серных бактерий, фотосинтез идет без выделения кислорода:
2nH2S +nCO2
(CH2O)n+ 2nS +nH2O. |
(I.2) |
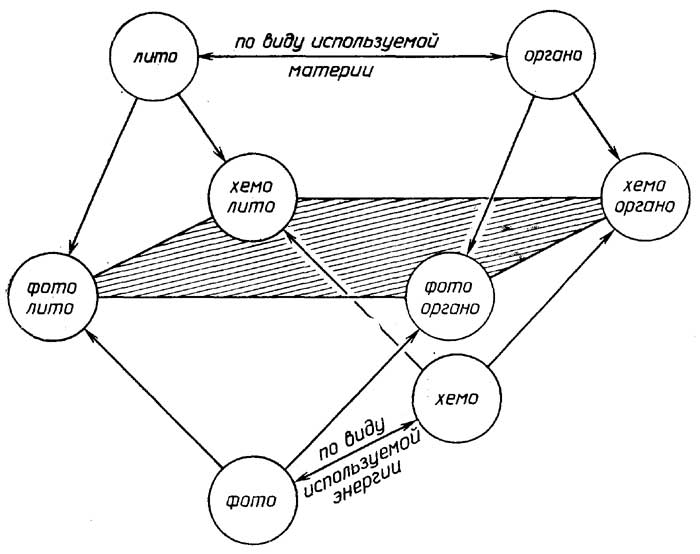
Рис. 1.1.Классификация живых объектов по характеру взаимодействия с окружающей средой
Хемолитотрофы - это некоторые виды бактерий, например нитрифицирующие (аэробы), которые ассимилируют СО2за счет энергии реакции окисления кислородом:
2NH4++ 5O2→ 2NO3-+ 4H2O, |
(I.3) |
или денитрифицирующие (анаэробы), ассимилирующие СО2за счет энергии окисления нитратом:
10S + 12NO3-+ 4H2O → 10SO42-+ 6N2+ 8H+. |
(I.4) |
Органотрофы (гетеротрофы) подразделяются нафото-ихемоорганотрофы.
Фотоорганотрофы, например несерные пурпурные бактерии, в качестве источника углерода нуждаются помимо СО2еще и в простых органических соединениях, таких, как этиловый или изопропиловый спирты и др.:
nСН3СН2ОН +nСО2
(СН2О)n+nСН3СООН. |
(I.5) |
Хемоорганотрофы являются основными представителями органотрофов (гетеротрофов). Они питаются за счет литотрофов (автотрофов) или других органотрофов (гетеротрофов).
По типу питания хемоорганотрофы в свою очередь подразделяют насапрофиты- организмы, питающиеся остатками других организмов или продуктами их жизнедеятельности (большинство грибов и многие типы бактерий);паразиты- живут на поверхности или внутри других организмов, питаясь за счет их (некоторые грибы, многие типы бактерий, некоторые растения и животные);голозойные организмы- это большинство животных, которые отыскивают и поедают другие организмы.
Раздел А
КЛЕТКА
Клетка -наименьшаяструктурная и функциональная единица живой материи. Клетка, как и всякая живая материя, состоит из молекул различных веществ, которые взаимодействуют по законам химии и физики, однако только в составе клетки это взаимодействие приводит к проявлению признаков живой материи. Наименьший размер клетки ограничен размерами составляющих ее молекул, наибольший размер определяется законами диффузии веществ извне и внутри клетки. Так как с ростом клетки ее поверхность увеличивается пропорционально квадрату радиуса, а объем - пропорционально кубу радиуса, то, начиная с какого-то размера, клетка будет испытывать недостаток питательных веществ и станет нежизнеспособной.
На основании особенностей структуры и функционирования все клетки делят на прокариотические ("доядерные") и эукариотические (с хорошо сформированным ядром). Прокариотические клетки представлены в природе организмами, называемыми прокариотами, эукариотические - эукариотами.
Глава 1
ПРОКАРИОТИЧЕСКИЕ КЛЕТКИ
§ 1.
Распространенность,
формы, размеры
Прокариотические клетки представлены в живой природе только бактериями - большинством микроорганизмов, на долю которых приходится три четверти живой материи на Земле. Встречаются бактерии разной формы: палочковидные - бациллы (bacillus); шаровидные - кокки (coccus), причем если они составлены из одной или двух клеток, то называются соответственно гонококками и диплококками, если собраны в нить, то это стрептококки, если имеют вид гроздьев - стафилококки; бактерии в виде запятой - вибрионы (vibrio), например холерный вибрион; в виде слабозакрученной спирали - спириллы (spirillum); в виде сильнозакрученной спирали - спирохеты (spirochaetales).
Обычные размеры бактерий - единицы и десятки микрометров, но бывают бактерии длиной до сотен микрометров, например спирохеты (до 500 мкм), к которым относится возбудитель сифилиса.
§ 2.
Строение
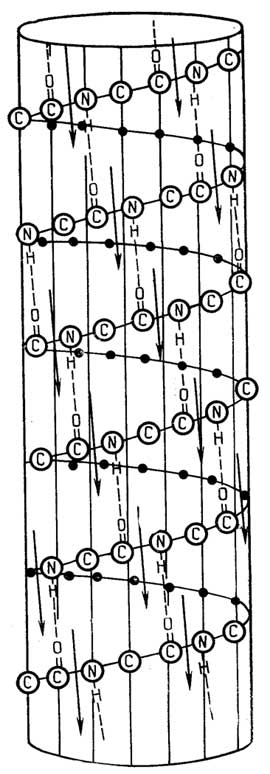
Строение прокариотической клетки отражено на рис. 1.2.
Снаружи клетка покрыта оболочкой, отделяющей содержимое клетки от внешней среды.Клеточная оболочкаобладает способностью пропускать внутрь необходимые питательные вещества, а
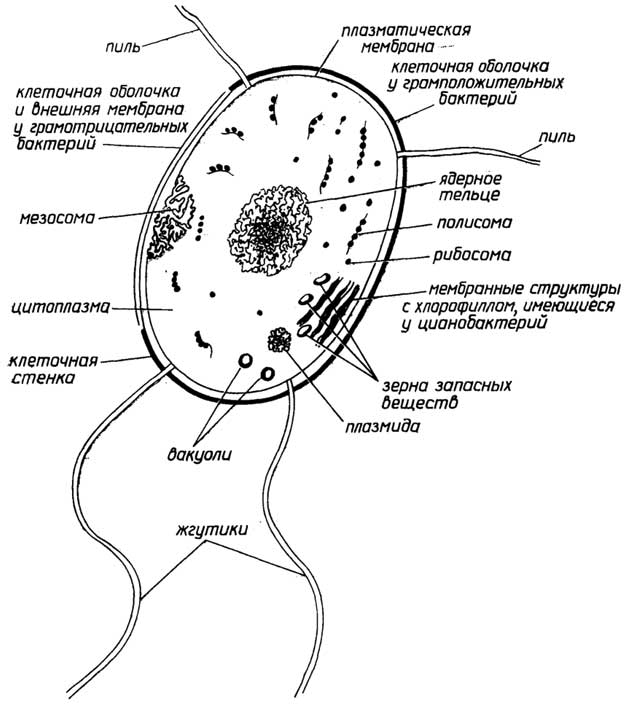
Рис. I.2.Строение прокариотической клетки
наружу - продукты жизнедеятельности клетки. Все бактерии по способности окрашиваться или не окрашиваться по Граму (при последовательном использовании красителя кристаллического фиолетового, йода и сафранина) делятся награмположительныеиграмотрщательныесоответственно. Это деление связано с двумя видами построения клеточных оболочек.
У грамположительных она состоит изплазматической мембраны, состоящей из липидов и белков, и расположенной поверх ее жесткой толстойклеточной стенки, структурная основа которой - полисахариды, сшитые короткими пептидами. У грамотрицательных бактерий плазматическая мембрана покрыта тонкой полисахаридной клеточной стенкой, которая в свою очередь защищена наружной мембраной из липидов, белков и липополисахаридов. Плазматическая мембрана у всех клеток имеет практически одинаковую толщину и одинаковое строение (см. разд. "Липиды"). Ее особенность в том, что она содержит большое число связанных с ней ферментов, обеспечивающих снабжение клетки химической энергией в виде АТФ за счет поступающих извне питательных веществ или света; направленный транспорт веществ через мембрану за счет энергии АТФ; синтез клеточной стенки.
Клеточная стенка поддерживает форму бактерий и предохраняет их от осмотического разрыва.
Протопластыисферопласты- это соответственно грамположительные и грамотрицательные бактерии, искусственно лишенные клеточных стенок и сохраняемые в гипертонической среде для сохранения их целостности.
Мезосомы- многослойные структуры, образованные складками плазматической мембраны. Они имеются не у всех бактерий. Мембраносвязанные ферменты мезосом участвуют во многих обменных реакциях, в частности в репликации ДНК.
Цитоплазма- внутренняя среда клетки, где протекает большинство обменных процессов.
Цитозоль- жидкая часть цитоплазмы.
Рибосомы- гранулы с максимальным диаметром около 20 нм, состоящие из РНК и белков. На рибосомах протекают реакции синтеза клеточных белков.
Полисомы, илиполирибосомы, представляют собой нить информационной РНК, с нанизанными на нее в виде бусин рибосомами.
Ядерное тельце(нуклеоид) - плотно упакованная кольцевая двухцепочечная ДНК. Эта единственная "хромосома" несет в себе основную генетическую информацию клетки. Она не отделена мембраной от цитоплазмы.
Плазмиды- внехромосомные кольцевые ДНК очень небольшого размера, находящиеся в цитоплазме. В них закодирована важная информация, определяющая жизнедеятельность клетки в определенных условиях, в частности структура ферментов, обезвреживающих некоторые антибиотики.
Эписомы- это плазмиды, способные в определенных условиях встраиваться в хромосомную ДНК. Эписомы, способные покидать хромосомы, захватывая с собой части хромосомной ДНК, называют фактором пола (факторомF).
Пи́ли(фимбрии) - тонкие прямые и полые волоски, покрывающие клеточную оболочку. Через половые пили (F-пили) происходит перенос ДНК от одной бактерии к другой.
Жгутики(флагеллы) - длинные нити, более толстые, чем пили, часто собранные в пучки. Их вращение заставляет бактерию поворачиваться в обратном направлении и продвигаться вперед. Вращение жгутиков бактерий обеспечивается своеобразным "протонным мотором", находящимся в плазматической мембране.
Различные гранулы, содержащие запасенные вещества, могут также находиться в цитоплазме бактерий. Это могут быть гранулы поли-β-оксимасляной кислоты, гликогена, полиметафосфата, белка, капельки жира.
Вакуоли- капельки изолированной водной фазы с растворенными веществами.
Таким образом, в прокариотической клетке существует примитивноеразделение функций: клеточная стенка выполняет защитную функцию, мембрана обеспечивает поступление питательных веществ и извлечение из них химической энергии, полирибосомы синтезируют белки, нуклеоид и плазмиды хранят и передают генетическую информацию и т. д.
§ 3.
Размножение
Размножение бактерий происходит обычно путемпростого деленияклетки пополам. Перед делением количество ДНК в ядерном тельце удваивается, и затем клетка делится так, что дочерние клетки получают ДНК, идентичную родительской до удваивания. В определенных условиях некоторые виды бактерий способны размножаться и путемконъюгации, в процессе которой происходит либо слияние двух клеток, либо перенос одной из цепей ДНК через пиль одной бактерии в другую. Затем в клетке происходит обмен генетическим материалом, и после деления дочерние клетки получают ДНК, которая несет информацию, полученную от двух клеток.
§ 4.
Многообразие
Многообразие прокариотических клеток определяется многообразием бактерий, которых насчитывается около 3000 видов. Все бактерии принято делить на 20 групп. Классификация их основана одновременно на многих признаках: форме, способности окрашиваться по Граму, способе питания, способности к спорообразованию, выделению определенных продуктов, отношению к кислороду и др.
Особо отметим четыре группы бактерий.
Цианобактерии, которые также называютсинезелеными водорослями, - единственные фотосинтезирующие бактерии, способные выделять молекулярный кислород.
Риккетсии- примитивные бактерии с очень ограниченными потребностями в питательных веществах, способные жить и размножаться лишь внутри клеток-хозяев.
Микоплазмы- отличающиеся наименьшими размерами (диаметр около 300 нм) и отсутствием жесткой клеточной стенки. Меняя форму, они способны проникать через отверстия с размером меньше, чем их собственный. Могут жить только как паразиты в других организмах.
Спорообразующиебактерии при неблагоприятных внешних условиях образуют внутри себя спору - микроклетку с необходимым запасом питательных веществ и генетического материала, для которой характерны крепкая защитная оболочка и почти полное отсутствие воды. После разрушения клетки спора может находиться в неблагоприятных условиях неопределенно долго. Однако при попадании в благоприятную среду она вновь превращается в нормальную бактерию.
В последнее время стало общепринятым выделять метаногенные бактерии (выделяют в процессе жизнедеятельности метан), галобактерии (живут в средах с достаточно высокой концентрацией солей), термоацидофилы (живут в кислой среде и при весьма высоких температурах) в особую группуархебактерий. Это выделение связано с особенностями их молекулярного строения и биохимического функционирования. Все другие бактерии называют истинными, илиэубактериями.
Глава 2
ЭУКАРИОТИЧЕСКИЕ КЛЕТКИ
§ 1.
Распространенность,
формы, размеры
К эукариотическим клеткам относятся клетки всех организмов, кроме бактерий: простейших одноклеточных микроорганизмов, грибов, водорослей, растений и животных. По сравнению с прокариотами эукариоты более многочисленны, и число их видов исчисляется миллионами.
Эукариотические клетки очень разнообразны по форме и размерам. Некоторые из них огромны, например яйцеклетка курицы (желток) или очень длинны, например некоторые нервные клетки с отростками (аксонами) у кальмара, достигающими нескольких метров. В целом же Эукариотические клетки значительно больше и сложнее, чем прокариотические. Они чаще всего имеют диаметр, измеряемый десятками микрометров, и объем в несколько тысяч раз больший, чем прокариотические.
§ 2.
Строение
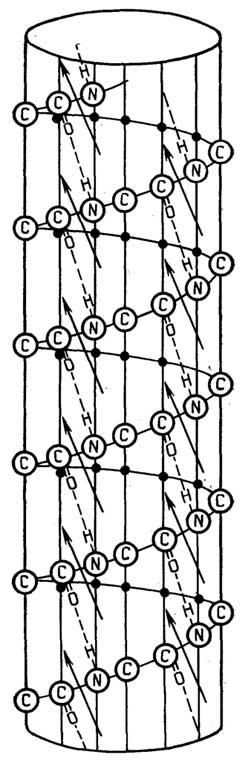
Эукариотические клетки отличаются хорошо оформленным ядром и большим количеством субклеточных органелл, некоторые клетки многоядерные. На рис. 1.3 представлена "обобщенная" эукариотическая клетка. Рассмотрим ее субклеточные структуры, начиная от центра к периферии.
Ядроотделено от остального содержимого клеткиядерной оболочкой, которая состоит извнешнейивнутренней мембраниперинуклеарного пространствамежду ними шириной 20-40 нм. Строение ядерных мембран аналогично строению плазматической мембраны. Ядерная оболочка имеет многочисленные поры (диаметром до 100 нм).Хроматин- содержимое ядра, назван так за способность окрашиваться определенными красителями. Он представляет собой смесь ДНК (35%), РНК (5%) и белков (60%). В период, когда клетка не делится, хроматин распределен равномерно вядерном соке(нуклеоплазме) и состоит из видимой только в электронный микроскоп сетихроматиновых нитей. В начале деления клетки хроматиновые нити путем закручивания в суперспирали образуют плотные образования -хромосомы, видимые в обычный микроскоп. На рис.1.4 показан хромосомный набор человека. Ядро - место синтеза ДНК и РНК.
Ядрышко- более плотная, чем хроматин, и лучше окрашивающаяся структура в ядре. Во время деления клетки ядрышко исчезает. Оно содержит большую часть ядерной РНК. Это место образования рибосом. В ядре может быть несколько ядрышек.
Цитоплазмаэукариот имеет более тонкую структуру, чем прокариотическая. Помимо жидкой фазы -цитозоля- у нее естьцитоскелет, который представляет собой густую сетьмикронитей, миофиламентовимикротрубочек. Он обеспечивает сохранение формы клеток, особенно у животных, имеющих довольно мягкие оболочки, а также относительно фиксированное положение многочисленных субклеточных образований (органелл).
Эндоплазматический ретикулум(ЭР) - это сложная разветвленная трехмерная сеть каналов и полостей, пронизывающая всю цитоплазму. Стенки каналов и полостей (цистерны) имеют мембранное строение, сходное с плазматической мембраной.Шероховатый ЭРотличается отгладкого ЭРналичием рибосом на наружной стороне мембран, образующих каналы и цистерны. Основная функция первого - синтез белков. Углеводы и липиды синтезируются на наружной стороне мембран гладкого ЭР. Синтезированные белки, углеводы и липиды проникают через мембраны ЭР на их внутреннюю сторону и по каналом ЭР доставляются к местам назначения. Цистерны играют роль накопителей синтезированных веществ.
Рибосомыэукариотических клеток несколько крупнее, чем прокариотических. Они состоят из комплексов РНК с белками и, так же как в прокариотических клетках, не имеют мембраны.
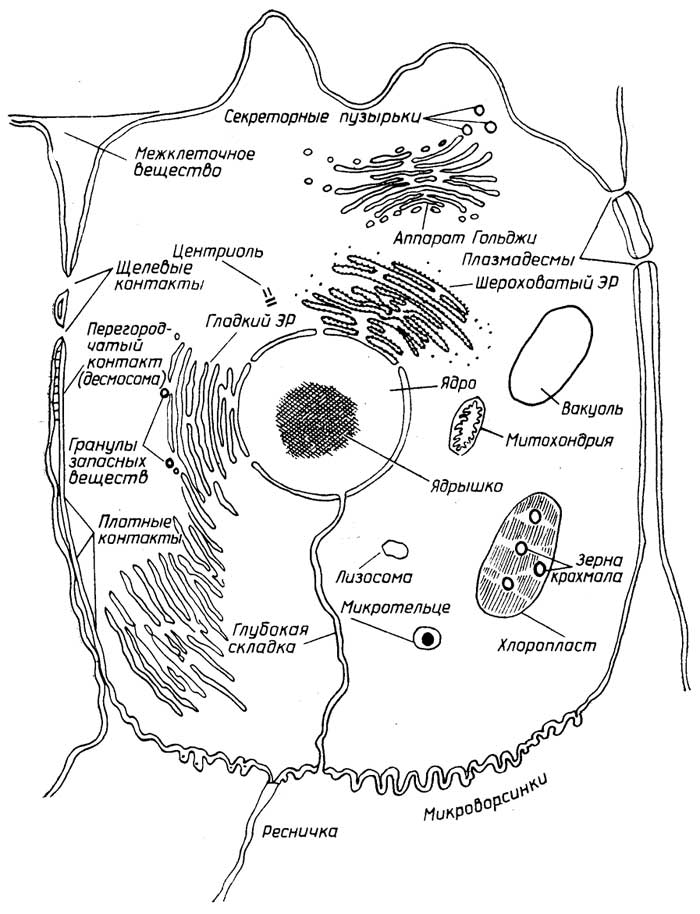
Рис. I.3.Строение эукариотической клетки
Комплекс Гольджипредставляет собой стопку образованных из одинарных мембран плоских полостей и трубочек. По краям можно видеть отдельные пузырьки, оторвавшиеся от основного тельца. Комплекс Гольджи обычно находится где-либо

Рис. I.4.Хромосомный набор человека: мужской (А), женский (Б), генетические аномалии (В, Г)
неподалеку от ядра, но в некоторых клетках, например в нервных, он целиком его окружает. В растительных клетках он называетсядиктиосомой. Синтезированные в ЭР соединения сначала поступают в комплекс Гольджи, накапливаются там, модифицируются, а затем в виде пузырьков транспортируются к местам назначения в клетке или же выводятся вне ее (экзоцитоз). На мембранах комплекса Гольджи синтезируются также собственные липиды и углеводы. Комплекс Гольджи отсутствует в эритроцитах и сперматозоидах.
Лизосомы- окруженные одинарной мембраной небольшие пузырьки, которые содержат ферменты, расщепляющие белки, липиды, углеводы, уже ненужные клетке или чужеродные.
Микротельца- органеллы, похожие на лизосомы, но часто отличающиеся от последних наличием внутри темного пятна, представляющего собой кристаллы белка.Пероксисомы- это микротельца животных и растительных клеток, содержащие группу ферментов, в результате действия которых образуется или используется перекись водорода.Глиоксисомы- это микротельца растительных клеток, содержащие группу ферментов глиоксилатного цикла, которые позволяют синтезировать углеводы из жирных кислот липидов.
Вакуоли- это пузырьки с одинарной мембраной. Они содержат различные продукты метаболизма. В клетках молодых растений они невелики по размерам, но с возрастом их размеры значительно увеличиваются. В клетках животных они встречаются редко.
Гранулы- запасы питательных веществ. Они содержат в твердом виде белки, полисахариды (гликоген, крахмал), липиды.
Капелькижира - это способ запасания жидких липидов.
Митохондрии- довольно большиеорганеллы с двойной мембранойи сложной внутренней структурой, представляющей собой многочисленные складки (кристы) внутренней мембраны. Митохондрии содержат ферменты, способные превращать с помощью окислителя (О2) химическую энергию связей питательных веществ в универсальный энергоноситель АТФ (см. раздел "Нуклеотиды"). Митохондрии содержат также небольшую кольцевую ДНК и рибосомы, похожие на бактериальные. При делении клетки митохондрии также делятся.
Пластиды- органеллы растительных клеток, значительно большие, чем митохондрии, но, как и последние, имеющие внешнюю и внутреннюю мембраны. При делении клетки они тоже делятся. Пластиды бывают трех видов: хлоропласты, хромопласты и лейкопласты. Все три вида способны трансформироваться друг в друга.Хлоропласты- это пластиды, содержащие в качестве основного пигмента хлорофилл и способные к фотосинтезу. В хлоропластах внутренняя мембрана образует во всем пространстве органеллы дискообразныетилакоидные пузырьки, объединенные в граны. Хлоропласты находятся в клетках зеленых частей растений. Подобно митохондриям, они содержат ДНК.Хромопластыв отличие от хлоропластов содержат помимо хлорофилла и другие пигменты из группы каротиноидов (см. раздел "Липиды"). Присутствием хлоропластов объясняется желтая, оранжевая, красная окраска цветов, плодов и осенних листьев.Лейкопласты- бесцветные пластиды, в которых растительные клетки запасают крахмал и масла.
Важную роль в организации деления хромосом играетклеточный центр. У животных клеток он представлен двумя маленькими тельцами -центриолями.
Клеточная оболочкаотделяет содержимое эукариотической клетки от окружающей среды. У растительных клеток она состоит из плазматической мембраны, защищенной снаружи жесткой клеточной стенкой. У животных клеток клеточная оболочка состоит из мягкой плазматической мембраны.
Клеточная стенкарастительных клеток создает форму клетки и выполняет защитную функцию. Ее структурной основой являются нити целлюлозы, сцементированные смесью полисахаридов, белков и сложноразветвленного полимера лигнина, содержащего в своих цепях ароматические остатки (см. раздел "Углеводы").
Плазматическая мембранарегулирует обмен содержимого клетки с внешней средой. У всех клеток она состоит из липидов и белков. Плазматическая мембрана иногда образует складки, уходящие глубоко внутрь клетки, вплоть до ядерной мембраны, соединяясь с последней. Способность некоторых одноклеточных микроорганизмов, например амёб, а также определенных клеток животных, например лейкоцитов, поглощать довольно крупные частицы питательных веществ, твердые (фагоцитоз) или жидкие (пиноцитоз), обусловлена свойствами плазматической мембраны. Это происходит следующим образом: мембрана с "прилипшей" частицей образует впадину, края которой затем смыкаются.
Микросомы- небольшие (диаметром около 100 нм) пузырьки, образованные из мембран ЭР и (или) плазматической мембраны. На их внешней стороне могут находиться рибосомы. Микросомы образуются после разрушения клеток и выделяются путем центрифугирования. В живых клетках не обнаруживаются.
Микроворсинки- это мелкие тонкие выросты плазматической мембраны животных клеток, значительно увеличивающие их поверхность.
Реснички- образования длиннее и толще, чем микроворсинки. Внутреннее устройство их таково, что они способны к вращательному движению за счет потребления энергии АТФ. Их функция - передвигать вещества вдоль клетки или обеспечивать движение последней.
Такое же строение имеютжгутики, но они в несколько раз длиннее. Вращаясь, жгутики обеспечивают одиночным клеткам быстрое продвижение.
§ 3.
Образование многоклеточных структур
Эукариотические клетки отличаются от прокариотических тем, что, взаимодействуя друг с другом, способны образовывать сложные многоклеточные структуры - ткани, органы, организмы.
Удержание эукариотических клеток вместе достигается различными способами.
В отсутствие прямого контакта это происходит 1) за счет склеивающего действия межклеточного вещества, в состав которого входят белки. Поэтому при разрушении белков, например ферментативным путем, клетки разъединяются.
Полупрямой контакт возникает путем 2) образованиядесмосом(перегородчатых соединений) - правильно расположенных многочисленных мембранных перегородок между неплотно прилегающими плазматическими мембранами соседних клеток; 3) с помощью коротких или длинных гибких клеточных отростков (нитей), через которые клетки могут обмениваться содержимым цитоплазмы.
Прямой контакт достигается за счет образованияплотных соединений, что может быть связано с 4) зацеплением клеточных оболочек путем их взаимопроникающих впячиваний-выпячиваний; 5) простым слиянием плазматических мембран в местах контакта; 6) образованиемщелевых контактов, т. е. достаточно крупных пор в соприкасающихся клеточных оболочках, 7) образованиемплазмодесм- мембранных трубочек, пронизывающих жесткие стенки растительных клеток и обеспечивающих обмен цитоплазмой между ними.
Особые формы объединения эукариотических клеток в многоклеточных организмах - это синцитии и симпласты, когда клетки частично или полностью сливаются.Синцитии(или соклетия) - это такое объединение клеток в единое целое, когда они соединяются между собой через плазматические отростки (нити) или щелевые контакты, что позволяет им достаточно свободно обмениваться содержимым цитоплазмы, при этом их ядра сохраняют свою функциональную самостоятельность. Всимпластахграницы между отдельными клетками практически исчезают, и образуется единая структура (или огромная клетка), в которой множество ядер расположены в общей цитоплазме.
§ 4.
Размножение
По типу размножения эукариотические клетки можно разделить на две группы. К первой относятся все клетки, кроме тех, которые ответственны за размножение организма в целом. У растений они называютсявегетативными, у животных -соматическими. Они образуются путем митоза - процесса, при котором дочерняя клетка получает столько же генетического материала, сколько его было у родительской клетки. Иногда размножение клеток происходит простым делением (амитоз). Вторую группу составляют специализированные клетки, ответственные за размножение организма в целом. Это -половые клетки. Они образуются путеммейоза- процесса,
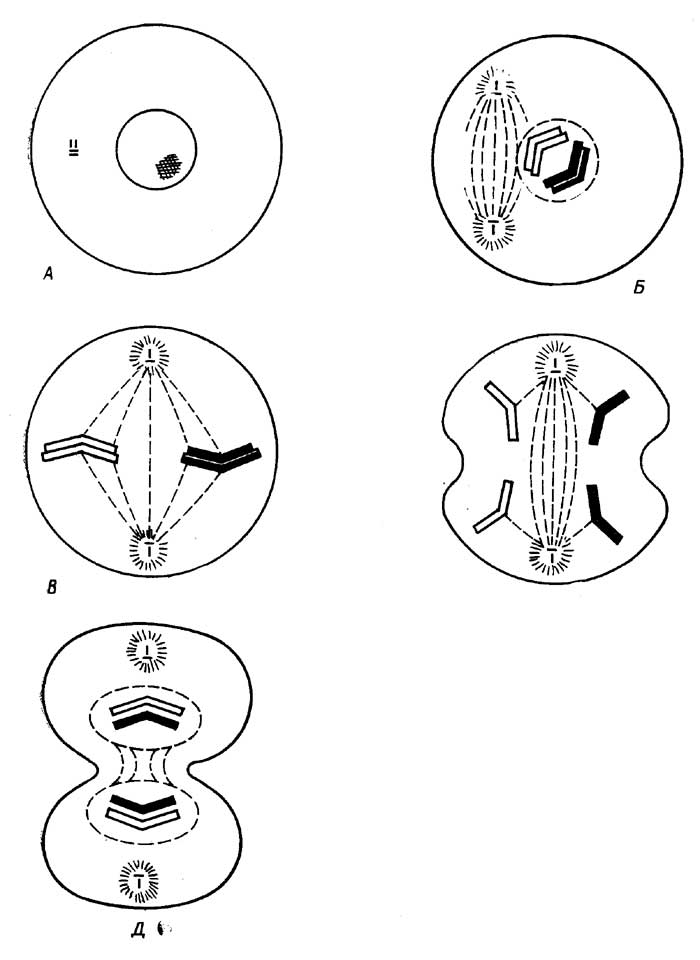
Рис. I.5.Митоз: интерфаза (A), профаза (Б), метафаза (В), анафаза (Г), телофаза (Д)
тором дочерняя клетка получает вдвое меньше генетического материала, чем было у родительской клетки.
Митоз. Это непрерывный процесс, который условно можно разделить на четыре стадии (рис. I.5): профаза, метафаза, анафаза, телофаза. В большинстве клеток митоз происходит в течение 0,5-3 ч, а подготовка к нему (интерфаза) занимает более продолжительное время (10-30 ч).
Интерфаза. Удваивается генетический материал за счет репликации ДНК. Синтезируются белки, которые участвуют в клеточном делении. Синтезируется АТФ, без запаса которой деление клетки невозможно. Увеличивается число некоторых субклеточных структур, например митохондрий, хлоропластов.
Профаза. Ядро увеличивается в размерах. Нити хроматина, каждая из которых претерпела в интерфазе репликацию, образуют суперспирали и превращаются в видимые в обычный микроскопхромосомы. Каждая хромосома состоит из двух сцепленных друг с другом (результат репликации)хроматид. Место сцепления называютцентромерой. Затем в клетке возникаютполюса, которые как бы управляют дальнейшим делением. В животных клетках центриоль делится, и дочерние центриоли расходятся к полюсам клетки. В растительных клетках полюса возникают без центриолей. Затем в направлении от полюсов к экватору протягиваются микротрубочки (15 нм) - нитиверетена деления, часть которых присоединяется к центромерам хромосом. Ядерная оболочка и ядрышко исчезают.
Метафаза. Хромосомы выстраиваются вдоль экватора. Эта стадия протекает быстрее, чем профаза.
Анафаза. Хромосомы в центромерах разделяются на хроматиды, которые расходятся к противоположным полюсам.
Телофаза. Вокруг собравшихся у полюсов хроматид (теперь уже называемых дочерними хромосомами) образуется ядерная оболочка. Животная клетка делится пополам. В растительной клетке посередине образуется плазматическая мембрана, которая разделяет родительскую клетку на две дочерние. Во вновь образованных клетках хроматиды (дочерние хромосомы) превращаются в хроматин, и возникает ядрышко.
Амитоз. Это процесс размножения клеток путем простого деления, когда не наблюдается образования хромосом, митотического веретена, а ядерная оболочка и ядрышко не исчезают. При амитозе происходит простое деление ядра пополам, затем делится цитоплазма. Амитоз часто не заканчивается полным делением клетки, а образуется двуядерная клетка. Он обнаружен в растительных и животных клетках, а также в клетках более простых организмов. Амитоз можно считать нетипичным способом размножения, так как дочерние клетки в дальнейшем теряют жизнеспособность и более не делятся.
Мейоз - процесс образования мужских и женских половых клеток (рис. I.6). Он включает в себя два деления, в каждом из
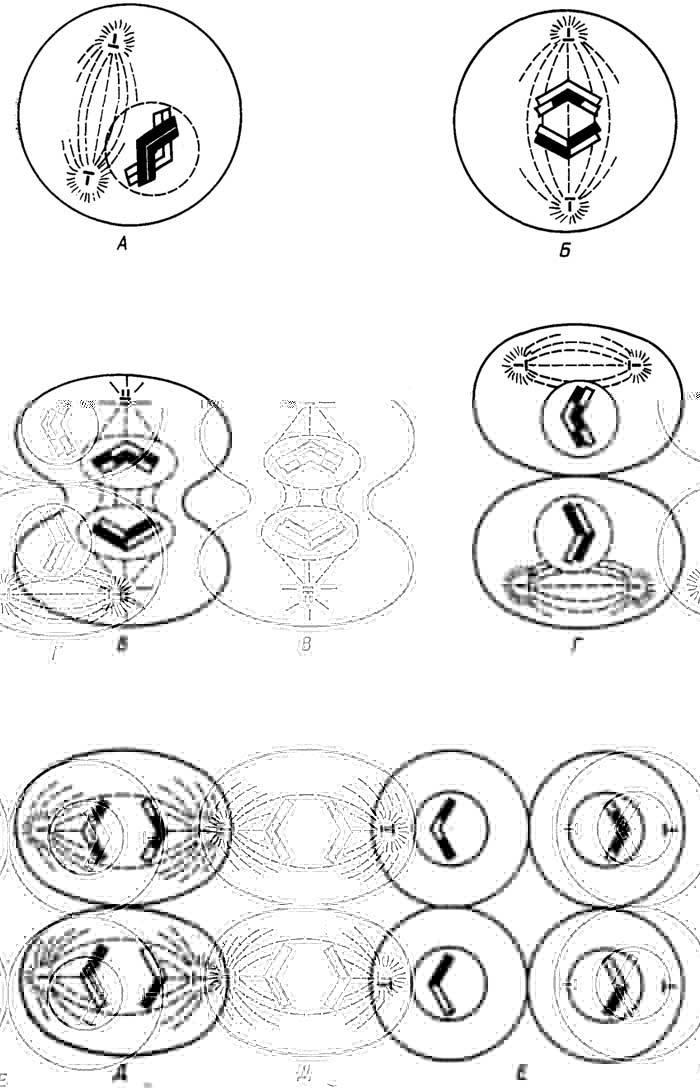
Рис. I.6.Мейоз. Первое деление: профаза (А), метафаза (Б), анафаза и телофаза (В). Второе деление: профаза и метафаза (Г), анафаза (Д), телофаза (Е)
которых можно также выделить профазу, метафазу, анафазу и телофазу.
Интерфаза. Протекают те же процессы, что и при митозе, т. е. репликация ДНК, синтез необходимых белков и АТФ.
Первое деление
Профаза. Из хроматина формируются хромосомы, так же как при митозе, но в отличие от него хромосомы разбиваются на пары, так как эукариотические клетки, кроме половых, обычно" содержат четное число хромосом. Входящие в такие пары хромосомы называютсягомологичными. Они несут сходную генетическую информацию, например цвет глаз, форма цветка и т. д. Кроме того, они, за исключением образующих только одну пару половых хромосом, тождественны по внешним признакам (форме, строению), поэтому и в клетках, претерпевающих митоз, все хромосомы можно разбить на пары гомологичных. Если клетка содержит пары гомологичных хромосом, она имеет диплоидный набор хромосом. Если клетка содержит по одной гомологичной хромосоме из каждой пары, она имеетгаплоидныйнабор хромосом. Гомологичные хромосомы в парах тесно сближаются, переплетаются хроматидами, образуятетрады.
Между ними происходиткроссинговер(или конъюганция), во время которого хроматида одной гомологичной хромосомы обменивается на некоторых участках генетическим материалом (т. е. ДНК) с хроматидой другой гомологичной хромосомы. Поскольку одна гомологичная хромосома несет информацию от отца, а другая - от матери, после кроссинговера каждая из хроматид в тетраде несет генетическую информацию от обоих родителей. Одновременно образуются полюса клетки и веретено деления.
Метафаза. Конъюгировавшие гомологичные хромосомы попарно (тетрадами) выстраиваются вдоль экватора.
Анафаза. Конъюгировавшие гомологичные хромосомы разделяются и расходятся к полюсам. Каждая из гомологичных хромосом по-прежнему состоит из двух хроматид.
Телофаза не доходит до конца, так как хромосомы не превращаются в хроматин и ядрышко не возникает. Вместо этого возникающие новые клетки сразу переходят ко второму делению.
Второе деление
Профаза. В каждой из двух образующихся клеток снова возникают полюса (под углом 90° по отношению к предыдущим), и между ними снова образуется веретено деления.
Метафаза. Хромосомы выстраиваются вдоль нового экватора (перпендикулярного экватору предыдущего деления).
Анафаза. Как и при митозе, каждая хромосома делится на хроматиды, которые и расходятся к полюсам.
Телофаза. Вокруг каждой группы хроматид (теперь уже называемых дочерними хромосомами) образуется ядерная оболочка. Клетка окончательно делится. В образующихся новых четырех клетках хромосомы превращаются в хроматин, возникают ядрышки.
Таким образом, при митозе в результатеодного делениякаждая из двух дочерних клеток имеет столько жехромосом, сколько и родительская, а при мейозе в результатедвух последовательных деленийкаждая из четырех дочерних клеток имеетвдвое меньше хромосом, чем родительская.
В родительской клетке в обоих случаях перед делением имеется диплоидный набор двойных хромосом, в дочерних клетках после деления имеются одинарные хромосомы, но после митоза они представляют собой диплоидный набор, а после мейоза -гаплоидный.
Способы размножения
эукариотических организмов
По способам размножения эукариоты можно разделить на три группы.
Первую группу составляют организмы, которые размножаются бесполым путем, т. е. делением, или почкованием, когда одна или несколько обычных клеток, отделившихся предварительно от родителя и содержащих диплоидный или гаплоидный набор хромосом, путем митотического деления образуют новый организм. Этот тип размножения присущ лишь некоторым простым одноклеточным, например амёбам.
Ко второй группе относятся организмы, которые размножаются половым путем с помощью специальных половых клеток, содержащих гаплоидный набор хромосом. При слиянии двух таких клеток происходитоплодотворениеи образуется диплоиднаязигота, которая дает начало новому организму. Этот тип размножения характерен для высших животных и растений.
Существуют также организмы, которые способны размножаться как бесполым, так и половым путем. В эту группу попадают многие примитивные организмы, низшие животные, а также многие высшие растения. Последние способны размножаться, например, черенками, прививками, клубнями.
§ 5.
Многообразие
Многообразие эукариотических клеток определяется, во-первых, многообразием эукариотических организмов, представленных миллионами видов, и, во-вторых, дифференцированием клеток на специализированные ткани у достаточно развитых организмов.
С давних пор живой мир делили на растения и животных.
Различия между растениями
и животными
Способ питания: в основном фотолитотрофный - у растений и хемоорганотрофный - у животных.
Подвижность: растения неподвижны или пассивно переносятся вместе со средой обитания, животные способны активно передвигаться (редкими исключениями являются некоторые низшие животные, например оболочники, ведущие неподвижный образ жизни во взрослом состоянии).
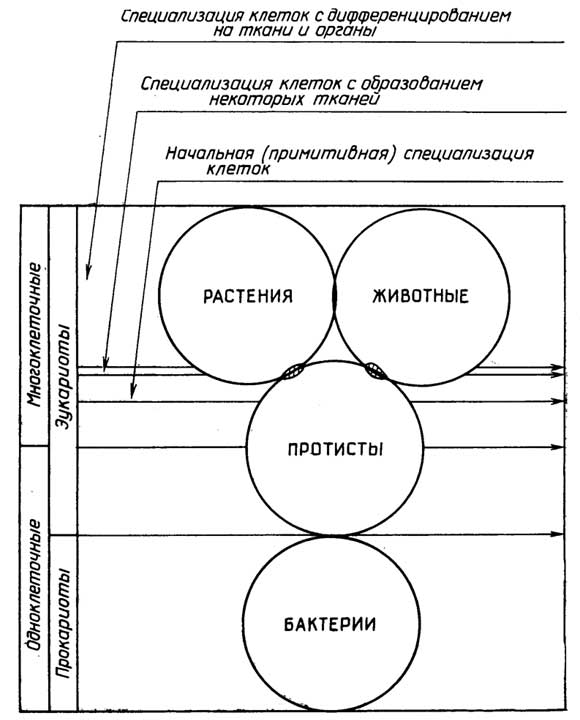
Рис. I.7.Принципы классификации живых организмов
Наличие целлюлозной клеточной стенки у растений и отсутствие ее у животных клеток (исключением являются такжеоболочники).
Форма запасания полисахаридов: крахмал - у растений и гликоген - у животных.
Способность к постоянному росту (увеличению размеров и объема). Растения растут, постоянно увеличиваясь в течение всей жизни. Животные, за некоторым исключением, растут до определенных размеров, затем происходит лишь замена старых клеток новыми.
С тех пор как мир микроорганизмов стал доступен для изучения, многие из его представителей можно было отнести и к растениям и к животным. В настоящее время эукариотические организмы принято делить на три царства (рис. I.7): Protista (npoтисты), Metaphyta (растения) и Metazoa (животные). Каждое царство делится на типы организмов и далее подтипы, классы, подклассы, порядки (отряды), семейства, роды, виды. Протисты бывают одноклеточными и многоклеточными, а растения и животные - только многоклеточными. Принципиальное отличие протистов от растений и животных выражается в отсутствии у первыхароморфозного признака- образования тканей и органов.
Ткань- объединение специализированных клеток, одинаковых по строению и выполняемым функциям.
Орган- это часть растительного или животного организма, выполняющая определенную функцию; может состоять из разных тканей. Возникновение органов - результат дальнейшей специализации клеток.
"Разделение труда между клетками" в связи с образованием ими тканей и органов позволяет клеткам функционировать более эффективно, но одновременно усиливает зависимость одного их вида от другого.
Раздел Б
ЭУКЛРИОТИЧЕСКИЕ ОРГАНИЗМЫ.
ОСОБЕННОСТИ СТРОЕНИЯ
И ЖИЗНЕДЕЯТЕЛЬНОСТИ
Глава 3
ПРОТИСТЫ
К этому царству принадлежат примитивные одноклеточные и многоклеточные организмы, которые часто имеют признаки как растений, так и животных (рис. I.8). У многоклеточных протистов все клетки одинаковы, а если и различаются, то не группируются с образованием тканей. Начальнаяспециализацияесли и существует,то на уровне отдельных клеток.
§ 1.
Одноклеточные
простейшие организмы
Одноклеточные протисты перечислены здесь в порядке убывания животных признаков и возрастания растительных.
Саркодовые- этоамёбы, которые не имеют жесткой оболочки, передвигаются с помощью выпячиваний плазматической мембраны (ложноножек) и перетекания цитоплазмы из одной части клетки в другую, а питаются путем фагоцитоза. Похоже ведут себя лейкоциты животных и человека;фораминиферы- тоже амёбы, которые имеют дырчатую наружную раковину.
Споровики, представителем которых являетсяPlasmodium-паразитирующий организм, вызывающий малярию, передвигающийся с током крови.
Инфузорииинтересны тем, что передвигаются за счет биения многочисленных ресничек на поверхности клеток. Имеют примитивный рот, глотку, анальную пору.
Жгутиковые- большая группа простейших, представители которой обладают признаками и растений и животных. Все они активно передвигаются с помощью одного, двух или более жгутиков. Среди жгутиковых выделяютгемо- идинофлагелляты, а такжеэвгленовыеихламидомонады.
Гемофлагелляты- микроорганизмы, у которых легко обнаружить признаки животных. Например, одножгутиковыетрипаносомыпредпочитают в качестве среды обитания нервную ткань. Они являются возбудителем сонной болезни. В кишечнике термитов обитаюттрихонимфы, являющиеся носителями бактерий, способных превращать целлюлозу в глюкозу. Бактерии-паразиты обеспечивают питанием не только себя, но и трихонимф, позволяя термитам питаться древесиной.
Динофлагеллятывходят в состав морского планктона. Они обладают жестким панцирем и двумя жгутиками, но, подобно растениям, содержатхлорофилл. Другой пигмент -фукоксантин- придает им красный цвет. Наличие хлорофилла и фукоксантина дает этим организмам возможность вестифотолитотрофныйобраз жизни. Однако среди динофлагеллят встречаются и формы без пигментов схемоорганотрофнымпитанием.
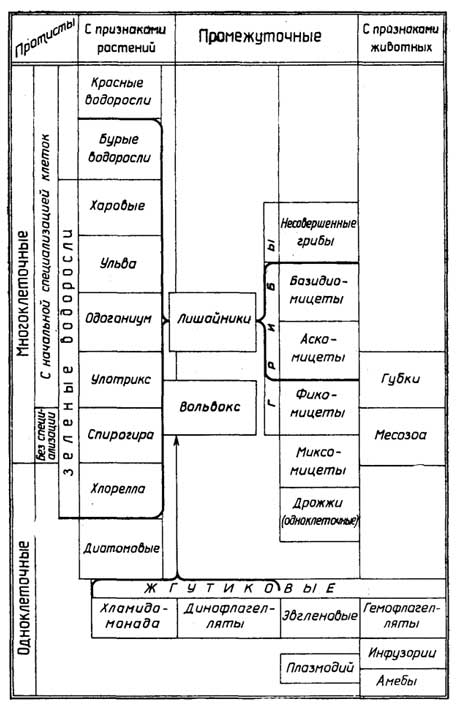
Рис. I.8.Классификация протистов
Эвгленовые, обладаяхлоропластами, способны к фотосинтезу, который, однако, не обеспечивает клетки всем необходимым, и поэтому культивирование эвгленовых возможно лишь при наличии в питательной среде аминокислот. В темноте они ведут образ жизни животного, заглатывая пищевые частички -детрит.
С помощью жгутика эвгленовые передвигаются в хорошо освещенные места, которые они способны обнаруживать благодаря наличию особого органа -глазного пятна(стигмы), содержащего светочувствительный пигмент астаксантин. Фотосинтез не является для них необходимым: если их искусственно лишить хлоропластов, то они продолжают существовать как животные. Целлюлозной стенки эвгленовые не имеют. Запасные вещества у них откладываются в виде полисахаридапарамила, отличного как от крахмала, так и ют гликогена.
Хламидомонадыво многом похожи на эвгленовые. Они также имеют животные признаки: светочувствительное глазное пятно и два жгутика, обеспечивающие передвижение. Из растительных признаков им свойственны: единственный хлоропласт, обеспечивающий фотосинтез необходимых веществ, крепкая целлюлозная клеточная стенка, запасание веществ в виде крахмала.
Диатомеибольше похожи на растения, чем на животных. Называемые часто диатомовыми водорослями, они вместе с динофлагеллятами, являясь основной составной частью морского планктона, синтезируют около 75% всех органических веществ в мире. Клетка диатомеи покрыта жесткой клеточной стенкой из оксида кремния (IV). Запасные вещества диатомеи откладывают не в виде гликогена или крахмала, а в виде капелек масла. Ископаемые отложения остатков клеточных стенок известны как инфузорная (диатомовая) земля, а отложения капелек масел древних диатомеи, возможно, трансформировались в залежи нефти.
Зеленые водоросли(Chlorophyta), к которым относится известнаяхлорелла, уже имеют все признаки растений: хлоропласты, жесткую целлюлозную стенку, накопление крахмала. Признаки животных клеток отсутствуют. "Цветение" воды в прудах обусловлено в основном скоплением зеленых водорослей.
Дрожжи- это грибы. Они обладают практически всеми признаками растений, кроме наличия хлорофилла. Существуют как одноклеточные сапрофиты на средах с достаточно высоким содержанием Сахаров.
§ 2.
Многоклеточные протисты
Среди многоклеточных протистов есть организмы без специализации клеток или с начальной специализацией на уровне отдельных клеток.
Примером организмов с некоторымипризнаками животных, у которых практическиотсутствует специализация клеток, могут служить паразитирующие в моллюсках мельчайшие червячки типа Mesozoa, состоящие всего из 25 клеток.
Губки(Porifera) - организмы с некоторымипризнаками животных и начальной специализациейклеток. Одиночные губки состоят из миллионов клеток, имеют размер 2-3 см, но часто образуют колонии, достигающие размеров метра и более. Губка представляет собой полый мешочек, прикрепленный нижней частью к чему-либо на дне водоема. Она непрерывно процеживает воду, извлекая из нее питательные вещества и кислород. Тело губки состоит из разных клеток:эпидермальные клетки(пинакоциты) обеспечивают защиту извне,пороцитызадерживают питательные вещества,хоаноцитыс помощью своих жгутиков создают ток воды,мезенхимные клеткиобеспечивают опорную функцию, образуя скелет губки из СаСО3, SiO2или белка спонгина. В отличие от перечисленных выше неподвижных клетокамёбоцитыпередвигаются как амёбы в желеобразном веществе, соединяющем все остальные клетки в единый организм. Амёбоциты отбирают часть пищи у пороцитов, выделяют желеобразное вещество и материал скелета. Губка размножается почкованием.
Организмы преимущественно срастительными признаками и отсутствием специализацииклеток - это некоторые видызеленых водорослей, например нитчатаяспирогира, все клетки которой одинаковы.
Организмы преимущественно срастительными признаками и начальной специализациейклеток - это многие виды зеленых водорослей, например нитчатые -Ulotrix, Oedogoniumили плоские - какморской салат(Ulva). У них есть специализированные половые клетки. У наиболее развитых водорослей -зеленых харовых, бурыхикрасных- наблюдается некоторая специализация клеток по выполняемым функциям: одни клетки образуютпластинки, другие -черешки, третьи -ризоиды, т. е.псевдоорганы: соответственно листья, стебли, корни.
Особое местосреди многоклеточных низших организмовс начальной специализациейклеток занимаютгрибыилишайники.
Грибыпо многим признакам напоминают водоросли, но у них "отсутствует полностью хлорофилл. Кроме уже упомянутых дрожжей, а также некоторых паразитов грибы - это многоклеточные организмы. Они развиваются во влажных, плохо освещенных местах: сапрофиты - в почве на органических остатках, паразиты -на растениях и животных. Многоклеточные грибы растут в виде разветвленных и переплетающихся трубочек (гиф), скопление которых называетсямицелием. Гифы состоят из трубчатых многоядерных клеток. По способу размножения грибы принято делить на четыре класса: фикомицеты, аскомицеты, базидиомицеты и несовершенные грибы.
Фикомицеты(Phycomycetes) - это простые плесени, например хлебная.
Аскомицеты(Ascomycetes) растут, например, на сыре, варенье. К ним относится грибок, вырабатывающий пенициллин, а также съедобные грибы, у которых "плодовое тело" образуется под поверхностью земли: трюфеля, сморчки, строчки.
Базидиомицеты(Basidiomycetes) - это съедобные и несъедобные грибы с "плодовым телом" на поверхности земли.
Несовершенныегрибы (Fungi imperfecti) представлены в основном различными паразитами растений и животных.
Лишайникипредставляют собойсимбиозводоросли и гриба, причем водоросль может быть и прокариотом (синезеленая). Каждый из симбионтов может быть выращен отдельно, но вместе они приобретают способность жить в более неблагоприятных условиях.
§ 3.
Протисты одноклеточно-многоклеточные,
с признаками растений и животных
Организмы, у которыхотсутствует клеточная специализация, - это, например,миксомицеты(слизевики). В определенный период жизни они представляют собой слизь, состоящую из множества амебоидных клеток. Клетки сливаются и разрастаются, образуя большие многоядерные клетки, т. е. превращаются всимпласты. На этой стадии миксомицеты подвижны и больше походят на животных. В определенный момент все амебоидные клетки, большие и малые, собираются вместе в плотное "плодовое тело", как у грибов, в котором образуются споры, дающие в благоприятных условиях начало новым амебоидным клеткам. В этот период миксомицеты больше похожи на растения без хлорофилла. Миксомицеты паразитируют на сырых растениях или ведут сапрофитный образ жизни на их остатках. Клетки миксомицетов отличаются лишь размером.
Начальную специализациюклеток можно видеть у колониального микроорганизмавольвокса(Volvox), который относят и к жгутиковым и к водорослям. Он же является типичным примеромсинцития. Этот водный фотосинтезирующий микроорганизм имеет вид небольших зеленых шариков, состоящих из десятков тысяч клеток. Клетки соединены друг с другом тонкими нитями. У каждой клетки имеются два жгутика, направленные наружу. За счет их направленного движения шарик-колония может двигаться. Клетки, расположенные спереди, обладают более развитой светочувствительной стигмой; клетки, расположенные сзади, обеспечивают размножение колонии.
§ 4.
Особенности размножения протистов
Одноклеточные протисты
Для большинстваодноклеточных протистовхарактернасмешанная форма размножения, т. е. как простым делением, так и половым путем. Например, у зеленой водорослиChlatnydomonas(рис. I.9) гаплоидная клетка может митотически разделяться на гаплоидныезооспоры(от 2 до 8) или на более мелкие гаплоидныегаметы(от 8 до 32). Две гаметы,
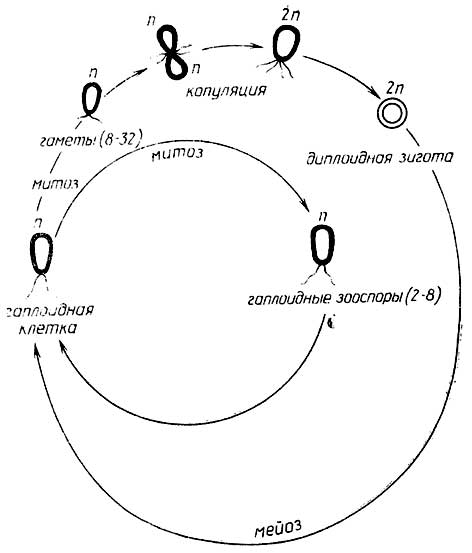
Рис. I.9.Цикл размноженияChlamydomonas
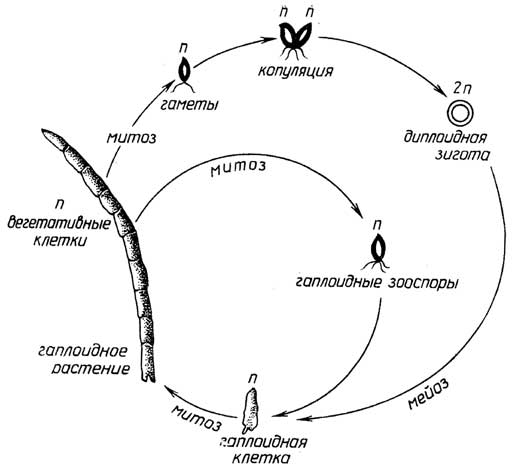
Рис. I.10.Цикл размноженияUlotrix
сливаясь, образуют диплоиднуюзиготу, которая затем делится путем мейоза на четыре новые гаплоидные клетки. Гаметы, образующие зиготу, внешне идентичны. Такая форма полового размножения называетсяизогамией.
Некоторые из этих организмов размножаютсябесполым путем- простым делением, например амёбы, зеленые водорослиProtococcus.
Многоклеточные протисты
Меньшая часть таких организмов, имеющих признаки животных, размножаетсябесполым путем- почкованием (губки). Для большинства многоклеточных протистов с признаками растений характернасмешанная форма размножения: с помощью и зооспор и гамет, причем возможны как изогамия (например, у зеленой нитчатой водорослиUlotrix, рис. I.10), так игетерогамия, когда сливающиеся гаметы разные: относительно большая яйцеклетка и маленький сперматозоид (например, у зеленой водорослиOedogonium, рис. I.11). При этом виде размножения сам организм существует в гаплоидной форме, а диплоидной является только зигота.
Другой вид смешанного размножения характеризуется сменой гаплоидного и диплоидного поколений, например, у зеленой водорослиUlva(морской салат). У бурых и красных водорослей (рис. I.12) гаплоидная форма организма -гаметофит- продуцирует гаметы, слиянием которых образуется диплоидная зигота, а далее, в отличие от первого вида смешанного размножения, зигота митотическим делением разрастается в диплоидный организм -спорофит, который затем размножается бесполым путем - гаплоидными спорами. Из каждой споры путем митоза вырастает гаметофит. У одних многоклеточных протистов спорофит и га'метофит внешне ничем не отличаются, у других они различаются формой, размерами, а также продолжительностью жизни.
Одноклеточно-многоклеточные протисты
У одних организмов этой группы, например у мищомицетов, форма размножениясмешанная- через гаметы и споры; у других, как у некоторых видов вольвокса, имеет местополовоеразмножение, причем гетерогамные гаметы продуцируются не обычными вегетативными клетками, как у упомянутого вышеOedogonium, а специализированными половыми органамиантеридиями, продуцирующими сперматозоиды, иоогониями, продуцирующими яйцеклетки.
Протисты с преимущественнорастительнымипризнаками обладаютболее развитойформой размножения, чем организмы с преимущественно животными признаками.
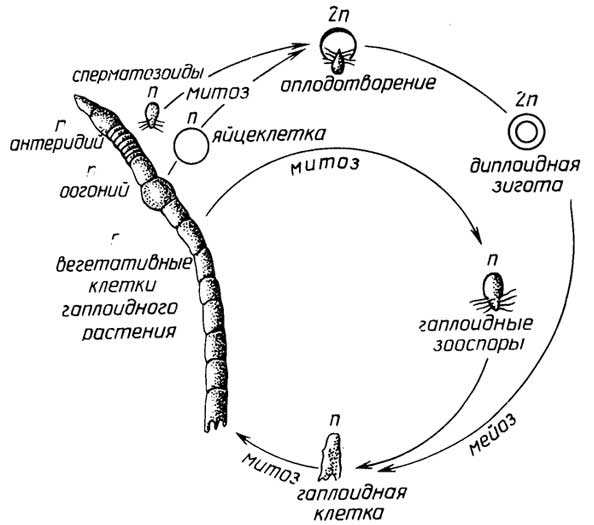
Рис. I.11.Цикл размноженияOedogonium
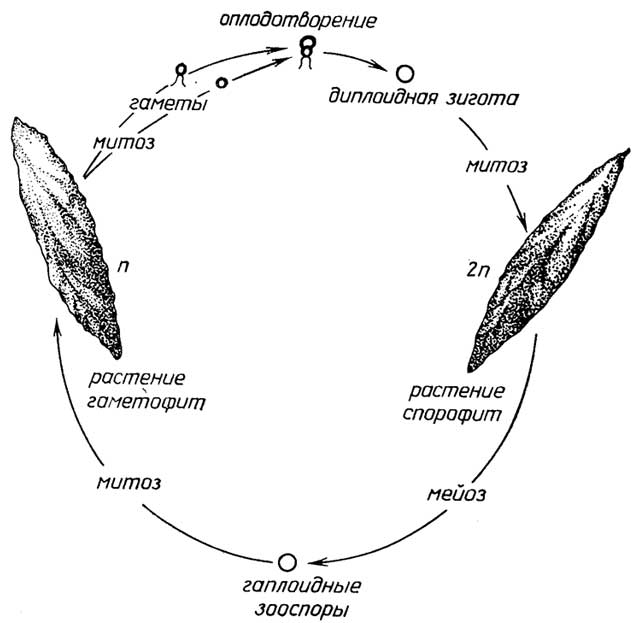
Рис. I.12.Цикл размноженияUlva
Глава 4
РАСТЕНИЯ
Это многоклеточные организмы, которые характеризуются фотолитотрофным способом питания, неподвижностью, наличием целлюлозной клеточной оболочки, запасанием полисахаридов в виде крахмала, способностью к постоянному росту в течение всей жизни.
§ 1.
Ткани наиболее развитых растений
Дифференцирование клеток у растений приводит к образованию нескольких типов тканей (рис.I.13).
Меристематическаяткань обеспечивает длительный рост растения. В кончиках корней и стеблей находятся клетки верхушечной меристемы, благодаря которой осуществляется апикальный
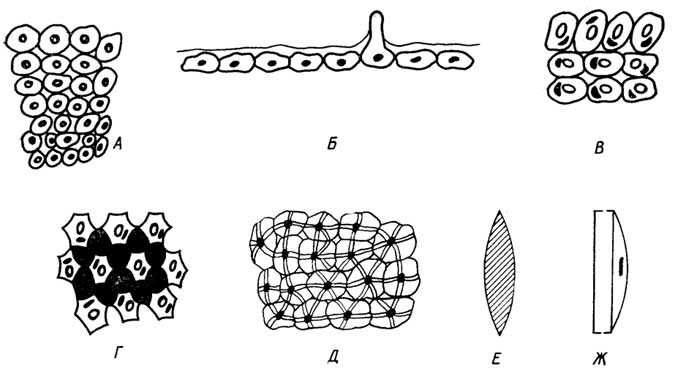
Рис. I.13.Ткани растений: меристема (А), покровная (Б), паренхима (В), колленхима (Г), склеренхима (Д), трахеидная клетка ксилемы (Е), ситовидная клетка (трубка) флоэмы (Ж)
(верхушечный) рост этих органов. Рост вширь ствола, стебля или корня (вторичный рост) обеспечивает боковая меристема (слойкамбия). Клетки меристемы небольшие по размеру, имеют довольно крупные ядра и тонкие стенки, вакуоли в них отсутствуют.
Покровнаяткань предохраняет находящиеся под ней другие ткани от повреждений и высыхания. Она представлена эпидермисом листьев и пробковым слоем стволов, стеблей и корней. Для клеток покровной ткани характерны толстые стенки; они вырабатывают гидрофобные вещества, которые либо выделяются наружу, покрывая листья (воск), либо входят в состав клеточных стенок (суберин пробки).
Основная тканьсоставляет большую часть растения. Ее назначение - синтез и запасание питательных веществ. Основная ткань включаетпаренхиму.
Паренхима- это мягкие ткани листьев, коры, стеблей, корней, цветков, плодов. Каждая клетка паренхимы содержит крупную вакуоль, в которой могут накапливаться запасные белки, жиры, таннины и другие вещества. Вакуоль нередко занимает основной объем клетки. Разновидность паренхимы -хлоренхима(зеленая паренхима), в клетках которой содержатся хлоропласты с хлорофиллом и протекает фотосинтез.
Некоторые клетки растения входят в состав специальных желёзок, которые продуцируют смолу, латекс, слизи, камеди и другие вещества. Иногда эти клетки относят к специальнойвыделительнойткани.
Клеткимеханической тканивыполняют опорную функцию. Различают колленхиму и склеренхиму.Колленхима- это упругая ткань черешков листьев, цветков, плодов, стеблей. Основное отличие ее клеток от клеток паренхимы - наличие угловых утолщений клеточных стенок, что и обеспечивает упругость и эластичность органов растения, в основном стеблей.Склеренхима- это жесткая ткань растения, обеспечивающая его стеблю и корням механическую прочность. Почти все пространство склеренхимных клеток занимает утолщенная жесткая клеточная стенка. Склеренхимные клетки мертвы. Они часто образуют длинные волокна, пронизывающие тело растения. Из подобных клеток (каменистых) состоит скорлупа орехов и плодовых косточек.
Проводящая тканьобеспечивает доставку воды и растворенных в ней солей от корней ко всем другим клеткам, а синтезированных питательных веществ - к местам их запасания. Она выполняет также опорную функцию. Проводящая ткань бывает двух видов:ксилема(древесина) ифлоэма(луб).
Ксилемаобразуется в глубине стебля из длинных тонких клеток -трахеид, которые, соединяясь концами, превращаются в достигающие нескольких метров в длину тонкие трубки - сосуды. После отмирания трахеид и отвердения клеточных стенок (в результате отложения в них лигнина) в растении образуются пучки трубок, по которым вода и растворенные в ней соли поступают по стеблю от корней в листья.
Флоэматакже представляет собой находящиеся под поверхностью стебля пучки трубок, образующиеся, как и в ксилеме, из состыкованных концами клеток, которые, в отличие от клеток ксилемы, не отмирают, а перегородки между ними не исчезают и имеют множество отверстий. По такимситовидным трубкамфлоэмы образующиеся в листьях питательные вещества поступают в стебель, корни, а весной, наоборот, из корней, стебля - в прорастающие почки.
§ 2.
Органы растений
Лист. Основная функция листьев - фотосинтез. Листья некоторых растений выполняют также функцию запасания воды (кактусы) или питательных веществ (капуста). Поверхность листа -это защитная ткань - эпидермис, - под которой расположена основная и проводящая ткани.
Корень. Корни растений обеспечивают всасывание из почвы воды с растворенными в ней солями. Они выполняют также опорную функцию, удерживая растение в почве. У некоторых растений в корнях, образующих корнеплоды (морковь, свекла), происходит запасание питательных веществ. В корне присутствуют все виды тканей.
Стебель- осевая часть побега растений. Главная функция стебля - вынос и наилучшее по отношению к свету расположение листьев. Он обеспечивает также связь между корнями и листьями, а у некоторых растений служит местом запасания питательных веществ (клубни картофеля). В структуре стебля имеются все ткани, особенно хорошо развиты проводящие.
Цветки, шишки, спорангии, антеридиииархегонии- это органы размножения растений.
Цветкиишишкивстречаются у высших растений (например, у яблони, сосны), которые размножаются семенами и самостоятельно существуют только как диплоидные спорофиты.
У низших растений, которые могут существовать как в виде гаплоидного гаметофита, так и в виде диплоидного спорофита, самостоятельного (папоротники) или паразитирующего на гаметофите (мхи), встречаются: у гаметофитов -антеридии, дающие сперматозоиды, иархегонии, дающие яйцеклетки; у спорофитов -спорангии, дающие бесполые гаплоидные споры, из которых вырастают гаметофиты.
§ 3.
Особенности размножения растений
Растения, как и протисты, могут размножаться как половым, так и бесполым путем.
Половое размножениеприсуще всем растениям. Оно связано с образованием в результате оплодотворения диплоидной зиготы - первой клетки нового организма (рис. I.14-I.17). Высшие растения, т. е. голосеменные и цветковые, представляют собой диплоидный спорофит. В их органах размножения - мужских шишках (у голосеменных, рис. I.16) или цветках (цветковые, рис. I.17) - образуется пыльца, которая с помощью насекомых или ветра попадает на другие - женские шишки или цветки, прорастает, достигает яйцеклетки, находящейся в теле самого спорофита. После оплодотворения постепенно происходит образованиесемени, в котором из диплоидной зиготы развивается
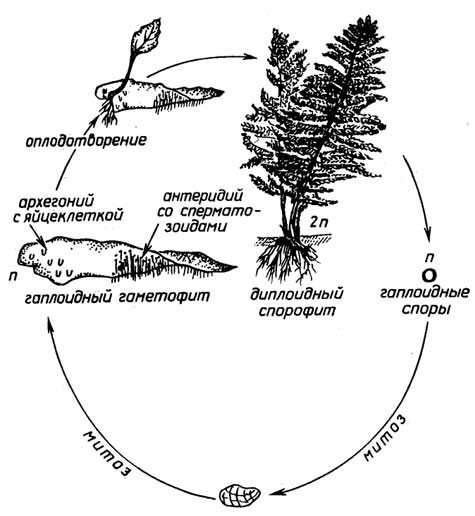
Рис. I.15.Цикл размножения папоротников
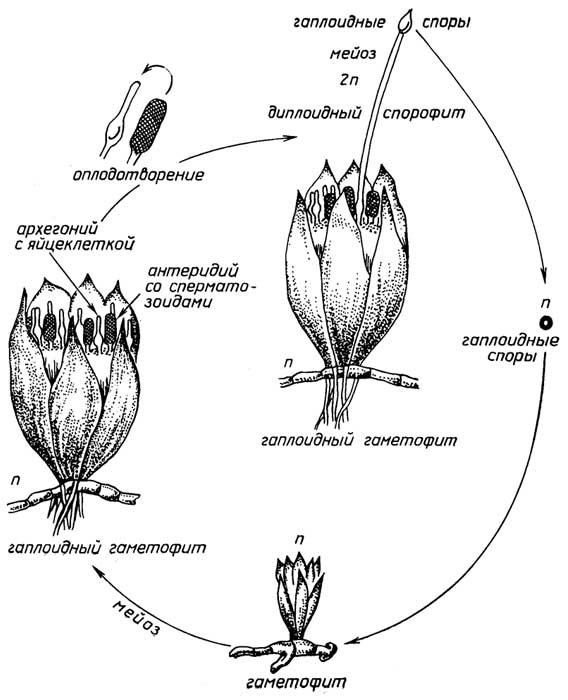
Рис. I.14.Цикл размножения мхов
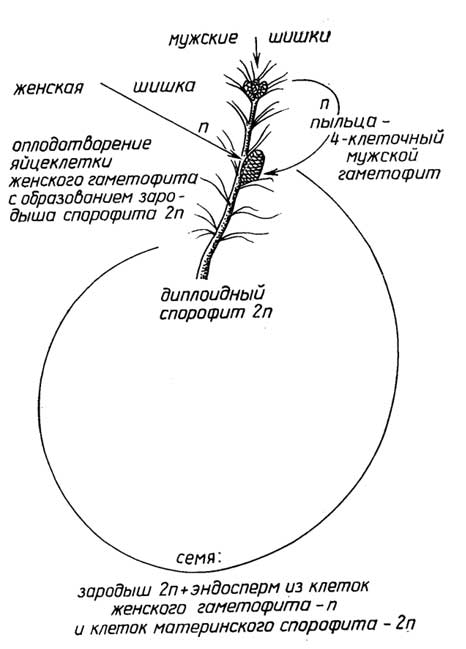
Рис. I.16.Цикл размножения голосеменных растений
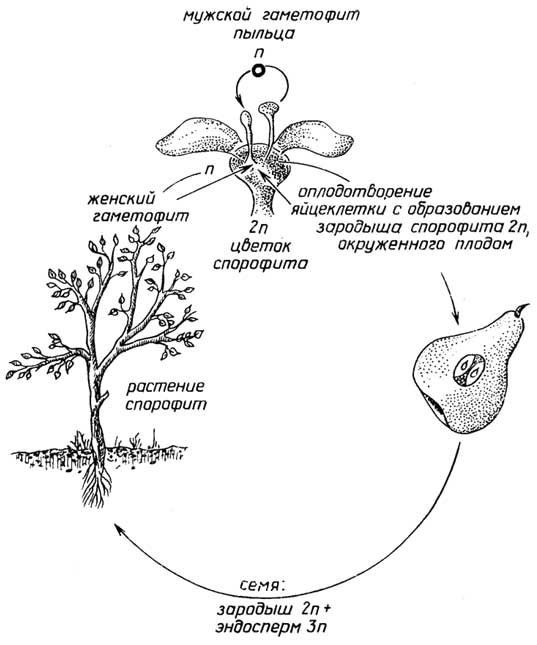
Рис. I.17.Цикл размножения цветковых растений
зародыш. Семя, попадая в благоприятные условия, вырастает в новый спорофит.
Бесполое размножениеу растений существует наряду с половым в двух разновидностях: спорообразование и вегетативное размножение.
Спорообразованиеимеет место у низших растений, таких, как мхи (рис. I.14), хвощи, папоротники (рис. I.15). Диплоидный спорофит таких растений, в отличие от голосеменных и цветковых, образует бесполые гаплоидные споры, из которых в благоприятных условиях вырастают гаплоидные растения - гаметофиты. Далее размножение протекает половым путем. Гаметофит продуцирует гаметы - сперматозоиды и яйцеклетки. Для оплодотворения необходима водная среда, так как подвижный сперматозоид должен подплывать к яйцеклетке, находящейся в теле гаметофита. Из образовавшейся зиготы вырастает новый спорофит.
Вегетативное размножениевстречается как у низших растений, так и у высших. У некоторых мхов и их разновидностей, например печёночников, гаметофит способен размножатьсяпочкованием, когда часть его тела в виде"выводковой корзиночки"отделяется и образует самостоятельное растение. Вегетативное размножение с помощьюгоризонтального стебля, располагающегося на поверхности или под поверхностью земли и образующего все новые растения, встречается как у низших, так и у высших растений. У мхов такой горизонтальный "стебель" называетсяпротонемой. У высших растений наземная форма горизонтального ползучего стебля представляет собой усы (как у земляники), а подземная называетсякорневищем(клубни картофеля - это утолщенное корневище). Вегетативное размножениечеренкамиипрививкамииспользуют при выращивании многих культурных растений.
§ 4.
Основные принципы
классификации растений
В связи с тем что эволюция растений происходила не по прямой, а на схеме имеет вид разветвленного дерева, трудно расположить все растения по возрастанию сложности строения на одной линии. Основным правилом, позволяющимобъединитьрастения в группы, являетсяобщностьихстроения, развития, размножения. Признаком, который позволяетвыделить две группырастений, одну из которых составляют наименее развитые, принято считатьналичие проводящих сосудистых тканей(рис. I.18). У мхов, печёночников и роголистников, относящихся к типу Bryophyta (мохообразные), проводящие ткани отсутствуют. Эти небольшие простые растения удерживаются в почве тонкими корнеподобными волосками (ризоидами). Стебли у них или отсутствуют, или развиты слабо. Эти

Рис. I.18.Принципы классификации растений
растения имеют много общего с многоклеточными водорослями.
Две выделенные группы растений отличаются также тем, что каждая из нихпреимущественно существует в гаплоидной или диплоидной форме. Двойной набор хромосом способствует выживанию вида, поэтому лучшее развитие получили растения, предпочитающие диплоидную форму существования. У менее развитых мохообразных растений лучше развит гаметофит (гаплоидная форма существования), на котором обычно паразитирует спорофит, а у более развитых сосудистых растений, напротив, лучше развит спорофит.
Сосудистые растения можно разделить в свою очередь на две труппы, использовав в качестве критерия важныйэволюционный признак, связанный с ароморфозом, - наличие или отсутствие самостоятельной существующей формы гаметофита. С этим различием связан переход отсмешанной формы размножения(полового - с помощью сперматозоида и яйцеклетки и бесполого - спорами)к чисто половому пути- с помощью пыльцы и яйцеклетки, находящейся в самом растении - спорофите. Как только такой переход состоялся, отпала необходимость в водной среде для оплодотворения, а значит, растения перестали зависеть от обилия влаги и окончательно "вышли на сушу". Поэтому объединение папоротников в одну группу с семенными растениями на основании только сходства строения и развитости тканей и органов не вполне правомерно из-за принципиальной несхожести путей размножения этих двух групп растений.
Глава 5
ЖИВОТНЫЕ. ЧЕЛОВЕК
Это многоклеточные организмы с хемоорганотрофным способом питания, подвижностью (большинство видов), отсутствием целлюлозной клеточной стенки, запасанием полисахаридов в виде гликогена и неспособность к постоянному росту (увеличению размеров) до конца жизни.
§ 1.
Ткани высших животных
Дифференцирование клеток у животных приводит к образованию тканей, которые поструктурно-функциональному признаку, а также попроисхождению(см. с. 77) можно разделить на несколько типов.
Эпителиальная тканьобразована клетками наружного слоя (эпидермиса) кожи, а также клетками, выстилающими изнутри пищеварительный тракт, дыхательные и мочеполовые пути, железы внешней и внутренней секреции.
Функции эпителиальной ткани: 1) защита от проникновения инфекции, от механических и химических повреждений прилегающих тканей; 2) всасывание воды и питательных веществ; 3) секреция различных веществ железами.
Клетки эпителиальной ткани плотно прилегают друг к другу. В зависимости от их формы и выполняемых функций их подразделяют на несколько видов, которые можно свести к двум основным: плоскому и цилиндрическому эпителию (рис. I. 19 А, Б). Эпителиальная ткань эволюционно старше всех остальных тканей.
Особый вид эпителиальной ткани представляет собойрепродуктивная ткань. Она состоит из двух разновидностей клеток. К первой относятся половые клетки -сперматозоид(рис. I. 19 В)
ияйцеклетка(рис. I.19 Г), ко второй -соматические клеткисеменников и яичников. Половые клетки имеют гаплоидный набор хромосом, соматические - диплоидный. Процесс образования сперматозоидов из сперматогониев, т. е. клеток семенников, называетсясперматогенез. Превращениеовогониев, т. е. клеток яичников, в яйцеклетки носит названиеовогенез. Превращение сперматогониев и овогониев в половые клетки (рис. I.20).
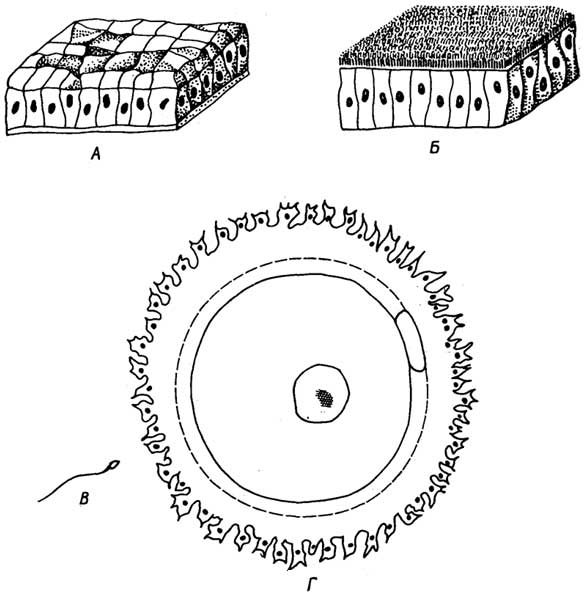
Рис. I.19.Основные виды эпителиальной ткани - плоская (А) и цилиндрическая (Б), а также клетки особого вида эпителиальной ткани - репродуктивной: сперматозоид (B) и яйцеклетка (Г)
происходит путем мейоза через последовательное образованиесперматоцитовилиовоцитовсначала первого порядка, далее - второго порядка и затем -сперматидилиовотид.
Существенное различие между сперматогенезом и овогенезомзаключается в том, что сперматоциты первого и второго порядков при делении образуютодинаковыеклетки, а овоциты первого и второго порядков при делении образуютразныеклетки.Овоцит первого порядкаделится на двенеравныечасти: более крупный овоцит второго порядка и маленький первыйполоцит(полярное тельце). При таком делении весь запас питательных веществ, находящийся в цитоплазме, переходит в овоцит второго порядка, а первый полоцит состоит практически только из ядра.Овоцит второго порядкатакже делится на двенеравныечасти: более крупную овотиду и маленький второй полоцит, также почти лишенный
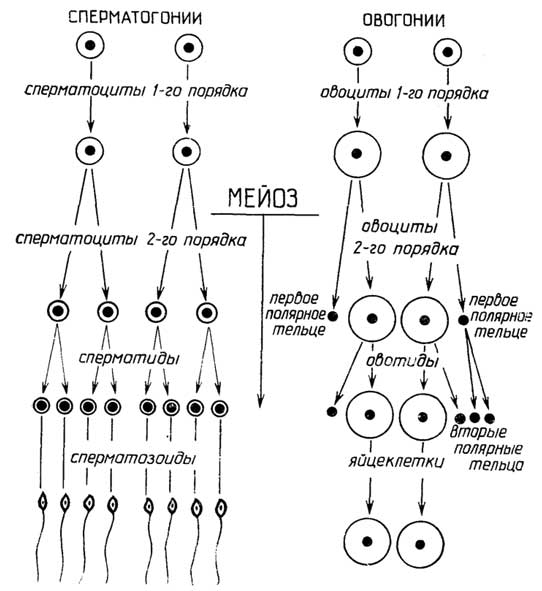
Рис. I.20.Сперматогенез и овогенез
цитоплазмы; первый полоцит в это время может разделиться на два одинаковых вторых полоцита. Все полоциты вскоре дегенерируют и исчезают.
Соединительная ткань- это система клеток, образующих внутренний основной слой кожи, сухожилия, связки, хрящи, кости, костный мозг, жировой слой под кожей и жировую подложку органов, а также жидкие ткани, такие, как кровь и лимфа.
Функции соединительной ткани: 1) связующая - скрепляет в одно целое другие ткани, а также обеспечивает обмен веществ между ними; 2) опорная - образует скелет, обеспечивает определенное взаиморасположение внутренних органов, сохраняет форму тела; 3) защитная - предохраняет расположенные под ним ткани и органы от переохлаждения и механического повреждения; клетки соединительной ткани закрывают рану, образовавшуюся в результате механического повреждения, препятствуют попаданию в организм инфекции, чужеродных тел и токсинов, а также удаляют их из организма; 4) трофическая - запасает питательные вещества (жиры).
Особенность соединительной тканив том, что ее клетки обычно располагаются на некотором расстоянии друг от друга, находясь восновном веществе(рис. I.21), однако это не мешает им образовывать в ряде случаевсинцитии. Основное вещество, выделяемое клетками, обеспечивает соединительной ткани выполнение многих ее функций.
В зависимости от строения и состава основного вещества и выполняемых функций различаютнесколько видов соединительной ткани: волокнистую, хрящевую и костную, ретикулярную, жировую, а также кровь и лимфу.
Волокнистая ткань встречается по всему организму, соединяя различные ткани и органы. К ней относится, например, внутренний слой кожи (именно он остается после процесса дубления и выделки), она образует сухожилия и связки. Основное вещество волокнистой ткани представляет собой густую сеть идущих в разных направлениях белковых волокон. В зависимости от плотности основного вещества и количества клеток в единице объема она подразделяется нарыхлуюиплотную(фиброзную).
Существует несколько типов клеток соединительной ткани: фибробласты, гистиоциты, тучные и эндотелиальные клетки.
Фибробласты- основные клетки соединительной ткани; они образуют волокна и межклеточное основное вещество, играют главную роль в рубцевании ран.
Гистиоциты- подвижные клетки, обладающие способностью к поглощению и разрушению чужеродных клеток и частиц, например бактерий, вирусов.
Тучные клетки(мастоциты) - особая категория клеток соединительной ткани, присутствующих во многих органах: печени, селезенке, легких, стенках кровеносных сосудов, в мозгу и др. Особенность их в том, что они секретируют в кровь и тканевую жидкость физиологически активные вещества, влияющие, например, на свертываемость и давление крови, воспалительные, аллергические, иммунные реакции.
Эндотелиальные клетки- из одного слоя этих клеток образованы стенки кровеносных и лимфатических капилляров; из них состоит также внутренняя выстилка более крупных кровеносных сосудов и сердца.
Хрящеваяикостнаяткани. Скелет очень молодых позвоночных животных состоит из эластичной хрящевой ткани, которая с возрастом заменяется на более жесткую костную, но у
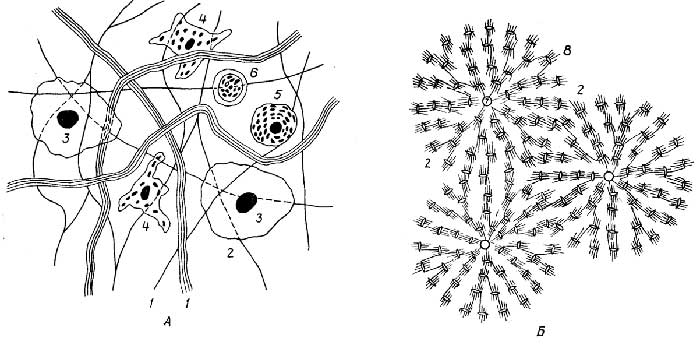
Рис. I.21.Соединительная ткань:
волокнистая (A) и костная (Б).
1- белковые волокна;2- основное вещество;3- фибробласт;4- гистиоцит;5- тучная клетка;6- лимфоцит;7- гаверсов канал;8- остебласт (костная клетка)
некоторых низших позвоночных, например у акулы, скелет остается хрящевым; у человека хрящевая ткань осталась в кончике носа, ушной раковине, из нее построены трахея, бронхи, гортань и др. Костная ткань отличается от хрящевой большей жесткостью (из-за отложения в основном веществе нерастворимых солей кальция) и более плотной структурой.
Ретикулярная, илисетчатая, тканьявляется основой красного костного мозга, а также селезенки, лимфатических узлов и некоторых образований, например миндалин.Полипотентные стволовыеклетки красного костного мозга играют главную роль в кроветворении, они дают началолимфоиднымимиелоиднымстволовым клеткам. Первые являются предшественникамилимфоцитов, вторые -эритроцитов, мегакариоцитов, макрофаговигранулоцитов(см. разд. "Кровь").
Жироваяткань выполняет роль как защитной прокладки (подкожный жировой слой, ложе для внутренних органов), так и хранилища высококалорийного "топлива". Ее клетки (адипоциты) почти целиком заполнены жиром. Они являются основой жёлтого костного мозга, который с возрастом замещает красный в костных полостях.
Кровьилимфа- это особый вид соединительной ткани. Они выполняют в основном связующую (транспортную) и защитную функции. Кровь и лимфа циркулируют в организме и вместе с тканевой жидкостью играют важную роль вгомеостазе, т. е. в поддержании постоянства внутренней среды организма, а именно: состава и концентраций веществ, температуры, рН (кислотно-щелочного равновесия), ионной силы (водно-солевого равновесия). Кровь переносит кислород (от органов дыхания ко всем тканям), углекислый газ (от тканей к органам дыхания), питательные вещества (из органов пищеварения к нуждающимся в них тканям) и продукты жизнедеятельности тканей (к органам выделения).
Защитная функция крови и лимфысостоит в их способности идентифицировать и нейтрализовать проникшие в организм чужеродные клетки, вирусы, вредные вещества, а также трансформированные собственные клетки.
Кровь состоит из форменных клеточных элементов (рис. I.22) - эритроцитов, лейкоцитов, тромбоцитов и межклеточного вещества, называемогоплазмой.
Эритроциты- это красные кровяные тельца. У млекопитающих в процессе созревания эритроциты теряют ядро. Эритроциты теплокровных животных содержат красный железосодержащий пигмент гемоглобин, который являетсяпереносчиком кислорода и углекислого газа. Они продуцируются клетками костного мозга и циркулируют в крови около 125 дней, затем разрушаются лейкоцитами в селезенке и печени. В 1 мм3крови здорового человека содержится 4-5 млн эритроцитов.
Лейкоциты- клетки, большие по размеру, чем эритроциты; они имеют ядро и способны кпролиферации, т. е. размножению путем митоза. Благодаря способности значительно менять свою форму и двигаться подобно амёбе лейкоциты могут плыть против тока крови, проскальзывать между клетками кровеносных капилляров и тканей.Главная функция лейкоцитов - фагоцитоз, т. е. уничтожение инфицированных, больных, старых, переродившихся (опухолевых) клеток, вирусов, инородных макромолекулярных веществ, а такжевыработказащитных, белков -антител.

Рис. I.22.Форменные элементы крови:
1- эритроциты;2- лимфоциты;3- моноциты;4- нейтрофилы;5- эозинофилы;6- базофилы;7- тромбоциты
По форме, строению и особенностям функционирования лейкоциты принято делить налимфоциты, моноциты(вид макрофагов) игранулоциты(илиполиморфно-ядерные лейкоциты).
Лимфоциты в свою очередь подразделяют на несколько типов:В, Т, NK, L, Ки нулевые. Среди гранулоцитов встречаютсянейтрофилы, эозинофилыибазофилы. Все лейкоциты происходят из клеток красного костного мозга. Большинство лейкоцитов живет недолго - от нескольких часов до нескольких дней, но некоторые виды (клетки иммунной памяти) живут в организме до десяти лет.
В 1 мм3крови здорового человека содержится 5-8 тыс. лейкоцитов. Количественное соотношение разных форм лейкоцитов (лейкоцитарная формула) также довольно постоянно, и лишь при заболеваниях и различных физиологических состояниях оно меняется определенным образом.
Тромбоциты(кровяные пластинки) - это небольшие (в несколько раз меньше, чем эритроциты), безъядерные клетки, происходящие из цитоплазмы огромных мегакариоцитов красного костного мозга. Функция тромбоцитов - восстановление целостности поврежденного кровеносного сосуда и инициирование гемостаза (свертывания крови) в месте повреждения. Сначала они "заклеивают" своими телами повреждение, затем на этом месте образуетсятромбиз свернувшейся крови. Тромбоциты живут несколько дней и разрушаются в селезенке и печени. В 1 мм3крови у здорового человека 200-400 тыс. тромбоцитов.
Плазмакрови - это прозрачная желтоватая жидкость (содержит 90% воды), остающаяся после отделения клеток крови. Белки плазмы выполняют в основном защитную и транспортную функцию. В плазме растворены также органические и минеральные вещества. Именно плазма играет главную роль в гомеостазе и гемостазе.
Сывороткакрови - это светло-желтая жидкость, отличается от плазмы тем, что из нее удален белокфибрин. Функция фибрина крови - образование кровяного сгустка (тромба), лежащее в основе процесса свертывания крови. Сыворотка образуется самопроизвольно, когда сгусток свернувшейся крови через некоторое время сжимается и выдавливает из себя сыворотку.
Лимфа- бесцветная жидкость лимфатических капилляров и сосудов. Она лишена эритроцитов, но содержит лейкоциты. Состав ее жидкой части сходен с составом плазмы. Так же как кровь, при вытекании из сосудов лимфа свертывается, но более медленно.
Функции лимфы: 1) способствует обмену веществами между тканями и кровью; 2) с помощью лейкоцитов уничтожает бактерии, вирусы, опухолевые клетки и чужеродные макромолекулярные вещества (фагоцитоз); 3) обеспечивает всасывание липидов из кишечника и перенос их в кровь.
Тканевая жидкостьявляется промежуточным продуктом при превращении крови, а точнее плазмы, в лимфу. Она входит в состав межклеточного вещества различных тканей.
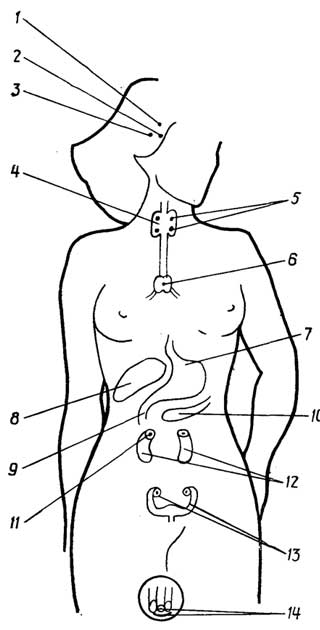
Кровь разных людей содержит эритроциты с поверхностью определенного типа, который зависит от наличия на ней углеводных соединений (агглютиногенов) типаАилиВ, илиАиВ, у некоторых лиц агглютиногены отсутствуют. В зависимости от этого выделяют четырегруппы крови: I, II, III, IV или 0,А, В, АВсоответственно. Плазма крови каждой группы, кроме четвертой, содержит белковые вещества (агглютинины), способные склеивать и осаждать эритроциты (вызыватьагглютинацию) других групп крови в соответствии с табл. 1.1. Для каждой расы и нации
ТаблицаI.1
Группы крови и правила ее переливания
Название группы крови |
Тип агглютиногенов на поверхности эритроцитов |
Тип агглютининов плазмы крови |
Группа крови реципиентов |
Группа крови доноров |
I, или 0 |
— |
аиb |
I II III IV |
I |
характерно определенное статистическое соотношение групп крови.
У разных людей кровь отличается еще наличием или отсутствиемрезус(Rh)-фактора(углеводное соединение на поверхности эритроцитов), а также других признаков, играющих существенную роль при массированном переливании крови или трансплантации тканей.
Группы крови и резус-фактор должны учитываться при переливании крови от одного человека другому.
Мышечная ткань- это совокупность мышечных клеток. Различают три вида мышечной ткани (рис. I.23): поперечнополосатую, гладкую и сердечную. Мышечные клетки имеют удлиненную форму и образуют волокна (миофибриллы). К поперечнополосатой
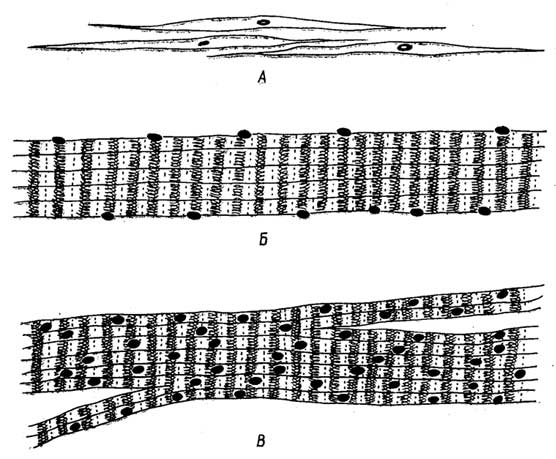
Рис. I.23.Мышечная ткань: гладких мышц (А), скелетных мышц (Б) и сердца (В)
мышечной ткани относятся скелетные мышцы. Сердечная мышца (миокард) также имеет поперечную исчерченность волокон, но отличается от скелетных мышц способом соединения мышечных волокон. Первые представляют собой симпласты, вторые образуют синцитии. Структура мышечной ткани определяется сократительной функцией мышц.
Рис. I.24.Клетка нервной ткани - нейрон (А):
1- тело нейрона;2- дендриты;3- аксон;4- миелиновая оболочка;5- неврилемма (шванновская клетка). Образование миелиновой оболочки аксона клеткой неврилеммы (Б)
Нервнаяткань представлена клетками различных отделов нервной системы: головного и спинного мозга, нервных узлов (ганглиев), нервных волокон. Различают два вида нервных клеток:нейроныинейроглию.
Нейроны(рис. I.24) - это главные клетки нервной ткани, функция которых связана с возникновением, восприятием и передачей сигнальных импульсов. Особенность строения нейронов - наличие у них отростков: более длинных (иногда до 1 м и более) -аксонови коротких -дендритов. Аксоны и дендриты представляют собой выросты тела клеток и состоят из цитоплазмы, покрытой, как обычно, клеточной мембраной. Аксоны и дендриты нейронов"белого вещества"головного и спинного мозга (т. е. центральной нервной системы), а также аксоны, дендриты и сами тела нейронов, связывающих головной и спинной мозг с различными органами и тканями организма (т. е. периферической нервной системы), покрыты дополнительномиелиновойоболочкой гидрофобного характера. Будучи хорошим изолятором, она, видимо, способствует лучшей проводимости сигнала.
Аксоны передают импульс из тела своего нейрона непосредственно соседнему нейрону или его дендритам, а дендриты воспринимают сигнал и передают его в тело своего нейрона. Между передающим импульс аксоном и воспринимающим этот импульс нейроном или его дендритом непосредственного контакта нет, они разделены небольшой щелью, называемойсинапсом. Передача импульса через синапс осуществляется за счет специальных веществ-переносчиков, называемыхнейромедиаторами, и только в одном направлении - от аксонов одного нейрона в тело соседнего нейрона или его дендритам. Органы нервной системы состоят из множества взаимодействующих друг с другом нейронов, причем каждый нейрон связан одновременно с сотнями, тысячами или десятками тысяч других нейронов.
Нейроглия- это вспомогательные клетки нервной ткани. Они заполняют промежутки между нейронами, а также между нейронами и кровеносными сосудами мозга, выполняя опорную, защитную и трофическую функции. Определенные клетки нейроглии, называемыеневрилеммой, илишванновскими клетками(см. рис. I.24), синтезируют миелиновую оболочку аксонов, дендритов и самой поверхности некоторых нейронов.
§ 2.
Органы высших животных
и человека
Органы у животных более многочисленны, чем у растений. Их принято объединять в системы. У высших животных и человека имеется 11 систем органов.
Система органов кровообращения
Система органов кровообращения (сердечно-сосудистая) выполняетсвязующую(транспортную) изащитнуюфункции. Она обеспечивает транспорт кислорода и обмен веществами между органами, доставляя им питание и химическую энергию и удаляя из них продукты жизнедеятельности. Благодаря сердечнососудистой системе осуществляется защитная функция крови и лимфы. В составе сердечно-сосудистой системы выделяют кровеносную и лимфатическую системы. Она включает сердце, кровеносные и лимфатические сосуды, кровь, лимфу, тканевую жидкость. К ней можно отнести икроветворные органы- красный костный мозг, селезенку, печень (она является также органом пищеварительной системы), тимус - орган эндокринной системы, который играет важную роль в выполнении защитной функции крови (с. 68).
Сердце(рис. I.25) представляет собой мышечный насос, обеспечивающий движение крови по сосудам. Кроме сократительного миокарда (сердечной мышечной ткани), в нем имеется особая мышечная ткань, сохранившая свойства эмбриональной и образующаяпроводящую систему сердца. В ней возникают электрические импульсы, вызывающие ритмические сокращения сердца.
Сердце окружено сумкой из соединительной ткани, заполненной жидкостью. Эта сумка называетсяперикардом. Перикард изнутри и миокард снаружи покрыты гладкими эндотелиальны-ми клетками для уменьшения трения, возникающего при сокращении.
Кровеносные сосудыпо выполняемым функциям и строению" стенок делятся на артерии, вены и капилляры. Артерии несут кровь от сердца к органам и тканям. От сердца отходят:легочная артерия, по которой кровь направляется в легкие, иаорта(главная и самая крупная артерия), которая недалеко от сердца разветвляется на другие артерии. Артерии в свою очередь разветвляются на более мелкие сосуды -артериолы- и затем на множествокапилляров. Стенки артерий и артериол состоят из трех слоев (см. рис. I.25):наружного, прочного и упругого, состоящего из соединительной ткани,среднего, который представляет собой гладкую мышечную ткань, ивнутреннего, также из соединительной ткани, покрытого изнутри слоем гладких плоскихэндотелиальных клеток. В большинстве артерий соединительная ткань внутреннего слоя образует прочную, но эластичную мембрану.
Венынесут кровь из органов и тканей к сердцу. В органах и тканях кровь из капилляров артериальной системы попадает в венозные капилляры, которые собираются в более крупныевенулы, а затем в еще более крупныевены. К сердцу кровь возвращается черезверхнюю(от легких) инижнюю(от других органов)полые вены. Таким образом, артериальное и венозное русла соединяются через капиллярную сеть. Через стенки капилляров, состоящие только из клеток эндотелия, происходит обмен веществ между кровью и тканевой жидкостью. Стенки вен и венул состоят из тех же трех слоев, что и стенки артерий и артериол, но они заметно тоньше. У большинства вен соединительная ткань внутреннего слоя не образует эластичной мембраны. Главное отличие вен от артерий - наличиеклапанов, расположенных через определенные промежутки и пропускающих кровь только в одном направлении. Особую роль в кровеносной системе играетворотнаявена печени. Она направляет кровь из селезенки и органов пищеварения (желудка, поджелудочной железы, кишечника) в печень.
Рис. I.25.Сердце (A):
1- правое предсердие;2- левое предсердие;3- правый желудочек;4- левый желудочек;5- нижняя полая вена;6- верхняя полая вена;7- легочная вена;8- легочная артерия;9- аорта. Строение артерий (Б):1- внешний соединительнотканный слой;2- средний мышечный слой;3- внутренний соединительнотканный слой;4- эндотелиальная выстилка внутреннего слоя;5- просвет артерии
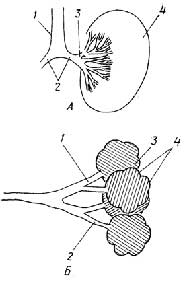
Рис. I.26.Дыхательная система (А):
1- трахея;2- бронхи;3- бронхиолы;4- легкое. Разветвление бронхиол (Б):1- бронхиолы;2- альвеолярные ходы;3- альвеолярные мешки;4- альвеолы
Рис. I.27.Пищеварительная система:
1- рот;2- глотка;3- пищевод;4- желудок;5- двенадцатиперстная кишка (дуодена);6- тонкий кишечник;7- толстый кишечник;8- прямая кишка;9- поджелудочная железа;10- печень;11- желчный пузырь
Отсюда кровь направляется по печеночной и далее по нижней полой вене в сердце.
Лимфатические сосуды- это и мелкие капилляры, и более крупные сосуды. Стенки лимфатических капилляров также состоят из клеток эндотелия и проницаемы для веществ тканевой жидкости. Принципиальное отличие лимфатических капилляров от кровеносных в том, что лимфатические капиллярыимеют начало. Они, как и кровеносные капилляры, абсорбируют вещества из тканевой жидкости. Далее, лимфатические капилляры сливаются в более крупные сосуды, а те в свою очередь - в еще более крупные. Самый крупный из них -грудной лимфатический проток- впадает влевую плечевую вену, и таким образом лимфатическая сеть соединяется с кровеносной.
Итак, из тканей жидкость и все растворенные в ней вещества возвращаются в кровь как через кровеносные капилляры, так и через лимфатические. В крупных лимфатических сосудах, так же как в венах, через определенные промежутки расположены клапаны, пропускающие лимфу только в одну сторону. В местах слияния лимфатических сосудов находятсялимфатические узлы-своеобразные фильтры, представляющие собой разрастания клеток с множеством узких и извилистых протоков. В лимфатических узлах размножаются лимфоциты, идет образование антител, задерживаются и уничтожаются бактерии, переродившиеся клетки (раковые), прочие инородные тела.
Кроветворные органынепрерывно обновляют кровь.Красный костный мозг, находящийся в полостях костей, продуцируетформенные элементы крови: эритроциты, лейкоциты, тромбоциты.Селезенкаслужит резервуаром крови. Кроме того, определенные ее клетки фагоцитируют "старые" эритроциты и тромбоциты.Печеньявляется еще более крупным депо крови, которое может запасать до 20% всей крови. Когда наступает необходимость, эта кровь дополнительно поступает в сосуды. Так же как селезенка, печень (с помощьюкупферовских клеток) выполняет санитарную функцию. Кроме того, она обеспечивает кровь многими составляющими ее компонентами.
Дыхательная система
Дыхательная система обеспечивает организм кислородом и освобождает его от углекислого газа.
Она состоит износовой полости, гортани, трахеи, разветвляющейся на правый и левый бронхи, которые далее ветвятся набронхиолы. Последние заканчиваются несколькимиальвеолярными мешками, в стенках которых находятся выпуклости, называемыеальвеолами(рис. I.26).
Стенки бронхов и трахеи состоят из трех слоев: внутреннего - из слизистого эпителия; среднего - из гладкой мышечной ткани и хрящевых колец и внешнего - из соединительной ткани. Клетки эпителия содержат реснички, биение которых выносит обратно в гортань проникших с воздухом в легкие бактерий, а также частички пыли и др. По мере разветвления бронхов внешний и средний слои их стенок исчезают, а ресничный эпителий заменяется на обычный плоский.
Обмен газов в легких между воздухом и кровью происходит путем диффузии через стенки альвеол, состоящие только из слоя эпителиальных клеток, и эндотелий кровеносных капилляров, густо покрывающих альвеолы. Упругость легких обеспечивается тем, что между альвеолами находится разделяющая и поддерживающая их эластичная волокнистая соединительная ткань. Легкие пронизаны также многочисленными нервами, как чувствительными, так и нервами, регулирующими процесс вдоха-выдоха.
Пищеварительная система
Система органов пищеварения предназначена для извлечения необходимых организму веществ и энергии из продуктов питания. Она состоит из (рис. I.27) ротовой полости, глотки, пищевода, желудка, кишечника (двенадцатиперстная кишка, тонкая, толстая и прямая кишки), печени с желчным пузырем и поджелудочной железы.
Вротовой полостипища предварительно измельчается и смачивается слюной, выделяемой слюнными железами. В слюне содержатся некоторые ферменты, частично расщепляющие углеводы, и слизь, которая делает пищевой комок легкопроглатываемым. Черезглотку, пищеводпища попадает вжелудок. Стенки желудка довольно толстые, состоят из трех слоев: внутреннего слизистого складчатого, представленного клетками эпителия, затем среднего - мышечного и внешнего - из волокнистой соединительной ткани. Клетки слизистого эпителия выделяют кислый (рН 1,5-2) богатый ферментамижелудочный сок, с помощью которого начинается переваривание белков. Сокращение и расслабление гладких мышц среднего слоя стенок желудка обеспечивает передвижение и перемешивание пищевого химуса. Внешняя поверхность всех отделов пищеварительной трубки дополнительно покрыта прочной и скользкой серозной пленкой -брюиишой. Стенки желудка пронизаны нервами, кровеносными и лимфатическими сосудами. Аналогичное трехслойное строение имеют стенкикишечника, который начинается относительно короткой (около 25 см)двенадцатиперстной кишкой. Сюда поступают по протокамжелчьизпечениипанкреатический сокизподжелудочной железы. Сами клетки слизистого эпителия двенадцатиперстной кишки выделяюткишечный сок. Совместным действием всех трех компонентов, имеющих рН 7-8, в двенадцатиперстной итонких кишкахпроисходит окончательное расщепление белков, жиров и углеводов. В тонком кишечнике происходит также всасывание продуктов переваривания. Продукты переваривания белков и углеводов всасываются в кровеносные капилляры кишечных стенок и затем по воротной вене направляются в печень.
Продукты переваривания жиров всасываются клетками слизистого эпителия тонкой кишки, в которых из этих продуктов вновь синтезируются жиры. Последние всасываются лимфатическими капиллярами и далее по лимфатическим сосудам поступают в кровь левой плечевой вены. Втолстом кишечникевсасывается вода. Здесь же находится множество полезных бактерий, которые утилизируют остатки пиши, например расщепляют клетчатку, и синтезируют некоторые вещества, необходимые организму. Содержимое толстого кишечника постепенно переходит в полутвердое состояние и проталкивается в прямую кишку, откуда выводится в виде экскрементов. Экскременты представляют собой непереваренные остатки пиши, не всосавшиеся или ненужные организму вещества, а также большое количество бактерий и продуктов их жизнедеятельности.Печеньпомимо синтеза желчи, которая концентрируется в желчном пузыре, осуществляет многочисленные превращения одних веществ в другие и тем самым обеспечивает постоянство состава веществ, их соотношения в различных тканях и органах.
Выделительная система
Выделительная система обеспечивает удаление из организма продуктов его жизнедеятельности.
Она включает в себя в первую очередь почки с мочевыводящими путями, которые выводят из организма большую часть "отходов". Выделительными функциями обладают также органы дыхательной системы (выделяют углекислый газ), пищеварительной системы (выделяют "отходы" с экскрементами), покровной системы (через кожу с потом выделяется 5-10% продуктов жизнедеятельности, в основном тех же, что и с мочой). Почки помимо выделительной функции играют важную роль вгомеостазе, т. е. поддержании постоянным состава внутренней среды организма, в том числе крови.
Почки- это парный орган (рис. I.28). Каждая почка состоит из большого числа функциональных единиц -нефронов. Их строение показано на рисунке. Почечная артерия разветвляется в почке на артериолы, которые в свою очередь в нефроне разветвляются на шаровидный пучок капилляров -почечный клубочек. Входит в негоафферентная артериола, а выходитэфферентная. Почечный клубочек располагается в мешке с двойными стенками -боуменовой капсуле, от которой отходит сосуд-трубочка, называемыйпочечным канальцем. Стенки почечного канальца состоят из одного слоя эпителиальных клеток. Эфферентная артерия, выйдя из почечного клубочка, сильно разветвляется на капилляры, плотно и густой сетью охватывающие начало почечного канальца (проксимальный каналец) и его конец (дистальный каналец). Проксимальный и дистальный концы почечного канальца, охваченные множеством капилляров, вместе с самим почечным клубочком, находящимся в боуменовой капсуле, составляют ту часть нефрона, которая располагается вкорковом слоепочки.
Рис. I.28.Выделительная система.
Почки (A):1- левая почка;2- корковое вещество правой почки;3- мозговое вещество правой почки;4- почечные лоханки;5- мочеточники;6- мочевой пузырь;7- мочеиспускательный канал.
Нефрон (Б):1- почечный клубочек;2- буоменова капсула;3- приносящая (афферентная) артериола;4- выносящая (эфферентная) артериола;5- почечные канальцы;6- петля Генле;7- капиллярная сеть;8- венула;9- собирательная трубочка;10- вклад других нефронов
Средняя часть почечного канальца, называемаяпетлей Генле, у большинства нефронов находится вмозговом веществепочки и также охвачена множеством капилляров, которые, сливаясь вместе, образуют венулу. Венулы далее соединяются в почечную вену. Дистальная часть почечного канальца переходит всобирательную трубочку, через которую моча попадает в небольшую полость в почке -почечную лоханку. Далее из почечной лоханки помочеточникуона попадает вмочевой пузырь, из которого выводится из организма черезмочеиспускательный канал.
Образование мочи в каждом нефроне начинается сфильтрациикрови в почечном клубочке через внутреннюю стенку боуменовой капсулы в проксимальную часть почечного канальца. Фильтрация происходит за счет перепада давления крови на входе и выходе почечного клубочка, обусловленного тем, что эфферентная артериола имеет меньший диаметр, чем афферентная. В образующийся фильтрат из крови переходят только низкомолекулярные вещества, соли и вода.
Образование мочи из фильтрата происходит в почечных канальцах, во-первых, за счет реабсорбции нужных организму веществ (глюкозы, аминокислот, воды и др.) в кровеносные капилляры, охватывающие почечные канальцы, и, во-вторых, за счет секреции дополнительного количества низкомолекулярных "отходов" из кровеносных капилляров в почечные канальцы. В отличие от фильтрации реабсорбция и секреция протекают против градиента концентрации и, значит, требуют затраты энергии. Процессы переноса вещества, протекающие с затратой энергии, как в данном случае, принято называтьактивными. Точные измерения показывают, что работа, производимая почкой (на единицу ее массы), даже больше, чем работа, выполняемая сердечной мышцей. Почки за счет активно протекающих реабсорбции и секреции играют не менее значительную роль в гомеостазе, чем печень.
Нервная система
Нервная система регулирует и координирует функционирование всех других систем организма при его взаимодействии с внешней средой. Она состоит изголовногоиспинногомозга,нервных узлов(ганглиев) инервов.
Структурнонервная система подразделяется нацентральную, включающую головной и спинной мозг, ипериферическую, которая состоит из ганглиев и пучков нервных волокон (нервов), связывающих головной и спинной мозг со всеми остальными органами и тканями тела.
Функциональнонервная система делится насоматическую, контролирующую сокращение-расслабление скелетных мышц и движение тела, иавтономную, иливегетативную, контролирующую деятельность гладких мышц, сердца и других внутренних органов.
Центральная нервная система.
Представлена множеством отделов.
Головной мозг
Головной мозгочень сложное образование (рис. I.29). Основную массу его занимаютбольшие полушария- парная структура, состоящая изсерогоибелого вещества. Серое вещество
Рис. I.29.Головной мозг:
1- большие полушария;2- мозолистое тело;3- таламус;4- гипоталамус;5- эпиталамус;6- средний мозг;7- мозжечок;8- варолиев мост;9- продолговатый мозг;10- первый и второй мозговые желудочки;11- третий мозговой желудочек;12- четвертый мозговой желудочек;13- гипофиз;14- шишковидная железа (эпифиз);15, 16, 17- мягкая, паутинная и твердая мозговые оболочки соответственно
мозга представляет собой скопление тел нейронов и их отростков, не имеющих миелиновой оболочки. У высших животных и человека серое вещество мозга в виде тонкого слоя с многочисленными складками образуеткору больших полушарий. С ее функционированием связаны самые сложные формы нервной деятельности: обучение, память, анализ восприятия, творчество, т. е. умственная деятельность. Под корой находится белое вещество мозга, состоящее в основном из покрытых миелиновой оболочкой отростков нейронов, соединяющих кору больших полушарий с другими отделами мозга. Отдельные массы серого вещества, расположенные внутри больших полушарий, образуютподкорковые нервныеузлы, илибазальные ганглии, называемые ещенервными центрами, которые являются промежуточными пунктами сбора, предварительной обработки и передачи нервных импульсов дальше в другие нервные центры, в кору больших полушарий или, напротив, из коры в управляемые органы. Большие полушария вместе с базальными ганглиями называютконечным мозгом.
Стволовая(базальная)часть головного мозгасвязывает конечный мозг со спинным. Она ответственна за рефлекторное управление эмоциями, инстинктами, движением мышц и состоит из промежуточного, среднего, продолговатого и заднего мозга. В ней расположены нервные центры вегетативной нервной системы.
Промежуточный мозгсодержит различные нервные центры, в том числе центры вегетативной нервной системы. Наиболее крупными нервными центрами промежуточного мозга являютсяталамус, интегрирующий все виды чувствительных импульсов (температурных, болевых и др.), которые поступают в мозг, игипоталамус, являющийся связующим звеном между нервной и эндокринной системами. Здесь же расположены и две важные эндокринные железы:гипофизиэпифиз(шишковидная железа). Гипоталамус регулирует уровень возбудимости центральной нервной системы в целом. Он играет важную роль в регуляции температуры тела. Так как гипоталамус тесно связан с одной из самых важных эндокринных желез - гипофизом, то через гипофиз и осуществляется регуляторное действие нервной системы на многие обменные процессы, на деятельность эндокринной, сердечно-сосудистой, пищеварительной, выделительной систем.
Средний мозгсвязывает промежуточный мозг с продолговатым. Он содержит нервные центры, регулирующие деятельность некоторых мышц, например глаз, ушей у животных, а также тонус скелетных мышц.
Продолговатый мозгсодержит нервные центры вегетативной нервной системы, регулирующие деятельность многих внутренних органов (сердца, легких, пищеварительной системы и др.). Кроме того, здесь расположены также нервные центры, воспринимающие импульсы от вкусовых и слуховых рецепторов, органов равновесия.
Задний мозгвключает мозжечок и варолиев мост.Мозжечокрасположен в задней затылочной части головного мозга, за продолговатым и частично за средним мозгом. Он состоит из двух полушарий, связь между которыми обеспечивается черезваролиев мост, охватывающий дугой стык продолговатого и среднего мозга.Кора полушарий мозжечкаимеет множество складок. Нервные центры мозжечка обеспечивают согласованность действий разных мышц.
Спинной мозг
Спинной мозг(рис. I.30) расположен в канале позвоночного столба и имеет вид трубки. Он играет основную роль в осуществлении большинства рефлексов, участвует в проведении импульсов от органов и тканей в головной мозг и наоборот. Спинной мозг состоит из находящегося внутрисерого вещества, на срезе имеющего форму бабочки и представляющего собой скопление тел нейронов. Снаружи находитсябелое вещество, состоящее в основном из пучков аксонов и дендритов, заключенных в миелиновые оболочки.
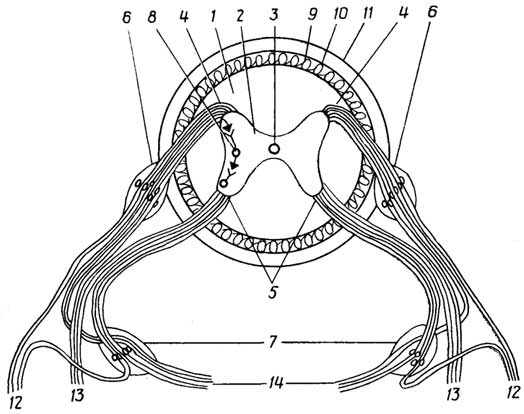
Рис. I.30.Спинной мозг:
1- белое вещество;2- серое вещество;3- центральный канал;4- задние корешки;5- передние корешки;6- ганглии задних корешков с чувствительными нейронами;7- ганглии симпатической нервной системы с двигательными нейронами;8- вставочный нейрон рефлекторной дуги;9, 10, 11- мягкая, паутинная и твердая мозговые оболочки;12, 13- дорсальная и вентральная ветви, иннервирующие кожу, мышцы задней и передней частей тела соответственно;14- вегетативные ветви, иннервирующие внутренние органы
Общность структуры головного и спинного мозга. Вдоль всего спинного мозга, внутри него, проходитцентральный канал, заполненныйспинномозговой(цереброспинальной)жидкостью, близкой по составу плазме крови. Переходя в стволовую часть головного мозга, этот канал расширяется четыре раза. Образованные в результате расширения четыре полости называютсямозговыми желудочками. Первый и второй находятся в больших полушариях, третий - в промежуточном мозгу, четвертый - в продолговатом. Они густо оплетены кровеносными капиллярами. Как спинной, так и головной мозг покрытытремя оболочками: внутренней мягкой - из клеток нейроглии, средней паутинной - из рыхлой соединительной ткани и внешней относительно твердой - из плотной соединительной ткани. Пространство между оболочками заполнено спинномозговой жидкостью.
Периферическая нервная система
Периферическая нервная система - это нервы, связывающие головной и спинной мозг со всеми органами и тканями. Они представляют собой в основном пучки аксонов и дендритов.Нервные сплетения- это скопления таких пучков. Тела нейронов периферической нервной системы находятся или в головном и спинном мозгу, или вне их, образуя в последнем случаенервные узлы(ганглии).Нервный импульспоступает в головной или спинной мозг черезчувствительные(афферентные)нейроны, а выходит из него черездвигательные(эфферентные)нейроны. Соединение между чувствительным и двигательным нейронами обеспечиваетсявставочным нейроном. Все вместе они образуют функциональную единицу -рефлекторную дугу. Чувствительные волокна входят в спинной мозг череззадние корешки, а двигательные выходят черезпередние(см. рис. I.30). Задние и передние корешки вскоре сливаются в один пучок, который затем вновь делится на три ветви. Первые две иннервируют кожу и мышцы, а третья - внутренние органы и, значит, относится к вегетативной нервной системе.
Вегетативная нервная система
Вегетативная нервная система, в отличие от соматической, автономна, т. е. она не подвержена волевому контролю. Вегетативная нервная система подразделяется насимпатическуюипарасимпатическуюсистемы. Большинство внутренних органов получают двойную иннервацию со стороны как симпатической, так и парасимпатической нервной системы. В некоторых органах имеются нервы только одной из систем. Действие двух систем на органы с двойной иннервацией противоположно; если импульсы симпатической системы "усиливают" деятельность органа, то импульсы парасимпатической эту деятельность "ослабляют" и наоборот. Нормальное функционирование внутренних органов в высшей степени зависит от согласованного действия симпатической и парасимпатической систем.
Структурно-функционально в нервной системе выделяютсяпирамидный тракт и экстрапирамидная система, сенсорные структуры,. лимбическая система, ретикулярная формация.
Пирамидный тракт(система) - совокупность нервных узлов и эфферентных нервных пучков в головном и спинном мозгу, по которым импульсы, управляющие движением мышц, направляются. из коры больших полушарий через нейроны спинного мозга в двигательные нервы, выходящие из мозга в составе передних корешков.
Экстрапирамидная система- совокупность подкорковых нервных центров больших полушарий и стволовой части головного мозга, участвующих в управлении движением мышц, регуляции их тонуса, в эмоциональных проявлениях типа смеха, плача и др.
Сенсорные структуры: нервные окончания, афферентные волокна, чувствительные нейроны, специальные проекционные зоны в различных отделах центральной нервной системы, отвечающие за восприятие, проведение и обработку сигналов, поступающих от рецепторов практически из всех тканей и органов тела.
Лимбическая система- совокупность отделов головного мозга, расположенных в коре, подкорковом слое и внутри больших полушарий и ответственных за инстинктивное поведение, эмоциональное состояние. Лимбическая система участвует в деятельности вегетативной нервной системы, в формировании определенных видов памяти.
Ретикулярная(сетчатая)формация- совокупность центральных структур головного мозга, деятельность которых связана с регуляцией уровня возбудимости центральной нервной системы, особенно коры больших полушарий. Ретикулярная формация, в частности, регулирует переход сон-бодрствование.
Система эндокринных и экзокринных желез
Эндокринные железы- это железы внутренней секреции, выделяющие в кровь вещества различного строения, называемые гормонами, которые способны в крайне малых концентрациях целенаправленно влиять на деятельность других органов и тканей организма. Эндокринная система наряду с нервной играет важную роль в регулировании функциональной активности всех других систем организма. В отличие от нервной регуляции эндокринные железы осуществляютгуморальную регуляцию. Функционирование самих эндокринных желез также регулируется как нервной системой, так и гуморально, т. е. гормоны одних эндокринных желез влияют на деятельность других желез и наоборот, по принципу "обратной связи", который часто встречается в живой природе. Кроме того, среди гормонов, секретируемых разными железами, нередко встречаются одинаковые, так что в некоторых случаях функции одной железы могут частично переходить к другой. Таким образом, ясно, что функционирование эндокринных желез тесно взаимосвязано. В состав эндокринной системы входят (рис. I.31): гипофиз, эпифиз, щитовидная и паращитовидные железы, тимус, надпочечники, поджелудочная железа, половые железы, а также клетки слизистой оболочки пищеварительной трубки и сердца.
Гипофиз. Он находится в нижней части промежуточного мозга, под гипоталамусом. Состоит из передней и задней долей, которые имеют разное эмбриональное происхождение.Гормоны передней доли(аденогипофиза) регулируют функционирование многих других желез внутренней секреции: щитовидной,
|
надпочечников, эндокринных клеток поджелудочной железы (островков Лангерганса), семенников, яичников, а также желез внешней секреции - молочных желез.Гормоны задней доли(нейрогипофиза) влияют на сокращение гладкой мускулатуры, молочных желез, вызывают сужение кровеносных капилляров, усиливают всасывание воды кровеносными капиллярами из почечных канальцев.
Эпифиз(шишковидная железа) находится в промежуточном мозгу. Его гормоны, оказывают тормозящее действие на функционирование половых желез и коры надпочечников.
Щитовидная железарасположена в области шеи. Ее гормоны регулируют интенсивность обменных реакций в организме.
Паращитовидные железы(их четыре) находятся на задней поверхности щитовидной железы, иногда в самой ткани железы. Гормоны этих желез регулируют обмен фосфора и кальция.
Тимус(вилочковая, илизобная, железа) состоит из двух долей, охватывающих справа и слева трахею. Он хорошо развит у новорожденного и растет до наступления половой зрелости, затем претерпевает инволюцию, которая в некоторых случаях доходит до атрофии. Тимус играет важную роль в формировании,иммунитета, от его функционирования зависит созревание определенного вида, лимфоцитов. Гормоны тимуса существенным образом влияют на развитие организма.
Надпочечники- парные железы. Каждая расположена на верхней части почки. Состоят из двух самостоятельных частей:внутренней- темно-бурого мозгового вещества ивнешней- светлой желто-розовой коры.Мозговое вещество надпочечниковсостоит изхромаффинных клеток, представляющих собой особую разновидность нервной ткани. Его гормональная деятельность управляется симпатической нервной системой. Гормоны мозгового вещества надпочечников (адреналин, и норадреналин) играют важную роль в мобилизации организма при стрессовых нагрузках - наивысших физических и психических напряжениях, в моменты опасности, тревоги, т. е. при чрезвычайных обстоятельствах.Кора надпочечниковсекретирует различные гормоны, относящиеся к классустероидови влияющие на многие обменные процессы, водно-солевое равновесие в организме, количество лимфоцитов в крови. От нормального функционирования коры надпочечников зависит сопротивляемость организма стрессовым ситуациям, инфекциям, адекватность воспалительных и аллергических реакций.
Поджелудочная железасостоит из клеток двух типов: эндокринных и экзокринных.Эндокринные клеткирасполагаются в ткани поджелудочной железы группами, которые называютостровками Лангерганса. Они выделяют различные гормоны, регулирующие в основном углеводный и в некоторой степени липидный обмен.
Половые железы - семенники(у мужчин) ияичники(у женщин) - выделяют в кровь мужские и женские половые гормоны так, что первые преобладают у мужчин, а вторые - у женщин. Это соотношение обусловливает признаки пола, выраженные во внешности и поведении.
Временной железой у женщинявляютсяжелтое телоиплацента, гормоны которых обеспечивают нормальное протекание беременности.
Клетки слизистой желудкаикишечникатакже секретируют в кровь ряд гормонов, регулирующих местное (на уровне конкретного отдела) пищеварение.
Почкипомимо выделительной функции выполняютроль эндокринной железы, выделяя в кровь гормоны, регулирующиеэригропоэз(созревание эритроцитов).
Сердце, как показали недавние исследования, является важной эндокринной железой, выделяя в кровь гормон, участвующий в регуляции обмена, давления крови и водно-солевого баланса.
Экзокринные железы- это железы, выделяющие секрет не в кровь, а по протокам либо наружу, либо в другие внутренние органы. К ним относятся:потовыеисальныежелезы кожи,слюнныеимолочныежелезы.Экзокринные клетки поджелудочной железы, называемыеацинарными, продуцируют пищеварительные ферменты, поступающие в кишечник с панкреатическим соком.Печень как экзокринная железавыделяет желчь, поступающую по протокам в двенадцатиперстную кишку.Предстательная железа, семенные пузырькиикуперовы железыимеются только у мужчин и располагаются под мочевым пузырем. Секрет, который они выделяют в половые протоки, обеспечивает жизнедеятельность сперматозоидов в семенной жидкости.
Покровная система
Представлена кожей, которая является внешней оболочкой организма. Ее основное назначение - защита организма от воздействия внешней среды и поддержание постоянства внутренней. Другими словами, кожа защищает от незначительных механических и химических воздействий, от губительного действия
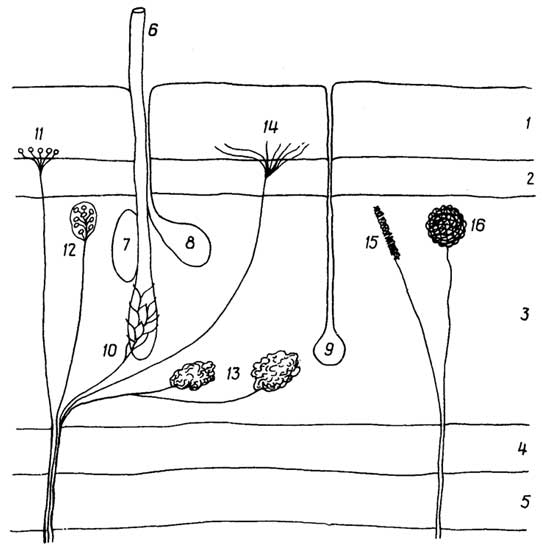
Рис. I.32.Кожа:
1- эпидермис;2- верхний слой дермы из плотной волокнистой соединительной ткани;3- нижний слой дермы из рыхлой соединительной ткани;4-жировая ткань;5- мышечная ткань;6- волос;7- мышца, поднимающая волос;8- сальная железа;9- потовая железа;10- нервные окончания волосяного фолликула;11, 12, 13- тактильные рецепторы разной чувствительности;14- свободные нервные окончания (болевые);15, 16- рецепторы тепла и холода соответственно
ультрафиолетового излучения, от проникновения микробов, от перегрева и потери тепла. Экзокринные железы кожи, потовые и сальные, а также молочные, образованные из той же ткани, что и кожа, являются органами выделительной системы. Кожа состоит (рис. I.32) из очень тонкого внешнего слояэпидермиса, не имеющего кровеносных капилляров, и расположенного ниже, более толстого слоя -дермы, который пронизывают многочисленные кровеносные и лимфатические капилляры, а также нервные волокна. Эпидермис состоит из эпителиальных клеток, а дерма -из клеток волокнистой соединительной ткани и жировых клеток. Верхний слой дермы представляет собой очень густое переплетение белковых волокон, которые образованы клетками соединительной ткани -фибробластами. Этот слой обеспечивает механическую прочность и эластичность кожи.
Скелетная система
Кости и их соединенияобразуют вместе скелет - вместилище для жизненно важных органов, хранилище минеральных соединений. Скелет выполняет опорную, а также архитектурную функцию, создавая форму тела. Жесткие кости скелета выполняют также защитную функцию для внутренних органов. Скелет человека состоит из более чем 200костей, а также множествахрящей, связокисухожилий. Скелет у человека и других развитых животных находитсявнутриорганизма, а у других, более примитивных животных (раки, крабы, улитки, некоторые насекомые) скелет являетсявнешнимобразованием.
Хрящи- полутвердые образования соединительной ткани. Они находятся там, где необходима упругая плотная ткань: суставная поверхность костей, гортань, трахея, бронхи, полужесткие соединения ребер с грудиной и др. Из них построены также ушные раковины и кончик носа.
Связки- эластичные образования соединительной ткани. Они соединяют кости между собой.
Сустав- место подвижного соединения двух костей, обычно заключен всуставную сумку, образованную связками. Внутренняя ее часть -суставная полость, заполненасиновиальной жидкостью, которая по составу близка лимфе, но содержит ещеслизистые вещества, выполняющие роль смазки.
Сухожилия- это нерастяжимые полужесткие образования соединительной ткани, способные выдерживать большие нагрузки на разрыв. Они соединяют мышцы с костями.
Мышечная система
Мышечная система, представленная многочисленными мышцами тела, вместе со скелетом образует форму тела и обеспечивает как движение его частей, так и движение всего организма в целом.
Мышцы человека и млекопитающих подразделяются на три вида:скелетные, сердечнуюигладкие. Скелетные обеспечивают движение тела или его частей; сердечная мышца (миокард) обусловливает работу сердца, как нагнетающего насоса; гладкие мышцы, составляющие основу стенок внутренних органов и сосудов, обеспечивают тонус и просвет сосудов, а также полых органов.
Работа мышц регулируется нервно-гуморальным путем, т. е. за счет нервной системы и физиологически активных веществ, в том числе гормонов. Волевое управление возможно только скелетными мышцами.
Органы восприятия (чувств)
Принято считать, что высшие животные и человек обладаютпятью видами чувств: зрения, слуха, осязания, обоняния, вкуса, - благодаря которым происходит восприятиевнешней среды. Для жизнедеятельности организма помимо информации из внешней среды очень важны сигналы, идущие из внутренней среды (восприятие внутреннего состояния), хотя ощущения, возникающие при этом, трудно точно охарактеризовать и определить. Животные и человек обладают ещечувством равновесия(гравитации), которое обусловлено функционированием как самостоятельного органа, так и органов других чувств, в том числе и тех, которые воспринимают внутреннее состояние организма.
Функционирование органов чувств всех видов основано на способности ихклеток-рецепторовк раздражению и затем передаче в центральную нервную систему генерированного нервного импульса.
Орган зрения - глаз. Его клетки-рецепторыколбочкиипалочкиреагируют на свет. Первые ответственны за зрение при ярком свете, за восприятие цветности, формы и деталей предметов, вторые - за зрение при слабом освещении и ночное видение.
Орган слухасостоит из внешнего, среднего и внутреннего уха. Во внутреннем ухе находятся слуховые рецепторы - волосковые клетки, которые воспринимают звуковые сигналы.
Органы осязаниянаходятся во внутреннем слое кожи (см. рис. I.32). Они представляют собой различные виды окончаний отростков чувствительного нейрона: или свободно разветвленные (отвечают за болевые ощущения) или усложненные специальными образованиями, например в виде капсулы (отвечают за тактильные ощущения, а также за восприятие холода, тепла). Считается, что превышение определенного уровня раздражения тактильных и температурных рецепторов также вызывает болевые ощущения.
Органы обоняния. Обонятельные клетки-рецепторы расположены среди клеток эпителия верхних носовых ходов, куда воздух попадает только путем диффузии.
Органы вкуса. Вкусовые рецепторные клетки находятся во вкусовых почках, которые располагаются в основном на языке и частично на мягком нёбе, задней стенке глотки, миндалине, надгортаннике, а в раннем детстве - и на губах.
Органы равновесия(гравитации) - этовестибулярный аппарат, который анатомически расположен во внутреннем ухе, а также многочисленныекинестетическиерецепторы (проприоцепторы), находящиеся в мышцах, связках, суставных сумках, в образованиях соединительной ткани и реагирующие на растяжение - сжатие. В возникновении чувства равновесия принимают участие также органы зрения и тактильные рецепторы кожи.
Рецепторы органов восприятия внешней среды (зрения, слуха, осязания, обоняния, вкуса) называютсяэкстероцепторами. Рецепторы, воспринимающие внутреннее состояние организма, называютсяинтероцепторами, или рецепторамивисцеральнойчувствительности. Они находятся во внутренних органах, кровеносных сосудах. С их сигналами целиком или частично связаны чувства жажды, сытости, тошноты, рвоты, головокружения, потребность в мочеиспускании, дефекации и др. К ним относятся также клетки-рецепторы вестибулярного аппарата и проприоцепторы. Раздражение рецепторов органов чувств достигается механическим способом (тактильные, слуховые, вестибулярные, проприоцепторы и частично интероцепторы), химическим способом (обонятельные, вкусовые, болевые, часть интероцепторов), физико-химическим (фотохимическим) способом (зрительные).
Органы размножения
Органы размножения (половые) обеспечивают воспроизведение потомства. Они подразделяются на внутренние и копулятивные.
Внутренние половые органы у мужских особей- этосеменникии вспомогательные половые железы:предстательная, куперовы железы, семенные пузырьки. Семенники помимо синтеза половых гормонов продуцируют мужские половые клетки - сперматозоиды, а вспомогательные половые железы образуют секрет, обеспечивающий жизнеспособность сперматозоидов.
Внутренние половые органы женских особей- этояичники, яйцеводы(фаллопиевы трубы),матка, а такжеплацента. В яичниках помимо половых гормонов образуются яйцеклетки, которые оплодотворяются сперматозоидами в фаллопиевой трубе. В матке происходит развитие эмбриона и вынашивание плода. Плацента - временный орган, возникающий при беременности из внутреннего слоя матки. Она представляет собой губчатую мембрану, которая отделяет кровь плода от крови матери, но через которую тем не менее плод получает питательные вещества и кислород из материнского организма, отдавая углекислоту и продукты своего метаболизма. Плацента является одновременно эндокринной железой, гормон которой регулирует протекание беременности.
Копулятивные(внешние)половые органыобеспечивают встречу между сперматозоидами и яйцеклеткой.
Ретикуло-эндотелиальная (макрофагическая)
система
В отличие от других систем органов человека и высших животных ретикуло-эндотелиальная система представляет собой не совокупность органов, построенных часто из нескольких видов тканей и объединенных одной или несколькими одинаковыми функциями в организме, а совокупность клеток с одинаковыми функциями, находящихся в разных тканях и органах. Основная функция клеток ретикуло-эндотелиальной системы - защита организма от бактерий, вирусов и частиц, проникших в организм или образовавшихся в нем в результате жизнедеятельности проникших микроорганизмов либо из-за нарушения собственного метаболизма. Защита осуществляется путем фагоцитоза.
К клеткам ретикуло-эндотелиальной системы относятся: моноциты и гранулоциты (нейтрофилы) крови, макрофагические клетки различных тканей и органов:гистиоцитысоединительной ткани,остеокластыкостной ткани,купферовскиезвездчатые клетки печени; в других органах и тканях (селезенке, легких, костном мозгу, лимфатических узлах) макрофаги не имеют специальных названий. Способностью к фагоцитозу обладают клетки нейроглии. Сами моноциты иногда также называют макрофагами, а нейтрофильные гранулоциты - микрофагами. На самом деле, моноциты превращаются в макрофаги после проникновения из крови в другие ткани.
§ 3.
Особенности размножения животных
Половое размножение
Этот вид размножения характерен для большинства животных. Он связан соплодотворением, т. е. слиянием мужской и женской половых клеток, в результате чего образуетсязигота. Зигота развивается вэмбриони затем вплод. При таком способе размножения мужские и женские половые клетки образуются путем мейоза в половых органах соответственно мужских и женских особей.
Гермафродитизм- особый вид полового размножения, когда одна и та же особь является и мужской и женской либо одновременно, либо в разное время. Примером первого случая могут служить некоторые ленточные черви, способные к самооплодотворению, или дождевые черви, способные оплодотворять друг друга. Примером второго случая являются устрицы, у которых одна и та же особь через некоторое время меняет свой пол.
Партеногенез- довольно редкая разновидность полового (но однополого) размножения, наблюдаемая у некоторых насекомых и мелких ракообразных. Он характеризуется тем, что взрослый организм развивается из неоплодотворенной яйцеклетки, причем вырастают всегда либо самцы, либо самки. Пример партено-генетического потомства - трутни у пчел, гаплоидные самцы. Искусственное партеногенетическое потомство было получено и у животных, стоящих на более высокой ступени развития, - у лягушек и кроликов, но оно оказалось гораздо менее жизнеспособным.
Бесполое размножение
Бесполое размножение осуществляется без участия специальных половых клеток. Встречается у беспозвоночных животных, причем иногда существует наряду с половым, например у кишечнополостных (гидр, медуз, гидроидных и коралловых полипов). У них образование дочерних особей происходит путемпочкования, т. е. новый организм того же пола развивается из группы клеток (почки), отделившейся от родительского организма. Некоторые беспозвоночные, например плоские черви, морские звезды и др., могут восстанавливать (регенерировать) весь организм из небольшой его части.
Онтогенез
Онтогенез - это индивидуальное развитие особи от момента зарождения (оплодотворение яйцеклетки) до конца жизни. Оплодотворенная яйцеклетка (зигота) развивается в эмбрион путем
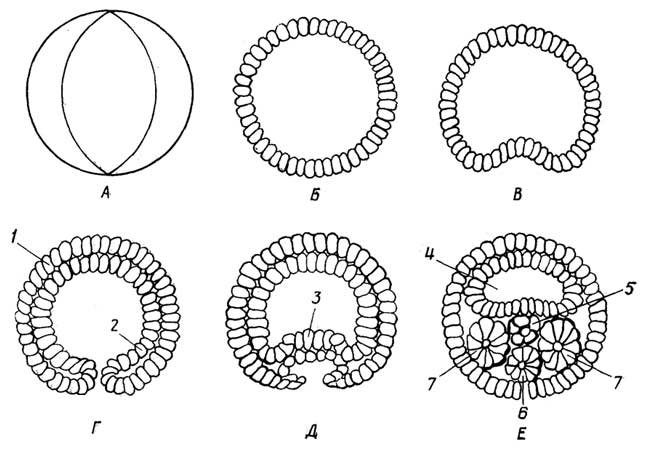
Рис. I.33.Развитие эмбриона у низших животных:
А- деление яйца;Б- бластула;В- начало образования гаструлы;Г-гаструла;Д- возникновение мезодермы;Е- начало образования внутренних органов.
1- эктодерма;2- энтодерма;3- мезодерма;4- полость первичной кишки,5- зачаток хорды;6- нервная трубка;7- зачаток внутренних органов
митотического деления (дробления), которое протекает через стадии бластулы и гаструлы (рис. I.33).Бластула- шарообразный зародыш с полостью (бластоцелем) внутри. Стенка бластулы представляет собой слой клеток, называемыйэктодермой. Гаструлаобразуется из бластулы. У низших животных это происходит путеминвагинации(впячивания внутрь) определенного участка
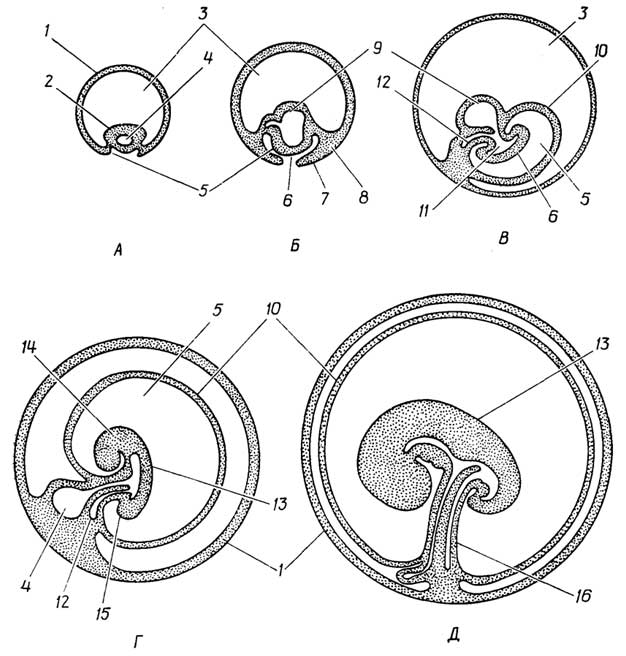
Рис. I.34.Развитие эмбриона у человека:
А- поздняя бластула в момент имплантации эмбриона в стенку матки, приблизительно на 8-10-й день развития;Б- гаструла через две недели;В-эмбрион на 20-й день развития;Г- эмбрион на 25-й день развития;Д- эмбрион через месяц.
1- оболочка хориона;2- плотный клеточный шарик;3- внеэмбриональная полость;4- желточный мешок;5- образование амниотической полости;6-зародышевая пластинка;7- эктодерма;8- мезодерма;9- энтодерма;10-оболочка амниона;11- полость первичной кишки;12- аллантоис;13- развивающийся эмбрион;14, 15- верхняя (головная) и нижняя части будущего плода;16- пупочный канатик
эктодермы до полного исчезновения бластоцеля. Образовавшаяся новая полость -гастроцель- открывается наружубластопоромименно там, где произошла инвагинация. Клетки внутреннего слоя гаструлы образуютэнтодерму.
Эмбрионы самых примитивных животных, таких как кишечно-полостные, состоят только из эктодермы и энтодермы. У эмбрионов всех других животных возникает различным путем третий слой клеток -мезодерма, - локализующийся между эктодермой и энтодермой.
Человеческий эмбрион (рис. I.34), после стадии бластулы называемыйбластоцистом, дифференцируется в полый шар, оболочка которого именуетсяхорион, и плотный шарик значительно меньшего размера, прикрепленный изнутри к хориону. Приблизительно на десятый день после оплодотворения эмбрион прикрепляется к стенке матки - происходитимплантация. На стадии гаструлы клетки плотного внутреннего шарика образуют две полости:амниотическую, окруженную эктодермой, ижелточный мешок, выстланный энтодермой. Между ними располагаются клеткизародышевого диска. Далее развитие идет таким образом, что амниотическая полость постепенно охватывает также растущий зародышевый диск, который, в свою очередь охватывает часть желточного мешка, формируя из другой его части длинную тонкую трубку. Из нее затем образуетсяпупочный канатик, соединяющий плод с хорионом, который в этом же месте с внешней стороны образует с тканью стенки маткиплаценту.
ТаблицаI.2
Эмбриональное происхождение некоторых органов
и тканей человека
Эктодерма |
Мезодерма |
Энтодерма |
Верхний слой кожи (эпидермис) и его производные, такие как кожные (потовые, сальные) железы, рецепторные структуры, волосы |
Внутренний слой (дерма) кожи |
Эпителий внутренней поверхности органов пищеварительной и дыхательной систем |
Нервная система, органы зрения, слуха |
Органы скелетной и мышечной систем |
Печень и поджелудочная железа |
Эпителий ротовой и носовой полостей; рецепторные клетки органов обоняния и вкуса |
Соединительная ткань и ее образования, такие, как кровь, кровеносные сосуды |
Эпителий внутренней поверхности органов мочеполовой системы |
Мозговой слой надпочечников |
Почки и кора надпочечников, внутренние половые органы |
Щитовидная и паращитовидная железы |
Зародышевые листки- это три типа зародышевой ткани: эктодерма, мезодерма и энтодерма. Из них в процессе развития плода формируются различные органы (табл. I.2). Некоторые из органов происходят из одного и того же типа ткани, в образований других принимают участие разные ткани.
§ 4.
Основные принципы
классификации животных
Как и в случае растений, основным правилом, позволяющим объединить животных в группы, являетсяобщность их строения, развития и размножения(рис. I.35).
Признаком, по которому всех животных делят на две большие группы: беспозвоночные и хордовые, являетсяналичие в теле животного так называемой хорды- полужесткого или вполне гибкого образования из хрящевой или костной ткани, идущего вдоль тела и выполняющего опорную функцию.
Беспозвоночныев свою очередь подразделяются на низших и высших. Низшие беспозвоночные имеют отдельные, еще несовершенные органы, которые можно условно объединить в системы.Высшиебеспозвоночные отличаются более высоким уровнем развития большинства систем, таких, как пищеварительная, кровеносная, нервная, мышечная, дыхательная, выделительная, половая, а также систем органов чувств и органов размножения.
Хордовыеподразделяются на организмы спримитивной хордойипозвоночные. Первые либо имеют недостаточно развитую хорду, либо она имеется только у личиночной формы, а у взрослого организма исчезает; они эволюционно являются связующим; звеном между беспозвоночными и позвоночными. Хорда последних представляет собой хрящевой (у миног, акул, скатов) или костный (у большинства животных) позвоночник.
Общие замечания
о классификации животных
Наиболее примитивные животные - этокишечнополостные. У них уже имеются все виды тканей, хотя органы весьма просты: пищеварительная полость с одним входом-выходом, щупальца, несложные половые органы (гонады). Мезодермы у них еще нет.
Уплоских свободноживущих червейобнаруживается мезодерма, появляются другие органы: органы чувств, мышечная глотка, выделительная система из специализированных клеток. Уплоских паразитирующих червей, таких, какленточные глисты, в силу специфики условий обитания хорошо развиты лишь органы размножения, а пищеварительная полость, рот отсутствуют, так как питательные вещества просто всасываются поверхностью тела.
Унемертин, круглых червейи других близких видов появляются системы органов. Имеется обычная пищеварительная система с раздельным входом-выходом, развиваются нервная и мышечная системы, у немертин - кровеносная с гемоглобином. Совершенствование мезодермы приводит к образованию целома, т. е. полости, заключенной между двумя "трубками" -
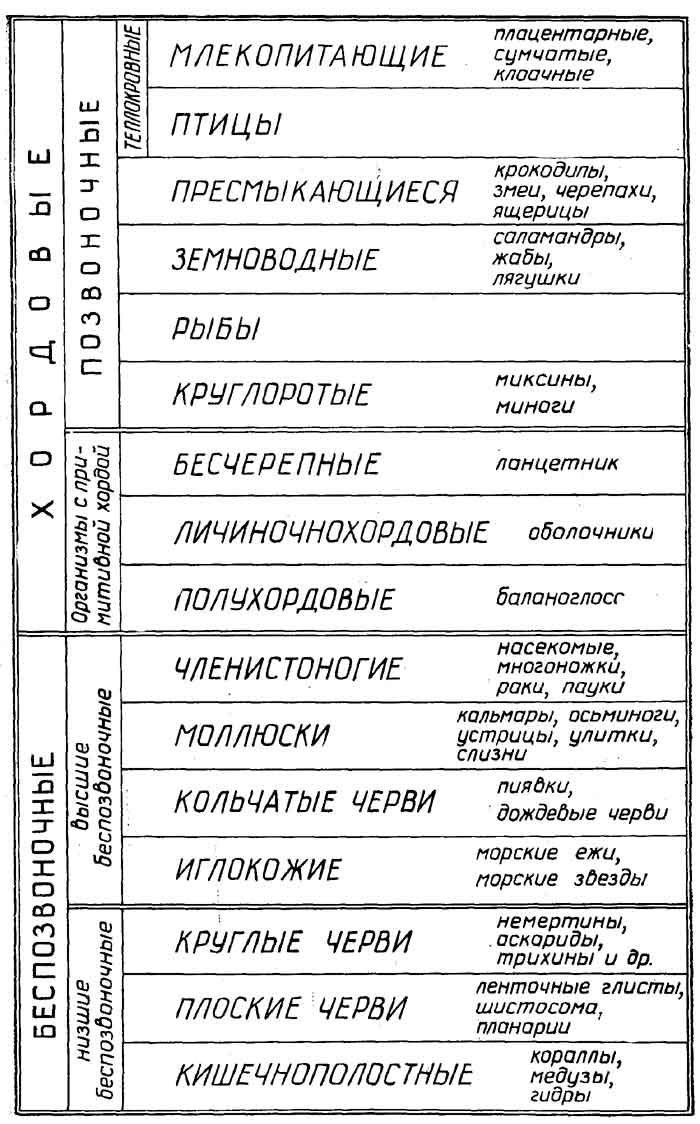
Рис. I.35.
Принципы классификации животных
|
эктодермой (внешней поверхностью) и энтодермой (пищеварительным каналом) и заполненной внутренними органами с омывающей их жидкостью.
Увысших беспозвоночныхсистемы органов претерпевают дальнейшее совершенствование, возникают органы дыхания, эндокринные "железы", внешний скелет. Считается, чтоэволюцияпроисходила от общего кишечнополостного предкадвумя ветвями. Одна из них - это плоские, круглые, кольчатые черви, моллюски и членистоногие, а другая шла через иглокожих к хордовым. Более дальний предок обеих ветвей животных вместе с предком растений и грибов происходит от древнейших: представителей протистов, а те, видимо, от прокариот (рис. I.36);.
Раздел В
КЛЕТКИ, ТКАНИ, ОРГАНЫ
В ИСКУССТВЕННЫХ УСЛОВИЯХ
Глава 6
ОСОБЕННОСТИ КУЛЬТИВИРОВАНИЯ
ЖИВОЙ МАТЕРИИ
§ 1.
Возможности культивирования клеток,
тканей, органовin vitro
и возникающие при этом проблемы
В настоящее время поддержание жизнедеятельности живой материиin vitroв течение длительного времени представляет собой проблему, успешно решенную для многих конкретных случаев.
Получение биомассы из одноклеточных прокариотических и эукариотических организмов широко используется как в лабораторных, так и в промышленных условиях.
Несколько более трудным технически, но также вполне преодолимым, является культивированиеin vitro растительныхиживотных тканей. Примером первого случая может служить успешное культивирование культуры ткани корня женьшеня или получение целого растения моркови из клеток флоэмы. Пример второго случая - культивирование эпителиальной ткани почек обезьян для получения вакцины против вируса полиомиелита. Техника культивирования тканей в настоящее время позволяет поддерживать их жизнедеятельность очень долго (десятки лет).
Еще более сложным является поддержание в течение определенного временижизнедеятельности органов, изолированных от организма. Здесь надо в первую очередь решать проблемы обеспечения тканей и органов питанием.
Что касаетсярастений, то достаточно поместить срезы веток в воду, поскольку поступление питательного раствора (воды и растворенных в ней минеральных веществ) в органы растения обеспечивается в основном за счет осмотических сил.Отдельные органы животныхв условиях стерильности и пониженной температуры удается сохранять жизнеспособными в течение многих часов и даже суток. Длительность поддержания жизнедеятельности изолированных органов животных зависит не только от обеспеченности их клеток питанием, но и от того, насколько хорошо обеспечено удаление из органов продуктов их жизнедеятельности.
§ 2.
Особенности
культивирования растительных
и животных клеток
Выявляются две особенности выращивания определенных клеток или образцов тканей организма изолированно от других тканей и органов.
Первая особенность -слабый рост или даже полное его отсутствиесвязано с тем, что развитие, т. е. пролиферация и дифференцирование, клеток определенного вида в организме обычно регулируется не только веществами, которые они сами вырабатывают, но также продуктами деятельности клеток других тканей и органов. Например, пролиферация миелоидных стволовых клеток (предшественников эритроцитов, тромбоцитов, макрофагов и тучных клеток) происходит под действиембелковых факторовроста, выделяемыхфибробластамисоединительной ткани.
Неплохо размножаются в искусственных условиях лишьэмбриональные и раковые клетки. Рост первых обусловлен, видимо, тем, что и в природных условиях их развитие до определенного этапа идет за счет внутренних резервов, когда они не нуждаются в притоке питательных веществ и регуляторов роста извне. Вторые клетки сами по себе отличаются безудержным ростом, который сохраняется и в условияхin vitro. Считается, что с превращением нормальной клетки в раковую осуществляется перестройка ядерного материала, при которой клетки утрачивают способность своевременно заканчивать рост после определенного числа делений. Другими словами, раковые клетки остаются неопределенно долго в стадии пролиферации и не переходят в конечную стадию дифференцирования. У них также отсутствуетконтактное торможение, под влиянием которого деление нормальной клетки прекращается, если она начинает контактировать с себе подобными.
Поддерживать в культуре нервные клетки труднее всего, особенно если они взяты у взрослых организмов. Однако можно индуцировать рост их нервных отростков. Это делается с помощьюбелковых факторов роста нервов, которые синтезируются многими тканями, но выделяются обычно из подчелюстных слюнных желез, из некоторых видов раковых клеток, из змеиного яда.
Вторая особенность -быстрая утрата способности к дифференцированию. Клетки какой-либо ткани при выращивании в культуре трансформируются в клетки одного из трех видов: эпителиоциты, фибробласты, амёбоциты.Эпителиоцитыобразуются при культивировании эпителиальных тканей как эктодермального, так и энтодермального происхождения.Фибробласты(механоциты) получаются из культуры мышечной ткани и различных видов соединительной ткани.Амёбоциты, как и робласты, имеют мезодермальное происхождение. Они возникают в культуре макрофагов и микрофагов.
Не трансформируются в культуре нервные клетки и лимфоциты.
§ 3.
Клонирование -
метод получения культуры
генетически идентичных клеток
Клон- колония клеток, полученных делением из одной-единственной клетки.Клонирование- техника выращивания клона клеток; применяется, когда необходимо получить культуругенетически идентичных клеток.
§ 4.
Получение гибридом -
способ выращивания культуры клеток
с заданными свойствами
Гибридома- клетка, полученная слиянием двух клеток совершенно разного происхождения, например мыши и человека.Слияние клетокв культуре достигается путем воздействия на клеточные оболочки химическими или физическими методами (электрослияние).Метод гибридомприменяется в том случае, когда необходимо в одной клетке объединить свойства двух клеток разного происхождения, как например свойство производить защитные белковые антитела у лимфоцитов и свойство хорошо расти в культуре (раковые клетки).
Часть II
СТАТИЧЕСКАЯ БИОХИМИЯ
Раздел А
БЕЛКИ -
ОСНОВНОЙ МАТЕРИАЛ КЛЕТКИ
Белки составляют до половины и более сухой массы животной клетки.
Глава 7
ЭЛЕМЕНТНЫЙ СОСТАВ
И ПЕРВИЧНАЯ СТРУКТУРА БЕЛКОВ
Состав белков по химическим элементам: С, О, Н, N, иногда S. В белках встречаются также элементы Fe, Cu, Zn и др. Но не химические элементы являются "буквами алфавита", из которых складывается все многообразие "слов" - молекул белков. Такими структурными элементами белков природа выбрала простые соединения - а-аминокислоты.
§ 1.
Структурные элементы белков - аминокислоты
Все белки состоят в основном из 20 α-аминокислот (строго говоря, одна из них, пролин, - α-аминокислота). Аминокислоты принято делить на три группы в зависимости от состояния аминокислоты при нейтральных рН (рис. II.1). Кроме перечисленных в рис. II.1 обычных аминокислот в белках встречаются:"необычные" аминокислоты- производные обычных аминокислот (рис. II.2) ипростетические группы, которые по составу и структуре могут быть очень простыми, например атом металла, фосфатные группы, и довольно сложными, например липиды, полисахариды, нуклеиновые кислоты.

Рис. II.1Аминокислоты белков при рН 7. В скобках: численные значения рК (депротонизации) соответствующих групп и условные обозначения.
§ 2.
Простые и сложные белки
По составу белки делят на простые и сложные.Простые белкисостоят только из аминокислотных остатков.Сложные белкиотличаются от простых наличием простетической группы.
ТаблицаII.1
Простепгические группы различных
сложных белков
Название сложных белков |
Простетическая группа |
Металлопротеины |
Атомы металлов |
Сложный белок, утративший простетическую группу, называютапобелком. Сложные белки подразделяют на классы (табл. II. 1) в зависимости от состава и структуры простетической группы.
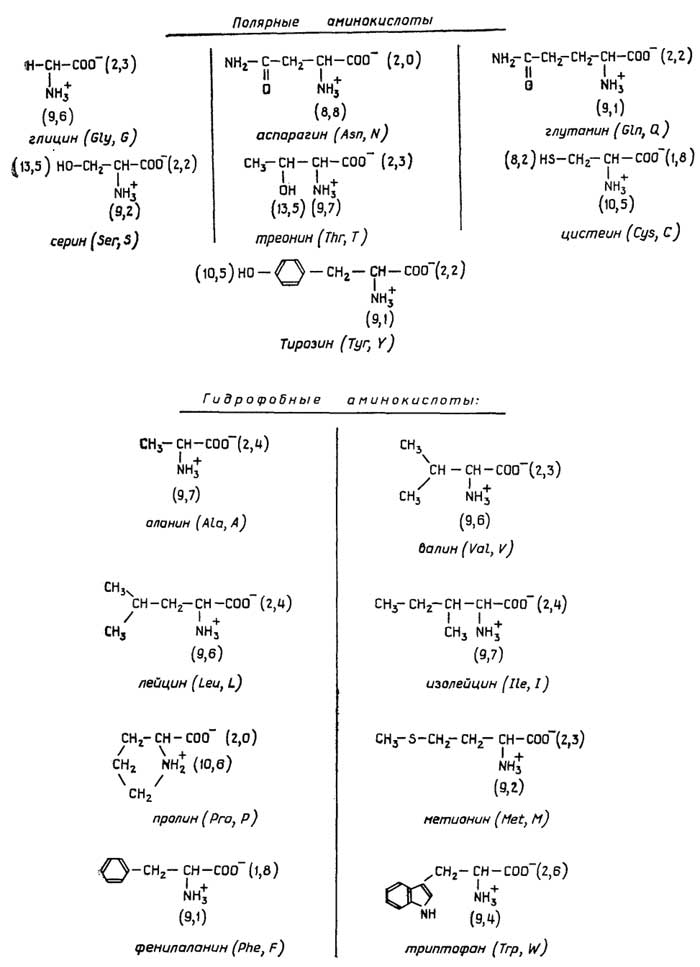
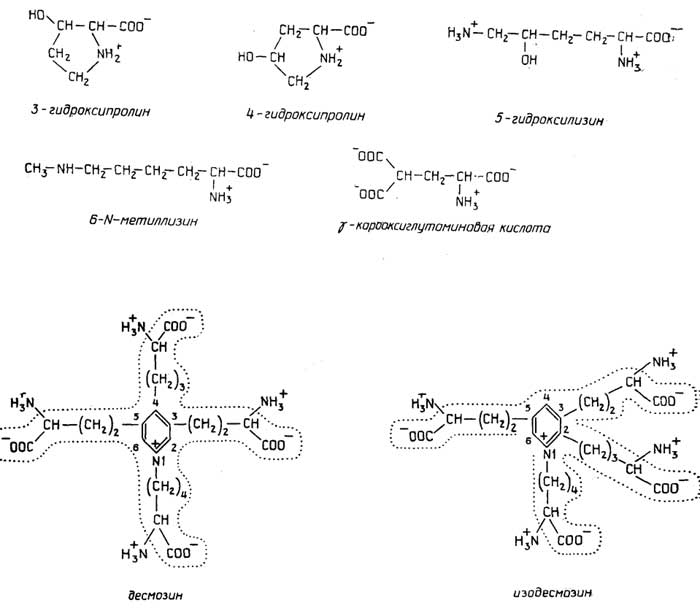
Рис. II.2.Некоторые "необычные" аминокислоты белков
§ 3.
Свойства аминокислот
Из данных табл. II.2 видно, что при нейтральных значениях рН аминокислоты находятся в состояниицвиттериона, т. е. амино- и иминогруппы заряжены положительно, а карбоксильные группы - отрицательно. Отсюда понятно, почему молекулы аминокислот имеют большие дипольные моменты, а их растворы - высокие диэлектрические постоянные. Относительно высокие температуры плавления аминокислот свидетельствуют о том, что их кристаллы обладают ионной решеткой.
Ароматические аминокислотыпоглощают ультрафиолет, причем лучше всех - триптофан (280 нм), несколько хуже - тирозин (280 нм) и еще слабее - фенилаланин (260 нм).
Все аминокислоты, за исключением глицина, обладают однимхиральным центром(асимметричным атомом углерода).
ТаблицаII.2
рКaразличных аминокислотных групп
Ионизируемая группа аминокислоты |
pKa |
α-Карбоксильная группа |
2 |
Две аминокислоты - треонин и изолейцин - имеют еще и второй хиральный центр. Чтобы различать стереоизомеры, условились за эталон конфигурации считатьL- иD-глицеральдегид (рис.II.3).
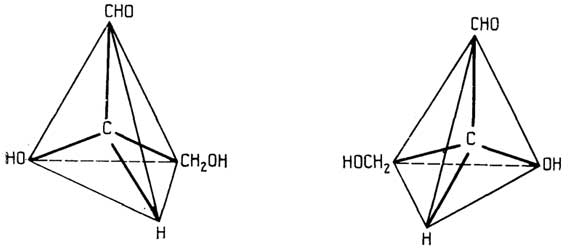
Рис. II.3. L-Глицеральдегид (слева) иD-глицеральдегид (справа)
В соответствии с этим аминокислоты также имеютL- иD-стереоизомеры (рис. II.4). Соответствующие проекционные формулы
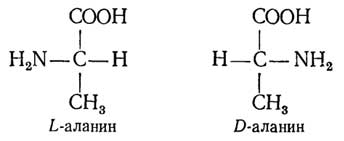
Эти формулы отражают на плоскости то, что видит наблюдатель, рассматривающий стереоизомеры в направлении, указанном стрелками на рис. II.4.DL-системаобозначения стереоизомеров является общепринятой для аминокислот и Сахаров. Более общаяRS-системав большинстве случаев совпадает сDL-системой
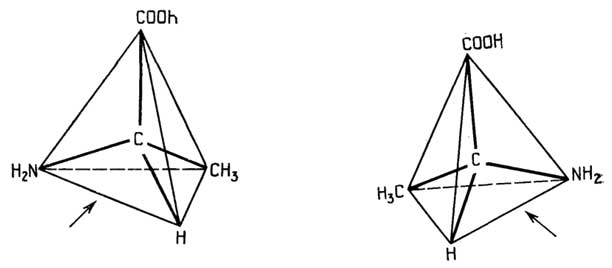
Рис. II.4. L-Аланин (слева) иD-аланин (справа)
(особенно для аминокислот и Сахаров). Все природные белки и пептиды, синтезируемые обычно на рибосомах, состоят изL-аминокислот.
§ 4.
Основа структуры белков -
полипептидная цепь
Аминокислоты с помощью пептидной связи образуют полимерные цепочки:
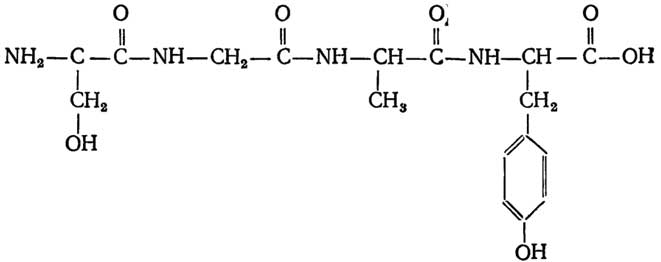
При сокращенной записи последовательности аминокислотных остатков слева пишут N-конец, а справа - С-конец.
Пептидная связь характеризуется высокой степенью стабилизации за счет резонанса:
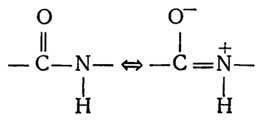
Это приводит к тому, что: 1) иминогруппа не способна присоединять или отдавать протон в области рН от 0 до 14; 2) связь, не будучи чисто одинарной, является "жесткой", т. е. невозможно свободное вращение вокруг нее.
Пространственно атомы пептидной связи расположены почти в одной плоскости, причем атомы, связанные с азотом, образуют пирамиду с тупой вершиной - азотом (рис. II.5). Атомы
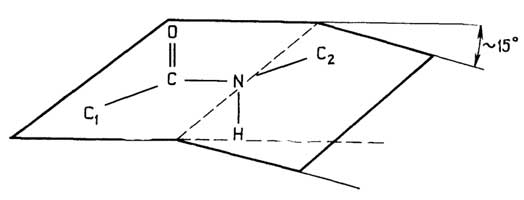
Рис. II.5.Пространственное расположение атомов в пептидной связи
кислорода и водорода чаще всего находятся втранс-положении, но встречается и несколько менее стабильнаяцис-пептидная связь (с участием пролина).
За счет пептидной связи в организме образуются как простые пептиды (ди-, три-, олиго-), так и полипептиды, т. е. белки, у которых число аминокислотных остатков бывает от пяти десятков до нескольких тысяч. Молекула белка может состоять из одной или нескольких полипептидных цепей. Отдельная полипептидная цепь содержит от нескольких десятков до нескольких сотен аминокислотных остатков. Пептидные цепочки не разветвляются, но могут быть ковалентно сшиты внутри себя или между собой за счет образованиядисульфидной связимежду пространственно сближенными SH-группами цистеинов:
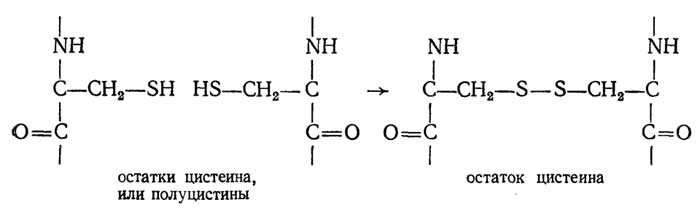
Последовательность аминокислотных остатков в полипептидной цепочке с учетом "цистиновых связок" составляет первичную структуру белков. Обратим внимание на то, что она держится наковалентных связях.
Глава 8
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ БЕЛКОВ
По пространственному строению белки делягна глобулярные и фибриллярные.
Глобулярные белкисостоят из одной полипептидной цепи или нескольких, плотно свернутых за счет нековалентных, а часто и ковалентных связей в компактную частицу, называемую глобулой. Они обычно хорошо растворимы в воде. Ферменты, антитела, многие гормоны, а также белки-переносчики, например миоглобин, гемоглобин (переносчики кислорода), сывороточный альбумин (переносчик жирных кислот) - все это глобулярные белки.
Фибриллярные белкисостоят из вытянутых или спирализованных полипептидных цепей, расположенных параллельно и удерживаемых вместе в основном за счет многочисленных нековалентных, а иногда и ковалентных связей. Полипептидные цепи объединены в волокна (фибриллы). Такие белки не растворимы в воде. Из них построены, например волосы, ногти, перья (кератины), сухожилия (коллаген), связки (эластин), шелк, паутина (фиброин).
Очевидны различия как между структурой глобулярных и фибриллярных белков, так и между их свойствами (растворимость и др.).
§ 1.
Первичная структура определяет
пространственное строение белка
Закономерность, отраженную в заголовке, экспериментально подтвердил К. Анфинсен. Он разрушилнативнуютрехмерную структуру белка рибонуклеазы (провелденатурацию), добавив в раствор белка мочевину и β-меркаптоэтанол. Затем, удалив диализом денатурирующие агенты, вновь получил активный белок (провелренатурацию). Таким образом, полипептидная цепь свертывается в "нативную" структуру самопроизвольно, по причинам, связанным со строением самой полипептидной цепи.
Причин, по которым данная полипептидная цепь принимает единственную трехмерную структуру -нативную конформацию, несколько. В полипептидной цепочке (рис. II.6) мы наблюдаем
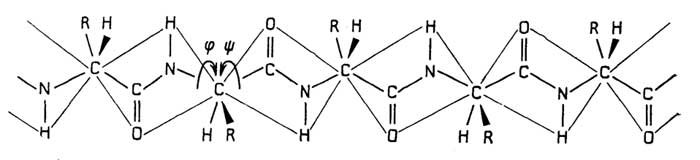
Рис. II.6.Чередование "жесткой" пептидной связи и одинарных связей в полипептидной цепочке
повторное чередование связей: пептидная - две одинарные. Теоретически допустимо свободное вращение плоскостей, в которых лежат "жесткие" пептидные связи, вокруг одинарных связей. Отклонения их от плоскостей рисунка определяется углами ф и г|). Однако реально на возможные значения ф и о|з накладывается целый ряд ограничений.
Ограничения, связанные с взаимодействиями в самой цепи
Стерические препятствия. Одновременное свободное вращение вокруг разных одинарных связей невозможно, в чем можно убедиться, использовав молекулярные модели. Наибольшим числом степеней свободы обладает полиглицин. Увеличение размеров боковых группRуменьшает возможность свободного вращения вокруг одинарных связей.
Дипольные взаимодействия. Плоскость пептидной связи представляет собой диполь, который, конечно, предпочитает расположиться относительно других диполей определенным образом, особенно если это расположение закрепляется образованием связей, напримерводородных.
Взаимодействие боковых группR. Положительный и отрицательный заряды или гидрофобность соседних боковых групп препятствуют или способствуют определенному пространственному расположению пептидных плоскостей.
Ограничения, связанные с взаимодействиями цепи
с окружающей средой
(с растворителем или другими соседними цепями):
образованиеводородныхсвязей;
гидрофобныевзаимодействия;
ионныевзаимодействия;
образованиецистиновыхмостиков.
Все эти ограничения приводят к тому, что полипептидная цепь принимаеттолькоодну нативную конформацию.
Уровни пространственного строения белков
Пространственное строение белков может быть: неупорядоченным, т. е. статистический клубок, как у денатурированного белка, и упорядоченным, как у нативного белка. В последнем случае принято рассматривать:
вторичную структуру - пространственную организацию соседних по цепи аминокислотных остатков;
третичную структуру - пространственную организацию удаленных по цепи аминокислотных остатков;
четвертичную структуру - пространственное расположение в единой молекуле отдельных полипептидных цепей, каждая из которых свернута в свою глобулу. Такие глобулы называютпротомерами, илисубъединицами. Связь между ними в молекуле белка обеспечиваетсянековалентными силами. Белки, молекулы которых состоят из нескольких субъединиц (протомеров), называютолигомерными.
Третичную и четвертичную структуры принято относить к глобулярным белкам. У фибриллярных белков граница между уровнями пространственного строения в определенной степени условна.
§ 2.
Вторичная структура белков
Первую успешную попытку построить для полипептидной цепи регулярную вторичную структуру сделали Полинг и Кори в 1951 г. На основании сравнения возможных вариантов пространственного расположения молекулярных моделей полипептидов они пришли к выводу о существовании их в двух формах: α-спирали и β-складчатого слоя, что и было экспериментально подтверждено через несколько лет. Затем были обнаружены в глобулярных белках короткие отрезки других спиралей, которые были названы соответственно 310-, π- и αII-спираль.
Типы вторичных структур
Праваяα-спираль- наиболее распространенная в белках спиральная структура полипептидных цепей изL-аминокислот (рис. II.7). Пространственное расположение в ней аминокислотных остатков обусловливает максимально стабильную структуру. Стабилизация достигается за счет того, что витки спирали "сшиты" водородными связями, а также взаимодействием диполей. Число водородных связей максимально. Их направленность почти параллельна продольной оси α-спирали. На виток приходится 3,6 аминокислотного остатка, а все диполи пептидных связей направлены вниз. Число атомов в цикле, образуемом водородной связью, равно 13. Водородная связь возникает между СО-группойn-го остатка и NH-группой (n+ 4)-го остатка (рис. II.8), т. е. взаимодействие сближенных и направленных в одну сторону диполей пептидных связей имеет место через каждые два диполя.
310-Спираль(рис. II.9) - это правая, более закрученная, чем α-спираль. Приятое обозначение 310связано с тем, что спираль характеризуется тремя остатками на виток и 10 атомами в цикле, образованном водородной связью. Последняя возникает между СО-группойn-гo остатка и NH-группой (n+ 3)-го остатка (рис. II.10), т. е. в данной спирали диполи сближены и взаимодействуют между собой через один.
π-Спираль(рис. II.11) - для нее характерно 4,4-аминокислотных остатка на виток и диаметр больший, чем у α-спирали. При образовании водородной связи возникает цикл из 16 атомов (рис. II.12). Таким образом, π-спираль может быть обозначена
Рис. II.7.Схема правой α-спирали. Пунктирными линиями обозначены водородные связи, стрелками - диполи пептидных связей. Точками обозначены аминокислотные остатки, находящиеся на невидимой стороне цилиндра |
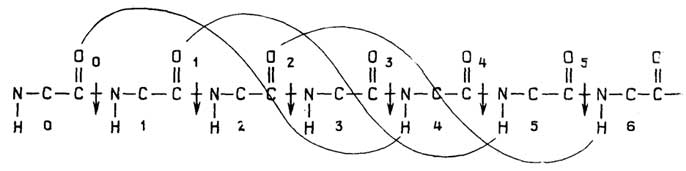
Рис. II.8.Образование водородных связей в α-спирали. Для наглядности пронумерованы диполи пептидных связей (вверху) и аминокислотные остатки (внизу);
|
Рис. II.9.Схема правой 310-спирали. Водородные связи обозначены пунктирными линиями, диполи пептидных связей - стрелками. Точками обозначены аминокислотные остатки, находящиеся на невидимой стороне цилиндра |
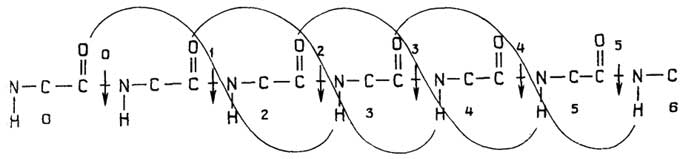
Рис. II.10.Образование водородных связей в 310-спирали
Рис. II.11.Схема правой π-спирали. Водородные связи обозначены пунктирными линиями, диполи - стрелками. Точками обозначены аминокислотные остатки, находящиеся на невидимой стороне цилиндра |
|
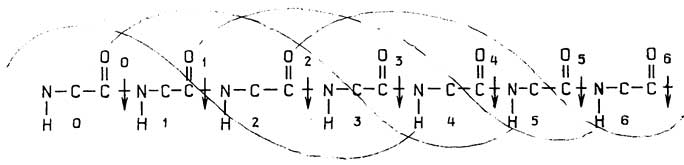
Рис. II.12.Образование водородных связей в π-спиряли
|
Рис. II.13.Схема правой αII-спирали. Пунктиром обозначены водородные связи, стрелками - диполи пептидных связей. Точки - аминокислотные остатки на невидимой стороне цилиндра |
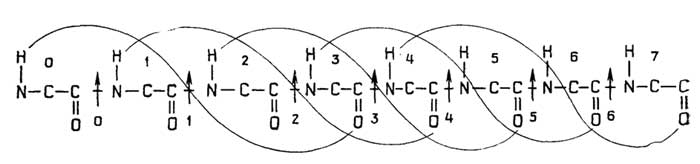
Рис. II.14.Образование водородных связей αII-спирали
как 4,416-спираль1. Водородную связь дают СО-группаn-го остатка с NH-группой (n+ 5)-го остатка, а сближаются и притягиваются диполи друг к другу через три, т. е. 1-й к 5-му, 2-й к 6-му и т. д.
|
αII-Спираль(рис. II.13) имеет 4 остатка на виток в цикле с водородной связью 14 атомов (рис. II.14). Водородная связь образуется между NH-группойn-го остатка и СО-группой (n+ 3)-го остатка, а диполи взаимодействуют друг с другом через три.
Сравнивая αII-спираль с уже перечисленными, можно увидеть характерные отличия:
все диполи направлены вверх;
водородные связи образуются междуначалом(NH-группой)n-го остатка и концом (СО-группой (п+ 3)-го остатка2.
Спираль коллагена(рис. II.15) встречается только в коллагенах - самых распространенных белках человека и высших животных. Они являются основой сухожилий, хрящей, кожи, костей и др. Полипептидная цепь коллагена образует ломаную левозакрученную и довольно растянутую спираль с тремя аминокислотными остатками на виток. Внутрице-почечных водородных связей в спирали нет. Стабилизация достигается за счет межцепочечных ковалентных связей, а также водородных связей и гидрофобных взаимодействий (см. с. 121). Полипептидная цепь содержит примерно 1000 остатков, м. м. 100000.
Рис. II.15.Схема спирали коллагена. Кружочками обозначены аминокислотные остатки, образующие левую спираль, которая в свою очередь закручивается в правую суперспираль
Особенности состава коллагенов:
треть состава - глицин;
пятая часть - пролин, а также его гидроксипроизводные;
остальные аминокислоты имеются в небольших количествах и в неполном наборе;
наличие редкой аминокислоты 5-гидроксилизина.
Точная структураспирали эластина- основного белка связок костей - неизвестна. Она содержит около 800 остатков; м. м. 72000.
Особенности состава цепи эластина:
треть состава - глицин;
много пролина (восьмая часть), но мало гидроксипролинов;
половина состава - гидрофобные алифатические аминокислотыAla, Val, Leu;
остальные аминокислоты содержатся в небольших количествах и в неполном наборе;
часто встречаются повторяющиеся последовательности, такие, какPro-Gly-Val-Gly-Val, Lys-Ala-Ala-Lys.
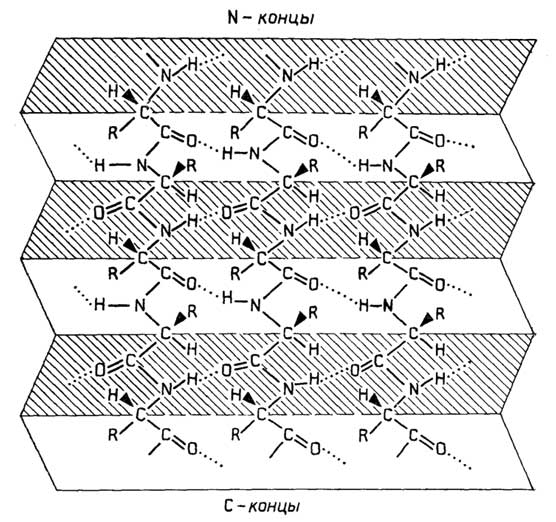
Рис. II.16.Параллельный β-складчатый слой. N-концы цепей - вверху, С-концы цепей - внизу
β-Складчатый слойобразуется из довольно вытянутых полипептидных цепей. Бывает двух видов:
параллельный - если направление полипептидных цепей одинаково (рис. II.16);
антипараллельный - если полипептидные цепи направлены навстречу друг другу (рис. II.17).
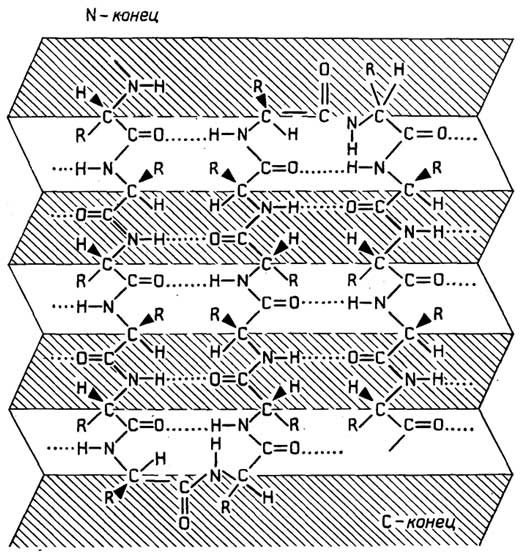
Рис. II.17.Антипараллельный β-складчатый слой. Одна цепь.
Ее N-конец - слева вверху, С-конец - справа внизу. Цепь
поворачивает, образуя два β-изгиба
Стабилизацияβ-складчатых слоев достигается за счет образованиямежцепочечных водородных связей, в которых принимают участие все пептидные связи.
Особенности β-складчатых слоев:
цепи вытянуты, но не полностью, поэтому образуется не плоскость, а "гофрированная" структура;
водородные связи лежат в плоскостях складок;
R-группы располагаются рядами, поочередно выше и ниже плоскости рисунка;
антипараллельный β-складчатый слой может быть образован одной полипептидной цепью, которая, поворачивая, образует β-изгибы.
Вторичная структура определяется первичной. Об этом свидетельствуют данные рентгеноструктурного анализа синтетических полипептидов, а также белков с известной аминокислотной последовательностью. На основании этих данных 20 аминокислот в соответствии с их склонностью к образованию спиралей или β-структур можно достаточно строго
ТаблицаII.3
Склонность L-аминокислот белков к образованию спиралей
иβ-структур
Спирали |
β-Структуры |
|
Активно образуют |
Glu, Ala, Leu |
Val, He, Met |
Склонны к образованию |
His, Gin, Val, Phe, Trp, Met |
Thr, Tyr, Cus, Gin, Leu, Trp, Phe |
Слабо образуют |
Lys, Ile |
Ala |
Безразличны к данной структуре |
Asp, Arg, Ser, Thr, Cys |
Asp, Arg, Gly |
Противодействуют образованию |
Asn, Tyr |
His, Lys, Ser, Asn, Pro |
Разрушают |
Gly, Pro |
Glu |
разделить на несколько групп (табл. II.3). Использование этих данных для теоретического предсказания вторичной структуры в ряде случаев дало неплохие результаты.
§ 3.
Третичная структура
глобулярных белков
Анализ данных по пространственному строению белков с известной структурой позволяет сделать вывод о том, что глобулярные белки по третичной структуре можно разделить на пять групп.
Типы построения глобул
α-Белки - белки с большим количеством спиральных структур, напримермиоглобин- кислородсвязывающий белок мышц. Запасенный кислород он высвобождает по мере необходимости для поддержания метаболизма. Его выделяют обычно из мышц ныряющих животных - китов, тюленей. Миоглобин был первым глобулярным белком, у которого методом рентгеноструктурного анализа была выяснена третичная структура (рис. II.18). Молекула миоглобина состоит из одной полипептидной цепи со 153 остатками, его молекулярная масса 16700.
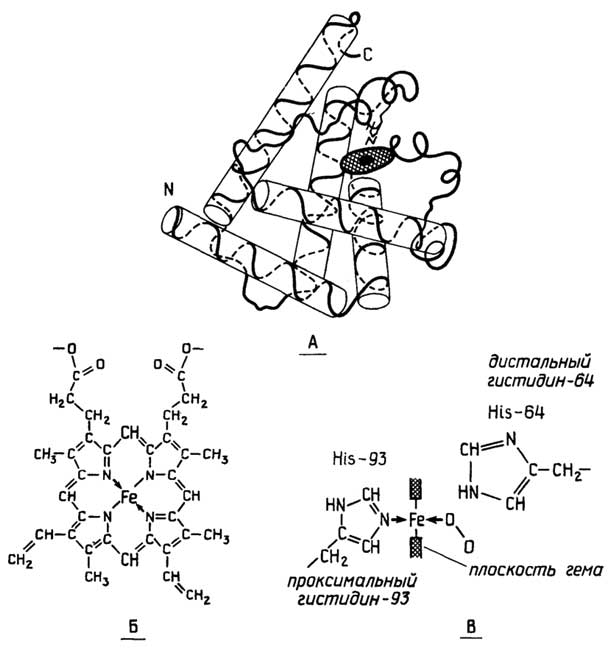
Рис. II.18.Миоглобин:
А - схема третичной структуры миоглобина; заштрихованная часть - гем, темное пятно в нем - атом Fe; Б - структура тема (Fe-протопорфирин IX); В - оксимиоглобин
Особенности структуры миоглобина:
около 75% его полипептидной цепи находится в виде α-спирали, имеется несколько спиральных участков;
между спиральными участками находятся аминокислотные участки, нарушающие α-спираль, -Pro, "заряженные" -Asp, Lys, Arg, а также способные образовывать водородные связи с карбоксильными группамиSer, Thr, Туr;
внутри молекулы спрятаны гидрофобные остатки, снаружи располагаются полярные и "заряженные" остатки;
внутри молекулы могут поместиться лишь четыре молекулы воды;
простетическая группа гем связана с апобелком нековалентно.
Рис. II.19.Схема третичной структуры субъединичной глобулы конканавалина А, состоящей из антипараллельных β-слоев. Заметно скручивание β-слоев в виде пропеллера
Рис. II.20.Схема третичной структуры субъединичной глобулы супероксиддисмутазы из эритроцитов быка
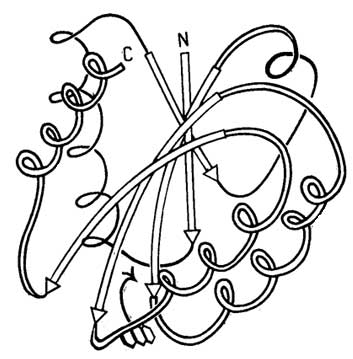
Рис. II.21.Схема третичной структуры глобулы флаводоксина. Параллельный β-слой, над которым расположены 2 α-спирали, а под ним - 3. Между двумя β-участками находится нековалентно связанный флавинмононуклеотид (ФМН) (см. рис. II.19)
β-Белки- их глобулы состоят из двух и более β-складчатых слоев. Такие белки довольно редки. В качестве примера можно привести олигомерный белок растительного происхожденияконканавалин А. Молекула его состоит из 4 субъединиц, каждая представляет собой полипептид из 237 остатков с молекулярной массой 27500 (рис. II.19). Конканавалин А относится к группе белков, объединяемых общим названиемлектины. Эти белки отличаются способностью специфично взаимодействовать с
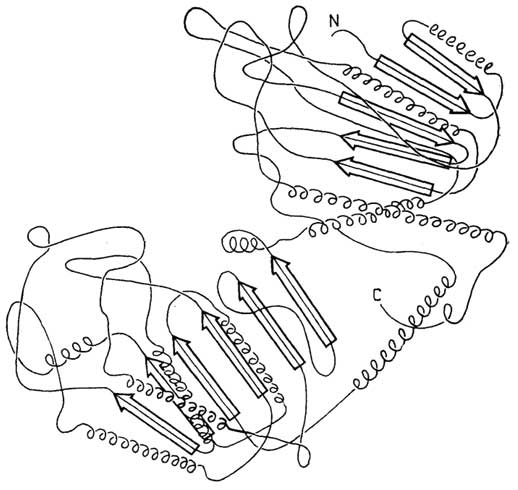
Рис. II.22.Схема третичной структуры фосфоглицераткиназы.
Участки α-спиралей находятся снизу и сверху β-слоев
поверхностью клеток, вызывая, например, склеивание (агглютинацию) последних. Сам конканавалин А агглютинирует раковые клетки, а также способен вызывать пролиферацию лимфоцитов.
Другим примером β-белка являетсясупероксиддисмутаза(СОД) эритроцитов быка. Молекула ее состоит из 2 субъединиц, каждая из которых представляет собой полипептид из 151 остатка, с одним цистиновым мостиком. Структура субъединицы СОД также основана на антипараллельном β-слое (рис. II.20), однако в данном случае он свернут в виде бочонка.
α/β-Белки- полипептидная цепь состоит из чередующихся α-спиралей и вытянутых β-участков цепи, сгруппированных в один β-слой, как например в бактериальномфлаводоксинеили
фосфоглицераткиназе. Молекула флаводоксина содержит 138 остатков. Пять участков цепи образуют параллельный β-слой, скрученный в виде пропеллера, с каждой стороны которого расположены α-спирали (рис. II.21). Молекула фосфоглицераткиназы состоит из 355 остатков и представляет собой два β-слоя с многочисленными спиралями с обеих сторон (рис. II.22).
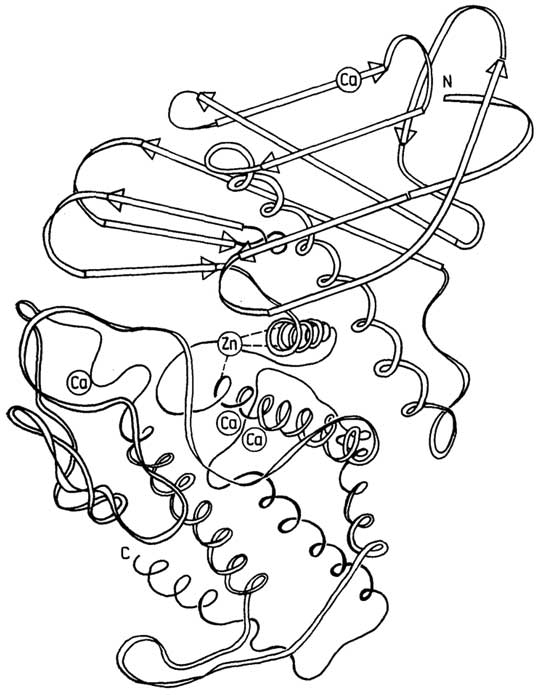
Рис. II.23.Схема третичной структуры молекулы термолизина. β-Складчатый слой состоит из 10 параллельных и антипараллельных цепей. Видны 7 спиральных участков
(α + β)-Белки- полипептидную цепь можно разделить на участки, целиком состоящие из спиралей, и на участки, имеющие форму β-складчатого слоя. Такая структура существует в молекулетермолизина(рис. II.23), полипептидная цепь которого имеет 316 остатков.
(без β, β)-Белки практически не имеют спиральных и складчатых структур. Примером может служитьферредоксинизРерtococcus aerogenes(рис. II.24). У таких белков на первый взгляд полипептидная цепь свертывается в глобулу в виде беспорядочного клубка, однако это не так. При сворачивании глобулы действуют те же силы, что и в других белках.
Домены
Молекулярные глобулы (или субъединичные глобулы) иногда состоят из ясно различимых долей, как это видно на примерах фосфоглицераткиназы (см. рис. II.22) и термолизина (см. рис. II.23). Такие доли, связанные между собой ковалентно, принято называтьдоменами. Домены - особенность третичной структуры некоторых глобулярных белков.
Сравнение третичных структур ряда белков привело к интересным выводам. Во-первых, белки с близкой функцией, но с разными первичной, вторичной, третичной и четвертичной
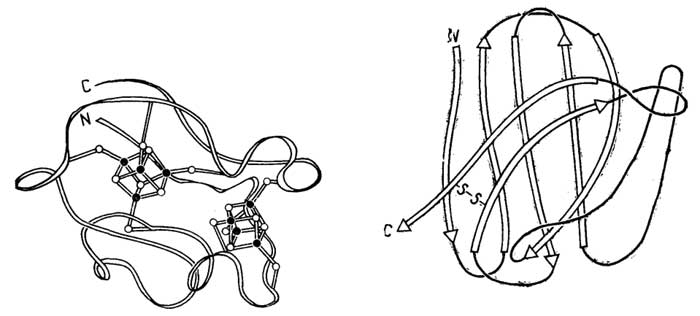 G">
G">
Рис. II.24.Схема третичной структуры белка ферродоксина изPeptococcus aerogenes. Темные кружочки - атомы железа, светлые кружочки - атомы серы
Рис. II.25.Схема третичной структуры вариабельного домена тяжелой цепи иммуноглобулинаG
структурами часто содержат сходные домены. Например, многие дегидрогеназы, для функционирования которых необходим никотинамидадениндинуклеотид (НАД) (см. рис. II.18), имеют в своем составе НАД-связывающий домен. Во-вторых, белки с разными функциями и разным строением иногда также содержат структурно подобные домены. Например, один из доменов (вариабельный) тяжелой цепи иммуноглобулинаG(рис. II.25) по пространственному строению удивительно напоминает субъединичную глобулу супероксиддисмутазы из эритроцитов быка (см. рис. II.20).
Природа сил, стабилизирующих третичную
структуру белков
Основную роль в стабилизации, видимо, играютгидрофобные взаимодействиябоковых групп аминокислотных остатков, которые, стремясь избежать термодинамически невыгодного контакта с молекулами воды, группируются вместе внутри глобулы. Не меньшую роль играютводородные связи. Они возникают как между боковыми группами аминокислотных остатков, так и между NH- и СО-группами пептидных связей. Существенно такжеэлектростатическое притяжениепротивоположных зарядов боковых групп, например СОО-и NH3+. Наиболее прочные связи, хотя и существующие далеко не во всех белках, представляют собойковалентные цистиновые мостики.
Воздействия,
вызывающие денатурацию белка
Ослабление одного из перечисленных выше взаимодействий (или нескольких), а также разрыв S - S-мостиков могут привести к разворачиванию полипептидной цепи, т. е. к нарушению нативной третичной структуры белка -денатурации. Денатурацию вызывают:
экстремальные значения рН, нарушающие электростатические взаимодействия и разрушающие водородные связи;
температура, разрывающая прежде всего слабые некова-лентные связи;
высокие концентрации солей также нарушают электростатические взаимодействия и разрушают водородные связи;
мочевина, гуанидин, органические растворители, разрывающие гидрофобные, а также водородные связи;
сульфгидрильные соединения, такие, как β-меркаптоэтанол, другие восстановители, например NaBH4, а также окислители, например надмуравьиная кислота, разрывающие цистиновые мостики (последние не всегда доступны, если спрятаны внутри глобулы).
Денатурация может бытьнеобратимойилиобратимой. Необратимость часто можно объяснить кинетическими причинами.
Образование нативной структуры
Образование нативной структуры -кооперативный процесс. Само образование α-спиралитермодинамически выгодно, если образуется достаточно много витков, "сшитых"водородными связями. При образовании одного витка необходимо преодолеть довольно высокий энтропийный барьер, связанный с тем, что одна водородная "сшивка" влечет за собой потерю свободы вращения шести связей, однако каждая последующая соседняя "сшивка" лишает свободы вращения уже только две связи (рис. II.26). Таким образом, в уравнении ∆G= ∆H - T∆Sпри образовании α-спирали отрицательное значение ∆Sс избытком компенсируется тоже отрицательным значением ∆Hобразования водородных связей, и чем больше их будет, тем термодинамически выгодней будет образование α-спирали. Немаловажный вклад в стабилизацию спиралей (а точнее, в отрицательное значение ∆H) вносят идиполь-дипольные взаимодействия(см. рис. II.7, II.9, II.11, II.13). Подсчитано, что наиболее полно они начинают проявляться в спирали из десяти остатков.
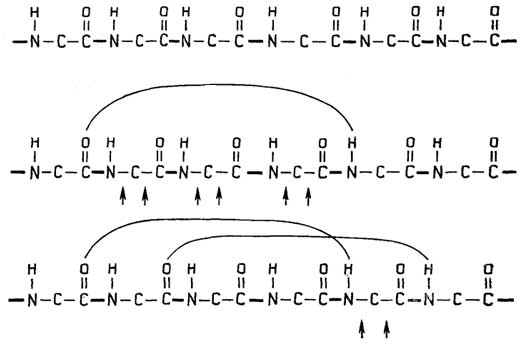
Рис. II.26.Образование одной водородной связи в α-спирали ведет к потере свободы вращения шести связей (указаны стрелками), оказавшихся внутри вятка, а при образовании второй водородной связи - только двух связей
Переход клубок-спираль происходит так: сначала на участке полипептидной цепи, называемом центром спирализации, возникает один виток с одной водородной связью - затравкой. Это с большой вероятностью происходит там, где четыре соседних остатка относятся к категории "активно способствующих образованию спирали". Затем от первоначального витка спирализация происходит с ускорением в обе стороны по цепи, пока не встретятся остатки, "препятствующие образованию спирали".
Образование β-слоев аналогично спирализации с той принципиальной разницей, что водородные связи возникают между полипептидными цепями. Роль "затравки" выполняют участки цепи, состоящие из трех остатков, "активно способствующих образованию β-слоя".
Образование нативной конформации белка происходит путем ассоциации α-спиралей и β-структур. Расчет показывает, что образование нативной конформации простым перебором всех вариантов с закреплением наиболее энергетически выгодного просто нереально, так как требует много миллиардов лет. Высказана убедительная гипотеза, что это происходит следующим образом: возникающие даже на короткое время небольшие участки (10-15 остатков) спиралей и β-структур при сближении в результате диффузии стабилизируются путем образования ассоциатов, которые называют"единицами скручивания". Дальнейшее образование нативной структуры происходит с ускорением.
В белках, бедных спиралями и β-структурами, видимо, не меньшую стабилизирующую роль играют другие участки цепи, а также другие причины, например комплексообразование с ионами металлов. Такой процесс, когда каждый последующий шаг облегчается и ускоряется, называетсякооперативным. Только за счет кооперативности ренатурация белка в подходящих условиях может происходить достаточно быстро.
§ 4.
Четвертичная структура
глобулярных белков
У многих белков молекула состоит более чем из одной глобулы.
Гемоглобин - пример аллостерическога
белка
Структура гемоглобина. Молекула гемоглобина позвоночных состоит из четырех субъединичных глобул (протомеров). Например, гемоглобин А (основной гемоглобин человека) состоит из двух идентичных субъединиц α (по 141 остатку) и двух идентичных единиц β (по 146 остаткам). Его субъединичная формула - α2β23, м. м. 64 500. Четыре протомера располагаются в виде тетраэдра (рис.II.27). Постоянная связь между ними обеспечивается гидрофобными взаимодействиями. Каждый α-протомер имеет хороший контакт с обоими β-протомерами. Между идентичными протомерами контакт слабее. Молекула гемоглобина легко диссоциирует на две αβ-половинки. Далее диссоциация идет в более жестких условиях. Из этого можно сделать вывод, что взаимодействия между α и β' и между α' и β существенно более слабые, чем взаимодействия между а и р, а также между α' и β'. Каждый протомер содержит гем, находящийся в гидрофобной "нише", что защищает его от окисления в ферриформу.
Гемогруппы располагаются с внешней стороны протомеров. Расстояния между ними довольно велики - 2,5 нм. Молекула гемоглобина существует в двух формах: "напряженной" (Т) и "релаксированной" (R). Первая характерна для
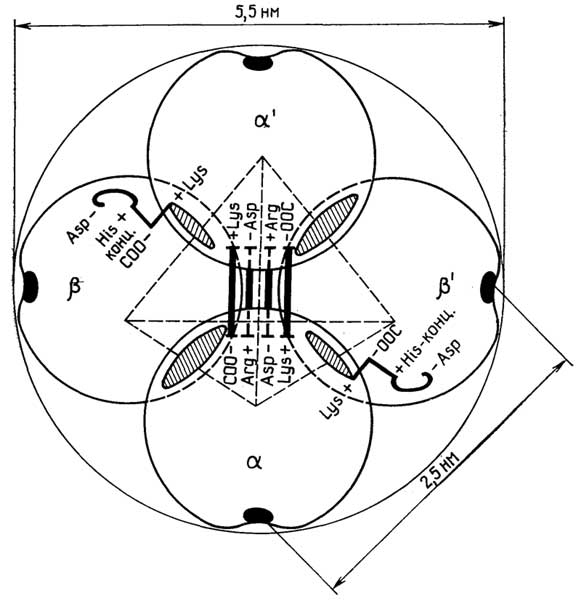
Рис. II.27.Схема четвертичной структуры молекулы гемоглобина. Заштрихованные области - места контактов α- и β-протомеров, зачерненные области - места расположения гемов, жирными линиями показаны "солевые мостики", существующие в дезоксигемоглобине. В центре тетраэдра имеется небольшая полость
дезоксигемоглобина, вторая - для оксигемоглобина.T-форма более "жесткая", в отличие отR-формы она имеет восемь солевых мостиков:
четыре солевых мостика между α-протомерами;
два солевых мостика между разными протомерами, а именно между α и β' и между α' и β;
по одному солевому мостику внутри каждого β-протомера.
В образовании четырех солевых мостиков участвуют С-концевые карбоксильные группы и боковые аминогруппы четырех лизинов, находящихся внутри α-цепей. В образовании других четырех солевых мостиков участвуют боковые карбоксильные группы четырех аспарагиновых кислот, с одной стороны, и боковые группы двух аргининов и двух гистидинов - с другой.
При оксигенерировании солевые мостики разрушаются иT-форма переходит в более компактнуюR-форму. При этом одна αβ-половинка относительно другой поворачивается на 15° и сдвигается на 0,08 нм. Это не влечет за собой практически никаких структурных изменений глобул в местах контактов протомеров α и β, а также α' и β'. Зато в местах контактов протомеров α и β', а также α' и β структура глобул настолько изменяется, что некоторые атомы в этих местах передвигаются на расстояния до 0,6 нм.
Протомеры гемоглобина по структуре и функции сходны с глобулой миоглобина. Сравнение α- и β-протомеров гемоглобина, а также миоглобина уодного вида позвоночныхпоказывает, что:
первичные структуры α- и β-протомеров весьма различны: 30-40% мест в полипептидных цепях занято одними и теми же остатками, называемыми в таких случаяхинвариантными, иликонсервативными;
по первичной структуре α- и β-цепи гемоглобина еще больше отличаются от единственной цепи миоглобина: 20% инвариантных остатков;
третичные структуры α- и β-протомеров гемоглобина практически одинаковы;
третичная структура миоглобина мало отличается от третичных структур α-, β-протомеров гемоглобина.
|
Сравнение гемоглобинов и миоглобина уразных видов животных и человекапоказывает, что по первичной структуре различия значительны (имеется всего 9 инвариантных остатков), а в третичных структурах обнаруживается удивительное сходство, которое можно объяснить лишь общностью выполняемых функций.
Функциональные особенности гемоглобина обусловлены его
Рис. II.28.Кривые насыщения кислородом миоглобина (1) и гемоглобина (2). Парциальное давление кислорода в артериях 90-100 мм рт. ст., в венах - 10-40 мм рт. ст.
четвертичной структурой. Функциональное назначение гемоглобина такое же, как и миоглобина, - обратимо связывать молекулярный кислород. И хотя каждый из протомеров гемоглобина связывает кислород точно так же, как миоглобин, в функционировании молекулы гемоглобина обнаруживаются существенные отличия: во-первых, кислород связывается молекулой гемоглобинакооперативно, т. е. связывание одной молекулы О2облегчает связывание последующей (рис. II.28), что приводит к более эффективному транспорту кислорода. Такая кооперативность называется положительной в отличие от отрицательной, когда связывание одной молекулы затрудняет связывание последующей. Во-вторых, молекула гемоглобина способна воспринимать "информацию" из окружающей среды и, как следствие этого, изменять сродство к кислороду, например протоны, молекулы СО2(концентрация которых повышена в работающих мышцах), присоединяясь к гемоглобину в местах, достаточно удаленных от гемов, ослабляют его связь с кислородом (эффект Бора). Аналогичным образом действует органический фосфат 2,3-дифосфоглицерат (ДФГ):
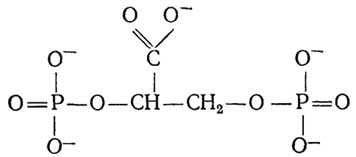
Повышение его концентрации в эритроцитах происходит при различных случаях нехватки кислорода, например при подъеме человека на высоту.
Перечисленные особенности гемоглобина обусловлены его четвертичной структурой, так как они отсутствуют у протомеров, у αβ-субъединиц и гемоглобина β4(гемоглобинаH). Белки, сродство которых к функционально необходимому веществу (субстрату) регулируется присоединением различных эффекторов в других местах молекулы белка, называютсяаллостерическими.
Механизм влияния аллостерических
регуляторов
на примере гемоглобина
Он объясняется конформационными изменениями внутри молекулы белка. Молекула О2, присоединяясь к атому Fe гемовой группы, перемещает его в плоскость тема (рис. II.29). За атомом Fe тянется проксимальный гистидин, который в свою очередь вызывает через другие атомы конформационные изменения в области контактов протомеров. Таким образом, информация о присоединении молекулы О2гемом одного протомера передается другому протомеру через их контакт. Конформационная перестройка влечет за собой разрушение солевых мостиков, стабилизациюR-формы и, значит, усиление сродства гемоглобина к кислороду.
Протоны обратимо присоединяются к боковым группам гистидинов на С-концах β-протомеров и к α-аминогруппам на N-концах α-протомеров, а также, возможно, к боковым группам двух других гистидинов внутри α-протомеров.
Молекулы СО2обратимо присоединяются к а-аминогруппам N-концов α- и β-протомеров.
ДФГ обратимо присоединяется за счет электростатического взаимодействия к положительно заряженным N-концам β-протомеров и тем самым скрепляет последние.
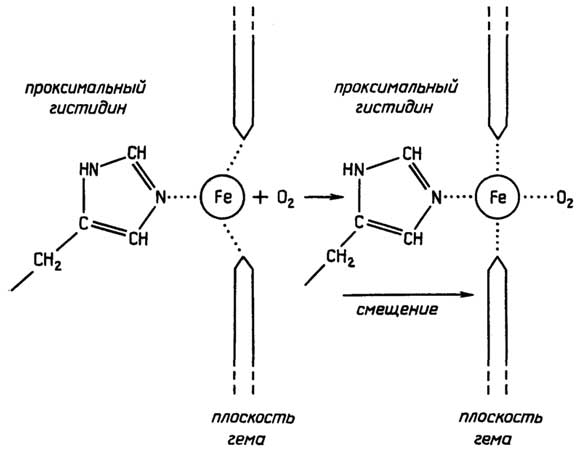
Рис. II.29.Смещение проксимального гистидина при оксигенировании дезоксигемоглобина
Протоны, СО2или ДФГ присоединяются лишь кT-конформации (дезоксигемоглобину), дополнительно стабилизируя ее. При оксигенировании даже одного протомера конформационные изменения передаются на другие протомеры, и сродство как первого оксигенированного протомера, так и молекулы гемоглобина в целом к Н+, СО2и ДФГ снижается.
Другие белки
со сложной четвертичной структурой
Белки, четвертичная структура которых складывается из нескольких субъединиц или десятков субъединиц, принято называтьолигамерными. Белковые структуры, состоящие из сотен или даже тысяч субъединиц, будем называтьполимерными белковыми
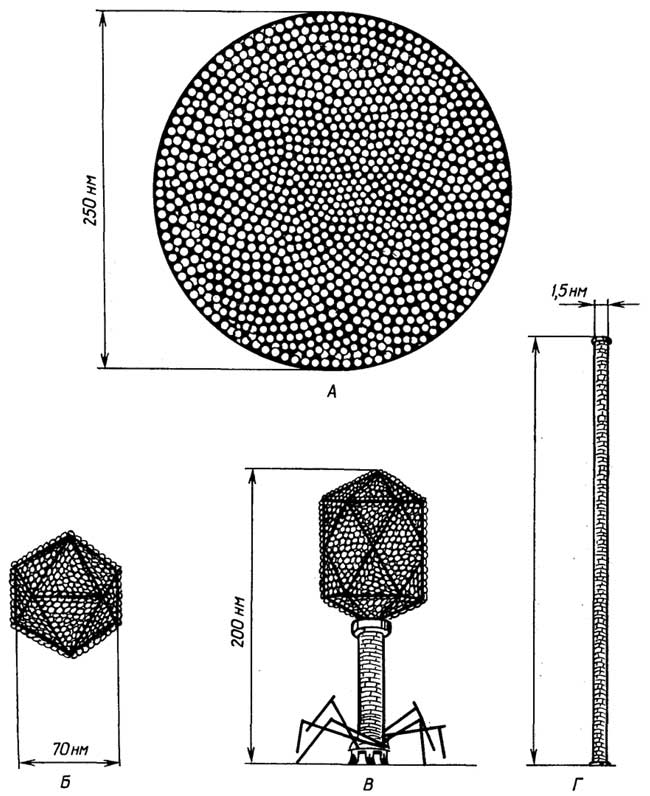
Рис. II.30.Формы и размеры некоторых вирусов:
А- сферическая оболочка вируса оспы;Б- аденовирус, вызывающий обычную простуду, его оболочка состоит из 252 субъединиц;В- головастикоподобный бактериофаг Т4; Г - палочка вируса табачной мозаики (ВТМ), его оболочка состоит из 2200 субъединиц
образованиями(ПБО). Разделение белков на олигомеры и ПБО довольно условно.
Наиболее простой случай олигомеров, когда молекула белка состоит из двух идентичных протомеров. Однако встречаются олигомеры с числом субъединиц до нескольких десятков, причем одновременно в молекуле присутствуют как одинаковые, так и
разные протомеры, напримерРНК-полимераза(м. м. 400 000) α2ββ'σ или огромныйпируватдегидрогеназный комплекс(м. м. 4 600 000)t24(p2)12(f2)12. Олигомеры могут иметь разную симметрию, но они всегда компактны.
Полимерные белковые образования можно условно разделить на два типа, исходя из соотношения их длины и диаметра (или ширины).
Рис. II.31.Субъединичная структура некоторых сложных белков с торца (вверху) и сбоку (внизу):
А- актинаFиз мышц;Б- пиля прокариот;В- жгутика прокариот;Г- белковой оболочки вируса табачной мозаики;Д- микротрубочек;Е- дезоксигемоглобинаS
Полимерные белковые образования, длина которых сопоставима с их диаметром. Это, например,белковые оболочки вирусов, имеющих сферическую форму, как у вируса оспы; или близкую к ней форму многогранника-икосаэдра, как у вируса, вызывающего острое респираторное заболевание; или форму головастика в виде головки-многогранника с довольно коротким цилиндрическим отростком, как у бактериофага Т4 (рис. II.30).
Полимерные белковые образования, длина которых много больше их диаметра, напримерактин Fиз мышечной ткани, составляющий около 25% от общего количества ее белков. Он представляет собой спираль (рис. II.31, А) длиной 1000 нм и диаметром 7 нм, скрученную из двух нитей, каждая из которых является цепочкой из связанных нековалентно субъединиц глобулярного актинаG(м. м. 46000, диаметр 2,4 нм, одна полипептидная цепь из 376 аминокислотных остатков). К этой группе белковых образований относятся также:пилиижгутики бактерий(рис. II.31, Б, В);белковая оболочка вируса табачной мозаики, который имеет форму длинных палочек (рис. II.31, Г);микротрубочки(рис. II.31, Д) - составная частьцитоскелета, а такжересничекижгутиков эукариот; волокна дезоксигемоглобина S(рис. II.31, Е), являющегося причиной наследственного заболевания серповидноклеточной анемии.
Общий принцип построения таких комплексов - спирализация, причем это могут бытьодинарнаяспираль (пили бактерий, вирус табачной мозаики); двойная (актинF) илимногоцепочечные спирали(жгутики прокариот, микротрубочки, волокна дезоксигемоглобинаS).
Особая роль четвертичной структуры
Белки с четвертичной структурой появились в результате эволюции в связи с тем, что:
они лучше приспособлены к выполнению своих функций из-за чувствительности к регуляторному действию среды;
при их биосинтезе экономится генетический материал и уменьшается вероятность ошибок.
§ 5.
Общие закономерности
пространственного строения
глобулярных белков
При сворачивании полипептидных цепей в глобулы, а также яри образовании последними олигомерных или полимерных структур можно отметить несколько общих закономерностей.
Образование третичной или четвертичной структур происходит так, что внутри молекулы группируются гидрофобные остатки, а снаружи - полярные и "заряженные". Этим объясняется растворимость глобулярных белков в воде или водных растворах солей, а также стабильность в этих растворах четвертичных структур.
Третичные и четвертичные структуры очень компактны. Внутрь их лишь в некоторых случаях могут проникать отдельные ионы или молекулы воды.
Нативный белок имеет обычно одну или, в некоторых случаях, несколько конформаций. Такая нативная конформация довольно устойчива при физиологических условиях, но не является совершенно жесткой. Ее элементы (атомы, группы атомов, домены, субъединицы) сохраняют в небольшой степени свободу перемещения в пространстве. В процессе функционирования нативная структура многих белков как бы "дышит".
§ 6.
Пространственное строение
фибриллярных белков
Принципиальное отличие фибриллярных белков от глобулярных в том, что их полипептидные цепи не сворачиваются в глобулы, а, оставаясь вытянутыми в виде линейных цепей или спиралей, группируются в протяженные волокна (фибриллы). Как и в глобулярных белках, основой пространственного строения фибрилл служат вторичные структуры: α-спираль, β-складчатый слой, другие спирали.
α-Кератины
α-Кератиныявляются основой волос, шерсти, перьев, ногтей, когтей, рогов, копыт, панциря черепахи. Вторичная структура - правая α-спираль. Строение α-кератина волоса показано на рис. II.32. Синтезируемый α-кератин образует фибриллы, которые заполняют всю клетку. Считается, что в пространстве между фибриллами находятся молекулы белка с более высоким содержанием цистина. Затем клетки отмирают, а их стенки превращаются в волосяной чехол - кутикулу. Аналогичные процессы происходят при образовании α-кератина других белков.
Особенности α-кератина
Полипептидные цепи (в виде α-спирали) параллельны и направлены в одну сторону.
Полипептидные цепи соседних фибрилл сшиты поперечными ковалентными дисульфидными связями цистиновых остатков. В результате этого волокна прочно связаны в одно целое. Чем выше содержание цистина в α-кератине, тем крепче и жестче его структура (в панцире черепахи 18% цистина).
Полипептидные цепи содержат относительно большое количество аминокислот с гидрофобными боковыми группами^ которые располагаются на наружной стороне α-спиралей, суперспиралей и самих фибрилл.
Гибкие α-кератины, имеющие небольшую долю цистинов (волосы, шерстяные нити), при обработке паром при высокой температуре могут быть растянуты вдвое. При такой обработке разрываются внутрицепочечные водородные связи; α-спирали распрямляются и образуется β-конформация, подобная той, которой обладают β-кератины (см. ниже). Вторичная структура β-конформации α-кератинов - параллельный β-складчатый слой. После снятия растягивающей нагрузки и охлаждения а-кератин волоса или шерсти из β-конформации возвращается в исходную α-спиральную конформацию. Это связано с тем, что в составе α-кератина относительно много аминокислотных остатков с довольно объемными боковыми группами. Взаимодействие этих групп дестабилизирует параллельный β-складчатый слой, и β-конформация α-кератина оказывается нестабильной.
Рис. II.32.Строение α-кератина волоса. Три α-спиральные полипептидные цепи скручены в суперспираль - протофибриллу. 11 таких параллельно расположенных протофибрилл образуют микрофибриллу, из которых в свою очередь складываются макрофибриллы
β-Кератины
β-Кератины- белки, из которых построены нити шелка и паутины (фиброин). Вторичная структура - антипараллельный β-складчатый слой.
Особенности β-кератинов
Межцепочечные ковалентные дисульфидные связи отсутствуют.
Полипептидные цепи содержат много аминокислот, у которых боковые группы имеют небольшие размеры, таких, как глицин и аланин, что, конечно, стабилизирует β-слой. Например, цепь фиброина шелка состоит в основном из повторов (-Gly-Ser-Gly-Ala-Gly-Ala-), причем по одну сторону β-слоя оказываются боковые группы глицина, а по другую - серина и аланина.
Нити β-кератинов более гибкие, чем у α-кератинов, растяжению практически не поддаются.
Коллагены
На долю коллагенов приходится третья часть всех белков позвоночных. Сухожилия, которыми мышцы прикрепляются к костям, состоят в основном из волокон коллагена, которые, переплетаясь крест-накрест, образуют нерастяжимую и очень прочную на разрыв структуру. Аналогичные структуры являются основой кожи, хрящей, вообще соединительной ткани, органического матрикса костей и зубов.
Вторичная структура коллагенов представляет собой левую спираль, которая встречается только в этих белках. Из трех таких спиралей (рис. II.33), свитых в правую суперспираль, и состоит субъединица коллагена, называемаятропоколлагеном. Ее длина около 300 нм, диаметр 1,5 нм, м. м. 300000. В некоторых, коллагенах все три цепи идентичны, в других - две идентичны, а третья несколько отличается от них. Тропоколлагены, составленные "голова к хвосту", образуют нити фибрилл. Волокна коллагена состоят из параллельно расположенных фибрилл, причем тропоколлагены одной фибриллы смещены на четверть длины относительно тропоколлагенов другой, соседней фибриллы. Пространство между тропоколлагеновыми нитями заполнено олигоса-харидами, присоединенными ковалентно через гидроксильные группы 5-гидроксилизинов. Поверхность фибрилл покрыта гликопротеинами и протеогликанами (см. разд. "Углеводы") с целью защиты коллагенов от действия ферментов.
Особенности коллагенов
Ковалентные лизиновые сшивки (рис. II.34) прочно связывают между собой полипептидные спирали как внутри тропоколлагенов, так и между фибриллами. Число таких сшивок практически равно нулю в коллагенах зародышей, но с возрастом постоянно увеличивается. Межцепочечные водородные связи, а также гидрофобные взаимодействия аминокислотных боковых групп, находящихся снаружи тропо-коллагенов, способствуют стабилизации не только самих тропоколлагенов, но и волокон коллагена в целом.
Рис. II.33.Структура коллагена.
Справа - расположение субъединиц тропоколлагена в фибриллах, слева - структура субъединицы из трех спиралей коллагена с ковалентными сшивками между ними
Коллагеновые волокна практически не растягиваются, что объясняется, во-первых, структурой самой спирали коллагена, уже достаточно растянутой и жесткой из-за присутствия в ней значительного количества пролина и его производных, и, во-вторых, наличием внутри коллагеновых волокон и между ними большого числа ковалентных сшивок и нековалентных взаимодействий.
Эластины
Эластины- основной компонент связок, соединяющих кости между собой. Они являются основой стенок кровеносных
сосудов, в качестве второго белкового компонента входят в состав соединительной ткани.
Вторичная структура эластинов - спираль, характерная только для этого белка. Она образует глобулярные субъединицы называемыетропоэластином, или α-эластином, с диаметром 3 нм и м. м. 74000, с числом аминокислотных остатков около 800. Как свернута спираль в глобуле, пока неясно. Однако известно, что в составе полипептидных цепей преобладают гидрофобные
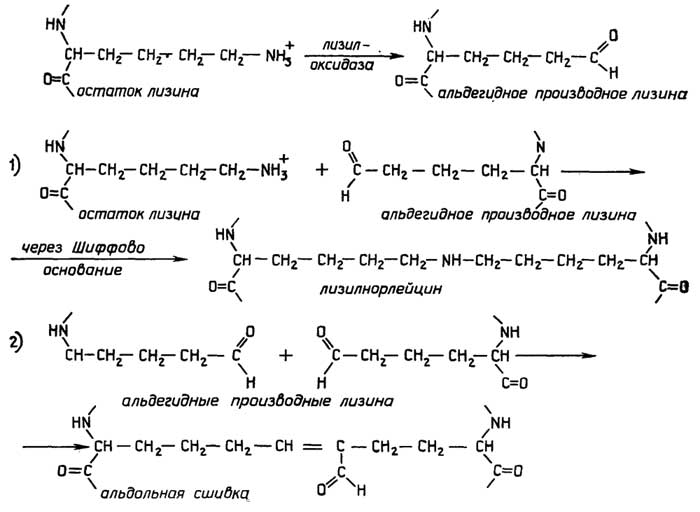
Рис. II.34.Два типа ковалентных лизиновых сшивок в коллагене и эластине
аминокислотные остатки, в основном алифатические. Предварительные данные позволяют считать, что спираль в глобуле располагается так, что эти гидрофобные боковые группы оказываются направленными внутрь. Нативная структура эластинов (рис. II.35) образуется из глобул тропоэластинов, сшитых в одно целое как лизиновыми связками (см. рис. II.34), так и особыми связками, основанными на десмозине и изодесмозине (см. рис. II.2) и обнаруженными только в эластинах. Как и в коллагенах, сшивки отсутствуют в эластинах зародышей, их мало у молодых организмов, но число их быстро увеличивается с возрастом.
Особенность эластиновзаключена в их способности растягиваться в несколько раз во всех направлениях и возвращаться в исходное состояние после снятия нагрузки, сохраняя
Рис. II.35.Структура эластина:
A- лизиновые сшивки;Б- десмозиновые и изодесмозиновые сшивки;В- глобулы тропоэластина
при этом высокую прочность на разрыв. Это свойство объясняется тем, что при растяжении разрушаются гидрофобные взаимодействия внутри тропоэластинов, нарушается их микросреда. Однако этот процесс полностью обратим. Высокая прочность на разрыв в растянутом состоянии связана с наличием ковалентных сшивок.
Миозины
Миозины- главные белки мышечных тканей (до 60% от общего количества белков).
|
Рис. II.36.Схематическое изображение молекулы миозина: |
Рис. II.37.Схема строения толстой нити мышечной ткани позвоночных: |
Молекула миозина из поперечнополосатых мышц (м. м. 470000) длиной 150 нм имеет сложную форму (рис. II.36). Она представляет собой длинный стержень, на одном из концов
которого находятся две несколько вытянутые глобулы, обладающие ферментативной активностью по отношению к аденозинтрифосфату (АТФ). Молекула состоит из двух идентичныхтяжелыхцепей и двух парлегкихцепей. Тяжелые цепи (м. м. по 200000) в форме α-спиралей, скрученные в суперспираль, образуют стержень молекулы и заканчиваются в концевых глобулах. Это самые длинные из известных полипептидных цепей. Они содержат по 1800 аминокислотных остатков. В каждой концевой глобуле находятся еще две легкие цепи (м. м. по 18000), свернутые в свои собственные глобулы, которые связаны нековалент-но с основной. При обработке ферментами, расщепляющими полипептидные цепи в определенных местах (см. рис. II.36), получаютсясубфрагменты. Трипсин делит молекулу налегкий меромиозин(ЛММ) итяжелый меромиозин(ТММ). Последний под действием папаина или при более длительной обработке трипсином дает два субфрагментаS1и субфрагментS2. Хотя в целом молекула миозина жесткая, в местах расщепления находятся гибкие шарнирные участки. Вполне можно считать, что эти шарнирные участки связывают между собой в молекуле четыре домена: 2S1,S2и ЛММ.
В результате нековалентного взаимодействия 300-400 молекул миозина образуетсятолстая нить мышечной ткани, которая при диаметре 16 нм имеет длину 1500 нм. В сечении ее можно насчитать два-три десятка молекул. Укладка молекул миозина в толстых нитях такова (рис. II.37), что в середине они стыкуются "хвост к хвосту", образуя зону в 150 нм, а далее к обоим концам толстой нити они уже стыкуются "голова к хвосту", причем ТММ-части молекул выступает наружу. Стыковка молекул к тому же ступенчатая, как в коллагене. В результате этого выступающие части располагаются на толстой нити по спирали. Соединение "хвост к хвосту" в области, где головки отсутствуют, обеспечивается так называемымМ-белком.
Особенности миозина:
молекула состоит из нескольких жестких частей, соединенных шарнирами;
наличие ферментативной активности, которая сосредоточена в головке (субфрагментахS1);
полипептидные цепи головки содержат цистеин (SH-группы).
Тропомиозины
Тропомиозины- фибриллярные белки мышечной ткани (всего 5% от общего количества белков). Исходя из аналогии с коллагеном и эластином, можно подумать, что тропомиозин - это субфрагмент миозина, но это неверно. Тропомиозии - самостоятельный белок со своей собственной функцией, но его молекулярная
структура очень похожа на строение молекулы миозина, а точнее, на строение ее хвоста.
Молекула тропомиозина довольно жесткая и имеет форму палочки длиной 41 нм и диаметром 2 нм. Она представляет собой суперспираль из двух очень близких по составу
Рис. II.38.Схема строения тонкой нити мышечной ткани позвоночных. Каждая нить тропомиозинов находится почти в желобке между нитями актинаFтаким образом, что контакт имеет лишь с одной из них. Каждая молекула тропомиозина покрывает по длине семь субъединиц актинаG. В местах стыка молекул тропомиозина находится белок тропонин, состоящий из трех глобулярных субъединиц и играющий важную регуляторную роль
полипептидных цепей, каждая из которых имеет форму α-спирали и м. м. 70000. Две нити из состыкованных концами молекул тропомиозина, свитые вместе с двойной спиралью актинаF, образуюттонкую нить мышечной ткани(рис. II.38).
Фибрины
Фибрины- белки кровяного сгустка (тромба).
Молекула фибрина (м. м. 340000) состоит из шести полипептидных цепей трех типов, соединенных между собой дисульфидными мостиками. Ее субъединичная формула - (αβγ)2. Она имеет форму палочки с двумя глобулярными образованиями на концах и одним в середине (рис. II.39). Упаковка полипептидных цепей в молекуле неизвестна. В некоторых местах к ним по остаткам аспарагина присоединены олигосахариды. При физиологических условиях молекулы фибрина агрегируют с образованием протяженных фибрилл, в которых они укладываются параллельными рядами со сдвигом на полмолекулы (рис. II.39). Из таких фибрилл, имеющих разное направление, возникаетмягкий сгусток. Он состоит израстворимого фибрина, поскольку из образовавшегося сгустка фибрилл можно вновь получить раствор мономера, сдвигая рН среды в кислую (<4,5) или щелочную (>9) область. Фибрин мягкого сгустка растворяется также в 1 М мочевине. Однако через некоторое время такая солюбилизация становится невозможной, так как из мягкого образуетсятвердый сгусток. Превращение связано с возникновением ферментативным путем ковалентных сшивок (рис. II.39, В) между боковыми группами глутамина и лизина соседних молекул.
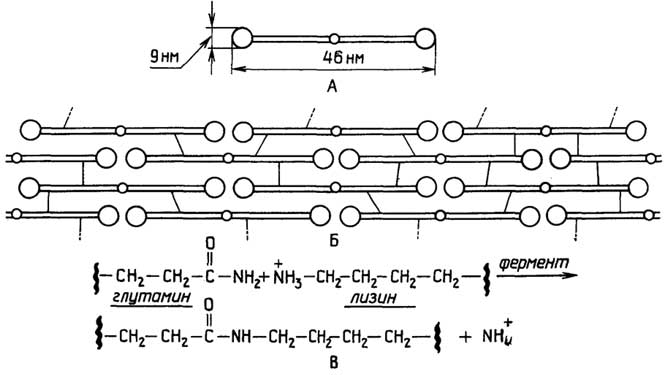
Рис. II.39.Структура фибрина:
А- форма молекулы фибрина;Б- укладка мономеров в фибрилле; показаны поперечные ковалентные сшивки внутри фибриллы и потенциальные сшивки с соседними фибриллами при образовании твердого сгустка;В- образование ковалентной сшивки
§ 7.
Общие замечания о строении
и свойствах фибриллярных белков
Высокая прочность на разрыв, а также нерастворимость многих из них в воде объясняются в первую очередь их структурой - наличием ковалентных связей, сшивающих как полипептидные цепи внутри фибрилл (коллаген), так и сами фибриллы в одно целое (α-кератин, коллаген и эластин взрослых животных, фибрин твердого кровяного сгустка).
Фибриллярные белки, у которых нет ковалентных сшивок, можно растворить:
в солевых растворах (миозин мышц, коллаген и эластин эмбрионов или очень молодых животных);
в горячей воде (тропомиозин);
сдвигая рН (фибрин мягкого кровяного сгустка);
добавляя мочевину (фибрин мягкого кровяного сгустка).
Фибриллярные белки, являющиеся на самом деле полимерами глобулярных, хорошо растворимы даже в дистиллированной воде (актинF).
Способность к обратимому растяжению некоторых из них обусловлена наличием в структуре спиралей, не сшитых внутри ковалентными связями, а скрепленных лишь слабыми силами, такими, как водородные связи (α-кератин) или гидрофобные взаимодействия (эластин).
1α-Спираль также можно обозначить как 3,613-спираль. В настоящее время рекомендовано обозначать спирали по целому числу остатков, содержащихся в целом числе витков. Например,α-спираль, 310-спираль иπ-спираль надо бы соответственно называть 185-спираль, 31-спираль и 225-спираль.
2Уα-,310-, π-спиралей водородные связи образуются между концом (NH-группой) n-го остатка и началом (СО-группой) соответствующего остатка (вперед по цепи).
3У человека, кроме того, обнаружены: гемоглобин A2(α2δ2)- 2% от общего количества; гемоглобинα2ε2-в зародыше человека; гемоглобин F(α2γ2) -гемоглобин плода человека, а также в небольших количествах другие гемоглобины. Как видно, протомерыαявляются общими для всех гемоглобинов человека. Протомерыβ, δ, γ, εпо первичной структуре имеют мало отличий, а их третичные структуры практически одинаковы.
Глава 9
ФУНКЦИОНАЛЬНОЕ МНОГООБРАЗИЕ БЕЛКОВ
И ИХ ОСОБЕННОСТЬ
§ 1.
Функциональная
классификация белков
По выполняемым функциямбелки принято делить на несколько классов.
Ферменты- наиболее многочисленная группа (их около 2000). Обычно это глобулярные белки, но известны и фибриллярные (миозин). Они обладают каталитической активностью. С их помощью в живых организмах протекают химические реакции.
Гормоны- эндогенные регуляторные белки организма, например инсулин (регулирует обмен глюкозы), соматотропин (гормон роста) и другие, в крайне небольших количествах способны влиять на протекание и направление обменных процессов в организме.
Токсины- экзогенные белки, например холерный и дифтерийный токсины, ботулин (продукт жизнедеятельности анаэробных бактерийClostridiym botutinum), рицин (из семян клещевины), змеиные яды. Они также в очень малых количествах сильно влияют на обменные процессы.
Структурные белкивходят в состав оболочек вирусов; клеточных оболочек, кожи. Это - главный компонент соединительной ткани сухожилий, хрящей, связок, волос, шерсти, панциря черепахи; основа костей. Благодаря им организм скреплен в одно целое.
Транспортные белкипереносят молекулы и ионы или между органами, или через мембрану клетки. Например, гемоглобин переносит О2, СО2, Н+; сывороточный альбумин - жирные кислоты; β-липопротеины - липиды.
Запа́сные белки- белки семян (глидин в пшенице, зеин в кукурузе), яичный альбумин, казеин молока. Необходимы для развития организма на ранних стадиях.
Двигательные белки- это белки мышц (миозин и актин), тубулин ресничек и жгутиков и других обеспечивают возможность двигаться организму и (или) его частям.
Защитные белкипредохраняют организм от разрушения извне или способствуют его выживанию при повреждении. Вот несколько примеров:
токсины, вырабатываемые растениями, защищают последние от поедания животными, а токсины насекомых (пчела) или некоторых позвоночных (жаба, ядовитые рыбы) защищают их от нападения врагов;
структурные белки, входя в состав оболочек вирусов, клеток и организмов (т. е. кожи, шерсти, панциря), выполняют еще и функцию защиты от неблагоприятного воздействия внешней среды или находящихся в ней организмов;
при повреждении кровеносных сосудов включается защитная система свертывания крови и образования кровяного сгустка. В этом процессе участвует большая группа белков;
высшие позвоночные в ответ на проникновение в их организм чужеродных белков, других высокомолекулярных соединений, вирусов, клеток, называемыхантигенами, способны синтезировать через несколько дней специальные белки иммунной защиты, называемыеантителами, которые с высокой специфичностью связываются с антигенами и нейтрализуют их;
кроме антител некоторые клетки высших позвоночных в ответ на проникновение какого-либо вида вирусов в организм способны в течение суток или двух синтезировать специальные белки, называемыеинтерферонами, которые, связываясь со здоровыми клетками, защищают их от заражения этим же или любым другим видом вирусов.
Белки со специальными функциями, например рецепторные белки, обеспечивающие передачу импульсов между нервными клетками или восприятие света; белки, предохраняющие кровь рыб, обитающих в холодных морях, от замерзания, и др.
§ 2.
Видоспецифичность -
особенность белков
Гомологичные белки, т. е. белки, которые выполняют одинаковые функции у организмов, принадлежащих к разным видам, различаются виммунологическом отношении. Это означает, что такие белки при введении в кровь какого-либо позвоночного животного (или акулы) вызывают у него образование антител с различной структурой, причем различий тем больше, чем дальше родство видов.
Гомологичные белки разных организмов одного и того же вида также могут различаться в иммунологическом отношении.
Раздел Б
УГЛЕВОДЫ И КЛЕТОЧНЫЕ СТЕНКИ
§ 1.
Общая характеристика, функции
и классификация углеводов
Углеводы - этополиоксиальдегиды(альдозы) иполиоксикетоны(кетозы), а также их производные. Название "углеводы" связано с тем, что у многих из них состав может быть выражен формулой (СН2О)n, гдеn≥ 3. Углеводы - это основные по сухой массе компоненты растительных клеток, но их функциональная значимость велика и в бактериальных и в животных клетках.
Функции углеводов можно разделить на три группы:
функции, связанные со способностью бытьносителями и хранителями как химической энергии, так и атомов углерода; при окислении 1 г углеводов может выделиться около 4 ккал энергии, которая используется в различных процессах метаболизма, а атомы углерода необходимы организму для биосинтеза не только самих углеводов, но и белков, нуклеиновых кислот, липидов;
функции, связанные соструктурной рольюуглеводов; являясь важными компонентами стенок бактериальных и растительных клеток, а также оболочек животных клеток, они помимоопорнойфункции выполняют одновременно и многие другие; так, они являютсяантигеннымидетерминантами клеток и многих соединений, т. е. наличие углеводных меток на поверхности клеток или макромолекул позволяет организму отличать свои клетки и макромолекулы от чужих; углеводные компоненты на поверхности белка частообеспечивают защитупоследнего от разрушающего действия внешней среды или ферментов; кроме того, углеводные компоненты клеточных стенок и оболочекслужат также рецепторамидля специфического связывания различных регуляторов метаболизма, таких, как гормоны и токсины, а также медиаторов при передаче нервных импульсов;
другие функции: предохраняют кровь от свертывания, а у некоторых рыб - от замерзания; обусловливают слизистую консистенцию веществ, которые покрывают эпителиальные ткани дыхательных и пищеварительных путей, а также выполняют роль смазки в суставах и других местах; являются антибиотиками, различными физиологически активными веществами; витамин С относится к углеводам.
Классификация углеводовсвязана с их делением напростыеисложныесахара.
Простые сахара- это моносахариды и их производные,сложные сахара- это олигосахариды и полисахариды вместе с производными.
Моносахариды- альдозы и кетозы, молекулы которых содержат от 3 до 7 атомов углерода. Иногда к ним относят также альдозы и кетозы с 8 и 9 атомами углерода, называемымивысшими сахарами.
Олигосахаридыможно рассматривать как результат поликонденсации 2-10 молекул моносахаридов или их производных.
Полисахариды(гликаны) - это результат поликонденсации большого числа молекул моносахаридов или их производных. Среди них различаютгомополисахариды, состоящие из остатков одного моносахарида, игетерополисахариды, у которых чередуются остатки разных моносахаридов (обычно не более четырех), так что повторяющееся звено представляет собой остаток небольшого олигосахарида. Молекулярная масса гликанов может достигать сотен миллионов.
Глава 10
МОНОСАХАРИДЫ И ОЛИГОСАХАРИДЫ -
РАСТВОРИМЫЕ САХАРА
§ 1.
Моносахариды
Моносахариды подразделяют по числу атомов углерода в составе молекулы натриозы, тетрозы, пентозы, гексозыи т. д. Вместо приставки "кето" можно использовать суффикс "ул", например вместо "кетопентоза" - "пентулоза". Нумерация атомов углерода начинается с того конца, где расположена альдегидная или карбонильная группа (кетогруппа). Для наиболее распространенных моносахаридов широко используются тривиальные названия, например фруктоза. Самые простые моносахариды - это триозы:
На рисунке II.40 показаны наиболее распространенные в живой природе альдозы и кетозы. Моносахариды изображены с помощьюпроекционных формул Фишера.
Стереоизомерия - свойство всех моносахаридов, за исключением диоксиацетона. Для углеводов общепринятой является
Рис. II.40.Наиболее распространенные гексозы и пентозы
DL-система стереоизомерии, которая берет за основу конформацииD- иL-глицеральдегида. Принадлежность моносахаридов кD- илиL-ряду определяется по расположению гидроксильной группы у хирального (асимметрического) атома углерода с наибольшим порядковым номером. Она обусловлена конформацией молекулы и не связана со способностью раствора данной формы моносахарида поворачивать плоскость поляризации плоскополяризованного света в ту или иную сторону, т. е. вправо или влево.
Энантиомеры- этоD- иL-стереоизомеры.
Диастереоизомеры- это стереоизомеры, не являющиеся энантиомерами, напримерD-глюкоза - диастереоизомер по отношению к любой альдогексозе (вD- илиL-форме), кромеL-глюкозы.
Эпимеры- пары диастереоизомеров, которые имеют различное расположение гидроксильных групп у атома углерода с одним порядковым номером, напримерD-глюкоза иD-манноза - эпимеры по атому С2,D-глюкоза иD-галактоза - эпимеры по атому С4.
Циклические структурымоносахаридов - это основные формы существования пентоз, гексоз и гептоз в водных растворах.
Аномеры- пары стереоизомеров, обозначаемых α- и β-, образование которых связано с существованием моносахаридов в циклической форме внутримолекулярных полуацеталей или полукеталей. Явление взаимопревращения двух аномеров через образование промежуточной линейной формы (альдегидной или кетонной) называетсямутаротацией. Этот процесс отражается на изменении угла вращения плоскости поляризации плоскополяризованного света при пропускании последнего через растворы аномеров. Мутаротация ускоряется с увеличением рН среды.
Циклические структуры моносахаридов принято выражатьпроекционными формулами Хеуорса. Циклизация пентоз, гексоз и других обычно сводится к образованию либопиранозной формы, т. е. шестичленного цикла, напоминающего структуру пирана (рис. II.41), либофуранознойформы, т. е. пятичленного цикла, напоминающего структуру фурана (рис. II.42). Пиранозные формы пентоз и гексоз, как правило, более устойчивы в растворах, а их фуранозные формы встречаются в составе олигосахаридов.
Конформационные формулы, в отличие от формул Хеуорса, дают представление о пространственном расположении атомов цикла.
Пиранозная формапентоз и гексоз имеет три конформации (рис. II.43): "кресло", "лодка" и "скрученная" ("твист"). Наиболее устойчива конформация "кресло", которая в свою очередь имеет две конформационные разновидности: "С1" и "1C" (рис. II.44). Первая характерна для моносахаридовD-ряда, вторая - дляL-ряда. Структуры "лодка" и "скрученная" более подвижны. Они имеют несколько конформационных разновидностей. Переход "кресло" - "лодка" связан с изменением энергии на 5-6 ккал · моль.
Рис. II.41.ЦиклизацияD-глюкозы,D-фруктозы иD-рибозы с образованием пиранозных аномеров, изображенных с помощью формул Хеуорса
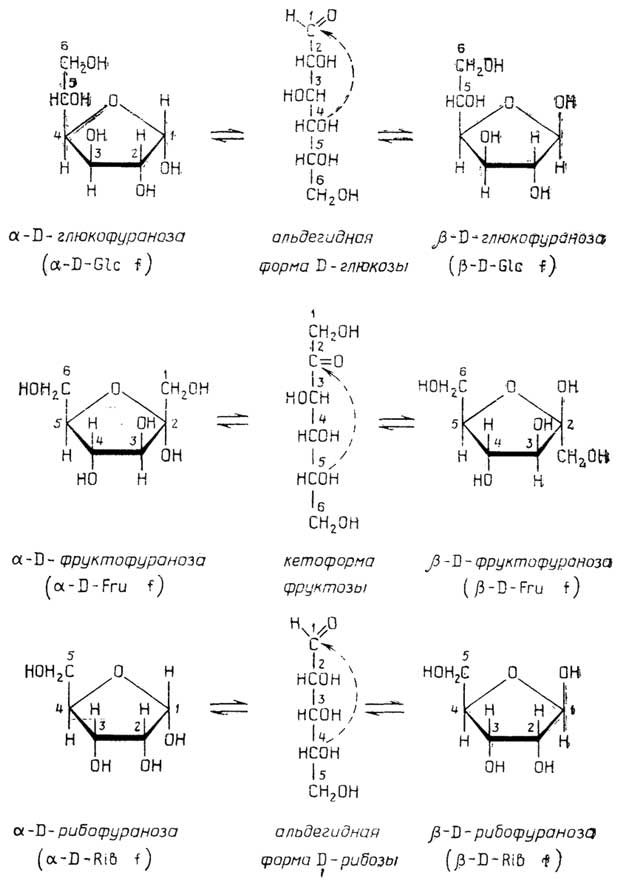
Рис. II.42.ЦиклизацияD-глюкозы,D-фруктозы иD-рибозы с образованием фуранозных аномеров, изображенных с помощью формул Хеуорса
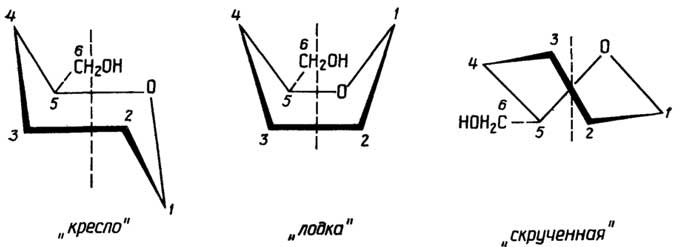
Рис. II.43.Конформационные формы пиранозного кольца пентоз и гексоз
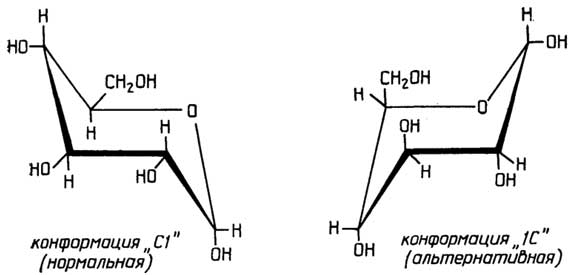
Рис. II.44.Разновидность конформации "кресло"
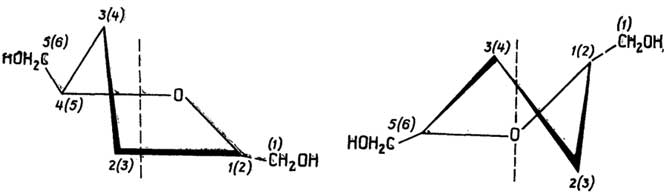
Рис. II.45.Конформационные формы фуранозного кольца пентоз и гексоз
Фуранознаяструктура пентоз и гексоз может существовать либо в форме "конверт", либо в "скрученной" ("твист") форме (рис. II.45). Более устойчивой является конформация "конверт". Обе конформации имеют несколько разновидностей, что связано
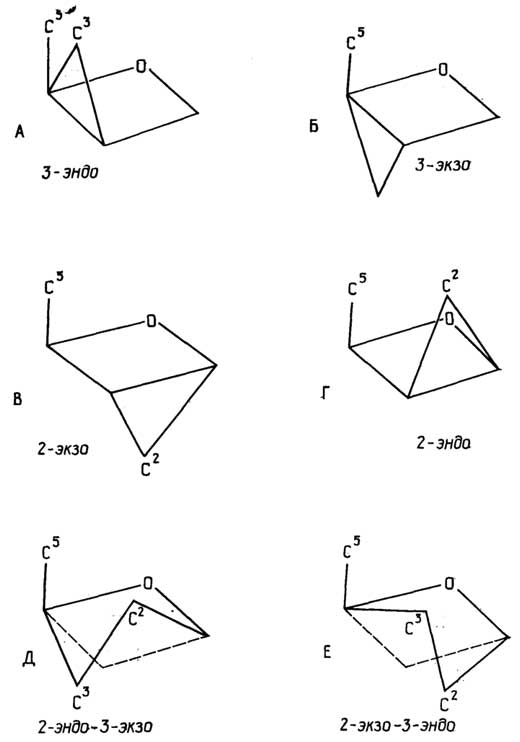
Рис. II.46.Разновидность конформации "конверт" (A-Г) и "скрученная" (Д, Е)
с различным расположением атомов С2и С3относительно атома С5(рис. II.46).
Значительное влияние на стабильность конформации оказываетпространственное расположение заместителейпри углеродных атомах цикла.Экваториальное
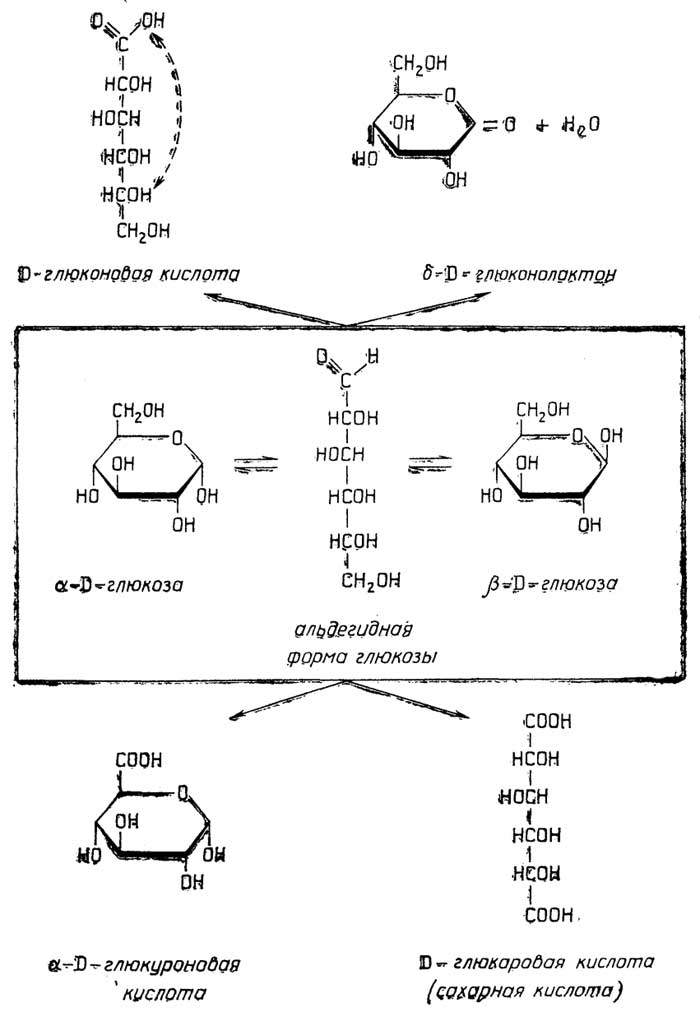
Рис. II.47.Сахарные кислоты - продукты окисленияD-глюкозы
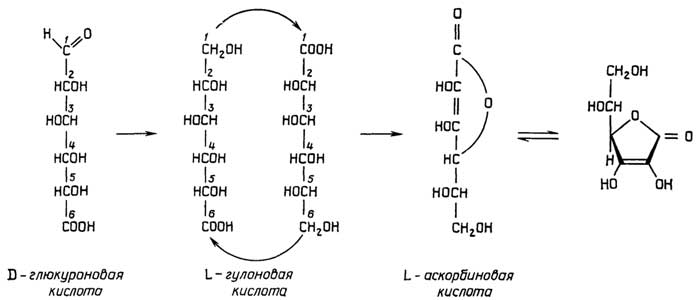
Рис. II.48. L-Аскорбиновая кислота (витаминС)
расположение предпочтительнееаксиального. Заместители при всех атомах у β-глюкозы расположены экваториально, а у α-глюкозы гидроксильная группа аномерного атома С1расположена аксиально, остальные заместители - экваториально.
§ 2.
Биологически важные
производные моносахаридов
Сахарные кислоты получаются окислением моносахаридов по альдегидной или гидроксильной группе у атома С6. В зависимости от того, какие группы окислены, получаютсяальдоновые, уроновыеиальдаровыекислоты. Так, в случае окисления глюкозы
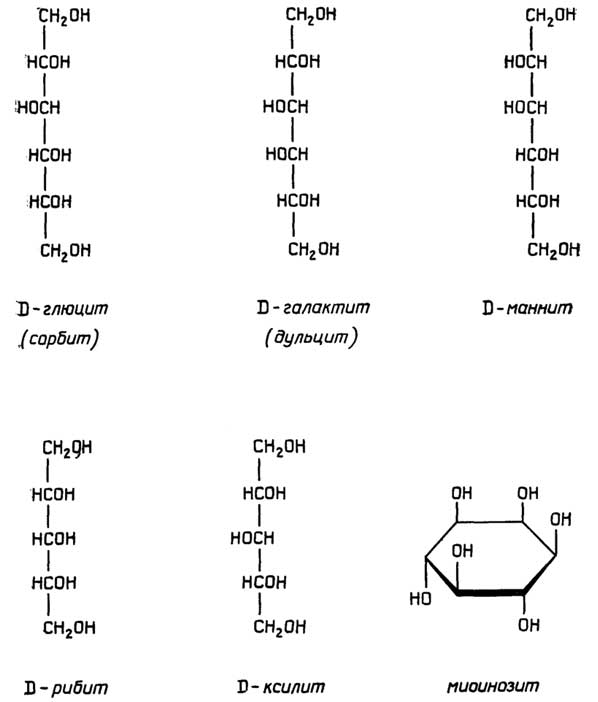
Рис. II.49.Сахароспирты
(рис. II.47) - этоD-глюконоваякислота, более устойчивая в форме δ-лактона,D-глюкуроноваякислота иD-глюкаровая(сахарная) кислота. Первая в качестве промежуточного продукта играет важную роль в метаболизме живых организмов, вторая
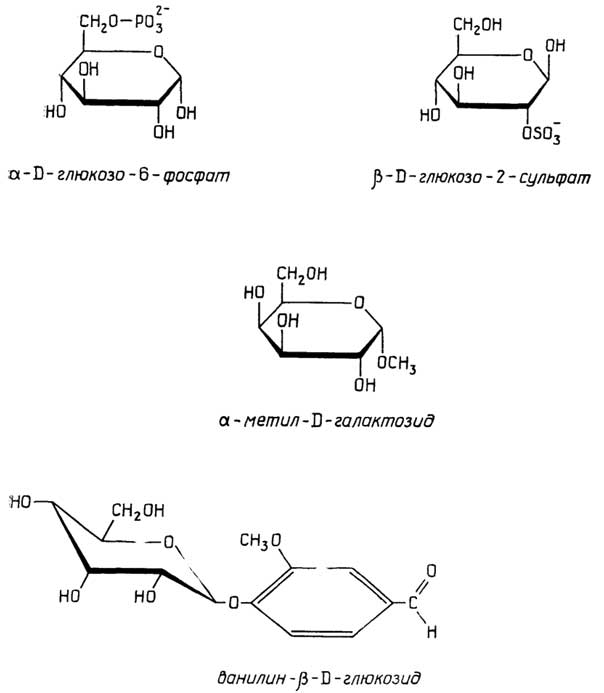
Рис. II.50.Эфиры моносахаридов: фосфат и сульфат (вверху) и гликозиды (внизу)
входит в состав многих биологически важных соединений, третья встречается редко.
Аскорбиновая кислота(витаминС) относится к сахарным кислотам. В организме животных, кроме обезьян, морских свинок и человека, она получается из глюкозы черезD-глюкуроновую кислоту (рис. II.48).
Сахароспирты- это продукты восстановления моносахаридов по альдегидной или кетонной группе. Наиболее известны сорбит" дульцит, маннит, рибит, ксилит и миоинозит (показаны на рис.II.49).
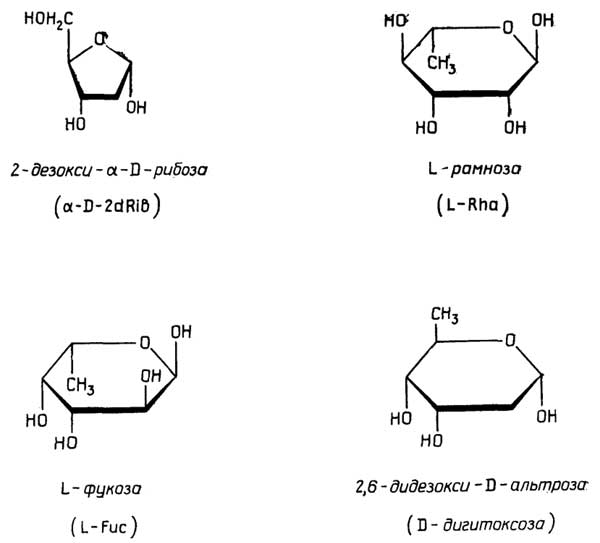
Рис. II.51.Наиболее известные дезоксисахара
Эфиры моносахаридовмогут образовываться двумя путями: либо по типу сложного эфира, либо по типу простого эфира. В первом случае это - продукты реакции гидроксильных групп моносахаридов с кислотами фосфорной, серной, уксусной и другими, например α-D-глюкозо-6-фосфат или β-D-глюкозо-2-сульфат (рис. II.50). Во втором случае это - продукты реакции гидроксильных групп моносахаридов с гидроксильными группами различных природных соединений, например спиртов, фенолов. Несахарную часть таких эфиров называютагликоном, сами эфиры -гликозидами(рис. II.50), а связь, которая их образует, -О-гликозидной.
Дезоксисахара(рис. II.51) играют важную роль как компоненты антигенных детерминант клеточных поверхностей; они входят в состав многих биологически важных соединений, антибиотиков; 2-дезокси-D-рибоза - компонент ДНК.
142
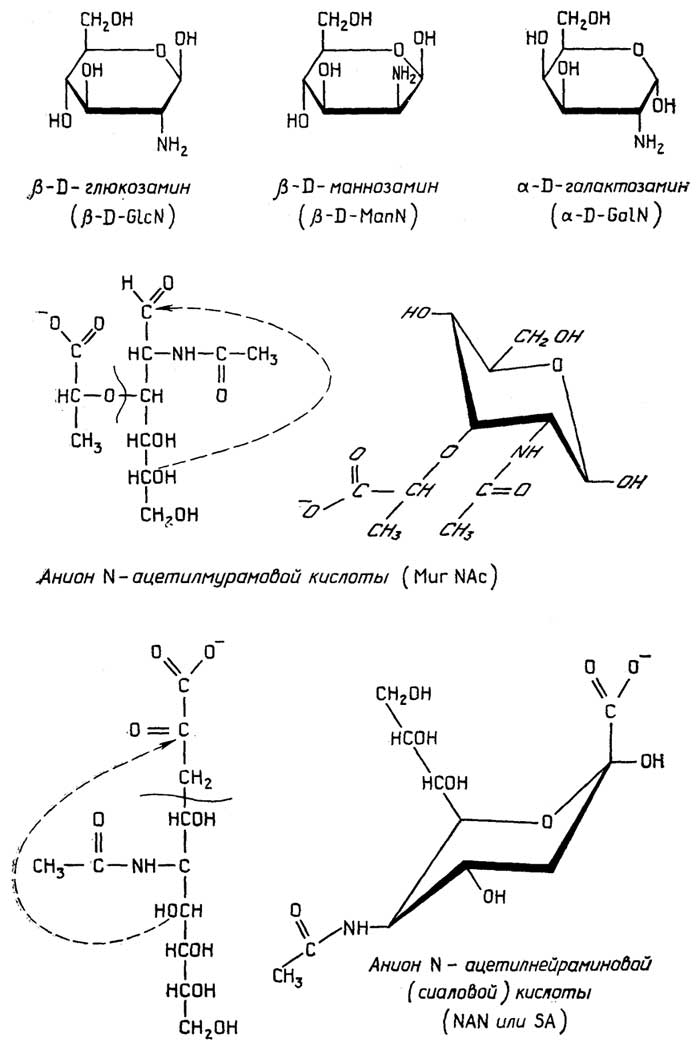
Рис. II.52.
Наиболее известные аминосахара
и их производные
Аминосахараи их производные (рис. II.52) входят в структуру многих природных гликанов. Особенно часто они встречаются в полисахаридах, выполняющих структурные функции.
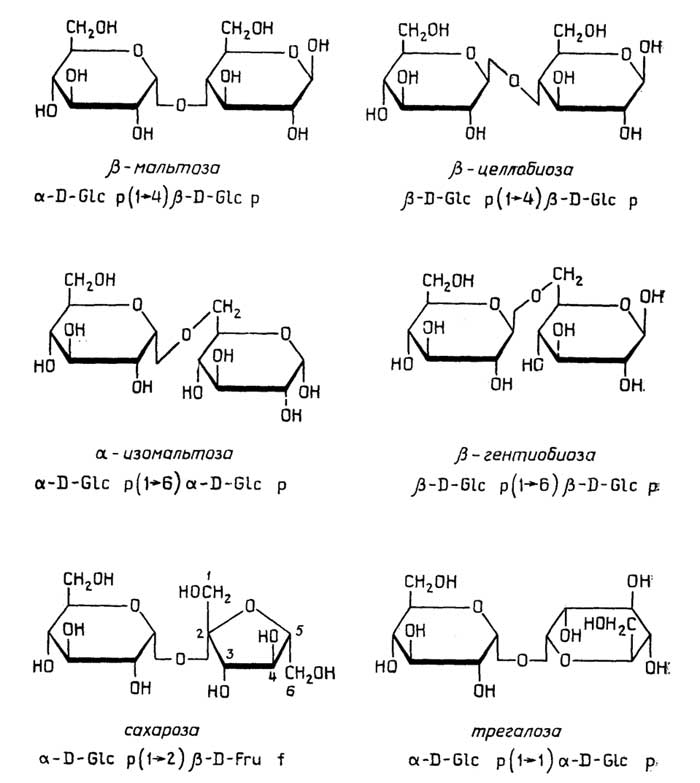
Рис. II.53.Наиболее известные дисахариды
§ 4.
Олигосахариды
По количеству моносахаридных остатков олигосахариды подразделяют надисахариды, трисахариды, тетрасахаридыи т. д. По наличию или отсутствию аномерного атома углерода их относят кредуцирующимилинередуцирующимсоответственно. Наиболее часто встречающиеся дисахариды с их названиями и принятыми обозначениями показаны на рис. II.53. Трисахариды (рафиноза - соединение галактозы, глюкозы, фруктозы) встречаются реже. Дисахариды и трисахариды являются обычно
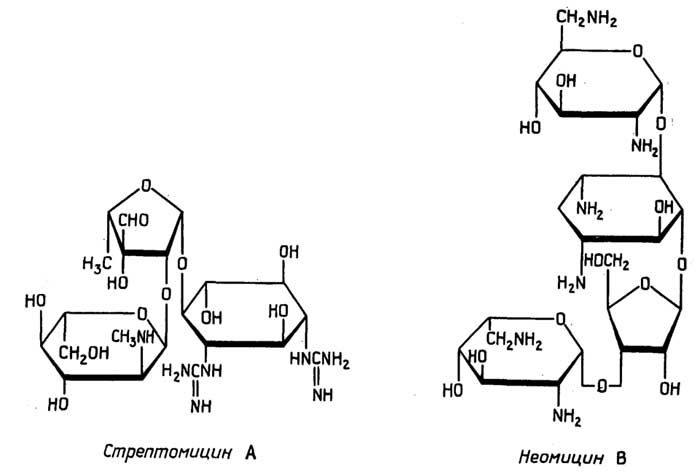
Рис. II.54.
Антибиотики - углеводы
транспорной, или запасной, формой Сахаров. Олигосахариды более высокого порядка в свободной форме встречаются довольно редко. У растений и некоторых насекомых они выполняют, например, функцию антифризов. Для олигосахаридов высокого порядка более обычным является существование в соединениях с белками (гликопротеины) или с липидами (гликолипиды). К олигосахаридам и их производным относятся некоторые антибиотики (рис. II.54).
Глава 11
ПОЛИСАХАРИДЫ (ГЛИКАНЫ) -
ОСНОВНЫЕ УГЛЕВОДЫ
ЖИВОЙ ПРИРОДЫ
Цепи этих природных полимеров отличаются от цепей других природных полимеров белков и нуклеиновых кислот тем, что могут иметьмножество разветвлений.
§ 5.
Запасные полисахариды
Запасные полисахариды - это всегда гомополисахариды и почти всегда внутриклеточные вещества.
Крахмал- основной запасной полисахарид растений, откладывается в клетке в виде зерен. Известны две его формы: α-амилоза и амилопектин, которые встречаются в растениях как отдельно, так и в виде смесей.
α-Амилоза (молекулярная масса от нескольких тысяч до 500 тыс.) состоит из линейных цепочек сотен и даже тысяч молекул α-D-глюкопиранозы, соединенных гликозидными связями α (1→4).Амилопектинотличаетсяотα-амилозы тем, что его цепи имеют множество ответвлений, которые встречаются в среднем через каждые 20-30 остатков. Ответвления возникают за счет образования дополнительных гликозидных связей α (1→6) (рис. II.55),такчтомолекулаамилопектинапредставляет собой весьма разветвленную структуру, у которой только одна ветвь имеет остаток α-D-глюкозы с редуцирующим аномерным атомом С1. Молекулярная масса амилопектина достигает десятков миллионов.
Гликоген- запасной полисахарид животных клеток, но встречается в грибах и даже в некоторых растениях. У животных он обычно присутствует в клетках печени и мышцах. Структура его аналогична структуре амилопектина с той разницей, что ответвления встречаются чаще, через каждые 8-12 остатков α-D-глюкозы. Молекулярная масса гликогена достигает 100 млн.
Декстрины- остатки амилопектинов или гликогенов, представляющие собой их разветвленные "сердцевины", оставшиеся после удаления всех линейных ответвлений путем избирательного гидролиза связей α (1→4),начинаясконцаветвии до разветвления. Таким образом, декстрины - это искусственный продукт.
Декстраны- запасные полисахариды бактерий, дрожжей. Это поли-D-глюкопираноза, цепи которой образуются за счет связей α (1→6),амногочисленныеответвления-засчетсвязейα(1→2), α (1→3)иα(l→4).Молекулярнаямассадекстранов-сотнимиллионов.Высокомолекулярные декстраны аналогично белкам обладают антигенными свойствами.
Другие запасные полисахариды(см. рис. II.55), более редкие, также встречаются в живой природе. Это, например, поли-β-D-фруктофураноза (инулин артишоков), поли-α-D-галактопираноза (у некоторых растений), поли-β-D-галактофураноза (у некоторых грибов).
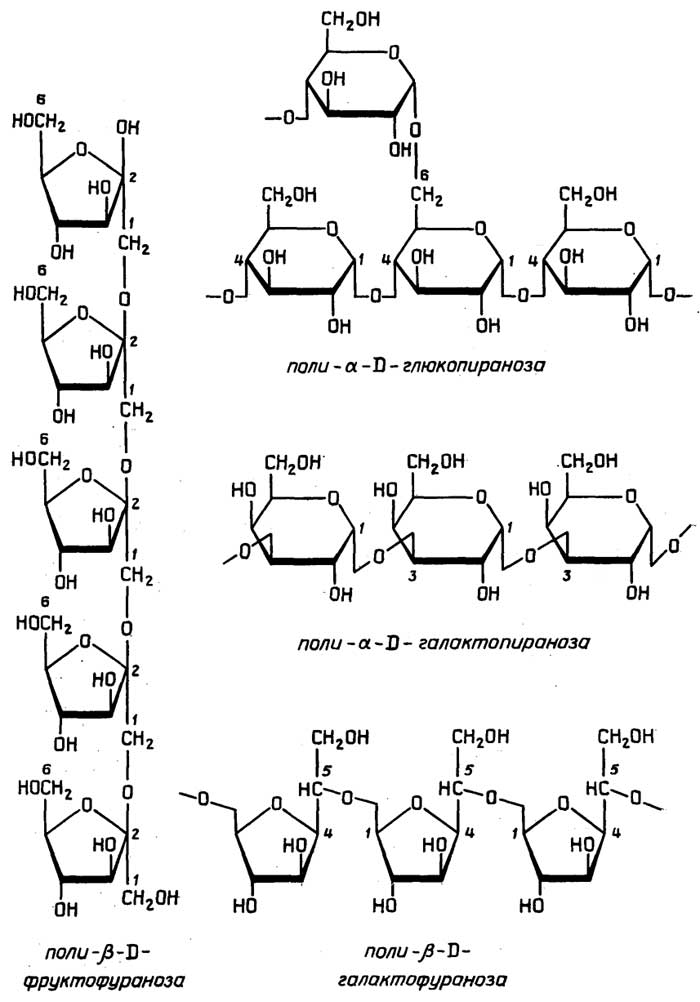
Рис. II.55.Запасные полисахариды
§ 6.
Структурные полисахариды
Условно их можно разделить на основные и вспомогательные. Первые являются основным "арматурным" материалом вклеточных стенках(растений, водорослей, грибов и даже одного вида низших животных) иливо внеклеточном образовании, таком, как внешний скелет у многих членистоногих. Вторые выполняют вспомогательную роль, "цементируя" основной "арматурный" материал в единое целое.
Основные структурные полисахариды
Целлюлозаобычна для всех растений, но встречается и у бактерий, грибов, низших животных (оболочников). Представляет собой линейный гомополисахарид из β-D-гликопиранозы, молекулы которой соединены связями β (1→4) (рис. II.56).ЧислоостатковD-глюкозы в молекуле полимера от нескольких тысяч до 10 тыс., а молекулярная масса, видимо, достигает 1-2 млн.
Хитинвстречается в животном мире, но его немало и в грибах. Это - гомополисахарид N-ацетилглюкозамина, молекулы которого образуют линейные цепи, аналогичные целлюлозным (рис. II.56). В природе они всегда связаны с белками, липидами и другими компонентами, поэтому выделить хитин в чистом виде довольно трудно. Именно хитин обеспечивает жесткость внешнего скелета многих представителей членистоногих.
Другие основные структурные полисахариды встречаются в водорослях и грибах. Чаще всего это гомополисахариды изD-маннозы,D-галактозы иD-ксилозы, причем они могут иметь ;как разветвленные цепи, так и линейные. Примеры того и другого типа даны на рис. II.56.
Вспомогательные структурные полисахариды
растений
Гемицеллюлоза- общее название различных сильно разветвленных полисахаридов (рис.II.57), состоящих из цепей ксилана, арабана, галактана, маннана, причем каждая цепь через определенное число звеньев может еще включатьD-ксилозу,D-глюкозу,D-галактозу,D-маннозу,L-арабинозу,L-фукозу, иногда производные глюкуроновой кислоты.
Пектины- гораздо менее разветвленные по сравнению с гемицеллюлозой полисахариды (рис.II.57). Известны в видепротопектинаи собственнопектина(растворимого). Протопектин не только входит в структуру клеточных стенок, но и является главным компонентом межклеточного вещества, особенно плодов и овощей. Его цепи состоят из поли-D-галактуроновой кислоты, карбоксильные группы которой в той или иной степени этерифицированы метанолом. Цепи включают также еще и некоторое число
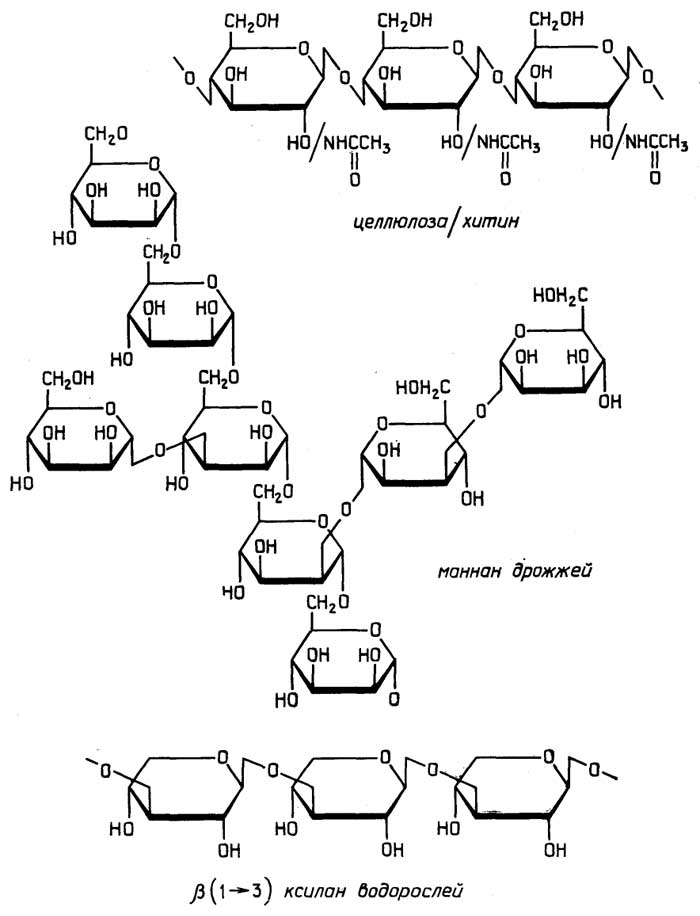
Рис. II.56.Основные структурные полисахариды
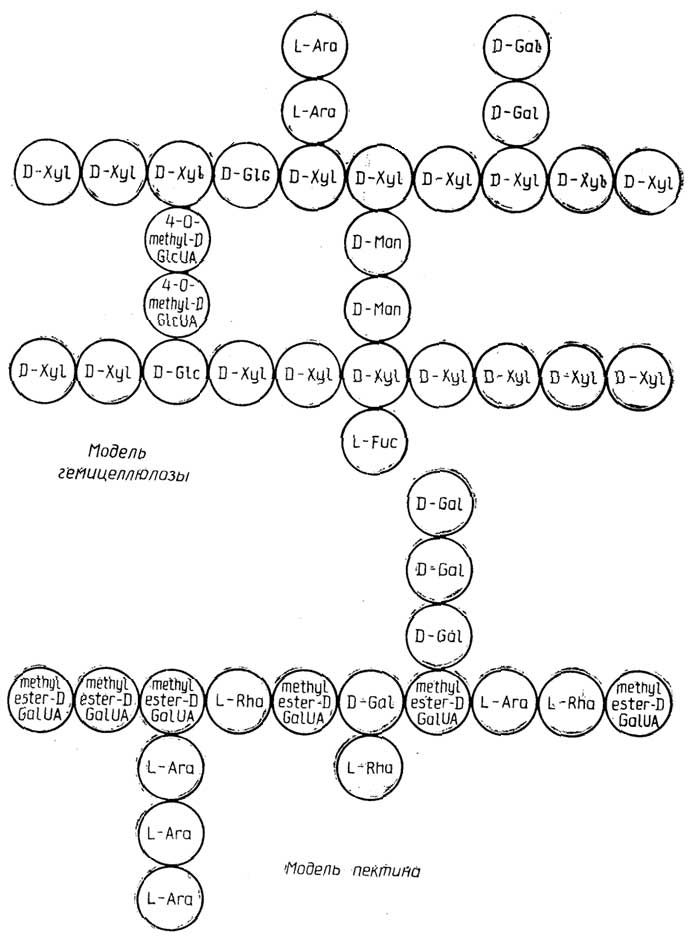
Рис. II.57.Вспомогательные структурные полисахариды растений
остатков других моносахаридов, таких, какD-галактоза,L-apaбиноза,L-рамноза. Цепи имеют ответвления обычно изD-галактозы иL-арабинозы, с помощью которых протопектины соединяются с другими полисахаридами, как основными, так и вспомогательными. Обрыв этих связей (в слабокислой среде) превращает протопектин в растворимый пектин, присутствующий обычно в соке плодов и овощей.
Вспомогательные структурные полисахариды
водорослей
В связи с тем, что клеточные стенки водорослей подвергаются значительно меньшим по сравнению с клеточными стенками растений нагрузкам, роль и доля основных структурных полисахаридов в водорослях незначительны. Вспомогательные
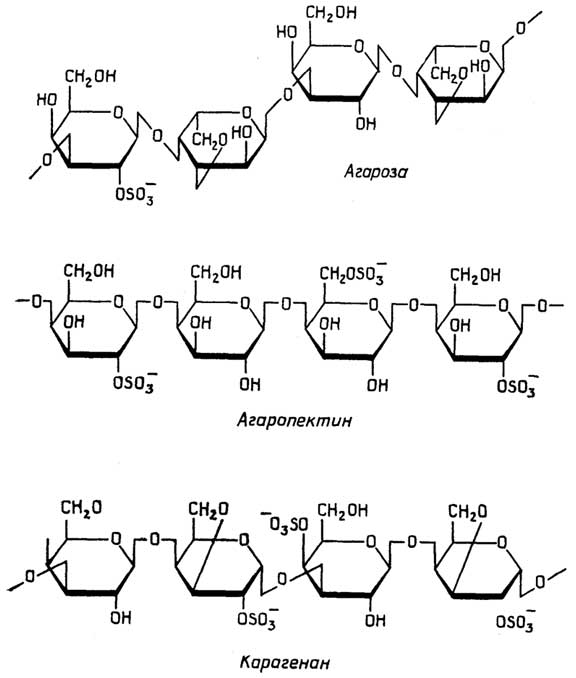
Рис. II.58.Вспомогательные полисахариды водорослей
структурные полисахариды в водорослях являются основоймежклеточного вещества.
Агар-агар(рис. II.58) состоит из двух компонентов: агарозы и агаропектина и добывается из красных морских водорослей.Агарозаобразована из цепей, повторяющимся звеном которых является дисахарид из β-D-галактозы и 3,6-ангидро-α-L-галактозы. Связь в дисахариде - β (1→4),связьмеждудисахаридами-α(1→3).Некоторыеизгидроксильныхгруппмогутбытьэтерифицированы сернойкислотой.Агаропектинобразован из цепей поли-β-D-галактозы, у которой гидроксильные группы частично этерифицированы серной кислотой.
Карагенан(рис. II.58) добывается, как и агар-агар, из красных водорослей и весьма его напоминает. Цепи образованы из дисахарида β-D-галактозы и 3,6-ангидро-α-D-галактозы. Связь в дисахариде - β (1→4),связьмеждудисахаридами-α(1→3).Гидроксильныегруппычастичноэтерифицированысернойкислотой.
Альгин, присутствующий в бурых и других морских водорослях, - это кислый гомополисахаридD-маннуроновой кислоты.
§ 7.
Полисахариды
с разными функциями
В эту группу попадают все полисахариды, не относящиеся к запасным или структурным. Они выполняют функции, находясь вне клетки: либо связанные с ее поверхностью, либо в свободном виде каквнеклеточные вещества.
Гликозаминогликаны
Гликозаминогликаны(мукополисахариды) - группа гетерополисахаридов, общей чертой которых является наличие в их составе остатков аминосахаров, а также кислых групп - карбоксильных или сульфатных: они составляют основумежклеточного вещества животных тканей, особенно соединительной. Большинство из них обычно связано с белками.
Гиалуроновая кислота(рис. II.59) - наиболее распространенный гликозаминогликан. Этот гетерополисахарид состоит из линейных цепей, повторяющимся звеном которых является дисахарид из β-D-N-ацетилглюкозамина и β-D-глюкуроновой кислоты. Связь в дисахариде - β (1→4),связьмеждудисахаридами-β(1→3).Гиалуроноваякислотавстречаетсявсвязанномисвободном виде.Особенноеемноговсиновиальной жидкостисуставных сумок, где ее вязкие растворы выполняют функциюзащитной смазки. У многих бактерий она входит в состав клеточной оболочки.
Хондроитмнсульфат, дерматансульфатикератансульфатпо структуре (рис. II.59), локализации в тканях и выполняемым
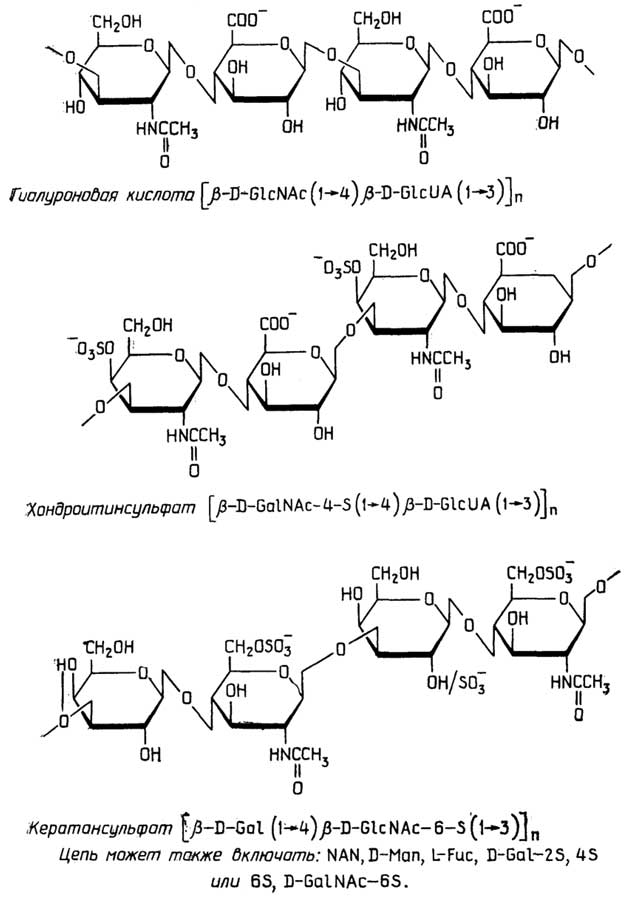
Рис. II.59.Гликозаминогликаны - внеклеточные полисахариды животных тканей
функциям напоминают гиалуроновую кислоту, но встречаются только в связанном с белками виде, в частности вмуцинах(см. с. 159, "Протеогликаны").
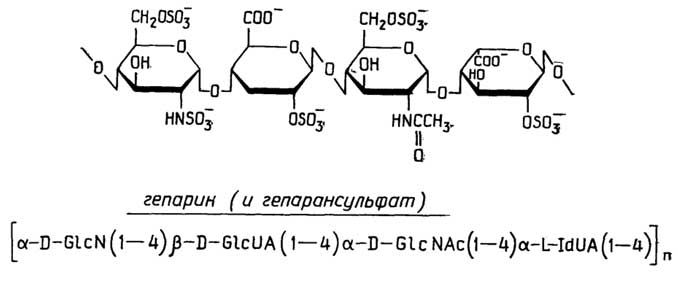
Рис. II.60.Гепарин и гепарансульфат
Гепарин(рис. II.60) структурно подобен многим мукополисахаридам, но выполняет другие функции. Связанный с белком, он присутствует на поверхности многих клеток, в частности клеток крови, где выполняет функцию антикоагулянта. Гепарин синтезируется и накапливается втучных клетках. Гепарансульфатотличается от гепарина лишь тем, что имеет меньше сульфатных групп и больше N-ацетильных.
Камеди
Это клейкие вещества, которые выделяют растения в местах повреждения, тоже кислые гетерополисахариды. Их цепи состоят из остатковD-галактозы иD-глюкуроновой кислоты и включают также некоторое количествоL-арабинозы иL-рамнозы.
§ 8.
Уровни структурной
организации полисахаридов
Понятие "уровень структурной организации", т. е. первичная, вторичная, третичная и четвертичная структуры, вполне применимо и к таким полимерам, как полисахариды.
Первичная структура
Первичная структураполисахаридов образуется за счет поликонденсации одного или нескольких (обычно не более четырех) различных моносахаридов. Она бываетлинейнойили в разной степениразветвленной. Линейные цепи характерны для основных структурных гликанов (целлюлоза, хитин,D-ксилан некоторых водорослей), а также вспомогательных структурных гликанов животных тканей (гликозаминогликанов). Разветвленные цепи характерны для запасных гликанов (амилопектин4, гликоген, декстран) и вспомогательных структурных гликанов растительных тканей (гемицеллюлоза, пектин).
Отличие первичной структуры полисахаридов от первичной структуры белков:
цепи полисахаридов состоят из повторяющихся звеньев, а цепи белков обычно не имеют повторов; те белки (коллаген, экстенсии), у которых цепи состоят из небольшого набора аминокислот и имеют повторяющиеся звенья, обладают определенным сходством с некоторыми гликанами (например,D-ксиланом водорослей);
цепи полисахаридов в отличие от белковых цепей бывают разветвленными.
Вторичная структура
Вторичная структураполисахаридов и белков возникает в силу одних закономерностей. В цепях белков чередуются одна жесткая полипептидная связь и две подвижные одинарные. В цепях гликанов роль жесткой связи играет моносахаридный цикл, за которым следует гликозидная связь, представляющая собой две подвижные одинарные связи, которыми атом кислорода связывает моносахаридные остатки (рис. II.61). Таким образом,
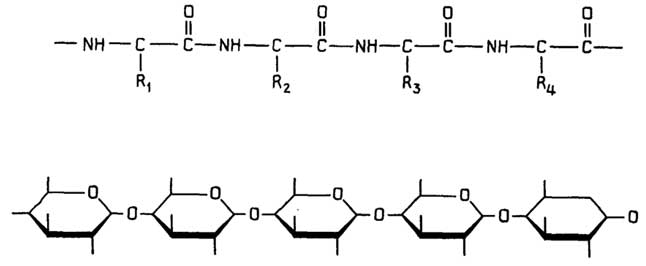
Рис. II.61.Сравнение гибкости белковой и полисахаридной цепей
можно считать, что при образовании вторичной структуры гибкость полимерной цепи гликанов и белков определяется одинаковым числом степеней свободы. Это подтверждается на практике. Вторичные структуры гликанов весьма напоминают вторичные структуры белков.
Ленточные структуры, похожие на β-слои белков, характерны дляцеллюлозыихитина. Их образование объясняется, во-первых, тем, что целлюлоза и хитин склонны давать жесткие линейные цепи, жесткость которых обусловлена экваториальным расположением гидроксильных групп β-D-глюкозы и наличием из-за этого водородных связей вдоль цепи (рис. II.62), а во-вторых,
Рис. II.62.Образование внутрицепочечных водородных связей в поли-β-D-глюкозе
тем, что параллельное расположение таких жестких цепей стабилизировано возникновением многочисленных межцепочечных водородных связей (рис. II.63). Этими же причинами
Рис. II.63.Вторичная структура целлюлозы, напоминающая параллельный β-слой белков
объясняется плохая растворимость целлюлозы (β-белки тоже плохо растворимы).
Спиральные структурыобразуются многими гликанами:
левая одинарная спиральс 6 моносахаридными остатками на виток характерна для α-амилозы;
левая одинарная спиральс 4 остатками на виток - длягиалуроновой кислоты;
левая двойная спиральс 3 остатками на виток каждой цепи обнаружена уагарозы;
левая двойная спиральс параллельным или антипараллельным ходом цепей и с 6 остатками на виток для каждой цепи, видимо, также возможна для α-амилозы(и для линейных участков амилопектина);
правая двойная спиральс 3 остатками на виток каждой цепи лежит в основе структурыкарагенана. Особенность ее в том, что одна из цепей накручивается на другую со сдвигом на полвитка;
правая тройная спиральс параллельным ходом цепей и с 6 остатками на виток для каждой цепи обнаружена уD-ксилана, основного структурного гликана некоторых водорослей. Она имеет определенное сходство с тройной суперспиралью коллагена.
Основные спиральные структуры полисахаридов в поперечном: сечении показаны на рис. II.64.
Третичная структура
Третичная структураполисахаридов - это, как и в белках, пространственная укладка слоев, спиралей, а при отсутствии таковых - пространственное расположение полимерных цепей. Среди третичных структур гликанов можно выделить несколько типичных.
Жесткие волокнаформируются уцеллюлозыиз свернутых двухцепочечных лент. Такие волокна, стабилизированные многочисленными межцепочечными водородными связями, довольно жестки, нерастяжимы и выдерживают на разрыв громадные нагрузки, что важно для растительных клеток. Аналогичные волокна, видимо, составляют основухитина.
Гибкие волокнав клеточных стенках некоторых водорослей образованы из правых тройных спиралейD-ксилана, со стабилизацией также за счет межцепочечных водородных связей. Они очень похожи на фибриллы тропоколлагена. Такие волокна выдерживают достаточно большие нагрузки на разрыв, но обладают еще и значительной гибкостью, что более подходит для клеток водорослей.
Сложноразветвленные компактные структурыглобулярной формы образуют запасные полисахариды, такие, какамилопектин, гликоген, декстраны. Спирали α-амилозы, как одиночные, так и ассоциаты из них, могут входить в состав таких глобулярных молекул.
Сложноразветвленные рыхлые неупорядоченные структурыхарактерны для вспомогательных структурных гликанов растений, таких, какгемицеллюлозыипротопектины. Такое строение определяется их функцией - "склеивать" волокна основных структурных полисахаридов в целую клеточную стенку, а клетки - в одну ткань.
Рис. II.64.Спиральные структуры полисахаридов в поперечном сечении
Пространственно-сетчатые рыхлые структуры, нити которых состоят из множества спиралей, присущи гельобразующим кислым полисахаридам, таким, какагар-агар, карагенан, альгин, растворимые пектины, камеди. Эти структуры весьма близки предыдущим и отличаются от них лишь наличием большого количества спиралей. Можно считать, что они "склеивают" не основные структурные гликаны, а просто определенное количество воды вместе с растворенными в ней веществами, вследствие чего возникают полужесткие структуры.
Пространственно-неупорядоченные подвижные структурыможно приписатьгиалуроновой кислоте. Они характеризуются тем, что связи между соседними спиралями легко разрушаются и возникают вновь; поэтому гели гиалуроновой кислоты выполняют функции не просто межклеточного вещества, но и внеклеточной смазки, везде, где имеет место трение тканей.
Четвертичная структура
Четвертичная структураполисахаридов - это не более чем следующий после третичной структуры этап пространственной организации полисахаридов. К проявлению четвертичной структуры, несомненно, можно отнести:
образование кристаллических областей в структуре целлюлозы, состоящих из упорядоченно уложенных крест-накрест слоев целлюлозных волокон;
образование кристаллических областей в зернах крахмала, состоящих, видимо, из упорядоченно и плотно уложенных глобул амилопектина, включающих и спираль α-амилозы; последняя, но в виде более скрученных двойных спиралей с параллельным или антипараллельным ходом цепей, видимо, также способна формировать кристаллические области: в составе зерен крахмала.
4α-Амилозу можно рассматривать как промежуточный продукт при образовании амилопектина.
Глава 12
СОЕДИНЕНИЯ УГЛЕВОДОВ
С ДРУГИМИ ВЕЩЕСТВАМИ
§ 9.
Молекулярные образования углеводов
с пептидами и белками
Пептидогликаны- структуры из полисахаридных цепей, "сшитых" короткими пептидами (рис.II.65).
Протеогликаны- соединения полисахаридов с белками, в которых основную часть составляют полисахариды. К этим же соединениям относятся муцины (мукопротеины) из слизевых секретов пищеварительного тракта. В протеогликанах полисахариды в большом количестве присоединены гликозидными связями к развернутой белковой цепи. Предполагается, что такие протеогликаны могут объединяться в громадные ассоциаты, общей основой которых является гиалуроновая кислота (рис.II.66).
Гликопротеины- сложные белки с одной или несколькими простетическими группами из моносахарида, олигосахарида или полисахарида (рис. 66,Б). В гликопротеинах доля по массе углеводной части меньше доли белковой части. Гликопротеины широко распространены во всех видах организмов, но особенно их много в животных клетках. К ним относятся ферменты, антитела, транспортные белки, гормоны, белки-рецепторы и т. д.
Рис. II.65.Пептидогликан клеточных стенок бактерий
Функции углеводной частигликопротеина разнообразны, но все сводятся к роли метки, которая обеспечивает опознание данного гликопротеина другими молекулами или клетками, специфически с ней взаимодействующими. Такое
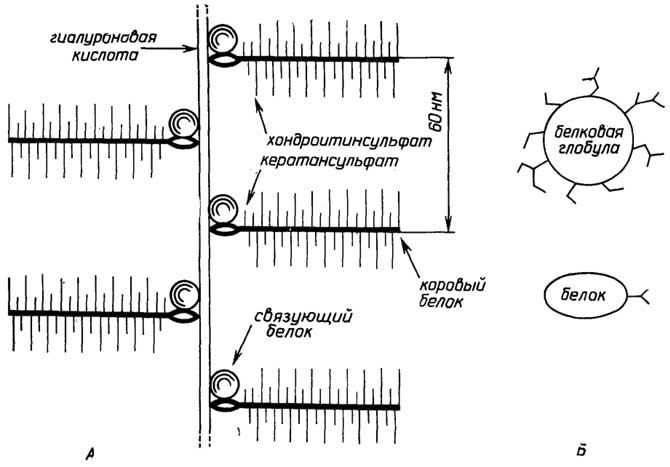
Рис. II.66.Протеогликан (А) и гликопротеины (Б)
взаимодействие лежит в основе функционированияиммунной системы высших животных, а также системы защиты растений от многих заболеваний. Частным, но наглядным примером роли углеводной метки является ее определяющее влияние на групповую принадлежность крови (рис. II.67).
Бесчисленное множество вариантов углеводных метокв гликопротеинах и (гликолипидах) обусловлено большим разнообразием их состава и структуры. Еслиразнообразие составасвязано с участием в построении углеводной цепи множества изомеров и их производных, торазнообразие структурыопределяется множеством вариантов связей между моносахаридными остатками с возможностью ответвлений.
Образование гликопротеинов из белков, синтезированных на рибосомах шероховатого эндоплазматического ретикулума, происходит с помощью ферментов, находящихся на мембранах аппарата Гольджи. Считается, что углеводами метятся (гликозилируются) в основном белки, которые предназначены функционировать либо в составе клеточной оболочки, либо вне клетки. Белки, которые клетка синтезирует для себя и которые
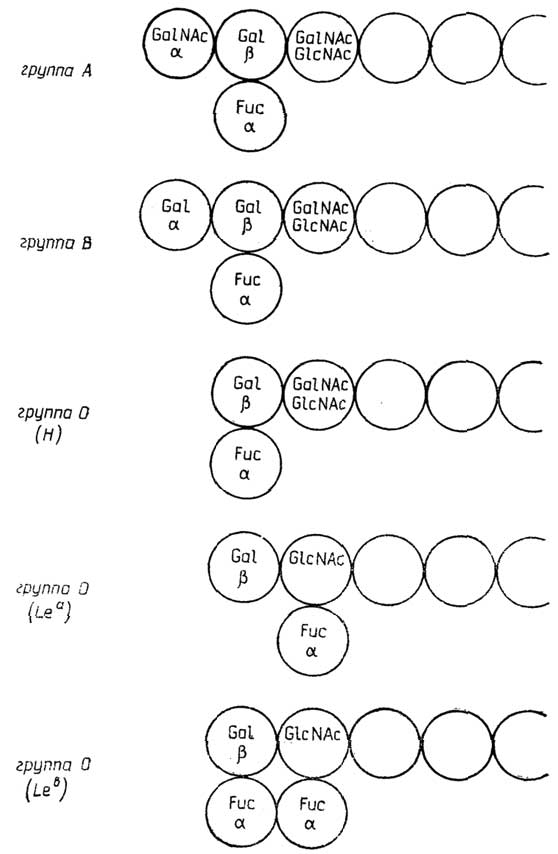
Рис. II.67.Антигенные детерминанты эритроцитов, определяющие группы крови человека
должны функционировать внутри нее (в цитоплазме), остаются не гликозилированными. Они синтезируются на свободных рибосомах, не прикрепленных к мембранам эндоплазматического ретикулума.
§ 10.
Структура клеточных стенок растений,
водорослей, грибов и бактерий
Клеточные стенки растений, особенно древесных, выдерживают колоссальные нагрузки. Их строение напоминает структуру железобетона.Основнымструктурным материалом являются волокнацеллюлозы. Расположенные параллельно друг другу, они образуют перекрещивающиеся слои.Вспомогательныйструктурный материал -гемицеллюлоза, протопектины, гликопротеинэкстенсин, по составу и структуре напоминающий фибриллярный белок коллаген, и сложноразветвленный полимерлигнин(м. м. около 10000), мономером которого являетсяконифериловыйспирт (рис. II.68).
Рис. II.68.Конифериловый спирт -мономер лигнина. Стрелками показаны возможные места образования связей в полимере |
|
Все компоненты клеточных стенок связаны между собой и с целлюлозными волокнами в единую структуру. Лигнин встречается в клеточных стенках только древесных растений, придавая им ту твердость, которая отличает их от травянистых растений.
Клеточные стенки протистов с растительными признаками, таких, как водоросли и грибы, должны быть достаточно крепкими, но в то же время не столь жесткими, как у древесных растений. Принцип их построения тот же, что и у растений: основные структурные гликаны сцементированы вспомогательными.
У водорослей основные структурные гликаны - это волокна изцеллюлозыидругих гликанов, которые могут быть сформированы из спиралей, как например волокнаD-ксилана. Часто встречаются волокна из поли-D-маннозы, а также из поли-D-глюкозы, в которой мономеры соединяются связями (1→2), (1→3).Вспомогательныеструктурныегликаныводорослей-эторазличныегельобразующие гликаны с кислыми группами, склонные к образованию спиралей.
У грибов основным структурным гликаном кромецеллюлозывыступаетхитин, а такжедругие полисахариды, в частностиманнаны. Вспомогательным структурным материалом в грибах являютсягликопротеины.
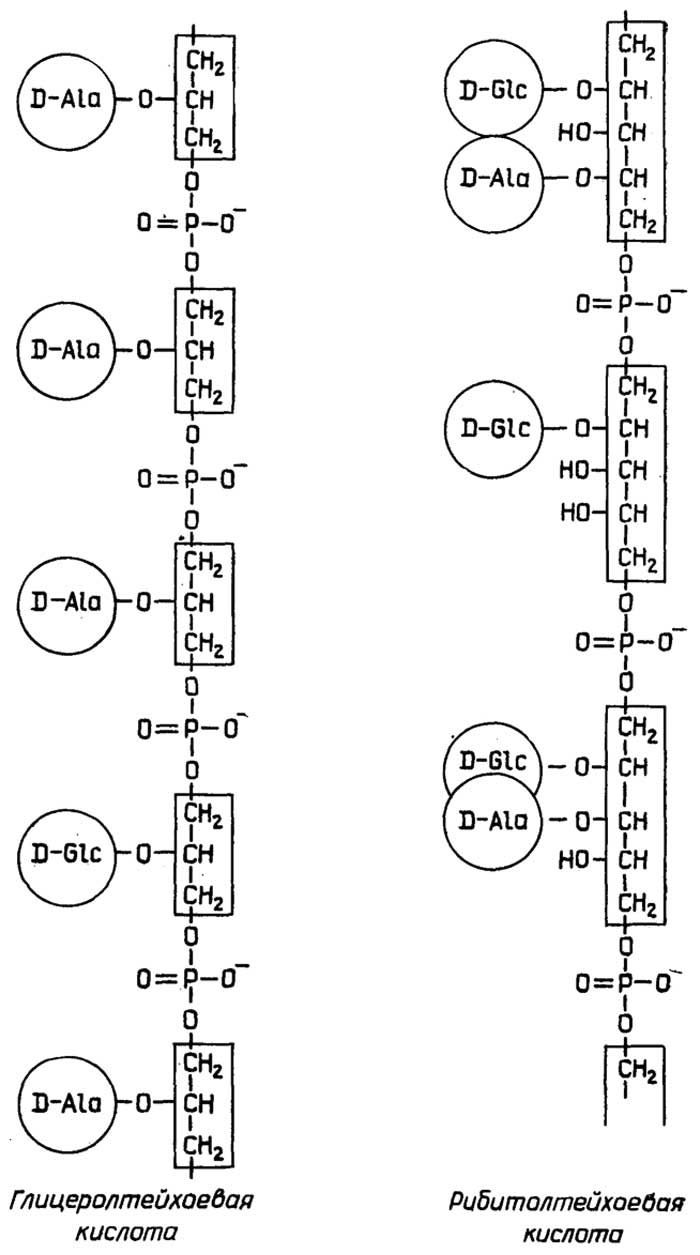
Рис. II.69.Тейхоевые кислоты
Клеточные стенки бактерий должны быть достаточно прочными, чтобы обеспечить выживание микроорганизмов в изменчивых условиях внешней среды. Жесткие клеточные стенки всех бактерий, кроме микоплазм, построены из сплошного пептидогликана, называемого ещемуреином. У грамположительных бактерий он имеет структуру, изображенную на рис. II.65, с вариациями в составе пептидов, которые связаны с видом микроорганизма. У грамотрицательных бактерий пептидные "сшивки" типа пентаглициновых мостиков отсутствуют, и пептидные отростки полисахаридных цепей связываются напрямую. Кроме того, муреиновый мешок грамположительных бактерий многослойный и в несколько раз толще, чем у грамотрицательных бактерий. Его слои пронизывают и скрепляют, присоединяясь к ним за счет фосфодиэфирных связей,тейхоевые кислоты(рис. II.69), основа которых - цепь из остатков либо глицерина (глицеролтейхоевые кислоты), либо рибита (рибитолтейхоевые кислоты), соединенных фосфодиэфирными связями. Срединные атомы углерода в остатках глицерина или рибита за счет сложноэфирных связей присоединяют аминокислоты (чаще всегоD-аланин) или за счет гликозидных связей - различные моносахариды (обычноD-глюкозу,D-галактозу, их ацетиламины,L-рамнозу). Внешние концы тейхоевых кислот выступают из клеточной стенки наружу и определяют антигенную специфичность микроорганизма. Внутренние концы тейхоевых кислот часто имеют липидный характер, и тогда они погружены в липидную же плазматическую мембрану, связывая ее таким образом с клеточной стенкой. Помимо тейхоевых кислот в структуре муреинового мешка обнаружены небольшие количества других полисахаридов, пептидов и белков, которые, видимо, в определенной степени выполняют те же функции, что и тейхоевые кислоты.
Раздел В
ЛИПИДЫ И БИОМЕМБРАНЫ
Липиды- общее название весьма разнородных веществ, которые плохо растворяются в воде, но могут быть экстрагированы из живой ткани органическими растворителями. В отличие от веществ других классов, т. е. белков, нуклеиновых кислот и полисахаридов,большинство липидов не являются полимерами.
По общности строения и по способности к гидролизуподавляющее большинство липидов можно отнести либо к омыляемым, либо к неомыляемым.Омыляемые липидыв результате гидролиза распадаются на несколько (обычно не более четырех) структурных компонентов.Неомыляемые липиды, или изопреноиды, представляют собой либо короткие полимерные цепи из изопрена, к одному концу или к обоим концам которых иногда присоединены простые органические молекулы, либо эти соединения - производные изопрена.
Основные функции липидов:
запасание и хранение энергии и атомов углерода (при окислении 1 г нейтральных жиров выделяется 9 ккал энергии);
защитная функция: например, липидный слой кожи животных защищает их от механического и температурного воздействий, а липидный покров листьев предотвращает проникновение бактерий и избыточное испарение воды;
главные структурные компоненты клеточных мембран;
регуляторы метаболизма - это липидные гормоны, витамины, а также родственные липидам соединения - производные некоторых жирных кислот: простагландины и лейкотриены.
Глава 13
ОСНОВНЫЕ ТИПЫ ЛИПИДОВ
И РОДСТВЕННЫЕ ИМ БИОЛОГИЧЕСКИ
АКТИВНЫЕ СОЕДИНЕНИЯ
§ 1.
Омыляемые липиды
Структурные компоненты
Структурные компоненты природных омыляемых липидов можно условно разбить на пять групп:А, В, С, D, E.
Компоненты А- это жирные кислоты и алифатические спирты.
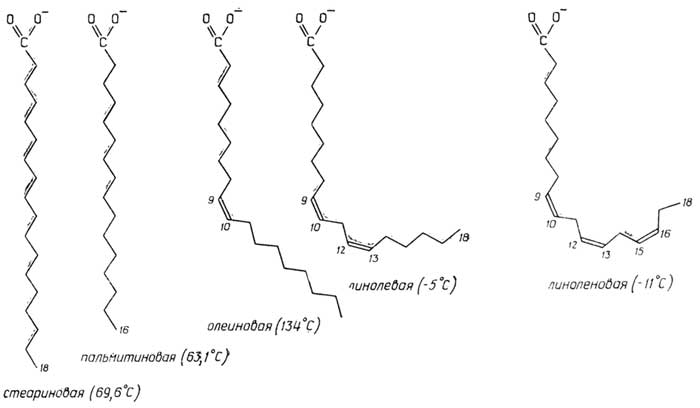
Рис. II.70.Наиболее распространенные жирные кислоты
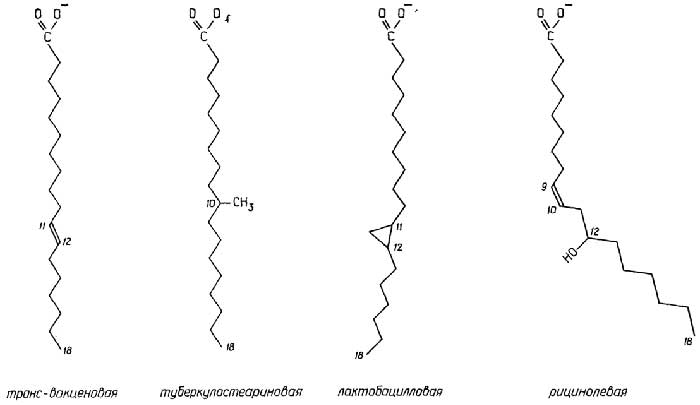
Рис. II.71.Редкие жирные кислоты
Жирные кислотылипидов - это монокарбоновые кислоты салифатической цепью. Их обнаружено около 70. Обычно они имеют линейные цепи с четным числом атомов углерода от 12 до 20. Реже встречаются более короткие или более длинные цепи, а также жирные кислоты с нечетным числом атомов углерода. Кроме того, иногда встречаются жирные кислоты, в алифатических цепях которых находятся заместители, такие, как метиловые,
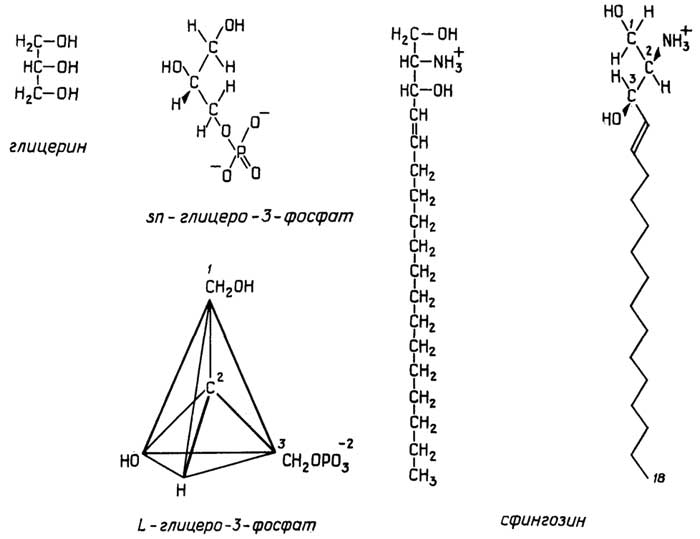
Рис. II.72.Глицерин и сфингозин
гидроксильные и карбонильные группы, эпоксигруппы или даже циклопропановые или циклопентановые группировки. Значительное число жирных кислот липидов, особенно растительного происхождения, является ненасыщенными карбоновыми кислотами. Они могут иметь одну или несколько двойных связей, которые чаще всего имеютцис-конфигурацию и крайне редко бывают сопряженными (обычно они разделены метиленовыми группами). Температура плавления жирных кислот понижается с увеличением числа двойных связей в цепи и укорочением самой цели. В жирных кислотах липидов иногда встречаются и тройные связи. Наиболее часто встречающиеся жирные кислоты показаны на рис. II.70, более редкие - на рис. II.71.
Алифатические спиртыкак компоненты липидов имеют длину цепи, сравнимую с длиной цепи жирных кислот или несколько бо́льшую (до 32 углеродных атомов). Они бывают насыщенные и ненасыщенные, с четным и нечетным числом атомов углерода.
Компоненты В- этоглицеринисфингозин(рис. II.72). Так как глицерин в составе липидов обычно имеет вместо гидроксильных групп различные заместители, его центральный атом углерода становится хиральным. В таком случае природные соединения глицерина в соответствии с правиламистереоспецифической(sn) нумерации атомов углерода соответствуютL-энантиомерам. Сфингозин отличается от глицерина наличием длинного алифатического хвоста у атома С3и заменой гидроксильной группы на аминогруппу у атома С2. Алифатический хвост в сфингозине имеет двойную связь втранс-конфигурации между атомами С4и С5. Наиболее распространен сфингозин с длиной цепи 18 атомов углерода, но известны сфингозины с более короткой (16, 17 атомов углерода) и более длинной цепью (19, 20 атомов углерода). Аминогруппа и гидроксильная группа у хиральных атомов С2и С3соответственно находятся вD-положении, но в пространстве направлены в разные стороны (см. рис. II.72). Наряду со сфингозином в природных липидах встречается идигидросфингозин, не имеющий двойной связи в алифатическом хвосте.
Компонент С- этоортофосфорная кислота.
Компоненты D- это обычноэтаноламин, холиниL-серин, показанные на рисунке:
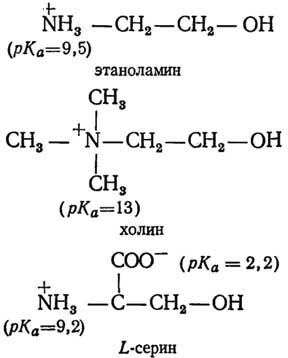
Компоненты Е- этоглицерин, инозит, моносахаридыиолигосахариды.
Классификация
Классификация омыляемых липидов и их названия связаны с набором структурных компонентов и порядком их соединения (рис. II.73).Простые липидысостоят либо из двух компонентов
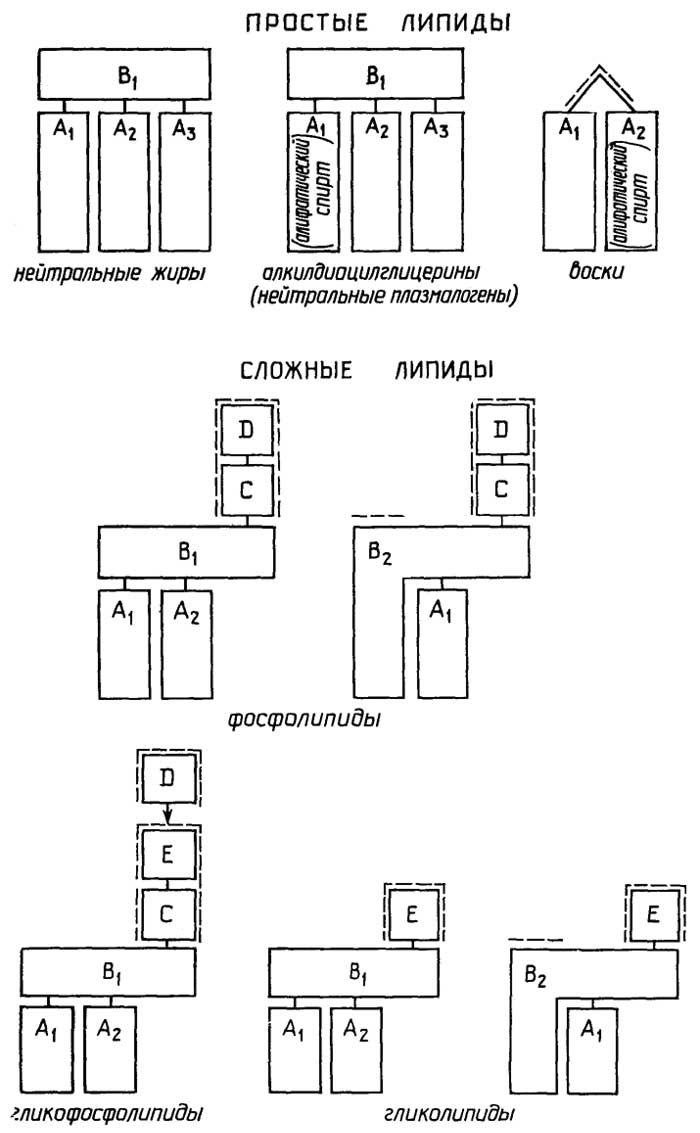
Рис. II.73.
Классификация липидов.
Гидрофильные части молекул
обозначены штриховой линией
А, соединенных сложноэфирной связью, либо из компонентовA, соединенных с компонентом В, который в таком случае может быть только глицерином.Сложные липидысостоят из более чем двух компонентов. К ним относятся:фосфолипиды, имеющие составABCD;гликофосфолипиды - АВСЕилиABCED;гликолипидыс формулойABE;сфинголипиды- любые липиды, содержащие в качестве компонентаВсфингозин.
Простые липиды, выполняющие главным образом энергетическую и защитную функции
Воски- это сложные эфиры жирных кислот и алифатических спиртов. Они образуют защитное покрытие листьев, плодов, защитную смазку перьев и кожи. Они являются основной формой энергетических запасов многих микроорганизмов морского планктона. Наиболее известны пчелиный воск и спермацет кашалотов. Основой первого является мирицилпальмитат, а второго - цетилпальмитат:
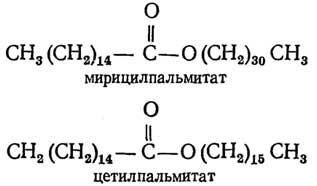
Нейтральные жиры(рис. II.74) - это сложные эфиры жирных кислот и глицерина: моноацил-, диацил- и триацилглицерины. Последние наиболее распространены. В триацилглицеринах могут содержаться одинаковые жирные кислоты, но чаще они разные, причем к С2-атому обычно присоединена ненасыщенная жирная кислота. Триацилглицерины животного происхождения переходят в жидкое состояние при более высокой температуре, чем триацилглицерины растительного происхождения. Первые отличаются от вторых большим содержанием насыщенных жирных кислот.
Простые эфиры диацилглицеринов(рис. II.74) отличаются от нейтральных жиров тем, что вместо жирной кислоты к глицерину в положении С1присоединен простой эфирной связью алифатический спирт, который может быть насыщенным или ненасыщенным. Они присутствуют в живых тканях в крайне малых количествах.
Нейтральные плазмалогены(рис. II.74) - простые эфиры диацилглицеринов с ненасыщенным алифатическим спиртом, у которого двойная связь находится в положении между первым и вторым атомами углерода, и имеет цис-конфигурацию. Такие 1-α, β-алкенил-2,3-диацилглицерины при гидролизе в кислой среде дают (помимо двух жирных кислот и глицерина) α, β-ненасыщенный спирт, который претерпевает немедленную перегруппировку в альдегид (плазмал).
Рис. II.74.Простые липиды на основе глицерина
Некоторые более редкие липиды
с энергетической функцией
Диольные липиды- эфиры некоторых диолов (рис. II.75) с компонентамиА, т. е. жирными кислотами и алифатическими спиртами. Встречаются моно- и диацильные производные диолов,
Рис. II.75.Диолы - основа некоторых липидов
простые диэфиры, смешанные алкил-, алкенил- и ацилпроизводные диолов и другие аналоги глицеринсодержащих липидов. Диольные липиды обнаружены в небольших количествах в растительных и животных тканях, в микроорганизмах. Их роль, видимо, сводится к энергетическому, а возможно, и структурному резерву.
Поли-β-D-оксибутират(рис. II.76) - запасное вещество многих бактерий, является "нетипичным" липидом. Его молекула представляет собой 1500 остатков β-D-оксимасляной кислоты, единственная неразветвленная цепь которой свернута в плотную правую спираль. Эта спираль в свою очередь, складываясь многократно, образует в клетке тонкие (5 нм) плоские пластины.
Фосфолипиды - основные структурные компоненты биомембран. Это сложные липиды, в составе которых присутствуют четыре типа компонентов:А, В, С, D. В зависимости от природы компонентаВих подразделяют на глицерофосфолипиды и сфингофосфолипиды.
Глицерофосфолипиды- производныефосфатидных кислот(рис. II.77), которые представляют собой сложные эфиры глицерина с двумя жирными кислотами и ортофосфорной. Фосфатидные кислоты в свободном виде в тканях практически не обнаруживаются, но соединенные сложноэфирной связью с этаноламином, холином илиL-серином образуют широко распространенные глицерофосфолипиды:фосфатидилэтаноламин(кефалин),фосфатидилхолин(лецитин) ифосфатидилсеринсоответственно (рис. II.77).
Простые эфиры глицерофосфолишдов(рис. II.78) с насыщенным или ненасыщенным алифатическим спиртом, присоединенным
Рис. II.76.β-D-оксимасляная кислота и поли-β-D-оксибутират
к С1-атому глицерина, встречаются в тканях значительно чаще, чем простые эфиры диалцилглицеринов.
Фосфатидали(рис. II.79) - это плазмалогены, но в отличие от нейтральных плазмалогенов они являются глицерофосфолипидами.
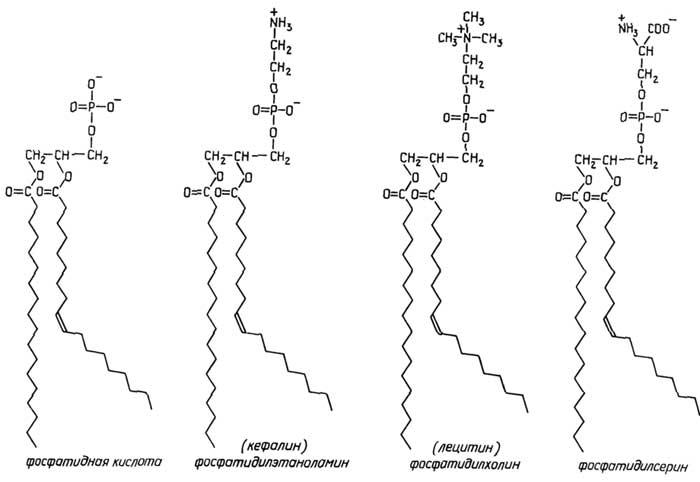
Рис. II.77.Наиболее распространенные глицерофосфолипиды
Сфингофосфолипиды- производныецерамидов(рис. II.79), которые представляют собой сфингозины (или дигидросфингозины), ацилированные жирной кислотой по аминогруппе. Церамиды в свободном виде в тканях почти не встречаются, но соединенные за счет сложноэфирной связи через фосфат с холином образуют широко распространенные сфинголипиды, которые называются;сфинго миелинами.
§ 2.
Неомыляемые липиды (изопреноиды)
Структурным компонентом изопреноидов являетсяизопрен. Он выполняет роль мономера, из которого строятся олигомерные или полимерные цепочки неомыляемых липидов. Обычно остатки изопрена соединяются в периодическую последовательность "голова к хвосту", но встречаются и связи "хвост к хвосту":
Классификация
Классификация неомыляемых липидов основана на традиционном разделении их на две группы:терпеныистероиды.
Терпены
Это олигомерные и полимерные вещества, молекулы которых составлены из остатков изопрена. Терпены, молекулы которых представляют собой соединения из 2, 3, 4, 6, 8 молекул изопрена, называют соответственно: монотерпены, сесквитерпены, дитерпены, тритерпены и тетратерпены. Молекулы терпенов могут иметь линейную или циклическую (даже полициклическую) структуру, а также структуру, которая имеет одновременно и линейные и циклические участки. Двойные связи в линейных участках обычно имеюттранс-конфигурацию, однако встречаются и терпены, в которых одна или больше связей могут иметьцис-конфигурацию, В молекулах терпенов некоторые углеродные атомы могут нести на себе гидроксильные, карбонильные и карбоксильные группы,
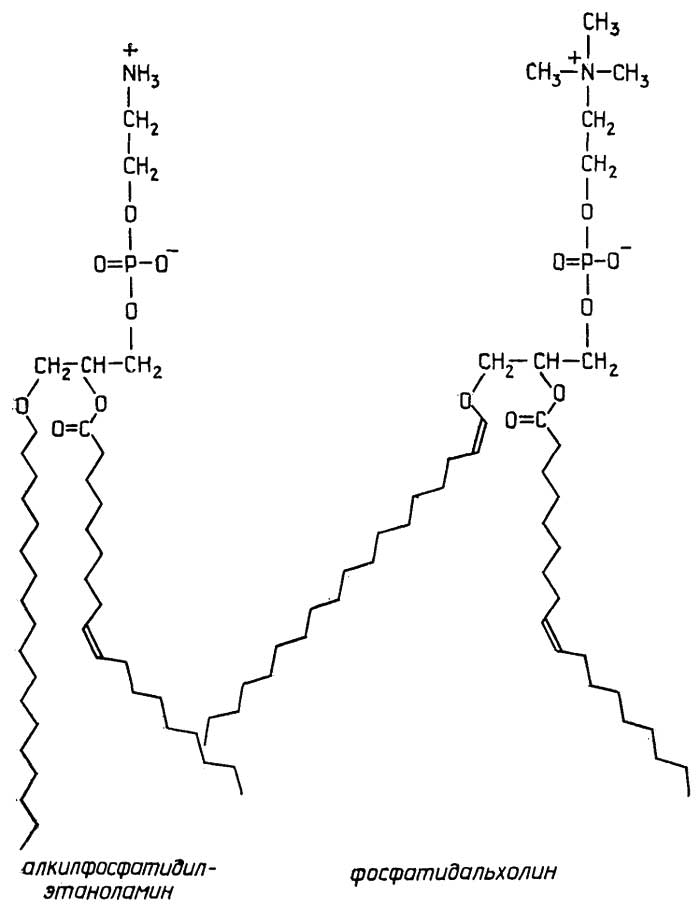
Рис. II.78.Простые эфиры глицерофосфолипидов
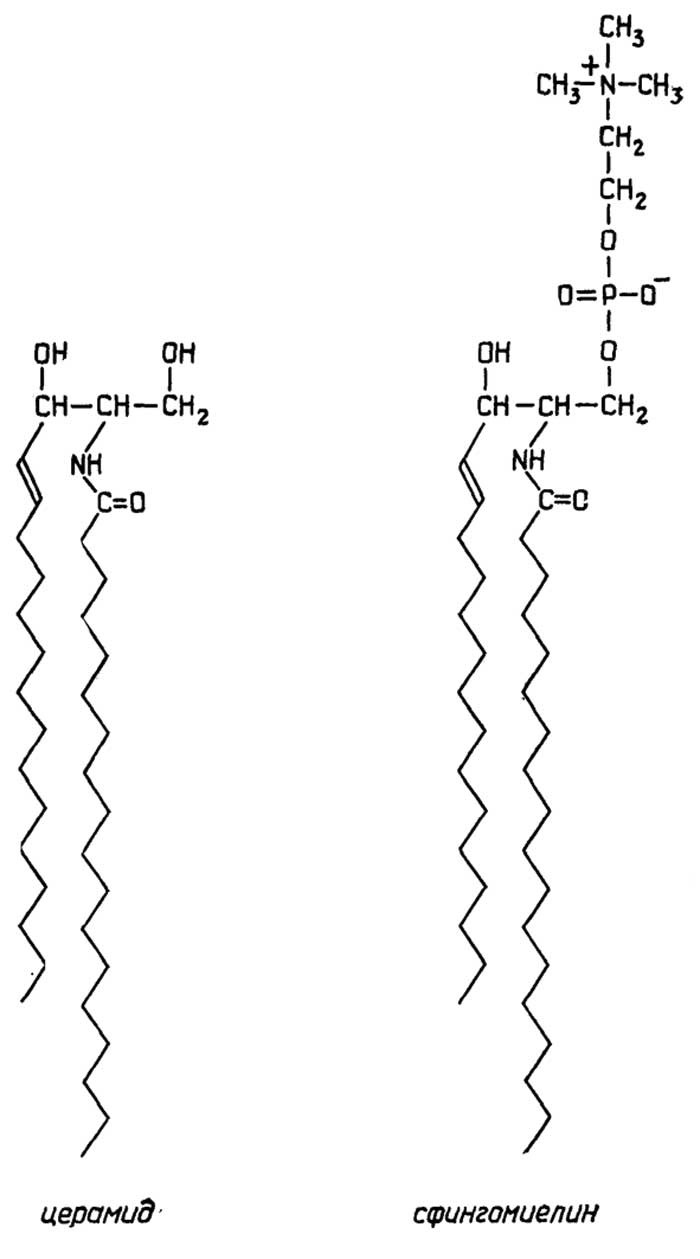
Рис. II.79.Сфингофосфолипиды
Рис. II.80.Наиболее известные монотерпены
Рис. II.81.Важные сесквитерпены
Рис. II.82.Основные дитерпены
Рис. II.83.Важные тритерпены
т. е. терпены могут быть спиртами, альдегидами, кетонами, органическими кислотами.
Монотерпены(рис. II.80) - это летучие жидкие вещества с приятным запахом; они - основные компоненты душистыхэфирных, масел, получаемых из растительных тканей (цветов, листьев, плодов). Ряд монотерпенов являютсяферомонами-веществами, с помощью которых насекомые передают друг другу информацию. Так, в частности, некоторые эфирные масла служат феромонами опасности.
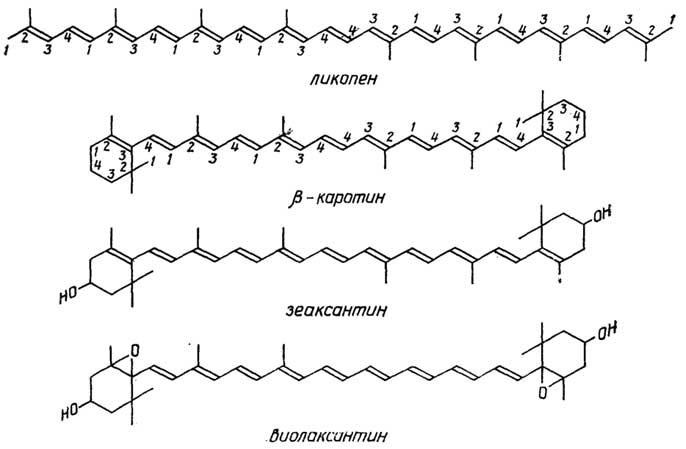
Рис. II.84.Тетратерпены (каротиноиды)
Сесквитерпены(рис. II.81) также входят в состав эфирных масел. Структуру сесквитерпенов имеют некоторые гормоны насекомых и растений. Так, например,6,7-транс-фарнезолиювенильный гормонрегулируют процесс превращения гусеницы в бабочку, аавсцизовая кислотаучаствует в регуляции развития высших растений, выполняя роль ингибитора роста.
Дитерпены(рис. II.82) - это, например,смоляные кислоты, известные какканифоль. Главным ее компонентом являетсяабиетиновая кислота. Ее натриевая соль известна как хозяйственное мыло.Витамин А- это моноциклический дитерпен.Фитол- дитерпеновый спирт, соединенный сложноэфирной связью с порфириновым ядром хлорофилла. Дитерпеновые цепи входят в составвитаминов ЕиК1.
Тритерпены(рис. II.83). Из них наиболее известенсквален, в относительно большом количестве присутствующий в печени
Рис. II.85.Терпеновые переносчики водорода в окислительно-восстановительных реакциях
акулы, а также в секретах сальных желез кожи человека. Тритерпеновая цепь входит в составвитамина K2.
Тетратерпены(рис. II.84) - это прежде всего различные цветные пигменты. Одни из них накапливаются в тех частях растений, где происходит запасание питательных веществ (например, томаты, морковь), другие являются участни-ками процессов поглощения света у многих фотосинтезирующих организмов.
Терпены с длиной цепи более восьми изопреновых остатков(рис. II.85).Убихиноны(коферменты Q) участвуют в окислительно-восстановительных реакциях, протекающих в бактериях и митохондриях. Наиболее распространен убихинон с пентатерпеновой цепью - коферментQ10, но известны также коферментQ8и коферментQ6.Пластохиноны- аналоги убихинонов, но встречаются только в хлоропластах растительных клеток. Наиболее распространен пластохинонАс терпеновой цепью из 9 остатков изопрена, но известны пластохиноны с 6, 8 и 10 остатками изопрена.
Политерпены - каучук, гуттаперча. Цепи первого состоят из остатков изопрена с двойными связями вцис-конфигурации, цепи второго содержат остатки изопрена с двойными связями втранс-конфигурации.
Стероиды
Стероиды можно рассматривать как полициклические производные тритерпена сквалена. Цепь последнего складывается так, что образуется структура стероидного скелета пергидроциклопен-танфенантрена (рис. II.86). Последующая ферментативная модификация этого , скелета ведет к образованию различных стероидов.
Общие черты многих стероидов:
жесткость структуры, состоящей из трех конденсированных "кресел" (рис. II.87);
наличие заместителей - гидроксильной или кетонной группы у атома С3; метальных групп у атомов С4, С10, С13, С14;
наличие алифатических "хвостов" различной длины и структуры, присоединенных к атому С17;
присутствие в кольцах А и В одной или нескольких двойных связей.
Заместители в кольцах, как и сами атомы водорода, могут быть аксиальными или экваториальными. Независимо от этого считается, что заместитель (или сам атом водорода) имеет α-ориентацию, если он расположен в пространстве дальше от наблюдателя, и β-ориентацию - если расположен ближе к наблюдателю. В связи с этим стероидные молекулы могут иметь конформационные разновидности. Так, например, если аксиально расположенные атом водорода у С5и метиловая группа у С10имеют β-ориентацию, молекула стероида обладает нормальной (цис-) конформацией. Если атом водорода у С5имеет α-ориентацию, а метиловая группа у С10- β-ориентацию, то молекула стероида обладает алло- (транс-) -конформацией. При написании плоских структурных молекул принято α-заместители соединять со стероидным скелетом пунктирной линией, а β-заместители - сплошной.
Классификация стероидовсвязана с природой и количеством заместителей, а также наличием в циклах двойных
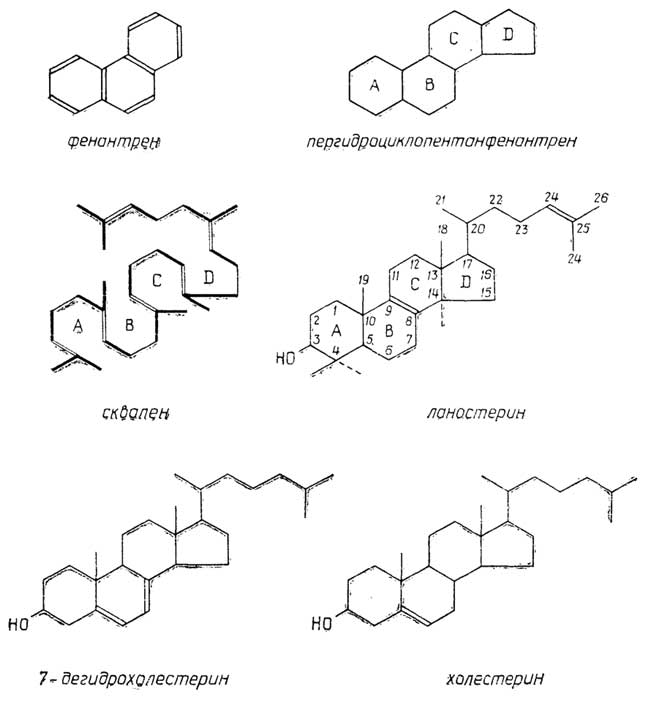
Рис. II.86.Структурное родство терпенов и стероидов
связей. Стероидные соединения обнаружены в животных и растительных клетках, в протистах, особенно в грибах. В прокариотах стероиды встречаются крайне редко.
Стерины(стеролы) - это стероиды, которые отличаются наличием экваториально расположенных и имеющих β-ориентацию гидроксильной группы у атома С3и углеводородной цепочки из 8-10 атомов углерода у атома С17:холестерин, фитостерины, эргостерин.
Холестерин- наиболее известный стерин, широко распространенный в животных тканях и меньше - в растительных. В печени животных он синтезируется из ацетата через образование нескольких десятков промежуточных соединений, среди которых помимо сквалена следует отметитьланостерини7-дегидрохолестгрин(см. рис. II.86). Первый является одним из компонентов ланолина - жира овечьей шерсти, а второй накапливается в коже, где под воздействием ультрафиолетового облучения превращается в витаминD. Сам холестерин в организме животных служит предшественником многих других стероидов.
Рис. II.87.Конформация стероидного скелета. Пронумерованы только атомы углерода
Фитостерины, или стерины растительных тканей (рис. II.96), напримерметиленциклоартенол, кампестерин, ситостерин, стигмастерин, отличаются от стеринов животного происхождения, таких, как ланостерин или 7-дегидрохолестерин, называемыхзоостеринами, наличием дополнительных углеродных атомов в алифатическом хвосте, присоединенном к С17-атому стероидного скелета. Пути биосинтеза фитостеринов и зоостеринов на начальных этапах совпадают (до образования сквалена и его 2,3-эпоксипроизводного), а затем расходятся: в животных тканях далее образуетсяланостерин, в растительных -циклоартенол(рис. II.96).
Эргостерин(рис. II.96) являетсямикостерином, так как синтезируется в грибах.
Стериды- это сложные эфиры стеринов и высших жирных кислот. Так, холестерин присутствует в плазме крови в двух формах: свободной (35%) и в видехолестерида(65%), содержащего некоторые жирные кислоты, в основном ненасыщенные. Так как
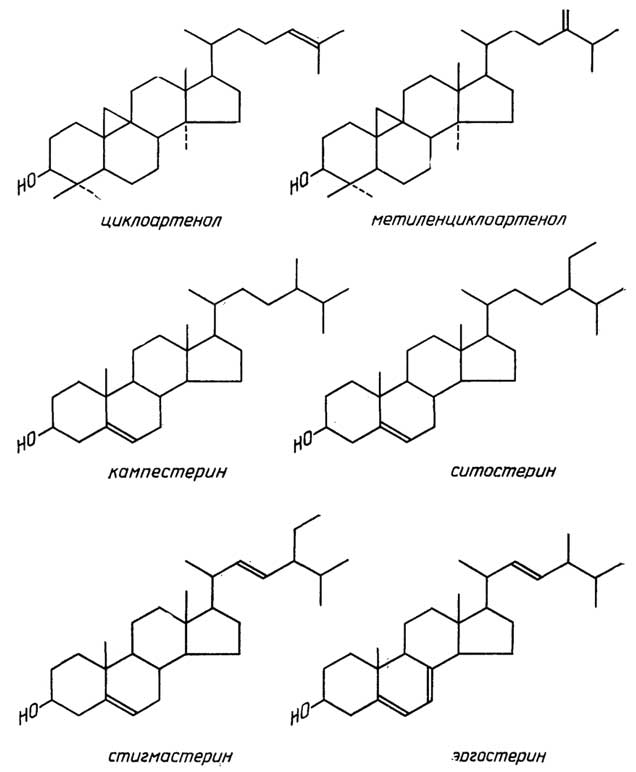
Рис. II.88.Стерины растений (фитостерины) и грибов (микостерин)
обе формы находятся в динамическом равновесии, холестерин, таким образом, служит переносчиком жирных кислот. Ланостерин в свободной форме существует как промежуточный продукт в биосинтезе холестерина, а в жире овечьей шерсти он представлен
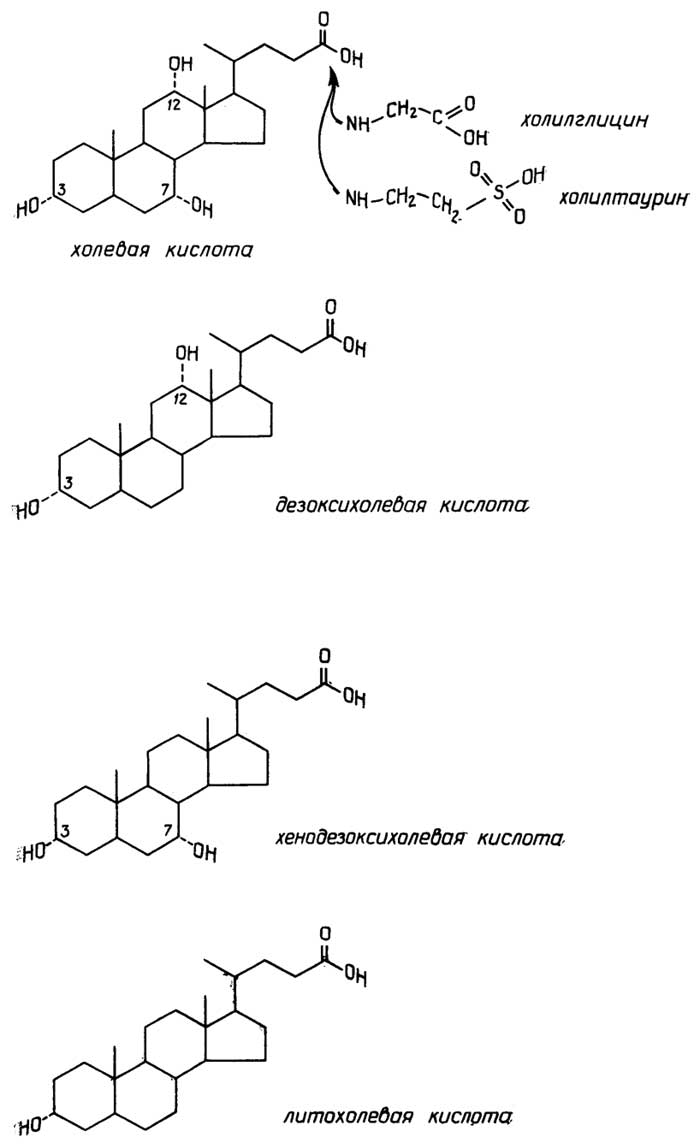
Рис. II.89.Желчные кислоты
в основном в виде сложного эфира миристиновой, арахидоновой и других более редких высших жирных кислот.
Желчные кислоты(рис. II.89) - это стероиды, общим признаком которых является наличие экваториально расположенной и α-ориентированной гидроксильной группы у атома С3и экваториально расположенного и β-ориентированного углеводородного "хвоста" длиной в пять углеродных атомов с карбоксильной группой на конце у атома С17. Гидроксильные группы у атомов С7и С12также имеют α-ориентацию, но расположены аксиально. Из четырех кислот, выделенных из желчи человека, преобладаетхолевая кислота, но все четыре синтезируются в печени из холестерина и накапливаются в желчном пузыре в виде соединений с глицином или аминосульфокислотойтаурином, что обеспечивает им хорошую растворимость в воде. Структура молекул всех четырех кислот представляет собойA/В-цис-нормальную конформацию.
Функциональное назначение желчных кислот- эмульгирование липидов в тонком кишечнике, без чего невозможно переваривание последних.
Гормоны коры надпочечников человека(рис. II.90) отличаются присутствием кетогруппы в положении С3, аксиально расположенной β-гидроксильной группы у атома С11и наличием двойной связи между атомами С4и С5. Их боковая группа у атома С17имеет длину всего в два углеродных атома.Кортикостерон, кортизол(гидрокортизон) иальдостерон- три основных гормона коры надпочечников. Кортизол усиливает превращение аминокислот в гликоген, замедляет синтез белка, а альдостерон является регулятором водно-солевого равновесия в тканях организма. Кортикостерон обладает свойствами и того и другого, но выраженными в меньшей степени. Помимо этого кортизол и его аналоги (см. рис. II.90), напримеркортизон(11-дезоксикортизол) или синтетическийпреднизалон, известны своим сильным противовоспалительным, противоаллергическим и иммунодепрессивным действием.
Прогестины- это гормоны желтого тела, плаценты, яичников, а также надпочечников. Основным среди них являетсяпрогестерон. Они обеспечивают нормальное протекание беременности, а также участвуют в регуляции менструального цикла. Прогестерон и его синтетические аналоги (рис. II.91) широко используются в медицине.
Половые гормоны(рис. II.92) - мужскиеандрогеныи женскиеэстрогены- отличаются отсутствием углеводородного хвоста в положении С17и сохранением кетогруппы или гидроксильной группы у атома С3, причем эстрогены существенно отличаются от андрогенов тем, что кольцо А эстрогенов ароматическое, и потому их гидроксильная группа обладает кислотными свойствами. Андрогены и эстрогены синтезируются в семенниках, яичниках и в небольшом количестве как промежуточный продукт в коре надпочечников. В мужском организме соотношение андрогенов и
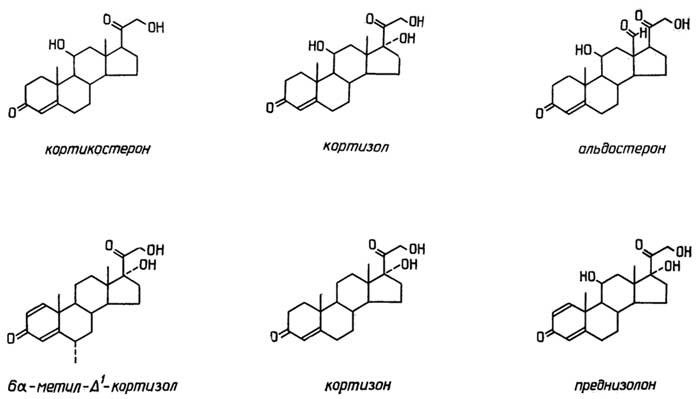
Рис. II.90.Гормоны коры надпочечников и некоторые их синтетические аналоги
эстрогенов сильно сдвинуто в сторону первых, в женском - наоборот. Среди мужских половых гормонов наибольшей активностью обладаеттестостерон, а среди женских -эстрадиол. Половые гормоны регулируют функционирование репродуктивных
|
|
органов. Соотношение половых гормонов определяет проявление вторичных половых признаков организма. Помимо этого половые гормоны оказывают специфическое влияние и на другие ткани и органы. Так, андрогены обладают выраженнойанаболической активностью, т. е. способствуют развитию скелетных мышц и их
силы. В животноводстве, а также в спорте используют синтетические анаболики с пониженной андрогенной активностью (см. рис. II.92).
Витамин D- это два стероида, обозначаемые как витаминыD2иD3(рис. II.93). ВитаминD1- это артефакт. За него был ошибочно принят эргостерин дрожжей, который при облучении
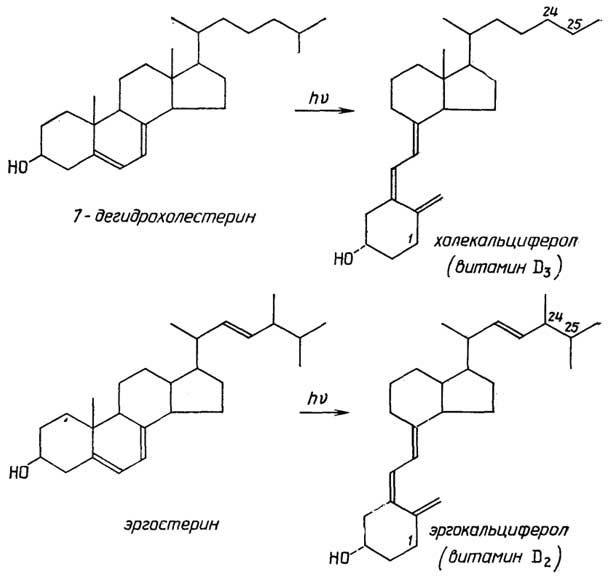
Рис. II.93.ВитаминD
ультрафиолетовым светом превращался в витаминD2(эргокальциферол). ВитаминD3(холекальциферол) поступает в организм человека с пищей или синтезируется в нем также под действием ультрафиолетового света из 7-дегидрохолестерина, накапливающегося в коже. Далее витаминыD2иD3путем гидроксилирования сначала в печени (по атому С25), затем в почках (по атомам С1и С24) превращаются в активную форму (см. рис. II.93), которая и принимает непосредственное участие в регуляции минерализации костной ткани.
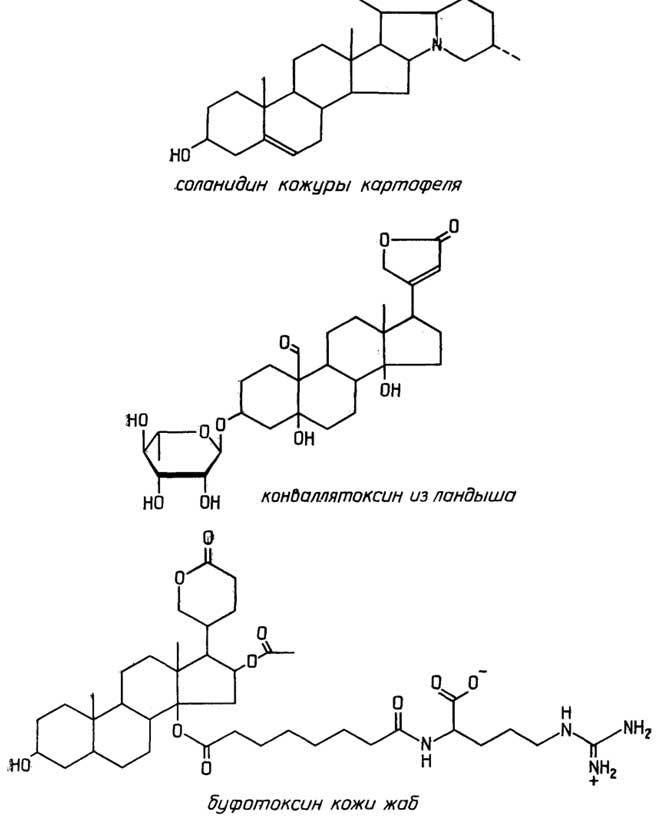
Рис. II.94.Примеры стероидов-токсинов
Стероиды-токсины(рис. II.94) находят применение в фармакологии как антиаттрактивные вещества. В частности, природные гликозидные производные некоторых из них (сердечные гликозиды) используются как лечебное средство, стимулирующее работу сердца.
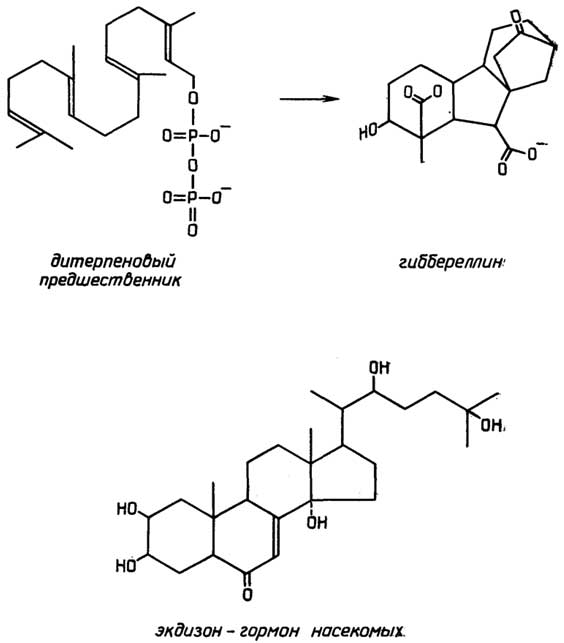
Рис. II.95.Стероидные гормоны растений и насекомых
Сапонины- вещества, молекулы которых состоят из сахара и агликона растительного происхождения стероидной структуры.
Стероиды-гормонырастений и насекомых. К первым относятсягиббереллины(рис. II.95), которые регулируют форму растения. Их известно около 40. Они синтезируются из дитерпена череа множество стадий. Ко вторым относятсяэкдизоны, регулирующие линьку насекомых. Некоторые растения их также синтезируют, очевидно, с целью защиты от насекомых.
Стероиды-антибиотикивстречаются редко. Это, например,фузидиевая кислота(рис. II.96), которая избирательно угнетает рост грамположительных стафилококков.
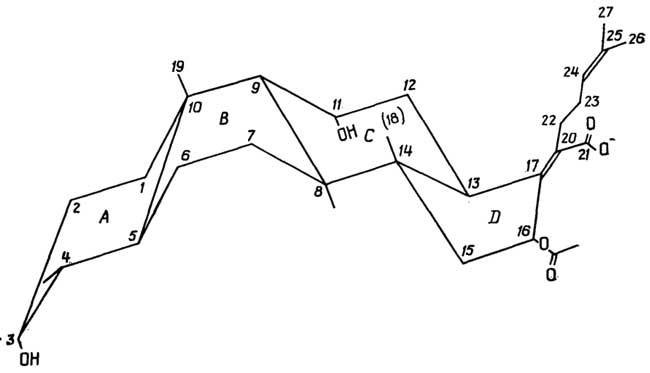
Рис. II.96.Стероидный антибиотик - фузидиевая кислота
§ 3.
Биологически активные соединения,
родственные липидам, -
производные арахидоновой кислоты
Названные ниже соединения синтезируются в клетках организма из арахидоновой кислоты, предшественником которой в свою очередь является линолевая. В организме животных линолевая кислота не синтезируется и должна поступать с пищей.
Простагландины(рис. II.97) - это С20-карбоновые кислоты с циклопентановым кольцом (С3-С12) в цепи. Буквенный индекс простагландина -А, В, Е, F, С, Н- определяется природой заместителей в цепи (у атомов С9и С11), а сопровождающая этот индекс цифра означает число двойных связей в цепи (одна у атома С13, две - у С5и С13, три - у С5, С13и С17). Все простагландины имеют гидроксильную группу у атома С15. Простагландины являются регуляторами (модуляторами) действия гормонов, причем их физиологические концентрации ничтожны (порядка 10-10моль/л). Они не вырабатываются в каких-либо эндокринных железах, а синтезируются клетками самых разных тканей. Физиологическое действие одного и того же простагландина в разных тканях может быть различным. Простагландины вызывают сокращение или расслабление гладкой мускулатуры,
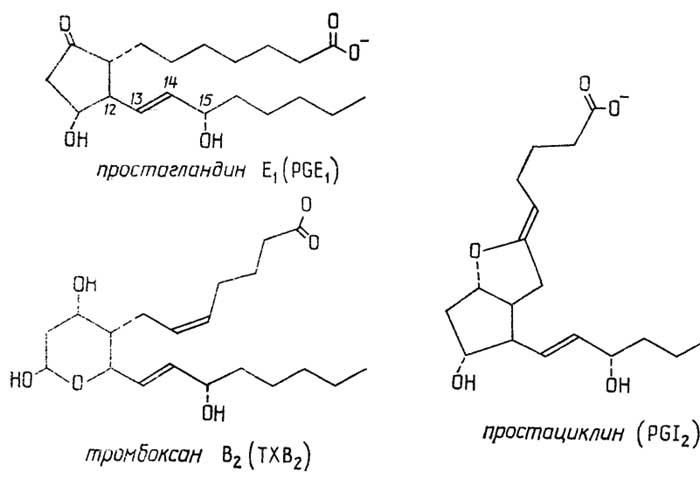
Рис. II.97.Простагландины
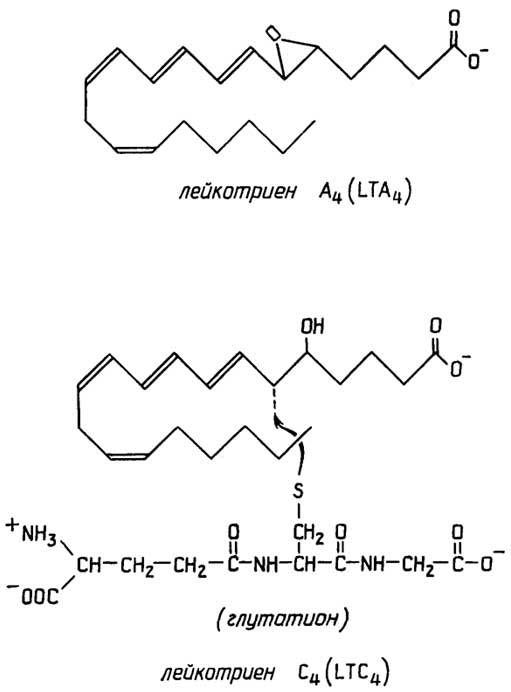
Рис. II.98.Лейкотриены
оказывают влияние на давление крови, деятельность сердечной мышцы, эндокринной системы. Они ответственны за воспалительные и аллергические реакции организма, влияют на транспорт ионов через некоторые мембраны, контролируют передачу нервного импульса через синапс.
Тромбоксаныипростациклины- особая разновидность простагландинов. Они влияют на свертываемость крови.
Лейкотриены(рис. II.98) - это С20-карбоновые кислоты, синтезируемые в лейкоцитах и имеющие общую черту строения -три сопряженные двойные связи (у атомов С7, С9и С11). Физиологическое действие их выражается в сильном сокращении гладких мышц в некоторых органах, что ведет к сужению их полости, например сужение кровеносных сосудов в определенных ситуациях или бронхиол во время приступов астмы. Активной формой лейкотриенов являются их соединения (через S) с глутатионом или цистеином.
Глава 14
СОЕДИНЕНИЯ ЛИПИДОВ
С ВЕЩЕСТВАМИ ДРУГИХ КЛАССОВ
И АССОЦИАТЫ ЛИПИДОВ МЕЖДУ СОБОЙ
§ 4.
Молекулярные образования липидов
с сахарами и белками
Гликофосфолипиды(рис. II.99) - это липиды, молекулы которых состоят из компонентовА, В, С, Е, причем компонентовВвыступает глицерин, а в качестве компонентаЕвстречаются простые углеводы (глицерин, инозит) и сахара. В последнем случае гликофосфолипиды называютфосфатидилсахарами. Глицерин как компонент Е в свою очередь может присоединять аминокислоту, образуялипоаминокислоту, или служить мостиком между двумя остатками фосфатидных кислот, образуя известныйкардиолинин(рис. II.108).
Гликолипиды, в отличие от гликофосфолипидов, не содержат компонентС, т. е. ортофосфата, а компонентомВу них могут быть или глицерин (гликозилдиацилглицерины) или сфинго- и дигидросфингозин (гликосфинголипиды).
Гликозилдиацилглицерины(рис. II.101) - соединения компонентовА, В, Е, причем компонентВ- это глицерин. Они выделены из растительных тканей и бактерий. В качестве компонента Е обычно содержат молекулу моносахарида или дисахарида, который частично может быть этерифицирован сульфатом.
Гликосфинголипиды(рис. II.102) - соединения составаABE, в которых компонентВ- это сфингозин (или дигидросфингозин). Они представляют собой соединения сахаров с церамидами:
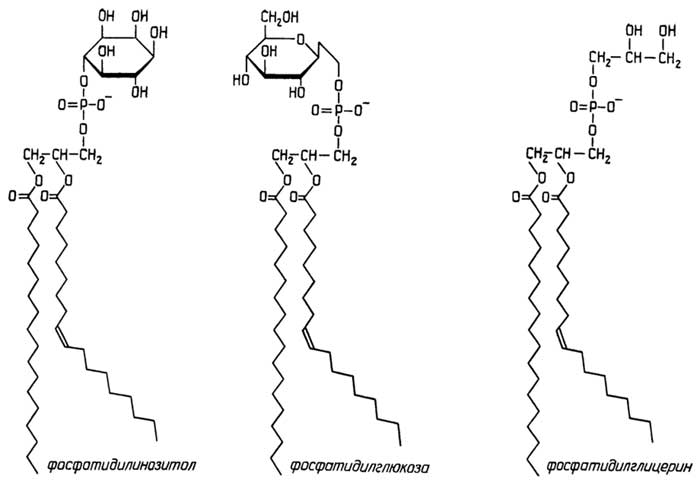
Рис. II.99.Гликофосфолипиды
цереброзиды- это соединения церамида с моносахаридом, обычно с β-D-галактозой или β-D-глюкозой, у которых гидроксильная группа атома С3может быть этерифицирована сульфатом;
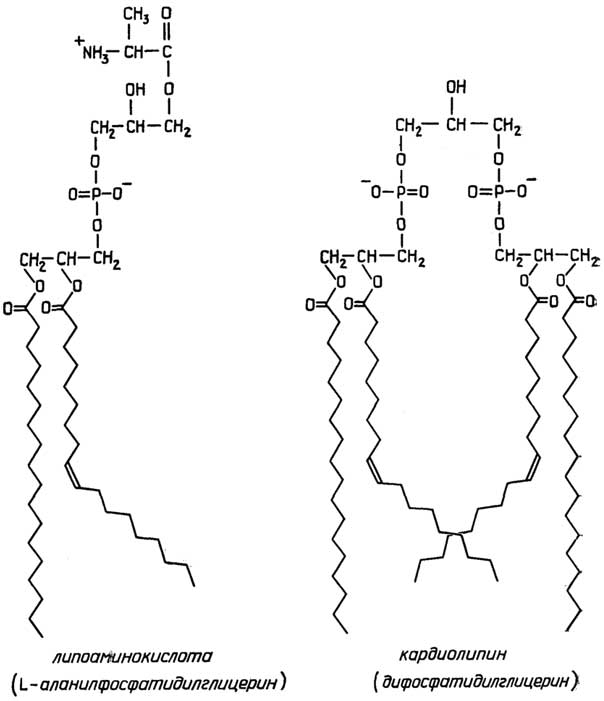
Рис. II.100.Важные производные фосфатидилглицерина
церамидолигосахариды- это соединения церамида с олигосахаридом;
ганглиозиды- это церамидолигосахариды, содержащие в углеводном хвосте остаток N-ацетил-нейраминовой кислоты. Ганглиозиды являются важными компонентами внешней стороны клеточных мембран. Именно они в значительной степени обеспечивают специфичность поверхности клеток и восприятие последними сигналов из окружающей среды, выступая, таким образом, в роли клеточных антигенов.
Липополисахариды- это весьма сложные полимеры (рис. II.103). В основе их лежит повторяющееся звено из двух N-ацетилглюкозаминов, соединенных гликозидной связью Р (1→6),ипирофосфатнойгруппойуаномерногоатомауглерода. ДвеN-ацильныегруппы-этоостатки3-D-оксимиристиновой
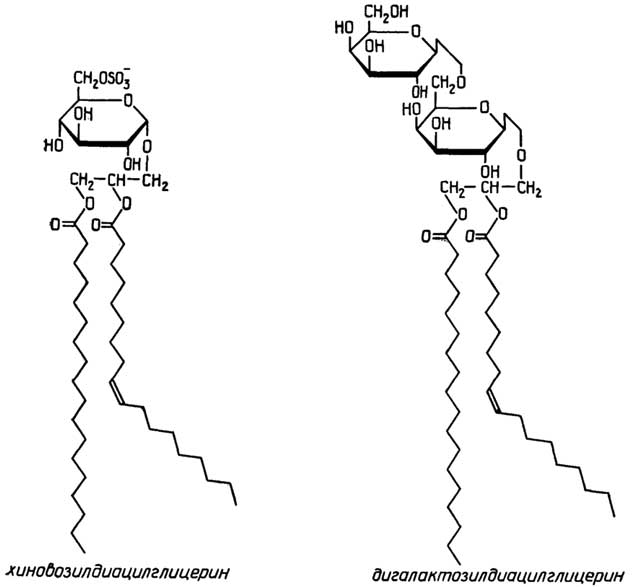
Рис. II.101.Гликозилдиацилглицерины
кислоты. Из оставшихся четырех гидроксильных групп дисахарида три этерифицированы пальмитиновой, лауриновой и 3-D-оксимиристиновой кислотами (последняя в свою очередь этерифицирована по гидроксильной группе миристиновой кислотой). Каждое повторяющееся звено имеет шесть жирнокислотных гидрофобных хвостов, направленных вниз. Эта часть липополисахарида обозначается каклипид А. Четвертая гидроксильная группа дисахарида связана с разветвленным гидрофильным олигосахаридом, который принято называть олигосахаридным ядром липополисахарида. Далее от олигосахаридного ядра отходит полисахаридная цепь,
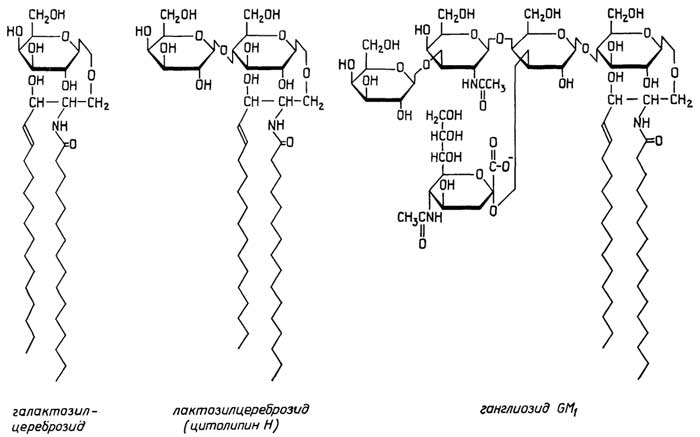
Рис. II.102.Гликосфинголипиды
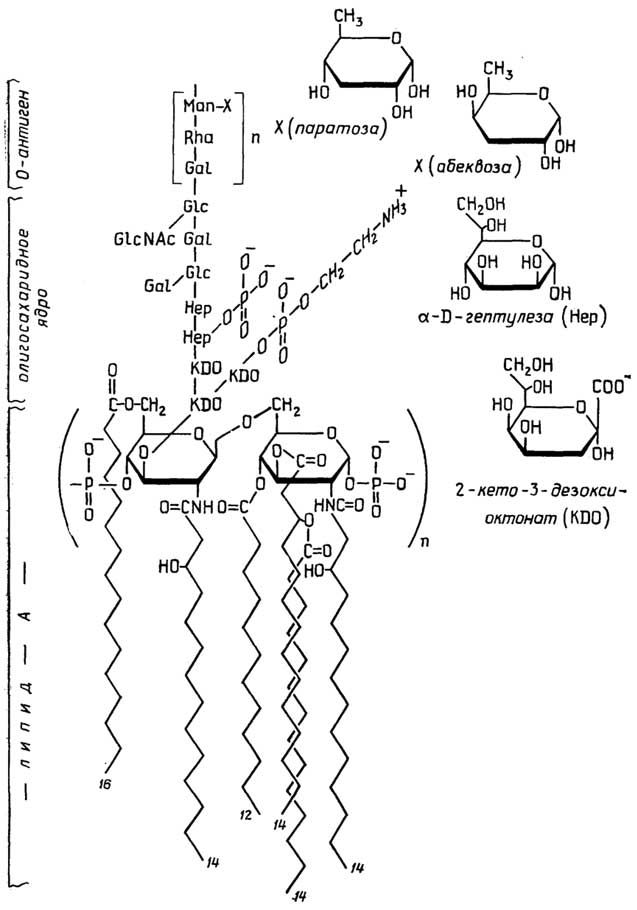
Рис. II.103.Липополисахарид из клеточной оболочки грамотрицательной бактерииSalmonella typhimurium(серотипыАиВ)
которая строится из повторяющегося несколько десятков раз тетрасахарида. Именно эти О-боковые цепи обладают антигенными свойствами, в связи с чем они получили названиеO-антигенов.
Протеолипиды- это глобулярные белки, имеющие три характерные особенности:
значительное количество гидрофобных аминокислот в полипептидной цепи;
значительное количество жирных кислот, присоединенных к полипептидной цепи за счет сложноэфирных связей;
способность функционировать лишь в липидном окружении.
Протеолипиды - это одна из разновидностей мембранных белков (ферментов, в частности), широко представленных в природе. Они не растворимы в воде, но могут быть солюбилизированы в органических растворителях.
§ 5.
Особые свойства липидов -
способность к образованию ассоциатов
Липиды не являются полимерами, как белки, нуклеиновые кислоты или полисахариды, но обладают способностью образовывать в природных условиях крупные ассоциаты, подобные макромолекулярным веществам, что обеспечивается особенностями их молекулярной структуры. Слабополярные липиды, так же как нейтральные жиры, воски, выполняющие функцию энергетических запасов, образуют ассоциаты в виде капелек масла.Амфифильность(свойство молекул, одна часть которых гидрофильна, а другая - гидрофобна) структурных липидов обусловливает образование ими ассоциатов, форма и размеры которых определяются природой липида, его концентрацией, а также составом и полярностью среды.
Виды ассоциатов, которые образуют амфифильные вещества (или иначе вещества самфипатическими свойствами), могут быть следующими (рис. II.104):
мицеллав виде сферы или эллипсоида;
монослойна границе двух несмешивающихся растворителей разной полярности (с разной диэлектрической проницаемостью);
бислой, который существует также в виде многослойныхламеллярныхобразований,липосом, везикул;
структура сгексагональной упаковкой.
Само образование ассоциатов начинается тогда, когда концентрация амфифильного вещества в растворителе достигает определенной величины, называемойкритической концентрацией мицеллообразования(ККМ).
Природные липиды с амфипатическими свойствами, такие, как фосфолипиды или гликолипиды, предпочитают образовывать ассоциаты со структурой бислоя. Образование мицелл возможно, но при очень низких концентрациях липида (ККМ ≈ 10-10моль/л), причем концентрация мицелл крайне мала, а сами мицеллы весьма велики (агрегационное числодостигает значений 2000-3000 молекул липида).
Рис. II.104.Виды ассоциатов из молекул амфифильных веществ:
А, Б, В- мицеллы;Г- монослой;Д- бислой;Е- везикула (липосома - многослойная везикула);Ж- гексагональная упаковка
Вещества с амфипатическими свойствами, такие, как получаемые искусственно и используемые часто в лаборатории детергенты (рис. II.105), предпочтительно образуют ассоциаты со структурой мицелл, причем ККМ таких детергентов лежит в пределах 10-3- 10-5моль/л, а число агрегированных молекул колеблется от нескольких десятков до полутора сотен или чуть больше.
Склонность фосфолипидов и гликолипидов к образованию бислоев обусловлена особенностью гидрофобной части их молекул, а именно наличием двух жирнокислотных хвостов, что не позволяет таким молекулам агрегировать в структуры с малым радиусом кривизны.
Рис. II.105.Типичные лабораторные детергенты:
А- анионный додецилсульфат натрия;Б- катионный бромид цетилтриметиламмония;В- нейтральный детергент из группы тритона-Х
Особое положение занимают природные детергенты стероидной структуры (желчные кислоты, холестерол), что, конечно, связано с их строением. Они образуют ассоциаты (ККМ ≈ 10-3моль/л) из нескольких молекул и вообще не способны к образованию бислоев. Но эти детергенты легко встраиваются в мицеллы или бислои, построенные другими амфифильными веществами.
§ 6.
Липопротеины и хиломикроны -
ассоциаты липидов и белков
Липопротеиныи их разновидностьхиломикроны- это ассоциаты различных липидов с белками, которые в норме присутствуют в плазме крови. Они представляют собой мицеллярные сферические образования, поверхность которых состоит из полярных голов молекул фосфолипидов и тех частей белковых молекул, которые состоят преимущественно из полярных и "заряженных" аминокислот. Под гидрофильной поверхностью располагаются гидрофобные части фосфолипидов, белков, а также нейтральные жиры, холестерол и его эфиры с жирными кислотами.
Липопротеины принято подразделять по плотности на хиломикроны и липопротеины, которые бываюточень низкой плотности(ЛПОНП, или пре-липопротеины),низкой плотности, (ЛПНП, или β-липопротеины) ивысокой плотности(ЛПВП, или α-липопротеины). С ростом плотности уменьшается размер частиц. Плотность липопротеинов увеличивается за счет роста белковой доли. Так, в хиломикронах белки составляют менее 2% и вместе с небольшим количеством фосфолипидов (<1%) образуют оболочку хиломикрона, под которой находятся триацилгли-церолы (более 95%) и незначительное количество холестеролш (<2%). В α-липопротеинах доля белка достигает 50%, фосфолипидов - 30, а доля триацилглицеролов падает до 3%. Самая высокая доля холестерола отмечена в α-липопротеинах (около 50%), в пре-липопротеинах и α-липопротеинах она ниже в 2,5-3 раза. Хиломикроны образуются клетками слизистой кишечника и обеспечивают доставку триацилглицеролов в печень и жировую ткань. Липопротеины образуются клетками печени. ЛПОНП доставляют синтезированные печенью триацилглицеролы в жировую ткань. ЛПНП доставляют холестерол в различные ткани, а ЛПВП переносят его обратно в печень.
§ 7.
Биомембраны -
сложные надмолекулярные
образования на основе липидов
Биомембраны- это общее название пленочных образований толщиной 6-10 нм, сходного состава и строения, функции которых сводятся к двум основным:
отграничивать клетку от окружающей ее среды или разделять клетку на отдельные пространства, называемыекомпартментами, образуя, таким образом, различные клеточные органеллы;
обеспечивать взаимодействие и материальный обмен между клеткой и внешней средой, а также между органеллами и внутриклеточной средой.
Биомембраны представляют собой (рис. II.106) липидный бислой, в который встроены молекулы белков, гликопротеинов, гликолипидов. Все компоненты удерживаются вместе за счет нековалентных (в основном гидрофобных) взаимодействий кооперативного характера. Соотношение липидов и белков в биомембранах зависит от происхождения последних и колеблется в пределах от 5 : 1 до 1 : 4. Молекулы белков могут находиться на поверхности, бислоя с той или другой стороны (поверхностные белки), быть частично погруженными в гидрофобную часть бислоя или пронизывать ее (интегральные белки). Гликопротеины и гликолипиды присутствуют в мембранах в количествах от долей процента до нескольких процентов. Они располагаются всегда на внешней стороне бислоя так, что их углеводные части выступают из него. Липидная часть мембран состоит в основном из фосфолипидов (до 90%), причем внешняя и внутренняя части бислоя отличаются по составу. Так, достаточно хорошо изученные мембраны эритроцитов во внешней стороне содержат преимущественно фосфатидилхолин и сфингомиелин, а во внутренней - фосфатидилэтаноламин и фосфатидилсерин. В бислое могут присутствовать также в небольших количествах нейтральные жиры в виде три-, ди- и моноацилглицеринов, а также холестерол и его эфиры, причем присутствие последнего отмечено в основном в плазматических мембранах клеток животных.
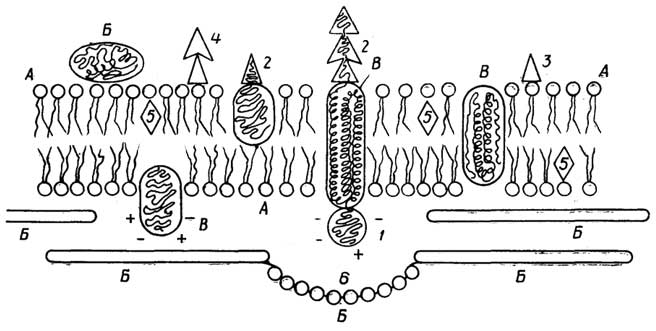
Рис. II.106.Схема плазматической мембраны животной клетки:
А- фосфолипиды;Б- периферические белки;В- интегральные белки;1- полярная часть белковой глобулы;2- углеводные части белковой глобулы;3- гликолипид;4- ганглиозид;5- холестерол;6- актин
Биомембраны живых клеток имеют жидкокристаллическую структуру. Липиды и некоторые белки легко перемещаются в плоскости биомембраны. Вязкость бислоя сравнима с вязкостью оливкового масла. Перемещение других белков в плоскости биомембраны затруднено. Это может быть связано либо с образованием окружающими молекулу такого белка липидами более организованной структуры типакластера, либо с тем, что молекула белка "заякорена" в прилегающем к биомембране слое цитоскелета, образующем упругую подложку и играющем роль каркаса мембраны.
Факторы, влияющие на жидкокристаллическое состояние биомембран и их функционирование: 1) температура; 2) ионная сила; 3) соотношение длинноцепочечных и короткоцепочечных углеводородных цепей в составе липидов; 4) соотношение насыщенных и ненасыщенных (сцис-конфигурацией) углеводородных цепей в составе липидов; 5) наличие холестерола в биомембране.
§ 8.
Особенности строения
наружной мембраны клеточной оболочки
грамотрицательных бактерий
Основное отличие клеточной оболочки грамотрицательных бактерий от клеточной оболочки грамположительных бактерий - наличие в ней второй (наружной) мембраны, покрывающей жесткую клеточную стенку из пептидогликана. Наружная мембрана отличается от плазматической составом липидов и белков, но главная ее особенность - наличие липополисахарида на ее внешней стороне, в то время как внутренняя сторона бислоя состоит, как обычно, из фосфолипидов и встроенных в нее белков, в частностибелков оболочки, через которые наружная мембрана и связывается с муреином клеточной стенки.
Раздел Г
НУКЛЕОТИДЫ
И НУКЛЕИНОВЫЕ КИСЛОТЫ
Глава 15
НУКЛЕОТИДЫ
Нуклеотиды- вещества, компонентами которых являются: азотистое гетероциклическое основание, углевод (обычно пентоза) и один, два или три остатка фосфорной кислоты.Нуклеозидполучается из нуклеотида путем отщепления остатков фосфорной кислоты. Все природные нуклеотиды можно условно разделить на две большие группы:
мононуклеотиды - мономерные звенья нуклеиновых кислот;
прочие нуклеотиды, играющие не менее важную роль в метаболизме живого.
§ 1.
Мононуклеотиды -
компоненты нуклеиновых кислот
Встречающиеся в нуклеиновых кислотах нуклеотиды содержат различные производные двух гетероциклических азотистых оснований:пиримидина(а точнее, 2-оксипиримидина) ипурина. (рис.II. 107).
Главные пиримидиновыеоснования (обозначаются первой буквой, латинской или русской):цитозин(Ц, или С),урацил, тимин.
Главные пуриновыеоснования:аденинигуанин.
На примере2-оксипиримидинапоказано (рис. II. 107) важное свойство таких оснований - существование двух таутомерных формлактимаилактама. Последняя форма характерна для рН 7. Лактим-лактамное равновесие существует и у других производных пиримидина и пурина.
Кроме пятиглавныхазотистых оснований в нуклеиновых кислотах встречаются:
минорные пиримидиновыеоснования (рис. II. 108) - это или замещенные в положении С5, такие, как5-метилцитозин(т5С),5-гидроксиметилцитозин, 5-гидроксиметилурацил, или "необычные" основания, такие, какдигидроурацил(DилиhU) и4-тиоурацил(4s, s4Uили4S);
минорные пуриновыеоснования (рис. II. 109) - это различные пуриновые основания, метилированные в положенииN1илиС2, например1-метилгуанин(m1C) и2-метиладенин(т2А), а также метилированные или диметилированные по аминогруппе, находящейся в положении 6 или 2, такие, как6-метил-(или 6,6-диметил) -аминопурин(т6Аилит26А)и 2-метил-(или 2,2-диметил)-амино-6-оксипурин(m2Gилиm22G). В так называемых транспортных
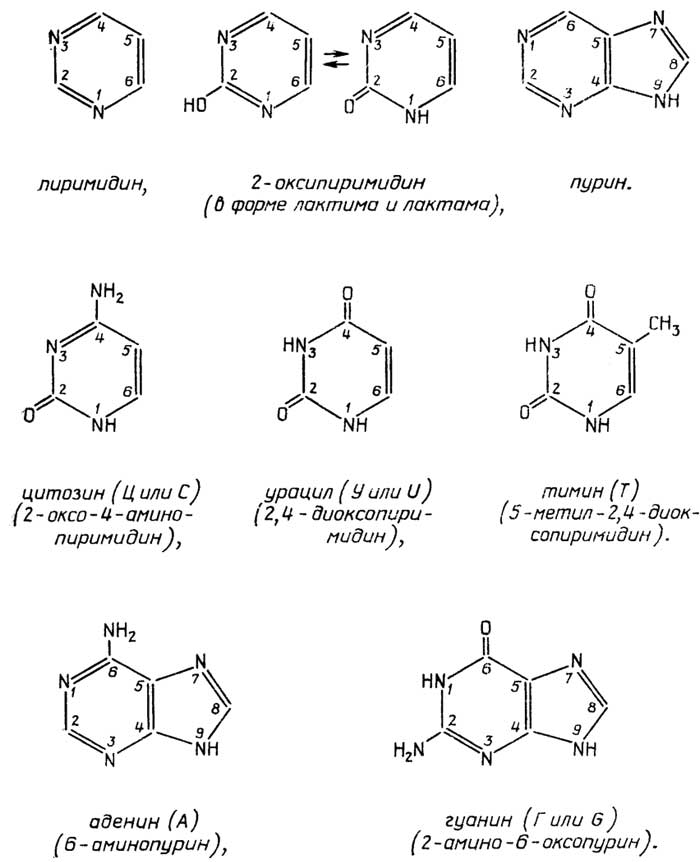
Рис. II.107.Главные пиримидиновые и пуриновые основания
рибонуклеиновых кислотах (тРНК) обнаружены нуклеотиды сгипоксантином(6-оксипурином), а также с другими производными 6-аминопурина с более сложномодифицированной аминогруппой.
Всерибонуклеиновые кислоты(РНК) в качестве сахара содержат β-D-рибозу, адезоксирибонуклеиновые кислоты(ДНК) -2-дезокси-β-D-рибозу.
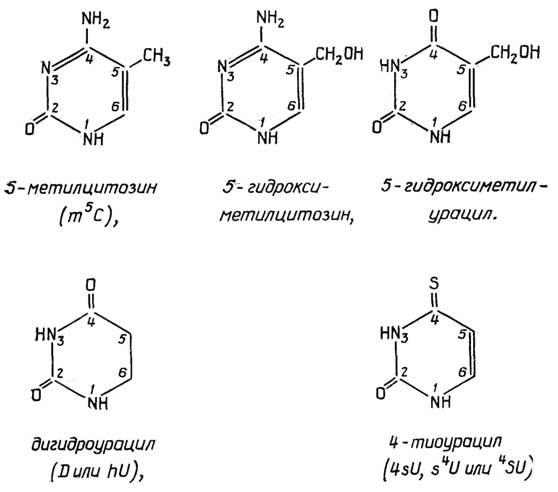
Рис. II.108.Минорные пиримидиновые основания
Соединение трех компонентов между собой в мононуклеотиде обеспечивается за счет связи между N1-атомом пиримидинового основания или N9-атомом пуринового основания с С1'-атомом пентозы5и за счет образования сложноэфирной связи между С5'-атомом пентозы и фосфорной кислотой, как это показано на рис. II.110 для мононуклеотида, образованного цитозином, дезоксирибозой и фосфорной кислотой и называемого б'-дезоксицитидиловой кислотой. Ее анион - дезоксицитидин-5'-фосфат, или сокращенно дЦМФ (dCMP).
Азотистое основание и пентоза относительно друг друга в нуклеозиде или нуклеотиде могут располагаться по-разному. В общем случае принято считать, что если атомы 2 и 3 пиримидинового
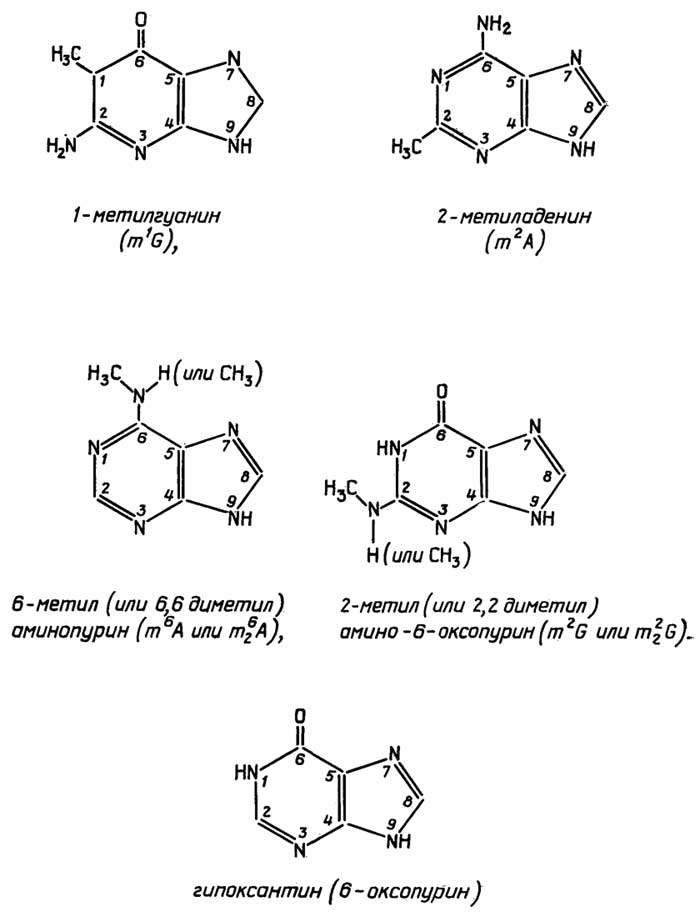
Рис. II.109.Минорные пуриновые основания
кольца или атомы 1 и 2 пуринового кольца находятся по одну сторону относительно гликозидной связи С1'-N, а пентозное кольцо - по другую, то мы имеем дело санти-конформером; если указанные атомы оснований и пентозное кольцо находятся по одну сторону от гликозидной связи, т. е. основание располагается над сахаром, то тогда этосин-конформернуклеозида или нуклеотида (рис.II.111).
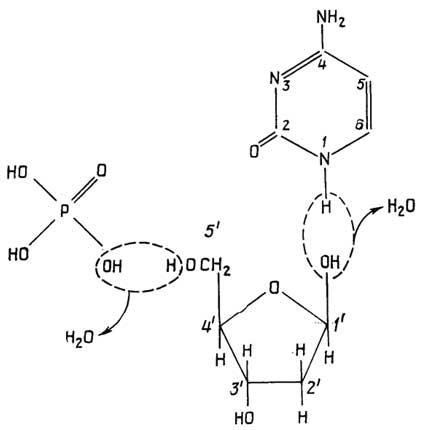
Рис. II.110.Образование мононуклеотида
Главные мононуклеотиды, входящие в РНК, перечислены в табл. II.4, а входящие в ДНК - в табл.II.5.
Обратим внимание на то, что в ДНК обычно нет дУМФ. Вместо этого присутствует дТМФ, часто неправильно называемый просто тимидинфосфатом. дУМФ встречается лишь в некоторых ДНК бактериофагов, а тимидинмонофосфат, содержащий рибозу, обнаружен в некоторых тРНК. Его называютрибозилтимидинфосфатом, илириботимидинфосфатом, чтобы отличать от тимидинфосфата ДНК.
Не следует забывать, что перечисленные ранее минорные пиримидиновые и пуриновые основания также образуют мононуклеотиды, которые встречаются в некоторых РНК или ДНК. Отметим только, что нуклеозид, содержащий гипоксантин и рибозу, - это
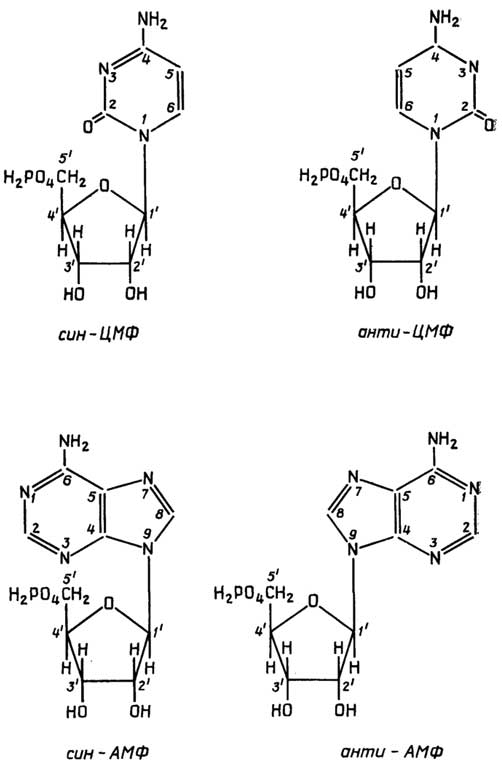
Рис. II.111.СИН- и АНТИ-конформеры мононуклеотидов
ТаблицаII.4 Главные мононуклеотиды РНК
|
ТаблицаII.5 Главные мононуклеотиды ДНК
|
инозин(I), а соответствующий мононуклеотид называетсяинозиновой кислотой, илиинозинфосфатом(рис. II.112). Он не имеет никакого отношения к похожему по названию инозиту или инозитфосфату (см. с. 40, 42).
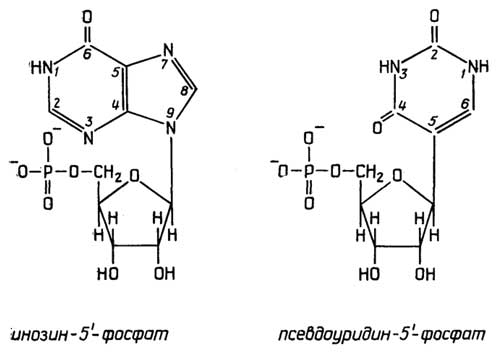
Рис. II.112. Редкие мононуклеотиды нуклеиновых кислот
Еще следует отметить необычность связи между азотистым основанием - урацилом и рибозой впсевдоуридин-5'-фосфате(псевдоуридин сокращенно обозначают ψ) (рис. II.112).
§ 2.
Другие важные нуклеотиды
Кроме мононуклеотидов - компонентов нуклеиновых кислот - в клетке встречаются в свободном виде или как компоненты других важных соединений различные моно- и динуклеотиды.
3'- и 2'-Мононуклеотиды
Нуклеотиды нуклеиновых кислот, встречающиеся в клетке в свободной форме как промежуточные продукты распада и синтеза нуклеиновых кислот, - это обычно 5'-фосфаты нуклеозидов. Однако путем гидролиза нуклеиновых кислот можно получить 3'-фосфаты, а в случае гидролиза РНК - еще и 2'-фосфаты нуклеоизидов. Общепринято не называть номер атома пентозы, если речь идет о 5'-фосфате нуклеозида; в случае же 2'- и 3'-мононуклеотидов упоминание номера атома пентозы обязательно.
Циклическая адениловая кислота (цАМФ)
цАМФ, т. е. аденозин-3'-5'-фосфорная кислота (рис. II.113), является важным посредником регуляторного действия гормонов во многих процессах.
5'-Ди- и 5'-трифосфаты нуклеозидов
Кроме 5'-монофосфатов нуклеозидов в клетке присутствуют5'-дии5'-трифосфаты нуклеозидов(рис. II.114). Фосфатные группа их обозначаются α, β и γ, начиная от сложноэфирной связи. Они могут последовательно отщепляться в местах, показанных на рисунке волнистой чертой.
|
|
При нейтральных рН 5'-трифосфаты и 5'-дифосфаты нуклеозидов, например АТФ и АДФ, представляют собой анионы с зарядом, равным соответственно 4 и 3, так как только для α-фосфатной группы рКaравно 6,5-7,2; рКaостальных фосфатных групп лежат э кислой области (рН около 2).
Пирофосфатные группы АТФ и АДФ обладают большим сродством к двухзарядным катионам металлов (Mg++, Mn++). Именно в виде комплексов с Mg++(иногда с Мn++) АТФ и АДФ принимают участие во многих обменных процессах. Здесь уместно отметить, что токсичность солей бериллия связана с тем, что катионы Ве++также хорошо связываются с АТФ и АДФ, но такие комплексы являются метаболическими ядами.
Особая рольАТФ в любой живой материи определяется ее главной функцией -служить основным переносчиком химической энергии в клетке. В результатекатаболизма, т. е. ферментативного разрушения белков, углеводов, жиров, поступивших с пищей, энергия их химических связей накапливается во всех живых организмах путем фосфорилирования АМФ и АДФ до АТФ. Затем за счет обратной реакции
(гидролиза АТФ) запасенная энергия используется живыми организмами для:
биосинтезанеобходимых организму сложных молекул из более простых, т. е. впроцессах анаболизма;
совершения работыв виде движения или мышечного сокращения;
активного переносавеществ против градиента концентрации;
поддержания температуры телау теплокровных организмов.
Таким образом, уникальностьаденилатной системы(рис. II.115) состоит в том, что она является связующим звеном между процессами катаболизма и анаболизма.
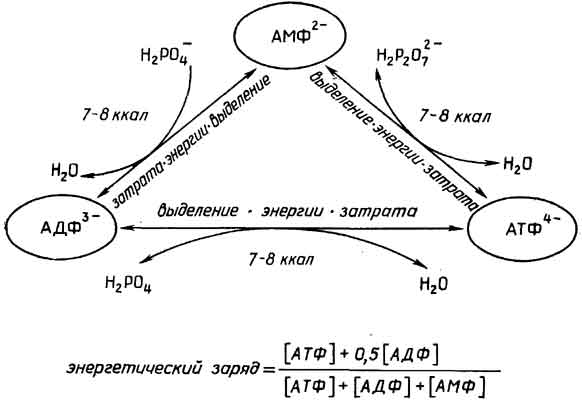
Рис. II.115.Аденилатная система
Катаболизм направлен на увеличение доли АТФ, анаболизм, напротив, ее уменьшает. Соотношение компонентов аденилатной системы в клетках принято определять "энергетическим зарядом":
энергетический заряд =
[АТФ] + 0,5 [АДФ] |
[АТФ] + [АДФ] + [АМФ] |
.
Из этой формулы видно, что аденилатная система полностью "заряжена", и ее заряд равен 1, если все АМФ и АДФ превращены в АТФ. Наоборот, если присутствует только АМФ, заряд системы равен нулю. АДФ является "полузаряженной" формой. Обычно энергетический заряд в клетках имеет величины 0,75-0,90.
Изменения стандартной свободной энергии Гиббса ∆G°(37°C)(штрих означает, что ∆G° относится к рН 7, как принято в биохимии) для превращений компонентов аденилатной системы при 37°С, μ = 0,2 М и при избытке Mg++лежат в области 7-8 ккал. Эти данные получены длястандартных условий
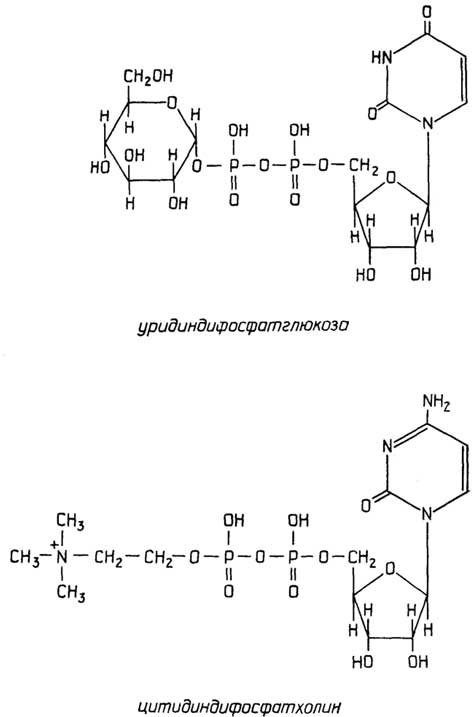
Рис. II.116.Мононуклеотиды - переносчики молекул
(концентрации исходных соединений и продуктов равны по 1 М) с поправками на температуру и рН, существующими в клетке. Если же учесть реальные концентрации компонентов в клетке, то ∆G, например для реакции гидролиза АТФ, будет более отрицательной величиной (-12,5 ккал). Для определения возможности самопроизвольного протекания реакции
(при наличии соответствующего катализатора-фермента) в биохимии принято иметь дело с ∆G°(25°C)или ∆G°'(37°C). Так как в реакциях гидролиза соединений происходит перенос определенной группы на воду, то в таких случаях ∆G°' называют потенциалом переноса данной, группы.
Помимо АТФ вкачестве переносчиков химической энергиив процессах биосинтеза принимают участие идругие нуклеотиды:
АТФ, ГТФ - в биосинтезе белков,
АТФ, УТФ - в биосинтезе полисахаридов;
АТФ, ЦТФ - в биосинтезе липидов;
АТФ, ГТФ, УТФ, ЦТФ - в биосинтезе РНК;
дАТФ, дГТФ, дТТФ, дЦТФ - в биосинтезе ДНК.
Все нуклеозид-5'-трифосфаты легко обмениваются через нуклеозид-5'-дифосфаты своей γ-фосфорной группой с помощью ферментануклеозиддифосфокиназы:
АТФ + УДФ↔АДФ+УТФ;
АТФ + ГДФ↔АДФ+ГТФ;
АТФ + ЦДФ↔АДФ+ЦТФ;
ГТФ + УДФ↔ГДФ+УТФ;
АТФ + дЦДФ↔АДФ+дЦТФит.д.
Отметим, что при биосинтезе нуклеиновых кислот у нуклеозид-5'-трифосфатов двойная функция: они несут в себе не только
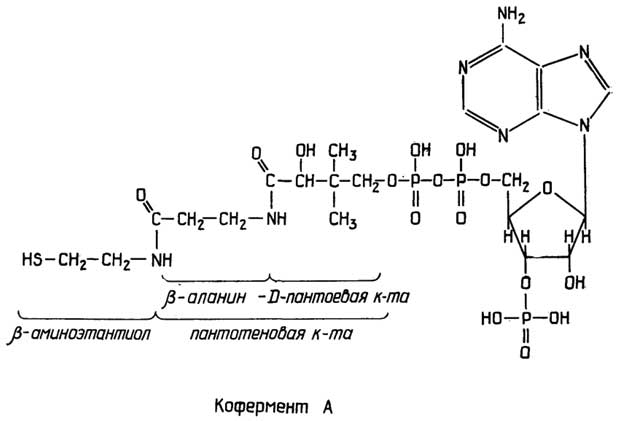
Рис. II.117.Переносчик ацильных групп - коферментА
энергию, необходимую для протекания биосинтеза, но и сам строительный материал - мононуклеотиды.
Некоторые нуклеозид-5'-фосфаты выполняют рольпереносчиков молекул. Так, например, глюкоза при синтезе гликогена переносится с помощью уридиндифосфата, а холин при синтезе лецитинов переносится с помощью цитидиндифосфата (рис. II.116).
Сложный нуклеозид-5'-дифосфат, называемый короткокоферментом А(рис. II.117), состоящий из последовательно соединенных 3'-фосфат-5'-пирофосфатаденозина, витаминапантотеновой кислотыи β-аминоэтантиола, является в процессах метаболизмапереносчиком ацильных групп, которые связываются сложноэфирной связью с его концевой SH-группой.
НАД+и НАДФ+
Связующим звеном между процессами катаболизма и анаболизма помимо перечисленных выше нуклеотидов являются два
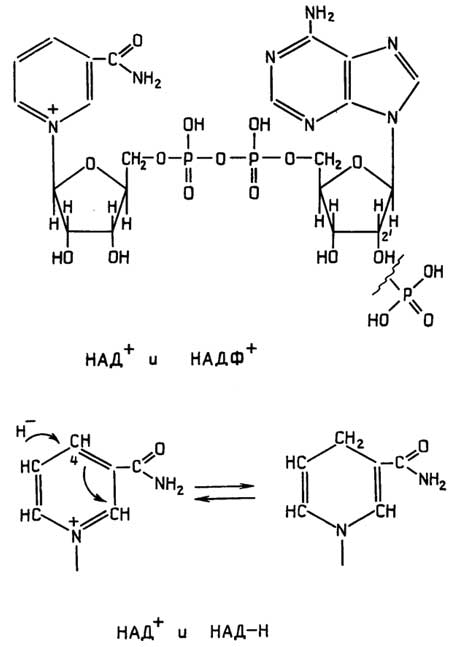
Puc. II.118.Посредники окислительно-восстановительных реакций НАД и НАДФ
динуклеотида:никотинамидадениндинуклеотид(НАД+)и никотинамидадениндинуклеотидфосфат(НАДФ+) (рис. II.118). Их связующая роль определяется способностью существовать в двух формах:окисленной(НАД+и НАДФ+) ивосстановленной(НАД-Н и НАДФ-Н):
НАД+/НАД-Н |
Е°'= — 0,320V; |
НАДФ+/НАДФ-Н |
E°'= — 0,324V |
(штрих здесь означает, чтоЕ° найден при рН 7). Водород переносится скорее всего в формегидрид-иона(см. рис. II.118). Составная часть НАД+и НАДФ+-никотинамидили его предшественникникотиновая кислота(ниацин) - известна еще под названиемвитамин PP. При окислении "биологического топлива" в
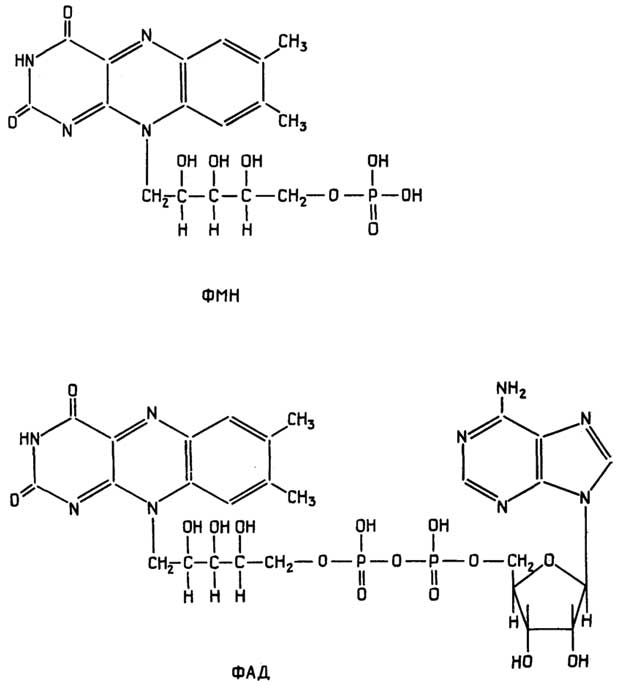
Рис. II.119.Посредники окислительно-восстановительных реакций ФМН и ФАД
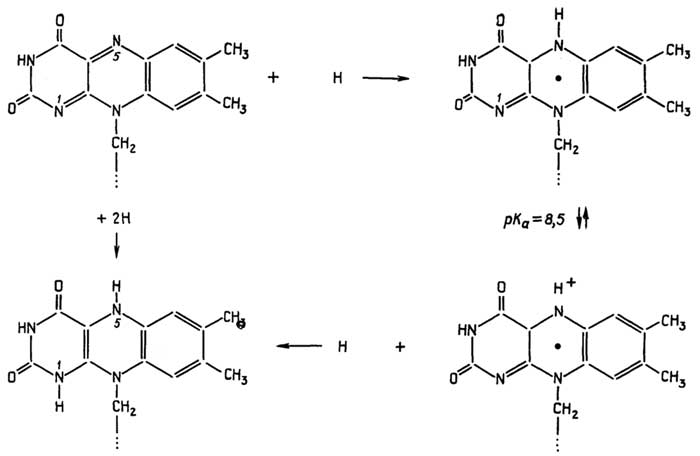
Рис. II.120.Окислительно-восстановительные переходы в ФМН и ФАД
процессах катаболизма происходит "запасание" водорода в молекулах НАД-Н и НАДФ-Н. От этих последних водород отнимается в процессах анаболизма и расходуется на гидрирование при биосинтезе соединений, жизненно необходимых клетке. НАД+больше используется в процессах катаболизма, зато НАДФ-Н шире вовлекается при анаболических реакциях. Обмен водородом между двумя переносчиками по схеме
НАД-Н + НАДФ+↔НАД++ НАДФ-Н
легко происходит с помощью ферментов - трансгидрогеназ.
Два других важных переносчика водорода - этофлавинмононуклеотид(ФМН) ифлавинадениндинуклеотид(ФАД) (рис. II.119). Составной частью ФМН и ФАД являетсярибофлавин, известный каквитаминВ2. Он представляет собой соединение сложного азотистого основанияизоаллоксазинаи пятиуглеродного сахарарибита. Обратимый окислительно-восстановительный переход
ФМН↔ФМН-Н2или ФАД↔ФАД-Н2
связан с присоединением - отщеплением двух атомов водорода в положениях N1и N5изоаллоксазина, причем возможно образование полувосстановленной формы - радикаласемихинона(рис. II.120). Образование восстановленных форм ФМН-Н2и ФАД-Н2можно также объяснить присоединением - отщеплением гидрид-иона и протона в положениях N5и N1соответственно.
5Атомы пентозы, в отличие от атомов азотистого основания, помечают штрихом.
Глава 16
НУКЛЕИНОВЫЕ КИСЛОТЫ
§ 1.
Первичная структура
Образование полимерной цепочки
Мононуклеотиды связываются в полимеры - природные или синтетические нуклеиновые кислоты (НК)-путем образования сложноэфирных связей между 3'-углеродом пентозы одного мононуклеотида, фосфатом и 5'-углеродом пентозы другого мононуклеотида (рис. II.121).
При сокращении записи первичной структуры 5'-конец цепи располагают слева, а 3'-конец - справа, например
5'-конецpApCpGpUpm2Apψpm5Cpm22Gps4UpC3'-конец. Число нуклеотидных звеньев в РНК колеблется от нескольких десятков в самых коротких РНК до 2 · 105в самых длинных. РНК содержат обычно значительно больше нуклеотидов с минорными основаниями, чем ДНК. Самые короткие ДНК состоят из нескольких тысяч, а самые крупные - из 108звеньев. Длина таких цепочек достигает нескольких сантиметров.
Особенности первичной структуры НК
РНК обычно состоят из одной полимерной цепи, а ДНК, напротив, в большинстве случаев представляют собой структуру из двух цепей, связанных нековалентно. Эти цепи всегда антипараллельны, т. е. 5'-конец одной цепи соседствует с 3'-концом другой.
Рис. II.121.Образование полимера нуклеиновой кислоты
Известны, однако, РНК двухцепочечные и ДНК одноцепочечные. Ковалентные цепи природных полинуклеотидов могут быть строго линейными; разветвляться или замыкаться в кольцо, причем кольца могут быть сцепленными (продетыми друг в друга). Некоторые одноцепочечные нуклеиновые кислоты (или полученные искусственно полинуклеотиды) могут в некоторых местах замыкаться на себя, образуя, таким образом, двухцепочечные участки в виде "шпилек с петлями". Искусственно могут быть получены даже трехцепочечные полинуклеотиды.
Образование водородных связей между
основаниями - основная причина
объединения цепей полинуклеотидов
Правила Чаргаффадля двухцепочечных ДНК: мольная доля аденина равна мольной доле тимина, а мольная доля гуанина равна мольной доле цитозина, т. е. м. д. А = м. д. Т, а м. д. G = м. д. С, или, иначе, (1 - м. д. АТ) = м. д. GC. Значения м. д. GC колеблются от самого маленького (0,005) до самого большого (0,75). При подсчете м. д. каждого главного основания учитываются все его производные минорные основания. Правила Чаргаффа для двухцепочечных РНК (некоторых вирусных) выполняются с учетом того, что вместо Т надо брать U и его производные. Выполнение правил Чаргаффа для двухцепочечных структур ДНК и РНК позволилиУотсону и Крикуобъяснить структуру НК схемой, основанной на комплементарном взаимодействии аденина с тимином (или урацилом) и гуанина с цитозином за счет образования водородных связей (рис. II. 122). Расстояния между С1-атомами пентоз разных цепей равны 1,085 нм в обоих случаях, причем пара AT соединена двумя водородными связями, а пара GC - тремя.
Обратим внимание на то, что другие атомы в основаниях также способны на образование водородных связей. В связи с этим можно представить взаимодействие оснований по другому пути (рис. II.123). Это -схема Хугстена, илиимидазольная. При таком взаимодействии расстояние между С1атомами пентоз меньше, чем в случае схемы Уотсона-Крика, и равно 0,88 нм. Этот тип взаимодействия обнаружен при совместной кристаллизации метилированных производных аденина и тимина, но в двойной спирали он не реализуется.
§ 2.
Вторичная структура
ДНК
Клеточная ДНК двухцепочечна. Одноцепочечная ДНК обнаружена в некоторых вирусах.
ОсобенностьДНК заключена в следующем: ДНК во всех клетках одного и того же организма, а также в каждом вирионе данного вида вирусов одинакова по составу и структуре и не меняется с возрастом или при изменении условий внешней среды6. Ее нуклеотидный состав и строение являются
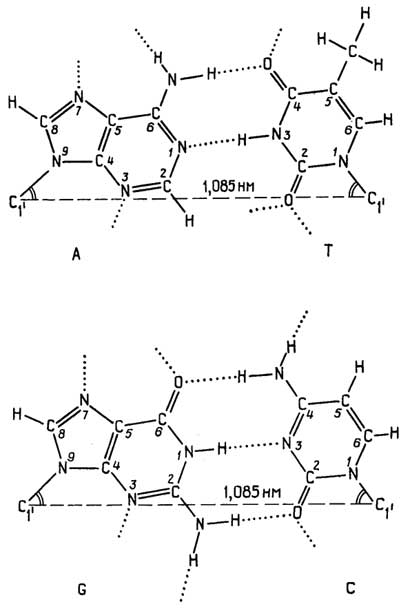
Рис. II.122.Образование водородных связей между комплементарными азотистыми основаниями по Уотсону-Крику (прямая схема)
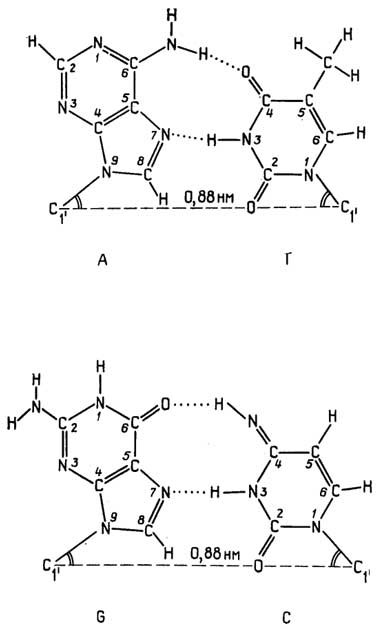
Рис. II.123.Образование водородных связей между комплементарными азотистыми основаниями по Хугстену (прямая схема)
характеристикой данного организма. Это связано с тем, что именно в последовательности нуклеотидных звеньев ДНК заключена вся информация, передаваемая организмом от поколения к поколению.Состав ДНКиногда принято характеризовать соотношением
м. л. (А + Т) |
м. д. (С + С) |
.
Молекула двухцепочечной ДНК, согласно Уотсону и Крику, представляет собойправую двойную спираль. Направление в цепяхантипараллельно. Цепи комплементарны по азотистым основаниям и удерживаются в первую очередь за счет образованияводородных связей. Нуклеотиды находятся вантиконформации. Таким образом, пары гидрофобных азотистых оснований располагаются одна над другой внутри спирали, а гидрофильные сахарофосфатные цепи обвивают эту стопку оснований снаружи. Второй, не менее значительной, чем водородные связи, силой, стабилизирующей двойную спираль, являетсястэкинг-взаимодействиенаходящихся в стопке оснований. Природа стэкинга, видимо, связана и с взаимодействием индуцированных диполей π-связей, и с гидрофобным взаимодействием. Хотя надо отметить, что в отличие от гидрофобного взаимодействия в белках, при стэкинге термодинамические параметры изменяются в обратную сторону, т. е. ∆Hи ∆Sотрицательны, a ∆Gотрицательно лишь потому, что энтальпийная компонента весомей.
Двойная спираль ДНК существует в разных формах (рис. II.124):В, А, С, Z.
В-форма ДНК, выделяется из водных растворов. Ее характеристики:
диаметр спирали 2,1 нм;
10 пар оснований на виток, шаг спирали 3,4 нм;
пары оснований перпендикулярны продольной оси спирали;
продольная ось спирали пронизывает стопку оснований посередине;
между цепями есть две бороздки: большая и маленькая.
А-форма ДНКможет быть получена из водных растворов при добавлении в последние растворителей с меньшей диэлектрической проницаемостью, например спирта. Для нее характерны:
диаметр спирали 2,5 нм;
11 пар оснований на виток, шаг спирали 2,8 нм;
пары оснований наклонены под углом 20° к плоскости, перпендикулярной продольной оси спирали;
они обвивают продольную ось так, что вдоль нее внутри имеется полость с диаметром 0,8 нм;
также есть две бороздки, но большая бороздка шире и глубже.
Известны еще С-форма, Z-форма ДНК и некоторые другие, менее изученные.
Для С-формыхарактерны:
9,3 пары оснований на виток;
пары оснований наклонены под углом около 6° к плоскости, перпендикулярной продольной оси спирали;
пары оснований немного наклонены относительно друг Друга.
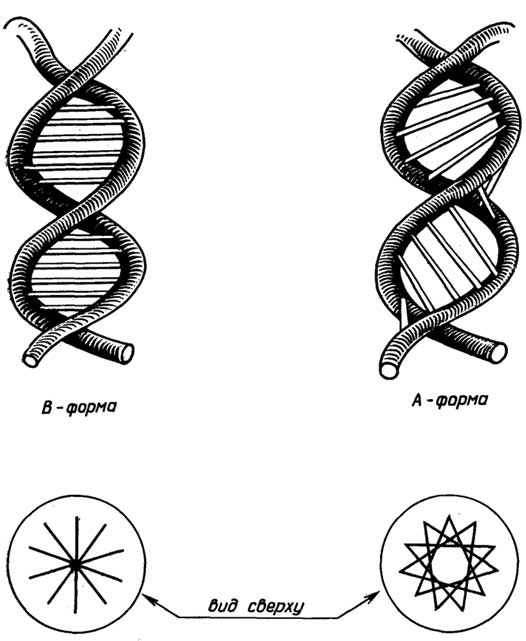
Рис. II.124.Две формы ДНК
Z-формасущественно отличается от остальных тем, что:
две ее цепочки закручены в левую спираль с 12 парами оснований на виток;
сахарофосфатные цепи представляют собой не плавные линии, как в В- или С-формах ДНК, а имеют ломаный зигзагообразный (Z) вид.
РНК
Клеточные РНК одноцепочечны. Двухцепочечные РНК обнаружены в некоторых вирусах.
РНК существует в виде нескольких форм, различающихся по биологической функции, строению и свойствам.
рРНК- рибосомная РНК составляет 80-90% всей клеточной РНК. Ее цепь свернута сложным образом в очень компактные структуры, стабилизированные включением многочисленных белков. Такие комплексы не растворимы в обычных условиях и могут быть выделены центрифугированием. Хотя рРНК бактерий, растений и животных несколько различны, они в каждом случае могут быть разделены на несколько молекулярных видов, отличающихся константой седиментацииS(табл. II.6). рРНК - это один из главных компонентов системы полипептидного синтеза.
ТаблицаII.6
Виды рРНК в прокариотах и эукариотах
Условное название |
Бактерии |
Растения и животные |
Число нуклеотидов |
Молекулярная |
"Легкая" рРНК |
5S |
5S, 5,8S |
100-150 |
3 · 104- 5 · 104 |
пре-рРНК- молекулы-предшественники рибосомных РНК. Каждая из трех молекулярных видов рРНК образуется из более длинной пре-рРНК. Все они в свою очередь являются продуктами расщепленияединого транскрипта(рибонуклеиновой комплементарной копии одного из участков одной из цепей ДНК).
тРНК- транспортная, или растворимая, РНК. Составляет до 15% всей клеточной РНК. Ее цепь свернута в глобулу. Она хорошо растворима в обычных условиях. Функция тРНК - перенос аминокислот к месту синтеза полипептидной цепочки. Каждой аминокислоте соответствует одна или несколько тРНК- Всего их известно около 100. Число нуклеотидов в молекуле тРНК достигает нескольких десятков. Молекулярная масса около 3 · 104.
пре-тРНК- молекулы-предшественники тРНК. Обычно включают в себя нуклеотидные последовательности более чем одной тРНК.
мРНК- матричная, или информационная, РНК. Существует в клетке недолго. Время жизни молекул мРНК от нескольких минут до нескольких часов или иногда до десятков часов. В каждый момент она составляет около 3% от всей клеточной РНК. Одноце-почечные, вытянутые молекулы мРНК представляют собой полимеры с молекулярной массой от 2,6 · 104до 1 · 106, содержащие от нескольких десятков до нескольких тысяч нуклеотидов. мРНК - это комплементарные копии одного из участков одной из двух цепей ДНК. В чередовании нуклеотидов закодирована последовательность аминокислот в полипептидной цепи. Таким образом, каждому из белков соответствует своя мРНК. Иногда мРНК несет информацию для двух белков и более.
гяРНК- гетерогенная ядерная РНК. Это более высокомолекулярный предшественник мРНК, еще более короткоживущий. Число нуклеотидных звеньев от 1500 до 3000. Молекулярная масса от 105до 2 · 107. Обнаружена только в клетках эукариот.
мяРНК- малая ядерная РНК, также найдена в эуяариотах. Короткие молекулы мяРНК содержат от 65 до 200 нуклеотидов. Они необходимы для превращения гяРНК в мРНК.
Вирусная РНКиз-за своих особенностей часто выделяется в отдельный молекулярный вид.Особенностиее в том, что она:
как и ДНК, является носителем наследственной информации;
в отличие от других РНК может быть и двухцепочечной.
Вирусная РНК, одноцепочечная или двухцепочечная, неизвестным образом очень компактно упакована в вирусных частицах. Она содержит несколько тысяч оснований или пар оснований. Ее молекулярная масса в пределах 106- 107.
Вторичная структура к настоящему времени изучена у тРНК и частично определена у двухцепочечных вирусных РНК.
Структура некоторых тРНК полностью расшифрована. Не вызывает сомнений предположение, что в общих чертах она одинакова у всех тРНК. Вторичная структура их известна под названием"клеверный лист". Она обеспечивается образованием около 50 водородных связей в двух десятках пар комплементарных оснований (рис. II.125). Общие черты всех тРНК:
способность присоединять аминокислоты к 3'-концу через образование сложноэфирной связи аминокислоты и 2'- или 3'-гидроксильных групп концевого аденозина;
на концеакцепторного стебля(3'-конец) всегда имеется последовательностьА-С-С;
в одних и тех же местах имеет место спаривание оснований за счет водородных связей;
дигидроуридиновая петля(D-петля) бывает разной величины, но в последовательности оснований имеет много общего; она содержит в себе участок, ответственный за связывание фермента, способного сшивать приносимые с помощью тРНК аминокислоты в полипептидную цепь;
псевдоуридиновая петля(ψ-петля) содержит большой участок, одинаковый для всех тРНК; она ответственна за связывание с тРНК в процессе синтеза белка;
некоторые тРНК имеют петлю разной длины, называемуювариабельной; она имеет в одних и тех же местах одинаковые нуклеотиды; существуют различные предположения о ее функциональной роли;
антикодоновая петлясодержит триплет нуклеотидов (антикодон), с помощью которого тРНК связывается с соответствующим триплетом (кодоном) мРНК в процессе биосинтеза белка; антикодон и кодон комплементарны; перед антикодоном в петле всегда стоит уридин.
Вторичная структурадвухцепочечных вирусных РНКбыла изучена с помощью рентгеноструктурного анализа. На основании его данных можно сделать вывод о возможности двух вариантов структуры:
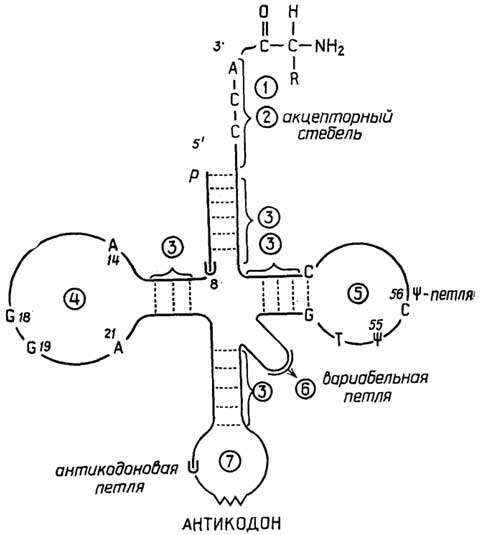
Рис. II.125."Клеверный лист" тРНК
двойная правая спираль РНК-11, для которой характерны 11 пар оснований на виток, а пары оснований наклонены под углом 13-14° к плоскости, перпендикулярной продольной оси спирали;
двойная правая спираль РНК-10, которая имеет 10 пар оснований на виток, а пары оснований наклонены под углом 10° к плоскости, перпендикулярной продольной оси спирали. Таким образом, РНК-11 весьма похожа на А-форму ДНК, а РНК-10 - это что-то промежуточное между А- и В-формами ДНК, но ближе к А-, чем к В-форме.
Двойная спираль
Существованиедвойной спирали ДНК-РНКвозможно только вA-форме. Это связано с тем чтоB-форма ДНК содержит дезоксирибозу в С2'-эндоконформации, аA-форма ДНК, РНК-10 и
РНК-11 содержат пентозы в С3'- эндоконформации. ДНК достаточно легко переходит из одной формы в другую; для РНК переход в форму, сходную сB-формой ДНК, энергетически невыгоден, так как из-за наличия гидроксильной группы в положении С возникают значительные стерические препятствия при переходе рибозы из С3', в С2', эндоконформацию.
§ 3.
Третичная структура
Третичную структуру нуклеиновых кислот можно рассматривать пока только на примере тРНК и суперспирализации кольцевых двухцепочечных ДНК.
Пространственное строение тРНК
К настоящему времени полностью установлена третичная структура для молекулы тРНКPheиз дрожжей. Она представляет собой глобулу, вытянутую в форме буквы Г. В основе ее лежит вторичная структура "клеверный лист", свернутая так, что псевдоуридиновая и дигидроуридиновая петли оказываются рядом, а вариабельная петля на самом деле вытягивается в довольно линейный участок (рис. II.126). Можно назвать четыре причины такого пространственного сворачивания:
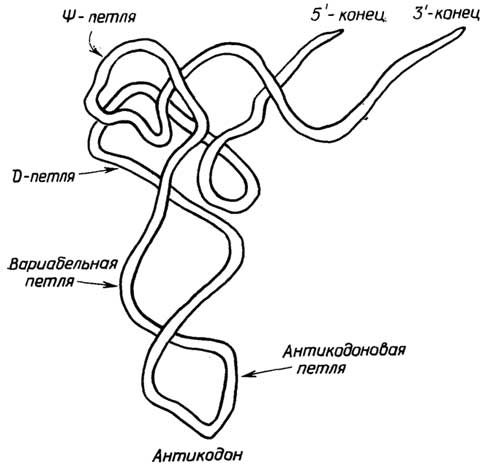
Рис. II.126.Третичная структура тРНК
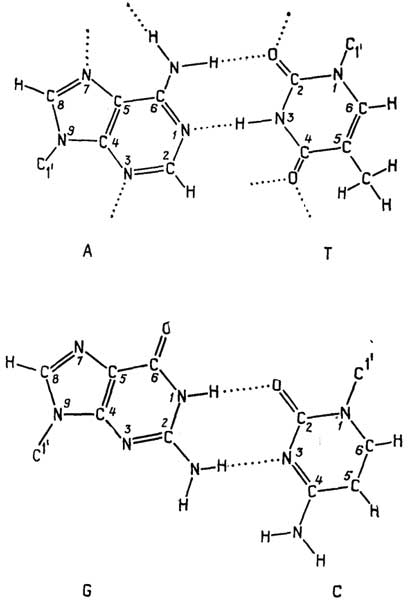
Рис. II.127.Образование водородных связей при взаимодействии азотистых оснований по обратной схеме Уотсона-Крика
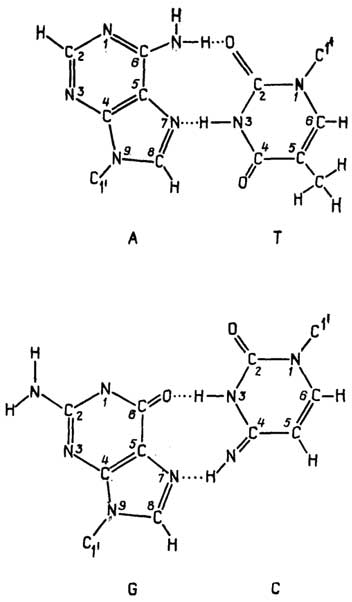
Рис. II.128.Образование водородных связей при взаимодействии азотистых оснований по обратной схеме Хугстена
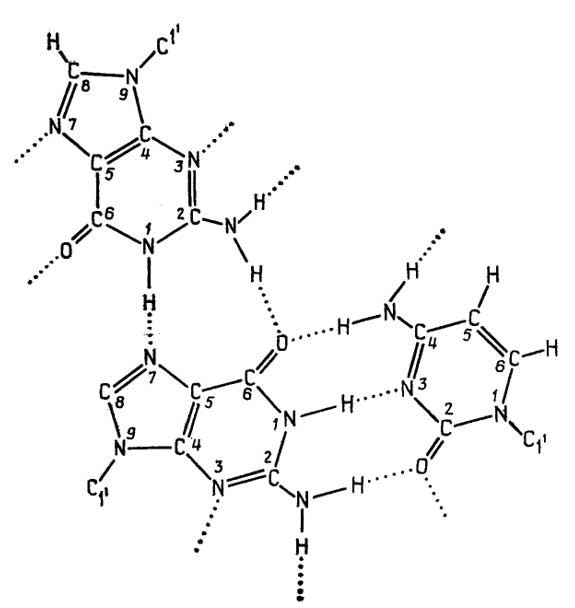
Рис. II.129.Образование водородных связей между тремя азотистыми основаниями
Рис. II.130.Суперспирализация кольцевых двухцепочечных ДНК
образование водородных связей между основаниями нуклеотидов, находящихся в местах "клеверного листа", удаленных друг от друга, например, в петляхDи ψ; это возможно как по схеме Уотсона-Крика, так и по схеме Хугстена, причем плоскость одного из оснований в обоих случаях может быть повернута на 180° (рис. II.127; II.128);
образование водородных связей между тремя основаниями; такие тройные взаимодействия особенно характерны для мест глобулы, в которых соприкасаютсяD-, ψ- и вариабельная петли (рис. II.129);
образование водородных связей между гетероатомами азота, амино- и оксигруппами оснований, с одной стороны, и фосфатными группами, гидроксильными группами пентоз полимерного остова РНК - с другой; возможности таких водородных связей показаны на последнем рисунке пунктирными линиями; в целом ряде конкретных случаев они не вызывают сомнений;
стэкинг оснований; только несколько оснований в молекуле тРНКPheне участвуют в стэкинге, остальные образуют две стопки оснований, составляющие два рукава буквы Г.
Суперспирализация кольцевых
двухцепочечных ДНК
Хотя молекулы ДНК могут достигать в длину нескольких сантиметров, in vivo они обычно упакованы так плотно, что их длина не превышает нескольких нанометров. Это достигается за счет суперспирализации.Третичная суперспирализация(райзинг) кольцевых двухцепочечных ДНК показана на рис. II.130. Обычно двухцепочечные кольцевые ДНК закручены в правую суперспираль. Добавление к растворам таких ДНК полиядерных ароматических соединений, обладающих плоской структурой (рис. II.131), ведет кинтеркаляциипоследних, т. е. встраиванию их в стопку оснований ДНК. Повышение концентрации интеркалирующих соединений влечет за собой раскручивание правой суперспирали до полного ее исчезновения, а затем к закручиванию кольцевой двухцепочечной молекулы ДНК в левую суперспираль.
§ 4.
Четвертичная структура
О четвертичной структуре нуклеиновых кислот известно мало. В некоторых опухолеродных вирусах РНК, видимо, представлена двумя одинаковыми субъединицами, связь между которыми обеспечивается скорее всего комплементарным взаимодействием оснований.
Рис. II.131.Примеры соединений, способных интеркалировать в НК и нарушать их структуру
§ 5.
"Внешние" факторы,
стабилизирующие вторичную, третичную
и четвертичную структуры НК
Стабилизация вторичной, третичной и четвертичной структур нуклеиновых кислот помимо водородных связей между основаниями и стэкинга последних обеспечивается еще и за счет "гашения" отрицательных зарядов остатков фосфорной кислоты положительными зарядами:
катионов металлов Na+, K+, Mg++и др.;
алифатических аминов с двумя или более аминогруппами, таких, как:
+H3N - (СН2)4- NH3+- путресцин,
+H3N - (СН2)5- NH3+- кадаверин,
+H3N - (СН2)4- NH2+- (СН2)3- NH3+- спермидин,
+H3N - (CH2)3- NH2+- (CH2)4- NH2+- (CH2)3- NH3+- спермин;
основных белков -гистоновипротаминов(небольших белков, богатых лизином и аргинином).
6Пока мы. исключаем случаи мутаций.
Глава 17
НУКЛЕОПРОТЕИНЫ -
НАДМОЛЕКУЛЯРНЫЕ КОМПЛЕКСЫ
НУКЛЕИНОВЫХ КИСЛОТ И БЕЛКОВ
§ 1.
Хромосомы клеточных ядер
Ядра клеток содержат веществохроматин, который состоит из равных по массе количеств ДНК и основных белков гистонов, а также небольшого количества кислых белков.Гистонысостоят из 100-200 аминокислотных остатков и имеют молекулярную массу 10000-20000. По относительному содержанию лизина и аргинина их делят на пять типов: H1, Н2А, Н2В, Н3 и Н4. Удивительно, что гистоны одного типа из совершенно разных организмов (например, гороха и быка) практически одинаковы по составу и структуре. Под электронным микроскопом хроматин имеет вид нитей с тесно нанизанными бусинами. Каждая бусина - этонуклеосома, или иначеv-частица.Она (рис. II.132) представляет собой
Puc. II.132.Строение хроматина
октамер, содержащий по две молекулы гистонов Н2А, Н2В, Н3 и Н4, обвитый снаружи суперспиралью ДНК со 150 основаниями. Между нуклеосомами суперспираль ДНК содержит около 50 оснований и связана лишь с одной молекулой белка H1.Хромосома- это хроматиновая нить, в свою очередь свернутая в спираль. Таким способом обеспечивается ультракомпактность упаковки ДНК.
§ 2.
Рибосомы
Рибосомы- частицы, обнаруживаемые в клетках, содержащие РНК и белки, причем последние по массе составляют менее половины. Рибосома состоит из двух субъединиц - большей и меньшей, на которые она диссоциирует, если концентрация Mg++становится ниже 1 мМ. Каждая субъединица - это комплекс одной или двух молекул РНК и двух-трех десятков молекул белков. Постепенно увеличивая концентрацию мочевины и LiCl, можно последовательно выделить все РНК и отделить белки. Большая субъединица содержит обычно "легкую" и "тяжелую" РНК, а меньшая - "среднюю" РНК. Схема постепенной диссоциации рибосом бактерийЕ. coliпоказана на рис. II.133.
Рис. II.133.Схема диссоциации бактериальной рибосомы
Полисомы(полирибосомы) - это образования в клетке, состоящие из вытянутой молекулы мРНК, окруженной глобулярными белками, на которую нанизаны рибосомы.
§ 3.
Информосомы
Информосомы- нуклеопротеины из мРНК и стабилизирующих и защищающих ее глобулярных белковинформатинов.
Информомеры- аналогичные нуклеопротеины из гяРНК и белков-информатинов.
§ 4.
Вирусы
Вирусы- особый интересный случай нуклеопротеинов. Это структуры, находящиеся на грани живого и неживого. С одной стороны, они могут быть выделены в виде чистых кристаллов, сохраняющих свои свойства бесконечно долго, что характерно для неживой материи. С другой стороны, им присущи все особенности живого с той оговоркой, что у них нет собственного метаболического аппарата. Поэтому способность к самовоспроизведениювирион(вирусная частица) может реализовать, только попав внутрь клетки какого-либо организма (бактерии, растения, животного) и использовав ее обменные процессы. Вирусная частица представляет собой плотно упакованную одноцепочечную или двухцепочечную молекулу ДНК или РНК, окруженную оболочкой. В одних случаях оболочка, называемаякапсидом, состоит из большого числа белковых субъединиц -капсомеров. В других случаях она представляет собой мембрану из липидов и белков (гликопротеинов), в которой белков значительно больше, чем липидов. Состав и строение поверхности вириона определяют тканевую специфичность вируса. Инфицирование клетки имеет место, когда внутрь ее проникает либо целый вирион, либо только его ДНК или РНК. После этого вирусная ДНК или РНК перестраивает обменные процессы клетки таким образом, что энергия и сырье окружающей среды начинают использоваться для синтеза новых вирусных частиц.
Рекомендуемая литература
Вилли К., Детье В.Биология. М., 1974.
Мецлер Д.Биохимия. М., 1980.
Уайт А., Хендлер Ф., Смит Э.и др. Основы биохимии. М., 1981.
Страйер Л.Биохимия. М., 1984.
Ленинджер А.Основы биохимии. М., 1985.
Мусил Я., Новакова О., Кунц К.Современная биохимия в схемах. М., 1984.
Рис Э., Стернберг М.От клеток к атомам. Иллюстрированное введение в молекулярную биологию. М., 1988.
Овчинников Ю. А.Биоорганическая химия. М., 1987.
Березов Т. Т., Коровкин Б. Ф.Биологическая химия. М., 1983.
Филиппович Ю. Б.Основы биохимии. М., 1986.
Анисимов А. А., Леонтьева А. Н., Александрова И. Ф.и др. Основы биохимии. М., 1986.