Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Анализ концевых групп и ступенчатая деградация белков и пептидов
Определение N-концевых аминокислот дансильным методом
Аминогруппы белков и пептидов реагируют с флуоресцентным красителем диметиламинонафталинсульфонилхлоридом (сокращенно дансилхлорид) в щелочной среде. Как и при динитрофенилировании, связь аминокислоты с реагентом не разрушается при гидролизе, и поэтому ДНС-аминокислоты можно идентифицировать в гидролизатах дансилированного белка (ДНС-белок) или пептида. Такие гидролизаты содержат a-ДНС-аминокислоты, образовавшиеся из N-концевых аминокислот, и s-ДНС-Лиз и О-ДНС-Тир, образовавшиеся из остатков Лиз и Тир, расположенных внутри цепи. Кроме того, дансилхлорид, реагируя с аммиаком, присутствующим в растворе, дает ДНС-сульфонамид (ДНС-NH2), а в результате гидролиза сульфонилхлоридной группы образуется ДНС-сульфоновая кислота (ДНС-ОН).
Одно из преимуществ дансилирования по сравнению с динитрофенилированием состоит в том, что после кислотного гидролиза ДНС-белка аминокислоты могут быть идентифицированы электрофоретически или хроматографически сразу после расщепления белка без экстракции гидролизата. Другим преимуществом является очень высокая чувствительность. Максимум возбуждения флуоресценции ДНС-аминокислот находится около 550 нм, их флуоресценция настолько интенсивна, что с помощью электрофореза на бумаге легко можно определить 1—5, а с помощью тонкослойной хроматографии 0,2—1,0 нмоль ДНС-производного.
МЕТОДИКА
ТЕХНИКА ДАНСИЛИРОВАНИЯ [9]
В маленькую пробирку с внутренним диаметром около 3—4 мм и длиной 25—30 мм вносят в зависимости от метода идентификации от 0,3 до 5,0 нмоль препарата. Объем раствора измеряют калиброванным капилляром. Чтобы избежать больших потерь при малом объеме проб (5—20 мкл), следует переместить капли исследуемого материала со стенок на дно пробирки с помощью непродолжительного центрифугирования при 2000—3000 об/мин. Затем раствор пептида высушивают в вакуумном эксикаторе, высушенный образец растворяют в 10 мкл 0,2 М NaHCО3 при осторожном встряхивании и вновь высушивают в вакууме. Цель высушивания в данном случае состоит в удалении аммиака, который мешает реакции. К сухому остатку добавляют 10 мкл деионизованной воды (свободной от аммиака), растворяют при осторожном встряхивании и затем добавляют 10 мкл раствора, содержащего 2 мг/мл ДНС-С1-реагента в ацетоне. Смесь осторожно встряхивают, пробирку закрывают, парафильмом и помещают в термостат при 37°С. О завершении реакции можно узнать по исчезновению желтой окраски — обычно это происходит через полчаса. После этого реакционную смесь высушивают, добавляют 30 мкл 6 н. НСl, пробирку запаивают и препарат гидролизуют 10—18 ч при 105°С. После гидролиза пробу центрифугируют для того, чтобы капли раствора со стенок попали на дно, затем пробирку осторожно открывают и высушивают в вакууме над NaOH и Р2O5.
ИДЕНТИФИКАЦИЯ ДНС-АМИНОКИСЛОТ
ДНС-аминокислоты могут быть идентифицированы с помощью электрофореза на бумаге или в тонком слое, а также с помощью тонкослойной хроматографии.
ИДЕНТИФИКАЦИЯ ДНС-АМИНОКИСЛОТ С ПОМОЩЬЮ ЭЛЕКТРОФОРЕЗА НА БУМАГЕ
Для идентификации ДНС-аминокислот необходимо провести электрофорез несколько раз. Сначала его осуществляют в пиридин- ацетатном буферном растворе pH 4,38 (фиг. 62). В данном случае важно, чтобы pH был именно 4,38, так как отклонение от этого значения даже на 0,02 единицы заметно влияет на качество разделения.
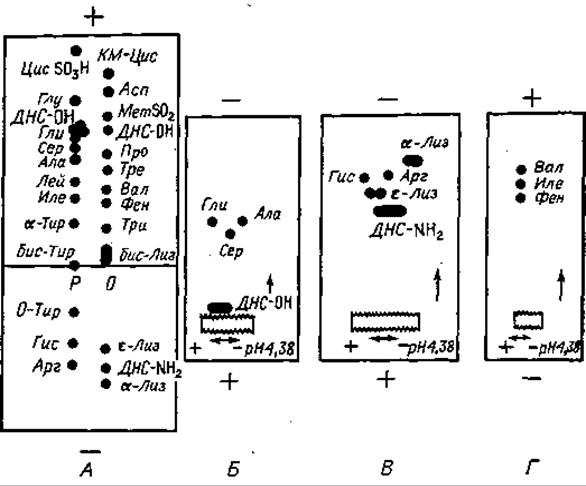
Фиг. 62. Идентификация ДНС-аминокислот хроматографией на бумаге. А. Электрофорез при pH 4, 38. Б, В, Г. Электрофорез при pH 1,9.
Буферный раствор состоит из 32 мл уксусной кислоты, 18 мл пиридина и 1950 мл дистиллированной воды. Стартовая точка находится на расстоянии одной трети длины листа от катода. Гидролизат наносят на сухую бумагу, причем стартовое пятно должно быть как можно меньше. Электрофорез продолжается 110 мин при градиенте напряжения 80 В/см. Если нет высоковольтной аппаратуры, то можно работать при среднем напряжении, пропорционально увеличив продолжительность электрофореза. Аппарат с непосредственным жидкостным охлаждением нельзя применять для первого электрофореза, поскольку ДНС-производные Про, Вал, Иле, Лей, Фен и Тир могут быть экстрагированы органическими растворителями.
Отдельно готовят два контрольных раствора ДНС-аминокислот. Один из растворов (0) содержит ДНС-КМ-Цис, ДНС-Асп, ДНС-МетSO2, ДНС-Про, ДНС-Тре, ДНС-Вал, ДНС-Фен, ДНС-Три, бис-ДНС-Лиз, а-ДНС-Лиз, ε-ДНС-Лиз, ДНС-NН2. Другой раствор (Р) содержит ДНС-Цис-SO3Н, ДНС-Глу, ДНС-Гли, ДНС-Сер, ДНС-Ала, ДНС-Лей, ДНС-Иле, а-ДНС-Тир, ДНС-Гис, ДНС-Арг, О-ДНС-Тир, бис-ДНС-Тир. Из этих растворов, в которых концентрация каждого производного равна 5 мкмоль/мл, для нанесения отбирают по 1 мкл.
После электрофореза бумагу следует тщательно высушить в сушильном шкафу при 100°С. Даже небольшое количество влаги или пиридина может вызвать сильное тушение флуоресценции, что заметно снизит чувствительность метода. Рекомендуется также установить за ультрафиолетовой лампой фен и обдувать теплым воздухом бумагу в ходе определения.
Иногда разделение ДНС-Гли, ДНС-Ала и ДНС-Сер происходит неудовлетворительно. То же относится и к группе производных ДНС-Иле, ДНС-Вал и ДНС-Фен, а в присутствии сильного пятна ДНС-NН2 также и к группе ДНС-Гис, ДНС-Арг, а-ДНС-Лиз и ε-ДНС-Лиз.
Идентификацию ДНС-Гли, ДНС-Сер и ДНС-Ала может осложнить сопутствующее пятно ДНС-ОН, однако все эти четыре компонента хорошо разделяются электрофоретически при pH 1,9. Участок электрофореграммы, содержащий эти четыре компонента (фиг. 62, Б), вырезают, пришивают к другому листу фильтровальной бумаги и проводят электрофорез при pH 1,9. На фиг. 62, Б показано распределение производных, полученное в этих условиях. Зоны, содержащие основные ДНС-производные (фиг. 62, В) и ДНС-Вал, ДНС-Иле, ДНС-Фен (фиг. 62, Г), анализируют таким же образом.
Если на N-конце белка или пептида находятся Вал или Иле, картина может осложниться из-за появления флуоресцирующих пептидов ДНС-Вал-Х и ДНС-Иле-Х благодаря устойчивости к гидролизу пептидных связей Вал-Х и Иле-Х. Подвижность этих производных отличается от подвижности ДНС-Вал и ДНС-Иле, и в результате может возникнуть ложное представление о гетерогенности исследуемого пептидного препарата. В таких случаях рекомендуется увеличить продолжительность гидролиза.
ИДЕНТИФИКАЦИЯ ДНС-АМИНОКИСЛОТ ЭЛЕКТРОФОРЕЗОМ В ТОНКОМ СЛОЕ [18]
ДНС-аминокислоты быстро и надежно могут быть идентифицированы с помощью электрофореза в тонком слое. В настоящее время в продаже имеются готовые для употребления тонкослойные пластинки для электрофореза (например, MN-полиграм, Sil N-HR, фирма Macherey-Nagel Со, ФРГ).
На пластинку размером 20 х 10 см в место старта, отмеченное на расстоянии 8 см от катода, наносят гидролизат ДНС-пептида при постоянном подсушивании. Контрольные аминокислотные смеси имеют следующий состав. Раствор К: ДНС-Цис SО3H, ДНС- Асп, ДНС-Сер, ДНС-Тре, ДНС-Про, а-ДНС-Тир, ДНС-Фен, бис-ДНС-Лиз, ДНС-Apr, ДНС-Лей, ε-ДНС-Лиз, а-ДНС-Лиз. Раствор L: ДНС-КМ-Цис, ДНС-Глу, ДНС-Гли, ДНС-Ала, ДНС-Мет, ДНС- Вал, бис-ДНС-Тир, О-ДНС-Тир, ДНС-Иле, ДНС-Гис.
Буферный раствор в конечном объеме 1 л содержит 12 мл уксусной кислоты и 8 мл пиридина (pH 4,5). Увлажнение пластинки проводят следующим образом: буферный раствор наливают в стеклянную камеру или фотографическую кювету и осторожно погружают в него пластинку. Когда уровень раствора достигнет стартовой линии, пластинку вынимают и после удаления избытка раствора промоканием вновь погружают в раствор другой стороной. Сама стартовая линия смачивается только тогда, когда оба фронта жидкости сходятся друг с другом; таким образом избегают прямого увлажнения стартовой линии.
Электрофорез проводят в горизонтальном аппарате при градиенте напряжения 80 В/см. Сила тока при ширине пластинки 10 см должна быть 50— 60 мА. После 20—25 мин электрофореза пластинку вынимают, высушивают струей теплого воздуха и проводят идентификацию ДНС-аминокислот в ультрафиолете.
Электрофореграмма показана на фиг. 63. Разделение Фен, Иле и Лей может представить известные трудности, так же как идентификация основных ДНС-аминокислот и разделение бис-ДНС-Лиз и бис-ДНС-Тир. Для разделения Фен, Иле и Лей нужно на другой пластинке сначала провести электрофорез, а затем хроматографию в перпендикулярном направлении в системе бензол—пиридин— уксусная кислота (80 : 20 : 2). Такой процедурой ДНС-Фен идентифицируется с полной определенностью, а ДНС-Иле и ДНС-Лей разделяются очень четко. ДНС-Гис определяют с помощью реакции Паули сразу же после электрофореза; таким способом его дифференцируют от других производных основных аминокислот: ДНС-Лиз и ДНС-Арг.
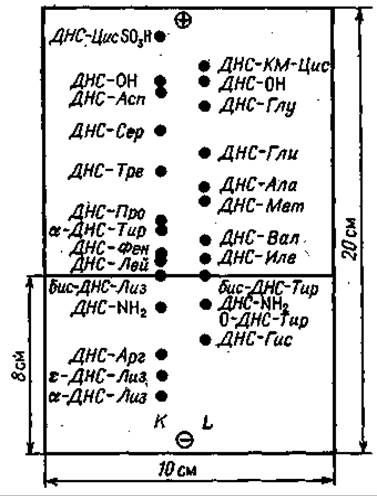
Фиг. 63. Идентификация ДНС-аминокислот тонкослойным электрофорезом при pH 4,5 в смеси пиридин — уксусная кислота.
ИДЕНТИФИКАЦИЯ ДНС-АМИНОКИСЛОТ ТОНКОСЛОЙНОЙ ХРОМАТОГРАФИЕЙ НА ПОЛИАМИДНЫХ ПЛАСТИНКАХ [18]
Все ДНС-аминокислоты могут быть определены с большой степенью достоверности тонкослойной хроматографией на полиамидных пластинках. Идентификация обеспечивается тем, что полиамидные пластинки устроены по принципу “сэндвича”, т. е. обе стороны поддерживающей пластинки покрыты тонким слоем полиамида. На одной стороне пластинки хроматографируют изучаемую ДНС- аминокислоту, а на другую наносят контрольную смесь аминокислот. Пользуясь прозрачностью пластинки, после хроматографии можно определить неизвестную ДНС-аминокислоту.
Последовательность операций в данном методе следующая. В одном из углов пластинки на расстоянии 1 см от краев отмечают стартовую точку. Необходимо проследить за тем, чтобы эта точка была в одном и том же месте с обеих сторон. Затем гидролизат, приготовленный описанным выше способом, растворяют в 20 мкл 50%-ного пиридина и половину его наносят на одну, а половину — на другую сторону, все время подсушивая раствор; важно наносить материал действительно в виде точки. Затем на одну сторону пластинки наносят контрольную смесь аминокислот, состоящую из следующих компонентов: ДНС-Сер, ДНС-Глу, ДНС-Про, ДНС-Гли, ДНС-Иле, бис-ДНС-Тир, ДНС-Арг. В контрольной смеси, 1 мкл которой наносят в место старта, концентрация каждого производного равна 1 нмоль/мкл.
Обычно для идентификации аминокислот необходимо провести хроматографию в трех системах растворителей: I — 1,5%-ная муравьиная кислота; II — бензол—уксусная кислота (9 : 1); III — этилацетат—метанол—уксусная кислота (10 : 1 : 1). В некоторых случаях при идентификации ε-ДНС-Лиз, а-ДНС-Гис и ДНС-Арг может оказаться необходимой четвертая система: IV — 0,05 М Na3PО4 — этанол (3 : 1). Для идентификации ДНС-цистеиновой кислоты требуется пятая система растворителей: V—1 М NН4ОН— этанол (1 : 1).
Исследуемые образцы сначала в течение 30 мин хроматографируют в растворе I, а затем, после высушивания пластинки феном, в течение 60 мин в перпендикулярном направлении в системе II. Пластинку опять высушивают и проверяют разделение компонентов в ультрафиолете. Хроматографию в системе III (в том же направлении, что и в системе II) проводят лишь тогда, когда необходимо идентифицировать ДНС-Тре и ДНС-Сер или ДНС-Асп и ДНС-Глу. В этом случае хроматография продолжается 45 мин. Если в смеси присутствует ДНС-Цис SО3H, то после хроматографии в системе II пробы хроматографируют в течение 40 мин в том же направлении в системе V. Для разделения ε-МН2-ДНС-Лиз, a -NН2-ДНС-Гис и ДНС-Арг после хроматографии смеси в системе II ее хроматографируют в течение 45 мин в системе IV.
Распределение пятен на хроматограмме показано на фиг. 64. Полиамидные пластинки можно применять несколько раз, если их тщательно отмывать после каждого опыта следующим образом: пластинку погружают в 50%-ный ацетон, содержащий 1 М NH4OH, стараясь не касаться стенок сосуда, и отмывают 2 ч, постоянно перемешивая отмывающий раствор. После высушивания пластинки можно использовать вновь, при этом лучше придерживаться одного и того же направления тока растворителей.
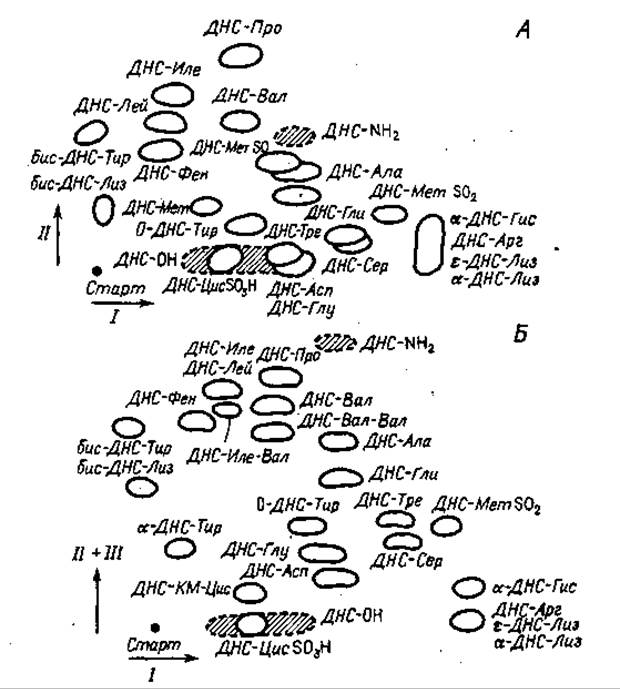
Фиг. 64. Идентификация ДНС-аминокислот хроматографией в тонком полиамидном слое.
Растворители: I — 1,5%-ная муравьиная кислота, II — бензол — уксусная кислота (9:1), III — этилацетат — метанол — уксусная кислота (10:1:1, по объему). Сокращения: КМ-Цис — 8-карбоксиметилцнстеии; Цис SO3H — цистеиновая кислота, Мет SO — метиоинисульфоксид, Мет SО2 — метиоинисульфон.
ДНС-Арг определяют в реакции Сакагуши. Бис-ДНС-Лиз и бис-ДНС-Тир можно разделить хроматографией во втором направлении в системе 2-бутанон—пропионовая кислота—вода (15 : 5 : 6).
ДНС-производное N-концевого Три полностью разрушается в ходе гидролиза. Поэтому полностью отрицательный результат в опытах по дансилированию аминокислот может свидетельствовать о том, что на N-конце присутствует Три. ДНС-Три можно легко определить после гидролиза химотрипсином. Все три производных Тир (бис-ДНС-Тир, О-ДНС-Тир на-ДНС-Тир) обычно определяются без труда, однако из-за плохой растворимости в воде бис-производное часто не обнаруживается, хотя известно, что оно присутствует в смеси. В таких случаях гидролизат растворяют в пиридине и переносят на бумагу или тонкослойную пластинку. Для ДНС-КМ-Цис характерны особенно большие потери в ходе гидролиза, поэтому следует брать для анализа больше материала, если предполагается, что эта аминокислота должна находиться на конце пептида.
ДНС-аминокислоты, необходимые для контрольных растворов, не обязательно выделять во всех случаях в чистом кристаллическом виде. Вполне достаточно дансилировать раствор аминокислот, как это описано ниже, без выделения их из раствора. Такие побочные продукты, как ДНС-ОН и ДНС-NН2, не мешают идентификации, и поэтому их можно не удалять из смеси.
Метод выделения, описанный ниже для ДНС-Ала, можно использовать также для получения следующих гомогенных кристаллических производных: ДНС-Гли, ДНС-Вал, ДНС-Лей, ДНС-Иле, ДНС-Фен, ДНС-Сер, ДНС-Тре, ДНС-Про, ДНС-Мет, ДНС-Мет SO2, ДНС-Цис, ДНС-Асп и ДНС-Глу.
150 мг аланина растворяют в 5 мл 1 М бикарбоната натрия. К этому раствору при сильном перемешивании добавляют 100 мг ДНС-С1, растворенного в 5 мл ацетона. Если часть ДНС-С1 выпадает в осадок, его растворяют, добавив 0,2 мл триметиламина. После 10 мин перемешивания реакционную смесь экстрагируют бутилацетатом (3 раза по 7 мл) для удаления ацетона, ДНС-NН2 и непрореагировавшего ДНС-С1. pH водной фазы доводят 2 н. НСl до 3,4 и ДНС-Ала экстрагируют бензолом (3 раза по 5 мл). К бензольному экстракту осторожно добавляют по каплям пиперидин до помутнения и оставляют на холоду. Перекристаллизацию проводят из бутилацетата.