Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Газохроматографический анализ производных аминокислот. Состояние проблемы. Возможности и ограничения метода
Принцип метода
Методика
Ввод образца
С помощью микродозатора аминокислотный раствор вводят а реактор, где под влиянием различных реагентов аминокислоты: превращаются в летучие вещества. Если имеются уже готовые летучие производные, их прямо вводят в прибор. В любом варианте вносимый образец должен испариться в токе газа-носителя в процессе, протекающем в нагреваемой камере, куда вводят 5—50 мг образца в сухом виде или в виде концентрированного раствора (фиг. 66).
При изотермическом ГХ-анализе переход в газообразное состояние должен происходить очень быстро, за доли секунды. В то же время смесь не должна подвергаться изменениям, т. е. соотношение веществ должно оставаться постоянным. Изменение соотношения веществ происходит в том случае, если вспомогательный материал, например растворитель, и легко летучая фракция образца испаряются очень быстро, а потом начинается испарение менее летучих фракций. Когда используют методику ГХ с программированием температуры, образец наносят другим способом.
При ГХ-анализе производных аминокислот мы уже столкнулись с определенными трудностями. Если дозатор горячий, летучие образцы испаряются мгновенно без повреждения. Но если дозатор имеет слишком высокую температуру, то могут происходить химические превращения термолабильных веществ. Следовательно, успешное проведение анализа зависит от правильного выбора температуры.
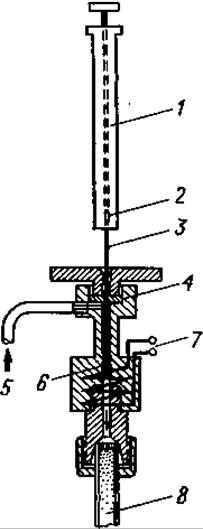
Фиг. 66. Устройство для ввода проб (дозатор).1 — шприц (например, гамильтоновский шприц на 10 мкл); 2 — объем, занимаемый образцом; 3 — игла; 4 — термоустойчивая резиновая прокладка; 5 — вход для газа-носителя; 6 — испарительная камера со сменными элементами; 7 — нагревательный элемент испарительной камеры; 8 — колонка.
Разделение
Испарившись в потоке газа-носителя, образец находится в условиях, близких к условиям вакуумной перегонки. Сильным разведением в инертном газе достигается его эффективная защита от дальнейшего повреждения. Выбор газа-носителя определяется используемым детектором (см. ниже), а также и другими факторами, которые следует принимать во внимание. Газ-носитель переносит испарившийся образец в ячейку прибора, где происходит разделение, зависящее от различных физических и химических параметров, обсуждаемых ниже.
Свойства разделяющей жидкости
В выбранных условиях работы прибора жидкая фаза определяет порядок выхода различных производных аминокислот с разделяющей колонки и относительные расстояния между ними (см. табл. 13, стр. 306).
Твердая фаза
Твердая фаза (носитель) обычно представляет собой гладкую или шероховатую поверхность из чистого металла. Ею может служить также поверхность трубки, модифицированная каким-либо неорганическим соединением, на которой в виде пленки сконденсирована жидкая фаза. В последнем случае говорят о разделяющем капилляре, а методику в целом называют капиллярной ГХ [44] (фиг. 67);
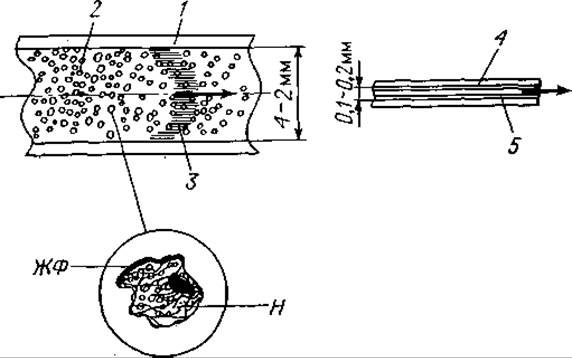
Фиг. 67. Набивная колонка и открытый капилляр.
1 — трубка (из стали 6X1 или 4X1, стекла или других материалов); 2 — плотная набивка частицами носителя (Н) размером 0,20—0,25 или 0,10—0,12 мм (площадь поверхности 0,3—3 м2/г); носитель импрегнируется жидкой фазой (ЖФ) (0,5—20% по весу); 3 — одна из последних фракций, проходящая через колонку; 4 — капиллярная трубка, сделанная из стали, стекла или других материалов, с внешним диаметром 2 мм и внутренним диаметром 0,10—0,25 мм; 5 — пленка жидкой фазы толщиной 10-3 — 10-2 мм на внутренней поверхности капилляра.
В качестве твердого носителя можно использовать также какой-либо неорганический пористый материал, например диатомовую землю [47], которую для ГХ аминокислот необходимо тщательно дезактивировать. Очень хорош в качестве твердой фазы, например, хромосорб G. При анализе аминокислот с большим успехом применяют твердые органические соединения (например, хромосорб Т), на которых получаются абсолютно симметричные пики даже для сильно полярных веществ.
Температура
Рабочая температура или температурный градиент (т.е. скорость повышения температуры в град/мин в методике с программированием температуры) также влияют на процесс разделения (фиг. 68). Наряду с некоторыми недостатками метод с программированием температуры имеет много достоинств; он позволяет получить наилучшие результаты на данной разделяющей колонке, если сравнивать его с другими методами.
Эффективность разделения зависит также от ряда других факторов: потока газа-носителя, длины колонки, перепада давления и, что не менее важно, качества набивки колонки, которую можно охарактеризовать эффективностью колонки, выражаемой числом теоретических тарелок на метр длины колонки.
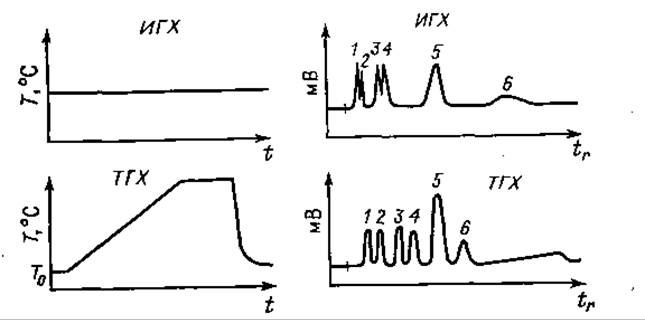
Фиг. 68. Влияние температуры на разделение.
ИГХ — изотермическая газовая хроматография; температура постоянная. ТГХ — газовая хроматография с программированием температуры; температура увеличивается от То до Т. В обоих случаях смесь делится на 6 пиков.
Детектирование, регистрация, измерение, идентификация
Из многочисленных детекторов, существующих в настоящее время, для количественного анализа аминокислот пригодны только детектор по теплопроводности, газовый денситометр и пламенноионизационный детектор. В детекторе теплопроводности для обеспечения достаточной чувствительности в качестве газа-носителя необходим гелий или водород, в газовом денситометре — азот или гелий, а в пламенно-ионизационном детекторе — высокоочищенный азот.
Поскольку для ГХ-анализа вообще и анализа аминокислот в частности характерно стремление к получению наилучшего разделения при минимальных затратах веществ, обычно предпочитают пользоваться наиболее чувствительным из всех детекторов — пламенноионизационным (фиг. 69).
Принцип метода. К границе слабого пламени, питаемого током высокоочищенного водорода (получаемого электролизом), со скоростью 2—3 л/ч подводят ток газа-носителя. Если газ-носитель содержит органические соединения, то в радикальной реакции сгорания будут образовываться промежуточные сильно ненасыщенные полимерные вещества, которые легко ионизируются, а также полимерный углерод. В электрическом поле, создаваемом между горелкой (отрицательный полюс) и измерительным электродом легко ионизируемые частицы отдают электроны и в результате образуется ионный ток (приблизительно 10-12—10-6 А). После соответствующих преобразований электронный компенсационный самописец регистрирует ионный ток в милливольтах (от 0,01 мВ до 1 В) как функцию времени удерживания.
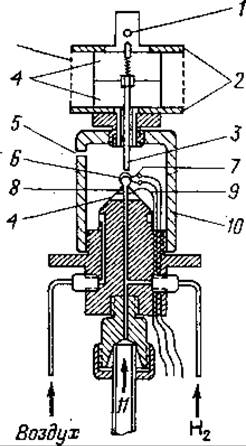
Фиг. 69. Схематическое изображение пламенно-ионизационного детектора.
1 — место присоединения измерительного прибора; 2 — выступы для охлаждения электрода; 3 — стержневой стальной электрод; 4 — изоляция (тефлон); 5 — выход использованного газа; 6 — пламя; 7 — горелка с регулируемым пламенем; 8 — форсунка; 9 — подсоединение ионизирующего напряжения; 10 — экраны; 11 — выход с разделяющей колонки.
Поправки, необходимые для количественной оценки, специфичны для каждого вещества и могут быть найдены с достаточной точностью путем калибровки или расчета, причем решающим фактором в этих расчетах является содержание углерода в исследуемом соединении [48].
Определяя количество вещества, следует помнить, что не зная качественного состава образца (если отсутствуют измерения или расчеты специфических поправок), трудно получить достоверные аналитические данные простым измерением площадей пиков, поскольку систематические ошибки измерений при этом могут превышать 10—15%. Вопрос количественных измерений в ГХ-анализе хорошо разобран Кайзером [48] (фиг. 70); ниже мы рассмотрим некоторые детали его.
Для количественной оценки хроматограмм производных аминокислот существуют следующие возможности:
1. Применение неполярных и полярных неподвижных фаз и вычисление индексов удерживания и скачка индекса удерживания при переходе от неполярной фазы к полярной [46, 52].
2. Непосредственное сочетание газовой и тонкослойной хроматографии.
3. Соединение газового хроматографа с масс-спектрометром [13, 20, 33, 75, 97].
4. Одновременное использование двух детекторов, таких, как ячейка теплопроводности и пламенно-ионизационный детектор.
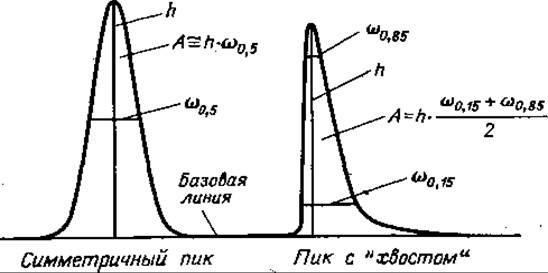
Фиг. 70. Количественная оценка хроматограмм: измерение площадей пиков с помощью приближенных методов (см. текст).
При использовании первой возможности окончательная идентификация достигается только при условии анализа большого числа стандартных образцов, тогда как сочетание ГХ с масс-спектрометрией обеспечивает самый простой и наиболее эффективный способ идентификации. В этом случае пик образца вместе с гелием (специально очищенным для этой цели) поступает через щель размером 0,1 мм (также омываемую чистым гелием) в стеклянный капилляр с внутренним диаметром около 0,005 мм, помещенный в систему высокого вакуума масс-спектрометра (например, спектрометра типа СН5, выпускаемого фирмой Atlas Messand Analysentechnik Gmb H, ФРГ). ГХ-сигнал, поступающий из ионного источника, регистрируется самописцем обычным образом, как это делается в ГХ-детекторах. Развертывающее устройство дает сигнал во всех случаях, когда максимум пика проходит через систему. В этот момент (время запаздывания 0,1 с) с помощью фотоумножителя быстро сканируется (за несколько десятых секунды) вся область интересующих экспериментатора масс, и масс-спектр регистрируется самописцем (самопишущий УФ-гальванометр). Даже если некоторые пики накладываются друг на друга, такой анализ дает практически всю информацию, необходимую для полного установления структуры.
Хотя этот метод довольно дорогостоящий, он не имеет себе равных по эффективности анализа.
Вторая возможность — комбинация с тонкослойной хроматографией — при подходящих условиях также может привести к достоверной идентификации, причем это самый дешевый из комбинированных методов.