Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Анализ белков с помощью низковольтного электрофореза
Низковольтный электрофорез на бумаге
Количественная оценка результатов разделения белков при низковольтном электрофорезе на бумаге
Количественная оценка окрашенных белковых фракций, полученных при электрофорезе на бумаге, основывается на том, что для используемых красителей справедлив закон Ламберта — Бэра.
Существует два способа количественного определения красителей, связавшихся с белками: элюирование фракций из электрофореграммы и их колориметрическое измерение и прямая электрофотометрия неразрезанной полоски.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ БЕЛКОВ МЕТОДОМ ЭЛЮИРОВАНИЯ ЭЛЮИРОВАНИЕ ОТДЕЛЬНЫХ ФРАКЦИИ
Принцип метода. Вырезают участок бумажной электрофореграммы с каждой отдельной фракцией; сорбированный на этом участке краситель элюируют и определяют колориметрически.
Методика. 1. Разрезание электрофореграммы на участки, занимаемые отдельными фракциями. На окрашенных и высушенных электрофореграммах те фракции, которые нужно элюировать, обводят карандашом. В местах, где граница между фракциями видна не четко, т. е. краситель не полностью удален из бумаги, соседние фракции делят по линии наименьшего окрашивания.
После разметки участки электрофореграммы, занимаемые каждой отдельной фракцией, вырезают. Чтобы элюирование было быстрым и достаточно полным, такой участок следует дополнительно разрезать на мелкие кусочки.
2. Элюирование. Соответственно числу фракций готовят ряд пробирок, в которые наливают по 3 мл раствора. Каждый участок электрофореграммы, соответствующий индивидуальной фракции, помещают в отдельную пробирку. Элюирование продолжается 2 ч при комнатной температуре, причем пробирки необходимо периодически встряхивать. При щелочном элюировании полученные элюаты подкисляют 1 мл 0,1 н. НСl и колориметрируют, определяя величину экстинкции при соответствующей длине волны.
В табл. 9 приведен состав элюирующих растворов, а также условия элюирования и колориметрии, рекомендуемые для использования в описанных методах.
Таблица 9 Условия элюирования и колориметрии при разных методах окрашивания электрофореграмм
Краситель |
Элюирующий раствор |
Время элюирования, ч |
Длина волны при колориметрии, им |
Амидовый черный |
0,1 н. NaOH |
0,5 |
595 |
Кислый фуксин |
0,1 н. NaOH |
2 |
570 |
Пунцовый красный |
0,1 н. NaOH |
2 |
550 |
Азокармин |
0,1 н. NaOH |
2 |
570 |
Бромфеноловый синий |
50%-ный метанол, содержащий 5% Na2CО3 |
0,5 |
550—600 |
Когда определяемая фракция содержит значительное количество белка (например, фракция альбумина при электрофорезе белков сыворотки), чтобы получить величины экстинкции, лежащие в пределах максимальной точности показаний прибора, объем элюирующего раствора следует увеличить до 6 мл.
3. Количественная оценка. Если учесть разведение и принять за 100% общую сумму величин экстинкции всех фракций, то можно рассчитать процентное содержание каждой фракции в исследуемом образце.
Примечания. 1. Анализ бумажных электрофореграмм методом элюирования весьма удобен для повседневной работы в клинических лабораториях. Он сравнительно прост, отличается быстротой получения результатов и их хорошей воспроизводимостью.
2. Рекомендуемые красители достаточно быстро окрашивают белковые фракции сыворотки и специфичны в отношении белков, т. е. не окрашивают других компонентов сыворотки. Однако различные белки окрашиваются по-разному. В связи с этим возможны артефакты, для устранения которых некоторые авторы предлагают вводить в количественный анализ электрофореграмм особые поправки: они должны привести в соответствие данные зонального и свободного электрофореза.
Тем не менее при проведении повседневных клинических анализов и даже в исследовательской работе этими поправками можно пренебречь. Во-первых, расхождение показателей может зависеть не только от самих красителей, но и от различных моментов техники окрашивания, элюирования и т. д. В этом случае внесение поправки только частично исправит ошибку. Во-вторых, техника анализа в руках каждого исследователя со временем стандартизуется настолько, что получаемые результаты становятся сопоставимыми друг с другом, а это вполне удовлетворяет требованиям, предъявляемым к экспериментам в повседневной клинической работе. Если какие-либо особые причины все же заставляют вводить поправки, то их величину следует определить в конкретных условиях, принимая во внимание все особенности опыта. Такие поправки дадут более точные результаты, чем величины, просто заимствованные из литературы.
3. Удобно представлять полученные результаты графически на миллиметровой бумаге. Когда по оси абсцисс откладывают ширину каждой фракции, измеренную на окрашенной электрофореграмме, а по оси ординат наносят процентное содержание белка соответствующей фракции, расположение точек очень напоминает график, получаемый по методу Тизелиуса. Соединив эти точки кривой, мы можем построить таким образом протеинограмму сыворотки.
МЕТОД ЭЛЮИРОВАНИЯ РАВНЫХ ОТРЕЗКОВ ВСЕЙ ЭЛЕКТРОФОРЕГРАММЫ
Окрашенные и высушенные электрофореграммы разрезают поперек на отрезки шириной 1—3 мм, каждый отрезок по отдельности элюируют одним из способов, описанных в этом разделе, и колориметрируют. На графике откладывают по оси ординат величину экстинкции, а по оси абсцисс — положение данного отрезка на электрофореграмме (в мм). В сравнении с предыдущим этот метод дает более правильную кривую. Однако он весьма трудоемок и в конце концов не обеспечивает большей точности. Процентное содержание различных белковых фракций при элюировании равных отрезков электрофореграммы определяют на полученной кривой планиметрически.
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ БЕЛКОВ ФОТОЭЛЕКТРИЧЕСКИМ МЕТОДОМ
Принцип метода: с помощью особой пропитки увеличивают прозрачность бумажной электрофореграммы и в специальном приборе определяют экстинкцию ее последовательно расположенных участков.
ПРИБОРЫ
1. Вакуумный эксикатор. Обычный лабораторный эксикатор с краном, соединенный с вакуумным насосом.
2. Денситометр. Существует несколько моделей таких приборов, действующих по изложенному ниже принципу (фиг. 4). Бумажную электрофореграмму, прозрачность которой увеличена специальной пропиткой, зажимают между двумя стеклянными пластинками 1 и помещают перед щелью 2, за которой расположен источник света 3. Позади зажатой между стеклянными пластинками электрофореграммы располагается фотоэлемент 4. По силе тока, возникающего в цепи, фотоэлемента, можно определить величину экстинкции Е для каждого участка электрофореграммы:
![]()
1) Приборы без автоматических приспособлений. Приборы для денситометрии, в которых передвижение бумажной электрофореграммы и регистрация экстинкции производятся вручную.
2) Полуавтоматические приборы. Денситометры, в которых передвижение электрофореграммы и регистрация экстинкции производятся автоматически. Экспериментатор должен только провести количественный анализ кривой.
3) Полностью автоматические приборы. В этих приборах передвижение электрофореграммы, регистрация экстинкции и обсчет полученной кривой производятся автоматически.
МЕТОДИКА
1. Увеличение прозрачности бумажной электрофореграммы. Окрашенные и высушенные электрофореграммы погружают в сосуд для окрашивания, заполненный глицерином. Необходимо следить, чтобы глицерин полностью покрывал полоски бумаги. Сосуд с погруженными в глицерин электрофореграммами помещают в вакуумный эксикатор, закрывают крышку и на 30 мин создают вакуум, который способствует выходу пузырьков воздуха из бумаги и лучшему пропитыванию последней глицерином. Если через 30 мин окажется, что глицерин пропитал электрофореграммы недостаточно равномерно, всю процедуру следует повторить.
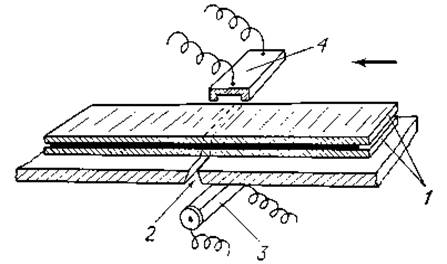
Фиг. 4. Схема прибора для денситометрии бумажных электрофореграмм (описание см. в тексте).
2. Денситометрия электрофореграммы и запись протеинограммы. Пропитанные глицерином бумажные электрофореграммы зажимают между двумя входящими в комплект денситометра стеклянными пластинками толщиной 1 мм. Для точного анализа очень важно, чтобы между пластинками и бумагой не осталось ни одного пузырька воздуха. Пузырьков можно легко избежать, если до закрепления электрофореграммы внутренние поверхности стеклянных пластинок покрыть тонким слоем глицерина. При закреплении электрофореграммы пластинки осторожно двигают относительно друг друга так, чтобы между ними и бумагой не осталось пузырьков воздуха. После этого их тщательно вытирают мягкой тканью и вставляют в соответствующее гнездо денситометра. Реагируя на изменение экстинкции, самописец прибора чертит кривую, весьма похожую на кривую Тизелиуса.
3. Количественная оценка протеинограммы. На протеинограмме каждая фракция представлена отдельной гауссовой кривой (фиг. 5). Площадь под кривой, соответствующей каждой фракции, можно измерить планиметрически или определить путем взвешивания на торзионных весах участка бумаги, вырезанного по ее контуру.
Для взвешивания всегда нужно вырезать полностью всю область, которую очерчивает гауссова кривая данной фракции. Так, например, после взвешивания участка бумаги, соответствующего альбумину, определяя вес участка, соответствующего а1-глобулину, к нему следует прибавить участок, являющийся общим для областей этих двух фракций. Суммарный вес всех участков принимают за 100% и, исходя из него, рассчитывают процентное содержание каждой фракции.
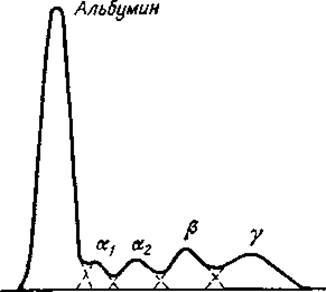
Фиг. 5. Количественная оценка электрофоретической диаграммы. Кривую экстинкции. полученную с помощью фотоэлектрического детектора (сплошная линия), расчленяют на гауссовы кривые (пунктирные линии), соответствующие каждой фракции. Подробное описание см. в тексте.
При работе с автоматическими приборами обычно пользуются способами расчета, которые рекомендуют фирмы-изготовители.
ПРИМЕЧАНИЯ
1. Для пропитки электрофореграмм вместо глицерина можно применять следующие реактивы: смесь равных частей жидкого парафина и а 1-бромнафталина (показатель преломления 1,5), бензиловый спирт (показатель преломления 1,54), метиловый эфир салициловой кислоты (показатель преломления 1,54).
Наиболее доступным реактивом все же является глицерин. Он особенно удобен для пропитки электрофореграмм, окрашенных для выявления гликопротеидов, но его нельзя применять в том случае, когда электрофореграммы окрашены кислым фуксином, так как он экстрагирует слишком много красителя из бумаги.
Недостаток парафин-бромнафталиновой смеси состоит в том, что при ее использовании бумага сохнет довольно медленно, а сама смесь раздражающе действует на слизистые оболочки.
2. Использование соответствующих светофильтров повышает точность работы денситометра. Следует применять красный светофильтр для денситометрии электрофореграмм, окрашенных синими красителями, и зеленый для электрофореграмм, окрашенных красными красителями. (Соответствующие рекомендации и другие сведения по эксплуатации обычно содержатся в руководстве к прибору.)
3. Величины процентного содержания фракций, определяемые денситометрией электрофореграмм, отличаются хорошей воспроизводимостью. Естественно, они в известной мере расходятся с данными свободного электрофореза или с данными, полученными методом элюирования. Эти расхождения заставляют некоторых исследователей вводить специальные поправки. Наша оценка этих поправок приведена на стр. 61.
4. Увеличение прозрачности электрофореграмм можно получить с помощью приспособления “Элфор-Транспавак” фирмы Веnder-Hobein, ФРГ. Приспособление представляет собой стеклянный цилиндрический сосуд, сужением разделенный на две части. В верхнюю часть помещают электрофореграмму, в нижней находится пропитывающая жидкость. Сосуд герметически закрывают притертой крышкой и верхнюю его часть с помощью крана соединяют с вакуумным насосом. Достигнув необходимого разрежения, кран, соединяющий сосуд с вакуумным насосом, закрывают. Сосуд переворачивают, и через несколько минут окрашенная электрофореграмма пропитывается жидкостью. В этом случае не наблюдается образования пузырьков воздуха, которые мешают денситометрии.