Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Количественное определение аминокислот с помощью автоматических аминокислотных анализаторов
Принцип метода (фиг. 35). Анализируемый материал фракционируется на колонке К, заполненной смолой типа дауэкс 50 х 8. Подача буферных растворов (Б1, Б2, Б3) осуществляется насосом H1 и регулируется краном Кр. Выходящая из колонки жидкость поступает в смеситель с, содержащий раствор нингидрина (Нг), который подается насосом Н2. Эта реакционная смесь проходит через капилляр Кn, погруженный в водяную баню с температурой 100° С, где и происходит характерная для аминокислот цветная реакция. Далее окрашенный элюат проходит через спектрофотометр Ф, показания которого регистрируются самописцем См.
Область применения. Химические и биохимические исследования белка, синтез аминокислот и пептидов, исследования гормонов, клиническая диагностика, экспериментальная и промышленная энзимология, селекция растений и др.
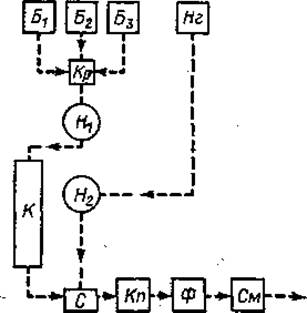
Фиг. 35. Схема работы автоматического аминокислотного анализатора (обозначения см. в тексте).
МЕТОДИКА
1. Выбор аналитического метода. Аминокислоты можно определять с помощью двух- или одноколоночного метода. В первом случае основные аминокислоты анализируют на отдельной колонке с высотой столбика смолы 6—8 см, а кислые и нейтральные аминокислоты — на другой, более длинной колонке высотой 50 см. При этом для определения основных аминокислот требуется около 1 ч, а для определения кислых и нейтральных аминокислот — около 3 ч.
Во втором методе для определения всех аминокислот используют лишь одну колонку. Время, необходимое для анализа, в этом случае зависит от числа используемых буферных растворов, что в свою очередь определяется имеющейся аппаратурой. Если прибор, например анализатор Унихром фирмы “Beckman” (США), автоматически позволит производить однократную смену одного буферного раствора на другой, то предпочтительнее применять двухбуферную систему. В этом случае весь анализ занимает 4 ч. Если же прибор позволяет автоматически менять протекающий буферный раствор два или несколько раз, то используют систему из трех буферных растворов, что сокращает продолжительность анализа до 3 ч. При соответствующей комбинации методов продолжительность анализа двухколоночным методом можно еще уменьшить (см. ниже).
2. Аппаратура. В настоящее время можно приобрести автоматические аминокислотные анализаторы нескольких типов, каждый из которых имеет свои преимущества и недостатки. Для обычных целей более экономичны простые анализаторы. Это определяется скорее не ценой, а надежностью как в обеспечении непрерывности операции, так и в способе программирования работы прибора. По-видимому, прибор с приспособлением для автоматического нанесения образца, надежно обеспечивающий непрерывность в работе, можно считать вполне экономичным.
Аминокислотный анализатор — это сложный прибор, требующий постоянного ухода даже при аккуратном обращении с ним. Анализатор не должен выключаться на длительное время (1—2 дня). Буферные растворы являются прекрасными средами для размножения грибов и других микроорганизмов. Даже при 1—2-дневной остановке прибора возможно бактериальное прорастание растворов, искажающее результаты анализа (см. источники ошибок). Если прибор постоянно не используется, то следует каждый день включать его на несколько минут для циркуляции растворов и менять при этом положение всех кранов. Когда прибор выключают на длительное время, необходимо удалить буферные растворы и промыть его дистиллированной водой. Смола должна храниться в щелочном растворе в колонке или в каком-либо сосуде.
3. Смола. В современных анализаторах применяются смолы со сферическими частицами, благодаря которым скорость протекания растворов через колонку при относительно небольшом давлении может быть довольно высокой. Если частицы смолы имеют одинаковые размеры и давление в колонке постоянно в определенных пределах, то смола заметно не сжимается. Но даже при абсолютной однородности частиц смолы после 30 анализов ее следует удалять из колонки и инкубировать в 2 н. NaOH при 80°С в течение 30 мин. Закончив инкубацию, жидкость сливают и смолу суспендируют в 0,2 н. NaOH. После осаждения частиц смолы надосадочную жидкость вновь сливают, а ионообменник суспендируют в буферном растворе определенной молярности в зависимости от применяемого метода. В колонку смолу вносят в этом же буферном растворе, а затем им же (тремя oбъемами колонки) окончательно отмывают колонку перед нанесением препарата.
4. Буферные растворы. Раствор для нанесения образца: 0,2 М NaCl в 0,01 н. НСl. Приготовление: 11,6 г NaCl и 0,8 мл концентрированной НСl растворяют в деионизованной дистиллированной воде в конечном объеме 1 л.
Элюирующие растворы: состав элюирующих буферных растворов приведен в табл. 8.
Таблица 8 Буферные растворы для автоматического аминокислотного анализатора
А |
Б |
В |
Г |
Д |
Е |
|
Na+, M |
0,2 |
0,2 |
0,35 |
0,8 |
0,8 |
1,6 |
pH |
3,28 |
4,25 |
5,28 |
4,25 |
4,25 |
6,0 |
Конечный объем, мл |
5000 |
5000 |
5000 |
5000 |
5000 |
5000 |
Лимонная кислота (одноводная), г |
70,5 |
282,0 |
123,0 |
282,0 |
70,5 |
35,25 |
НСl (уд. вес 1,19), мл |
61,6 |
167,5 |
32,5 |
167,0 |
41,88 |
— |
NaOH, г |
40,0 |
160,0 |
70,0 |
160,0 |
40,0 |
20,0 |
NaCl, г |
— |
— |
— |
— |
175,32 |
438,75 |
Этанол, мл |
200 |
— |
— |
— |
— |
— |
Детергент (брий 35), г |
10 |
10 |
10 |
10 |
10 |
10 |
Для приготовления всех растворов используется деионизованная дистиллированная вода, которую можно получить, пропуская дистиллированную воду через колонку, заполненную катионо- и анионообменниками.
Необходимо, чтобы растворы А и В имели строго определенный pH, поскольку даже небольшое изменение pH вызывает значительное ухудшение разделения. При элюировании раствором А маркером на хроматограмме может служить цистин. В идеальном случае он выходит между аланином и валином. Если же pH выше 3,28, пик цистина смещается ближе к пику аланина или даже сливается с ним. С другой стороны, если pH раствора ниже 3,28, пик цистина смещается к пику валина, перекрывает его или даже предшествует ему на хроматограмме. В первом случае буфер подкисляют добавлением 0,5—1,0 мл концентрированной НСl на 1 л раствора, а во втором pH раствора повышают, добавляя такое же количество 50%-ного раствора NaOH. Необходимо отметить, что при подщелачивании возрастает концентрация ионов натрия, а следовательно, увеличивается молярность раствора А. При увеличении концентрации Na+ с 0,2 до 0,25 н. пики аспарагиновой кислоты, треонина, серина, глутаминовой кислоты и пролина сливаются. При элюировании раствором В маркером служит гистидин. Если pH раствора слишком высокий, пик гистидина накладывается на пик аммиака, а если слишком низкий — увеличивается время, необходимое для элюирования. Для колонки высотой 6—8 см при скорости протекания 68 мл/ч максимальная продолжительность элюирования 1 ч.
Даже если анализатор используется непрерывно, из-за опасности размножения бактерий не следует готовить более 5 л буферных растворов. Первым признаком пророста (когда раствор еще не имеет хлопьев) является асимметрия пиков, в особенности в восходящей части, и слияние пиков аммиака и лизина при одноколоночной процедуре. При обильном проросте оба пика полностью накладываются друг на друга. Проросший раствор следует немедленна вылить, посуду тщательно отмыть сначала детергентом, а затем деионизованной водой; эту же процедуру необходимо проделать с соединительными трубками. Проросшую смолу нельзя отмывать в колонке, ее следует извлечь и промыть теплым щелочным раствором.
Небольшие колебания pH растворов Г, Д и Е не столь важны при элюировании, как изменения в концентрации ионов натрия. Если концентрацию Na+ уменьшить на 0,05 М, расстояние между пиками аммиака, лизина, гистидина и аргинина на хроматограмме увеличивается. При увеличении концентрации ионов натрия на 0,05 М аммиак выходит сдвоенным пиком с лизином. Концентрация ионов натрия в растворе Г зависит от качества используемой NaOH, а в растворах Д и Е — от чистоты NaCl. Судя по нашему опыту, большая часть препаратов NaCl содержит заметные количества воды, поэтому мы рекомендуем пользоваться препаратами, предварительно высушенными при 100°С в течение 6 ч.
Очень важно, чтобы растворы были свободны от аммиака. Если растворы, особенно А, содержат аммиак, то при одноколоночном методе на хроматограмме можно наблюдать так называемое “аммиачное плато”, которое начинается перед пиком аммиака и кончается после пика гистидина. Чем выше это плато, тем меньше чувствительность прибора в тех пределах, где выходят пики аммиака, лизина и гистидина. Чтобы избежать высокого фона, следует применять реактивы высокой чистоты и деионизованную воду, а также запретить курение в комнате, где стоит прибор.
5. Заполнение колонки. Заполнение малой колонки для определения основных аминокислот. Около 15 мл смолы смешивают с 0,2 н. NaOH. После оседания частиц надосадочную жидкость декантируют, смолу суспендируют в растворе. В, перемешивая при комнатной температуре 30 мин. После оседания частиц надосадочную жидкость опять декантируют и всю процедуру повторяют. Затем смолу смешивают с двумя объемами раствора В. На дно колонки на металлическую сетку кладут круглый фильтр и наливают около 2 мл раствора В. Смолу суспендируют в 2 объемах раствора В, наливают в колонку и оставляют стоять 5—10 мин. Затем к колонке подключают раствор В. Высота осевшей смолы в колонке должна быть 6—8 см. Через колонку 3 раза поочередно пропускают 0,2 н. NaOH и раствор В.
Заполнение большой колонки для разделения кислых и нейтральных аминокислот при двухколоночном методе. Для одной колонки требуется около 50 г смолы. Большая колонка заполняется так же, как и малая (описано выше), за исключением того, что вслед за обработкой щелочью смолу суспендируют в растворе А и последующую обработку в колонке также производят щелочью и раствором А.
Заполнение колонки при одноколоночном методе. При одноколоночном методе анализа в системе двух растворов эти растворы отличаются по концентрации Na+ в 4 раза. В системе трех буферных растворов первый и третий растворы отличаются по концентрации Na+ в 8 раз. Столь большие различия могут влиять на объем смолы в колонке, если заполнение ее вести обычным способом. Чем выше молярность раствора, тем меньше набухание и соответственно объем смолы в колонке. Поэтому если при заполнении колонки был использован первый низкомолярный буфер, а при последующей обработке применялся буферный раствор более высокой молярности, то объем смолы в колонке может заметно уменьшиться, что при повторном цикле пропускания растворов приведет к очень сильному спрессовыванию. Во избежание этого заполнение колонки проводят следующим образом.
Смолу смешивают с 0,2 н. NaOH, надосадочную жидкость декантируют, а осадок заливают раствором Г или Д при работе в двухбуферной и раствором Е при работе в трехбуферной системе. После 30 мин уравновешивания жидкость декантируют, а смолу вновь суспендируют в данном растворе. После очередной декантации смолу смешивают с двумя объемами раствора и вливают в колонку, как описано выше. Важно заполнять колонку в растворе высокой молярности. После того как столбик смолы в колонке достигает 50 см, для окончательной упаковки через колонку в течение 20 мин пропускают раствор высокой молярности. Затем повторяют пропускание растворов, начиная со стартового, и этот цикл обработки проделывают еще 3 раза. Следует иметь в виду, что из-за различий в молярности продолжительность каждого цикла занимает по крайней мере 20 мин.
Благодаря высокой концентрации ионов натрия (0,8 и 1,5 н.) в используемых растворах совсем не обязательно проводить каждый раз регенерацию колонки щелочью. Обработку щелочью целесообразно производить один раз после каждых 15—20 анализов, а проведя 30 анализов, рекомендуется извлечь смолу из колонки и обработать подогретой щелючью.
6. Приготовление пробы. Гидролиз пептидов и белков. Анализируемый материал растворяют или суспендируют в 6 н. НСl, которую берут примерно в 200-кратном избытке. Через полученный кислый раствор или суспензию продувают азот и ампулу запаивают. Гидролиз продолжается 48—72 ч при 106°С, а по окончании его кислоту удаляют над КОН и Р2O5 при 80°С в вакуумном эксикаторе.
Важно достаточно быстро удалить соляную кислоту: при медленном ее удалении возможно частичное разрушение аминокислот.
При кислотном гидролизе триптофан разрушается полностью, а серин и треонин — на 5—10%; разрушаются также цистин, цистеин и метионин. Из метионина получается главным образом метионинсульфоксид, который частично снова превращается в метионин в процессе гидролиза. Серусодержащие аминокислоты могут быть определены только в окисленных образцах (например, окисленных надмуравьиной кислотой).
Освобожденный от кислоты гидролизат растворяют в смеси 0,2 н. NaCl и 0,01 н. НСl (раствор для нанесения).
Подготовка проб сыворотки крови. Анализируемую сыворотку смешивают с сульфосалициловой кислотой (20 : 1) и центрифугируют. Надосадочную жидкость сливают в 5-миллилитровую колбочку. Осадок промывают двумя порциями по 1,5 мл раствора для нанесения и объем объединенной надосадочной жидкости доводят до 5,0 мл тем же раствором.
Подготовка проб мочи. К 5 мл мочи добавляют 2 н. NaOH до pH 11—12 и раствор высушивают в вакуумном эксикаторе для удаления аммиака. Суаой остаток растворяют в 10 мл раствора для нанесения.
Примечания. Физиологические жидкости — сыворотка, моча и др. — содержат как моноаминодикарбоновые кислоты, так и их амиды (аспарагин и глутамин). Их разделение требует специальных методов, обзор которых сделан Бенсоном и др. [1].
При исследовании любого материала (белкового гидролизата, физиологической жидкости, синтетического материала и др.) количество анализируемого образца в среднем должно быть 0,25— 0,35 мкмоля (при длине кюветы 6,6 мм), причем нижний предел — не ниже 0,1 мкмоля, а верхний — не выше 1,0 мкмоля. Если анализатор снабжен микроспектрофотометром, то можно брать для анализа 0,05—0,075 мкмоля, а нижний и верхний пределы будут 0,001 и 0,3 мкмоля соответственно.
7. Нанесение образца. Образец можно нанести на колонку либо вручную, либо автоматически. К автоматическим устройствам для нанесения образца обычно прикладываются подробные инструкции, поэтому мы не будем здесь рассматривать автоматический способ нанесения.
Анализируемое вещество растворяют в упомянутом выше буферном растворе для нанесения, имеющем оптимальный для связывания pH. Объем образца можно варьировать, однако нанесение слишком больших объемов занимает много времени. Оптимальным, пожалуй, является объем от 0,1 до 0,5 мл. Раствор над смолой удаляют и образец вводят соответствующей пипеткой с помощью сжатого азота. Остатки наносимого образца трижды смывают со стенок колонки стартовым раствором круговыми движениями пипетки.
8. Программирование. Программирование анализа, т. е. выбор соответствующего аналитического метода, зависит от конкретной задачи. Если в лаборатории определенного профиля обычно проводят однотипные исследования, например анализы гидролизатов или физиологических жидкостей, рекомендуется ограничиться использованием какого-либо одного оптимального метода. Литература по автоматическому аминокислотному анализу очень обширна, к настоящему времени описано значительное число различных методик. Не имеет смысла перечислять все эти методики, поэтому ниже будут приведены лишь те, которые по нашему мнению наиболее удобны (фиг. 36 и 37).
Общий анализ гидролизатов одноколоночным двухбуферным методом [2]
Высота столбика смолы в колонке |
55 см |
Буферный раствор 1 |
А |
Буферный раствор 2 |
Г или Д |
Скорость протекания буферного раствора |
100 мл/ч |
Скорость протекания нингидрина |
50 мл/ч |
Время замены буферного раствора |
90 мин |
Общая продолжительность анализа |
240 мин |
Давление буферного раствора при 55°С |
18—25 атМ |
Примечания. После элюирования аргинина колонку можно регенерировать без обработки щелочью, пропуская раствор А. Щелочная обработка необходима лишь после каждых 15 анализов.
Общий анализ гидролизатов белков одноколоночным трехбуферным методом [3]
Высота столбика смолы в колонке |
55 см |
Буферный раствор 1 |
А |
Буферный раствор 2 |
Д |
Буферный раствор 3 |
Е |
Первая смена буферного раствора |
90 мин |
Вторая смена буферного раствора |
На восходящей части пика аммиака |
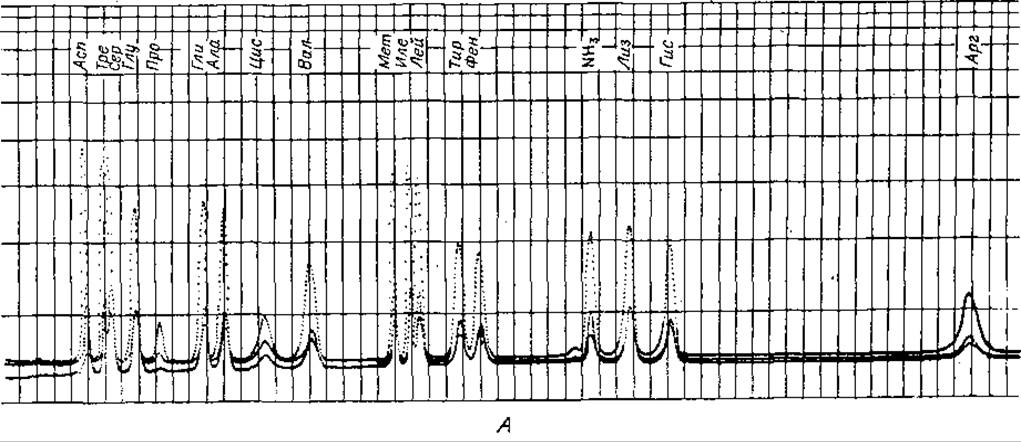
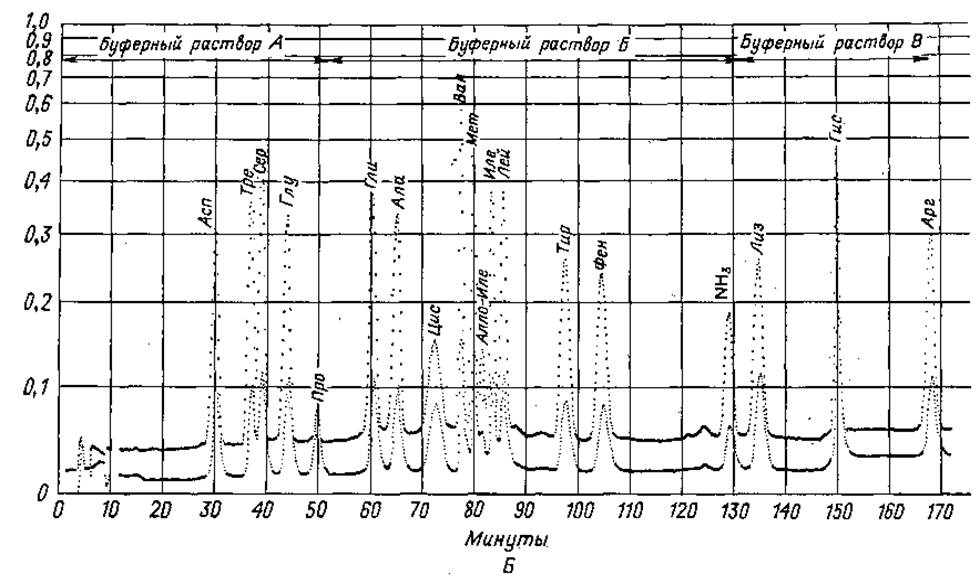
Фиг. 36. Количественное определение аминокислот на одной колонке. А. Двухбуферная система. Б. Трехбуфериная система.
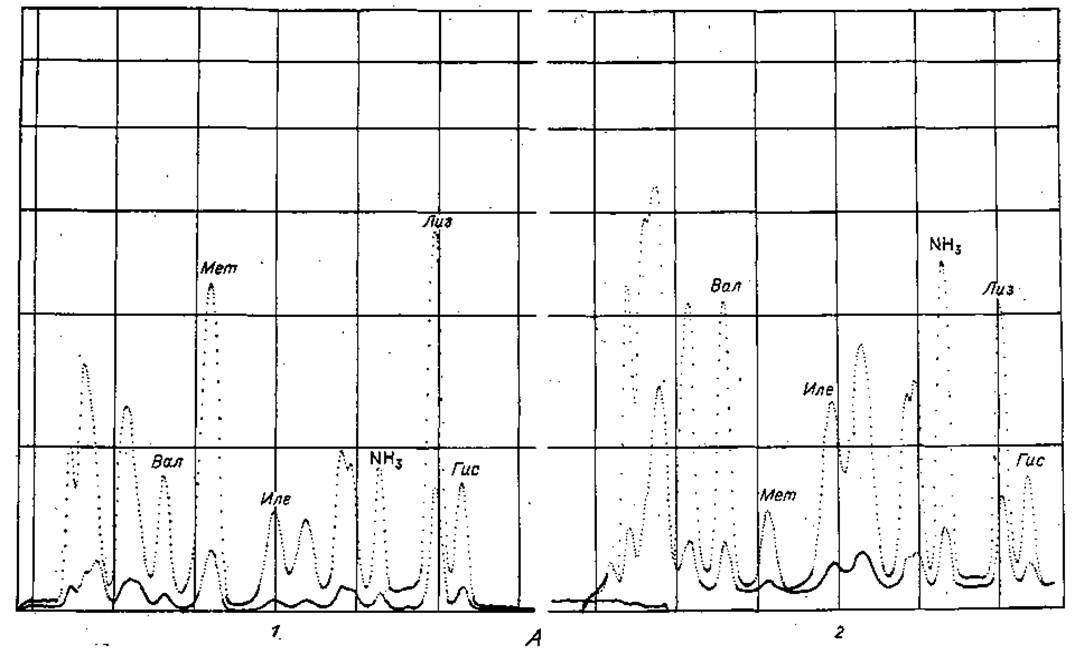
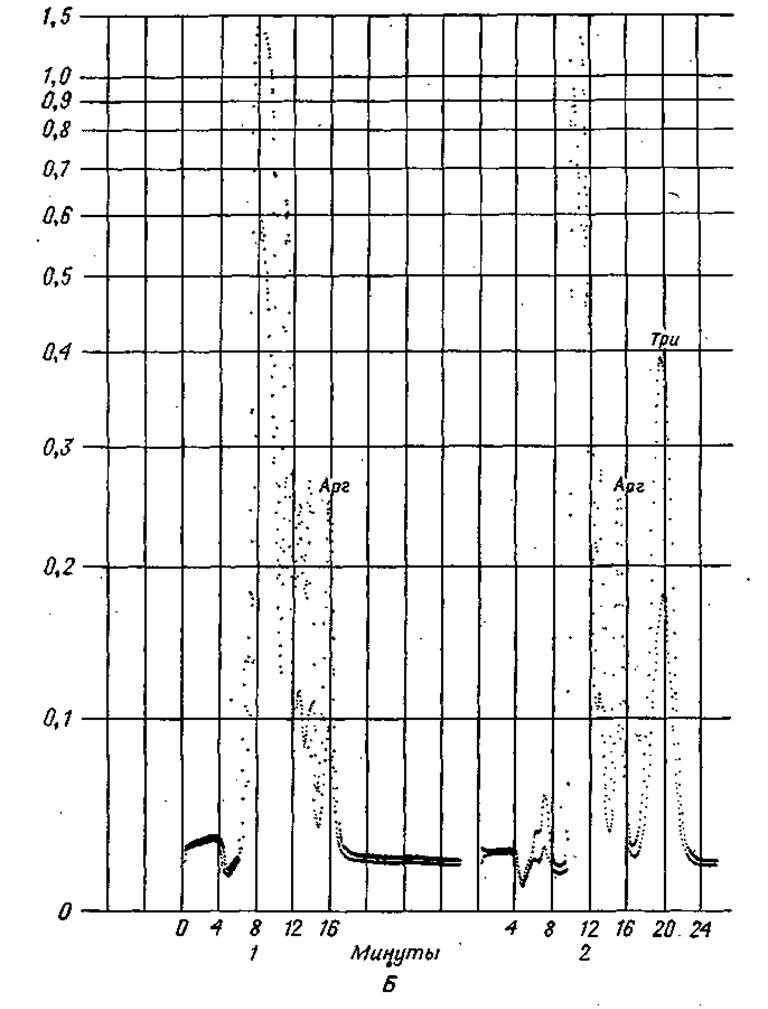
Фиг. 37. Хроматограммы, полученные при быстром программированном анализе аминокислот.
А. Определение Мет и Лиз. 1 — смесь, используемая для калибровки, содержащая 4-кратный избыток Мет и Лиз; 2 — кислотный гидролизат семян растений.
Б. Определение Трк. 1 — смесь, используемая для калибровки, не содержащая Трн; 2 — смесь, используемая для калибровки, содержащая 1 мк моль Три.
Скорость протекания буферного раствора |
100 мл/ч |
Скорость протекания нингидрина |
50 мл/ч |
Продолжительность анализа |
180—190 мин |
Давление буферного раствора-при 55°С |
30—35 атм для раствора А, 25—28 атм для раствора Д, 20—22 атм для раствора Е |
Примечания. В этом случае регенерация не обязательна. Обработку щелочью проводят способом, описанным выше.
При определении кислых и нейтральных аминокислот двухколоночным методом прибору задается такая же программа, как и при одноколоночном методе, но анализ останавливают после того, как выходит пик фенилаланина.
С растворами Г и Д такой анализ проводят в течение 2 ч. Если применяют классическую методику с использованием раствора Б, это время возрастает до 3 ч, поэтому последний вариант метода вряд ли оправдан.
После анализа колонку следует регенерировать 0,2 н. NaOH и отмыть стартовым буферным раствором (А).
Определение основных аминокислот на малой колонке [5]
Высота столбика смолы в колонке |
8—10 см |
Буферный раствор |
В |
Скорость протекания буферного раствора |
68 мл/ч |
Скорость протекания нингидрина |
34 мл/ч |
Давление буферного раствора при 55°С |
4—8 атм |
Продолжительность анализа |
около 80 мин |
Примечания. Продолжительность анализа зависит от высоты смолы в колонке. Регенерация необходима только после 10—15 анализов.
Быстрое определение метионина и лизина [4]
Высота смолы в колонке |
14 см |
Буферные растворы |
А и Г |
Скорость протекания буферного раствора |
100 мл/ч |
Скорость протекания нингидрина |
50 мл/ч |
Давление буферного раствора при 55°С |
8—12 атм |
Продолжительность анализа, включая регенерацию |
75 мин |
Программирование |
0—25 мин раствор А, 25—62 мин раствор Г, 62—63 мин 0,2 н. NaOH, 63—73 мин раствор А |
Примечания. Во многих случаях, прежде всего при селекции растений и оценке кормов, бывает достаточно определить содержание лишь метионина и лизина. Метод быстрого анализа позволяет выполнить целую серию ориентировочных опытов. На малой колонке в анализаторе с приведенной выше программой метионин выходит отдельным пиком между пиками валина и изолейцина, а пик лизина — между пиками аммиака и гистидина.
9. Оценка результатов. В инструкции к прибору обычно описано, как нужно производить оценку хроматограммы, поэтому мы не рассматриваем здесь этот вопрос.
10. Источники ошибок. Автоматический аминокислотный анализатор — довольно сложный прибор; при работе с ним следует иметь в виду, что возможны артефакты, обусловленные следующими причинами: а) механическими неполадками прибора, б) химическими факторами, в) неточностью в работе.
Очевидно, основные источники ошибок могут быть различными в разных лабораториях и для разных типов приборов, поэтому ниже мы обратим внимание лишь на ошибки более общего характера.
Наблюдаемые неполадки |
Возможная причина |
Пики Асп, Тре, Сер, Глу накладываются друг на друга |
Колонка неправильно уравновешена буфером слишком высокой концентрации). |
Пики Глу и Про перекрываются или меняются местами |
Нарушения в системе, поддерживающей температуру колонки, температура занижена. Повышенное давление на смолу буферного раствора. |
Асимметричные лики |
Загрязнение смолы тяжелыми металлами (смолу следует извлечь из колонки и промыть ЭДТА и кислотой). Размножение бактерий (необходима обработка горячей щелочью). Загрязнение белком (необходима обработка горячей щелочью). |
Нестабильная линия фона, “выбросы” на хроматограмме при каждой длине волны |
Пузырьки воздуха или плавающие частицы в проточной кювете (например, гранулы смолы). Не закреплены держатели кюветы в спектрофотометре. Неполадки в электронной схеме самописца (в усилителе). |
Периодические изменения (повышение и понижение) линии фона |
Нарушение работы насоса, утечка в кранах. |
Внезапное падение давления буферного раствора |
Нарушения в системе подачи буферного раствора: а) пузырьки воздуха в насосе, б) прокол в подающем шланге, в) утечка в клапане насоса, г) резиновые прокладки износились или повреждены. |
Внезапное падение давления раствора нингидрина |
Воздух в насосе, подающем нингидрин (нингидрин израсходован); прокол в соединительном шланге. |
Линии фона при длине волны 570 и 440 нм поменялись местами |
Изменилось соотношение элюат — нингидрин; один из насосов плохо работает. |
На самописце появляется прерывистая линия |
Плохие контакты в электронной системе ламп; окислились контакты микропереключателя самописца. |
Появление на хроматограмме необычного пика; чаще всего новые компоненты появляются перед аммиаком и аргинином |
Загрязнен буферный раствор для нанесения. |
Повышение линии фона между пиками аммиака и гистидина |
Аммиак в буферном растворе; загрязненная дистиллированная вода. |
Пики слишком низкие |
Обесцветился нингидрин (реокисление); “устарели” лампы; сильно загрязнена смола. |
Пики аммиака и лизина перекрываются |
Сильно загрязнена смола; испорчен клапан между сосудами с буферными растворами 2 и 3 |
Нет цветной реакции |
Неполадки в системе, обеспечивающей поддержание необходимой температуры реакционной смеси; нет нингидрина. |
Цитированная литература
1. Benson J. V., Gordon М. J., Patterson J. A., Anal. Biochem., 18, 228.(1967).
2. D ev enyi T., Acta Biochim. Biophys. Acad. Sсi. Hung., 3, 429 (1968).
3. D ev enyi T., Acta Biochim. Biophys. Acad. Sci. Hung., 4, 297 (1969).
4. D ev enyi T., Acta Biochim. Biophys. Acad. Sci. Hung., 6, 129 (1971).
5. Spackman D. H., Stein W. H., Moore S., Anal. Chem., 30, 1181 (1958).