Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Некоторые методологические вопросы аналитического исследования белков
Изучение нативных белков
Фракционирование белков с помощью гель-фильтрации
Разработанная Поратом и Флодиным в 1959 г. [15] гель-фильтрация явилась большим достижением в развитии фракционирования белков по молекулярному весу. Материал, используемый в этом методе в качестве неподвижной фазы, носит фирменное название сефадекс и представляет собой нерастворимый в воде высокогидрофильный декстран с поперечными сшивками, имеющий пористую структуру. Благодаря многочисленным гидрофильным группам он способен разбухать в воде и водных растворах солей, образуя гель, который может выполнять роль молекулярного сита при разделении веществ разного молекулярного веса. Размер пор этого сита определяется частотой поперечных сшивок в декстране. Чем ближе друг к другу расположены поперечные сшивки, тем плотнее пространственный каркас геля и соответственно меньше способность сефадекса связывать воду.
Если раствор, содержащий вещества различного молекулярного веса, пропустить через колонку, заполненную гелем сефадекса, то более мелкие молекулы проникнут во внутреннюю часть гель-образующих гранул и в результате их миграция через колонку будет замедлена. В то же время вещества большего молекулярного веса не проникают внутрь гранул геля и мигрируют быстрее мелких молекул. Разные скорости миграции приводят к разделению веществ при их прохождении через “молекулярные сита”.
Фирма Pharmacia (Швеция) выпускает 18 типов сефадексов (без ионообменных свойств), которые отличаются друг от друга частотой поперечных сшивок. Важнейшие свойства сефадексов приведены в табл. 2. Символ, указывающий тип сефадекса (G-25, G-50 и т. д.), обозначает пористую структуру (G) и величину поглощения воды на грамм сухого веса сефадекса, т. е. указывает частоту поперечных сшивок декстрана. У сефадексов с высоким значением индекса цифра указывает нижний предел молекулярного веса веществ (в тысячах), не проникающих внутрь гранул геля. Например, вещества с молекулярным весом меньше.100 000 могут проникать внутрь гранул сефадекса G-100, тогда как вещества с более крупными молекулами выходят в свободном объеме раствора.
Благодаря перечисленным выше свойствам сефадексы интенсивно используются при изучении структуры белков. Чаще всего их применяют для разделения белков в зависимости от молекулярного веса, для очистки белковых фракций, для концентрирования разбавленных растворов белка и для обессоливания белковых препаратов.
Гель-фильтрация все шире используется для фракционирования белков сыворотки. Наиболее подходящим в данном случае является сефадекс G-200. С колонки этого геля белки сыворотки элюируются тремя пиками. Первый пик соответствует в основном липопротеидам и макроглобулинам, вторым пиком выходит IgG, в третьем пике содержатся главным образом альбумин и трансферрин. В принципе гель-фильтрацию на G-200 можно использовать и для выделения иммуноглобулинов.
Таблица 2 Типы сефадексов
Тип |
Размер частиц, мкм |
Поглощение воды, мл/г сухого геля |
Объем набухшего геля, мл/г сухого геля |
Область разделения по молекулярному весу |
G-10 |
40—120 |
1,0 ± 0,1 |
2—3 |
—700 |
G-15 |
40—120 |
1,5 ± 0,2 |
2,5—3,5 |
— 1 500 |
G-25 крупнозернистый |
100—300 |
2,5 ± 0,2 |
4—6 |
1000—5 000 |
G-25 среднезернистый |
50—150 |
2,5 ± 0,2 |
4—6 |
1000—5 000 |
G-25 мелкозернистый |
20—80 |
2,5 ± 0,2 |
4—6 |
1000—5 000 |
G-25 сверхмелкий |
10—40 |
2,5 ± 0,2 |
4—6 |
1000—5000 |
G-50 крупнозернистый |
100—300 |
5,0 ± 0,3 |
9—11 |
1500—30 000 |
G-50 среднезернистый |
50—150 |
5,0 ± 0,3 |
9—11 |
1500—30 000 |
G-50 мелкозернистый |
20—80 |
5,0 ± 0,3 |
9—11 |
1500—30 000 |
G-50 сверхмелкий |
10—40 |
5,0 ± 0,3 |
9-11 |
1500—30 000 |
G-75 |
40—120 |
7,5 ± 0,5 |
12—15 |
3000—70 000 |
G-75 сверхмелкий |
10—40 |
7,5 ± 0,5 |
12—15 |
3000—70 000 |
G-100 |
40—120 |
10,0 ± 1,0 |
15—20 |
4000—150 000 |
G-100 сверхмелкий |
10—40 |
10,0 ± 1,0 |
15—20 |
4000—150 000 |
G-150 |
40—120 |
15,0 ± 1,5 |
20—30 |
5000—400 000 |
G-150 сверхмелкий |
10—40 |
15,0 ± 1,5 |
20—30 |
5000—400 000 |
G-200 |
40—120 |
20,0 ± 2,0 |
30—40 |
5000—800 000 |
G-200 сверхмелкий |
10—40 |
20,0 ± 2,0 |
30—40 |
5000—800 000 |
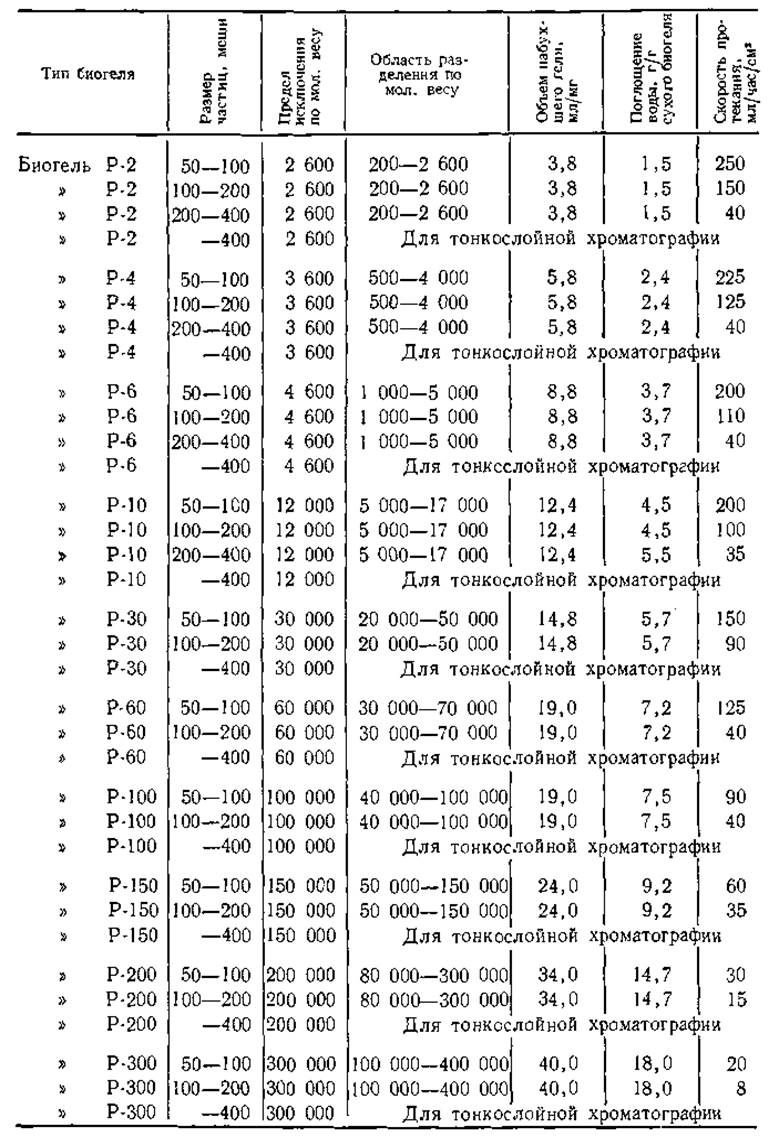
С 1962 г. в хроматографии стали применять полиакриламидные гели [5,81. Фирма Bio-Rad Laboratories выпускает более 30 гелей для хроматографии под коммерческим названием биогели (табл. 3). Сухие биогели, подобно сефадексам, набухают в воде и имеют такие же свойства в диапазоне pH от 2 до 11. Первое сообщение о гель-хроматографии в агаре в 1961 г. сделал Полсон [14]. Главной особенностью гелей агара и агарозы является пригодность для фракционирования веществ с большим молекулярным весом, которые не удается разделить на сефадексе G-200 или биогеле Р-300.
Агар и агароза при нагревании становятся жидкими. В связи с этим их гели при температуре выше 50° С теряют стабильность. Их нельзя использовать при pH ниже 4,5 и выше 9,0; поэтому при работе с этими гелями крайне важно соблюдать указания изготовителя относительно температуры и величины pH. В продаже имеются следующие гели агарозы: сагавак (фирма Seravac Laboratories, сефароза (фирма Pharmacia Fine Chemicals), гелароза (фирма Litex) и биогель А (фирма Bio-Rad Laboratories).
Таблица 3 Типы биогелей