Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Некоторые методологические вопросы аналитического исследования белков
Изучение нативных белков
Мембранная фильтрация
Мембранная фильтрация, или как ее еще называют — ультрафильтрация или молекулярная фильтрация, представляет собой процесс разделения веществ с помощью мембран, имеющих определенную величину пор. За последние годы мембранная фильтрация получила широкое распространение в связи с производством большого набора разных типов мембран и специального оборудования. Мембранная фильтрация используется как быстрый и мягкий способ удаления растворителя из раствора макромолекул или же замены одного растворителя другим. Чаще всего с задачами такого рода сталкиваются при обессоливании раствора макромолекул или же при его концентрировании. Другой важной задачей, которую можно решить с помощью мембранной фильтрации, является разделение двух или большего числа компонентов, отличающихся размерами своих молекул. Наконец, молекулярная фильтрация позволяет изучать связывание макромолекулами низкомолекулярных соединений.
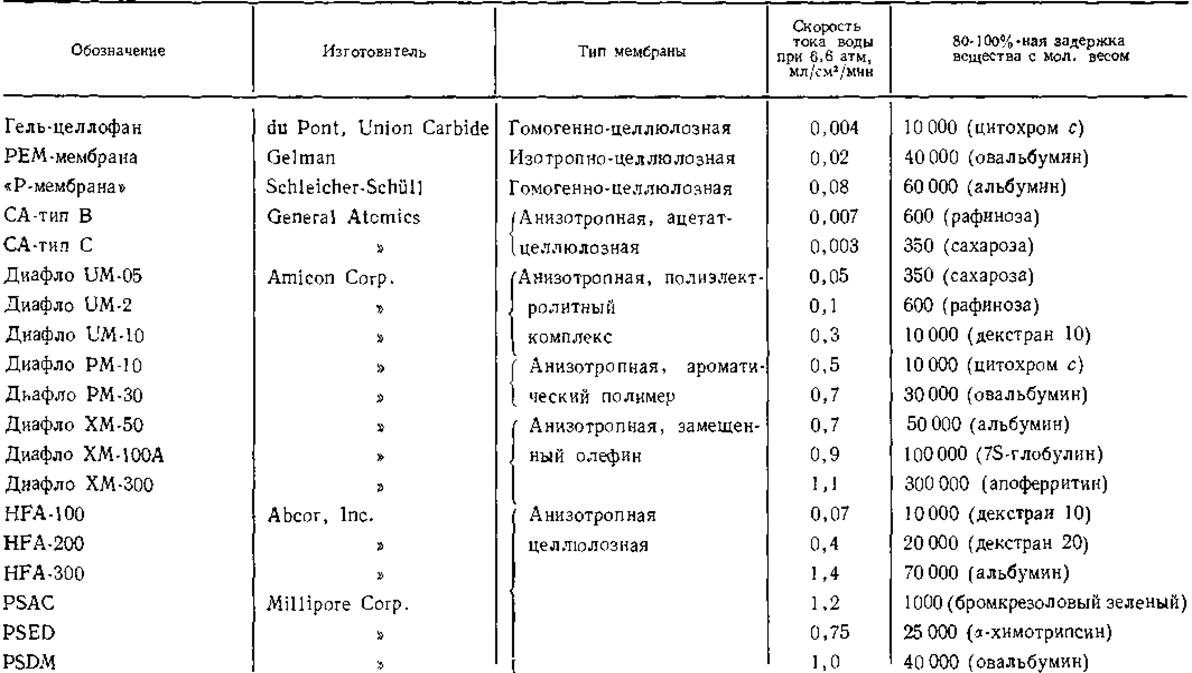
В обзоре Блатта перечислены следующие основные требования, которые предъявляются к мембранам: они должны обладать определенными размерами пор, пропускать раствор с достаточно высокой скоростью и иметь минимальную адсорбирующую способность. В настоящее время ряд фирм выпускает мембраны для фильтрации, в большей или меньшей степени удовлетворяющие этим требованиям (табл. 4). Наибольшее распространение получили анизотропные мембраны, состоящие из плотной, очень тонкой пленки-мембраны с избирательной проницаемостью, которая прикреплена к пористой подложке. В табл. 4 указана величина молекулярного веса веществ, задерживаемых мембраной, но в действительности мембраны задерживают не 100% соответствующих макромолекул, а несколько меньше. Отсюда следует, что для более полной задержки следует брать мембрану с меньшими, чем указано в таблице, величинами пор. Например, для альбумина (мол. вес 67 000) лучше использовать РМ-30, чем ХМ-50. Следует также помнить, что способность проходить через мембрану зависит не только от молекулярного веса, но и от формы молекулы и ее гибкости. Кроме приведенных в табл. 4, следует упомянуть и о выпускаемых фирмой Sartorius (ФРГ) изотропных ультрафильтрах, изготовленных из регенерированной целлюлозы (серия SM 115, величина пор у разных фильтров серии 150—5 нм), ацетата целлюлозы (серия SM 117, величина пор 35—5 нм) и нитрата целлюлозы (серия SM 121, величина пор 15—5 нм).
1 Данный раздел написан Р. С. Незлиным и включен в главу по согласованию с авторами. — Прим. ред.
Таблица 4 Мембраны для ультрафильтрации (Blatt, 1971)
Одной из важных проблем мембранной фильтрации является возникновение градиента концентрации: у самой поверхности мембраны концентрация макромолекул становится столь высока, что может препятствовать ультрафильтрации. Особенно это заметно при работе с высокомолекулярными белками. Для получения хороших результатов при мембранной фильтрации очень существенную роль играет выбор оборудования.
Весьма просты в работе имеющиеся в продаже сосудики для фильтрации под давлением с постоянным перемешиванием жидкости вблизи мембраны (stirred cells). Получили широкое распространение удобные и надежные в работе такого рода ячейки, выпускаемые фирмой Amicon (США) нескольких размеров — на 10, 60, 200, 400 и 2000 мл. Сделаны они из материалов, обладающих малой адсорбирующей способностью, легко собираются и при аккуратном пользовании весьма долговечны. Мембраны фирмы Amicon, обладающие большой избирательностью, можно использовать многократно, если же ток жидкости через них постепенно замедляется, обработка разбавленными растворами протеаз (например, трипсина) вновь восстанавливает их фильтрующую способность. Давление газа (например, азота), равное 2—3 атм, как правило, обеспечивает достаточно быстрое вытекание жидкости. Сосудики можно поставить в ледяную баню; на холоду, однако, фильтрация идет в 2 раза медленнее.
Недостаток сосудиков с перемешиванием заключается в том, что с ними довольно трудно работать тогда, когда мы имеем дело с концентрированными белковыми растворами. Другие, более сложные системы оказываются пригодными и в этих случаях, причем они обладают большей скоростью фильтрации. К ним относятся приборы с системой тонких канальцев над мембраной (thin-channel system) и приборы с системой полых волокон (микротубулярных мембран) с диаметром отверстий 0,2—0,5 мм (hollow-fiber system). Высокая скорость тока жидкости в канальцах предотвращает возникновение градиента концентрации у стенок. При увеличении площади фильтрации скорость вытекания резко возрастает, но одновременно увеличивается неспецифическая сорбция белков, и в связи с этим при работе с разведенными растворами наблюдаются большие потери. В продаже имеются микротубулярные мембраны фирмы Amicon (США), зедерживающие белки с молекулярным весом 10 000 (РМ) и 50 000 (ХМ) и мембраны фирмы Bio-Rad (США), задерживающие белки с молекулярным весом 100 000 (Био-Файбер 80), 30 000 (Био-Файбер 50) и 5000 (Био-Файбер 20).
В последнее время начали выпускаться также очень простые системы для однократного концентрирования небольших по объему образцов, так называемые сосудики Миникон (Amicon, США). Это плоские конусовидные сосудики с одной стороной-мембраной, к которой с внешней стороны прилегает слой, адсорбирующий жидкость. Нижняя остроконечная часть сосудика лишена мембраны, здесь накапливается сконцентрированная жидкость. Для такого типа сосудиков не требуется никакого дополнительного оборудования (мешалки, баллона с газом) и поэтому они особенно удобны в клинических лабораториях для быстрого концентрирования образцов мочи, спинномозговой жидкости или других белковых растворов с целью их последующего исследования электрофоретичесским или иным методом. В продаже имеются следующие типы сосудиков Миникон, перечисленные в табл. 5.
Таблица 5
Тип |
Способность к концентрированию, раз |
Задерживаются белки с мол. весом |
B-15 |
100 |
15 000 |
A-25 |
20 |
25 000 |
S125 |
4 |
125 000 |
A-75 |
20 |
75 000 |
Цитированная литература
1. Aronsson Т., Grönwall A., Scand. J. Сlin. Lab. Invest., 9, 338 (1957).
2. Davis В. J., Ann. N. Y. Acad. Sci. U. S., 121, 404 (1964).
3. Finger I., Kabat E. A., J. Exp. Med., 108, 453 (1958).
4. Grabar P., Williams C. A., Biochim. Biophys. Acta., 17, 67 (1955).
5. Hjerten S., Mosbach Z., Anal. Biochem., 3, 109 (1962).
6. Kohn J., Protides of Biol. Fluids, Elsevier Publ. Co, Amsterdam, p. 120, 1958.
7. Kohn J., Nature, 183, 1512 (1959).
8. Lea D. J., Shon A. H., J. Chromatogr., 40, 159 (1962).
9. Ornstein L., Ann. N. Y., Acad. Sci. U. S., 121, 321 (1964).
10. Osserman E. P., J. Immunol., 84, 93 (1960).
11. Ouchterlony O., Acta Path. Microbiol. Scand., 25, 186 (1948).
12. Ouchterlony O., Acta Path. Microbiol. Scand., 26, 50 (1949).
13. Ouchterlony O., Acta Path. Microbiol. Scand., 32, 231 (1953).
14. Poison A., Biochim. Biophys. Acta, 50, 565 (1961).
15. Porath J., Flodin P., Nature, 183, 1657 (1959).
16. Scheidegger J. J., Int. Arch. Allergy, 7, 103 (1955).
17. Scheurlen P. G., Z. Naturforsch., 176, 598 (1962).
18. Sober H. A., Peterson E. A., J. Am. Chem. Soc., 78, 751 (1956).
Рекомендуемая литература
Blatt W. F., Methods in Enzymol., vol. XXII, Academic Press, New York, London, p. 39 (1971).
Clausen J., Immunochemical Techniques for the Identification and Estimation of Macromolecules, North Holland Publishing Company, Amsterdam, London, 1969.
Fischer L., Introduction to Gel Chromatography, North Holland Publishing Company, Amsterdam, London, 1969.
Freedman S. О., Chinical Immunology, Harper-Row, New York, 1971.
Gordon A. H., Electrophoresis of Proteins in Polyacrylamide and Starch Gels, North Holland Publishing Company, Amsterdam, London, 1969.
Kabał E. A. Einführung in die Immunochemie, Springer Verlag, 1971.
Leach S. J. ed., Physical Principles and Techniques of Protein Chemistry, Academic Press, New York, London, 1969.
Maurer H. R., Disc Electrophoresis and Related Techniques of Polyacrylamide Gel Electrophoresis, Walter de Gruyter Berlin, New York, 1971.
Mollison P. L., Blood Transfusion in Clinical Medicine, Blackwell Scientific Publications, Oxford, London, Edinburgh, Melbourne, 1972.
Schultze H. E., Heremans J. E., Molecular Biology of Human Proteins, Vol.
I, Elsevier Publishing Company, Amsterdam, London, New York, 1966. Weir D. M., Handbook of Experimental Immunology, Blackwell Scientific Publications, Oxford, London, Edinburgh, Melbourne, 1973.
Williams C. A., Chase M. W., Methods in Immunology and Immunochemistry, vols. II—III, Academic Press, New York, London, 1968, 1971.