Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Анализ концевых групп и ступенчатая деградация белков и пептидов
Определение N-концевых групп 2,4-динитрофторбензольным методом
После классической работы Сэнгера [17] 2,4-динитрофторбен- зольный метод стал одним из наиболее важных в белковой химии. Метод основан на следующих реакциях:
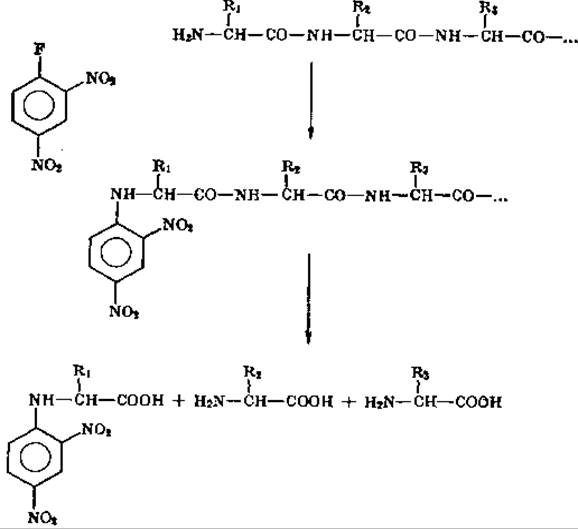
Реакции идут в слабощелочной среде: в присутствии NaHCО3 2,4-динитрофторбензол (ДНФБ) связывается со свободными NH2-группами пептидной цепи. В результате гидролиза динитрофенилированного белка (ДНФ-белка) 20%-ной НСl, кроме свободных аминокислот, образуются ДНФ-аминокислоты, имеющие желтую окраску. ДНФ-аминокислоты, соответствующие N-концевому остатку белка (или пептида), имеют замену по а-углеродному атому. Другие ДНФ-производные аминокислот (ε-NH 2-ДНФ-Лиз, O-ДНФ-Тир) обычно являются производными не концевых аминокислот, а остатков, расположенных внутри цепи! Таким образом, количественно определяя и идентифицируя а-ДНФ-аминокислоты, мы получаем данные относительно N-концевых аминокислот, которые позволяют рассчитать число пептидных цепей у изучаемого белка.
ДНФБ — высокореакционноспособное соединение, количественно реагирующее с белками в мягких условиях без побочного расщепления пептидных связей. Поэтому можно не опасаться, что в ходе анализа в результате расщепления пептидных связей появятся “новые” концевые группы.
ДНФ-производные, за исключением некоторых, образующихся при реакции с остатками, расположенными внутри цепи, имеют желтую окраску, что облегчает их идентификацию и определение. Это чувствительные к свету соединения, поэтому эксперименты должны проводиться в темноте или по крайней мере следует избегать дневного освещения и использовать искусственное.
Анализ состоит из следующих стадий: 1) динитрофенилирование, 2) удаление избытка реагента, 3) гидролиз ДНФ-производного, 4) растворение ДНФ-аминокислот.