Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Первичная структура белковой молекулы
Определение числа полипептидных цепей. Разделение цепей
Белки с большим молекулярным весом обычно состоят из нескольких полипептидных цепей. Каждая цепь в общем случае имеет одну свободную а-аминогруппу на N-терминальном конце и одну а-карбоксильную группу на С-терминальном конце. Однако некоторые белки являются исключением из этого правила — их а-аминогруппа находится в замаскированном состоянии, будучи замещена ацетильным или другим радикалом. Так, например, в белке вируса табачной мозаики (ВТМ) N-концевой участок полипептида представлен остатком N-ацетилсерин-тирозин. В этом случае для определения a-NH2-гpyпп следует провести предварительно реакцию деацетилирования. Число а-аминогрупп в молекуле белка, так же как и число а-карбоксильных групп указывает непосредственно на количество полипептидных цепей, присутствующих в молекуле данного белка. Таким образом, число полипептидных цепей может быть установлено путем определения числа N-концевых или С-концевых групп.
Как уже говорилось (гл. III), методом определения N-концевых аминокислот может быть динитрофторбензольный метод Сэнджера. После динитрофенилирования и гидролиза динитрофенилпроизводного белка (ДНФ-производное), продукты реакции — ДНФ-аминокислоты — сорбируют при pH 7—6 на анионообменной смоле, тогда как свободные аминокислоты остаются в растворе. Это обусловлено тем, что ДНФ-аминокислоты при этом pH являются анионами, тогда как свободные аминокислоты — цвиттерионами или катионами, не сорбируемыми анионитом. Окрашенные производные элюируют затем со смолы кислотой, разделяют при помощи двумерной бумажной хроматографии, идентифицируют с помощью соответствующих свидетелей и рассчитывают количество молей ДПФ-аминокислот на 1 моль белка. Это позволяет найти число свободных N-терминальных групп и, следовательно, число полипептидных цепей в белке. N-концевые аминокистоты могут быть определены и в виде фенилтиогидаптоиновых производных или свободных кислот из них по методу Эдмана. Наконец, С-концевые аминокислоты можно определить гидразинолизом или карбоксинептидазным методом. Определение числа С-концевых групп обычно применяют тогда, когда а-амипогруппа, как в белке ВТМ, замещена каким-либо радикалом. В этом случае о числе полипептидных цепей приходится судить по количеству а-карбоксильных групп белковой молекулы, что является менее надежным (см. гл. III).
Полипептидные цепи связаны в молекуле белка с помощью различного рода поперечных связей. Из них наиболее важной является связь, включающая аминокислоту цистин — продукт окисления цистеина. Эта аминокислота занимает в структуре белка особое положение. Как будет показано ниже (гл. V), боковые радикалы цистеина могут быть соединены путем окисления с образованием цистина, при этом возникающий цистиновый мостик может «сшивать» как две разные полипептидные цепи, так и различные участки одной цепи. Наличие таких сшивок делает невозможным разъединение цепей и последующее изучение чередования аминокислот в них. Поэтому необходимо разрушить дисульфидные мостики и разделить освобождающиеся цепи. Лучше всего это можно сделать с помощью сильного окислителя — надмуравьиной (пермуравьиной) кислоты, которая не разрывает пептидную связь и мало повреждает аминокислоты. При этом цистиновый мостик окисляется до двух молекул цистеиновой кислоты, и на полипептидных цепях появляются сильно кислые группы SО3H:
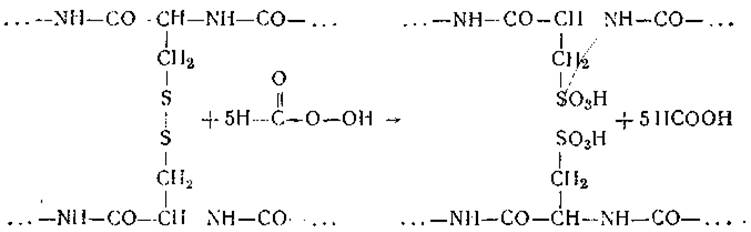
Разъединенные полипептидные цепи могут быть разделены методом ионообменной хроматографии. Как уже говорилось выше, лучше использовать ионообменники на целлюлозной основе, которые обладают большой емкостью по отношению к полипептидам, отсутствием необратимой сорбции и т. д. С помощью этого приема были, например, расфракционированы и получены в чистом виде две цепи инсулина и две субъединицы гемоглобина. В последнем случае разделение велось па карбоксиметил-целлюлозе при градиентной элюции буфером пиридин — муравьиная кислота (pH 2,0). Получаемые субъединицы разделяли на отдельные цепи в щелочной среде.