Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Первичная структура белковой молекулы
Определение числа и местоположения дисульфидных связей
Данных по аминокислотной последовательности каждой полипептидной цепи белка еще не достаточно для установления его первичной структуры. Необходимо определить число и местоположение дисульфидных мостиков, связывающих эти цепи в единое целое. Разрешение этой задачи требует очень мягких условий гидролиза, ибо воздействие таких реагентов, как концентрированная соляная кислота приводит к окислению цистина до цистеиновой кислоты и ряда других продуктов. Поэтому белок подвергают энзиматическому гидролизу в возможно более мягких условиях и в присутствии тиоловых ингибиторов (например, N-этил.малеинимида). Часто для этой цели используют пепсин и химотрипсин, и расщепление ведут при pH 1,9 и 8,0 соответственно. Полученную смесь пептидов подвергают разделению с помощью одного или нескольких перечисленных выше приемов, и фрагменты, содержащие дисульфидную связь, выделяют в чистом виде и окисляют надмуравьиной кислотой. После этого с помощью высоковольтного электрофореза на бумаге получают пептиды, содержащие цистеиновую кислоту. Эти пептиды подвергают полному кислотному гидролизу и идентифицируют по аминокислотному составу.
Таким путем в молекуле инсулина были найдены следующие дисульфидные связи и соединяемые этими связями пептиды:
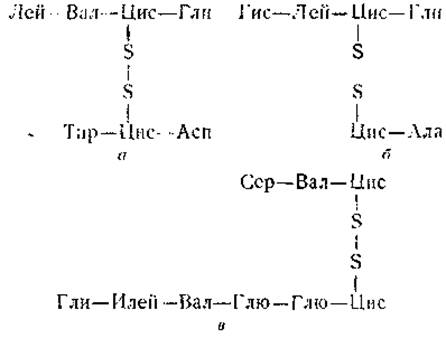
При сравнении строения этих пептидов с известной последовательностью аминокислот в А- и В-цепях инсулина (см. рис. 13 и 14) видно, что мостик а соединяет аминокислоту № 19 цепи В с аминокислотой № 20 цепи А. Цистиновый мостик б соединяет аминокислоты № 7 обеих цепей, тогда как мостик в образует дисульфидную петлю между 6-й и 11-й аминокислотами цепи А.
Знание последовательности аминокислотных остатков в пептидных цепях, а также числа и местоположения дисульфидных мостиков позволяют воспроизвести первичную структуру белковой молекулы в целом. Впервые подобного рода расшифровка была завершена для молекулы инсулина Сэнджером к 1955 г. (рис. 15).
Указанный выше порядок проведения исследования не является обязательным; существуют различные его модификации, зависящие от характера исследуемого белка. Из всего вышеизложенного видно, что несмотря на применение современных методов анализа во всей их совокупности и разнообразии, исследование химической структуры белков является очень сложным и трудоемким делом, отнимающим годы напряженного труда. Так, для анализа структуры химотрипсина, состоящего из 226 аминокислот, расположенных в одной цепи, потребовалось около 10 лет работы нескольких крупных лабораторий.
В настоящее время первичная структура известна для ограниченного числа белков, а именно для инсулина, адренокортикотропина, рибонуклеазы, ВТМ, химотрипсина, трипсина, цитохрома С, гемоглобина, миоглобина и лизоцима.