Химия белка - Часть 2 - Избранные разделы частной химии белка - Ашмарин И. П 1968
Гистоны
Взаимодействие гистонов и ДНК
В настоящее время хорошо известно, что гистоны содержатся только в ядрах дифференцированных клеток, где основная их масса локализована в хроматине. Различными цитохимическими приемами показано, что между ДНК хроматина и гистонами существуют тесные пространственные соотношения: во всех участках хромосом, характеризующихся высоким содержанием ДНК, обнаружена и высокая концентрация гистонов. Анализ изолированного хроматина показывает, что гистоны и ДНК содержатся в нем в примерно равном весовом количестве. При измельчении хроматина в 4M растворе хлористого цезия и последующем центрифугировании происходит отделение гистонов от ДНК, и структура хромосом полностью разрушается. Если хроматин подвергнуть кратковременной гомогенизации в среде с низкой ионной силой (0,01 М трис-буфер, pH 8), интенсивному перемешиванию и центрифугированию при 10 000хg, то в раствор переходит 70—80% ДНК хроматина. Эта ДНК полностью связана с гистоном (соотношение массы гистона к массе ДНК равно приблизительно 1,35), вследствие чего препарат получил название растворимого нуклеогистона. Растворимый нуклеогистон состоит из отдельных частиц ДНП, молекулярный вес которых равен примерно 19∙106, длина 4200 Å. Поскольку соответствующие величины для свободной ДНК, составляли 8∙106 и 7100 Å, то был сделан вывод о том, что цепь ДНК в нуклеогистоне свернута и укорочена. Вторая особенность нуклеогистона это то, что содержащийся в нем гистон стабилизирует ДНК, повышая ее температуру плавления (Тпл).* Так, Тпл ДНК из проростков гороха в 0,16 М хлористом натрии равна 70° С. Когда же ДНК находится в комплексе с гистоном (нуклеогистон), то ее Тпг становится равной 84° С (рис. 18). Нуклеогистон, как и хроматин, распадается на ДНК и гистон в среде с высокой ионной силой (1,5—2,0 М растворе хлористого натрия).
Таким образом, все эти данные говорят о том, что гистоны играют важную структурную роль в хроматине, где они связаны с молекулами ДНК. Эта связь осуществляется за счет электростатического взаимодействия фосфатных групп ДНК с основными группами гистонов и приводит к стабилизации и изменению конформации молекулы ДНК в образующемся ДНП-комплексе.
* Азотистые основания в ДНК уложены наподобие стопки монет Благодаря п—п взаимодействиям между ними такая система поглощает ультрафиолетовый свет слабее, чем соответствующее количество свободных нуклеотидов (гипохромный эффект). Если раствор ДНК постепенно нагревать, то в конце концов будет достигнута температура, при которой разрываются водородные связи, исчезает взаимодействие основании, и двуцепочечная структура ДНК разрушается. Поглощение света системой возрастает до уровня, характерного для эквивалентного количества свободных оснований (гиперхромный эффект). Плавление ДНК происходит в некотором температурном диапазоне. Этот диапазон характеризуют температурой плавления (Тпл), при которой проявляется 1/2 полной гиперхромности
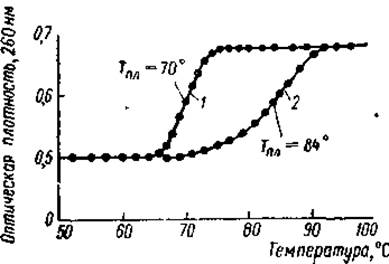
Рис. 18. Кривые плавления ДНК зародышей гороха в свободном состоянии (1) и в форме нативного нуклеогистона (2) (Боннер, 1967).
Какова же структура этого комплекса?
Для ответа на этот вопрос необходимо прежде всего коснуться специфичности взаимодействия отдельных фракций гистонов с ДНК. Работами Джонса и Батлера было показано, что любая из основных фракций гистонов способна вступать в соединение со всей ДНК, переводя ее при этом в осадок. Гистоны, богатые лизином, могли осадить в 0,14М растворе хлористого натрия вдвое больше ДНК, чем остальные фракции, между которыми было обнаружено мало различий в этом отношении (рис. 19). Каких-либо специфических взаимодействий, которые бы обусловливали ассоциацию той или иной фракции гистонов с определенной частью ДНК, при этом не наблюдалось. Вместе с тем эти и последующие эксперименты показали, что взаимодействие ДНК и гистонов зависит от концентрации последних и ионной силы среды. Оказалось, что лизинбогатые гистоны не способны осадить всю ДНК из водного раствора даже при отношении гистон/ДНК, равным 1,6. Если же взаимодействие протекало в 0,14 М хлористом натрии, то полное осаждение ДНК наблюдалось при соотношении белок/ДНК, равном 0,8.
С другой стороны, понижение ионной силы почти в 7 раз (0,02 М NaCl) не влияло существенно на осаждение ДНК лизинбогатыми гистонами, если концентрация их была достаточно высока (белок/ДНК = 1,6). Для аргининбогатых гистонов степень осаждения ДНК заметно снижалась с уменьшением ионной силы даже при высокой концентрации белка в растворе.
Эти различия в зависимости между степенью осаждения ДНК, ионной силой раствора и концентрацией в нем белка для лизинбогатых и аргининбогатых гистонов обусловлены неодинаковым числом и характером поперечных связей в образующихся комплексах. Выше уже говорилось, что примерно 75% всех аминокислотных остатков лизинбогатых гистонов нe являются основными. С другой стороны, 3/4 всех основных остатков группируются в С-терминальной половине молекулы этих белков, образуя последовательности из двух, трех и более лизиновых остатков. В NН2-половине молекулы содержится много неполярных и основная масса дикарбоновых аминокислот, которые также группируются в пачки Поэтому основные группы карбоксилтерминальной половины молекулы могут, по-видимому, последовательно нейтрализовать фосфатные группы ДНК, а сама молекула лизинбогатых гистонов располагается, очевидно, внутри ее большого жёлоба. Если принять молекулярный вес фракции f1 равным 22 000, то молекула лизинбогатых гистонов будет содержать около 60 основных аминокислот, что достаточно для последовательной нейтрализации фосфатных групп примерно 30 нуклеотидных пар, или в трех оборотах спирали ДНК При этом 75% аминокислотных остатков фракции f1 не принимают, вероятно, никакого участия в этом взаимодействии, а расположение этой части молекулы белка относительно ДНК зависит от ряда факторов.
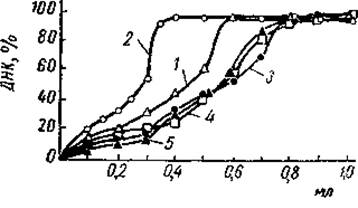
Рис. 19. Кривые осаждения ДИК из растворов суммарным аппаратом гистонов тимуса теленка и отдельными гистоновыми фракциями (Johns а. Butler, 1964)
По оси ординат отложена доля ДНК, выпавшей в осадок, по оси абсцисс отложен объем растворов гистонов, добавленных к 5 мл раствора ДНК. 1 — цельный гистон, 2 — фракция f1, 3 — фракция f2а, 4 — фракция f2b; 5 — фракция f3.
Так, при относительно низкой концентрации белка и ионной силе вся молекула лизинбогатых гистонов, по-видимому, располагается в большом жёлобе ДНК, занимая примерно 12 оборотов двойной спирали. При этом 75% фосфатных групп такого «прикрытого» участка ДНК доступны для других поликатионов. Молекулы И при этом имеют вытянутую конфигурацию и разделены свободными участками ДНК. С увеличением концентрации гистона в глубокой борозде молекулы ДНК остается лишь С-терминальная часть молекулы белка, тогда как 75% остальных остатков выдаются из нее в виде петель и «хвостов». Подобного рода выступы были обнаружены при электронномикроскопическом анализе фибрилл ДНП, из которых были удалены все гистоны, за исключением f1. Эти петли и выступы способны взаимодействовать с другими белками ДНП, и, вероятно, друг с другом, изменяя свою конфигурацию и связывая молекулы ДНК в нерастворимый комплекс.
Природа этого связывания неясна до настоящего времени Многие авторы полагают, что эти петли образуют белковые мостики между частицами ДНП. С другой стороны, имеются данные о том, что образование нерастворимых комплексов ДНП обусловлено нековалентными взаимодействиями (водородные, гидрофобные, электростатические) между такими выступами Растворение ДНП в 4M мочевине и зависимость между степенью осаждения ДНК и ионной силой раствора и концентрацией в нем гистона f1 служит веским подтверждением этого предположения. По-видимому, неосаждение комплекса ДНК-гистон f1 даже при высокой концентрации последнего, но при низкой ионной силе связано с электростатическим отталкиванием частиц ДНП вследствие наличия большого числа петель с одноименно заряженными карбоксильными группами. С другой стороны, осаждение растворимого комплекса при повышении ионной силы можно, очевидно, объяснить экранизацией части этих группировок, равно как и свободных фосфатных групп ДНК.
Для аргининбогатых гистонов также характерна группировка 3/5 основных остатков в NH2-терминальной половине молекулы. тогда как все ароматические аминокислоты, основная масса неполярных и около 50% кислых остатков собраны в С-терминальной половине. Однако молекула аргининбогатыx гистонов намного компактнее молекулы f1, поскольку она содержит значительное число спиральных сегментов. В ниx, как уже говорилось выше, содержится много основных, дикарбоновых и неполярных остатков. В таких участках на один оборот а-спирали будет приходиться в среднем по одной выступающей основной группе, и расстояния между ними будут сравнительно невелики. Благодаря этому такие спиральные участки аргининбогатых гистонов, по-видимому, могут последовательно связывать ряд фосфатных групп обеих цепей ДНК, располагаясь в глубокой борозде ее молекулы. Участки же, богатые карбоксильными или гидрофобными радикалами, образуют, вероятно, петли в полипептидной цепи, которые будут располагаться на поверхности комплекса. Возможно, что гидрофобные взаимодействия между этими петлями будут способствовать конденсации и сверхскручиванию молекулы ДНК в хроматине и в ДНП. Вместе с тем, можно допустить, что на поверхности комплекса могут быть и петли, обогащенные основными остатками, которые могут обеспечивать поперечное связывание отдельных частиц ДНК. Однако размеры этих петель и их число в молекуле аргиниибогатых гистонов, очевидно, невелики, благодаря чему для осаждения ДНК требуется при прочих равных условиях гораздо больше гистонов f3, чем f1. Низкая степень поперечного связывания объясняет, по-видимому, и большее влияние ионной силы и концентрации белка на степень осаждения ДНК этими гистонами.
Особенности первичной и вторичной структур определяют не только пространственные взаимоотношения отдельных гистонов и ДНК, но и прочность их связи. Известно, что если к большому количеству смешанных гистонов добавить небольшое количество ДНК, то она связывает гистоны не в том соотношении, которое наблюдается in vivo, а выбирает из них те, которые проявляют к ДНК большее сродство. При этом в первую очередь с ДНК связываются аргининбогатые гистоны, а в последнюю — лизинбогатые. Определение константы равновесия для связывания ДНК гистонами методом равновесного диализа также показало, что фракция Ib обладает меньшим сродством к ДНК, чем фракция IV. И наконец, многими авторами было показано, что фракция f1 может быть извлечена из ДНП 0,1 М лимонной кислотой, 0,4—0,6 М раствором хлористого натрия или при pH 1,5, тогда как для экстракции остальных фракций необходима концентрация хлористого натрия 1—1,5 М и pH 0,7.
Такое относительно низкое сродство лизинбогатых гистонов к ДНК обусловлено тем, что в их связывании главную роль играют ионные взаимодействия между основными группами гистона и фосфатными группами ДНК. Правда, по данным Фрирсона и Керби, некоторые лизинбогатые гистоны связываются с ДНК еще и водородными связями. В случае же аргининбогатых гистонов к этим силам прибавляются еще и мощные гидрофобные взаимодействия тех нетель, которые располагаются на поверхности комплекса. Кроме того, радикалы неполярных аминокислот, собранные в спиральных сегментах аргининовых гистонов, могут взаимодействовать с гидрофобными основаниями ДНК, дополнительно стабилизируя последнюю и укрепляя связь ее с гистоном. И наконец, число основных аминокислот па молекулу белка у аргининбогатых гистонов выше, чем у гистонов, богатых лизином, а рК гуанидиновой группировки аргинина значительно выше рК ε-аминогруппы лизина (11,6—12,6 и 9,4—10,66 соответственно). Поэтому в случае аргининбогатых гистонов имеет место значительно большая основность и, как следствие этого, более прочная связь с фосфатными группами ДНК. Фракции гистонов f2а и f2b занимают в этом отношении промежуточное положение, приближаясь соответственно к аргининбогатым или лизинбогатым гистонам.
Все эти данные были получены на растворимых реконструированных нуклеогистонах. Последние были получены из отдельных фракций гистонов и ДНК градиентным диализом, при котором концентрация хлористого натрия в среде снижалась с 2 до 0,4 М. В этих условиях происходило слабое, по заметное образование геля. Однако при длительном выдерживании системы в 0,4 М хлористом натрии гель ДНП переходил в растворимую форму. По мнению Боннера, это связано с тем, что в среде с невысокой ионной силой молекулы гистона, отрываясь от ДНК и вновь присоединяясь к ней, со временем находят для себя наиболее стабильные конформационные положения, которые соответствуют максимальной растворимости комплекса. Эти комплексы по ряду свойств были подобны нативным нуклеогистонам (отношение гистон/ДНК равнялось 1,35, константа седиментации — 26S), обладали более высокой температурой плавления ДНК и не распадались на составные компоненты при длительном центрифугировании при 350 000хg (ускорение, при котором оседает ДНК, но не гистоны). Исследования интенсивности светорассеяния растворов указанных комплексов показали, что при реконструкции нуклеогистона происходит изменение конформации молекулы ДНК. При этом фракция аргининбогатых гистонов f3 приводит к уменьшению молекулы ДНК, делая ее упаковку более компактной. Обогащенная лизином фракция f1 не изменяет длины молекулы ДНК, которая в комплексе находится в В-форме. Последнее подтверждается интенсивным связыванием актиномицина Д комплексом ДНК — f1 (известно, что актиномицин Д не связывается гибридами ДНК и РНК, где ДНК находится в A-форме) и малыми различиями в дихроизме между исходной ДHК и этим комплексом.
Таким образом, аргининбогатые гистоны обладают наибольшим по сравнению с другими гистонами сродством к ДНК и вызывают уплотнение ее молекулы. С этими данными хорошо согласуются результаты опытов по изучению влияния отдельных фракций гистонов на процесс плавления ДНК. Как показали Ших и Боннер на реконструированных комплексах, при субэквивалентном отношении гистон/ДНК наибольшей температурой плавления (83,7°С) обладали рекомбианты ДНК — гистон IV. Для комплексов ДНК - гистон Ib температура плавления равнялась 76,3° С. Фракция гистонов, относительно богатых лизином, занимала промежуточное положение. Аналогичные результаты были получены и на частично депротеинизированных ДНП. Оказалось, что при ступенчатом удалении гистонов с ДНП температура плавления последнего практически не меняется, если ДНК оставалась связанной с аргининбогатыми гистонами.
В настоящее время еще трудно объяснить влияние аргининбогатых гистонов на плавление ДНК. В случае лизинбогатых гистонов повышение температуры плавления ДНК комплекса объясняют тем, что фракция f1 взаимодействует с АТ-парами ДНК и тем самым стабилизирует ее структуру. Эту стабилизацию можно объяснить следующим образом. Известно, что в водных растворах АТ-пары наиболее сольватированы и связь между ними менее прочна, чем между парами ГЦ. Наличие областей, богатых такими сольватированными АТ-парами, приводит к определенным дефектам в структуре ДНК. Присоединение полиаминов или лизинбогатых гистонов к таким областям вызывает, очевидно, дегидратацию АТ-пар и устраняет «несовершенства» структуры ДНК. Прямым подтверждением этого положения являются данные Охбы, который нашел, что в нуклеогистоне, в отличие от депротеинизированной ДНК, ГЦ - пары более чувствительны к тепловой денатурации, чем пары АТ. По его мнению, стабильность АТ-пар в таком комплексе обусловлена лизиновыми остатками гистона. Подобный факт отмечался и Батлером, обнаружившим, что гистоны, богатые лизином, обычно связаны с фракцией ДНК, содержащей аномально высокие количества аденина.
Сходные результаты были получены в опытах Г. П. Георгиева и сотр. по изучению люминесценции комплексов акрифлавина с ДНК разного нуклеотидного состава и с ДНП. Оказалось, что квантовый выход люминесценции акрифлавина на ДНК изменяется пропорционально квадрату концентрации АТ-пар в ней. Следовательно, краситель наиболее интенсивно люминесцирует при адсорбции между парами АТ — АТ. Если же акрифлавин был адсорбирован на ДНП, то квантовый выход люминесценции был значительно ниже, чем на ДНК. Удаление лизинбогатых гистонов из ДНП приводило к увеличению квантового выхода люминесценции. Очевидно, что гистоны, богатые лизином, связаны с теми участками ДНК, которые богаты АТ-парами. Для аргининбогатых гистонов подобного рода закономерностей не обнаружено.
Изложенные выше соображения о способах взаимодействия ДНК и отдельных фракций гистонов во многом гипотетичны, хотя и подтверждаются анализом рентгенограмм, ИКС-спектров, кривых титрования и определения дисперсии оптического вращения нативных дезоксирибонуклеопротеидов. И в них лизинбогатые гистоны образуют вытянутые полипептидные цепи, тогда как аргининбогатые гистоны и гистоны, относительно богатые лизином, обладают значительными спиральными участками, которые отличаются высоким содержанием основных остатков и остатков дикарбоновых и неполярных аминокислот. Все карбоксильные, имидазольные и тирозиновые группы гистонов, находящихся в комплексе с ДНК, доступны электрометрическому титрованию. 80% остатков лизина и аргинина недоступны титрованию, будучи, вероятно, связанными с фосфатными группами ДНК. Исследование двойного лучепреломления и дихроизма ДНК, нативных и частично депротеинизированных нуклеогистонов показало, что при связывании ДНК с гистонами происходит сокращение и сверхскручивание ее молекулы. За это говорит уменьшение числа пар оснований, перпендикулярных оси молекулы, которое достигает 60% по сравнению с ДНК. Это сверхсокращение молекулы ДНК происходит благодаря, главным образом, аргининбогатым гистонам, так как при отщеплении части этих белков от ДНП наблюдалось увеличение дихроизма, двойного лучепреломления в потоке и коэффициента внутреннего трения.
К сожалению, все эти данные еще мало творят о пространственной архитектуре нативных нуклеогистонов. Трудности ее изучения обусловлены тем, что ДНП-комплекс не является кристаллическим и при рентгеноструктурном анализе не обнаруживает высокоупорядоченной структуры. Кроме того, в зависимости от условий выделения (интенсивность гомогенизации хроматина, длительность выдерживания в разбавленных солевых или водных растворах) ДНП может быть получен в виде геля или растворимого комплекса. Последний состоит из индивидуальных молекул ДНП, содержащих двуспиральную ДНК и присоединенные к ней белки. Строение гелевого ДНП неизвестно. Возможно, он состоит из одной ДНП-частицы, образующей складки и изгибы, а возможно, и из индивидуальных молекул ДНП. Неясна также и природа связей между различными ДНП-нитями или между разными участками одной и той же ДНП-нити. Поэтому модели организации ДНП во многом гипотетичны и на первый взгляд противоречат друг другу.
Так, одна из первых моделей допускала, что нуклеогистоны образуют регулярные структуры, в которых ось полипептидной цепи располагается иод углом в 55° к направлению ориентации молекулы ДНК. Поскольку жёлобы двойной спирали расположены под углом примерно 58° к ее оси, то, согласно этой модели, гистоны располагаются в большом жёлобе спирали ДНК, как бы перебинтовывая ее. Однако эта структура требовала относительно регулярного чередования остатков основных аминокислот в цепи белка. Основываясь па существовании рефлекса, соответствующего периоду 37 Å, и на результатах инфракрасной спектроскопии, Зьюби предложил структуру в виде решетки, где молекулы гистонов, частично располагаясь в больших жёлобах ДНК, пересекают ее цепи под углом 55—60° к оси двойной спирали (рис. 20). Наконец, целый ряд авторов полагает, что третичная структура нуклеогистона возникает благодаря системе гистоновых мостиков, связывающих отдельные молекулы ДНК или отдельные ее участки.
При этом спиральные сегменты гистоновой цепи могут располагаться в больших жёлобах спирали ДНК, тогда как аморфные участки — в промежутках между се молекулам и.
Существование таких гистоновых мостиков подтверждается исследованиями различных форм ДНП. Выше уже говорилось, что в зависимости от обработки хроматина ДНП может быть получен в растворимой или гелевой форме. Длительное время считали, что между ними существуют принципиальные различия и что лишь одна из них является действительно нативным ДНП. Так, Зьюби и Доги считали таковым лишь мелкодисперсный растворимый материал, тогда как Итзаки, Фредерик и другие авторы полагали, что растворимая форма является продуктом деградации ДНП-геля. Это заключение основывалось на том, что растворимая форма ДНП содержала меньшее количество белка и ДНК более низкого молекулярного веса. Однако уже тогда было показано, что в составе обеих фракций имеются частицы ДНП, сходные по своим параметрам, и что ДНК и аминокислотный состав гистонов в них идентичны. Это позволило допустить, что для образования гелевой сетки ДНП необходима высокая концентрация гистонов.
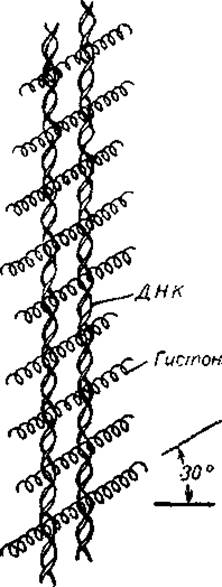
Рис. 20. Модель нуклеогистона, согласно которой гистоны образуют мостики между молекулами ДНК (Zubay, 1964).
Исследования последних лет показали, что различия между растворимой и гелевой формами связаны, в основном, с изменениeм уровня организации ДРП. При интенсивном размельчении хроматина или разбавлении гелевого ДНП последний распадается на отдельные нуклеогистоновыe компоненты различного размера и различной структурной сложности, сходные по ряду свойств с ДПП-гелем (химическому составу, УФ-спектрам поглощения, профилям плавления, двойному лучепреломлению и дихроизму). Однако они отличаются низким модулем упругости, несколько меньшим соотношением белок/ДНК и более низким молекулярным весом ДНК. По-видимому, при размельчении гелевого ДНП происходит не только потеря части белка, но и разрыв некоторых цепей ДНК. Сходного рода компоненты могут быть получены при извлечении части лизинбогатых гистонов из ДНП-геля; обратимая ассоциация в этом случае дает снова ДНП с исходными свойствами. Вероятно, эти нуклеогистоновые компоненты объединяются в трехмерную гелевую сетку поперечными белковыми связями, роль которых выполняет часть лизинбогатых гистонов.
Вместе с тем, работами Г. П. Георгиева и сотр., Чалклей и Ненсона было показано, что разрушение гелевой сетки можно осуществить и без удаления лизинбогатых гистонов. Для этого достаточно обработать ДНП-гель 4 М мочевиной при низкой ионной силе. При этом солюбилизация ДНП происходит без потери белка и без какой-либо деградации ДНК. Известно, что мочевина разрывает водородные связи и влияет на гидрофобные взаимодействия. Поэтому можно допустить, что связи этого типа ответственны за образование сшивок между отдельными молекулами (или отдельными участками одной молекулы) ДНП. Поскольку, вместе с тем, существование гелевого ДНП невозможно без участия лизинбогатых гистонов, то можно предположить, что образование подобных связей протекает при непосредственном участии последних. Иными словами, отдельные частицы ДНП связываются в надмолекулярную гелевую структуру не самими цепями лизинбогатых гистонов, а водородными связями и гидрофобными взаимодействиями этих цепей. Какая из этих моделей соответствует действительности — сказать в настоящее время трудно. Однако какова бы ни была природа связей между молекулами (участками) ДНП, несомненно одно: решающую роль в образовании гелевой сетки играют лизинбогатые гистоны.
Определенную роль в организации ДНП могут играть не только лизиибогатые гистоны, но и другие белки. Известно, что модуль упругости реконструированных гелеобразных ДНП ниже такового нативных ДНП-гелей. При диссоциации же и последующей реассоциации нативных ДНП можно получить гели, свойства которых одинаковы. Вероятно, одних гистонов еще недостаточно для образования нативной решетки ДНП- геля. Полное удаление гистонов из ДНП и анализ остающейся ДНК показали, что последняя прочно связана с остаточными кислыми белками. Последние содержат значительное числе SH-гpyпп и дисульфидных мостиков, которые связывают молекулы ДНК и образуют трехмерную рыхлую фибриллярную сетку. Такие комплексы ДНК и остаточных кислых белков обладают относительно высокими вязкостью и модулем упругости и напоминают этим нативные ДНП-гели. Разрыв связей —S—S— приводит к полной потере гелевых свойств этими комплексами. Очевидно, что остаточные кислые белки являются тем компонентом, который наряду с лизинбогатыми гистонами необходим для построения гелевой решетки. Возможно также, что какую-то роль в образовании гелевых ДНП играют взаимодействия гидрофобных петель аргининбогатых гистонов. В ДНП основная масса заряженных основных групп гистонов экранирована фосфатными группами ДНК. Остающихся полярных групп уже недостаточно для экранизации не полярных радикалов, взаимодействие которых может способствовать образованию ДНП-гелей.
Поперечные гистоновые мостики и кислые белки играют существенную роль и в организации хроматина. Известно, что хроматин в ядре существует в двух формах: в виде плотных конденсированных глыбок и в виде диффузных областей, состоящих из свободно вытянутых нитей диаметром около 100— 150 Å. Хотя конденсированный хроматин содержит большую часть ДНК ядра, активным в поддержании синтеза РНК является только диффузный хроматин. Работами Литтау, Олфри, Мирского и других исследователей показано, что избирательное удаление лизинбогатых гистонов из плотного хроматина или метафазных хромосом приводит к исчезновению конденсированных глыбок и появлению сетки фибрилл. Удаление аргининбогатых гистонов не оказывает такого эффекта. Если из метафазных хромосом удалить все гистоны, то они состоят из рыхлой сетки фибрилл. Добавление к таким хромосомам лизинбогатых гистонов приводит к образованию плотного хроматина. Аргининбогатые гистоны, хотя и связываются такими гистонистощенными хромосомами, оставляют их в том же самом рыхлом состоянии. Все это говорит о том, что лизинбогатые гистоны могут образовывать связи между отдельными нитями ДНП хроматина, переводя его в конденсированное состояние.
Однако это не значит, что различие между конденсированным и диффузным хроматином обусловлено количественными различиями в содержании лизинбогатых гистонов. Исследованиями последних лет показано, что соотношение гистон/ДНК практически одинаково в конденсированном и диффузном хроматинах. Электрофоретический анализ отдельных фракций гистонов из хроматинов обоих типов также не обнаружил каких-либо различий в гистоновых спектрах. Очевидно, что количество гистонов и их типы практически одинаковы в этих фракциях хроматина, и переход диффузный - конденсированный хроматин зависит от целого ряда других факторов. Такими факторами, вероятно, являются кислые белки, фосфолипиды и РНК хроматина. Как было показано в работах Боннера, Ванга, Комингса, Френстера и других исследователей, диффузный хроматин содержал значительно больше РНК и фосфолипидов, в четыре раза больше фосфора фосфопротеинов и в два раза больше кислых белков, чем конденсированный. Кислые белки хроматина составляют примерно 20% его массы, состоят по меньшей мере из четырех фракций, обладают высокой скоростью обновления и содержат в своем составе до 0,14% фосфора и до 3,6% РНК. Они способны образовывать прочные комплексы как с гистонами, так и с ДНК. По-видимому, увеличение количества и степени фосфорилирования кислых белков и является тем основным фактором, который препятствует возникновению мостиков лизинбогатых гистонов. Возможно также, что кислые белки, будучи связаны с ДНК, могут непосредственно играть роль регуляторных белков. Интересно, что содержание этих белков в хроматине зародышей морского ежа возрастает по мере перехода от бластулы до личинки.
Изложенные выше данные говорят лишь о роли отдельных белков в организации хроматина. Однако они во многом еще гипотетичны, неполны и не позволяют представить себе «архитектуру» этой сложной субстанции хромосом. Вместе с тем они ничего не говорят и о расположении отдельных типов молекул гистонов вдоль цепей ДНК в хроматине. Между тем вопрос о том, получает ли каждая молекула ДНК полный набор различных типов гистонов или же она связывает гистоны лишь определенных типов, имеет принципиальный интерес. Электрофоретический анализ нативных ДНП, а также ступенчатое удаление гистонов из них и последующее исследование свойств частично депротеинизированных ДНП показали, что локализация гистонов вдоль цепей ДНК в хроматине носит сложный характер. Наряду с участками, где ДНК связана с гистонами одного тина, существуют и такие области хроматина, где с ДНК соединены почти все типы молекул гистонов. Прямые электронномикроскопические наблюдения подтверждают это заключение. Используя фибриллы нативного хроматина, из которых были удалены все гистоны, за исключением лизинбогатых, Боннеру и сотр. удалось показать, что субфракции этих белков расположены рядом друг с другом и образуют выступы на ДНК. Эти выступы расположены регулярно относительно хромосомальной ДНК через промежутки, равные 805 Å. В этих промежутках расположены все остальные фракции гистонов, причем каждый тип гистона покрывает, по-видимому, участок ДНК длиною не более 40-50 Å.
Таким образом, расположение гистонов относительно ДНК хроматина характеризуется известной специфичностью, несмотря на то, что их взаимодействие является, видимо, чисто ионным. Как можно объяснить это противоречие? Как будет показано ниже, специфичность взаимодействия гистон — ДНК и определенная регулярность расположения гистонов относительно ДНК в хроматине обеспечивается его важным составным компонентом — векторной РНК. Присоединяя к себе несколько молекул гистонов, эта РНК может находить комплементарный ей ген-оператор и обеспечивать взаимодействие определенных гистонов с соответствующим структурным геном. В случае лизинбогатых гистонов существенную роль играет и состав оснований ДНК.