Химия белка - Часть 2 - Избранные разделы частной химии белка - Ашмарин И. П 1968
Гистоны
Специфичность гистонов. Возможные механизмы репрессии и дерепрессии
Вопрос о специфичности гистонов возник сразу же, как только была сформулирована гипотеза об их генетической функции. Действительно, если гистоны избирательно блокируют различные участки ДНК в клетках различных тканей и видов, то они должны обладать тканевой и видовой специфичностью. Однако накопленный по этому вопросу материал весьма противоречив и не позволяет сделать достаточно определенного вывода.
С одной стороны, многочисленными работами Батлера, Джонса, Хнилицы и других исследователей было показано, что аминокислотный состав гистонов из тканей, различающихся по степени дифференциации и метаболической активности, не обнаруживает каких-либо существенных отличий. Весьма сходными были и картины электрофоретического разделения в крахмальном и полиакриламидном гелях. Число полос и их электрофоретическая подвижность оказались практически одинаковыми для тотальных гистонов тимуса теленка и крыс, асцитной опухоли мышей и спермы морских ежей, для гистонов печени курицы и четырехдневного куриного эмбриона и для гистонов.
Печени, почек и мозга некоторых видов млекопитающих (мыши, крысы, кролика, свиньи). Вместе с тем, работами Боннера и Сотр. было показано, что в тканях далеко отстоящих видов животных (печени форели и тимуса теленка) или животных и растений (тимуса теленка и проростков гороха) присутствуют примерно в одинаковых количествах одни и те же фракции пистонов, которые почти не отличаются по аминокислотному составу, N-концевым группам и картинам электрофоретического разделения в гелях.
Еще более четкие результаты были получены при изучении отдельных фракций гистонов из различных источников. Так. Хнилица обнаружил большое сходство гистонов f2b из тимуса теленка и крысы, кожи и селезенки крысы, карциносаркомы Вокера 256 и эритроцитов цыпленка. Сходство наблюдалось по следующим показателям: по аминокислотному составу, содержанию N-концевых групп, картинам электрофоретического разделения, кинетике расщепления карбоксипептидазой, пептидным картам триптического гидролизата и аминокислотному составу ряда пептидов. На основании этих данных Хнилица пришел к выводу о полной тождественности фракции f2b во всех исследованных тканях.
Наконец, раскрытие аминокислотной последовательности к молекуле гистона, богатого аргинином и глицином (гистон IV) показало почти полную идентичность этих белков в тимусе теленка и семядолях гороха. Из 102 аминокислот полипептидной цепи только в двух случаях были обнаружены так называемые консервативные замены, которые не сказываются на вторичной структуре белка. Эти замены состояли в том, что в гистоне гороха валин в 60-м положении заменен на изолейцин, а лизин в 77-м положении - на аргинин. Столь близкое сходство гистонов из видов, так далеко разошедшихся в процессе эволюции, позволило ряду авторов заключить, что выявляемые незначительные различия являются следствием накопления неодинаковых единичных мутаций. Полный же набор гистонов, обнаруживаемый теперь у различных видов млекопитающих, присутствовал ранее в эволюционном ряду и оставался неизменным.
С другой стороны, известен ряд фактов противоположного характера. Правда, все эти факты могут быть подразделены на три неравноценные группы.
К первой относятся случаи количественных, но не качественных изменений основных фракций гистонов. Такие сдвиги в соотношении гистоновых фракций наблюдались в раннем эмбриогенезе морских ежей и морских гольцов, в тканях куриного эмбриона на разных этапах развития, в ядрах регенерирующей печени молодых и старых крыс, в клетках различных дифференцированных тканей одного и того же животного (кожа, печень, регенерирующая печень и гепатома Новикова крыс) и в тканях различных видов животных и растений. Однако сами по себе аналогичные фракции гистонов растений и животных были сходны но аминокислотному составу, электрофоретическим свойствам, N-концевым группам, а иногда и по первичной структуре в целом. По мнению Хнилицы и Гудвина, эти изменения в соотношении отдельных фракций гистонов могут влиять на генную экспрессию. В настоящее время имеются и прямые экспериментальные подтверждения этого заключения. Показано, что в ходе развития морских ежей и гольцов при переходе от стадии бластулы к стадии гаструлы значительно снижается содержание аргининбогатых гистонов и увеличивается лизинбогатых. В этот же период происходит и резкое увеличение в синтезе РНК ядер, причем эти изменения В основном затрагивают популяцию и-РНК.
Во вторую группу можно отнести редкие случаи качественных изменений гистонов различных тканей. Работами Бастина и Коле, Нельсона и Джениса было показано, что количество и качество (аминокислотный состав и состав триптических гидролизатов) отдельных субфракций лизинбогатых гистонов различны для тканей тимуса и молочной железы кролика, печени л тимуса теленка и хомячка, печени и эритроцитов цыпленка н лягушки. Другим примером тканевой специфичности гистонов может служить замещение одних фракций гистонов другими в процессе спермиогенеза. Эти изменения для млекопитающих сводятся к замене лизинбогатых гистонов на аргининбогатые в случае рыб и моллюсков этот процесс идет дальше, аргининбогатые гистоны замещаются протаминами. Такие качественные изменения можно, по-видимому, связать с процессом конденсации хроматина и почти полным подавлением генома в зрелых сперматозоидах.
И наконец, к третьей группе относятся единичные случаи видовой специфичности гистонов. Они были выявлены для гистонов морской мидии Mytilus edulis и для лизинбогатых гистонов селезенки четырех видов животных. В первом случае в составе гистонов удалось обнаружить две фракции с необычайно высоким содержанием основных аминокислот (35 мол.%). Во втором случае было показано, что лизинбогатые гистоны селезенки теленка, крысы, кошки и курицы отличаются по числу субфракций, выделяемых хроматографией на амберлите IRC-50. Одна из субфракций гистонов f1 селезенки крысы отличалась электрофоретической подвижностью в полиакриламидном геле и содержала значительные количества метионина. Это единственный случай, когда метионин был обнаружен в составе лизинбогатых гистонов.
Суммируя вышеизложенное, можно заключить, что случаи видовой и тканевой специфичности гистонов крайне редки и известны лишь для лизинбогатой фракции этих белков. Как правило, в различных тканях у различных видов высших организмов - имеются качественно одинаковые типы гистонов, которые могут находиться в различных соотношениях. Такое заключение кажется вполне обоснованным еще и потому, что гистоны связаны с теми генами, которые остаются репрессированными в течение всей жизни клеток данной линии и которые составляют основную массу генома. С другой стороны, чтобы закодировать белок, состоящий примерно из 500 аминокислот (молекулярный вес порядка 55 000), требуется структурный гея, содержащий 1500 нуклеотидов. Такой структурный ген будет соответствовать части одной цепи молекулы ДНК с молекулярным весом порядка 465 000 или части двойной цепи с молекулярным весом 930 000. Принимая отношение гистона к ДНК в нуклеогистоне равным 1,2 и молекулярный вес гистона — 18 000, можно подсчитать, что для соединения с таким геном требуется около 60 молекул гистона. Поэтому любая специфичность здесь маловероятна.
Таким образом, в тканях растений и животных имеется ограниченное число типов гистонов, для которых не доказана тканевая и видовая специфичность. Типы гистонов в диффузном хроматине подобны таковым в конденсированном. Это означает, что гистоны, являясь существенным структурным элементом хроматина, выполняют функцию общих, но не специфических репрессоров. Вместе с тем известно, что расположение гистонов относительно ДНК хроматина, равно как и угнетение матричной активности этой ДНК, носит специфический характер. Как же достигается необходимая специфичность репрессин? В случае лизинбогатых гистонов такая специфичность может быть обусловлена их повышенным сродством к АТ-парам ДНК. Однако для других гистонов подобного сродства к определенным участкам ДНК не обнаружено. Поэтому многие авторы считают, что характерное распределение гистонов в ДНП осуществляется с помощью хромосомной РНК.
Этот новый тип рибонуклеиновых кислот в настоящее время обнаружен в хроматине семядолей и проростков гороха, куриного эмбриона, печени и асцитной опухоли крысы и тимуса теленка. Характерными особенностями хромосомной РНК является малая длина цепи (40—50 нуклеотидов) и несколько необычайный нуклеотидный состав, включающий около 27% дигидроуридиловой кислоты. Последняя обладает способностью к обратимой циклизации и соединяется амидной связью с белком кислого характера:
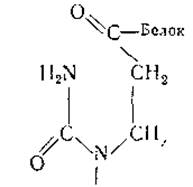
Б свою очередь этот РНК-связанный белок соединен водородными связями с несколькими молекулами гистонов. В результате образуются комплексы, которые в целом, вероятно, связаны с ДНК хроматина. Об этом свидетельствует тот факт, что РНК комплекса становится доступной действию РНК-азы только после удаления из него ДНК.
Такое строение комплекса может иметь принципиальное значение. Благодаря тому, что гистоны в комплексе ассоциированы в большие единицы, последние могут иметь размер, вполне достаточный, чтобы комплексироваться с ДНК одного или нескольких генов С другой стороны, гистонсвязанная РНК может находить комплементарный ей ген-оператор, что в свою очередь облегчает взаимодействие гистонов с ДНК соседнего структурного гена (или генов). Целый ряд фактов подтверждает это предположение. Так, Боннер и сотр. центрифугированием в градиенте плотности хлористого цезия выделили из хроматина проростков гороха такие комплексы РНК, кислого белка и гистонов. Оказалось, что хромосомная РНК может гибридизоваться с ДНК, когда она свободна от белка. Как показали эти опыты, хромосомная РНК представлена в различных тканях различными и чрезвычайно гетерогенными по последовательности оснований популяциями молекул. В присутствии этой РНК происходит специфическая реассоциация хроматина, матричные свойства которого оказываются идентичными свойствам нативного хроматина. РНК, синтезированные на матрице такого хроматина, были сходны с РНК ядра по своей способности образовывать молекулярные гибриды с ДНК. Если же хромосомная РНК предварительно разрушалась нитратом цинка, то специфичность реассоциации хроматина нарушалась.
Таким образом, все эти данные говорят о том, что хромосомная РНК является тем детектором, с помощью которого гистоны находят соответствующие участки ДНК. Поэтому такую РНК часто еще называют векторной РНК. Возможно, что векторные РНК собираются на генах-регуляторах, и их количество соответствует числу генов-операторов. Число же отдельных видов гистонов может быть значительно меньше числа операторов, и для их синтеза вполне достаточно ограниченного количества генов В результате и число веществ-эффекторов, соответствуя количеству типов гистонов, может быть гораздо меньше числа генов-операторов.
Как можно представить себе механизмы дерепрессии ДНК? Во-первых, путем демаскирования какого-то участка молекулы ДНК в результате «снятия» с нее гистона или в результате ослабления связи ДНК — гистон. Такое удаление гистона может произойти под влиянием различных внутриядерных полианионов, среди которых в первую очередь следует назвать РНК. Показано, что содержание РНК в диффузном хроматине в пять раз выше, чем в конденсированном, и что общая ядерная РНК может служить эффективным дерепрессором ДНК. С другой стороны, известно, что в обоих типах хроматина содержится примерно одинаковое количество однотипных гистонов. На основании этих данных Френстером было высказано предположение о том, что гистоны угнетают активность ДНК как неспецифические репрессоры, тогда как РНК действует как специфический по отношению к ДНК дерепрессор. Согласно модели Френстера, РНК подвергается простому объединению с комплементарным ей участком одной из цепей двухцепочечной ДНК и присоединяет к себе гистоны, которые были первоначально связаны с ДНК. В результате определенные участки второй цепи ДНК становятся открытыми для РНК-полимеразной реакции (рис. 24).
В качестве других полианионов, ослабляющих связь ДНК и гистонов, следует, назвать кислые белки, фосфолипиды, фосфопротеины и полифосфаты. Известно, что в активном хроматине содержится в два раза больше кислых белков, в пять раз — фосфолипидов и почти в четыре раза — фосфора фосфопротеинов, чем в конденсированном. С другой стороны, работами И. П. Ашмарина и А. И. Комковой, Лэнгена и Смита было показано, что фосфопротеины и полифосфаты значительно уменьшают ингибирующее действие гистонов на синтез РНК. В присутствии этих соединений образуются трехкомпонентные растворимые комплексы ДНК — гистон — полифосфат (фосфопротеин), которые обладают матричной активностью даже при значительном преобладании гистона над ДНК. О важной роли негистоновых белков говорят и другие факты. Так, опытами Пола и Гильмора было показано, что при реассоциации гистонов и хромосомной ДНК образуется комплекс, который неактивен как матрица. Если же гистоны рсассоциируются с комплексом ДНК — кислые белки, то восстанавливается хроматин, подобный исходному по матричной активности. Добавление кислых белков к хроматину может восстанавливать его активность после подавления ее гистонами. Если же кислые белки добавить к хроматину перед введением в систему гистона, та ингибиторный эффект последних вообще не наблюдается. Все эти данные говорят о том, что полианионы, частично нейтрализуя гистоны, могут ослаблять прочность их связи с ДНК, изменять структуру комплекса ДНК — гистон и служить в результате дерепрессором матричной функции ДНК.
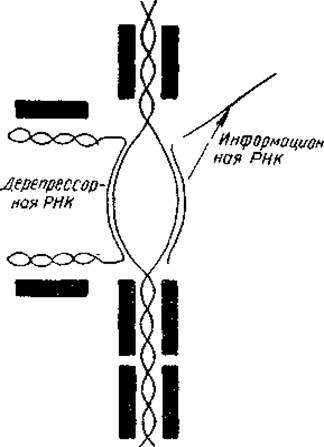
Рис. 24. Модель специфической депрессии РНК-синтеза в активном хроматике (Frenster, 1965). Черные блоки — молекулы гистонов-репрессоров.
Третьим путем дерепрессии является химическая модификация отдельных участков в молекуле гистонов. Как уже говорилось, этот путь заключается в ацетилировании, метилировании и фосфорилировании гистонов, а также в изменении числа дисульфидных сшивок в их молекуле. Так, еще в 1964 г. Олфри с сотр. показали, что в ядрах тимуса осуществляется ацетилирование гистонов, которое протекает независимо от синтеза белка (включение С14-ацетата продолжалось и при блокировании белкового синтеза пуромицином) и наиболее интенсивно модифицирует фракцию аргининбогатых гистонов. Эти результаты подсказали эксперименты, в которых к РНК-полимеразной системе тимуса или Е. coli добавлялись С14-АТФ или С14-ГТФ и аргининбогатые гистоны, ацетилированные химическим путем. Оказалось, что даже незначительное ацетилирование фракции f3, которое почти не сказывалось на се электрофоретической подвижности, существенно стимулировало синтез РНК (80% от количества РНК, синтезированной в отсутствие гистонов). При этом ацетилирование не изменяло основных свойств гистонов, и последние могли комбинироваться с ДНК.
Анализ конденсированного и диффузного хроматина показал, что гистоны диффузного хроматина содержат почти в два раза больше ацетильных групп, чем гистоны плотного хроматина. При сопоставлении этих двух фракций хроматина по их способности ацетилировать гистоны оказалось, что этот провесе, так же как и синтез РНК, осуществляется более интенсивно во фракции диффузного хроматина. Это говорило о том, что между ацетилированием гистонов и интенсивностью синтеза РНК в хроматине может существовать определенная связь. Опыты, поставленные на лимфоцитах человека и регенерирующей печени крысы, доказали существование этой связи.
Известно, что добавление к тканевой культуре лимфоцитов фитогем агглютинина (ФГА) приводит к увеличению размеров клеток, их общей метаболической активности, скорости синтеза РНК и белка в них; часть клеток при этом начинает делиться. Инкубация таких трансформированных клеток с Ме-Н3-ацетатом и 2-С14-уридином показала, что ФГА стимулирует не синтез РНК в лимфоцитах, но и ацетилирование в них аргининбогатых гистонов (рис. 25). При этом увеличение скорости ацетилирования гистонов несколько опережало повышение интенсивности синтеза РНК, а структура хроматина претерпевала определенные изменения. На это указывало более интенсивное и возрастающее во времени связывание акридина оранжевого хроматином клеток, обработанных ФГА. Прямая связь между ацетилированием гистонов и увеличением синтеза РНК в ФГА-стимулированных лимфоцитах была доказана и методами авторадиографии. Используя двойную метку и авторадиографию на двойном слое эмульсии, Дарцинкевич и сотр. показали, что пропорция лимфоцитов, увеличивших включение С14-ацетата, такая же, как и клеток, увеличивших синтез РНК. Таким образом, все эти результаты подтверждают тесную связь между стимуляцией ФГА синтеза РНК и увеличением интенсивности процесса ацетилирования гистонов. И наоборот, в тех случаях, когда ФГА вызывает подавление процессов транскрипции (гранулоциты, полиморфноядерные лейкоциты), наблюдается и уменьшение включения С14-ацетата в гистоны.
Сходные результаты были получены и в опытах на регенерирующей печени крысы. Известно, что после частичной гепатоэктомин остающиеся клетки начинают интенсивно делиться и что этот процесс сопровождается увеличением синтеза РНК. Методом конкурентной гибридизации было показано, что популяция к-РНК регенерирующей печени иная, чем в норме, и содержит РНК, характерные для эмбриональной печени. Очевидно, что в ходе регенерации меняется спектр активных генов и открываются локусы, ранее репрессированные. Как показали Пого и сотр.. эти процессы сопровождаются значительными изменениями в ацетилировании гистонов. Оказалось, что и в регенерирующей печени ацетилирование гистонов протекает независимо от их синтеза, в первую очередь и наиболее сильно ацетилируются аргининбогатые гистоны f2a1 и f3. Включение (Me—II3)-ацетата в эти белки достигает максимума спустя 3—4 часа после гепатоэктомии, тогда как наибольшая интенсивность синтеза РНК наблюдается через 6 часов после операции. Очевидно, что ацетилирование аргининбогатых гистонов предшествует увеличению синтеза РНК. При этом процессы деацетилирования в регенерирующей печени замедлены, и ацетатная метка длительное время сохраняется в гистонах. Все эго позволило Олфри с сотр. заключить, что для синтеза новых РНК на ранее репрессированных генах необходимы изменения в структуре хроматина, которые вызываются или совпадают с ацетилированием гистонов. Однако к этому заключению необходимо относиться с определенной осторожностью. Известно, что ацетилирование и деацетилирование гистонов представляют собой энзиматические процессы, которые сами по себе являются регулируемыми. С другой стороны, показано, что при обработке лимфоцитов препаратами ФГА, которые не обладают митогенной активностью, но увеличивают синтез РНК, происходит не увеличение, а уменьшение интенсивности ацетилирования гистонов. Повышенный синтез РНК, вызванный ФГА, может быть возвращен к прежнему уровню гидрокортизоном; при этом высокий уровень ацетилирования сохраняется. Кроме того, имеется ряд данных, говорящих о том, что активация генома представляет собой сложный многоступенчатый процесс и что ацетилирование гистонов является лишь одним из его этапов. Так, работами Риглера, Киландера и других исследователей было показано, что изменения структуры ДНП лимфоцитов, вызываемые ФГА, протекают на самых ранних этапах активации во всех исследованных, клетках. Последующее увеличение ацетилирования гистонов наблюдается лишь в части лимфоцитов. При этом изменения структуры ДНП, происходящие на первом этапе активации, значительно превышают таковые, происходящие при ацетилировании гистонов. По- видимому, ацетилирование гистонов, хотя и участвует в активации генома, является не первой ее ступенью и не играет роли контрольного механизма.
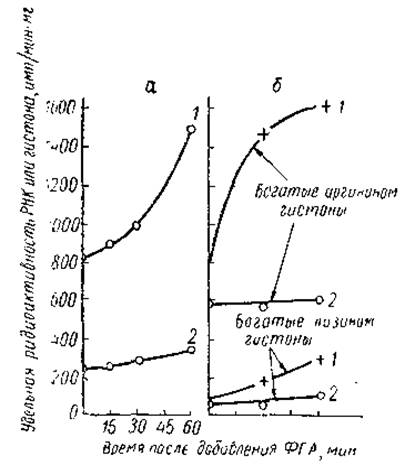
Рис. 25. Сопоставление уровня ацетилирования гистонов и интенсивности синтеза РНК в покоящихся лимфоцитах (2) и в клетках, стимулированных фитогемагглютинином (1) (Allfrey et al., 1966). а — включение 2-С14-уридина, б - включение Ме-Н3-ацетата.
Модификация взаимодействия между гистонами и ДНК может осуществляться и в результате фосфорилирования гистонов. Работами Клайншмидта, Олфри, Орда, Стевели и других исследователей было показано, что фосфорилирование гистонов также не зависит от их синтеза, причем ответственным за него является ядерное, а не митохондриальное фосфорилирование. Этот процесс является энергетически зависимым (все агенты, блокирующие ядерный гликолиз или синтез АТФ, нарушают включение Р32-ортофосфата в белки ядра), и непосредственным источником фосфора для него является терминальный фосфат АТФ и других нуклеозидтрифосфатов. Фосфат находится в гистонах в виде фосфосерина (85%) и фосфотреонина (15%), причем содержание фосфосерина во фракции f1 в три раза превышает его количество во фракции f3. По-видимому, фосфорилирование гистонов тесно связано с изменением активности генома. Показано, что содержание фосфора во фракции f1 заметно выше в митотически активных тканях (эмбриональная и регенирирующая печень, клетки асцитной опухоли, находящиеся в логарифмической фазе) и что количество его в гистонах диффузного хроматина в несколько раз превышает таковое в компактном хроматине. В ходе созревания спермы форели и снижения в ней синтеза РНК значительно падает и содержание фосфорилированных остатков в гистонах. При «трансформации» лимфоцитов ФГА наблюдалось резкое возрастание скорости фосфорилирования гистонов при одновременном увеличении интенсивности синтеза РНК И наконец, в опытах с РНК-полимеразной системой для лизинбогатых гистонов была установлена прямо пропорциональная зависимость между интенсивностью синтеза РНК и содержанием фосфора в гистоне.
Репрессорное действие гистонов на синтез РНК может, по-видимому, зависеть и от соотношения в них тиоловых и дисульфидных групп. Исследования Джеллома, Орда, Стокена и Хилтона показали, что восстановление или блокирование SH-гpyпп аргининбогатых гистонов n-хлормеркурифенилсульфонатом не сказывалось на их способности подавлять ДНК-зависимый синтез РНК. Однако окисление SH-гpyпп до дисульфидных или «сшивание» их по типу R—S—R—S—R (где R = Hg) приводило к увеличению репрессивного эффекта гистонов на РНК-полимеразную реакцию. Последнее хорошо согласуется с более высоким содержанием SH-групп в диффузном и дисульфидных групп в плотном хроматине.
Наконец, весьма вероятно, что дерепрессия осуществляется при активном участии гормонов. Как было показано многочисленными исследованиями, последние обладают органной специфичностью и избирательностью и стимулируют синтез и-РНК и соответствующих энзимов в ряде тканей животных, насекомых и растений. Вместе с тем гормоны привлекательны к потому, что в ряде случаев один и тот же гормон стимулирует синтез нескольких и-РНК и энзимов (например, гормон экдизон контролирует синтез ферментов линьки и окукливания у насекомых). Это подтверждает высказанное ранее предположение о том, что число веществ-эффекторов может быть значительно меньше числа генов-операторов и что один и тот же эффектор может принимать участие в дерепрессии различных генов.
Что можно сказать в настоящее время о механизме действия гормонов? Так как гормоны стимулируют синтез РНК в «подвластных» им тканях, возможно, путем дерепрессии определенных генов, то эта стимуляция должна быть связана с изменением матричной активности хроматина. Выше уже говорилось, что матричная активность хроматина из печени крыс составляет 1/5 от активности ДНК из того же хроматина. У адреналэктомированных крыс эта величина падала до 1/7 активности ДНК. При введении таким животным гидрокортизона матричная активность хроматина возрастала на 30%. Однако добавление гормона к хроматину in vitro не вызывает какого-либо увеличения синтеза РНК. Следовательно, гормоны не оказывают прямого эффекта на активность хроматина. Поэтому многие авторы полагают, что действие гормонов осуществляется через промежуточное вещество белковой природы. Этот белок, получивший название белка-мишени, вероятно, образует комплекс с гормоном, и этот комплекс осуществляет отрыв гистона от соответствующего гена (рис. 26). Наличие таких белков обнаружено для некоторых растительных гормонов (ауксинов); показано, что они обладают тканевой специфичностью и способны связываться с хроматином в присутствии гормона. Вместе с тем действие гормонов может протекать и путем модификации структуры гистонов или увеличения синтеза негистоновых белков. Показано, например, что стимуляция синтеза РНК в печени гидрокортизоном, глюкагоном и инсулином сопровождается усилением включения фосфора в гистоны, особенно во фракцию И. При введении адреналэктомированным крысам гидрокортизона наблюдается не только увеличение интенсивности синтеза РНК, но и повышение степени ацетилирования гистонов хроматина. И наконец, усиление синтеза РНК в матке млекопитающих, вызываемое эстрогеном, коррелирует с повышением синтеза кислых белков хроматина.
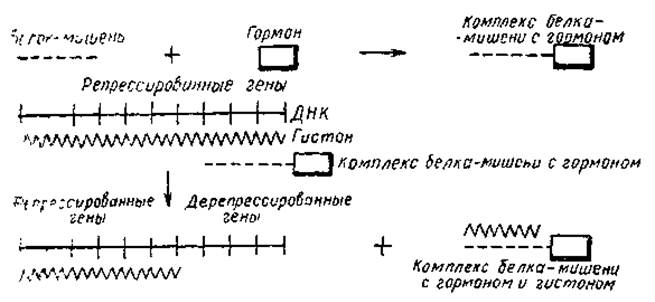
Рис. 26. Возможный механизм регуляции активности генов гормонами (Butler, 1966)
Возможно, что предполагаемое существование ряда механизмов дерепрессии находится в тесной взаимосвязи с наличием нескольких типов гистонов. Каждый из этих типов гистонов выполняет, видимо, как структурные, так и регуляторные функции, поскольку имеющиеся в настоящее время данные не позволяют их строго разграничить. Однако эти регуляторные функции каждый тип гистонов выполняет, вероятно, по-разному. Очевидно, что у высшего организма один и тот же ген должен обладать в различных клетках различной реактивностью. В простейшем случае ген может быть репрессирован в одной клетке и «включен» в другой. Для такого рода регуляции вполне достаточно гистона одного типа и определенного числа разнообразных векторных РНК. Однако репрессия должна принимать много различных форм: ген, репрессированный в одной клетке, способен активироваться определенным сигналом, тогда как для дерепрессии того же гена в другой клетке требуется сигнал совершенно иного рода. Для создания таких различий в реактивности одних и тех же генов и существуют, вероятно, разные типы гистонов. Гистоны, богатые лизином, например, могли бы репрессировать определенный ген и не препятствовать его активации путем фосфорилирования, тогда как в клетках иного типа этот же ген угнетался бы аргининбогатыми гистонами и реактивировался при ацетилировании (взаимодействии с комплексом белок — гормон и т. п.) последних. В результате распределение разнотипных гистонов между молекулами геномной ДНК явилось бы той программой генной активности, которая в известной мере определяла бы развитие организма.
Естественно, что такого рода программа весьма нуждается в целенаправленных механизмах взаимодействия гистон — ДНК и дерепрессии. Вместе с тем она предполагает, что дерепрессия генов должна возрастать по мере развития и специализации. Поскольку в любом типе клеток большинство генов неактивно, то эти изменения не будут, вероятно, значительно отражаться на общем составе гистонов. Выше мы уже говорили о существовании особого класса векторных РНК. Имеются и другие данные, которые подтверждают эти заключения. Так, работами Олфри, Пого, Орда, Стокена и других исследователей было показано, что содержание ацетатных, фосфатных и дисульфид- пых групп во фракциях гистонов различных тканей неодинаково. Различной была в них и интенсивность процессов ацетилирования и фосфорилирования, а также содержание фосфопротеинов. С другой стороны, известно, что скорость обновления гистонов во много раз меньше таковой кислых белков. По-видимому, гистоны образуются лишь однажды, а именно в ходе репликации хроматина. И наконец, работами последних лет показано, что содержание негистонных (кислых) белков в хроматине, равно как и интенсивность ацетилирования гистонов, увеличивается по мере развития эмбриона.
Однако эти результаты лишь косвенно указывают на целенаправленность дерепрессии. Недостаточно доказана и роль векторной РНК. Так, если в нуклеогистоне гороха на каждые 1000 нуклеотидов ДНК приходилось около 100 РНК-гистоновых нуклеотидов, то в нуклеогистоне печени и слизистой кишечника их было обнаружено только 2. Поэтому все высказанные выше предположения в значительной мере спекулятивны. Кроме того, необходимо помнить, что у полихромосомных клеток дифференцированного организма имеется несколько разнообразных уровней регуляции генетической активности (по оперонам, по структурным участкам хромосом, межхромосомный, цитоплазматическо-хромосомный и т. д.), взаимодействие между которыми не может быть обеспечено только гистонами.