Химия белка - Часть 2 - Избранные разделы частной химии белка - Ашмарин И. П 1968
Сократительные белки мышечной ткани
Миозин
Физико-химические свойства и состав миозина. Миозин — белок с относительно высоким молекулярным весом — от 450 000 до 500 000. Следует отметить полноценность аминокислотного состава миозина он содержит все известные аминокислоты. Особенно велико количество дикарбоновых (18%) и основных (16%) аминокислот. N-концевую аминокислоту обнаружить пока не удалось, а С-концевая представлена изолейцином.
Молекула его обладает высокой степенью асимметричности: длина ее — около 1400 А, поперечник — 20—28 А. На электронных микрофотографиях она представляется палочкой с двумя глобулярными образованиями на одном из концов (рис. 4).
Характерные свойства растворов миозина — двойное лучепреломление в потоке и высокая вязкость — являются следствием асимметрии его молекулы и высокого молекулярного веса. Вязкость растворов чистого миозина не имеет аномального характера, т. е. практически не зависит от давления (в пределах 5—100 см вод. ст.), и связана с его концентрацией зависимостью, близкой к линейной. Тиксотропии также не наблюдается. Это свидетельствует об отсутствии существенных дополнительных сил взаимодействия между молекулами в растворе, столь характерных для других мышечных белков. Растворимость миозина в воде характеризуется сложной зависимостью от ионной силы среды. Освобожденный от солей гель миозина растворим в воде. Однако уже наличие 0,001 М хлористого калия резко снижает растворимость миозина, а при 0,02—0,05 М он осаждается полностью. Весьма незначительна растворимость его и вплоть до концентрации 0,15 М хлористого калия. Заметим, что в миофибрилле концентрация хлористого калия составляет как раз 0,15 М и соответствует, следовательно, гелеобразному состоянию большей части миозина (не говоря уже об осаждающем действии присутствующих в миофибрилле актина и ионов магния и кальция). При дальнейшем увеличении концентрации хлористого калия растворимость миозина возрастает и достигает максимума при 0,4—0,6 М. Сульфатом аммония миозин высаливается при 48—49% насыщения раствора. Растворимость в отсутствие солей и условия осаждения сульфатом аммония позволяют отнести миозин к псевдоглобулинам. Однако нерастворимость миозина при концентрациях хлористого калия, близких к физиологическим или меньших, является его отличительной особенностью. Гели миозина характеризуются чрезвычайно высоким содержанием воды (95—98%), следовательно он весьма гидрофилен. Явление осаждения миозина при малых концентрациях хлористого калия связывают с образованием электронейтральных миозинатов калия; в отсутствие катионов его изоэлектрическая точка лежит в слабокислой среде — при pH 5,4, что свидетельствует о наличии лишь относительно небольшого числа избыточных электроотрицательных групп. Двухвалентные ионы магния и кальция также осаждают миозин уже при концентрации 0,001 М.

Рис. 4. Электронные микрофотографии молекул миозина (Лови и сотр., 1969).
Аденозинтрифосфатазная активность миозина. Как уже указывалось, особое значение для раскрытия химических механизмов мышечного сокращения имело установление аденозинтрифосфатазной активности миозина. Многолетние исследования в этой области полностью подтвердили неотделимость энзиматической активности от молекулы миозина. Хотя удельная активность его небольшая (расщепление около 50 молей АТФ на 1 моль миозина за 1 сек), значение ее велико, поскольку именно в молекуле миозина протекают важнейшие этапы превращения химической энергии, освобождающейся при расщеплении АТФ в механическую, и так как количество миозина в мышечной ткани относительно очень большое. АТФ-азная активность миозина весьма специфична в том отношении, что отщепляется только третья концевая фосфатная группировка АТФ. АДФ-азной и АМФ-азной активностью миозин не обладает. Миозин не обладает специфичностью в отношении нуклеозидного радикала, связанного с трифосфатной группировкой, он даже еще более интенсивно расщепляет такие нуклеозидтрифосфаты, как ГТФ, УТФ, ЦТФ и ИТФ; он расщепляет, наконец, просто неорганический трифосфат, хотя и значительно медленнее, чем АТФ. То, что именно АТФ, а не другие нуклеозидтрифосфаты, является непосредственным источником энергии сокращения, определяется, видимо, его общей ролью универсального донора энергии в биохимических реакциях.
Важную роль в проявлении аденозинтрифосфатазной активности играют ионы металлов. В отсутствие катионов миозин неактивен. Ионы калия активируют миозин, но особенно характерно активирующее действие ионов кальция. В присутствии хлористого калия в концентрациях 0,05—0,15 М, т. е. близких или меньших, чем физиологические, АТФ-азная активность значительно возрастает уже при наличии 0,001 М хлористого кальция. Напротив, ионы магния, также при концентрации 0,001 М резко подавляют активность миозина (и сами по себе, и в присутствии ионов калия и кальция). Зависимость АТФ-азной активности миозина от pH характеризуется наличием двух максимумов — главного при pH 9,0 и менее выраженного при pH 6,3—6,5. При физиологических значениях pH 7,0—7,4 активность также довольно значительна — около 40% от максимальной (рис. 5).
Постепенно раскрывается структура той области миозина, которая ответственна за АТФ-азную активность. Особое значение имеют некоторые виды SH-гpyпп миозина. Не все SH-гpyппы связаны с энзиматической активностью, что проявляется в двойственном характере действия ряда специфических SH-peaгентов. Например, такой агент, блокирующий SH-группы, как парахлормеркурибензоат, в малых концентрациях даже активирует миозин, а в больших — подавляет.
Исследования последних лет позволяют полагать, что в миозине есть два типа SH-гpyпп, связанных с АТФ-азной активностью. Блокирование одной из них полностью инактивирует миозин, а блокада другой нарушает способность миозиновой АТФ-азы активироваться ионами кальция. Выяснена последовательность аминокислот вблизи этих SH-гpyпп:
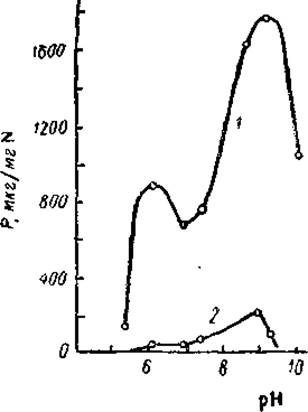
Рис. 5. Зависимость АТФ-азной активности миозина от pH среды (Энгельгардт, 1946).
1 — кальциевая соль АТФ; 2 — то же в присутствии 0,01 М хлористого магния.

Таким образом, мы приближаемся к раскрытию первичной структуры миозина в области активного центра. Каждая молекула миозина содержит по два таких центра. Установлено, наконец, положение активного центра на одном из концов палочковидной молекулы миозина, в упоминавшихся выше глобулярных участках (см. рис. 4, а также рис. 6).
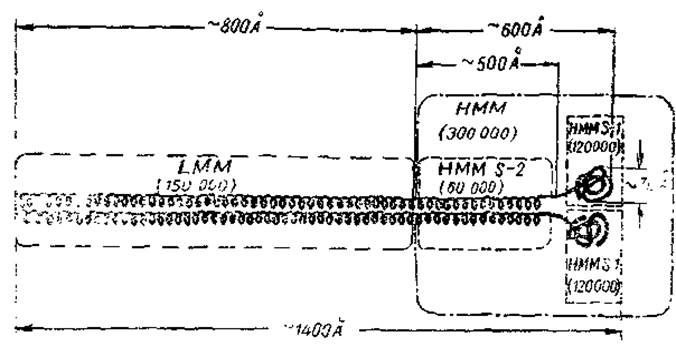
Рис. 6. Схема молекулы миозина (Лови и сото., 1969).
LMM - легкий меромиозин, HМM - тяжелый, НММ S-1 и НММ S-2 - первый и второй субфрагменты тяжелого меромиозина.
Специального упоминания заслуживает неустойчивость чистого миозина к различным денатурирующим воздействиям. В частности, кратковременное, 20-минутное выдерживание миозина при 40° С резко снижает АТФ-азную активность, а также существенно нарушает его способность к связыванию актина. Быстрая инактивация наблюдается и в присутствии незначительных концентраций ионов тяжелых металлов. Устойчивость же миозина значительно повышается при комплексообразовании с АТФ и актином.
Взаимодействие миозина с актином. Следующим важнейшим свойством миозина является способность образовывать прочные комплексы с другим сократительным белком — актином. Однако образование и свойства этих комплексов удобнее рассмотреть после того, как читатель познакомится не только с характеристиками миозина, но и актина. Кроме того, целесообразно выделить описание актомиозина в особый параграф (§ 5), так как его свойства непосредственно связаны с механизмом сокращения мышцы.
Здесь отметим лишь, что важную роль в процессе взаимодействия с актином играют SH-группы, расположенные в глобулярной части молекулы миозина. Предполагают, что эти SH-группы идентичны тем, которые определяют аденозинтрифосфатазную активность миозина.
Детали структуры молекулы миозина. За последнее десятилетие были получены новые важные данные о деталях строения в составе молекулы миозина. Оказалось, что при кратковременном воздействии (в течение 7—12 мин) ряда протеиназ — триптина, химотрипсина, субтилизина, папаина, — расщепляющих около 60 пептидных связей, молекула миозина распадается на два фрагмента — так называемые меромиозины. Это указывает на наличие высокочувствительных участков, легко реагирующих с протеиназами.
Меромиозины различаются по молекулярному весу и получили наименование тяжелого Н-меромиозина (НММ) и легкого L-меромиозина (LMM). Н-меромиозин имеет молекулярный вес, близкий к 300 000. Он сохраняет АТФ-азную активность и способность связываться с актином — свойства, присущие исходному миозину. В то же время у него менее выражена характерная для миозина способность к образованию упорядоченных структур в гелях. Это проявляется в неспособности к образованию кристаллов (или псевдокристаллов) и в отсутствии характерной для миозина осаждаемости в растворах 0,02—0,05 М хлористого калия. Дальнейшее расщепление Н-меромиозина протеиназами (папаином) позволяет разделить его па три субфрагмента, два из которых одинаковы и обозначаются обычно, как НММ S-1, а один существенно отличается от них по свойствам и обозначается НММ S-2. Первые два субфрагмента как раз и представляют собой глобулярные участки молекулы миозина, наблюдаемые на электронных микрофотограммах (см. рис. 4). Именно они являются носителями АТФ-азной активности и способности связываться с актином. Молекулярный вес каждого из них составляет 120 000, а диаметр глобулы близок к 70 Å. Характерно, то полипеитидная цепочка, из которой состоит глобула, лишь в незначительной части находится в виде а-спирали.
Субфрагмент НММ S-2 является палочковидной частицей, состоящей из двух полипептидных цепочек, которые находятся преимущественно в а-спиральной форме. Его молекулярный вес — 60 000, длина — около 500 Å. Полагают, что этот фрагмент образует наиболее гибкую часть молекулы миозина, связывающую скользящие друг относительно друга при мышечном сокращении линейные образования — L-меромиозин и комплекс актива с субфрагментом НММ S-1.
Легкий меромиозин (L-меромиозин) — палочковидная частица с молекулярным весом 150 000 и длиной около 800 Å. Подобно НММ S-2 она состоит из двух полипептидных цепочек в а-форме. L-меромиозин лишен энзиматической активности и сродства к актину; он является носителем способности миозина к образованию упорядоченных структур в гелях и в миофибрилле. В отличие от Н-меромиозина он осаждается в 0,02—0,05 М хлористом калии и может образовывать игольчатые кристаллы.
Сумма молекулярных весов меромиозинов (450000) близка к молекулярному весу исходного миозина. Суммарная длина частиц меромиозинов (первого — 600 Å, второго — 800 Å) тоже соответствует длине целой молекулы миозина (1400 Å). Однако полный анализ продуктов неглубокого расщепления миозина протеиназами заставляет полагать, что кроме главных компонентов — Н- и L-меромиозинов в состав миозина входит еще один компонент с небольшим молекулярным весом — около 20 000. Этот компонент (обычно обозначаемый LMP) связан с остальной частью миозиновой молекулы нековалентными связями — его удается отделить при обработке 1—3-молярной мочевиной или гуанидином, а также при высоких pH (около 11). Полное его отделение ведет к потере миозином АТФ-азной активности и способности связывать актин. В то же время сам по себе LMP-компонент этими свойствами не обладает.
Рассмотрим теперь схему молекулы миозина в целом. Она представлена на рис. 6, где показана последовательность расположения описанных выше фрагментов и субфрагментов. На схеме видно также, что молекула миозина в целом состоит из двух полипептидных цепей, тесно связанных друг с другом в L-меромиозине и в следующем за ним субфрагменте Н-меромиозина. В конце молекулы нити расходятся, образуя глобулярные области. Обращает на себя внимание двуликость миозина, объединяющего в своей структуре и глобулярные, и фибриллярные компоненты. Очевидно, это отражает особенности функций миозина, который не только расщепляет АТФ, но и служит трансформатором освобождающейся при этом химической энергии в механическую. В составе миофибриллы молекулы миозина обращены своими L-меромиозиновыми компонентами к мембране М. а Н-меромиозиновыми — к краям анизотропного диска, где и осуществляется взаимодействие с актином и АТФ.