Основи біоорганічної хімії (навчальний посібник) - Г. О. Сирова - 2018
Тема
Класифікація, будова і значення біологічно важливих гетероциклічних сполук
Актуальність теми. Важливе значення гетероциклічних сполук обумовлено тим, що їх цикли лежать в основі багатьох природних сполук: як біомолекул - структурних компонентів клітин, так і низькомолекулярних фізіологічно активних речовин - рослинних алкалоїдів, синтетичних лікарських препаратів.
Загальна мета: сформувати знання про будову і особливості хімічної поведінки гетероциклічних сполук, що мають біологічну активність.
Конкретні цілі:
1. Уміти пояснювати залежність реакційної здатності гетероциклічних сполук від їх будови.
2. Уміти прогнозувати їх лабораторний синтез з метою отримання лікарських засобів, а також біосинтез в організмі.
3. Уміти інтерпретувати механізми участі гетероциклів у складі вітамінів, гормонів і коферментів у різних біохімічних перетвореннях.
Теоретичні питання
1. Класифікація гетероциклів за розмірами циклу, кількістю і природою гетероатомів.
2. Ароматичність гетероциклів.
3. Біологічно важливі сполук п'ятичленних гетероциклів.
4. Біологічно важливі сполуки шестичленних гетероциклів.
5. Алкалоїди.
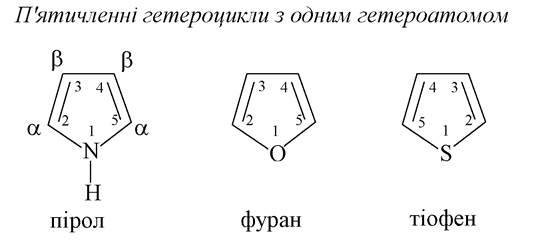
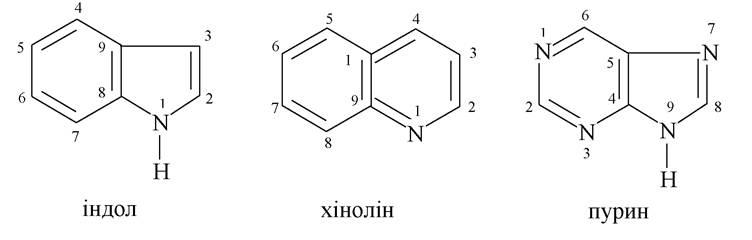
1. Гетероцикли, що становлять для нас інтерес, різняться між собою природою гетероатома (одного або двох) і розмірами циклу: п'яти-, шестичленні цикли, рідше - семичленні. Зазвичай використовуються їх тривіальні назви. Нумерацію окремих атомів у циклі починають з гетероатома. Іноді атоми карбону позначаються буквами грецького алфавіту, починаючи з С- атома, який стояв поряд з гетероатомом.
П’ятичленні гетероцикли з одним гетероатомом
П’ятичленні гетероцикли з двома гетероатомами
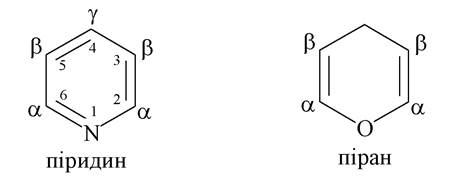
Шестичленні гетероцикли з одним гетероатомом
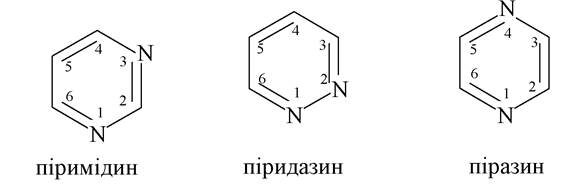
Шестичленні гетероцикли з двома гетероатомами
Конденсовані гетероцикли
2. Вищеперераховані гетероциклічні сполуки мають ароматичні властивості (гетероароматичні сполуки). Органічна речовина є ароматичною, якщо її структура являє собою плоский цикл, утворений a-зв'язками, з кількістю спряжених л-електронів (N), рівних: N = 4n + 2, де n = 1, 2, 3 (число циклів) та ін. (правило Хюккеля).
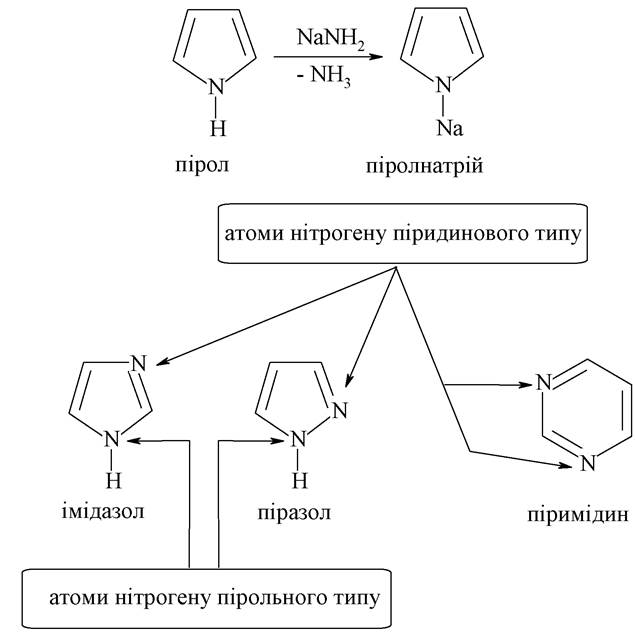
Маючи електронну конфігурацію 1s22s22p3, атом нітрогену в складі гетероциклів формує три гібридні sp2-орбіталі, які утворюють відповідно три ковалентні a-зв'язки цього атома. Залежно від розміру циклу (п'яти- або шестичленний) і від того, один або два р-електрони (з двох неспарених електронів нітрогену) будуть включені у спряжену π-систему, вплив гетероатомів нірогену на утворення ароматичного секстету буде різним. Згідно із цими обставинами розрізняють атоми нірогену піридинового або пірольного типу.
У молекулі піридину для утворення σ-зв'язку використовуються дві (з трьох) гібридні орбіталі, а на спряження «пішов» негібридний р-електрон. Неподілена пара електронів, що залишилася, на третій гібридній орбіталі визначає властивості піридину як основи і нуклеофілу. Атом нітрогену як більш електронегативний порівняно з карбоном, відтягує на себе електронну густину з кільця. Тому системи з піридиновим нітрогеном називають л-недостатніми.
У молекулі піролу в утворенні трьох σ-зв'язків беруть участь усі гібридні орбіталі. Для утворення ароматичного секстету п’ятичленного циклу π-електронів використовуються обидва р-електрони, що залишилися і знаходяться на негібридній орбіталі. Таку систему називають π-надлишковою. До неї належать також фуран і тіофен.
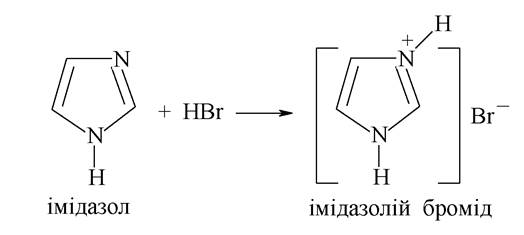
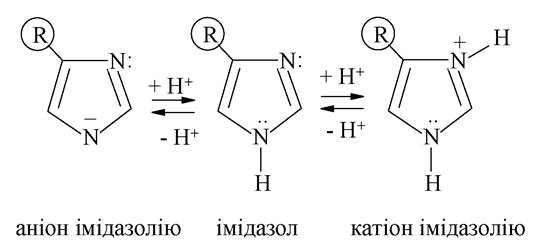
Два атоми нітрогену в імідазолі, піразолі і піримідині мають різну електронну будову і по-різному взаємодіють із циклічною структурою молекули, що визначає хімічні властивості відповідних біоорганічних сполук.
Так, сполуки з піридиновим атомом нітрогену за рахунок неподіленої пари електронів являють собою основи Льюїса і можуть взаємодіяти із сильними кислотами, утворюючи солі:
Пірольні ж атоми нітрогену надають гетероциклам властивості слабких NH-кислот. При дії сильних основ від NH-груп може відщеплятися атом гідрогену із заміщенням його на метал:
3. У біологічних структурах дуже часто зустрічається макроцикл порфін-тетрапірольний ароматичний цикл, побудований з піролінового (IV), пірольного (II) і двох ізопірольних ядер (I, III), сполучених між собою метиновими групами =СН-.
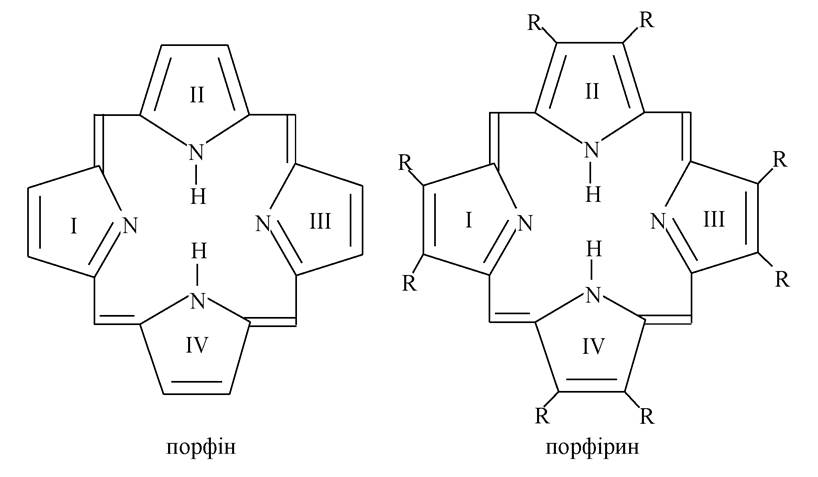
Порфірини в комплексі з атомом металу - металопорфірини - є компонентами (простетичними групами) складних білків. Наприклад, гем - простетична група гемоглобіну (киснетранспортуючий білок еритроцитів) - комплексна сполука ферума (II) з порфіриновим циклом. До металопорфіринових білків належать: міоглобін (кисень-депонуючий білок м'язів), дихальні ферменти мітохондрій - цитохроми, ферменти, які беруть участь в обміні перекису гідрогену - каталаза і пероксидаза, хлорофіл - фотосинтезуючий білок рослин. Модифікована тетрапірольна структура в комплексі з іоном кобальту входить до складу вітаміну В12.
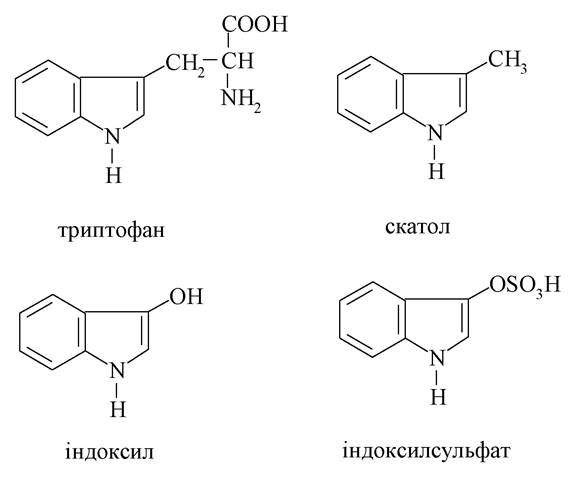
У медицині та фармакології знаходять застосування численні похідні конденсованого гетероциклу на основі піролу - індолу, а саме: амінокислота триптофан і продукти її перетворення - серотонін, триптамін, індоксил, β-індолілоцтова кислота, алкалоїди та лікарські препарати.
Серотонін і триптамін — біогенні аміни, продукти біохімічного перетворення триптофану в організмі:
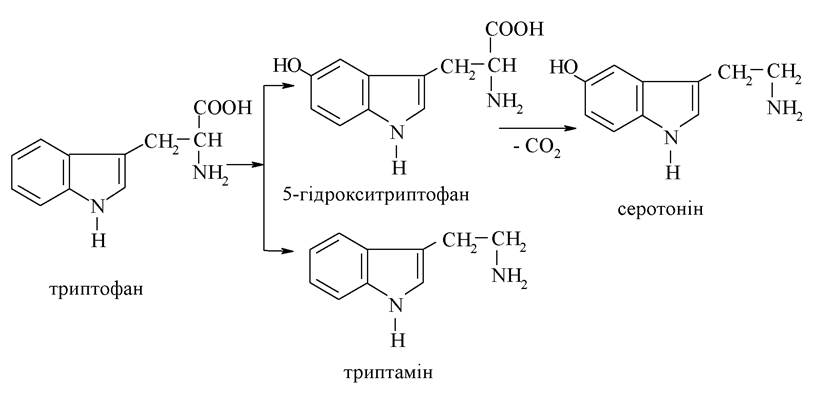
Серотонін - фізіологічно активна сполука, що має властивості гормону і нейромедіатора; регулює кров'яний тиск, є модулятором важливих психічних функцій людини. З порушенням обміну серотоніну пов'язують розвиток шизофренії, алкоголізму, ендогенної депресії. Триптамін проявляє токсичну дію на організм.
Кінцевими продуктами метаболізму серотоніну і триптаміну в організмі є 5-окси-βр-індолілоцтова кислота і βР-індолілоцтова кислота, які виділяються із сечею:
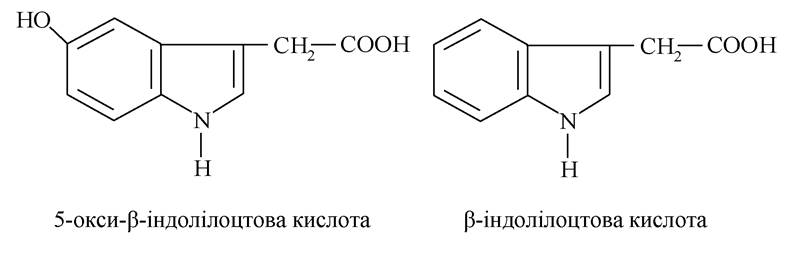
У рослинах β-індолілоцтова кислота виконує роль гормону росту (гетероауксин), внаслідок чого використовується в сільському господарстві.
Індоксил (3-оксиіндол) - похідне від триптофану, утворюється в товстому кишечнику («гниття білків у кишечнику») і піддається детоксикації в печінці шляхом утворення естеру із сірчаною кислотою, який виводиться нирками у вигляді калієвої солі:
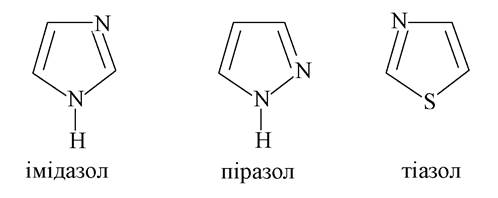
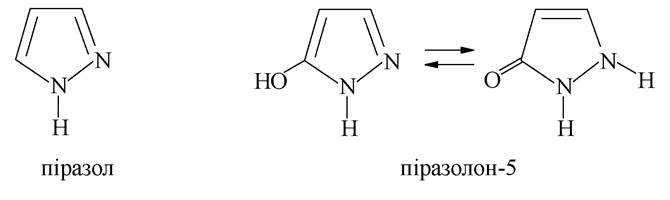
П'ятичленні гетероцикли з двома гетероатомами називають азолами, коли хоча б один з гетероатомів є нітрогеном. Становлять інтерес піразол, імідазол і тіазол. Перші два містять у своїй структурі атоми нітрогену пірольного і піридинового типів і, отже, виявляють властивості як основ, так і кислот (див. вище).
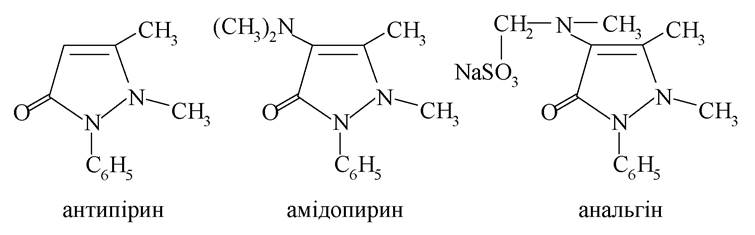
Піразол (1,2-діазол) - синтетична сполука, яку не знайти в природі, але яка широко використовується у фармації: на її основі синтезується важлива група лікарських засобів з анальгетичною та жарознижувальною дією:
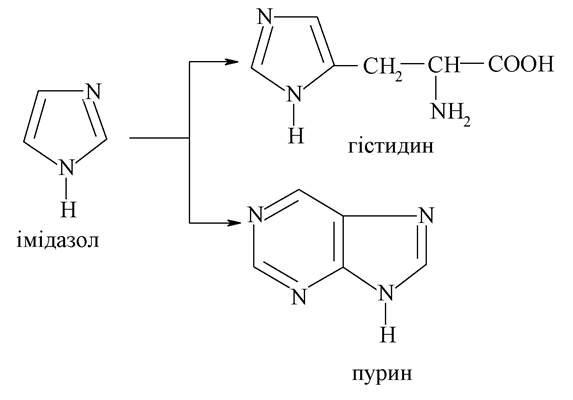
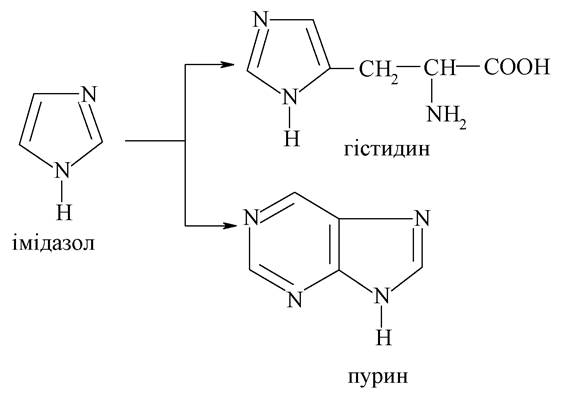
Структура імідазолу входить до складу багатьох біомолекул і лікарських засобів, серед яких найбільш важливими є протеїногенна амінокислота гістидин і конденсований гетероцикл пурин, який входить до складу багатьох вільних нуклеотидів і нуклеотидів як мономерів нуклеїнових кислот:
Здатність різних атомів гістидину проявляти кислотні та основні властивості визначає роль цієї амінокислоти як центру кислотно-основного каталізу в складі багатьох ферментів:
Гістамін - продукт реакції декарбоксилювання амінокислоти гістидину:
Гістамін - біогенний амін гормональної дії: розширює кровоносні судини; його концентрація в міжклітинному просторі різко зростає в умовах запалення і алергічного стану. Сполуки, які перешкоджають зв'язуванню гістаміну з чутливими рецепторами сполучної тканини, застосовуються як антигістамінні (протиалергічні) препарати - димедрол, діазолін.
Тіазол - п’ятичленний гетероцикл, що містить, крім атома нітрогену, атом сульфуру, разом із шестичленним циклом піримідином входить до складу вітаміну В1 (тіамінброміду). В організмі тіамін перетворюється на тіамінпірофосфат або кокарбоксилазу:
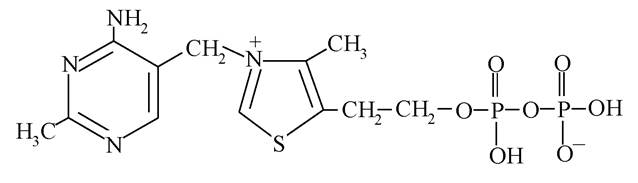
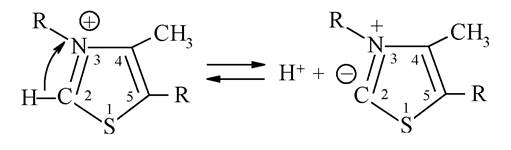
Вітамін В1 виконує важливу каталітичну функцію як кофермент складних ферментативних систем внутрішньоклітинного метаболізму, зокрема здійснює окисне декарбоксилювання багатьох α-кетокислот (піровиноградної, α-кетоглутарової). Можливість участі тіамінпірофосфату в цих реакціях обумовлена С-Н-кислотністю 2-го положення в тіазольному фрагменті молекули:
4. Із шестичленних циклів найбільш часто в природних системах зустрічаються: піридин, піримідин і конденсований на основі піримідину і імідазолу пурин.
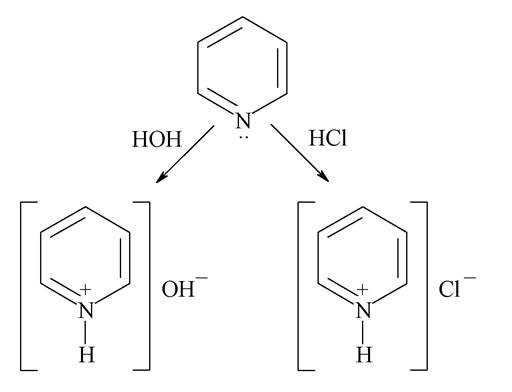
Хімічні властивості піридинового циклу обумовлені його електронною будовою, розглянутою раніше. Як основа піридин зв'язує вільний протон, що лежить в основі його взаємодії з водою (обумовлюючи слабколужний характер розчинів) і сильними кислотами (утворюючи піридинієві солі):
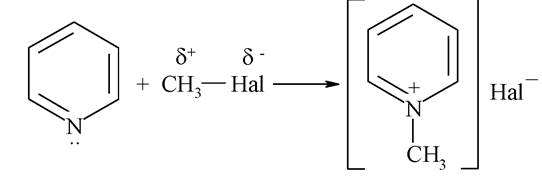
Як нуклеофіл піридиновий атом нітрогену атакує електрофільні центри в молекулах алкілгалогенідів з утворенням солей алкілпіридинію:
З похідних піридину важливе біологічне значення мають піпидинкапбонові кислоти:
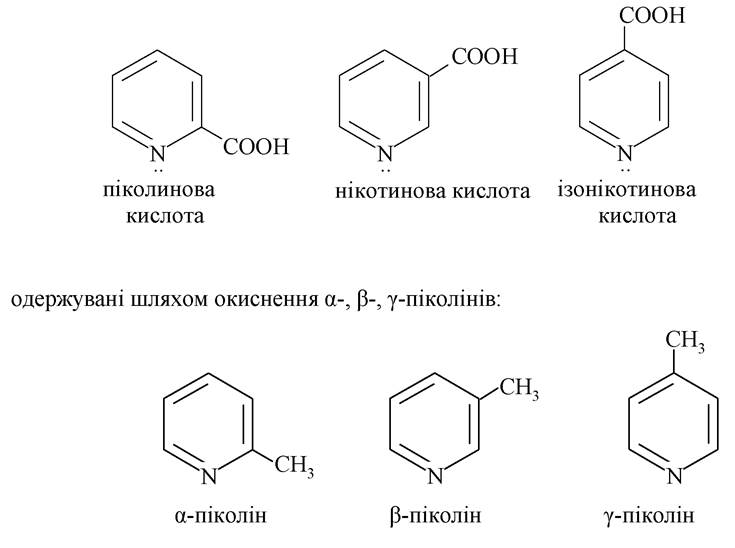
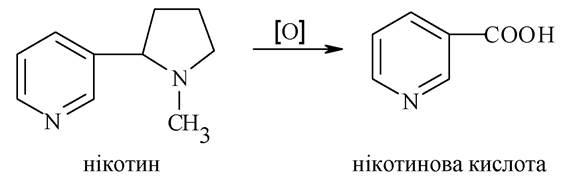
За рахунок бічного ланцюга гомологи піридину окиснюються легко з утворенням αа-, β-, γ-піридинкарбонових кислот. Найважливіші з них - нікотинова та ізонікотинова кислоти.
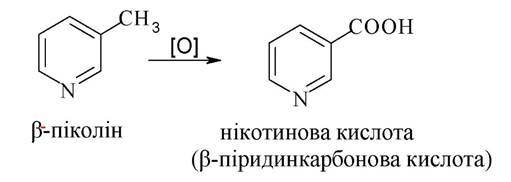
Нікотинова кислота та її амід проявляють вітамінну активність, застосовуються як антипелагричні засоби. Нікотинамід (вітамін РР) є структурним компонентом коферменту НАД+, що виконує функцію акцептора гідрид-іона під час біологічного дегідрування.
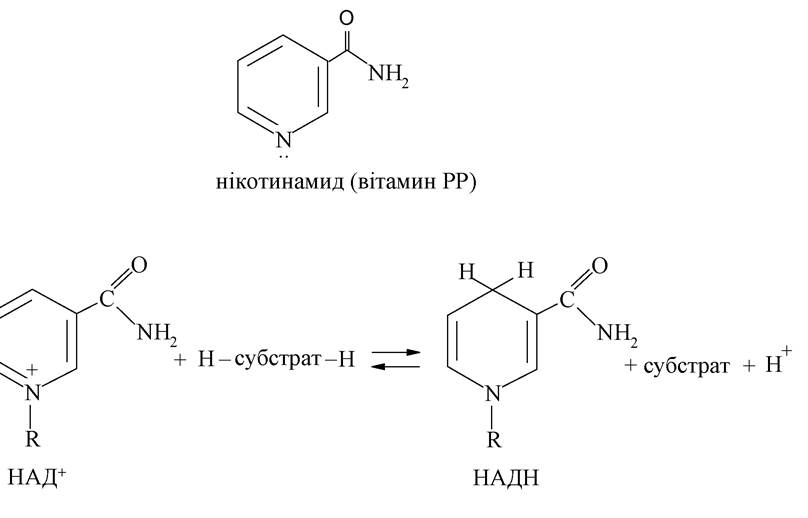
Діетиламід нікотинової кислоти називається кордіамін - лікарський засіб, що застосовується при серцевій недостатності:
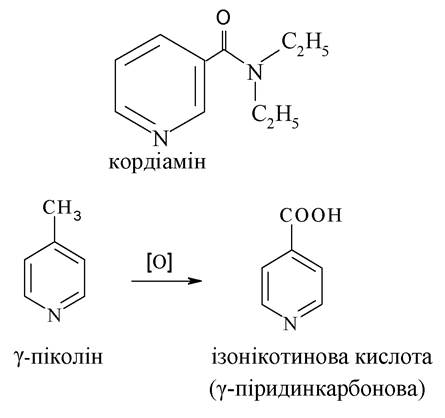
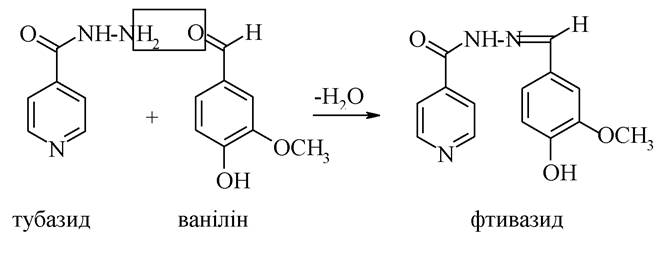
Гідразид ізонікотинової кислоти має назву ізоніазид (тубазид) - високоефективний протитуберкульозний лікарський препарат. Для зниження токсичності ізоніазид конденсували з ваніліном. Отриманий продукт називається фтивазидом, який також є високоефективним протитуберкульозним засобом.
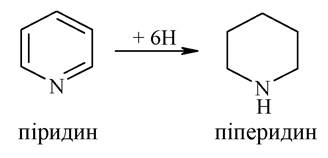
У результаті повного гідрування піридину утворюється піперидин:
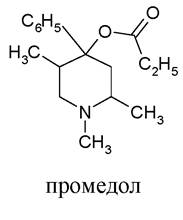
Похідне піперидину промедол - є особливо небезпечним наркотичним анальгетиком, до якого виникає звикання:
Піперидинове кільце входить до складу алкалоїдів атропіну, кокаїну, лобеліну.
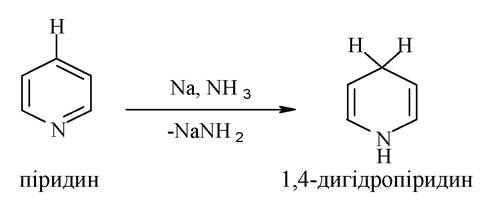
При відновленні піридину металевим натрієм за присутності амоніаку утворюється 1,4-дигідропіридин:
Похідні 1,4-дигідропіридину є антагоністами іонів кальцію, деякі з них застосовуються в медичній практиці для лікування серцево-судинних захворювань, гіпертонічної хвороби (фенігідин, коринфар та амлодипін). Вони блокують проникнення іонів кальцію в клітини гладких м'язів серця, викликають їх розширення та зниження артеріального тиску.
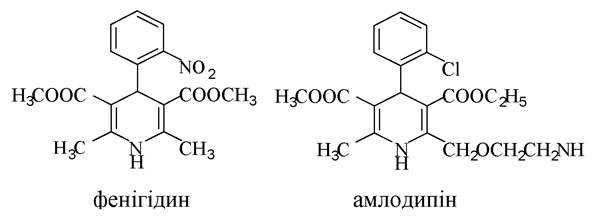
Ядро конденсованого на основі піридину і бензену гетероциклу - хіноліну - входить до складу деяких природних алкалоїдів: хініну, морфіну, кодеїну, героїну, а також синтетичних протимікробних препаратів: нітроксоліну, ентеросептолу.
Із шестичленних гетероциклів з двома гетероатомами найбільш поширений у біохімічних системах піримідин і його похідні.
Піримідин - ароматична система з двома атомами нітрогену піридинового типу. Наявність двох електронегативних атомів нітрогену призводить до значного зменшення електронної густини на кільці і знижує здатність його до електрофільного заміщення. Крім того, незважаючи на наявність двох центрів основності, основні властивості піримідину слабші, ніж у піридину, - діазини реагують тільки з одним еквівалентом кислоти з утворенням солей:
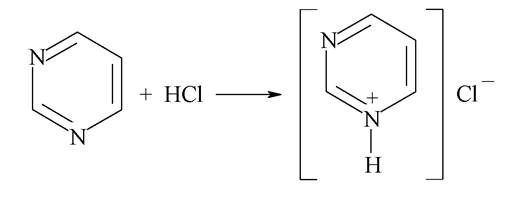
Похідними піримідину, присутніми в живих організмах, є переважно гідрокси- та амінопіримідини, які входять до складу нуклеотидів нуклеїнових кислот, вітамінів та коферментів, так звані «азотисті основи»:
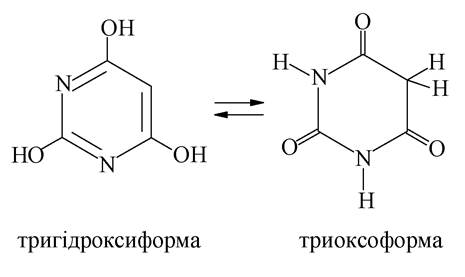
Серед лікарських препаратів - похідних піримідину - важливе місце посідають препарати, які синтезуються на основі барбітурової кислоти (2,4,6-тригідроксипіримідину). Барбітурова кислота у водних розчинах може існувати в декількох таутомерних формах. Лактам-лактимна таутомерія обумовлена міграцією атома гідрогену між NH- та карбонільними групами, кето-енольна таутомерія - міграцією гідрогену між метиленовими -СН2- та карбонільними групами:
Барбітурати - лікарські препарати на основі барбітурової кислоти, фармакологічна дія яких проявляється в снодійній, заспокійливій та протисудомній дії. Наприклад, фенобарбітал (люмінал), барбітал (веронал):
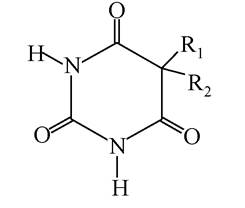
барбітурати (5,5-похідні барбітурової кислоти) Фенобарбітал: Ri = C2H5; R2 = C6H5.
Барбітал: R1 = R2 = C2H5.
Пурин - конденсована система, ароматична, складається із шестичленного піримідину та п'ятичленного імідазолу:
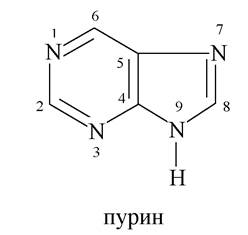
Найбільш важливими серед похідних пурину є гідрокси- та амінопурини, які беруть активну участь у процесах життєдіяльності.
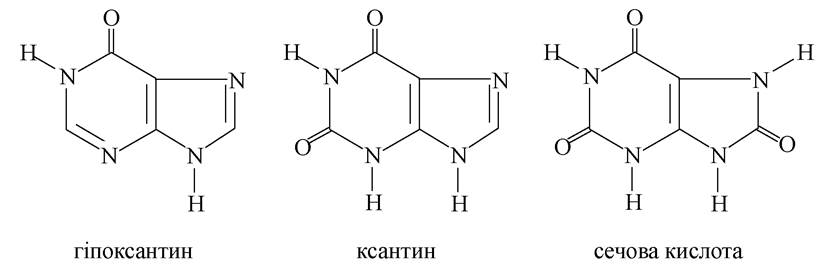
Гідроксипурини - гіпоксантин, ксантин та сечова кислота - утворюються в організмі під час метаболізму нуклеїнових кислот:
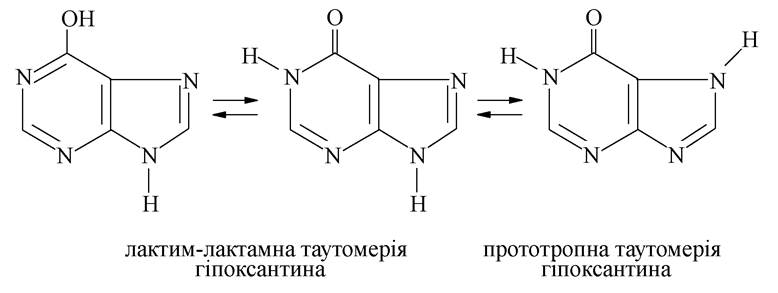
Для сполук, що містять пуриновий цикл, можлива як лактим-лактамна таутомерія, так і міграція гідрогену між атомами нітрогену в положеннях 7 та 9 імідазольного кільця (прототропна таутомерія):
Сечова кислота - кінцевий продукт метаболізму пуринових сполук в організмі. Вона виділяється із сечею в кількості 0,5-1 г на добу. Сечова кислота двохосновна, погано розчиняється у воді, але легко розчиняється в лугах, утворюючи кислі або середні солі - урати:
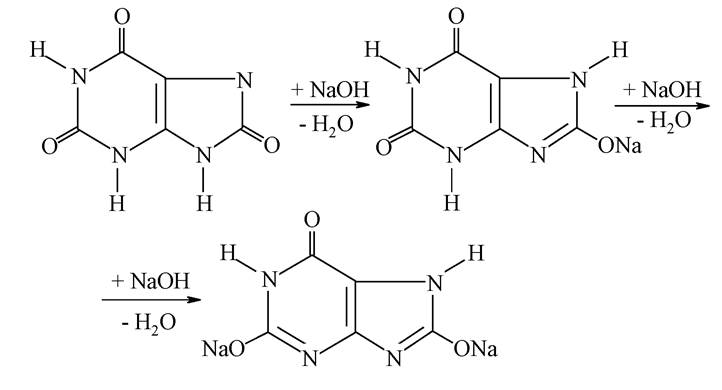
Унаслідок деяких порушень в організмі солі сечової кислоти, особливо кислі, можуть відкладатися в суглобах, наприклад, при подагрі, а також у вигляді ниркових каменів.
N-метилзаміщені похідні ксантину належать до алкалоїдів - кофеїн, теофілін, теобромін:
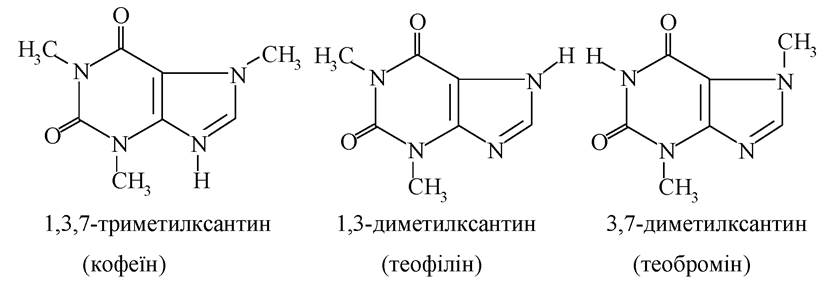
Природним джерелом цих алкалоїдів служать листя чаю, зерна кави, боби какао. Кофеїн - ефективний засіб, що збуджує нервову систему і стимулює роботу серця. Загальностимулююча дія теофіліну і теоброміну виражена менше, проте вони є досить сильними діуретиками.
З амінопуринів найбільш важливі 6-амінопурін, або аденін, і 2-аміно-6-гідроксипурин, або гуанін, які є обов'язковими компонентами нуклеїнових кислот:
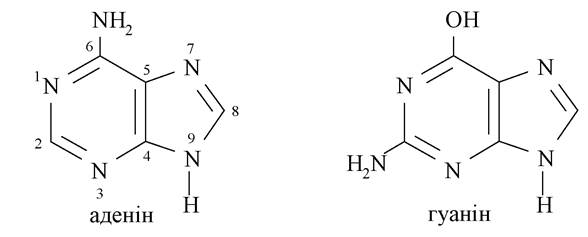
5. Алкалоїди - нітрогеновмісні органічні сполуки переважно рослинного походження, які мають основні властивості і високу біологічну активність. Алкалоїди є токсичними сполуками, але в малому дозуванні багато з них використовуються як лікарські препарати. Більшість має гетероциклічну структуру.
Алкалоїди групи піридину і піперидину. Найбільш важливими із цієї групи є нікотин і лобелін. Нікотин міститься в листі тютюну. До складу його молекули входять два гетероциклічних фрагменти - піридину і N-метильованого повністю гідрованого піролу - піролідину.
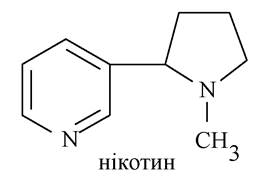
Нікотин - дикислотна основа. Піридиновий атом ніртрогену обумовлює основні властивості, а N-метилпіролідинове кільце можна розглядати як третинний амін, який забезпечує молекулі нікотину порівняно високу основність. Під час окиснення нікотину утворюється нікотинова кислота:
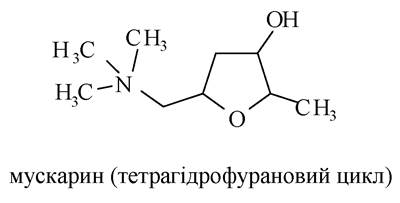
В організмі людини є холінорецептори, які стимулюються ацетилхоліном. Крім ацетилхоліну, вони можуть активуватися мускарином (М-холінорецептори); мускарин - токсин гриба мухомора:
Крім мускаринових рецепторів, існують ще і нікотинові (Н-холінорецептори), які активуються нікотином.
Алкалоїди групи хіноліну. До цієї групи належать алкалоїди, виділені з кори хінного дерева (найбільш важливим з них є хінін).
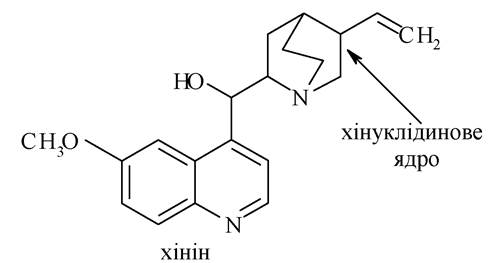
Хінін, аналогічно нікотину, є дикислотною основою. Піридинове кільце забезпечує молекулі слабкі основні властивості, а хінуклідинове ядро обумовлює високу основність. Завдяки вінільному радикалу хінолін знебарвлює бромну воду, а вторинний спиртовий гідроксил обумовлює властивості вторинних спиртів. Хінін - ефективний протималярійний засіб, здатний стимулювати пологову діяльність.
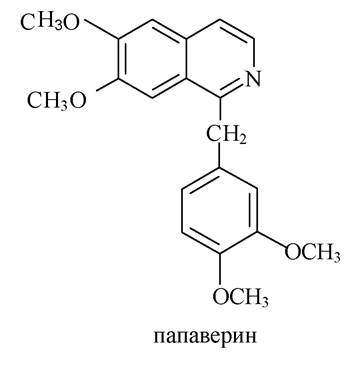
Алкалоїди групи ізохіноліну і фенантренізохіноліну. Папаверин - алкалоїд, який уперше був виділений з маку снотворного (Papaver somniferum), має спазмолітичну та судинорозширювальну дію.
Морфін являє собою складну поліциклічну систему. Кільця 1, 2 і 3 складають частково гідроване фенантренове ядро, а кільця 3 і 4 утворюють ядро гідрованого ізохіноліну.
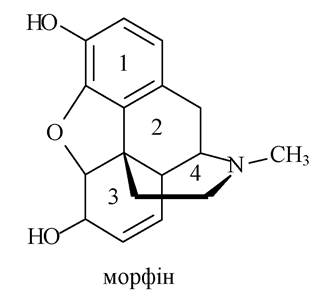
Морфін містить фенольний (тому з лугами утворює феноляти, а з FeCl3 - комплексні сполуки синього кольору) і спиртовий гідроксили (тому морфін проявляє властивості вторинного спирту), а також третинну аміногрупу (тому проявляє основні властивості, з мінеральними кислотами утворює солі).
Уперше морфін був виділений з опію. У медичній практиці застосовується при сильних і надсильних болях як наркотичний анальгетик. До морфіну швидко виникає звикання (наркоманія) - морфінізм, тому його використовують під суворим контролем.
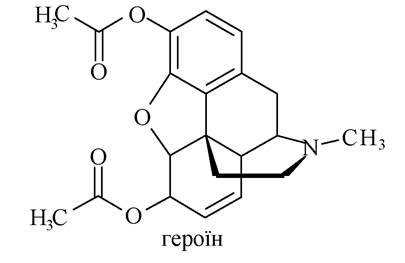
Повний оцтовокислий естер морфіну називається героїном, який є найбільш поширеним наркотиком, унаслідок звикання до нього розвивається героїнізм.
Алкалоїди групи тропану. Найбільш важливими представниками цієї групи алкалоїдів є атропін і кокаїн. В основі лежить тропанове ядро.
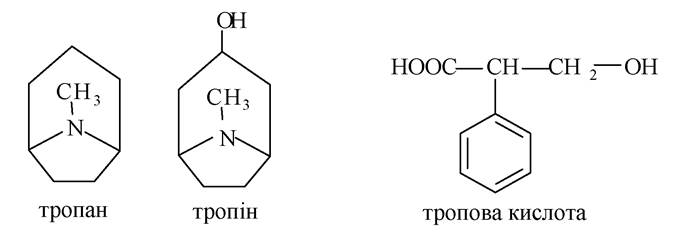
Атропін - естер спирту тропіну і тропової кислоти. Є отруйною речовиною. Міститься в такій рослині, як беладона - Atropa belladonna (лат.). У малих дозах застосовується в медичній практиці як спазмолітичний і М-холіноблокуючий засіб (блокує М-холінорецептори). В офтальмології його використовують для розширення зіниці і діагностики очного дна (викликає мідріаз).
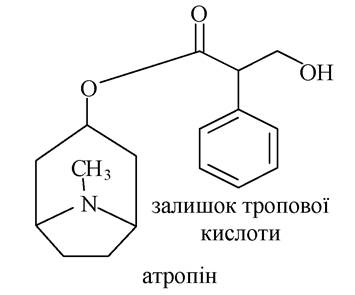
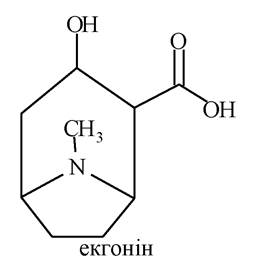
Кокаїн - подвійний естер екгоніну (екгонін - похідний тропану, гідроксикислота).
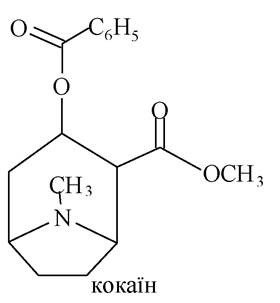
Екгонін в одному випадку виступає як спирт, в іншому - як кислота. Спиртовий гідроксил екгоніну естерифікований бензойною кислотою, а карбоксильна група - метиловим спиртом.
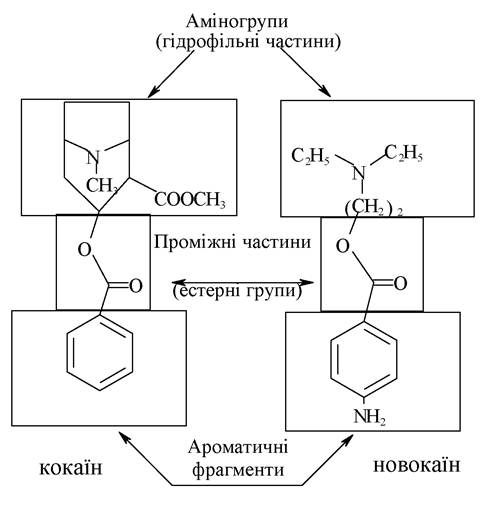
Міститься кокаїн у кущі Соса, який виростає в Південній Америці. Виявляє сильну знеболювальну дію, більшу, ніж анестезин і новокаїн. Аналогічно до морфіну, кокаїн викликає кокаїнізм, тому застосовується рідко, лише в офтальмології та для знеболювання слизових оболонок рота і носа при хірургічних втручаннях. Знеболювальна дія новокаїну та кокаїну обумовлена наявністю в їхніх молекулах спільних фрагментів.
Ці два анестетики подібні за будовою, вони однаково взаємодіють з рецепторами організму людини.
Виконайте завдання та перевірте правильність їх розв’язання за еталонами відповідей
Завдання № 1
1. Напишіть схему реакції одержання метилпіридиній йодиду. Можливість реакції N-метилування обумовлена:
A. Слабкокислотними властивостями піридинового азоту.
B. Недостатньою електронною густиною на піридиновому нітрогені.
C. Нуклеофільними властивостями піридинового нітрогену.
2. Напишіть рівняння реакцій нітрування піролу і піридину. До якого типу належать ці реакції?
A. Електрофільне приєднання.
B. Електрофільне заміщення.
C. Нуклеофільне заміщення.
D. Нуклеофільне приєднання.
3. Доведіть ароматичний характер з урахуванням електронної будови гетероатомів імідазолу. У молекулі імідазолу є:
A. Пірольний і піридиновий атоми нітрогену.
B. 2 пірольні атоми нітрогену.
C. 2 піридинові атоми нітрогену.
Еталони відповідей: 1-С; 2-В; 3-А.