Биохимические основы жизнедеятельности организма человека - Волков Н.И., Несен Э.Н. 2000
Биохимические основы жизнедеятельности организма человека
Ферменты - биологические катализаторы
Строение ферментов и коферментов
В настоящее время подробно изучено около 2000 ферментов. Как и белки, ферменты имеют сложную пространственную третичную и четвертичную структуру. Нативная (природная) структурная организация ферментов обеспечивает их каталитическую функцию. Нарушение ее под воздействием различных факторов приводит к потере активности ферментов. Простые и сложные ферменты. Разделяют ферменты на простые и сложные. Простые ферменты состоят только из белка. Это многие ферменты пищеварительного тракта — амилаза, пепсин, трипсин. Сложные ферменты состоят из белковой части, которая называется апоферментом, и небелковой, которая называется кофактором. Молекулу сложного фермента часто называют холоферментом. Кофакторы, которые слабо связаны с белковой частью фермента, называются коферментами (коэнзимами). Кофермент может легко переходить от одного фермента к другому. Кофакторы, прочно связанные с белковой частью фермента, называются простетической группой. Кофакторами могут быть различные органические вещества и их комплексы, а также минеральные вещества. Многие из них термостабильны, но могут окисляться атмосферным кислородом. В организме человека ряд кофакторов не синтезируется, а поступает с продуктами питания. Их строение и участие в биологических процессах рассмотрено далее.
В проявлении каталитической активности фермента принимает участие не вся его молекула, а только незначительная часть, которая называется активным центром (рис. 33). Активный центр — это часть молекулы фермента, которая взаимодействует с коферментом и субстратом и участвует в преобразовании вещества. Активный центр ферментов может быть образован несколькими функциональными группами отдельных аминокислот, расположенными в различных участках полипептидной цепи белка (рис. 34). Поэтому для проявления каталитической активности фермента важна его нативная структурная организация. При нарушении этой структуры изменяется активный центр, а значит, и активность фермента. Существуют ферменты, которые состоят из нескольких белковых молекул, т. е. имеют субъединичное строение. Они могут иметь несколько активных центров или единый центр, образованный при взаимодействии этих субъединиц.
Кроме активного центра многие ферменты имеют регуляторный (аллостерический) центр. Это особый участок на молекуле фермента, удаленный от активного центра, к которому могут присоединяться низкомолекулярные вещества-модуляторы и изменять его структуру и активность. Ферменты с аллостерической регуляцией часто находятся в начале метаболических путей и определяют их скорость. Называются они ключевыми ферментами. К ним относится фермент анаэробного цикла окисления углеводов — фосфофруктокиназа. Ее аллостерическими регуляторами являются АМФ, АТФ и другие вещества. В зависимости от соотношения этих модуляторов изменяется активность фосфофруктокиназы и скорость процесса окисления глюкозы, ведущего к образованию АТФ.
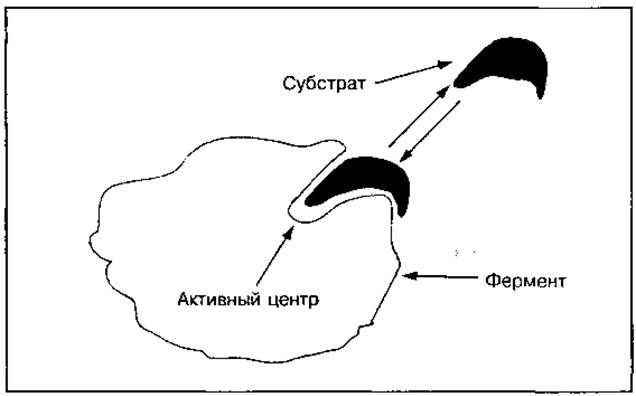
Рис. 33 Схема строения ферментов
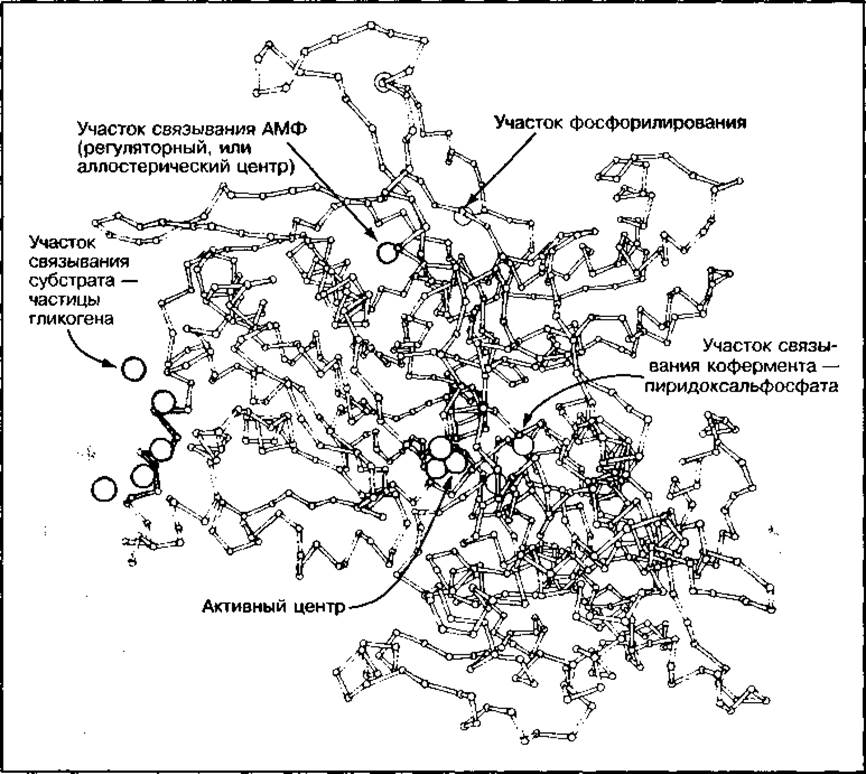
Рис. 34 Третичная структура фосфорилазы а (показана локализация активного центра, участков связывания гликогена, аллостерических центров и участка фосфорилирования)
Кофакторы. Каталитическая активность сложных ферментов проявляется только в присутствии коферментов:
![]()
Кофермент участвует в формировании активного центра фермента. Многие коферменты имеют сложное строение и включают витамины. Таким образом, регуляторное влияние витаминов на обмен веществ опосредовано через ферменты.
Исходя из особенностей строения коферменты разделяют на две большие группы — витаминосодержащие и невитаминные (табл. 7).
ТАБЛИЦА 7 Основные кофакторы ферментов
Витаминосодержащие |
Невитаминные |
Никотинамидные (НАД, НАДФ) Флавиновые (ФМН, ФАД) Тиаминовые (ТМФ, ТДФ, ТТФ) Пантотеновые (коэнзим А и 4-фосфопантотенат) Пиридоксалевые Фолиевые или птеридиновые Кобаламидные Биотиновые Липоевые (восстановленный и окисленный липоамид) Хиноновые (убихинон, пластохинон) Карнитиновые (карнитин) |
Нуклеотидные (АТФ, УДФ-глюкоза и другие нуклеотидные производные углеводов и спиртов) Гемсодержащие Пептидные (глутатион) Фосфаты моносахаридов Металлы (Cu, Мn, Со и др.) |
Отдельные коферменты входят в состав продуктов повышенной биологической ценности, которые используются в практике спорта для улучшения механизмов энергообразования, ускорения процессов восстановления, специфического построения конституции тела, поэтому остановимся более подробно на их характеристике.
Витаминосодержащие коферменты — никотинамидные, флавиновые, кофермент ацетилирования, тиаминпирофосфат, пиридоксалевые, кобаламидные и др. — различаются строением и выполняемыми функциями.
Никотинамидные коферменты (НАД и НАДФ) в своем составе содержат витамин РР (никотинамид), флавиновые (ФМН и ФАД) — витамин В2 (рибофлавин). Это кофакторы ферментов дегидрогеназ, катализирующих процессы биологического окисления питательных веществ. Они играют роль акцепторов и переносчиков водорода:
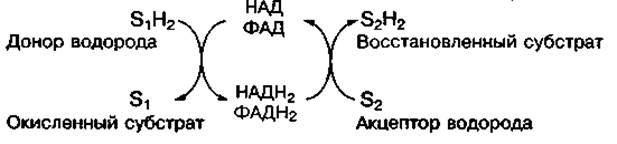
Строение и действие этих коферментов более подробно рассмотрено в главе 3.
Кофермент ацетилирования (KoA-SH) содержит витамин В3 (пантотеновую кислоту), а также нуклеотид (АДФ) и ß-меркаптоэтанол, содержащий SH-гpyппy. Этот кофермент играет важную роль в обмене углеводов, липидов и белков. Он входит в состав ферментов, катализирующих перенос ацетильных остатков (СН3-СО-) в процессе распада углеводов и жирных кислот, а также синтеза жирных кислот, стероидов, ацетилхолина, превращения аминокислот.
Тиаминпирофосфатный кофермент (ТПФ) содержит витамин В1 (тиамин). Он является коферментом ферментов, которые катализируют декарбоксилирование (-СО2) пировиноградной и других кетокислот, регулируют распад и окисление углеводов.
Пиридоксалевые и кобаламидные коферменту являются производными витамина В6 (пиридоксальфосфата) и витамина В12 (цианкобаламина) соответственно. Они входят в состав ферментов, которые катализируют превращение аминокислот и азотистых оснований, ускоряют процесс синтеза нуклеиновых кислот и белков.
Биотин (витамин Н) является простетической группой фермента ацетил-КоА-карбоксилазы, которая участвует в биосинтезе жирных кислот. Белок авидин, который находится в куриных яйцах, способен связываться с биотином и ингибировать этот фермент.
Убихиноновые коферменту (коферменты Q) являются производными жирорастворимых витаминов К и Е. Они участвуют в процессах тканевого дыхания и энергообразования.
Невитаминными кофакторами могут быть нуклеотиды (АТФ, ГТФ, ИТФ, УДФ, ЦДФ), гемсодержащие соединения, пептиды и многие металлы. Нуклеотиды и ионы металлов помогают ферменту или субстрату принять форму, необходимую для их взаимодействия. Гем является простетической группой цитохромов (компонентов дыхательной цепи), каталазы и других ферментов.